A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שריר הלב מבוססי תא מפעיל ומייצב עצמי ביורובוט - חלק 2
In This Article
Summary
במחקר זה, actuator ביולוגי עצמית התייצבות, biorobot שחייה עם זרועות פונקציונליות אלסטומרי פונקציונלי מזרקים עם cardiomyocytes, מתורבת, ומאופיינת המאפיינים הביוכימיים והביומכניים שלהם לאורך זמן.
Abstract
בשנים האחרונות, התקנים היברידיים המורכבת של תא חי או רכיב רקמה משולב עם חוט שדרה סינתטי פותחו. התקנים אלה, הנקראים biorobots, מופעלים אך ורק על ידי כוח שנוצר על ידי פעילות מכווצת של הרכיב החי, בשל היתרונות הטבועים רבים, יכול להיות חלופה קונבנציונאלי מלא רובוטים מלאכותיים. כאן, אנו מתארים את שיטות זרע לאפיין actuator ביולוגי biorobot שתוכנן, מפוברק, ו functionalized בחלק הראשון של מאמר זה שני חלקים. מפעיל ביולוגי מפוברק ומכשירי biorobot המורכבים מבסיס polydimethylsiloxane (PDMS) וממשק סרט דק היו פונקציונליים עבור התקשרות תא עם fibronectin. לאחר functionalization, cardiomyocytes חולדה neonatal היו seeded על הזרוע PDMS זרוע בצפיפות גבוהה, וכתוצאה מכך גיליון תאים confluent. המצלמות היו צילמו כל יום ותנועת הקאנטיזרועות המנוף נותחו. ביום השני לאחר הזריעה, ראינו את כיפוף הזרועות שלוחות בשל כוחות המופעל על ידי התאים במהלך התכווצויות ספונטנית. לאחר ניתוח כמותי של כיפוף שלוחה, עלייה הדרגתית הלחץ פני השטח המופעל על ידי התאים כפי שהם התבגרו לאורך זמן נצפתה. כמו כן, ראינו התנועה של biorobot עקב actuation של הזרוע PDMS זז, אשר פעל כסנפיר. עם כימות של פרופילי השחייה של המכשירים, נצפו מצבים הנעה שונים, אשר הושפעו בזווית המנוחה של הסנפיר. כיוון התנועה ותדר המכות נקבעו גם על ידי זווית המנוחה של הסנפיר, ורמת מהירות מקסימלית של 142 מיקרומטר לשנייה נצפתה. בכתב יד זה, אנו מתארים את הנוהל לאכלוס המכשירים המפוברקים עם קרדיומיוציטים, וכן להערכת המפעיל הביולוגי ופעילות ביורובוט.
Introduction
Biorobots הם מכשירים המבוססים על תאים חיים כי הם משולבים בתוך עמוד שדרה מכני כי הוא מורכב בדרך כלל מחומרים רכים, גמישים, כגון PDMS או הידרוג 1 . התאים עוברים צירים קצביים, או באופן ספונטני או בתגובה לגירויים, ובכך מתפקדים כמפעיל. הכוח שנוצר מכווץ התא כונני biorobots שונים. תאים לב יונקים (cardiomyocytes) ותאי שריר השלד משמשים לעתים קרובות עבור actuation biorobot בשל המאפיינים התכווצות שלהם. מלבד cardiomyocyte ותאי שריר השלד, סוגים אחרים של תאים, כגון רקמות שריר חרקים 2 ו tissanted רקמות שריר 3 , כבר בשימוש. רקמות שריר חרקים לאפשר את הפעולה של המפעילים הביולוגיים בטמפרטורת החדר.
הפונקציה והביצוע של biorobot נקבעים בעיקר על ידי כוח ועקביות של מפעיל ביולוגי ( כלומר. תאי שריר), בעוד מבנה עמוד השדרה מכני קובע בעיקר את מנגנוני התנועה, היציבות, ואת הכוח. מכיוון שמכשירים אלה מונעים אך ורק על ידי כוחות הנוצרים על ידי תאים, אין מזהמים כימיים או רעשים תפעוליים. לכן, הם מהווים חלופה חסכונית באנרגיה לרובוטים קונבנציונליים אחרים. מקורות ספרות שונים דנו בשיטות השונות לשלב תאים חיים ורקמות לתוך biorobots 1 , 4 , 5 . ההתקדמות microfabrication ורקמות טכניקות הנדסה אפשרו את הפיתוח של biorobots שיכול ללכת, אחיזה, לשחות, או משאבת 5 , 6 . באופן כללי, תאים מתורבתים ישירות על עמוד השדרה מכני (פולימרי) כמו גיליון תא confluent או שהם יצוק לתוך מבנים actuating 3 ממדי בתוך פיגומים כגון טבעות ופסים. לרוב, biorobots הםמפוברק באמצעות גליונות cardiomyocyte 6 , 7 , כמו תאים אלה יש יכולת מולדת להפגין התכווצות ספונטנית ללא גירויים חיצוניים. מצד שני, דיווחים על גיליונות שלד שרירי השלד מוגבלים בשל הצורך שלהם לגירויים כדי ליזום התכווצויות במבחנה על מנת ליזום deolarization ממברנה 8 .
פרוטוקול זה הראשון מתאר כיצד cardiomyocytes זרע על actuator ביולוגי פונקציונלי עשוי שלוחה PDMS דק. לאחר מכן הוא מתאר בפירוט את זריעת וניתוח של פרופילי השחייה. שלוחה הוא functionalized עם חלבון דבק תא כגון fibronectin והוא seeded confluently עם cardiomyocytes. כמו התאים seeded על חוזה המכשיר, הם גורמים שלוחה להתכופף ובכך לפעול כמפעיל. עם הזמן, כמו התאים בוגרת, אנו עוקבים אחר השינויים בלחץ פני השטח על המכשיר על ידי ניתוח קטעי וידאו שלכיפוף שלוחה. המפעיל הביולוגי שפותח כאן ניתן להשתמש כדי לקבוע את המאפיינים של כל סוג התא, כגון fibroblasts או המושרה pluripotent גבעולים תאים, כפי שהם עוברים differiation.
רוב המחקרים המוקדמים על ביורובוטס התמקדו בפיתוח של מיזמים ביולוגיים, בעוד שהמיטוב של ארכיטקטורת הביורובוט והיכולות הפונקציונליות הוזנח במידה רבה. לאחרונה, כמה מחקרים הוכיחו את יישום מצבי שחייה ב biorobots כי הם בהשראת הטבע. לדוגמה, שחייה biorobots עם תנועה מבוססת flagella 6 , הנעה מדוזה 9 , וקרני ביו היברידית 4 כבר מהונדסים. שלא כמו עבודות אחרות בספרות, כאן אנו מתמקדים משתנה המאפיינים של עמוד השדרה מכני ליצור מבנה מייצב את עצמי. Biorobot שפותחו במחקר זה מסוגל לשמור על גובה קבוע, רול, ו- IMעומק המרעה כפי שהוא שוחה. פרמטרים אלה ניתן לשנות על ידי שינוי עובי של כל מרוכב בסיס. את השלבים ייצור מעורב בפיתוח PDMS actuator, biorobot הצוללת, ופונקציונליזציה של המכשיר מתוארים בפירוט בחלק 1 של מאמר זה שני חלקים, כמו גם בעבודה האחרונה שלנו 7. הטכניקה שפותחה כאן יכול לסלול את הדרך לפיתוח של biorobots חדש, יעיל מאוד עבור יישומים שונים, כגון משלוח המשלוח.
תהליך הבידוד במחקר זה דומה לתהליך המתואר בעבודה קודמת 10 , וכן בעבודות שפורסמו לאחרונה. שיטות microfabrication המשמשים להבראת PDMS actuators והתקנים biorobot מתוארים בפירוט בחלק 1 של כתב היד הזה שני חלקים. סעיף הפרוטוקול של כתב היד הזה מתאר את השלבים הכרוכים זריעת cardiomyocytes על PDMS מפוברק אCtuator ואת biorobot בעקבות functionalization שלהם עם חלבונים דבק התא.
Protocol
כל הנהלים המתוארים כאן בוצעו באמצעות פרוטוקול מאושר בהתאם לתקנות של טיפול בבעלי חיים מוסדיים ועדת שימוש של אוניברסיטת נוטרדאם.
1. תא זרע ותרבות
- לפני תחילת, להכין את הפריטים הנדרשים: משפך קטן, טפיחות, חמים Dulbecco השתנה הנשר בינוני (DMEM) בתוספת 10% עוברית שור בסרום (FBS) ו 1% פניצילין אנטיביוטיקה (DMEM להשלים).
- קח T-25 צלוחיות יחד עם המכשיר פונקציונלי (מפעיל ביולוגי או biorobot) בתוכו. עיין בסעיף 4 של חלק 1 של כתב היד הזה של שני חלקים לפרטים אודות הכנת המכשיר, פונקציונליזציה ואחסון לפני זריעת התאים.
- הכן משפך, אשר יכול להתבצע על ידי גלגול קטן, גיליון פלסטיק מרובע. מניחים אותו על המפעיל הביולוגי או biorobot בתוך בקבוק T-25. התאם את הקוטר של הקצה הרחב יותר כדי שיתאים למכשיר כולוואת גובה כך שהוא מתאים snugly כאשר החלק העליון של הבקבוק הוא הידוק.
- עבור biorobots, להשתמש מגנט להחזיק את המכשיר במקום בתחתית הבקבוק לאורך תהליך זריעה.
הערה: כאן, מגנט אחד neodymium דיסק (1.26 "בקוטר) שימש, אבל כל מגנט של גודל דומה כוח יכול לשמש גם כדי להחזיק את biorobot עם בסיס ניקל מגנטי PDMS מגנטי. - UV לעקר את גיליון פלסטיק לפחות 30 דקות לפני השימוש.
- עבור biorobots, להשתמש מגנט להחזיק את המכשיר במקום בתחתית הבקבוק לאורך תהליך זריעה.
- ודא כי אין פער גדול בין הבסיס של המשפך ואת הבקבוק.
- Resuspend cardiomyocytes ב DMEM להשלים בצפיפות של 1.6 x 10 7 תאים / מ"ל לאט ירידה 400 μL של השעיה על המכשיר דרך המשפך. השתמש hemocytometer או כל מונה תאים אחרים כדי לקבוע את מספר התאים שהושגו.
- לאט לאט להעביר את המערכת בחזרה לתוך החממה מבלי להפריע את המכשיר ואת שנינות משפךHin. תרבות עבור 24 שעות ב 37 ° C.
- לאחר תקופת הדגירה, לאט להסיר את משפך, בעדינות לשטוף את המדגם עם PBS, ולמלא את הבקבוק עם 10 מ"ל של DMEM טרי להשלים.
הערה: עבור biorobots, להסיר את המגנט כך המכשיר לצוף.
2. אפיון ביוכימי
- סידן השטף assay
הערה: Assay השטף סידן מתבצעת להעריך interconnectivity התא. הליך טעינת התאים עם פלואורסצנטי, סידן יון ספציפי צבע עוקב אחר התהליך המתואר בפרוטוקול שהוקם בעבר 11 .- ראשית, להכין את החומרים הדרושים, סידן fluo-4-acetomethyl (AM) אסתר, פוליאול פעילי שטח nonionic (ראה טבלה של חומרים ), פתרון מלח של Tyrode.
- באמצעות פינצטה ארוכה, בעדינות להעביר את המכשיר מן הבקבוק תרבות כדי צלחת פטרי 35 מ"מ עם 2 מ"ל של סולו מלח של Tyrode Tion.
- בצינור צנטריפוגות נפרד, לקחת 1 מ"ל של תמיסה חמה של Tyrode (מחומם ל 37 מעלות צלזיוס) ומוסיפים 3-5 μL של סידן מלאי פלואוקו -4 בבוקר צבע (ריכוז עבודה: 3-5 מיקרומטר) וחלק שווה של פעילי שטח nonionic ריכוז: 0.2%). החלף את הפתרון המדגם עם פתרון חם של Tyrode בתוספת צבע אינדיקטור הסידן, fluo-4, ו 0.2% פעילי שטח nonionic. דגירה של 25 - 30 דקות על 37 מעלות צלזיוס.
- הסר את הפתרון לצבוע בעדינות לשטוף את המדגם עם פתרון Tyrode טרי. Re-דגירה המדגם ב 2 מ"ל של DMEM טרי להשלים עוד 30 דקות ב 37 מעלות צלזיוס לפני הדמיה.
הערה: התוצאות של assay זה וידאו קשורים מסופקים בעבודה שפורסם בעבר 7 .
- Immunofluorescence
הערה: immunostaining כפולה של כל הדגימות בוצע בעקבות פרוטוקול הוקמה בעבר> 12.- ראשית, להכין 10% בסרום עזים (GS) בפתרון מלוחים שנאגרו פוספט (PBS), paraformaldehyde 4% (PFA) ב diH 2 O, חומר ניקוי lyse 0.1% תא (ראה טבלה של חומרים ) ב PBS, נוגדנים ראשוניים (אנטי -Mouse נוגדנים חד שבטיים טרופונין לב אני ו אנטי ארנב נוגדן חד שבטי connexins-43), נוגדנים משני (Alexa 594 מצומד ועז נגד עכבר IgG (H + L) Alexa 488 מצומד), ו- DAPI.
זהירות: Paraformaldehyde הוא מסרטן. - הסר את המדגם של עניין מן הבקבוק בעדינות לשטוף אותו פעמיים עם PBS. ראה סעיף 4 בחלק 1 של כתב היד הזה שני חלקים לפרטים על הכנת המדגם ופונקציונליזציה.
- הוסף טיפה של PBS על coverslip קטן (בקוטר: 12 מ"מ או 15 מ"מ). בעדינות להחזיק את הבסיס של המכשיר עם פינצטה ולחתוך את הנשק PDMS דק (שלוחה, איור 1 ) באמצעות מספריים מהסוף שבו הוא מתחבר אל החלק העליון של הבסיסה. מעבירים את הזרועות שלוחה על גבי טיפה עם הצד תא דבקים כלפי מעלה. P drovelt PBS ימנע התאים ייבוש.
- תקן את דגימות עם PFA 4% ולבצע immunostaining כפול של דגימות, כמתואר בעבר 12 .
- לאחר immunostaining, הר דגימות על שקופית זכוכית נקייה באמצעות מגיב אנטי דוהה הרכבה ולהניח בצד, ללא הפרעות, בחושך במשך 24 שעות.
- חזור על ההליך עבור כל הדגימות.
הערה: התוצאות של assay זה ואת התמונות הקשורות נדונים לעומק בעבודה שפורסם בעבר 7 .
- ראשית, להכין 10% בסרום עזים (GS) בפתרון מלוחים שנאגרו פוספט (PBS), paraformaldehyde 4% (PFA) ב diH 2 O, חומר ניקוי lyse 0.1% תא (ראה טבלה של חומרים ) ב PBS, נוגדנים ראשוניים (אנטי -Mouse נוגדנים חד שבטיים טרופונין לב אני ו אנטי ארנב נוגדן חד שבטי connexins-43), נוגדנים משני (Alexa 594 מצומד ועז נגד עכבר IgG (H + L) Alexa 488 מצומד), ו- DAPI.
3. הדמיה
- מניחים את בקבוק T-25 זקוף בחממה CO 2 ולהכין את מערכת הדמיה בתוך החממה. רשום את ההתקן באמצעות מצלמה (ראה טבלת חומרים ) עם עדשת זום (ראה טבלה של חומרים ). עבור מקור אור,השתמש ברצועה של נורות LED.
הערה: רצועה של נוריות LED לבן שימש כאן, אבל כל נוריות נורמלי גם לעבוד. - חבר את המצלמה למערכת הפעלה ופתח את התוכנה ספציפית מצלמה (ראה טבלה של חומרים ). לחץ על תמונת המצלמה מתחת לכרטיסייה "קובץ", בחלונית העליונה, כדי לפתוח את כל אפשרויות המצלמה, ולבחור את המצלמה הנכונה.
- בחר "חי" מתוך רשימת הכרטיסיות בחלונית העליונה בתוך התוכנה.
- העבר ידנית את התמונה למיקוד על-ידי התאמת חיוג העדשה. בחר באפשרות "חתוך לאזור עניין (החזר ROI)" מלוח למעלה. לאחר מכן, באופן ידני לצייר מלבן בתוך מסגרת וידאו, מקיף את מכשיר מפעיל ביולוגי ואת זרועות שלוחה, כדי לסמן את ההחזר על ההשקעה.
הערה: בחירת החזר ROI מתאים ממזערת את גודל קובצי התמונות.- במקרה של biorobots, ללכוד את המסך כולו כדי להקליט את תנועת השחייה של המכשיר.
הערה: אין צורך לצייר החזר השקעה עבור biorobots
- במקרה של biorobots, ללכוד את המסך כולו כדי להקליט את תנועת השחייה של המכשיר.
- לפני תחילת ההקלטה, בחר "הגדרות מצלמה" מאחת הכרטיסיות בחלונית העליונה על המסך. הגדר את קצב המסגרת על-ידי התאמת יחס החשיפה והפיקסלים של התמונה החיה על-ידי הזזת סרגל עבור כל אחד מהם או על-ידי הזנה ידנית של הערכים. הגדר את שיעורי מסגרת על 30 ± 2 fps.
הערה: שינוי יחס החשיפה והפיקסלים משנה את הבהירות והחדות של התמונה החיה. - לחץ על כפתור "הקלטה" מהחלונית העליונה בתוכנה כדי להתחיל להקליט את קטעי הווידאו של המפעילים עם 1000 x 1000 פיקסלים ברזולוציה של 30 S בדיוק. חזור על התהליך עבור כל הדגימות.
4. ניתוח תמונה של המפעילים הביולוגיים על בסיס נייח
- לנתח את התמונות באמצעות תוכנת תכנות ( למשל, Matlab) פועל סקריפט מותאם אישית. ראה טבלה של חומרים ואת הקובץ המשלים לפרטים נוספים.
הערה: סקריפט מציג כל מסגרת של קטעי וידאו מוקלט, מקבל את קלט העכבר של המשתמש כדי לתעד את התיאום של נקודות של שלוחה על התמונות, מחשבת את הקוטר ואת מרכז המעגל העובר את נקודות קלט דרך הכיכר הכי פחות מתאים, ו מייצא את כל הנתונים שהוזנו ומחושבים לשימוש נוסף.- פתח את תוכנת התכנות על ידי לחיצה על הסמל. לחץ על "קובץ" -> "פתח" משורת התפריטים שבחלק העליון ובחר את קובץ התסריט .m לניתוח תמונות. ודא שתמונות TIFF שהוקלטו נמצאות באותה תיקייה כמו הקובץ .m. לחץ על "הפעלה" כדי להפעיל את הסקריפט.
הערה: תצוגה אינטראקטיבית תופיע עבור שינוי. - לחץ על "הפעל" כדי להתחיל את התוכנית בפועל. לחץ על כפתור "פתוח" ולאתר את הקובץ TIFF כי הוא הולך להיות מנותח.
- לחץ על "בסיס & #34; ולאחר מכן לחץ על הנקודה שבה שלוחה נצמדת לבסיס בראש; הזן הזן זה ישים סמן מרובע על התמונה עבור כל מסגרת לציין את המיקום של הבסיס שלוחה.
- לחץ על כפתור "קנה מידה" ולאחר מכן לחץ ידנית על קצה אחד של חרוז זכוכית. הבא את מצביע העכבר אל הצד הנגדי של חרוז הזכוכית ולחץ על "Enter".
הערה: זה צריך לצייר קו המודד את קוטר חרוז זכוכית. מאז חרוז זכוכית הוא 3 מ"מ קוטר, זה יתייחס 3 מ"מ לפיקסלים המוצגים. - לחץ על הלחצן "נתח". לחץ לאורך שלוחה במרחק קצר מן הסמן מרובע הראשון המייצג את הבסיס שלוחה.
- לחץ על הלחצן "נתח". לאחר מכן, לחץ לאורך שלוחה במרחק קצר מן הסמן מרובע הראשון המייצג את הבסיס שלוחה. המשך ללחוץ לאורך שלוחה, כולל קצה, ולחץ על Enter כאשרבוצע. זה יהיה מקום "x" על כל נקודה לחץ על שלוחה.
הערה: על בסיס התיאום של הסמן הריבועי ועל סמני x, מרכז וקוטר המעגל יחושבו באמצעות פונקציית ריבוע מינימלית (עיין בקובץ המשלים המצורף לסקריפט שבו נעשה שימוש). המעגל, אשר עובר את סמני x ואת יצרנית מרובע, יהיה על גבי התמונה באופן אוטומטי. - בדוק אם המעגל על גבי המעקב כראוי עוקב אחר פרופיל שלוחה.
הערה: כאשר שלוחה שטוחה מאוד, קשה לשפוט אם פרופיל שלוחה נחקרת כראוי. ראה איור 3 . - לחץ על הלחצן "מסגרת הבאה". פעולה זו תעבור למסגרת הבאה בקובץ TIFF. הבסיס והסולם כבר נקבעו מהצעד הקודם.
- חזור על שלבים 4.1.5 עד 4.1.7 עד שכל המסגרות בקובץ TIFF הושלמו. לאחר כל המסגרות כבר proceSsed, לחץ על כפתור "ייצוא".
הערה: פעולה זו תיצור קובץ גיליון אלקטרוני עם שם הקובץ TIFF עבור שלוחה כי היה רק ניתח. ערוך את שם הקובץ כדי לכלול איזה צד (שמאל או ימין) של שלוחה היה מנותח.
- פתח את תוכנת התכנות על ידי לחיצה על הסמל. לחץ על "קובץ" -> "פתח" משורת התפריטים שבחלק העליון ובחר את קובץ התסריט .m לניתוח תמונות. ודא שתמונות TIFF שהוקלטו נמצאות באותה תיקייה כמו הקובץ .m. לחץ על "הפעלה" כדי להפעיל את הסקריפט.
- חישוב מתח בגיליון האלקטרוני.
- חישוב הלחץ על פני השטח, "σ", על שלוחה באמצעות המשוואה הבאה:
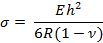
כאשר E, R, V , ו- h הם מודולוס של יאנג, רדיוס העקמומיות, היחס של פואסון והעובי הקונסולרי, בהתאמה.
הערה: עובי שלוחה ניתן לשנות את הרגישות. במחקר זה, הערכים היו כדלקמן: E = 750 kPa, v = 0.49, ו- h = 25 מיקרומטר 13 , 14 . - חישוב מתח פני השטח באמצעות המשוואה בשלב 4.2.1. פתח את ה .Xls קובץ גיליון אלקטרוני. שים לב לפלט יש מספר עמודות המציגות תחילה את הקואורדינטות x ו- y של הבסיס והמעגל ולאחר מכן את רדיוס העקמומיות. לחשב את x ו- y קואורדינטות של כל נקודה לחץ על בסיס אלה.
הערה: מתווה את הלחץ על זמן לשגות מסגרות תמונה מראה שינויים בכוח המופעל על שלוחה לאורך זמן. שקתות להראות את הלחץ על שלוחה במהלך הרפיה של cardiomyocytes או הלחץ סטטי מופעל על שלוחה בשל כוחות המתיחה התא. פסגות להראות את הלחץ הדינמי על שלוחה, אשר הופעל על ידי המכות של cardiomyocytes. ערך זה תואם את הסכום המרבי של כוח שנוצר על ידי התכווצות של cardiomyocytes.
- חישוב הלחץ על פני השטח, "σ", על שלוחה באמצעות המשוואה הבאה:
5. ניתוח של שחייה Biorobots
- שיא את המיקום של biorobot באמצעות תוכנת ניתוח תמונה.
הערה: עיין ברשימת החומרים עבור התוכנה שבה נעשה שימושהוא סעיף.- פתח את תוכנת ניתוח התמונה ( למשל, ImageJ). לחץ על "קובץ" ו "פתח" ובחר את קובץ הווידאו biorobot שחייה. לחץ על "אישור" ולתת לתוכנית לטעון את הקובץ. פתח את תוכנת הגיליונות האלקטרוניים.
- ב וידאו biorobot טעון, למצוא התייחסות של ממדים ידועים ( למשל, חרוז זכוכית 3 מ"מ קוטר כי היה מוטבע מפעיל ביולוגי).
הערה: כל אובייקט בעל מאפיין ידוע יעבוד. פעולה זו תקבע את יחסי הפיקסלים באורך בכל סרטון. - השתמש בכלי "ישר" כדי לצייר קו על פני חרוז זכוכית. לחץ על "ניתוח" ובחר "הגדר קנה מידה". הגדר את "מרחק ידוע" שדה ל "3000 מיקרומטר" ולחץ על "אישור".
הערה: פעולה זו תגדיר את הקואורדינטות x ו- y למיקרומטרים. - בחר נקודה בהתקן שאינו מתנדנד בין מסגרות כדי לשמש סמן.
הערה:מומלץ לבחור פינת בסיס. - הצבע על הנקודה שנבחרה ב 5.1.4 על המסגרת הראשונה. רשום את הקואורדינטות x ו- y בגיליון האלקטרוני.
- עבור אל חלון התוכנה ניתוח התמונה ולחץ על מקש החץ ימינה כדי לשנות את המסגרת הבאה. הצבע שוב על הסמן (משלב 5.1.4) ורשום את הקואורדינטות x ו- y בגיליון האלקטרוני.
- חזור על שלב 5.1.6 עבור כל המסגרות.
- חישוב הפרמטרים שחייה של biorobot באמצעות גיליון אלקטרוני של קואורדינטות 7 .
- לחשב את התקופה בין מסגרות משער המסגרות הידוע של כל סרטון.
- לחשב את השינוי בקואורדינטות x ו- y בין המסגרות כדי למצוא את המרחק נע, כולל המרחק הכולל.
- חישוב המשרעת של התכווצות מן השינוי המרבי לאורך ציר y. לקבוע את תדירות המכות עבור כל biorobot מהופך של התקופה בין שני התכווצויות.
- גלחשב את מהירות השחייה של כל התקן מן הזמן הכולל והמרחק נע בכיוון x.
- חזור על שלב 5.2 עבור כל וידאו biorobot נותח.
- מנרמל כל פרמטר שנמדד.
הערה: מנרמל את כל הערכים כדי לחזות טוב יותר את ההבדלים. פרוטוקול זה מדגים נורמליזציה לגבי מצב biorobot אופקי עם התכווצויות בתדר נמוך (LF אופקי) ( איור 4 ) 7 .
6. ניתוח של הביטוי חלבון
הערה: הדגימות רכוב מוכן בשלבים 2.2.4 ו 2.2.5 היו צילמו באמצעות מיקרוסקופ confocal. תמונות נרכשו בהגדלה 20X, 40X ו 60X ברצף בשלושה ערוצים בו זמנית: 460 ננומטר, 488 ננומטר, ו 594 ננומטר. קבוצה של 5 תמונות נלכדו בהגדלה 40X, ממיקומים שונים עבור כל דגימה, וכל ערוץ נשמר בתור TIFF יחיד.קוֹבֶץ. הגדרת החשיפה נקבעה על ידי הגדלה של המטרה בשימוש ונקבעה קבועה עבור כל הלכידות בהגדלה זו.
- פתח את תוכנת ניתוח התמונה ובחר "קובץ" -> "פתח" כדי לטעון את התמונות.
- צייר מצולע מלבני על מסגרת התמונה כדי לסמן את ההחזר על ההשקעה. בחר "ניתוח" -> "למדוד" כדי למדוד את עוצמת פלורסנט מתכוון.
- חזור על שלב 6.2 כדי לאסוף מדידות אינטנסיביות מכל הדגימות ולחשב את עוצמת הממוצע בהתאמה עבור כל תנאי.
הערה: כאן, מצב אחר מתייחס לנקודות זמן שונות, כמו ביום 1, יום 2 ועד יום 6. - לייצא את התוצאות על גיליון אלקטרוני לניתוח סטטיסטי נוסף לייצור של מגרשים נתונים.
תוצאות
המפעיל הביולוגי עשוי שלוחה PDMS דק (25 מיקרומטר עובי) ו cardiomyocytes מהווה את הליבה של biorobot שחייה, כפי שמוצג סכמטי ואת צילום מסך של מכשירים באיור 1 . התאים מתחילים להציג התכווצויות לאחר 24 שעות בתרבות, וכיפוף של זרועות שלוחה נצפתה על ידי יום 2. פרופי...
Discussion
ההליך המתואר כאן מתאר שיטת זריעה מוצלחת עבור PDMS מבוססי actuators ו biorobots, אשר מאפשר את ההתקשרות של cardiomyocytes. יתר על כן, התהליך של רכישת התמונה ואת הניתוח הבאים המאפיינת את ההתנהגות של התאים ואת הביצועים של המכשירים תוארה.
ראינו התכווצות...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
MT Holley נתמך על ידי תוכנית עמיתי בוגרים של מועצת לואיזיאנה של ריג 'נט, ו C. דניאלסון נתמך על ידי הווארד יוז המכון הרפואי פרופסורים התוכנית. מחקר זה נתמך על ידי NSF גרנט מס ': 1530884.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Cardiomyocytes (primary cardiac cells) | Charles River | NA | Isolated from 2-day old neonatal Sprague Dawley rats |
| Dulbecco’s modified eagle’s media (DMEM) | Hyclone Laboratories | 16750-074 | with 4500 mg/L glucose, 4.0 mM L-glutamine, and 110 mg/L sodium pyruvate |
| Fetalclone III serum | Hyclone industries, GE | 16777-240 | Fetal bovin serum (FBS) |
| Dulbecco’s phosphate buffer (PBS) | Sigma-Aldrich | D1408-100ML | |
| Penicillin-G sodium salt | Sigma-Aldrich | P3032 | |
| Goat serum | Sigma-Aldrich | G9023 | |
| 4,6-diamidino-2-phenylindole dihydrocholride powder (DAPI) | Sigma-Aldrich | D9542 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | Solution (1 mg/ml) |
| Calcein-AM and ethidium homodimer-1 kit (Live/Dead Assay) | Molecular Probes | L3224 | |
| Calcium Fluo-4, AM | Molecular Probes | F14217 | calcium indicator dye |
| Tyrodes salt solution | Sigma-Aldrich | T2397 | buffer solution |
| Pluronic F-127 | Molecular Probes | P3000MP | nonionic surfactant-20 % solution in Dimethylsiloxane (DMSO) |
| 16% Parafomaldehyde | Electron microscopy | 15710 | Caution: Irritant and combustible |
| Triton x-100 | Sigma-Aldrich | X-100 100 mL | cell lyses detergent, (4-(1,1,3,3-Tetramethylbutyl)phenyl-polyethylene glycol, t-Octylphenoxypolyethoxyethanol, Polyethylene glycol tert-octylphenyl ether) |
| ProLong gold antifade reagent | Molecular Probes | P10144 | Mounting agent |
| Alexa Fluor 594 Phalloidin | Molecular Probes | A12381 | Actin filament marker |
| Goat anti-rabbit IgG (H+L) secondary antibody, Alexa Fluor 594 conjugate | Molecular Probes | A-11012 | |
| pha | Molecular Probes | A-11001 | |
| Anti-connexin 43 antibody | Abcam | ab11370 | Gap junction marker |
| Anti-cardiac troponin I antibody | Abcam | ab10231 | Contractile protein |
| 16% EM grade paraformaldehyde solution | Electron microscopy | 100503-916 | |
| Polydimethylsiloxane (PDMS) | Elsevier | Sylgard 184 | |
| Materials and Equipment | |||
| Camera | Thor Labs | DCC1545M | |
| LED light strip | NA | NA | Any white LED without spectrum emission |
| Confocal microscope | Nikkon C2 | NA | Confocal microscope with three filter set. |
| Zooming lens | Infinity | Model# 252120 | |
| Software | |||
| Matlab | Mathworks | NA | Used in Section 4) for biological actuator analysis. |
| Image J | National Institute of Health | NA | Java-based image processing software. Used in Section 5) for biorobot analysis. Free Image Processing and Analysis software in java. (https://imagej.nih.gov/ij/) |
| Thor Cam | Thor Labs | NA | Camera operating software |
References
- Feinberg, A. W. Biological Soft Robotics. Annu. Rev. Biomed. Eng. 17, 243-265 (2015).
- Akiyama, Y., et al. Room Temperature Operable Autonomously Moving Bio-Microrobot Powered by Insect Dorsal Vessel Tissue. PLOS ONE. 7, 38274 (2012).
- Herr, H., Dennis, R. G. A swimming robot actuated by living muscle tissue. J. NeuroEng Rehabil. 1, 6 (2004).
- Park, S., et al. Phototactic guidance of a tissue-engineered soft-robotic ray. Science. 353 (6295), 158-162 (2016).
- Cvetkovic, C., et al. Three-dimensionally printed biological machines powered by skeletal muscle. Proc. Natl. Acad. Sci. 111, 10125-10130 (2014).
- Williams, B. J., Anand, S. V., Rajagopalan, J., Saif, M. T. A. A self-propelled biohybrid swimmer at low Reynolds number. Nat. Commun. 5, (2014).
- Holley, M. T., Nagarajan, N., Danielson, C., Zorlutuna, P., Park, K. Development and characterization of muscle-based actuators for self-stabilizing swimming biorobots. Lab. Chip. 16, 3473-3484 (2016).
- Hopkins, P. M. Skeletal muscle physiology. Contin Educ Anaesth Crit Care Pain. 6, 1-6 (2006).
- Nawroth, J., et al. A tissue-engineered jellyfish with biomimetic propulsion. Nat Biotechnol. 30 (8), 729-797 (2012).
- Ehler, E., Moore-Morris, T., Lange, S. Isolation and Culture of Neonatal Mouse Cardiomyocytes. J. Vis. Exp. JoVE. (79), e50154 (2013).
- Bers, D. M. Calcium Fluxes Involved in Control of Cardiac Myocyte Contraction. Circ. Res. 87, 275-281 (2000).
- Shin, S. R., et al. Carbon-Nanotube-Embedded Hydrogel Sheets for Engineering Cardiac Constructs and Biological actuators. ACS Nano. 7, 2369-2380 (2013).
- Park, J., et al. Real-Time Measurement of the Contractile Forces of Self-Organized Cardiomyocytes on Hybrid Biopolymer Microcantilevers. Anal. Chem. 77, 6571-6580 (2005).
- Tamayo, J., et al. Quantification of the surface stress in microcantilever biosensors: revisiting Stoney's equation. Nanotechnology. 23, 475702 (2012).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nat. Methods. 10, 781-787 (2013).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in Cardiomyocyte Isolation, Culture, and Gene Transfer. J. Mol. Cell. Cardiol. 51, 288-298 (2011).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Sfakiotakis, M., Lane, D. M., Davies, J. B. C. Review of fish swimming modes for aquatic locomotion. IEEE J. Ocean. Eng. 24, 237-252 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved