Method Article
Glycoproteomics של מטריקס: שיטה Intact ניתוח Glycopeptide באמצעות ספקטרומטריית מסה
In This Article
Summary
מאמר זה מתאר מתודולוגיה להכין דגימות רקמות וכלי דם לצורך ניתוח MS המאפשרת (1) ניתוח של הרכב החלבון ECM, (2) זיהוי של אתרי glycosylation, ו (3) אפיון ההלחנה של צורות glycan. מתודולוגיה זו יכולה להיות מיושמת, עם שינויים קלים, כדי המחקר של ECM ברקמות אחרות.
Abstract
פיברוזיס היא סימן היכר של מחלות לב וכלי דם רבות והיא קשורה עם הפרשת המחריפה בתצהיר של מטריקס (ECM). פרוטאומיקה שימוש, זיהינו בעבר יותר מ 150 ECM ו- ECM-הקשורים חלבונים ברקמות הלב וכלי הדם. יש לציין, חלבוני ECM רבים glycosylated. שינוי שלאחר translational זה משפיע חלבון מתקפל, מסיסות, מחייב, ושפלה. פתחנו חילוץ רציף ושיטה והעשרת חלבוני ECM כי הוא תואם ספקטרומטריית מסת טנדם כרומטוגרפיה הנוזלית עוקבת (LC-MS / MS) הניתוח של glycopeptides השלם. האסטרטגיה מבוססת על incubations הרציף עם NaCl, SDS עבור decellularization רקמות, ו הידרוכלוריד guanidine עבור solubilization של חלבוני ECM. התקדמות LC-MS / MS כוללת שיטות פיצול, כגון שילובים של ניתוק התנגשות אנרגיה גבוהה יותר (HCD) לבין ניתוק העברת אלקטרונים (ETD), המאפשריםניתוח ההלחנה הישיר של glycopeptides של חלבוני ECM. בעבודה הנוכחית, אנו מתארים שיטה להכנת ECM מן דגימות רקמה. השיטה לא רק מאפשרת אפיון חלבון אלא גם את ההערכה ואפיון של glycosylation ידי ניתוח MS.
Introduction
פיברוזיס היא סימן היכר של מחלות רבות. פיברובלסטים להתרבות להבדיל כלפי פנוטיפים סינתטי מאוד, אשר משויכים את הפרשת מחריפה בתצהיר של מטריקס (ECM) 1. בתצהיר ECM מוגזם יכול להמשיך, גם לאחר הפגיעה הראשונית כבר שככה, שמוביל פגיעה תפקודית. פרוטאומיקה שימוש, זיהינו בעבר יותר מ 150 ECM ו- ECM-הקשורים חלבונים ברקמת הלב 2, 3. הם אינם חלבונים מבניים בלבד, אלא גם חלבונים matricellular ו פרוטאזות התורמים שיפוץ מתמשך והתאמה דינמית של הלב. יש לציין, רבי חלבוני ECM הם glycosylated 4. שינוי שלאחר translational זה (PTM) יהיה כרוך בתוספת שאריות סוכר לעמדות חומצת אמינו מסוימות, וזה משפיע קיפול חלבונים, מסיסות, מחייב, ושפלת 5 .
ישנם שני סוגים עיקריים glycosylation המתרחשות יונקים. (1) N-glycosylation מתרחשת חנקן carboxamido של שאריות asparagine (ASN) בתוך רצף קונצנזוס ASN-XAA-Thr / שירו, שבו XAA הוא כל חומצת אמינו למעט פרולין. (2) בשנת O-glycosylation, שאריות סוכר לצרף שאריות סרין ו תראונין (שירו, Thr) או, במידה פחותה בהרבה, כדי hydroxyproline ו hydroxylysine. בעוד O-glycosylation יכול להתרחש במגוון של קבוצות חלבון, N-glycosylation מוגבל חלבונים מופרשים או תחומים תאיים של חלבונים בממברנה 5. זה עושה N-glycosylation יעד אטרקטיבי כאשר לומדים את ECM.
פרוטאומיקה קובע סטנדרט חדש עבור ניתוח של שינויים חלבון המחלה. עד כה, רוב המחקרים פרוטאומיקה כבר התמקדו חלבונים תאיים 6. זהו בעיקר בשל הסיבות הבאות. ראשית, חלבונים תאיים בשפע לעכב את ההזדהותfication של רכיבי ECM נדירים. זה חיוני במיוחד ברקמת לב, שבו חלבונים המיטוכונדריה myofilament מהווים חלק גדול מתוכן החלבון 7. שנית, חלבוני ECM אינטגרליים הם צולבים בכבדות וקשה solubilize. לבסוף, נוכחותה של PTMs בשפע (כלומר, glycosylation) משנה את המסה המולקולרית, אחראי, ומאפיינים electrophoretic של פפטידים, המשפיעים הן הפרדה וזיהוי על ידי ספקטרומטריית מסה טנדם כרומטוגרפיה נוזלית (LC-MS / MS). במהלך השנים האחרונות, פתחנו ושפרנו חילוץ רציף ושיטה והעשרת חלבוני ECM התואמת ספקטרומטריית מסה עוקב (MS) ניתוח. האסטרטגיה מבוססת על incubations הרציף.
השלב הראשון מתבצע עם NaCl, חוצץ יוני המאפשר ההוצאה קשור ECM וחלבוני ECM הכרוך ברפיון, כמו גם חלבוני ECM מסונתזים חדש. זה אניים תכשיר נטול, הלא denaturing, ללא הפרעה של קרום התא, וכן מקובל עבור 8 מבחני ביוכימיים נוספים. ואז, decellularization מושגת עם סולפט dodecyl נתרן (SDS). בשלב זה, ריכוז נמוך SDS מבטיח יציבות הממברנה ואת שחרורו של חלבונים תאיים תוך מניעת השיבוש של רכיבי ECM יותר המסיסים שאינם נפרדים. לבסוף, חלבונים ECM המחולצים עם חיץ הידרוכלוריד guanidine (GuHCl). GuHCl יעיל לחילוץ חלבונים צולבים בכבדות ו proteoglycans מרקמות כגון גידים 9, הסחוס 10, כלי 11, 12, 13 ו הלב 2, 3. יישמנו חלוקה ביוכימיים זו, בשילוב עם LC-MS / MS, לחקור שיפוץ ECM במצב מחלת לב 2 , 3, 11, 12, 13, 14. התקדמות MS כוללת שיטות פיצול רומן, כגון שילובים של ניתוק התנגשות אנרגיה גבוהה יותר (HCD) לבין ניתוק העברת אלקטרונים (ETD), המאפשרים ניתוח הישיר של glycopeptides השלם 3, 15.
כאן אנו מתארים שיטה להכין ECM לניתוח MS המאפשרת ניתוח של הרכב החלבון, לזיהוי האתרים glycosylation, ואת האפיון של צורות glycan. לעומת ניתוחים קודמים של glycosylation ECM 16, מתודולוגיה זו מאפשרת הערכה הישירה של שינויים ב רכב פרופילי glycosylation באופן אתר ספציפי באמצעות MS. יש לנו ליישם מתודולוגיה זו לרקמות לב וכלי דם. עם זאת, זה יכול alכך להיות מיושם, עם שינויים קלים, כדי המחקר של ECM בדגימות רקמה אחרות והוא יכול לספק תובנה חסרות תקדים לתוך ביולוגית ECM.
Protocol
המחקר אושר על ידי ועדת האתיקה מחקר מקומי Wandsworth (מספר אסמכתא: 06 / Q0803 / 37) ואישור המוסדי קיבל מהמשרד מחקר ופיתוח. כל החולים נתנו הסכמה בכתב הודיעה.
1. הפקת החלבונים התאים מטריקס
הערה: רקמות פרוזדורי האדם המשמשות בניסויים אלו נתקבלו נספחי הפרוזדורים במהלך מכונת לב-ריאה, רק לאחר מעצרו cardioplegic של הלב. כל הדגימות נאספו בבית החולים סנט ג'ורג ', לונדון, בריטניה. כל דגימות הרקמה חייבות להיות קפוא ב -80 מעלות צלזיוס. אין להשתמש דגימות נשמרו עם fixatives, כגון paraformaldehyde, כי חלבוני קשר צולבים.
- הכן את כל מאגרי החילוץ מראש של ניסויים, לפי טבלה 1, על מנת לצמצם את הזמן בין הצעדים החילוץ. בצעו את כל incubations בטמפרטורת החדר (RT) בסביבה מבוקרת טמפרטורה(כלומר, ~ 20 ° C) כדי להבטיח עקביות בין עקירות.
- לשקול 20-50 מ"ג של רקמות. אם כמה דוגמאות הן להיעקר, לחתוך ולשקול אותם אחד אחד כדי למנוע ההפשרה המלאה של הרקמות. באמצעות אזמל, הקוביות רקמה לתוך 3-4 חתיכות קטנות (2-3 מ"מ) ומניחים אותם יחד לתוך 1.5 צינורות מ"ל.
- הוספת 500 μL של בופר פוספט קר כקרח (PBS; ראו טבלה 1 ו טבלה של חומרים) ולבצע חמישה שוטף כדי למזער זיהום בדם.
- שלב החילוץ 1: דגירה עם הצפת NaCl
- לאחר שטיפה עם PBS, למקם את הדגימות לתוך 1.5 צינורות מ"ל עם פקקי הברגה. הוסף חוצץ NaCl (ראה טבלה 1) ב 10 פעמים (נ: w) משקל הרקמה. וורטקס צינורות ב RT עבור 1 h במהירות מינימום (כלומר, 600 סל"ד).
הערה: מהירות מערבולת נמוכה היא קריטית כדי למנוע הפרעה מכנית של רקמת במהלך שלב זה.השתמש במתאם קצף למקם את כל הצינורות במהלך החילוץ. - מעביר את התמציות כדי צינורות צנטריפוגות חדשות ב- 16,000 XG במשך 10 דקות ב 4 ° C. אחסן את התמציות ב -20 ° C עד שימוש. בקצרה לשטוף את כדורי רקמות נותרים עם חיץ NaCl טרי. השתמשו באותו הסוג של חיץ (כלומר, 100 μL של חיץ NaCl) לשטיפה כדי למנוע המיצוי של חלבונים אחרים עם solubilities השונה (כלומר, חלבונים לא ניתן לחילוץ עם NaCl).
- לאחר הכביסה, להבטיח הסרה מלאה של חיץ כדי למזער חפיפה בתוכן חלבון בצעדים החילוץ הבאים. בטל חיץ NaCl המשמש לשטיפה.
הערה: היחס בין נפח המאגר ומשקל רקמות חשובה עבור חילוץ לשחזור. של 10: 1 יחס (נ: w) עבור עקירות NaCl ו SDS ו 5: 1 עבור הצעד GuHCl לספק כמות מספקת של חלבון ללא להרוות את החיץ. ריכוזי חלבון כ 1-2 מיקרוגרם / μL לאחר שלוחהraction.
- לאחר שטיפה עם PBS, למקם את הדגימות לתוך 1.5 צינורות מ"ל עם פקקי הברגה. הוסף חוצץ NaCl (ראה טבלה 1) ב 10 פעמים (נ: w) משקל הרקמה. וורטקס צינורות ב RT עבור 1 h במהירות מינימום (כלומר, 600 סל"ד).
- שלב החילוץ 2: Decellularization עם הצפת SDS
- הוסף חוצץ SDS (לוח 1) בשעה עשר פעמים (נ: w) משקל רקמות; שימוש ריכוזי SDS נמוכים (כלומר, 0.1%) הוא קריטי כדי למנוע האובדן של חלבוני ECM במהלך decellularization. וורטקס צינורות ב RT עבור 16 שעות ב מהירות מינימלית (כלומר, 600 סל"ד).
הערה: מהירות מערבולת נמוכה ממזער הפרעה מכאנית של ECM. - מעבירים את תמציות צינורות חדשים. צנטריפוגה XG 16,000 עבור 10 דקות ב 4 ° C; לאחסן ב -20 ° C עד השימוש. בקצרה לשטוף את כדורי רקמות הנותרים עם dd H 2 O להסיר את SDS. ודא הסרה מלאה של הנוזל לאחר הכביסה.
- הוסף חוצץ SDS (לוח 1) בשעה עשר פעמים (נ: w) משקל רקמות; שימוש ריכוזי SDS נמוכים (כלומר, 0.1%) הוא קריטי כדי למנוע האובדן של חלבוני ECM במהלך decellularization. וורטקס צינורות ב RT עבור 16 שעות ב מהירות מינימלית (כלומר, 600 סל"ד).
- שלב חילוץ 3: דגירה עם GuHCl חוצץ
- הוסף חוצץ GuHCl (לוח 1) בשעה חמש פעמים (נ: w) משקל הרקמה. וורטקס הצינורות ב RT עבור 72 h במהירות מרבית (כלומר, 3200 סל"ד); vortexing הנמרצת מקלה על ההפרעה המכאנית של ECM.
- מעבירים את תמציות צינורות חדשים. צנטריפוגה ב g 16,000 × עבור 10 דקות ב 4 ° C ולאחסן ב -20 ° C עד השימוש.
2. חלבון כימות משקעים
הערה: עקב הנוכחות של חומרי ניקוי, למאגר SDS אינו עולה בקנה אחד עם כימותי חלבון ישירים על סמך מדידות של ספיגה ב 280 ננומטר. כדי להבטיח כימות לשחזור, להשתמש מבחני colorimetric עבור כל תמציות חלבון 17.
- קְבִיעַת כָּמוּת.
- כן סטנדרטים עבור עקומת כיול באמצעות אלבומין בסרום שור (BSA) בדילול סדר במאגר החילוץ המתאים (כלומר, NaCl, SDS, או GuHCl) 17. במהלך תקופה זו, להפשיר את תמציות מדגם.
- לדלל את הדגימות במאגר חילוץ להשיג ריכוזים בתוךבטווח של ספיגה ליניארי; 1:10 דילול (v: v) מניב תוצאות משביעות רצון. לדלל את דגימות GuHCl עם כמות שווה של DDH 2 O עבור כימות, כמו assay colorimetric אינו תואם ריכוזים של> 4 M GuHCl.
- השתמש חומצה bicinchoninic (BCA) מבוססי assay colorimetric 17 (ראה טבלה של חומרים), בעקבות הוראות היצרן עבור מבחני צלחות 96-היטב; מומלץ לבצע מדידות כפולות לפחות.
- לאחר דוגר במשך 30 דקות, לקחת קריאות ספיגות באורך גל של 570 ננומטר כדי לחשב את ריכוז החלבון באמצעות עקומת הכיול הסטנדרטית BSA 17.
- משקעים חלבון
- ההפשרה GuHCl מחלץ ב RT. Aliquot 10 מיקרוגרם של חלבון עבור כל דגימה לתוך צינורות חדשים. לניתוח glycopeptide ישיר, aliquot 50 מיקרוגרם. להוסיף 10 פעמים את הנפח של אתנול ו incuבייט לילה בשעה -20 ° C.
הערה: GuHCl אינה תואמת תגובות אנזימטיות נוספות ורוב יישומי electrophoretic. הסרת GuHCl נדרש לפני עיכול deglycosylation טריפסין. המסיסות של GuHCl באתנול, לעומת זאת, המסיסות הנמוכה של חלבונים המאפשרת היעילה להסרת GuHCl בעוד המניב כ החלמת 98% חלבונים 18. - צנטריפוגה דגימות ב g 16,000 × עבור 30 דקות ב 4 ° C ו לשאוב supernatant. יש להיזהר שלא להפריע הגלולה זרזה. לייבש את כדורי עבור 15 דקות באמצעות concentrator ואקום (ראו טבלה של חומרים) ב RT.
הערה: הפרוטוקול ניתן לעצור כאן ואת כדורי יבשים לאחסן -20 ° C עד השימוש. - לחלופין, להריץ ג'ל אלקטרופורזה כמו בקרת איכות (QC, לראות את השיטות המשלימות).
- ההפשרה GuHCl מחלץ ב RT. Aliquot 10 מיקרוגרם של חלבון עבור כל דגימה לתוך צינורות חדשים. לניתוח glycopeptide ישיר, aliquot 50 מיקרוגרם. להוסיף 10 פעמים את הנפח של אתנול ו incuבייט לילה בשעה -20 ° C.
3. סדרתית deglycosylation עבורהערכה תפוס אתר N-glycosylation
- במהלך ייבוש מדגם (ראה שלב 2.2.2), להכין את החיץ deglycosylation המכיל debranching אנזימים deglycosylation, לפי טבלה 1. ראה טבלה של חומרים לפרטי מוצר.
- להוסיף 10 μL של חיץ deglycosylation המכיל אנזימים מדגם זה. ודא resuspension גלולה מתאימה על ידי ביצוע מערבולת מהירה ספין למטה של דגימות.
הערה: הסרת מונומרים סוכר באמצעות אנזימי debranching חיונית להסרת עוקבות ומלאה של סוכרים מורכבים צמוד O ומקלה על המחשוף מאוחר של סוכרי N-linked ידי PNGase-F. - דגירה של 2 שעות ב 25 מעלות צלזיוס, כדי לאפשר את הסרת סולפט heparan ידי heparinase II.Increase את הטמפרטורה ל 37 מעלות צלזיוס ו דגירה של 36 שעות עם תסיסה עדינה.
הערה: בהינתן כמויות תגובה הנמוכות ושעות דגירה ממושכות, שייקרים אינקובטור שימוש בחוזקה לארוז 1.5 מיליליטר גיגית מרובהes בתוך צינור חרוטי 50 מ"ל נשען בתוך האינקובטור על כ 45 °. - לאחר 36 שעות, צנטריפוגות מדגמים עבור 1 דקות ב XG 16,000 ו להתאדות H 2 O ממדגמים באמצעות רכז ואקום ב RT במשך כ 45 דקות.
- Resuspend הדגימות המיובשות עם 10 μL של H 2 O 18 המכיל 50 U / mL PNGase-F, אשר דבק כל גליקנים צמודים asparagine בריאקצית deamidation.
הערה: חומצה אספרטית וכתוצאה נושאת המונית עודף של 2.98 דא, מעיד על נוכחות של N-glycosylation במהלך ניתוח MS. - דגירה של 36 שעות ב 37 מעלות צלזיוס מתחת תסיסה מתמדת שייקר אינקובטור.
In-פתרון 4. העיכול טריפסין
הערה: שלב זה צריך להתבצע הן בלתי deglycosylated (כלומר, המשמשים לניתוח glycopeptide ישירה) ודגימות deglycosylated (כלומר, המשמש להערכה של OC glycancupancy).
- השתמש 10 מיקרוגרם של חלבון הכולל להערכת תפוסה באתר N-glycosylation (כמצוין בשלב הקודם). לקבלת דוגמיות המיועדת לניתוח glycopeptide ישיר, להשתמש 50 מיקרוגרם של חלבון כסכום החל.
הערה: השלבים הבאים מתוארים עבור 10 מיקרוגרם של חלבון. בהיקף של עד evolumes ה (כלומר, 5 פעמים במשך 50 מיקרוגרם) כנדרש. - לפגל חלבונים על כל aliquot מדגם באמצעות 9 M אוריאה 3 M thiourea, עם ריכוזים הסופי של 6 M אוריאה 2 M thiourea, בהתאמה (למשל, עבור מדגם 10 μL, 20 μL של thiourea אוריאה /).
- הפחת את החלבונים על ידי הוספת 100 מ"מ dithiotreitol (DTT, 3.33 μL, ריכוז סופי: 10 מ"מ). לדגור על 37 מעלות צלזיוס למשך 1 שעות עם תסיסה ב 240 סל"ד.
- לקרר את דגימות כדי RT לפני ביצוע אלקילציה ידי הוספת 0.5 M iodoacetamide (3.7 μL, ריכוז סופי: 50 מ"מ). דגירה בחושך במשך 1 h.
- השתמש טרום צונן (-20מעלות צלזיוס) אצטון (6 פעמים את הנפח של המדגם) כדי לדגור דגימות לילה בשעת -20 ° C. המשקע על ידי צנטריפוגה ב 14,000 XG במשך 25 דקות ב 4 °.
- לשאוב supernatant. יש להיזהר שלא להפריע הגלולה זרזה. לייבש את כדורי חלבון באמצעות concentrator ואקום עבור 30 דקות ב RT.
- גלולה ב 20 μL של 0.1 M ביקרבונט triethylammonium (TEAB) חיץ, pH 8.2, טריפסין המכיל (0.01 מיקרוגרם / μL) ולעכל לילה בשעה 37 ° C ו 240 סל"ד.
- עצור את מערכת העיכול על ידי acidifying דגימות עם 10% חומצה trifluoroacetic (TFA, 2 μL ריכוז סופי של 1% TFA).
5. ניקוי פפטיד באמצעות עמודות C18
הערה: הסרת להתערב מזהמים מן התערובת פפטיד לאחר עיכול מפחית דיכוי יון ומשפר אות לרעש יחס וכיסוי רצף. צעד זה אמור להתבצע בשני sa הלא deglycosylated ו deglycosylatedmples.
- הפעל את שרף על צלחת ספין C18 (ראה טבלה של חומרים) באמצעות 200 μL של מתנול לכל היטב צנטריפוגות ב 1000 XG במשך 1 דקות.
- לשטוף ידי הוספת 200 μL לכל היטב אצטוניטריל 80% (ACN) ו 0.1% TFA ב צנטריפוגה H 2 O. ב 1000 XG במשך 1 דקות.
- לאזן על ידי הוספת 200 μL לכל היטב% ACN 1% ו 0.1 TFA ב H 2 O. צנטריפוגה ב 1000 XG במשך 1 דקות. חזור על פעולה זו עוד פעמיים.
- טען את הדגימות (כל הנפח) משלב 4 לתוך הבארות המכילות השרף צנטריפוגות ב 1500 XG במשך 1 דקות. רענן את הזרימה דרך בשנית וחזור על צנטריפוגה.
- לשטוף ידי הוספת 200 μL לכל טוב של TFA ACN 1% ו 0.1% ב צנטריפוגה H 2 O. ב 1500 XG במשך 1 דקות. חזור על פעולה זו עוד פעמיים.
- Elute דגימות עם 170 μL לכל טוב של 50% ACN, 0.1% TFA ב צנטריפוגה H 2 O. ב 1500 XG במשך 1 דקות. חזור על השלב הקודםולשלב את eluate שנאסף.
- יבש את eluate באמצעות concentrator ואקום עבור 2 שעות ב RT. אם זה לא נמצא בשימוש מיד, לשמור על דגימות יבשים ב -80 ° C עד השימוש.
הערה: דגימות Deglycosylated המיועדות לזיהוי חלבונים בלבד מוכנה לשימוש עבור LC-MS / MS לאחר שלב זה. שלבים 6 ו 7 אינם נדרשים עבור דגימות אלה. - ההפשרה להשעות את דגימות deglycosylated ב 2% ACN ו 0.05% TFA ב H 2 O לריכוז החלבון הסופי של 0.5 מיקרוגרם / μL. המשך עם צעד 6 לניתוח glycopeptide הישיר של דגימות הלא deglycosylated.
- לחלופין, לסנן את פפטידים לפני תיוג עם תגי מסה טנדם (TMT); לראות את השיטות המשלימות עבור fitration פפטיד.
6. תיוג עם TMT (עבור ניתוח ישיר Glycopeptide בלבד)
- ההפשרה מחדש להשעות את כדורי יבשים ב 50 μL של 50 מ"מ TEAB לקבל ריכוז של 1 מיקרוגרם / μL.
- ResusPED הבקבוקון 0.8 מ"ג של TMT אפס (0 TMT, ראה טבלת חומרים) מגיב ב 41 μL של ACN. בצע את recommendantions של היצרן עבור resuspension.
- תווית דגימות פפטיד ביחס של 50 מיקרוגרם פפטידים כדי 0.4 מ"ג 0 TMT (כלומר, 50 μL של פפטידים כדי 20.5 μL של TMT 0). לדגור על RT עבור 1 h.
- להרוות את התגובה תיוג ידי הוספת hydroxylamine 5% ביחס 6: 100 (כלומר, 4.23 μL של hydroxylamine 5%). לדגור על RT עבור 15 דקות.
- יבש את דגימות פפטיד TMT 0 -labelled עבור 1 ש 'ב RT באמצעות concentrator ואקום. גלולה ב 10 μL של DDH 2 O.
הערה: עקב שאריות glycan, glycopeptides להציג מסה מולקולרית גבוהה יותר פפטידים שאינם glycosylated. TMT 0 מגביר את מצב glycopeptides תשלום. זה מקטין את המסה היחסית שלהם לגבות (m / z) יחסי ומקל פיצול ETD.
7. עשרה Glycopeptide
- השתמש מאגרי תגובה המסופק בערכה (ראה הטבלה של חומרים).
- להוסיף 50 μL של חיץ מחייב כל דגימה 10 μL משלב 6.5. הפתרון וורטקס שרף glycocapture עד שהוא הופך הומוגני. השתמש כרומטוגרפיה נוזלית אינטראקצית zwitterionic הידרופילי (ZIC-HILIC) מבוסס ללכוד 15.
- Aliquot 50 μL של ההשעיה שרף צינורות 1.5 מ"ל חדש. ספין עבור 1 דקות ב 2500 XG ולהסיר את supernatant. להוסיף 60 μL של המדגם (כלומר, המדגם עם חיץ מחייב) על צינורות המכילים את כדורי שרף. מערבבים בעזרת פיפטה לדגור על RT עבור 20 דק 'ב תסיסה ב 1200 סל"ד.
- צנטריפוגות במשך 2 דקות ב 2000 XG ולהעביר את supernatant צינורות חדשים. שמור את הצינורות. הוספת 150 μL של חיץ לשטוף את הצינורות שרף. מערבבים בעזרת פיפטה לדגור על RT עבור 10 דק 'ב תסיסה ב 1200 סל"ד.
- ספין עבור 2 דקות ב 2500 x גרם. לְהַעֲבִיראת supernatant לאותו צינורות (משלב 7.4). חזור על כביסת צעדי שתי פעמים.
- להוסיף 75 μL של חיץ elution ומערבבים בעזרת פיפטה. להתסיס ב 1200 סל"ד במשך 5 דקות ב RT ואז צנטריפוגות צינורות במשך 2 דקות ב 2500 x ז. העבר את supernatants צינורות 1.5 מ"ל חדש. חזור על שלבי כביסה ולאחר מכן להעביר את supernatant eluate לאותו צינור.
- בצנטריפוגה צינורות המכיל את eluate (כלומר, glycopeptides) עבור 2 דקות ב 2500 x גרם. מעבירים את supernatant צינורות חדשים על מנת להבטיח את הסרת כל שרף הנותר מן השלבים הקודמים.
- יבש את סך 150 μL של eluate באמצעות concentrator ואקום כ 2 שעות ב RT. Resuspend את glycopeptides למטה יבשים ב 15 μL של ACN 2% ו 0.05% TFA ב DDH 2 O.
- המשך לבצע LC-MS / MS באמצעות הפיצול HCD לנתח את הרכב החלבון ECM, ו LC-MS / MS באמצעות HCD ופיצול ETD לאפיון glycopeptide. ראה סעיף 8.
8. ניתוח ספקטרומטריית מסה
- בצע LC-MS / MS באמצעות פיצול HCD לנתח את רכב חלבון ECM; לראות את השיטות משלים לפרטים.
- בצעו LC-MS / MS באמצעות HCD ופיצול ETD לאפיון glycopeptide (ראה שיטות משלימה לפרטים נוספים); המדגם המועשר יש להשוות את חומר הקלט שאינו מועשר 15.
הערה: תיאורים מפורטים של שיטות LC-MS / MS לניתוח glycopeptide עקיף, ניתוח glycopeptide ישיר, וחיפוש נתונים ניתן השיטות המשלימות. חוקרים מעוניינים באפיון חלבון ECM ורכב glycan באמצעות ספקטרומטריית מסה מעודדים להתייחס לפרסומים קודמים 3, 11, 15.
תוצאות
זרימת עבודה סכמטי של הפרוטוקול מסופקת באיור 1.
פרוטוקול חילוץ ECM
היעילות של מיצוי ניתן לנטר ידי הפעלת aliquots יוצרים כל תמצית על ג'ל acrylamide Bis-טריס ושימוש צביעת כסף עבור להדמיה. 2A האיור מראה את מידת ההשלמה של NaCl, SDS ו GuHCl תמציות לאחר מיצוי רציף. QC זו מאפשרת זיהוי של בעיות פוטנציאליות עם איכות מדגם כגון פירוק חלבונים מופרז. לאחר החילוץ, גליקופרוטאינים ECM הם בשפע תמציות GuHCl (איור 2B).
deglycosylation
כדי להעריך את היעילות של deglycosylation, שליטה בלתי deglycosylated יש להפעיל parallel. פעמים deglycosylation צריך להיות מתאים כדי להשיג הסרה מלאה ואחידה של שאריות סוכר, כפי שהודגם 3A איור. איור 3 ב מציג דוגמה מייצגת של דגימות deglycosylated ביעילות על ידי תוספת של אנזימים אנזימים להסרת deglycosylation GAG כי יעד קטן N- ו- O צמודות אוליגוסכרידים.
Glycoproteomics
פרוטוקול עבור הערכה של תפוסה של sequons NXT / S משפר כיסוי רצף חלבון עבור גליקופרוטאינים ECM לאחר MS (איור 3 ג) ומאפשר סינון ראשוני של נוכחות של גליקופרוטאינים. זה עוזר להפחית את זמן החיפוש אחר glycopeptides, כמו יכול להיות מותאם אישית מסדי להכיל גליקופרוטאינים זוהו בעבר. פיצול HCD-ETD משמש לזיהוי ואפיון הלחנה של אוליגוסכרידים המצורף גרם ECM lycoproteins. איור 4A מציג ספקטרום נציג שהושג עבור פפטיד שכותרתו עם 18 O לאחר deglycosylation (ניתוח glycopeptide עקיף). איור 4B הוא דוגמא מייצגת של קשת שהושגה לאחר הניתוח של glycopeptides השלם מתמציות ECM (ניתוח glycopeptide ישיר).
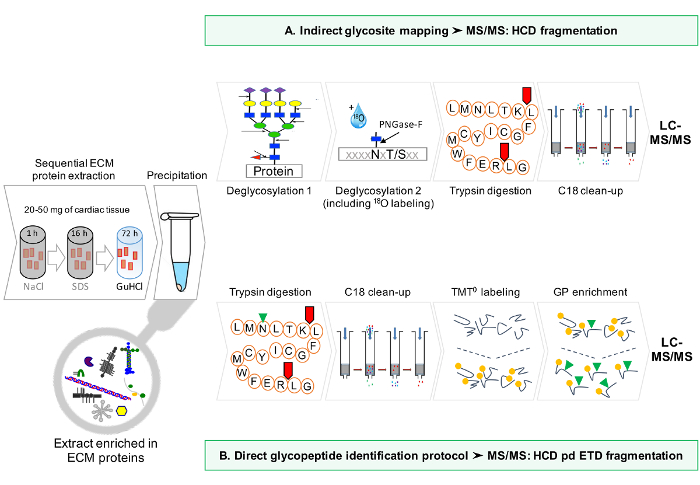
איור 1: סקירה כללית שיטה. (א) לאחר העשרת סדרתי עבור חלבוני ECM, ניתוחי LC-MS / MS מבוצעים על תמציות deglycosylated. (ב) לחלופין, תמציות ECM deglycosylated שאינם מועשרים נוספת glycopeptides. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
2" src = "/ files / ftp_upload / 55,674 / 55674fig2.jpg" />
איור 2: הפקת חלבוני ECM. (א) 3 תמציות שונות הליך החילוץ הרציף ( "Quickstep אנגלית") הן משלימות תכול החלבון שלהם. בעוד תמציות SDS מועשרים בחלבונים תאיים, תמציות GuHCl מכילים את רוב החלבונים ECM. חלוקה מוצלחת היא דמיינה ידי דפוס מכתים כסף השונה. (ב) חלבוני ECM כגון decorin proteoglycans לאוצין העשיר הקטן, biglycan ו mimecan מזוהים בעיקר תמציות GuHCl, עם נוכחות מעט תמציות SDS ו NaCl. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
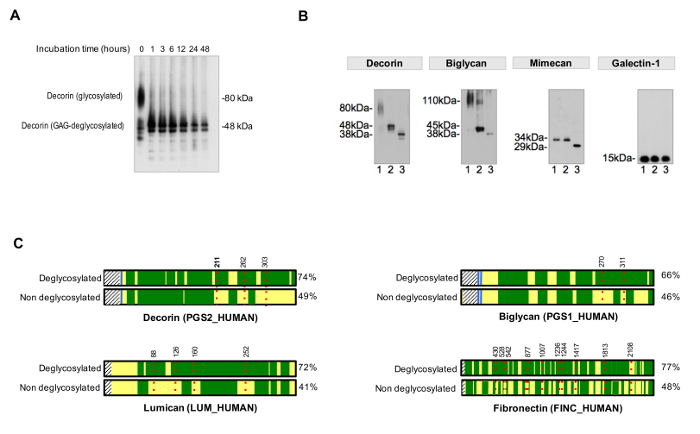
איור 3. ניתוח של Glycosylation. (א) זמני דגירה מתאימים לצורך deglycosylation השלם. הדוגמה מראה את ההשפעה של זמן הדגירה במהלך הסרת שרשראות גליקוז מן decorin גליקופרוטאין. (ב) גליקופרוטאינים ECM הם שרשרות גליקוז גדולות חוזרות N- קצר ומגוונים אוליגוסכרידים צמוד O. ליין 1 על כל אחד immunoblots מייצג תמציות לב לא מטופל. ליין 2 מכיל תמציות שטופלו אנזימים מעכלים glycosaminoglycans. דוגמאות בנתיב 3 מכילות, בנוסף, אנזימים להסרת N- ו- oligossacharides O צמוד. Galectin-1 הוא לא glycosylated, ומכאן שאין שינוי גודל החלבון. מעובד מתוך לינץ M, et al. 4 (ג) LC-MS / MS ניתוח, דגימות שטופלו PNGase-F בנוכחות H 2 O 18 להשיג כיסוי רצף טוב יותר (%, בצד ימין) לעומת דגימות הלא deglycosylated. Dשטחים ירוקים ארון מייצגים כיסוי רצף ידי LC-MS / MS. הקווים האדומים, מנוקד מייצגי glycosites, עם מספרים המציין עמדת חומצת אמינו שלהם. איתור של glycosylation של decorin במיקום ASN 211 (N, מודגשים) מוצג בפירוט כדוגמה באיור 4. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
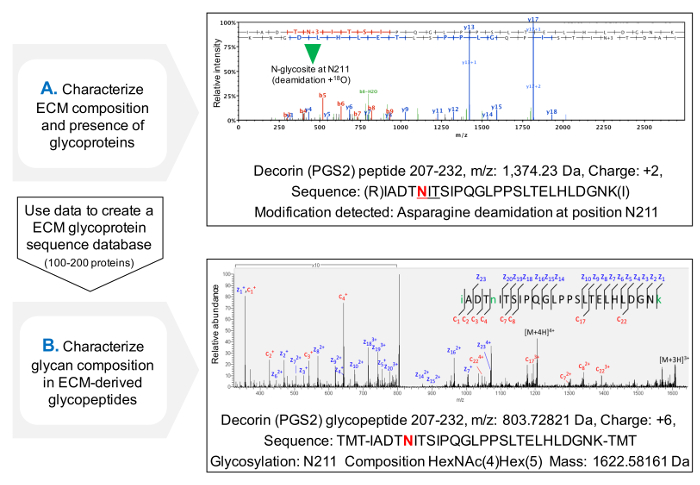
איור 4. ניתוח Glycopeptide ידי MS. (א) שימוש בגישת פרוטאומיקה רובה על תמציות מועשרות ECM, ניתן לזהות glycopeptides ידי הנוכחות של asparagines deamidated בתוך sequons NXT / S ו שכותרתו עם 18 O. הדוגמא מראה ספקטרום HCD MS / MS עבור פפטיד של decorin המכיל את בעבר glycosylated ASN 211. הנתונים המתקבלים יכולים לשמשכדי ליצור גליקופרוטאינים נתונים של ECM אישית. (ב) פיצול HCD-ETD משמש כדי לנתח את תמצית ECM מועשר glycopeptide. הספקטרום ETD MS / MS מאפשר אפיון של הרכב glycan. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
| פתרונות מניות א | |
| DTT (Dithiotreitol, C 4 H 10 O 2 S 2) | 100 מ"מ DTT ב DDH 2 O. 1 |
| EDTA (חומצה Ethylenediaminetetraacetic, C 10 H 16 N 2 O 8) | 250 מ"מ EDTA ב DDH 2 O, pH 8.0. |
| GuHCl (hydrochloride guanidine, CH 6 Cln 3) | 8 M GuHCl בDDH 2 O. |
| רש"ת (iodoacetamide, C 2 H 4 INO) | 500 מ"מ רש"ת ב DDH 2 O. 1,2 |
| Na אצטט (אצטט נתרן, C 2 H 3 נאו 2) | 1 אצטט M Na ב DDH 2 O, pH 5.8. |
| NaCl (נתרן כלורי, NaCl) | 1 M NaCl ב DDH 2 O. |
| Na פוספט dibasic (פוספט Disodium, Na 2 H 2 PO 4) | 1 dibasic פוספט M Na ב dd H 2 O, pH 6.8. |
| SDS (סולפט dodecyl נתרן, NAC 12 H 25 SO 4) | 1% SDS (35 מ"מ) ב DDH 2 O. 3 |
| TFA (חומצה trifluoroacetic, C 2 HF 3 O 2) | 10% TFA (1.2 M) ב DDH 2 O. |
| TEAB (ביקרבונט Triethylammonium, C 7 H 17 NO 3) | 1M TEAB ב ב ddH2O, 8.5 pH |
| Thiourea (Thiourea, CH 4 N 2 S) | 3 M thiourea ב DDH 2 O. |
| Tris-HCl (טריס-הידרוכלוריד (NH 11 C 4 O 3 [HCl]) | 100 מ"מ טריס-HCl ב DDH 2 O, pH 7.5. |
| אוראה (שתנן, CH 4 N 2 O) | 9 אוריאה M ב DDH 2 O. |
| מאגרי תגובת B. | |
| חיץ איזון לנקות C18 | 1% ACN, 0.1% TFA ב DDH 2 O |
| חיץ לשטוף טור לנקות C18 | 80% ACN, 0.1% TFA ב H 2 O |
| חיץ elution לנקות C18 | 50% אצטוניטריל, 0.1% TFA ב DDH 2 O |
| Deglycosylation חוצץ (4x) | 600 מ"מ NaCl ו 200 פוספט mM Na ב DDH 2 O, pH 6.8. |
| GuHCl חיץ 4 | 4 M הידרוכלוריד guanidine, 50 אצטט mM Na ו 25 מ"מ EDTA ב DDH 2 O, 5.8 pH. להוסיף 1: 100 (v: v) של קוקטייל של מעכבי proteinase לפני השימוש. |
| חיץ NaCl 4 | 0.5 M NaCl, 10 מ"מ טריס-HCl ו 25 מ"מ EDTA ב DDH 2 O, pH 7.5. להוסיף 1: 100 (v: v) של קוקטייל של מעכבי proteinase לפני השימוש. |
| PBS (1x) | 1.7 מ"מ KH 2 PO 4, 5 מ"מ Na 2 HPO 4, 150 מ"מ NaCl, pH 7.4. להוסיף 25 מ"מ EDTA ו 1: 100 (v: v) של קוקטייל של מעכבי proteinase לפני השימוש. |
| חיץ מדגם (4x) | 100 מ"מ טריס, 2% SDS, 40% גליצרול, 0.02% כחול bromophenol ב DDH 2 O, pH 6.8. להוסיף 10% SS-mercaptoethanol לפני השימוש. |
| חיץ SDS 4 | 0.1% SDS ו 25 מ"מ EDTA ב DDH 2 O. הוסף 1: 100 (v: v) של קוקטייל של מעכבי proteinase BEFשימוש עפרות. |
| אנזימי ג | |
| Chondroitinase ABC 5 | 0.5 U / mL במאגר deglycosylation (1x) |
| Keratanase 5 | 0.1 U / mL במאגר deglycosylation (1x) |
| Heparinase השנייה 5 | 0.1 U / mL במאגר deglycosylation (1x) |
| α2-3,6,8,9-Neuraminidase (sialidase) 5 | 0.025 U / mL במאגר deglycosylation (1x) |
| β1,4-galactosidase 5 | 0.015 U / mL במאגר deglycosylation (1x) |
| בטא-N-Acetylglucosaminidase 5 | 0.25 U / mL במאגר deglycosylation (1x) |
| אנדו-α-N-acetylgalactosaminidase (O-glycosidase) 5 | 0.013 U / mL במאגר deglycosylation (1x) |
| PNGase-F (N-glycosidase-F) 6 | 50 U / mL ב H 2 O 18 |
| טריפסין | 0.01 מיקרוגרם / μL במאגר TEAB |
| הערות בטבלה. | |
| 1 שמור פתרון מניות קפוא ב -20 מעלות צלזיוס. | |
| 2 רש"ת צריך להישמר מפני אור. | |
| 3 SDS מתגבש בקלות על <20 ° C. על מנת להקל solubilization של 1% SDS (פתרון מניות), לחמם את החיץ תחת מים ברז חמימים. | |
| ניתן לאחסן 4 מאגרי חילוץ ב RT. הוסף קוקטייל ספקטרום רחב של מעכבי proteinase כמצוין לפני השימוש. | |
| 5 אלה אנזימים יש להוסיף במהלך השלב הראשון deglycosylation. | |
| 6 PNGase-F יש להוסיף רק במהלך השלב השני deglycosylation. | |
טבלה 1: פתרונות מניות, חוצצי תגובה ואנזימים. טבלה זו מפרטת את ההרכב של כל חיץ פתרון ותגובת מניות הנדרשים להפקה והעיבוד הבא (כולל digestions אנזימטי) של חלבוני ECM לב לפני ניתוח MS.
Discussion
פרוטוקול פרוטאומיקה זה ממוטב במהלך השנים האחרונות במעבדה שלנו. הנה, השתמשנו ברקמת לב, אבל רק שינויים קלים עשויים להידרש ליישום שלה לרקמות אחרות. לדוגמה, פרוטוקול החילוץ צריך לקחת את cellularity של הרקמה בחשבון. ברקמת לב היא מאוד הסלולר לעומת רקמת כלי דם. בעת שימוש ברקמת כלי הדם, ריכוז SDS יכול להיות נמוך יותר (כלומר 0.08%) ואת הזמן decellularization הוא קצר יותר (כלומר 4 h) 11, 12, 13. השימוש באנזימי deglycosylation חיוני לניתוח LC-MS / MS של רכב ECM. עם זאת, פעמי דגירה צריכות להיות מותאמות עבור סוגי רקמות שונים. לדוגמה, heparinase השנייה פעמים דגירה ממושכת הנדרשת על 25 מעלות צלזיוס, כאשר באמצעות דגימות כגון העור, אשר עשירים בחלבונים קרום במרתף (למשל Agrin, perlecan) (מידע לא מוצג). ניתן לבצע ניתוח glycopeptide ישיר על התקשורת המותנה מתאי בתרבות 15. צעדים עשרה לא ייתכן שיידרשו לניתוח subproteome פשוטה זו. בדומה תמציות GuHCl, תמציות NaCl הם גם מקובל לניתוח glycoproteomics עם שינויים קלים. פרוטוקולי מיצוי אחרים להעשרה של חלבוני ECM ניתן להתאים לאפיין glycopeptides ECM 19, 20.
Glycosylation הוא PTM 5 המורכבים ביותר. זיהוי עקיף של glycopeptides מושג על ידי זיהוי של ASN deamidated עם 18 שולבו O בכל sequon NXT / S. Deamidated ASN על עמדות אחרות עשוי לייצג חיוביות שגויות. כמו כן, N-glycosylation חייב להיחשב בהקשר של אונטולוגיות חלבון: חלבונים תאיים המכילים sequon NXT / S לא יהיה glycosylated אבל אולי להצמיח תוצאות חיוביות שגויות. כפי searc הנוכחיאלגוריתמים h אינם מאפשרים הקרנת PTMs על רצפים שנקבעו מראש בלבד (כלומר ASN ב NXT / S), סינון ידני של נתונים נדרש. זיהוי נוכחות / היעדרות של glycosylation על עמדות אלה ניתן להשוות בין דגימות ולניטור מחלות. אין מקבילת אנזים כדי PNGase F עבור O-deglycosylation (כלומר החדרת שינוי מסה על תראונין או סרין). לכן, זיהוי של glycosylation O מוגבל ניתוח glycopeptide ישיר. ניתוח glycopeptide ישיר משמש להשגת מידע הלחנה של סוכרים המחוברים לחלבונים, אך אינו מספק מידע מבני של glycan. יתר על כן, את הרכב glycan הוא התוצאה של סינתזת glycan ועיבוד לאחר הפרשה.
שיטת החילוץ 3-צעד שלנו עבור חלבונים ECM ( "אנגלית Quickstep") 6 אפשרה המאפיינת את ECM במגוון של רקמות וכלי דם. היפוך של הרקמהלכמה תמציות נדרש לקבל proteome ECM מפושטת כפי שפורט במקום אחר 6. חלבונים תאיים אחרת יתרמו טווח דינמי מוגזם של שכיחותם חלבון בתוך התמציות כי הייתה לעכב זיהוי של חלבוני ECM בשפע פחות. יתר על כן, חלבונים תאיים לשאת O-glycosylations 5 כי תסבך עשרת glycopeptide ECM וניתוח MS עוקב. מחברים אחרים להחיל מתודולוגיות חילוץ דומות לאפיין עבור ריאות למשל 21 ורקמות סחוס 10, אולם הם לא רדפו אחרי הניתוח של glycosylation. הניתוח קודם של glycosylation התמקד זיהוי glycosites בלבד, דורש הסרה של glycan מן ליבת החלבון, ולא ניתן להעריך O-glycosylation 22, 23. מערכים לקטינים והעשרה כימיים זמינים עבור הערכה של typ glycanes על דגימות ביולוגיות המבוסס על סגוליות המחייבות שלהם, אבל הטכניקות הללו לא יכולות להקצות סוגי glycan לחלבונים ספציפיים 24 וגם הם יכולים להעריך אתרי glycosylation.
בתחילה, השתמשנו ג'ל אלקטרופורזה לפני LC-MS / MS של חלבוני ECM. למרות הפרדת ג'ל שימושית בקבלת שברי חלבון פשוטים מקובלים לניתוח LC-MS / MS, המכשירים האחרונים מציעים מהירויות סריקה מהירה יותר. לכן, צעד הפרדת electrophoretic ניתן להשמיט. זה מספק יתרון נוסף כמו חלבוני ECM גדולים, אשר נשמרים על גבי ג'ל, מנותח בצורה יעילה יותר. עם זאת, המידע לגבי Mw של חלבונים שלמים הולך לאיבוד. צעד האידוי לפני deglycosylation PNGase F מבטיח הסרה מלאה של O הרגיל H 2 למזער שלילי שווא. שאריות סוכר (כלומר המוני glycan משתנים) להפריע הפרדה על ידי LC ו להתפשר זיהוי הפפטיד עוקב ידי MS / MS. עמ 'פרוטוקול א-deglycosylation מומלץ גם עבור ניתוח חקר חלבונים של חלבוני ECM לא התמקדו glycosylation.
פרוטאומיקה יכול לספק תובנות חסרות תקדים לתוך ECM. מעבר לתמיכה מבנית, גליקנים המחוברים ECM חיוניים אינטראקציה מארח הפתוגן, תקשורת בין תאים לבין התגובה החיסונית 25, כלומר דחייה של השתל לאחר השתלת איברים. Glycoproteomics תהיה כלי חיוני glycobiology.
Disclosures
אף אחד.
Acknowledgements
JBB הוא עמית הקמת קריירה במרכז קרן הלב הבריטית של המלך. MM הוא עמית בכיר של קרן הלב הבריטית (FS / 13/2 / 29,892). המחקר נתמך על ידי יוזמה ומצוינת (מרכזי כשירות עבור טכנולוגיות מעולות - COMET) של FFG סוכנות קידום המחקר האוסטרי: "מרכז המחקר של אקסלנס ב Vascular הזדקנות - טירול, VASCage" (K-Project מספר 843,536) לבין המחקר ביו-הרפואי NIHR מרכז מבוסס על ו של גיא סנט תומאס National Health Service Foundation Trust ו בקינגס קולג 'בלונדון בשיתוף עם בית החולים קינגס קולג'.
Materials
| Name | Company | Catalog Number | Comments |
| A. Chemicals | |||
| Acetonitrile, MS-grade (ACN, C2H3N) | Thermo Scientific | 51101 | 5.2-5.8, 6.2, 7.11, Supp 2, 3, 4 |
| Cocktail of proteinase inhibitors | Sigma-Aldrich | P8340 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Disodium phosphate (Na2H2PO4) | Sigma-Aldrich | S7907 | 3.1 |
| Dithiotreitol (DTT, C4H10O2S2) | Sigma-Aldrich | D0632 | 4.3 |
| Ethylenediaminetetraacetic acid (EDTA, C10H16N2O8) | Sigma-Aldrich | E9884 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Ethanol (C2H6O) | VWR | 437433T | 2.2.1 |
| Guanidine hydrochloride (GuHCl, CH6ClN3) | Sigma-Aldrich | G3272 | 1.6.1 |
| Glycerol (C3H8O3) | Acros organics | 158920025 | Suppl 1.1 |
| H2O LC-MS Cromasolv | Sigma-Aldrich | 39253-1L-R | Throughout the protocol |
| H218O | Taiyo Nippon Sanso | FO3-0027 | 3.5 |
| Hydroxylamine (HA, H3NO) | Sigma-Aldrich | 467804 | 6.4 |
| Iodoacetamide (IAA, C2H4INO) | Sigma-Aldrich | A3221 | 4.4 |
| Phosphate-buffered Saline (PBS), 10x | Lonza | 51226 | 1.3 |
| Sodium acetate (C2H3NaO2) | Sigma-Aldrich | S7545 | 1.6.1 |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | 1.4.1, 3.2 |
| Sodium dodecyl sulfate (SDS, NaC12H25SO4) | Sigma-Aldrich | 466143 | 1.5.1 |
| Triethylammonium bicarbonate (TEAB, C7H17NO3) | Sigma-Aldrich | 11268 | 4.7, 6.1 |
| Trifluoroacetic acid (TFA, C2HF3O2) | Sigma-Aldrich | T62200 | 4.8, 5.2-5.8, 7.11, Supp 2, 3 |
| Thiourea (CH4N2S) | Sigma-Aldrich | T8656 | 4.2 |
| Tris-hydrochloride (Tris-HCl, NH11C4O3[HCl]) | Sigma-Aldrich | T3253 | 1.4.1, Suppl 1. |
| Urea (CH4N2O) | Sigma-Aldrich | U1250 | 4.2 |
| Name | Company | Catalog Number | Comments |
| B. Enzymes | |||
| α2-3,6,8,9-Neuraminidase (Sialidase) | EDM Millipore | 362280 (KP0012) | 3.1 |
| β1,4-Galactosidase | EDM Millipore | 362280 (KP0004) | 3.1 |
| β-N-Acetylglucosaminidase | EDM Millipore | 362280 (KP0013) | 3.1 |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | 3.1 |
| Endo-α-N-acetylgalactosaminidase (O-glycosidase) | EDM Millipore | 362280 (KP0011) | 3.1 |
| Heparinase II | Sigma-Aldrich | H6512 | 3.1 |
| Keratanase | Sigma-Aldrich | G6920 | 3.1 |
| PNGase-F (N-Glycosidase F) | EDM Millipore | 362280 (KP0001) | 3.5 |
| Trypsin | Thermo Scientific | 90057 | 4.7 |
| Name | Company | Catalog Number | Comments |
| C. Reagent kits | |||
| 30 kDa MWCO spin filters | Amicon, Millipore | 10256744 | 5.9, Suppl 2 |
| Macro SpinColumn C-18, 96-Well Plate | Harvard Apparatus | 74-5657 | 5.1 |
| NuPAGE Novex BisTris Acrylamide Gels | Thermo-Scientific | NP0322PK2 | Suppl 1 |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | 2.1.3 |
| ProteoExtract Glycopeptide Enrichment Kit | Merk Millipore | 72103 | 7 |
| Tandem mass tag 0 (TMT0) | Thermo Scientific | 900067 | 6.2, 6.3 |
| Name | Company | Catalog Number | Comments |
| D. Equipment and software | |||
| Acclaim PepMap100 C18 Trap, 5 mm x 300 µm, 5 µm, 100 Å | Thermo Scientific | 160454 | Suppl 3, 4 |
| Acclaim PepMap100 C18, 50 cm x 75 µm, 3 µm, 100 Å | Thermo Scientific | 164570 | Suppl 3 |
| Byonic Search Engine | Protein Metrics | Version 2.9.30 | Suppl 5 |
| Dionex UltiMate 3000 RSLCnano | Thermo Scientific | n/a | Suppl 3, 4 |
| EASY-Spray Ion Source | Thermo Scientific | ES081 | Suppl 4 |
| EASY-Spray PepMap RSLC C18, 50 cm x 75 µm, 2 μm, 100 Å | Thermo Scientific | ES803 | Suppl 4 |
| Mascot Search Engine | Matrix Science | Version 2.3.01 | Suppl 3 |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFADBMBHQ | Suppl 4 |
| Proteome Discoverer Software | Thermo Scientific | Version 2.1.1.21 | Suppl 3, 5 |
| Picoview Nanospray Source | New Objective | 550 | Suppl 3 |
| Q Exactive HF Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFALGMBFZ | Suppl 3 |
| Savant SpeedVac Concentrator | Thermo Scientific | SPD131DDA | 2.2.2, 3.4, 4.6, 5.7, 6.5, 7.11 |
| Scaffold Software | Proteome Software | Version 4.3.2 | Suppl 3 |
References
- Porter, K. E., Turner, N. A. Cardiac fibroblasts: at the heart of myocardial remodeling. Pharmacol. Ther. 123 (2), 255-278 (2009).
- Barallobre-Barreiro, J., et al. Proteomics analysis of cardiac extracellular matrix remodeling in a porcine model of ischemia/reperfusion injury. Circulation. 125 (6), 789-802 (2012).
- Barallobre-Barreiro, J., et al. Glycoproteomics reveals decorin peptides with anti-myostatin activity in human atrial fibrillation. Circulation. 134 (11), 817-832 (2016).
- Lynch, M., Barallobre-Barreiro, J., Jahangiri, M., Mayr, M. Vascular proteomics in metabolic and cardiovascular diseases. J. Intern. Med. 280 (4), 325-338 (2016).
- Varki, A., Lowe, J. B., Varki, A. Biological Roles of Glycans. Essentials of glycobiology. 2nd ed. , (2009).
- Barallobre-Barreiro, J., Lynch, M., Yin, X., Mayr, M. Systems biology - opportunities and challenges: The application of proteomics to study the cardiovascular extracellular matrix. Cardiovasc. Res. , (2016).
- Agnetti, G., Husberg, C., Van Eyk, J. E. Divide and conquer: the application of organelle proteomics to heart failure. Circ. Res. 108 (4), 512-526 (2011).
- Mason, R. M., Mayes, R. W. Extraction of cartilage protein-polysaccharides with inorganic salt solutions. Biochem. J. 131 (13), 535-540 (1973).
- Vogel, K. G., Peters, J. A. Isolation of proteoglycans from tendon. Methods. Mol. Biol. 171, 9-17 (2001).
- Wilson, R., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell. Proteomics. 9 (6), 1296-1313 (2010).
- Barallobre-Barreiro, J., et al. Extracellular matrix remodeling in response to venous hypertension: proteomics of human varicose veins. Cardiovasc. Res. 110 (3), 419-430 (2016).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell. Proteomics. 9 (9), 2048-2062 (2010).
- Didangelos, A., et al. Extracellular matrix composition and remodeling in human abdominal aortic aneurysms: a proteomics approach. Mol. Cell. Proteomics. 10 (8), (2011).
- Grandoch, M., et al. Loss of biglycan enhances thrombin generation in apolipoprotein E-deficient mice: Implications for inflammation and atherosclerosis. Arterioscler Thromb. Vasc. Biol. 36 (5), e41-e50 (2016).
- Yin, X., Bern, M., Xing, Q., Ho, J., Viner, R., Mayr, M. Glycoproteomic analysis of the secretome of human endothelial cells. Mol. Cell. Proteomics. 12 (4), 956-978 (2013).
- Parker, B. L., et al. Quantitative N-linked glycoproteomics of myocardial ischemia and reperfusion injury reveals early remodeling in the extracellular environment. Mol. Cell. Proteomics. 10 (8), (2011).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal. Biochem. 150 (1), 76-85 (1985).
- Pepinsky, R. B. Selective precipitation of proteins from guanidine hydrochloride-containing solutions with ethanol. Anal. Biochem. 195 (1), 177-181 (1991).
- de Castro-Brás, L. E., et al. Texas 3-step decellularization protocol: looking at the cardiac extracellular matrix. J. Proteomics. 86, 43-52 (2013).
- Naba, A., Clauser, K. R., Hynes, R. O. Enrichment of extracellular matrix proteins from tissues and digestion into peptides for mass spectrometry analysis. J Vis Exp. (101), e53057 (2015).
- Decaris, M. L., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell. Proteomics. 13 (7), 1741-1752 (2014).
- Zhang, H., Li, X. J., Martin, D. B., Aebersold, R. Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry. Nat. Biotechnol. 21 (6), 660-666 (2003).
- Parker, B. L., et al. Site-specific glycan-peptide analysis for determination of N-glycoproteome heterogeneity. J. Proteome Res. 12 (12), 5791-5800 (2013).
- Li, Y., et al. Simultaneous analysis of glycosylated and sialylated prostate-specific antigen revealing differential distribution of glycosylated prostate-specific antigen isoforms in prostate cancer tissues. Anal. Chem. 83 (1), 240-245 (2011).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix: an ever-changing and diverse entity. Circ. Res. 114 (5), 872-888 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved