Method Article
הליך ואסטרטגיות אופטימיזציה מפתח שיטה אוטומטית נימי מתכלה מבוסס על Electrophoretic
In This Article
Summary
ראגנטים מבוסס-נים באמצעות פלטפורמה מסחרית כדי למדוד את היעד חלבונים מן ההכנות חלבון הכולל הוא הפגין. בנוסף, הפרמטרים וזמינותו של זמן החשיפה, לריכוז החלבון נוגדן דילול הממוטבות מערכת מודל של התרבות תאים.
Abstract
טכנולוגיות חדשות לנצל המבוסס על נימי immunoassays מבטיח הערכה כמותית יותר ויותר חלבון בהשוואה immunoassays המסורתי. בדומה מבחני נוגדן מבוססי חלבונים אחרים, אופטימיזציה של פרמטרים המבוסס על נימי מתכלה, כגון ריכוז חלבון, דילול נוגדן זמן החשיפה עם זאת, תנאי מוקדם חשוב לדור של אמין ובעל משמעות נתונים. מדידות חייב ליפול בתוך הטווח. ליניארית של וזמינותו איפה לשינויים אות יחסי ישירות לשינויים בריכוז lysate. תהליך בחירת המתאים ריכוזי lysate נוגדנים דילולים, פעמים חשיפה בשורה תאי אפיתל הסמפונות אדם, BEAS-2B, הוא הפגין כאן. ליניאריות assay מוצג על טווח של תאים כל תמצית חלבון ריכוזים עם נוגדנים p53 וα-טובולין. דוגמה של האות שחיקה נתפסת בבית את הריכוזים הגבוהים ביותר עם חשיפה ארוכה פעמים, מעגל דילול של נוגדן α-טובולין מוצג הוכחת רוויה. בנוסף, מדווחים תוצאות ניסויית דוגמה עבור תאים שטופלו דוקסורוביצין באמצעות פרמטרים אופטימליים.
Introduction
נימי immunoassays electrophoretic ביטוי חלבון lysates תא באמצעות מערכות הפרדה גודל או תשלום וכולן מספקות כמה יתרונות על פני immunoassays המסורתי. לדוגמה, כאשר לעומת תספיג, ההליך ממוכנת המבוססת על נימי מבטלת את הצורך ג'ל, העברת התקנים, ושוטף ידני. בנוסף, כמות החלבון הנדרש המוחלט נמצא כ 10 פעמים פחות, ביצוע מערכות מבוססות נימי אידיאליות לשימוש עם סוגי תאים נדיר או מדגם מוגבל1,2. תוצאות מתקבלים קצת כמו 3 שעות באמצעות מערכות אוטומטיות, בעבר הוכחו להיות כמותיים יותר לשחזור מאשר המערבית הקונבנציונלית כתם הליכים3,4,5. תהליך מבוסס-גודל מבחני מורכב טעינה בדגימות המכיל נתרן גופרתי dodecyl (מרחביות), dithiothreitol (DTT), ומתויגים fluorescently משקל מולקולרי סמני לתוך עמודות נימי המכיל סידור בערימה והפרדה מטריצות. מתח חלה על הנימים מפריד את החלבונים הדגימות בהתאם לגודל, אור UV עוצר את החלבונים מופרדים לקיר נימי. נים זה אז חיסונית-שנבדק עם במטרה העיקרית נוגדן וחזרת peroxidase (HRP)-נוגדנים משניים מצומדת. הלומינול ותחמוצת המימן לעודד דור אור chemiluminescent, אשר נמדדת מצלמה בשילוב התקן (CCD) תשלום, ניתח quantitate חלבון.
למרות בקלות יחסית המהירות של פלטפורמת מיכשור וציוד electrophoretic אוטומטית מבוססת-נימי, אופטימיזציה של assay תנאים כגון ריכוז חלבון, דילול נוגדן זמן החשיפה חשובה להשגת מדויק, לשחזור תוצאות. באופן כללי, הפרוצדורות הבאות יש לבצע כדי למטב וזמינותו של מערכות אלה:
1) מסך צריכה להתבצע להעריך ולבחור נוגדנים עבור האות וספציפיות אל המטרה חלבון. אם הוא זמין, חלבון מטוהרים או היעד epitope ניתן להשתמש כדי להעריך ירידה לפרטים; עם זאת, עדיין חשוב להעריך את פוטנציאל אות לא ספציפית הכוללת חלבון הטרייה מערכת מודל.
2) הבא, הטווח הדינמי של וזמינותו צריך להיקבע. במצב אידיאלי, לסמן הכפלה (נמדד בעזרת שיא) נצפית כמו ריכוז מדגם מוכפל; עם זאת, בפועל, שינוי ביחס אות קלט באופן צפוי (למשל, לינאריות מתאים) מספיקה על כימות חלבון. בנוסף, מיטוב זה מגדיר את ריכוז חלבון קליטה גבוהה אך עדיין בתוך הטווח. ליניארית עבור דגם ניסיוני.
3) לקבוע ריכוז נוגדן אופטימלית באמצעות ריכוז חלבון קבוע נבחר אופטימיזציה בשלב 2. ריכוז נוגדן גודלת, האות מגדיל עד זה מישורים-רוויה. ריכוז נוגדן ליד רמת רוויה זו נדרשת עבור מדידה מדויקת של ריכוז חלבון.
התהליך המשמש כדי למטב את ריכוז חלבון נוגדן דילולים, פעמים חשיפה וזמינותו גודל אוטומטי המבוסס על נימי6 הוכח באמצעות תמציות התא כולו מבודד BEAS-2B, אדם SV-40 טרנספורמציה הסימפונות שורת תאים אפיתל. בידוד חלבון של תמציות תאים או רקמות יכול להתבצע באמצעות מספר פרוטוקולים שפורסמו7,8,9 , לא יכוסו כאן. התוצאות של ניסוי הניסיון להשתמש בתנאים אופטימליים גם דיווחו על סך ובעלות phosphorylated (סרין 15, סרין 20) p53 בתרבויות נחשפים דוקסורוביצין (נפוץ כימותרפיות סוכן אשר מעוררת אפופטוזיס תא10) ב- 1.2, 1.8, ו 2.4 מדיה µg/mL עבור 4 h לפני הקציר. האזורים שיא p53 הם מנורמל ל ɑ-טובולין, אשר משמש פקד הטעינה.
Protocol
הערה: להבטיח כי כל ריאגנטים ודוגמאות מוכנות על פי היצרן ' פרוטוקול s, המפורטות להלן. בבקשה ללבוש ציוד למיגון אישי תקין במהלך הליך זה, אשר כוללת nitrile כפפות, חלוק המעבדה, סגור-נעל בטיחות משקפי מגן. טבלת חומרים ספציפיים, ראגנטים וציוד נדרש מסופק בנפרד. ריכוז החלבון הכולל של דגימות צריך להיקבע מראש באמצעות מתודולוגיות הוקמה התואמים המאגר lysate בשימוש, כגון ברדפורד assay 11.
1-הכנת ודוגמאות מן הלהקה רגיל כפי שסופקו על ידי היצרן
- כדי להכין את הפתרון עובד 400 מ של dithiothreitol (DTT), להוסיף מים µL יונים 40 צינור נקי המכיל מניות שסופקו מהיצרן. חשוב להימנע מהחדרה בועות לפתרון על ידי ערבוב הפתרון עם איטית ועדינה pipetting. מאגר מדגם
- µL להוסיף 20 10 X ו- µL 20 של הפתרון DTT מוכן 400 מ ל הצינור ורוד המכיל פלורסנט 5 X מיקס מאסטר (ראה את הטבלה של חומרים).
הערה: מיקס מאסטר (מ מ) חתום על ידי היצרן עם כיסוי רדיד, חייב להיות נעוץ טיפ פיפטה. מערבבים בעדינות על-ידי pipetting איטי כדי להימנע שכשוך DTT פיפטה. - הבא, מוסיפים מים µL יונים 16, 2 µL של מסופקים 10-מאגר דוגמאות, ו- 2 µL של הפתרון DTT מוכן 400 מ ל הצינור הסולם biotinylated לבן המסופקים על ידי היצרן. מערבבים בעדינות ולהעביר לתוך צינור 0.6 מ"ל עבור denaturing.
- הכנת 0.1 x דוגמת המאגר על ידי דילול 10 שסופקו X מטריים פתרון עם מים. להכין מספיק 0.1 x דוגמת המאגר כדי לדלל את כל הדגימות.
- לחשב את כמות 0.1 x מדגם מאגר זה מתווסף מדגם, אשר יהיה תלוי הריכוז הרצוי הסופי של החלבון הכולל. לערבב 1 חלק 5 x מ מ פלורסנט עם 4 חלקים מדולל הדגימה כדי להשיג ריכוז החלבון הסופי הרצוי.
- חישוב כרכים כלהלן: (i) כרך ה' x מ מ פלורסנט = (ריכוז החלבון הסופי הרצוי) / 5; (ii) כמות חלבון מניות = (ריכוז החלבון הסופי הרצוי x הנפח הכולל הדרוש) / חלבון מלאי ריכוז; (iii) נפח 0.1 x מדגם מאגר = הנפח הכולל - 5 x מ מ נפח - חלבון מניות נפח.
2. דנטורציה של הסולם ודוגמאות
- biotinylated הסולם בתוך גוש חום 95 ° C עבור 5 דק וורטקס צינורות מיד לאחר דגירה, ודוגמאות המקום מוכן לבצע סיבוב ~ 5 s שולחן צנטריפוגה, ובמקום על קרח
הערה: חלבונים מסוימים עשויים לדרוש תנאים denaturing עדינה (למשל, 70 o C 10 דקות) כדי למנוע צבירת חלבון ולשפר את ההעברה המטריצה נימי. לשקול אפשרות זו אם יש כבד מריחת משקלים מולקולרית גבוהה יותר (ראה וידאו לדוגמה).
3. הכנת נוגדנים
- כפי שנקבע על ידי אופטימיזציה (ראה תוצאות נציג או וידאו), להכין את dilution(s) הרצוי של נוגדן ראשוני (למשל, 1:50, 1: 100) בהנוגדן שסופקו Diluent 2.
הערה: נוגדנים משמשות בדרך כלל בריכוזים גבוהים עבור המבוסס על נימי מתכלה מאשר עבור סופג המערבי המסורתי. הנוגדן משני המסופק הוא מוכן לשימוש ללא דילול.
4. הכנת הלומינול-S, מי חמצן
- להכין תערובת של 1:1 של הלומינול-S מי חמצן-
- מערבולת לערבב ולאחסן על קרח
הערה: חשוב כי תערובת זו הוא מוכן טרי כל assay ניסיוני. מיקס הכולל 250ul יש צורך להפעיל את צלחת מלאה.
5. הכנת צלחת assay
- כפי שמוצג באיור 1, טען דגימות של ריאגנטים המוכן מעל המשקולת וזמינותו. ראה הוראות מפורטות להלן עבור כל שורה. כדי למזער את אידוי מן הבארות, להבטיח כי המכסה צלחת מוחלף בין תוספות ריאגנט.
- בשורה A, pipet 5 µL של הסולם Biotinylated לתוך A1 היטב. עבור השורה שנותרה, pipet הכין דגימות (5 µL כל) לתוך בארות A2-A25.
הערה: זה הכרחי כי A1 מכיל טוב תמיד הסולם, כמו נימי הראשון במחסנית ממוטבת עבור הפעלת בתקן זה. - בשורה B, pipet 10 µL של נוגדן Diluent 2 לבאר כל (B1-B25).
- בשורה C, pipet 10 µL של נוגדן Diluent 2 לתוך C1 היטב. בשורה הנותרים C בארות, pipet 10 µL של נוגדן ראשוני (בארות C2-C25).
- בשורה D, pipet 10 µL של Streptavidin-HRP לתוך D1 היטב. בשורה הנותרים D בארות, pipet 10 µL של נוגדנים משניים (בארות D2-D25).
- בשורה E, pipet 10 µL של המיקס הלומינול-חמצן טרי כל טוב (E1-E25).
- לבסוף, להוסיף מאגר לשטוף µL 500 לכל תא לכל השורות top 3 של מאגר בארות.
הערה: חשוב למזער את היווצרות בועה pipetting בעדינות, לא גירוש האחסון הסופי מהקצה כמו בועות עשויה להפריע נימי לטעון ולהפעיל. - פעם הבארות כל נטענים, centrifuge את הצלחת-1000 g x עבור 5 דקות בטמפרטורת החדר, כדי להסיר את הבועות ולהבטיח את הנוזל הוא בחלק התחתון של הבארות. פופ בועות גלוי עם טיפ קטן פיפטה או מחט נקי (לדוגמה, סטרילי 25 מד " נציג העליון " מחט).

איור 1 . תבנית pipetting לצלחת assay. קודי הצבע מייצג נכונה ריאגנטים ודוגמאות (סה כ עד 24) הוסיף לצלחת וזמינותו. להוסיף biotinylated הסולם (כתום), ובכן A1 הכין דגימות מבארות A2 עד A25 (תכלת), 2 Diluent נוגדנים לבארות B1 B25 ו- C1 (אור ירוק), נוגדן ראשוני כדי בארות C2 עד C25 (כחול), streptavidin-HRP כדי D1 טוב (ורוד כהה), נוגדנים משניים כדי בארות D2 עד D25 (ירוק כהה), ולערבב הלומינול-חמצן בארות E1 עד E25 (סגול). מאגר שטיפת מתווסף בשלוש השורות הראשונות של אמצע צלחת גדולה יותר וולס (כחול כהה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
6. הפעלת המכשיר מתכלה נימי
- ודא כי המכשיר והמחשב הנלווה מופעלים. אין לחמם את הזמן הדרוש.
- פתח את התוכנה מכשור במחשב. ראשית, בחר " Assay " טאב בצד ימין של החלון, " Assay חדש " תחת " תפריט קובץ " בצד השמאל. בחר את גודל, גודל טווח (למשל, 12-230 kDa) ואת מחסנית סוג (למשל, נימי 25) שבו נעשה שימוש עבור וזמינותו מסוים.
הערה: אחד במאי גם קלט assay פרמטרים, כולל ריכוז חלבון, סוג נוגדן של דילול, אם רצונך בכך, אך אלה אינם נדרשים להתחיל וזמינותו. - פתח את הדלת על המכשיר על-ידי לחיצה על הכפתור בראש החלונית ' תפוז '.
- הסר בזהירות את מחסנית נימי מאריזתו. בלי לגעת הנימים זכוכית עצמם, למקם את המחסנית בעל מחסנית. ודא מחסנית ישיבה על ידי התבוננות את התאורה הפנימית לשנות מ orange לכחול.
- להחזיק את הצלחת בחוזקה על הספסל, לקלף בזהירות את החותם אידוי מן החלק התחתון של הלוח. פופ בועות לראות בבארות מטריקס אלה ההפרדה עם משכל אורח/ים ילד/pipet עצה או מחט נקי (לדוגמה, סטרילי 25 מד " נציג העליון " מחט).
- למקם את הצלחת assay על לוחית, להבטיח שהוא מתיישב, וסגור את הדלת מכשיר.
- לחץ " התחלה " כפתור בתוכנה.
הערה: אם אין לחצן ' התחל ' מופיע, הקשר עם המכשיר אבד. לבחור מכשיר בתפריט השמאלי העליון, ולאחר מכן חבר. מוקפץ אמור להופיע עם המספר הסידורי כלי; בחר באפשרות זו ולאחר מכן לחץ על התחבר. לחצן התחל עכשיו אמור להופיע. - בסיום המרוץ, למחוק את הצלחת. הסר את מיכל הדיו ומניחים במיכל החדים עבור סילוק, יחד עם מזרקים זה אולי שומש כדי יבעבע. להשאיר את הכוח כדי למנוע בעיות התחברות אם המכשיר נמצא בשימוש באופן קבוע (למשל, אחת לשבוע לפחות).
7. ניסוי ניתוח
- לפני ניתוח, להבטיח איכות הבדיקות הבאות מבוצעות.
- תקנים פלורסנט אימות על-ידי בחירה " תקנים להראות " סמל. בדוק כי הסטנדרטים מזוהים כראוי " תצוגת גרף " טאב. אם הם אינם נכונים, ללכת " תצוגה יחידה " סמל, לחץ לחיצה ימנית על הפסגה נכונה ובחר " תקן כוח ", או לחץ לחיצה ימנית על הפסגה שגוי ובחר " לא תקן ". בצע בדיקה זו עבור כל נים חדשים.
- אימות הסולם biotinylated על ידי לחיצה על " דגימות " ו " תצוגה יחידה " סמלים. בחר את הסולם בכרטיסיה הניסוי. אם לשיא מזוהה באופן שגוי, לחץ לחיצה ימנית על זה " תצוגת גרף " ובחר " הסר שיא ".
הערה: לדוגמה, הסולם biotinylated המשמש עבור ערכת kDa 12-230 צריך להראות 12, 40, 66, 116, 180 ו- 230 kDa שנקודות פסגות. אם שלב זה לא מבוצע, שינוי גודל של הפסגות מדגם באופן שגוי יחושבו, הפקת תוצאות כדין. - תצוגה וניתוח פסגות לדוגמה. להפיק נתונים מהטבלה ' פסגות ', כולל משקל מולקולרי, באזור השיא, שיא גובה אות רעש (S/N), כנדרש לצורך חישובים ניסיוני.
תוצאות
זמן החשיפה - שחיקה אות הקובע
האות שחיקה עשויה להתרחש כאשר המצע הלומינול ותחמוצת המימן תיגמר מהר מדי. זה יכול להיקבע על ידי בחינת הנתונים בזמנים חשיפה chemiluminescence שונים. התוכנה ניתוח, כנס ל "ערוך – > ניתוח – > תמונות". חשיפות בטווח שבין 5 ל 480 s. ציר ה-y ב- electropherogram דוחות אות/שעה, כך נתוני החשיפה כל אחד צריך מקדם אות/זמן דומה. מקדם זה מקטין עם חשיפות ברצף זמן רב יותר אם הלומינול הופך להיות דלה, כפי שניתן לראות עם הנוגדן דו-1 p53 (איור 2). בגלל המחסור המצע, assay זה יכול להיחשב מדיד עד ריכוז µg/µL 0.2 רק ב 5-30 s החשיפות. לכן, בדוגמה זו, 15 s היה נחוש בדעתו להיות הזמן חשיפה אופטימלית נתונים ניתוח p53.
טיטור lysate - קביעת טווח דינמי ליניארי
חשוב מדידות להילקח בטווח דינמי ליניארי של כל assay, איפה לשינויים האות כפי שנמדד לפי אזור שיא ביחס לשינויים בכמות החלבון במדגם. שימוש בזמן חשיפה אופטימלית נבחר s 15 בסעיף הקודם, וזמינותו ליניאריות הוכח p53 וגם ɑ-טובולין מעל גדול יותר מגוון 15-fold של ריכוז (איור 3). מניסיוננו, ערך2 R של > 0.9 של רגרסיה ליניארית להתאים נחשב מקובל עבור טווח דילול של חלבון מטוהרים של כמות ידוע (אם וזמינותו מדידה כמותית מוחלטת) או לטעום lysate של חלבון המטרה לא ידוע (אם וזמינותו הוא מידה כמותית יחסית).
אופטימיזציה של דילול נוגדן
באמצעות נוגדנים ב קולח ריכוזים מסייעת להבטיח כי כל שינוי האות נמדד רק בשל שינויים בכמות החלבון. בתור הדגמה, שתי שורות תא BEAS-2B, התא כולו תמציות (0.2 µg/µL הכוללת חלבון נטען לתוך וזמינותו) היו שנבדק עם ריכוזים נוגדן ɑ באופן סדרתי מדולל-טובולין הנע בין 1:25 - 1:800 (איור 4). האות chemiluminescent (כאן, נמדד כשטח שיא) הייתה להתוות נגד דילול נוגדן. רוויה נצפתה ליד 1:50 מתחילה העקומה מישור בולט דילול.
משפט ניסיוני - דוקסורוביצין הטיפול בתאים BEAS-2B
שימוש assay מיטבי בתנאים, תרבית תאים BEAS-2B טופלה עם שלושה ריכוזים שונים של דוקסורוביצין (1.2, 1.8 ו 2.4 µg/mL) במשך 4 שעות (איור 5, טבלה 1). הפעלה של p53 דרך שינויים post-translational שמתווכת תגובות הסלולר מספר, כולל מעצר מחזור התא, הזדקנות ביולוגית של אפופטוזיס12. באופן ספציפי, זירחון של סרין 15 יוחסה להפעלה תעתיק של p53, וכתוצאה מכך אפופטוזיס לאחר טיפול דוקסורוביצין13. בהפגנה הזו, ɑ-טובולין מנורמל שיא האזורים מוצגים כמו קיפול של שליטה. מעניין, 3.5 לעלייה p53 זרחון על סרין 4-fold נצפו עליות 15 ו- 2-fold רמת p53 phosphorylated-סרין 20 לאחר 4 שעות חשיפה דוקסורוביצין. תוצאות אלו מצביעות על ההפעלה של p53; עם זאת, אין מנה-תגובה נתפסת עבור הריכוזים שבחרת (לעומת זאת, המנה הנמוכה ביותר נבדק elicited התגובה הגבוהה ביותר). סה כ p53 לא להפגין מענה ברור טיפול במערכת מודל. הבחנו בעבר הפעלה של p53 זירחון בהיעדרו של רמות גבוהות של p53 הכולל תנאים דומים שטופלו אבץ BEAS-2B תאים14.

איור 2 . חשיפה השוואה התמונה כדי לזהות אות שחיקה. ליין צפיות הצג הפחתת ריכוז חלבון עבור BEAS-2B lysates שנבדק עם p53 נוגדנים דו-1 לדילול שבערך. המקדמים של אות chemiluminescence, המדווח פסגת הגולן בתוכנה כלי נגינה, הן נקודות המגע המוצגים. בניגוד הגולן שיא, עוצמות הלהקה ויזואלית אוטומטית שנוצר, על ידי המכשיר כדי לסייע צפייה של להקות, הן לא דומות מהחלונית אחד למשנהו. שימו לב לירידה chemiluminescence אות כמו זמן החשיפה עולה, עם האות תחילתן (פיצול פיק)-שתי החשיפות הארוך, המציינת את המצע דלדול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3 . טיטור lysate מציג תצוגות ליין. טיטור lysate מציג את ליין צפיות (א) BEAS-2B lysate כאשר נחקר עם שבערך p53 דו-1 או 1:50 ɑ-טובולין. שלא כמו ערכי אזור הפסגה, עוצמות הלהקה חזותי באופן אוטומטי שנוצר, על ידי המכשיר כדי לסייע צפייה של להקות, הן לא דומות מהחלונית אחד למשנהו. ניתוח של רגרסיה ליניארית (B) מאשרת שמבחני הם לינארית מעל הטווח כולו נבדק, מ 0.01 µg 0.20/µL, µg 0.025 כדי 0.40/µL, עם ערכי R2 0.999 ו- 0.985, בהתאמה. ריכוז החלבון הכולל באמצע הטווח. ליניארית נבחרו כדי להכיל פוטנציאל וריאציה חלבון המטרה בשני הכיוונים (לדוגמה, µg/µL 0.2 עבור α-טובולין). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 . Α-טובולין נוגדן דילול ' עקומות ' עבור שתי נפרד BEAS-2B חלבון lysates עם או בלי בסיס נורמליזציה. Depar מובהקמכשור מ ליניאריות נתפסת 1:50 (0.02) דילול, המציינת את הרוויה. 1:50 ולכן נבחר דילול אופטימלית עבור זה הנוגדן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
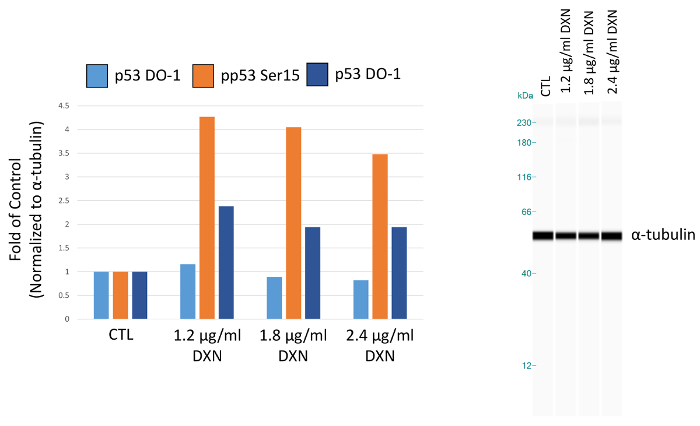
איור 5. השפעת הטיפול דוקסורוביצין (DXN) 4 שעות על סך של סרין phosphorylated ביטוי חלבון p53 של תאים BEAS-2B. שיא אזורים מנורמל ל α-טובולין, התווה קיפול של שליטה (CTL). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
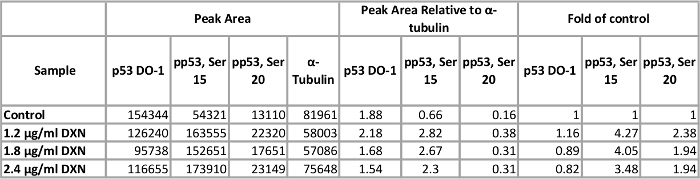
טבלה 1. השפעת הטיפול דוקסורוביצין (DXN) 4 שעות על סך של סרין phosphorylated ביטוי חלבון p53 של תאים BEAS-2B. אנא לחץ כאן כדי להציג גירסה גדולה יותר של השולחן הזה.
Discussion
במשך עשורים, היו מתמשכת ההתעניינות בפיתוח שיטות מתכלה electrophoretic המבוסס על נימי עקב נמוך ריאגנט ולדגום ההוצאה, ירד עיבוד זמן בהשוואה לשיטות מסורתיות וגבוה תאימות ל להפוך לאוטומטיות הליך ה-4,15. ישנם מספר פרוטוקולים שונים עבור הפרדת חלבונים אשר נעזרו נימים, כולל פולימר electrophoretic, electrokinetic, ניפוי, ושיטות לגירויי כאב, אשר לבודד חלבונים לפי מאפיינים שונים (בהתאמה, מטען אלקטרוסטטי, שיווי משקל המחיצה, ניפוי מאפיינים של מטריקס הפרדת, ו pH)16. כאן, אנו מתארים של השיטה אלקטרופורזה נימי נוגדן מבוסס (או מתכלה), באמצעות פולימר ניפוי הפרדה, יש כבר אוטומטי ומסחרית המאומץ3. היתרונות של מערכת זו כולל קלות שימוש, מבצע, ריאגנטים סטנדרטית ו זמינים מסחרית, מדידות אמין, רגיש הדורשים פחות ריאגנט ודוגמאות לעומת מבחני חלבון מסורתיים כגון, תספיג חלבון מקושרים-אנזים מתכלה, ועוד פורמטים3,4,5. זה נרשמה בהערכות קודמות של טכנולוגיה זו כי הטווח בגודל של חלבון זה יכול להיות מוערך יש היה מוגבל על-ידי הפרדה זמין מטריקס4ההנפקות אולם האחרונות הרחיבו את טווח מדידה 2 440 kDa17 . בנוסף, כמה מאגרי lysate ידועים להיות תואם ל- assay18, ולכן מבחר ריאגנטים ניסיוני המשמש יש לקחת בחשבון מראש.
היתרון העיקרי של הליך אוטומטי עם רכיבים זמינים מסחרית היא עקביות של תוצאות באמצעות שיטות מתוקננת, ריאגנטים. פעולה זו מקטינה את הסיכוי לכשל assay על ידי מיכון שלבים קריטיים בתוך השגרה. עם זאת, חשוב לציין כי פרקטיקות מסוימות חייב להיות דבקה במהלך פרוטוקול כדי למזער בעיות מיכשור וציוד נימי מבוסס על electrophoretic. קודם, זה קריטי כי התערובת הלומינול-S/מי חמצן מוכן טרי ומיד לפני צלחת טעינה. תזמון עקבי תגרום לומינסנציה עקבי אחרי הסוכן חמצון נוסף, אשר תגרום המידות עקבית עבור וזמינותו נוגדנים מסוימים לאחר assay. יתר על כן, חשוב כי ריאגנטים שפג תוקפו שאינם משמשים, אשר משפיע בעיקר את העוצמה של סוכן חמצון. בנוסף, חשוב כי סדר טעינה של דגימות, נוגדנים, וחומרים אחרים אך ורק לאחר מכן (ראה איור 1). כל ריאגנט pipetted מהמקום יביא כשל assay, ריצה מבוזבז.
מלבד השלבים הקריטיים, בעיות העיקרי חוו עם הטכניקה ניתן בדרך כלל להתגבר באמצעות אופטימיזציה. אכן, תנאים אלה ספציפיים לכל שילוב מערכת/נוגדן מודל, לכן צריך להיות נחוש מדעית עבור כל assay חדש. במאמר זה, אנו מתמקדים שלושה הליכים אופטימיזציה נפוצות: זמן החשיפה טיטור lysate, דילול נוגדן ראשוני. היכולת להפיק תוצאות הניתנות למדידה תלוי ניתוח של מועד החשיפה כאשר המצע הלומינול לא להיות במהירות תיגמר, כתוצאות המצע דלדול לאובדן של האות. טיטור lysate קובע את הטווח הדינמי ליניארי של כל assay, שיכול להיות שונה עם מערכות מודל שונה, כמו גם נוגדנים שונים, אפילו בשביל חלבון לאותו היעד. נוגדן דילולים שבחרת ליד קולח ריכוזי או להבטיח שינויים אות לא יושפעו על ידי מחסור נוגדן חינם, אלא רק על ידי כמות חלבון זמין היעד epitope שונות. שיקולים אחרים במהלך תהליך אופטימיזציה עשויים לכלול זמן הדגירה נוגדן ודגימת לערום/זמן טעינה. ברוב המקרים הגדרות ברירת המחדל עבור הכלי מציעים את האיזון הטוב ביותר של רזולוציה ורגישות. עם זאת, במקרים מסוימים, רזולוציה נמוכה או רגישות ניתן לשפר באמצעות התאמת הפרמטרים האלה.
ראגנטים נימי electrophoretic מבוססי שיטות מספקים מדידות חלבון מהיר, יעיל, ו לשחזור. שיטות אלה כבר נעזרו בעיקר בהגדרות מחקר ופיתוח, מרקם של טכנולוגיות אלה יש פוטנציאל השירות יישומים קליניים ולניהולו. לדוגמה, זיהוי subpopulations רגישים חשיפה לרעלים סביבתיים או חולים עם התקדמות המחלה יכול להיות מבוסס על חלבון סמנים ביולוגיים נמדד מטריצות נגישים, כגון דם, שתן ורוק. ריאגנט של ירידה במחיר מבצע, מספר מטרות שניתן המוערך בו זמנית מגביר ודוגמאות, שנראה סביר מתכלה נימי electrophoretic המבוסס על שיטות המשמשות עבור סוגים אלה של יישומים.
Disclosures
המחברים מצהירים כי יש להם אינטרסים כלכליים אין מתחרים. כתב יד זה נבדקו על ידי נבחרת בריאותם של מעבדת המחקר השפעות סביבתיות ואושרו לפרסום. התוכן ואינם משקפים בהכרח של המשרד לאיכות הסביבה אותנו ולא עושה איזכור שמות מסחריים או מוצרים מסחריים מהווים המלצה או המלצה לשימוש.
Acknowledgements
המחברים רוצה להודות קית Tarpley אותנו לאיכות הסביבה במשרד ראש צוות פיתוח, מחקר, פיתוח-Research Triangle Park (ORD-RTP) גרפיקה ומדיה מדביק, ועריכה של וידאו הדרכה. כן נרצה להודות דבורה פריטצ'ט מ ProteinSimple לשיחות מועיל לגבי אופטימיזציה של הנתונים שלנו,. JM Guynn נתמכה על ידי המכון אוק רידג המדע, החינוך תוכנית מחקר/השתתפות ב לנו מסוכנות ההגנה על הסביבה.
Materials
| Name | Company | Catalog Number | Comments |
| Wes instrument | ProteinSimple (Santa Clara, CA) | 004-600 | |
| P53 DO-1 primary antibody | Santa Cruz Biotechnology, Inc. | sc-126 | |
| phosphorylated p53 (ser 15) primary antibody | Cell Signaling Technology | 9286 | |
| phosphorylated p53 (ser 20) primary antibody | Cell Signaling Technology | 9287 | |
| alpha-tubulin primary antibody | Cell Signaling Technology | 3873 | used as a loading control |
| Compass Software | ProteinSimple (Santa Clara, CA) | provided with the Wes | |
| 12-230 kDa Master kit | ProteinSimple (Santa Clara, CA) | PS MK02 (since replaced by a new kit #) | |
| www.proteinsimple.com/consumables_sw_wes.html | INCLUDES PART NO: Wash Buffer (60 mL) 042-202 10X Sample Buffer (440 μL) 042-195 Pre-Filled Microplates (8) PS-PP01 Capillary Cartridges (8) PS-CC01 Antibody Diluent II (20 mL) 042-203 Luminol-S (1.5 mL) 042-233 Peroxide (1.5 mL) 042-234 Streptavidin-HRP (132 μL) 042-414 Standard Pack (8): Biotinylated ladder, fluorescent 5X master mix, DTT, and empty 0.6 mL tube PS-ST01 Anti-Rabbit Secondary Antibody 042-206 or Anti-Mouse Secondary Antibody 042-205 | ||
| Name | Company | Catalog Number | Comments |
| Cell culture, treatment, and harvest (using vendor recommended protocols; protocols not included in manuscript) | |||
| BEAS-2B cells | American Type Culture Collection (ATCC, Manassas, VA) | CRL-9609 | |
| keratinocyte growth medium, KGM Gold | Lonza Ltd (Basel, Switzerland) | 192152 | for cell culture |
| keratinocyte basal medium, KBM Gold | Lonza Ltd (Basel, Switzerland) | 192151 | serum free medium for chemical dosing |
| doxorubicin | Sigma-Aldrich (St. Louis, MO) | D1515 | |
| Coomassie Blue Bradford Assays | ThermoFisher Scientific (Waltham, MA) | 23200 | for protein quantification |
| Nuclear Extract kit | Active Motif (Carlsbad, CA) | D1515 | used to prepare whole cell lysates |
| INCLUDES: | |||
| Lysis Buffer AM1 | |||
| 1M dithiothreitol (DTT) | |||
| Protease Inhibitor Cocktail | |||
| 10X PBS | |||
| Phosphatase Inhibitors |
References
- Bradley, H. L., Sabnis, H., Pritchett, D., Bunting, K. D. . Hematopoietic stem cell protocols. 1185, (2014).
- Guo, L., Eldridge, S., Furniss, M., Mussio, J., Davis, M. Use of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes (hiPSC-CMs) to Monitor Compound Effects on Cardiac Myocyte Signaling Pathways. Curr Protoc Chem Biol. 7 (3), 141-185 (2015).
- Chen, J. Q., et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system. Anal Biochem. 442 (1), 97-103 (2013).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. J Transl Med. 13, 182 (2015).
- Liu, S., et al. The Application of a Novel Nanovolume Capillary Electrophoresis- Based Protein Analysis System in Personalized & Translational Medicine Research. J Bioanal Biomed. S3 (004), (2013).
- ProteinSimple Western. . Size Assay Development Guide, Revision 1. , (2014).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. J Vis Exp. (93), (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Silva, J. M., McMahon, M. The fastest Western in town: a contemporary twist on the classic Western blot analysis. J Vis Exp. (84), e51149 (2014).
- Thorn, C. F., et al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics. 21 (7), 440-446 (2011).
- Ernst, O., Zor, T. Linearization of the bradford protein assay. J Vis Exp. (38), (2010).
- Taira, N., Yoshida, K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets. Histol Histopathol. 27 (4), 437-443 (2012).
- Thompson, T., et al. Phosphorylation of p53 on key serines is dispensable for transcriptional activation and apoptosis. J Biol Chem. 279 (51), 53015-53022 (2004).
- Currier, J. M., Cheng, W. Y., Menendez, D., Conolly, R., Chorley, B. N. Developing a Gene Biomarker at the Tipping Point of Adaptive and Adverse Responses in Human Bronchial Epithelial Cells. PLoS One. 11 (5), e0155875 (2016).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Shintani, H. . Handbook of Capillary Electrophoresis Applications. , (1997).
- . Wes reagents and consumables :: ProteinSimple Available from: https://www.proteinsimple.com/consumables_sw_wes.html (2017)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved