A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בשנת Vivo הערכה של תכונות מכניות ו Viscoelastic של לשון עכברוש
In This Article
Summary
אנו מתארים הליך כירורגי במודל עכברוש הרדים לקביעת טונוס השרירים ותכונות הלכלוך של הלשון. ההליך כרוך גירוי ספציפי של עצבים hypoglossal ויישום של כוח פסיבי Lissajous / עיוות עיוות לשריר.
Abstract
הלשון היא הידרוסטט שריר מאוד ו vascularized על הרצפה של הפה של רוב החולייתנים. הפונקציות העיקריות שלה כוללות תמיכה בעיסוי ו deglutition, כמו גם חישה טעם פונטיקה. לפיכך, עוצמת ונפח הלשון יכול להשפיע על היכולת של חוליות לבצע פעילויות בסיסיות כגון האכלה, תקשורת, נשימה. לחולים אנושיים עם דום נשימה בשינה מוגדלות לשונות מוגדלות, המאופיינות בטון שריר מופחת ובשומן שריר מוגבר שניתן לדמיין ולכמת באמצעות הדמיית תהודה מגנטית (MRI). היכולות למדוד את ייצור הכוח ואת המאפיינים viscoelastic של הלשון מהווים כלים חשובים להשגת מידע פונקציונלי כדי להתאים עם נתוני הדמיה. כאן, אנו מציגים טכניקות למדידת ייצור כוח הלשון חולדות צוקר הרדים באמצעות גירוי חשמלי של עצבים hypoglossal ולקביעת המאפיינים viscoelastic oF הלשון על ידי הפעלת כוח Lissajous פסיבית / עקומות דפורמציה.
Introduction
הלשון מספקת תמיכה חיונית לעיסוי, deglutition, חישה טעם ודיבור. נוכחותם של שרירים חיצוניים וחיצוניים, עם העצבנות והאנטומיה / הפונקציה, מייחסת את ייחודה של ההידרוסטט השרירי. ההתקדמות האחרונה בטכניקות הדמיה סיפקו תצוגה מפורטת יותר של האנטומיה המורכבת שלה 1 . ירידה בפונקציונליות הלשון, באטרופיה של הלשון, בדיספגיה ובמניעת דיבור הם גם ביטויים נפוצים של מצבים מיופתיים כמו פרקינסון 2 , טרשת נפוצה (ALS) 3 , Myotonic Dystrophy (MD) 4 ו מיופתים אחרים.
שינויים בהרכב השרירים הקשורים למצבים נפוצים המחלה משפיעים על תכונות מכניות ו viscoelastic של הלשון. לדוגמה, ניתוח פונקציונלי של כוח הלשון חשף שינויים במאפיינים התכווצות הקשורים ההזדקנותSs = "xref"> 5 , 6 , היפוקסיה 7 , 8 והשמנה 9 , 10 . במקרה של ניוון שרירים, פיברוזיס מוגבר מוביל נוקשות שרירים גבוהה יותר, אשר מתרגמת ציות נמוך יותר לעיוות כאשר פרוטוקול עיוות Lissajous מוחל 11 . לעומת זאת, שינויים בתוכן השומן בשומן, כמו אלה המתועדים בחולים שמנים, משנים הן את התכונות המטבוליות והן את התכונות המכניות של שרירי השלד 13 , 14 והם צפויים להגביר את תאימות השרירים לעיוות. שומן הלשון מוגברת גם בקורלציה עם התפתחות של דום נשימה בשינה חסימתית (OSA) בבני אדם 17 על ידי הגדלת נפח הלשון עד לנקודה חלקית חלקית חסימת דרכי הנשימה (apnea) 15 , 16 . סיםבבני אדם, חדירת שומן הלשון תועדה בחולדות זאקס שמנים 10 , מה שמרמז כי מודל זה הוא כלי רב ערך לחקר ההשפעות של חדירת שומן על פיזיולוגיה הלשון.
מדידת כוח הלשון דורשת טכניקות ניתוחיות עדינות לבידוד וגירוי בילטרלי של העצבים ההיפוגלוסיים 17 , 18 . טכניקות כאלה תוארו בעבר בחולדות 5 , 17 , 19 , 20 , ארנבות 21 ובני אדם 22 , 23 , אך עם עזרי ראייה מוגבלים לחוקר. בשל אופי טכני מאוד, את הזמינות של פרוטוקול מפורט היה לשפר באופן משמעותי את הנגישות ואת reproducibility של טכניקה זו. מטרת הפרדיגמה הניסויית שלנו היא חולהלאמוד טכניקה תקפה ואמינה למדידת כוח ו viscoelastic המאפיינים של הלשון במודל חולדה. כדי להשיג זאת, החולדה הוא הרדים, עצבים hypoglossal נחשפים קנה הנשימה הוא cannulated כדי להבטיח גישה חופשית לשון של בעל החיים. לולאה תפר מכן מחבר את קצה הלשון כדי מתמר כוח, מסוגל לשלוט הן כוח ואורך, בעוד שתי אלקטרודות דו קוטבית לעורר את עצבי hypoglossal כדי לגרום התכווצות של הלשון. לאחר השלמת מדידת הכוח, יכולות השליטה באורך של מתמר הכוח משמשות לשינוי מהיר של אורך הלשון, בהתאם לפרוטוקול סינוס גל עם משרעת קבועה (עקומות ליסאג '), משך ותדירות, המאפשרים לגזור את תכונות viscoelastic 11 , 24 . הפרוטוקול ידריך את החוקר דרך הצעדים לנתיחה, המיקום של החיה על platfo ניסיוניRm, המיקום של אלקטרודות, ולבסוף לרכישה וניתוח של כוח נתונים viscoelasticity.
Protocol
כל הנהלים כולל בעלי חיים אושרו על ידי טיפול בבעלי חיים מוסדיים ועדת שימוש (IACUC) של אוניברסיטת פנסילבניה (פרוטוקול מספר 805822). הנוהל המתואר הוא מסוף ואינו דורש ניצול של תנאים aseptic או מוצרים כיתה התרופות.
1. ניתוחים כירורגיים
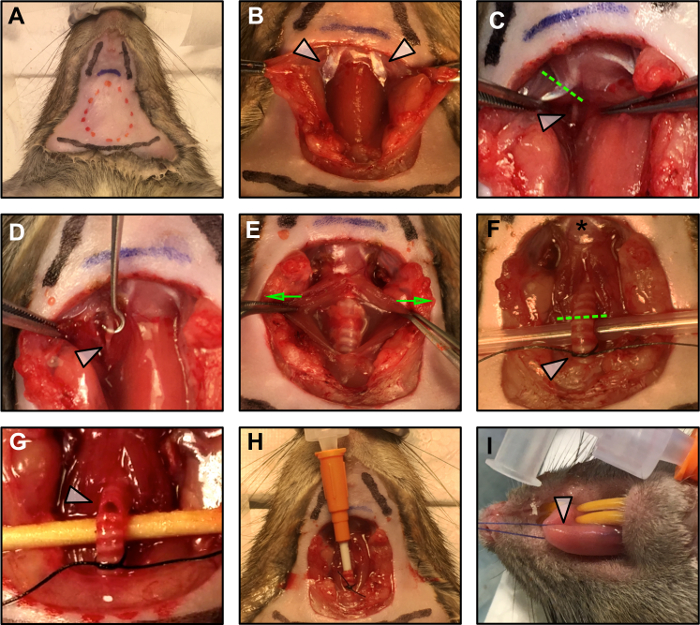
איור 1: ניתוחים כירורגיים.
(א) ניתוח תוכנית כירורגית. הקו המקווקו האדום מציין את שטח החתך. שני קווים שחורים מציינים את מיקום הלסת, ואילו השורה התחתונה התחתונה מסמלת את מיקום בית החזה. הקו הכחול מציין את עצם העצם. (ב) חשיפה של הבטן האחורית של שריר digastric (חצים) לאחר דיסקציה קהה של רקמת השומן, sublingual ו subaxill בלוטות. (ג) כריתה של בטן אחורית של שריר digastric (קו ירוק מקווקו) לחשוף את עצב hypoglossal (חץ לבן). (ד) עצב hypoglossal (חץ לבן) הוא ניקה מן fascia שמסביב. (E) קנה הנשימה חשוף על ידי משיכה בעדינות את השריר החלק סביב זה (החצים הירוקים מצביעים על כיוון הכוח המופעל), והרים (F) להתכונן לאינטובציה. הכוכב מציין את החדרת הלשון לעצם היידואידית. הקו המקווקו הירוק מסמן את נקודת החתך עבור האינטובציה. החץ הלבן מציין את הקשר הרופף מוכן לאבטח את הצינורית במקום לאחר הכנסתו. (G) חתך של קנה הנשימה עבור cannulation. (H) צינורית קנה הנשימה מוכנס ומאובטח במקום עם קשר מרובע. (I) יישום של תפר על הלשון.יעד = "_ ריק"> אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
- הרדמה והכנה לניתוח
- מניחים את החולדה בחדר אינדוקציה עם הרדמה isoflurane 4%.
- הנח את החיה על פני מקור חום ולשמור על הרדמה עם isoflurane 1 - 3% מן nosecone, הבטחת קצב הנשימה של לפחות 70 נשימות לדקה.
- לגלח את אזור הצוואר עם קצוץ אוויר קרם להסרת שיער. בעת שימוש קרם להסרת שיער, להפיץ את השמנת עם המוליך כותנה tipped עד פרווה מוסר. חשיפה ממושכת להסרת שיער יכולה לגרום לגירוי של העור.
- לנקות את שדה כירורגיה עם אלכוהול 70% ( איור 1 א ).
- בדוק את דפוס הנשימה של החיה ואת הרפלקסים (חוסר רפלקס קמצוץ הבוהן) לפני שתמשיך עם החתך הראשוני. ניטור רציף והערכה של עומק ההרדמה הוא חיוני (reקצב הנשימה של הכבד וחוסר רפלקסים כל 10 דקות); החיה צריכה להיות מתחת למישור עמוק, כירורגי של הרדמה במהלך ההליך כולו.
- Hypoglossal עצבים זיהוי
- פתח את שדה הניתוח עם זוג מספריים ההפעלה על ידי הסרת וסילוק העור כפי שצוין על ידי הקו מנוקד אדום בתרשים 1A .
- Blunt לנתח דרך כל רקמת השומן, בלוטות sublingual ו subksillary ואת שכבת השרירים סביב קנה הנשימה.
הערה: להיות שמרני במהלך לנתיחה. השתמש דיסקציה קהה בכל הזדמנות אפשרית להיזהר לא לפגוע בכלי הדם של הצוואר. - לזהות את הבטן האחורית של שריר digastric (PD) לרוחב קנה הנשימה ( איור 1B - חצים לבנים). עצב hypoglossal פועל מתחת לשריר זה ( איור 1C - חץ לבן). עם electrocautery, לכרות את prox PDImal לעצם היידית ( איור 1C - קו מקווקו).
הערה: אל תתנו העצב או הרקמה סביבו להתייבש. הוסף טיפה של שמן מינרלי על העצב כדי להגן על זה. כדי למנוע התכווצות שרירים עקב התפשטות השדה של הגירוי מן האלקטרודות, בזהירות לצרוב את רקמת השריר באתרי קשר אפשרי סביב העצב. - בעזרת זוג מלקחיים בסדר, לנתח את עצב hypoglossal מן fascia שמסביב. בעזרת וו, לוודא כי לפחות 3 מ"מ של העצב זמינים עבור החיבור של האלקטרודה דו קוטבית ( איור 1D ).
- באמצעות מלקחיים המוסטית מיקרו, לרסק את עצב hypoglossal כמו distally מן העצם היידית ( איור 1D - חץ לבן) ככל האפשר, כדי למנוע התפשטות מדרדר של הגירוי. למחוץ את העצב על ידי הפעלת לחץ על זה עם מלקחיים מיקרו המוסטטי עבור 5 s. כאשר המוסטאט תופסת את העצב, קצרההמכשפה בבסיס הלשון צריכה להיות גלויה.
- חזור על הנוהל עבור הצד השני.
- אינטובציה של קנה הנשימה
- לחשוף את קנה הנשימה על ידי הפרדה בעדינות את השרירים החלקים שמסביב על ידי דיסקציה קהה ( איור 1E - כפי שצוין על ידי החצים הירוקים).
הערה: להיות שמרני ולהשתמש דיסקציה בוטה עדיף. השווה את קוטר הצינור עם קנה הנשימה. הקנולה צריכה להתאים כראוי קנה הנשימה צריך להישאר יציב ביציבות לאחר sutured כמתואר בשלבים 1.3.2 עד 1.3.5. - בעדינות להרים את קנה הנשימה באמצעות זוג מלקחיים קשירה תפר ולהעביר תפר 4-0 מתחתיו, קרוב לבית החזה. לקשור קשר ראשוני רופף בין 6 ו טבעת 7 מן הגרון ( איור 1F - חץ לבן). קשר זה ייסגר לאחר הכנסת הצינור על מנת להחזיק אותו במקומו.
- החלק את גזע aהעברת פיפטה (סיכה פיפטה עם שמן מינרלי כדי להקל על ההכנסה) תחת קנה הנשימה להרים אותו להקל על הכניסה של צינורית (IV 14 ג 'ק 3.25 "צינורית).
- חותכים חתך קטן בין הטבעות 4 ו 5 מן הגרון ( איור 1G - חץ לבן). לאחר החתך הראשון, הפתיחה נוטה להתפשט, ולכן להיות שמרנית בעת ביצוע חיתוך ראשוני על מנת למנוע כריתה מלאה של קנה הנשימה.
הערה: לפני ביצוע החתך של קנה הנשימה, ודא את הצינורית מוכנה משלוח ההרדמה מופעלת. - התחל את הממשל הרדמה באמצעות צינורית ולהכניס אותו בעדינות לתוך החתך, התקדמות בעדינות בתוך קנה הנשימה באורך של כ 5 טבעות. מאובטח את הצינורית במקום עם תפר, כדי ליצור אטום אטום ( איור 1H ).
הערה: ודא כי לא נוזל נכנס קנה הנשימה nicked כדי למנוע סוב. לאחר קנה הנשימה הוא חרות, בעל החיים יהיה אוויר אוויר. לכן חשוב להכניס במהירות את צינורית כך נשמרת ההרדמה נשמרת. כאשר / אם מזיזים את החיה, לפקח על המיקום הנכון של צינורית קנה הנשימה. - להסיר בעדינות את החיה מן nosecone.
הערה: השימוש בהרדמה בהזרקה במקום isoflurane עשוי לפשט את ההליך על ידי ביטול הצורך אינטובציה קנה הנשימה וניקוי סביבת העבודה הניסוי מ צינורות עודף.
- לחשוף את קנה הנשימה על ידי הפרדה בעדינות את השרירים החלקים שמסביב על ידי דיסקציה קהה ( איור 1E - כפי שצוין על ידי החצים הירוקים).
- הלשון תפירה
- משרים חתיכת 20 ס"מ ארוך של תפר 5/0 (אנו מציעים משי, שחור קלוע) ב PBS.
- בעוד מחזיק את הפה של העכברוש פתוח, בעדינות להחזיק את קצה הלשון עם מלקחיים קשירה תפר.
- להעביר את תפר מדי פעם דרך קצה הלשון ( איור 1I - חץ לבן) לשים לב לשמור על הלשון לחות עם מלוחים, כדי למנוע רקמה פוטנציאליתנֵזֶק.
- לקשור לולאה כ 4 ס"מ רוחב (הקוטר יכול להשתנות על בסיס המרחק בין החיה לבין מתמר כוח).
הערה: ודא התפר ואת הלשון רטובים כדי להקל על ההכנסה ולמנוע נגעים מיותרים של הרקמה.
2. הגדרת הניסוי
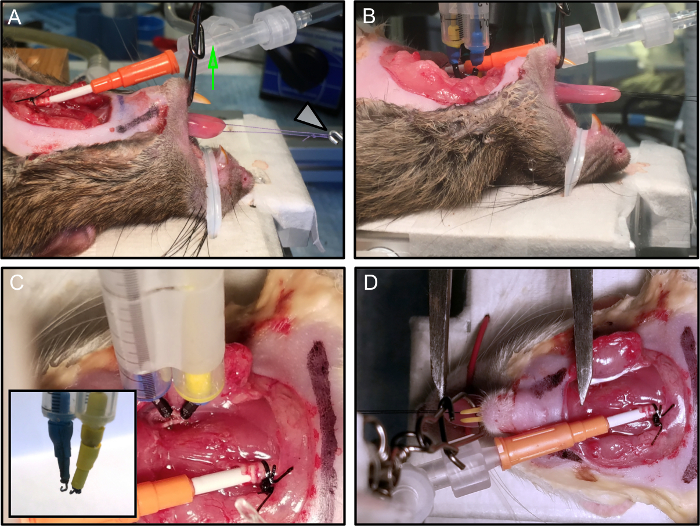
איור 2: מיקום ואבטחת החיה.
(א) העכבר ממוקם על פלטפורמת הניסוי. הלסת מאובטחת והפה נשאר פתוח על ידי יישום המתח האנכי (החץ הירוק). לולאה תפר מחובר מתמר כוח (חץ לבן). (ב) האלקטרודות מחוברות. (ג) כל אלקטרודה, רכוב על micromanipulator, מחובר ביציבות עצב. הבלאי מראה סיום של tהוא אלקטרודה וו. (ד) אורך אופטימלי של הלשון נמדדת עם קליפר ורניה, מן ההכנסה ברמה של עצם היידוד עד קצה הלשון. בתמונה זו, האלקטרודות הוסרו לבהירות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
הערה: הצב את חזית החיה על המגש המחומם של המנגנון, תוך שימוש באמצעי האבטחה הבאים כדי למנוע תנועה במהלך הניסוי.
- לאבטח את האף של החולדה על המגש עם מתכת מצופה מתכת טוויסט עניבה מחובר ישירות פלטפורמה מחוממת ( איור 2 א , 2 ב ).
- לשמור על הפה של חולדה נפתחה על ידי הפעלת מתח אנכי (השתמש 3-מסתובב בדרך קשורה ל 9 ק"ג קו monofilament הבדיקה והחזק במקום עם מקל המצלמה) ( איור 2 א - החץ הירוק).
הערה: גישה חלופית לייצוב החולדה משתמשת במכרסם בפה מכרסם או שינוי מותאם אישית של זה. זה חיוני כי הפה נשמר פתוח ויציב, כדי למנוע תנועות של הצוואר אשר יכול להשפיע על איכות המדידות. - חבר את הלולאה תפר כדי מתמר כוח ( איור 2 א - חץ לבן).
- באמצעות קלטת כירורגית, לשתק את הגפיים ואת הבטן של החולדה להגביל את תנועות במהלך גירויים.
- החל את שני אלקטרודות דו קוטבית מגרה את הומוסקסואלים לעצב hypoglossal גזור, proximally לאתר למחוץ ( איור 2 ג ).
- השתמש גירוי אלקטרודות דו קוטבית מותאמת אישית מתוך זוג פלדה כיתה כיתה 29 אלקטרודות מחט מד, המוחזקים יחד במרחק של 2 מ"מ אחד מהשני באמצעות תמיכה פלסטיק (כאן, השתמשנו שני 1-מ"ל פיפטות serological מודבק יחד).
- לכופף את הקצות של אלקטרודות המחט לצורה ווקטן מספיק כדי ליצור קשר יציב עם העצב (~ 1 מ"מ קוטר) ( איור 2C - שיבוץ).
- חבר את שני החוטים של כל אלקטרודה כדי לכתוב ערימה כפולה stackable עם שקע בננה x שקע BNC, ולאחר מכן להתחבר מודול ממריץ של מערכת בדיקה שריר באתרו (טבלה 3) באמצעות מפצל BNC.
הערה: ודא החיה היא יציבה וכי הצוואר והלשון מיושרים מנוף כוח הכוח. המשך לעקוב אחר קצב הנשימה ולוודא שהכבלים אינם מפריעים לנשימה.
3. אורך אופטימלי (L 0 ) ו מקסימלי איזומטרי קביעת כוח
- להתאים את אורך הלשון בהדרגה וליישם גירויים עיוות איזומטרי עד כוח מקסימלי מתקבל.
- הגדרת L 0 כאורך שבו כוח איטומטרי עווית ( טבלה 1 ) הוא מקסימלי, ולהקליט על הנורמליזציה שלאחר מכן שלמדידות הכוח, כפי שהוא משתנה עבור כל בעל חיים. באמצעות קליפר ורניה, למדוד את אורך הלשון מן ההכנסה ברמה של עצם היידואי ( איור 2 ד ) עד קצה הלשון.
הערה: המיקום הנכון של האלקטרודות הוא חיוני כדי להבטיח קשר אופטימלי עם העצבים. המיקום האופטימלי צריך להפעיל כוחות דומים ותוספים בעת גירוי אחד משני העצבים או שניהם, בהתאמה.
- הגדרת L 0 כאורך שבו כוח איטומטרי עווית ( טבלה 1 ) הוא מקסימלי, ולהקליט על הנורמליזציה שלאחר מכן שלמדידות הכוח, כפי שהוא משתנה עבור כל בעל חיים. באמצעות קליפר ורניה, למדוד את אורך הלשון מן ההכנסה ברמה של עצם היידואי ( איור 2 ד ) עד קצה הלשון.
- לפני תחילת הניסוי, חבר הן את האלקטרודות כדי ממריץ ולנהל גירוי טטני הבדיקה ( טבלה 1 ). במהלך התכווצות זו, לפקח על החיה כדי להבטיח כי המיקום יציב, ולבדוק התכווצויות גלוי לא רצויות של שרירי הצוואר.
- מדוד כוח איזומטרי על ידי הפעלת עווית בעקבות 20 S על ידי גירוי טטני. חזור על הגירויים 3 פעמים המאפשר 4 דקות התאוששות בין מחזורי גירוי (מחזור כולל מעווית אחת עלE טטניק גירוי), וכן להקליט את העווית המרבי ואת כוחות טטני.
- לשמור על הלשון רטובה בכל עת על ידי החלת כמה טיפות של PBS בין הצירים.
הערה: אם שרירי הצוואר מתכווצים, בזהירות לשנות את המיקום של האלקטרודות, כך שהם לא נוגעים כל רקמת השריר שמסביב, ואם יש צורך, לצרוב את הרקמה במגע עם האלקטרודות.
4. קביעת נכסים Viscoelastic (Curves Lissajous)
- אפשר לשון לנוח במשך 3 - 5 דקות לאחר קביעת כוח איזומטרי. בצע את העקומות Lissajous החל L 0 , ולכן המיקום של החיה של מתמר כוח לא צריך להיות שונה.
- מבלי לעורר את העצבים ההיפוגלוסיים, יש ליישם מחזורים של מתיחות פסיביות ( טבלה 2 ) עם עלייה בתזוזה (ד) כלומר 5, 10, 15, 20, 25, 30, 35, 40, 50% של L 0 (אמפליטודות גבוהות יותר עשויות לדרוש כפולה בקר מצב עם higheR ערכי הטיול מאשר 305C-LR). לדוגמה, משרעת של 40% L 0 תגרום עיוות של הלשון מ + 20% L 0 עד 20% L 0 .
- השתמש בתדר קבוע של סינוס 2 הרץ עם 10 חזרות בכל מחזור, למשך זמן כולל של 5 שניות בכל מחזור. שינויים בתדר הסינוס שימשו בעבר ברקמות כגון דיאפרגמה 24 וניתן לאמץ אותם כדי לשנות את הפרוטוקול הניסויי.
- אפשר 30 s בין כל מחזור להבטיח את הלשון רטובה במהלך ההליך כולו.
הערה: לשמור על הלשון רטוב במהלך ההליך הוספת כמה טיפות של PBS. ודא כי האיפוק מחזיק את הלסת נשאר יציב במקום במהלך מתיחות, במיוחד כאשר העקירה מגיע 40% או גבוה יותר.
- מיד לאחר השלמת הניסוי, בעוד החיה עדיין תחת מטוס כירורגי עמוק של הרדמה, להרדים את החיה על פי החיה המאושרת IACUC בעלי חייםOcol. לנתח את הלשון לעיבוד נוסף ( כלומר חתך קפוא או אחסון עבור ניתוחים ביוכימיים).
תוצאות
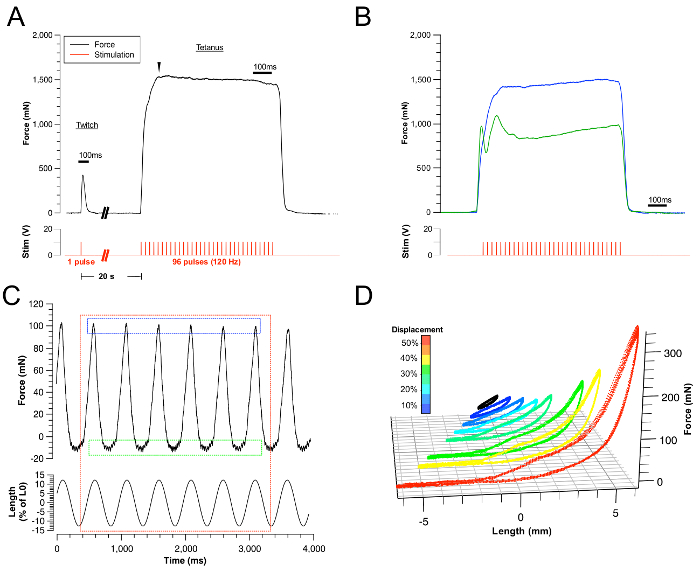
איור 3: תוצאות נציג.
(א) דוגמאות של עווית מוצלחת עקבות כוח טטני. הגירוי המקביל מיוצג על ידי עקבות אדום. (ב) דוגמה של הצלחת הלשון התכווצויות הלשון עקב התכווצות submaximal (סימן כ...
Discussion
שינויים בחילוף החומרים הלשון ו / או הרכב, כגון חדירת שומן הלשון כתוצאה מהשמנת יתר, צפויים לגרום לשינויים הניתנים לכימות של הפרמטרים המוערכים על ידי הפרוטוקול שלנו. הכמות של כוח הלשון היא עניין רב מאז חוסר איזון בין פעילות פולשנית retrusive או הלשון הכללית היחלשות ...
Disclosures
למחברים אין מה לגלות.
Acknowledgements
מחקר זה נתמך על ידי שני מכוני הבריאות הלאומיים: HL089447 ("השמנת יתר ו- OSA: הבנת החשיבות של הלשון בשומן ובמטבולי") ו- HL094307 ("הבנת הקשר בין השמנה לשומן שומן")
Materials
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
References
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved