A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
באמצעות שבב חוש הריח של Microfluidic מותאם עבור ההדמיה של פעילות. עצבית בתגובה פרומונים בנוירונים הראש הגברי C. Elegans
In This Article
Summary
השימוש מותאם "צ'יפ חוש הריח" עבור ההדמיה סידן יעיל של C. elegans זכרים מתואר כאן. מחקרים של חשיפה זכר גליצרול פרומון מוצגים גם.
Abstract
השימוש של סידן אינדיקטורים התעלתה ההבנה שלנו של דינמיקה עצבית ורגולציה. תולעים נימיות Caenorhabditis elegans, עם מערכת העצבים לחלוטין ממופה, אנטומיה שקוף, מציג מודל אידיאלי להבנת הדינמיקה עצבית בזמן אמת באמצעות מחווני סידן. בשילוב עם טכנולוגיות microfluidic עיצובים ניסיוניים, מחקרים סידן-הדמיה באמצעות אינדיקטורים אלה מבוצעות בבעלי חיים חינם-המעבר והן לכוד. עם זאת, רוב המחקרים הקודמים ניצול התקני לכידה, כגון השבב חוש הריח המתוארים Chronis. et al., יש התקנים שנועדו לשימוש ההרמפרודיט נפוץ יותר, כמו הזכר פחות נפוץ הוא שניהם מורפולוגית, מבחינה מבנית שונה. שבב חוש הריח מותאם היה מתוכנן, מפוברק ליעילות מוגברת בתחום ההדמיה עצביים זכר עם באמצעות בעלי חיים למבוגרים צעירים. פנייה סופחה התולעת בטעינת לנמל כדי לסובב את החיות, כדי לאפשר את ההפרדה של הנוירונים בודדים בתוך זוג הדו-צדדיים בתחום ההדמיה 2D. תולעים נחשפים זרימה מבוקרת של odorant בתוך המכשיר microfluidic, כמתואר במחקרים קודמים דו-מיניים. תופעות מעבר סידן ואז ניתוח שימוש בתוכנת קוד פתוח ImageJ. ההליך המתואר במסמך זה אמור לאפשר עבור כמות מוגברת של מבוססי זכר C. elegans סידן הדמיה מחקרים, העמקת ההבנה שלנו על מנגנוני איתות עצביים מין ספציפי.
Introduction
Microfluidic התקני מספקים גישה מוגברת דווקא בסביבות מבוקרות, שבו חיות, כגון תולעים נימיות C. elegans, יכול להיות מרומה השפעול1. מחקרים אלה כוללים מבחני התנהגות, מחקרי הדמיה סידן או הקרנות אפילו על הפנוטיפים ספציפיים, וכתוצאה מכך מדידות מדויקות יותר של תוצאות ניסוי1,2,3,4, 5,6. מיקרופלואידיקה לספק תנאים נוזלי בקנה מידה קטן שדרכו ניסויים מפורטים ניתן להפעיל תוך ניצול כמויות מינימליות של נוגדנים. יש הפקה מתמדת של עיצובים חדשים של המכשיר microfluidic, השימוש של כל משתנה, החל ארנאס המאפשרים טבעי sinusoidal התנועה של C. elegans מבחני התנהגות ולימודים הדמיה עצבית, מלכודת התקנים המשמשים הדמיה עצבית ולימודים חוש הריח, התקנים המאפשרים עבור תפוקה גבוהה פנוטיפי ניתוח גנטי מסכי4,5,6,7. בעקבות ייצור של תבנית בסיס, microfluidic מכשירים זולים לבנות — נתן את שימושית של המאסטר — וקל לשימוש, ומאפשר לדור נתונים מהירה באמצעות מחקרים תפוקה גבוהה. הזיוף של התקנים באמצעות פולימרים כגון polydimethylsiloxane (PDMS) מאפשר היצירה של מכשירים חדשים בתוך שעות.
מחקרי הדמיה סידן להשתמש סידן מקודדים גנטית אינדיקטורים (GECIs) המתבטא התאים היעד כדי למדוד את הדינמיקה עצבית של תאים אלה בזמן אמת8,9,10,11. הטבע שקוף של C. elegans מאפשר ההקלטה של פלורסנט רמות החלבונים האלה בבעלי חיים. באופן מסורתי, GECIs להסתמך על חלבון פלואורסצנטי ירוק (GFP)-מבוסס חיישן ה-GFP-קלמודולין-M13 פפטיד (GCaMP), אך מחקרים מאוחרים יותר הסתגלו חיישנים אלה כדי לאפשר יותר יחס אות לרעש ופרופילים עירור אדום-העביר. בעקבות הפיתוח של GCaMP3, חלבונים עם מפרטים אלה יש מגוונים, כולל חיישנים כגון GCaMP6s ו- GCaMP6f (לאט ומהר פלורסצנטיות חופש-המחירים, בהתאמה), כמו גם RFP-קלמודולין-M13 פפטיד (RCaMP), אשר יש אדום-העביר הפעלת פרופיל. השילוב של אלה GECIs עם C. elegans גנים ספציפיים תא יזם רצפי ניתן לייעד תאים עניין, במיוחד החישה הניריונים12,13,14,15 , 16.
בעוד קלות השימוש C. elegans במחקרים microfluidic הוא לכאורה, כמעט כל המחקרים התמקדו אנדרוגינוסים. למרות זכרים בלבד החשבונאי 0.01-0.02% מהאוכלוסייה פראי סוג, ממצאים שלא יסולא בפז יכול לנבוע האפיון שלהם. ואילו connectome הפיזי של מערכת העצבים אנדרוגינוס מופה באופן מלא במשך עשרות שנים17, connectome זכר נשאר שלם, במיוחד באזור הראש של בעלי חיים18. השימוש של סידן הדמיה של הזכרים יסייע ליצירת הבנה של מערכת העצבים זכר וההבדלים שעולות בין שני המינים. גודל קטן יותר מהזכרים הבוגרים C. elegans מונעת השמנה יעיל ואמין בנמלי טעינת התקנים חוש הריח מסורתי המיועד אנדרוגינוסים גדול יותר. כדי לטפל בבעיה זו, יש את הגירסה שבב חוש הריח Chronis19 פותחה עם יציאת הטעינה צר יותר, ערוץ בגובה נמוך, והופך בנמל הטעינה תולעת (אשר לסובב את החיה), המאפשר החזיית הדו-צדדיים שמאלה/ימינה זוגות עצביים. עיצוב זה מאפשר: (1) השמנה יעיל של זכרים בוגרים צעירים, (2) כיוון יותר אמין של החיה עבור הפריט החזותי של שני בני נוירונים לזווג דו צדדיים, (3) הדמיה מדויקת של פעילות עצבית בנוירונים זכר.
יותר ויותר מחקרים מראים כי גברים C. elegans להגיב באופן שונה מאשר אנדרוגינוסים למגוון רחב של ascarosides (ascr), או תולעים נימיות פרומונים20,21,22,23 ,24. לכן, לפתח הבנה של דינמיקה עצבית, ייצוגים בתוך connectome זכר הפך אפילו יותר רלוונטי. זכר C. elegans מכיל נוירונים ספציפיים סקס 87 לא נוכח אנדרוגינוס25,26, לשנות את connectome כדרכים שטרם נקבע. היכולת תמונה הדינמיקות האלה עצביות ייחודיות יאפשר לנו להבין טוב יותר את תגובות ספציפיות סקס וייצוגי עצבית.
פרוטוקול זה מתאר את השימוש שבב חוש הריח זכר הותאם עבור ההדמיה עצבית של זכר C. elegans chemosensation. הנוירון nociceptive שאש מגיב בצורה אמינה גליצרול 1 מ' אצל הזכרים, בקנה אחד עם הקודם אנדרוגיניות מחקרים27. חשיפה ascarosides עשוי להפיק תגובות כי הם משתנה חיה כדי חיה, הדורשות מספר גדול יותר של בעלי חיים כדי להיבדק. התגובה של הנוירונים צ'ם זכר הספציפי שהוצג בעבר, דרך אלקטרופיזיולוגיה וגם סידן הדמיה מחקרים, להגיב variably ascaroside #323.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. ייצור המכשיר
הערה: ראה הפניה 1.
הערה: תבניות בסיס סיליקון זוייפו. שימוש בטכניקות photolithographic רגיל עבור תכנים SU-8 photoresist על בסיס 1 , סיליקון 7. Photomasks עבור המתבנת וופל הודפסו ב 25,000 dpi. התכונות המכשיר הותאם זכר שבב חוש הריח Chronis עיצוב 19 עם שינוי התולעת בטעינת לנמל, בהתאמת עיצוב המתקבל מ צימר (מכתבים אישיים, 2016). פנייה נכלל כדי לקבוע את זווית הסיבוב של בעלי החיים. הרוחב של התולעת בטעינת ערוץ היציאה הוא הצטמצם ל 50 μm. כל הערוצים הם בגובה 32 μm. לאחר תבנית בסיס סיליקון לרשות המשתמש, המשתמש יכול לבצע עוקבות פרוטוקול, כפי שתואר לעיל 1.
- PDMS תערובת הבסיס, ריפוי סוכן ביחס של 10:1 לפי משקל.
- לערבב ביסודיות עם העברת פיפטות.
- דגה את התערובת ב desiccator ואקום לשעה עד כל הבועות גלוי יוסרו.
- יוצקים את התערובת על תבנית סיליקון מאסטר צלחת בקוטר 150 מ מ עד 5 מ מ עבה (100 גרם). השתמש פיפטה פסטר כדי להסיר את כל הבועות או אבק הוכנסו לתערובת.
- אופים ב- 65 מעלות צלזיוס לפחות 3 שעות או לילה.
- לחתוך את PDMS מן כייר באמצעות אזמל. ולחתוך את התקנים נפרדים בנפרד באמצעות סכין גילוח.
- חורים כניסת ולשקע עם אגרוף עורי 1 מ מ.
- לרוקן את החורים עם dH 2 O, אתנול, ואני שוב ב- dH 2 O כדי להסיר חלקיקים העקיצות. לייבש את המכשיר בדופק זרם האוויר.
- נקי ערוץ הצדדים והן את הצד העליון של המכשיר עם דבק, הסרת אבק או פסולת הנותרת על המכשיר כדי לאפשר מליטה מוצלח.
- פלזמה-בונד המכשיר, ערוץ-בצד למטה, לכוס שער מס ' 1-
- וחושפים כיסוי זכוכית, התקן (ערוץ מקצה לקצה) כדי פלזמה אוויר באמצעות תנאים המאפשרים התקשרות נכונה, כגון 100 W עבור 30 s או 24 W עבור 60 ס
הערה: ניתן לכוונן הגדרות כדי לשפר את היעילות מליטה. פלזמה-מליטה התנאים לא קריטי כמו ניקוי נאות כאשר מנסים לשפר את יעילות מליטה. מכשיר נקי דיו לא יתבסס, אפילו בתנאים אידיאליים פלזמה. - היפוך הזכוכית המכסה לצד ערוץ של ההתקן, לחץ למטה על האגודל עבור 5 ס
- וחושפים כיסוי זכוכית, התקן (ערוץ מקצה לקצה) כדי פלזמה אוויר באמצעות תנאים המאפשרים התקשרות נכונה, כגון 100 W עבור 30 s או 24 W עבור 60 ס
2. מאגר הכנה
- Dilute 1 x S התאים הבזליים (100 מ מ NaCl ו- 0.05 M KPO 4, pH 6.0) של מניה x 10 סטרילי.
- לדלל 1 מ' מניות tetramisole ריכוז סופי של 1 מ מ ב 1 x S בזאלי עבור כל מאגר פתרונות.
- להוסיף שתי fluorescein " בקרת זרימה ", " מאגר " מאגרי.
- ליצור מלאי 100-מ"ג/מ"ל של fluorescein 1 x S הבזליים.
- לדלל את המניה ריכוזי הסופי של µg/mL 1 בבקרת הזרימה, 0.1 µg/mL במאגר.
- ליצור הגירויים.
- גליצרול שתדללו כדי ריכוז סופי של 1 מ' 1 X S הבזליים.
- Ascaroside שתדללו #3 (ascr #3) כדי ריכוז סופי של מיקרומטר 1 1 X S הבזליים.
3. התקנת מכשיר
הערה: ראו 1.

איור 1. הגדרת התקן Microfluidic. (א) מאגרי מים, אבובים. 30 מ ל מזרק ללא בוכנה משמש " אשמורת. " זה מצורף שסתום זכוכית עם שלוש אפשרויות זרימה. שקע אחד מחובר מזרק 3 מ עם פומפה, בעוד השני מחובר מחט (כתום) המוחדר לאורך צינור שמחבר ההתקן microfluidic. כיוונון (B) הכולל microfluidic הדמיה הניסוי. המכשיר מושם על שלב של מיקרוסקופ epifluorescence הפוכה, מעל העדשות אובייקטיבי. " בקרת זרימה " מאגר נוסע דרך שסתום 3-דרך אשר נשלטת על ידי יחידת על המדף מעל ההתקנה. שורות המכילות מאגרי מוכנסים ואז יציאות ההתקן המתאים. (ג) היציאות של המכשיר microfluidic. " בקרת זרימה " יציאות לאגף את היציאות כניסת אחרים: " גירוי ", " מאגר " יציאות. " שקע " פורט הוא הנמל הימני ביותר. בשל המיקום של הזירה הטעינה תולעת, " תולעת טעינת " פורט הוא הנמל המרכזי ביותר על המכשיר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- הכן שלושת מאגרי נוזלים על ידי הצמדת מזרק 30 או 60 מ ל 3-דרך שסתום סכינים סטריליים, עם מזרק 3 מ"ל ואת המחט מחוברת לשסתום סכינים סטריליים גם כן (כמו איור 1 א'). להתחבר המחט אבובים המשתרע על המכשיר microfluidic (כמו איור 1A -B).
- להסיר את בועות האוויר מן המאגר אבובים.
- למלא את המזרק 3 מ עם אבובים המצורפת עם 1 x S בזאלי והוספתו לתוך השקע עם מסמרים
- בעדינות אל תפעילו לחץ על המזרק עד המאגר יופיע בחלק העליון של החורים כניסת.
- להתחבר בקרת זרימה, מאגר, אבובים הגירוי המתאים כניסת חורים (כמו איור 1B -C), המבטיח טיפות נוזל נמצאים שני הנמל טעינה חור ואת הצנרת מאגר להיקשר.
- שוב, בעדינות אל תפעילו לחץ על המזרק מחובר ליציאת ה-outlet עד טיפות מופיעים התולעת טעינת כניסת יציאת.
- להוסיף סיכה מוצק חסימה לתוך התולעת טעינה עם מסמרים
- להסיר את המזרק מיציאת ה-outlet ולצרף קו שקע מחובר אבק הבית (-670 טנדר של גוה של).
- בדוק המכשיר עבור בועות בזרם ערוצי, מבחינה ויזואלית, באמצעות אישור וידאו דרך תוכנה תואמת המצלמה בשימוש, כגון תוכנת קוד פתוח מיקרו-מאנגר. ראה שלב 6 לקבלת עצות אודות השימוש מיקרו-מנהל.
- אם כל הבועות קיימות, לחכות להם או להיספג לתוך PDMS קיר לפני טעינת כל חיות; הנוכחות של בועות יפריע את הזרימה הנכונה של נוזלים דרך המכשיר.
- באמצעות מסנן ה-GFP, לאשר זרימה נאותה הדינמיקה בתוך המכשיר לפני תולעת טעינה על-ידי הגורמים השסתום 3-דרך התבוננות את המעבר של מאגרי.
- לקבוע הדינמיקה זרימה נאותה: לבחון את fluorescein נוכח זרימת בקרה, מאגר הפתרונות ( איור דו-ממדי -2E) שינוי כאשר הערך בקרת זרימה משתנה על ידי לחיצה על הפקד הלחצן המתאים השסתום אסידו על הקישור שסתום ( איור 1B).
- לאחר פתיחת מיקרו-מנהל, לחץ על " Live " להתבונן תמונה חיה של המכשיר. הפעל את מקור האור פלואורסצנט לצפות את הזרימה של מאגרי במכשיר ( איור דו-ממדי -2E).
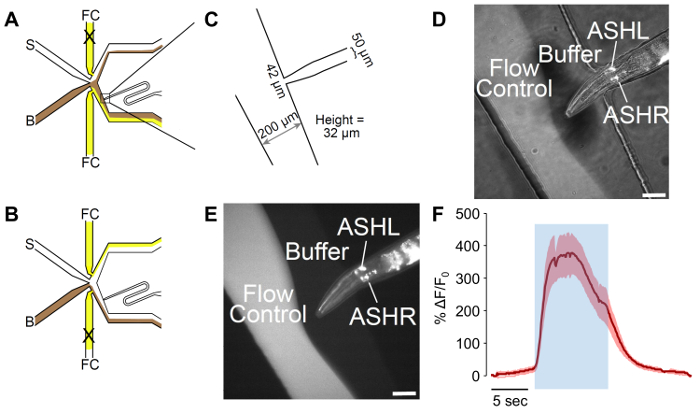
איור 2: זכר-הותאם microfluidic חוש הריח שבב. (א) זרימת דפוסים של המכשיר כאשר התולעת נחשף למאגר. מאגר (B) מוצג בראון, בקרת זרימה (FC) מוצג צהוב, עם גירוי (S) בלבן. התולעת בטעינת לנמל הותאם לכלול העקומה, המאפשר שליטה טובה יותר של תולעת התמצאות. תבניות (ב') הזרימה של המכשיר כאשר התולעת חשוף לגירוי. מאגר (B) מוצג בראון, בקרת זרימה (FC) מוצג צהוב, עם גירוי (S) בלבן. (ג) מדידות של המכשיר מותאם כמו מפוברק. התולעת טעינת נמל מסתיים מיקרומטר 42 פתיחה, עם ערוץ 50 מיקרומטר תוכנן עבור רוחב זכר. הגובה נמדד של הערוצים הוא 32 מיקרומטר, למרות יעד של 25 מיקרומטר בעיצוב. (D-E) A לכוד זכר p לביטוי ההזמנות-6:: GCaMP3. יזם ההזמנות-6 הוא לא ספציפי אפר, ביטוי מסוימים עלולים להיות שנצפו בתוך הנוירון אסי, למרות אין תופעות מעבר הסידן נצפתה אסי. התמונה היא (D) שילוב של תאורה בהירים-שדה, פלורסנט, בעוד (E) הוא פלורסנט בלבד. פסי סולם מציינות 42 מיקרומטר. (F) לאש נוירון מגיב 1 מ' גליצרול גירוי עם פעילות עצבית חזקה. האזור הכחול מסמל את הזמן של הגירוי גליצרול 1 מ'. אזור מוצל מציין השגיאה הסטנדרטית, עם n = 20 פולסים של שבע תולעים. עקבות אדומות מציינות תגובות depolarizing. Y-axes הצג ΔF/F 0. סרגל קנה מידה מציין 5 ס אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
4. הכנת החיה
הערה: ראה הפניה 23.
- אש הדמיה התגובות 1 מ' גליצרול.
- מקום כ 20 C. elegans זכרים הם חיוביים עבור p ההזמנות-6:: GCaMP3 ביטוי מערך על צלחת אגר צמיחה נמטודות (NGM) בינוני נזרע עם מדשאה של OP50 e. coli. להשתמש את הביטוי של פלורסנט GECI ו/או שותף הזרקת סמן לצורך זיהוי חיובי מערך חיות.
הערה: בעלי חיים חיובית מערך לזרוח על פי GECI פעם (קרי, חיות לבטא GCaMP לזרוח ירוק תחת גירוי אור כחול, בעוד RCaMP חיות לזרוח אדום תחת גירוי אור ירוק). סמני הזרקת משותף שיכול לנוע בין חלבונים פלורסנט אחרים, כגון ה-GFP, RFP, סמנים פנוטיפי, כגון rol-6, או יכול להציל פנוטיפ דומיננטי, כמו מוטציה פא-1 28.- אם בוחר מייד לפני וזמינותו, פיק זכרים בוגרים צעירים. אם בוחרים ביום שלפני וזמינותו, לאסוף זכרים זחל L4.
- מקום כ 20 C. elegans זכרים הם חיוביים עבור p ההזמנות-6:: GCaMP3 ביטוי מערך על צלחת אגר צמיחה נמטודות (NGM) בינוני נזרע עם מדשאה של OP50 e. coli. להשתמש את הביטוי של פלורסנט GECI ו/או שותף הזרקת סמן לצורך זיהוי חיובי מערך חיות.
- הדמיה צ'ם התגובות 1 מיקרומטר ascr #3-
- פיק כ-20 L4 C. elegans זכרים (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; פא-1 (e2123ts); לו-5 (e1490); לייט-1 (ce314)) כי הם חיוביים dsRed שיתוף הזרקת סמן ביטוי.
הערה: הביטוי dsRed בתוך הנוירונים ריי של הסיפור הגברי הוא קל יותר להתבונן, לאשר מאשר GCaMP ביטוי בתוך הנוירונים צ'ם ארבע. - לבודד אלה גברים הרמפרודיטים על צלחת אגר NGM נזרע עם מדשאה של OP50 e. coli עבור h 5-14 לפני ביצוע הניסוי הדמיה-
הערה: זכרים לא מבודדים למשך תקופה מינימלית של 5 שעות אינם מגיבים בהתנהגותו ascr #3, ולכן ייתכן שיישומים אפילו פחות שנחשולי סידן כדי ascaroside ממה שרואים כאן.
- פיק כ-20 L4 C. elegans זכרים (fkEx98 [p pkd-2::GCaMP::SL2::dsRED + pBX-1]; פא-1 (e2123ts); לו-5 (e1490); לייט-1 (ce314)) כי הם חיוביים dsRed שיתוף הזרקת סמן ביטוי.
5. טעינת בעלי חיים
הערה: ראו refefence 1-
- לבחור תולעת אחת על גבי צלחת אגר NGM unseeded בטכניקות תחזוקה תולעת רגיל.
- פיק תולעים על ידי שלהוב מעדר (עשוי תיל פלטינה שעברו שיטוח), אוסף חיידקים על האיסוף, ו " שמרחתי " תולעת לאסוף אותו. הנח בעדינות את התולעת על צלחת חדשה, ולאפשר לו לזחול מחוץ בכוחות עצמו.
- להוסיף כ- 5 מ ל 1 x S בזאלי לבסיס unseeded, כך צלחת מוצף.
- לצייר את התולעת לתוך מזרק טעינה (קרי, מזרק 3 מ עם אבובים המצורפת) כי כבר שמולאו מראש עם 1 x S הבזליים.
- להיות בטוח למצוץ את התולעת רק אל הצנרת, לא כל הדרך לתוך המזרק.
הערה: אם התולעת נוסע לתוך המזרק, לא ניתן כמעט להחזיר אותו לתוך הצנרור.
- להיות בטוח למצוץ את התולעת רק אל הצנרת, לא כל הדרך לתוך המזרק.
- לבטל את שואב האבק לעצור את הרצף על-ידי הפעלת את השסתום סכינים סטריליים outlet-
- להסיר את ה-pin מוצק חוסם את התולעת טעינה עם מסמרים
- . סובב את השסתום סכינים סטריליים מחובר ליציאת אאוטלט ( איור 1B) כך הוא פולט.
הערה: השתמש בשידור חי שידור הוידיאו בעת טעינת התולעת כדי לאשר את המיקום והכיוון של החיה (שלבים 5.8-5.13). - הוסף את התולעת טעינת צינור לתוך התולעת טעינה עם מסמרים
- בעדינות אל תפעילו לחץ על המזרק עד התולעת מופיע בערוץ הטעינה.
- אם התולעת מתחיל להזין את הערוץ הזנב-הראשון, למשוך על הבוכנה מזרק כדי למנוע את התולעת להיכנס לתעלה.
- מעבר בין החלת ולבטל את הלחץ עד הראש נכנס הערוץ הראשון-
- פתח הואקום על-ידי הפעלת את השסתום סכינים סטריליים אסידו מחובר ליציאת לשקע כדי לפתוח אותו כדי לשאוב במקום אווירה.
- ידנית הפעילו לחץ על ידי מדכא הבוכנה מזרק אוריינט ולמקם את הראש תולעת כזה חשוף לערוץ זרימה מאגר, אבל בינתיים לא כי הראש יכול לנוע בחופשיות ( איור 2 D-2E).
6. גירוי ורכישה
- באמצעות תוכנה קוד פתוח מיקרוסקופ, כגון מיקרו-המנהל, להקליט על ידי לכידת תמונות כמו ערימה TIFF ב 10 מסגרות לשנייה באמצעות אור כחול עירור (470 ננומטר) ב-30 ס
- להגדיר את החשיפה בתפריט הראשי כדי גב' 100
- פתח " Acq רב D. " מהתפריט הראשי של התוכנה. להגדיר " מספר " כדי " 300, " ו " מרווח הזמן " כדי " 0. " לחץ על " ידרשו! " לרכוש את הוידאו.
- החל דופק s 10 של ה s גירוי 5 לאחר הרכישה. התאמת משך stimulus ביישום כרצונכם.
- לאחר שרכשה 5 s של וידאו, לשנות את השסתום 3-דרך שליטה המאגר בקרת זרימה כדי להחיל את הגירוי על החיה הנבדקת. לחץ על הלחצן השמאלי ביותר על הקישור שסתום ( איור 1B).
- S 10 לאחר החשיפה לגירוי (הפעם ניתן לכוונן לפי הצורך על-ידי המשתמש), לשנות את הזרימה של מאגרי בלחיצה על הלחצן השמאלי ביותר שוב על הקישור שסתום.
- רשומה תחת מאגר רק עד החלון 30-s הושלמה כדי לאפשר את זריחה GECI לשוב בסיסית.
- חוזר כרצונכם. חכה 30 s בין הקצה של רכישת אתחול של מהמבחן הבא.
7. ניתוח תמונה
- פתח הערימה TIFF עם התוכנה פתוח, ImageJ, על-ידי גרירת קובץ לתוך חלון ImageJ.
- לחץ באמצעות הסמן וגרור כדי להגדיר את האזור עניין (ROI) סביב נוירון עניין. הגדר את האזור כדי לכלול את soma של נוירון עניין (כמו באיור 3 א).
- מגרש z-הערימה של עוצמת קרינה פלואורסצנטית רועי על פני ערימות על-ידי לחיצה על פתח-> תמונה - > ערימות - > עלילה פרופיל ציר z.
- לחץ " רשימת " בחלון שנפתח. לחץ על עריכה - > העתק כדי להעתיק את הערכים. להדביק את הערכים לתוכנית של גליון נתונים.
- לנתח את פלורסצנטיות רקע לכל פעימה על-ידי גרירת רועי לאזור של התולעת שאינו מכיל ביטוי GCaMP.
- לבצע רקע חיסור לכל פעימה על-ידי חיסור הערך פלורסצנטיות רקע מהערך עוצמת קרינה פלואורסצנטית נוירון.
- לחשב ΔF/F 0 עבור כל מסגרת של הדופק לכל.
- F לחשב את 0 כערך בעוצמה ממוצעת של רועי 1 הראשון s של רכישה (למשל, מסגרות 1-10).
- לחשב ΔF/F 0 על-ידי חלוקת הערך המופחת-רקע מסגרת של עניין על-ידי הערך המחושב של 0 F.
- חזור על כל נוירון עם תמונה ודופק כל גירוי.
- נוירונים עם פרופילים תגובה עקבית, כגון אש, ממוצע כל פולסים עבור כל נוירון, לחשב את ה-SEM (כמו דמות 2F).
- להתוות את הממוצע ΔF/F 0 עם SEM לאורך זמן עבור כל נוירון.
הערה: במקרה זה, מקובל לכלול heatmaps את התגובות עצביים בודדים בכל ניסוי גם כן. בנוירונים שמראות לא עקבי לשינויים שנחשולי סידן עם חשיפה לגירויים מעבר stimulations חוזרות, או אנשים שונים 23, ייתכן יותר החלות על הצג עקבות הדופק בודדים (כמו ב איור 4). ראו דיון לפרטים לקבוע כיצד להציג את הנתונים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ניתן לראות דוגמה של הגדרת התקן הכוללת איור 1A-B. איור 1A , מתאר את בניית מאגר תקין וההתקנה. איור 1B מציגה את החיבורים של המאגרים למכשיר microfluidic. איור 1C מתאר התקן microfluidic עם יציאות בודדות המסומנות על בהירו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
השבב חוש הריח הותאם זכר משלבת פנייה לתוך נמל טעינה צר יותר, אשר מאפשר שליטה רבה יותר כיוון ועבור לכידה יעילה של זכר C. elegans. דבר זה מאפשר הפריט החזותי של שני ימינה ושמאלה חברי זוגות דו צדדיים עצביים, ללא צורך z-לערום. עקום זה מוביל אוריינטציה מרחק אנכי 100% של הזמן תולעים שבו זוג הדו-צדדיים ר...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אין לחשוף.
Acknowledgements
ברצוננו להודות מנואל הצימר סיפק לנו הקובץ הראשוני בעיצוב הותאם לשימוש עם זכרים; פרנק שרדר על סינתזה ועל אספקת ascr #3; רוס Lagoy כדי להפוך את התובנה בסיוע הדמיה וניתוח; לורה Aurilio על הזיוף הבסיס, ומי, לצד כריסטופר המצנח, תרמו הסקירה של כתב היד הזה. מימון עבור עבודה זו סופקה תחת של מכוני הבריאות הלאומיים גרנט 1R01DC016058-01 (ס), המענק הלאומית למדע CBET 1605679 (D.R.A.), ופרס בורוז Wellcome הקריירה ב מדעי ממשק (D.R.A.).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
References
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023(2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2(2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008(2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31(2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164(2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1(1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. dC., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037(2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613(2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved