A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חילוץ מדגם, כימות כרומטוגרפי סימולטני של דוקסורוביצין, מיטומיצין C שלאחר משלוח סמים בשילוב של חלקיקים נושאות לעכברים
In This Article
Summary
פרוטוקול זה מתאר תהליך אנליטי יעיל ונוח של חילוץ מדגם ונחישות סימולטני של סמים מרובים, דוקסורוביצין (DOX), מיטומיצין C (MMC), מטבוליט רעיל אירובי DOX, doxorubicinol (DOXol), בהביולוגי דוגמאות של המודל הגידול השד פרה שטופלו nanoparticle ניסוחים שילוב סינרגטי סמים.
Abstract
כימותרפיה בשילוב נעשה שימוש תכוף במרפאה לטיפול בסרטן; עם זאת, תופעות לוואי המשויך אל הרקמות עלולה להגביל על התועלת טיפולית. שילוב תרופה מבוססי ננו-חלקיק הוכח להקל על הבעיות בהם נתקלים שילוב תרופתי חינם. מחקרים קודמים שלנו יש מראה כי השילוב של שתי תרופות נגד סרטן, דוקסורוביצין (DOX) ו מיטומיצין C (MMC), הפיק אפקט סינרגיסטי נגד שני מאתר, סרטן השד אנושי תאי במבחנה. DOX ו- MMC פולימרים טעונים שיתוף-השומנים היברידית חלקיקים (DMPLN) עקף משאבות טרנספורטר שונות בזרימת המקנים עמידות multidrug והיעילות משופרת והפגינו במודלים הגידול השד. לעומת פתרון קונבנציונאלי צורות, כגון יעילות מעולה של DMPLN יוחס את פרמקוקינטיקה מסונכרן DOX. MMC ואת הזמינות הביולוגית מוגברת סמים תאיים בתוך תאים סרטניים מופעל על-ידי nanocarrier PLN.
כדי להעריך את פרמקוקינטיקה והפצה ביו-של שיתוף מנוהל DOX ו- MMC פתרון חינם והן nanoparticle טפסים, שיטה פשוטה ויעילה ניתוח סמים רב באמצעות ביצועים גבוהים הפוכה-פאזי כרומטוגרפיה נוזלית (HPLC) היה פיתח. בניגוד לשיטות שדווחה בעבר לנתח DOX או MMC בנפרד ב הפלזמה, שיטה זו-hplc, קורס חדש הוא מסוגל בו זמנית quantitate DOX, MMC ורעיל סיבולת לב ריאה DOX מטבוליט מרכזי, doxorubicinol (DOXol), במטריצות ביולוגיים שונים ( למשל, דם, סרטן השד, לב). Methylumbelliferone 4 בדיקה סופג כפול פלורסנט, אולטרה סגול (4-MU) שימש תקן פנימי (I.S.) לגילוי בשלב אחד של ניתוח הסם מרובים עם אורכי גל שונים לזיהוי. שיטה זו הוחלה בהצלחה כדי לקבוע את ריכוזי DOX MMC מועברים על ידי גישות nanoparticle וגם פתרון בדם כל ורקמות שונים מודל מאתר הגידול השד של orthotopic. השיטה האנליטית המובאת הוא כלי שימושי עבור ניתוח קליניים מבוססי ננו-חלקיק משלוח של שילובים תרופתיים.
Introduction
כימותרפיה היא הטיפול היסודי מודאליות עבור סרטן רבים זה קשורה לעיתים קרובות עם תופעות לוואי חמורות, יעילות מוגבלת עקב עמידות לתרופות, אחרים גורמים1,2,3. כדי לשפר את התוצאה של כימותרפיה, סמים בשילוב משטרי הוחלו במרפאה בהתבסס על שיקולים כגון רעילות שאינם חופפים, מנגנונים שונים של פעולה סמים, סמים-צלב ההתנגדות4,5 , 6. בניסויים קליניים, קצב התגובה גידול טוב יותר לעיתים קרובות נצפתה באמצעות בו-זמנית מנוהל שילובים תרופתיים לעומת משטר של סמים רציפים משלוח7,8. עם זאת, בשל תת אופטימלית ביו-הפצת סמים חינם טפסים, הזרקת בו זמנית של מספר תרופות יכול לגרום לרעילות הרקמות בולט זה עולה10,9,את האפקט הטיפולי11. תרופות מבוססות Nanocarrier הוכח לשנות את פרמקוקינטיקה, ביו-והפצה של תרופות שעברו אנקפסולציה, שיפור, ממוקדות הגידול הצטברות12,13,14. כפי שנסקרו במאמרים האחרונים שלנו, חלקיקים נטען במשותף עם שילובים תרופתיים סינרגטי הפגינו יכולת להקל על הבעיות בהם נתקלים שילובים תרופתיים חינם, עקב שלהם מבוקרת הגיאופוליטיות והמרחביות טמפורלית שיתוף מסירת תרופות מרובות רקמת הגידול, הפעלת אפקטים סמים סינרגטי נגד סרטן תאים4,15,16. כתוצאה מכך, יעילות טיפולית מעולה ורעילות נמוכה הוכחו בשני מחקרים פרה-קליניים ומחקרים קליניים4,17,18.
שלנו במבחנה מחקרים קודמים מצאו כי השילוב של שתי תרופות נגד סרטן, דוקסורוביצין (DOX) ו מיטומיצין C (MMC), המיוצר אפקט סינרגיסטי נגד מספר שורות תאים של סרטן השד וטעינה, יתרה מזאת, משותף DOX ו- MMC בתוך פולימר-השומנים היברידית חלקיקים (DMPLN) התגבר על שונות בזרימת המשויך עמידים בפני התרופה מרובה משאבות (למשל, P-גליקופרוטאין, חלבון עמיד סרטן השד)19,20,21. In vivo, DMPLN זמין המרחבית-טמפורלית מסירת שיתוף DOX ו- MMC לאתרי הגידול ואת הזמינות הביולוגית מוגברת של סמים בתוך תאי סרטן, כמצוין על-ידי צמצום של היווצרות של doxorubicinol (DOXol) מטבוליט22DOX. כתוצאה מכך, DMPLN משופרת גידול התא אפופטוזיס, עיכוב בצמיחה הגידול והישרדות מארח ממושך בהשוואה חינם לשילוב DOX של MMC או liposomal DOX ניסוח22,23,24, 25.
ניתוח הכמות בפועל של סמים מועברים במשותף על ידי nanocarrier הוא קריטי עבור תכנון יעיל nanoparticle ניסוחים. שיטות רבות פותחו כדי לנתח את רמת פלזמה של מינונים DOX או MMC יחיד באמצעות ביצועים גבוהים כרומטוגרפיה נוזלית (HPLC) לבד או בשילוב עם ספקטרומטר מסה (MS)26,27,28 , 29 , 30 , 31 , 32 , 33 , 34. עם זאת, שיטות אלה הם לעיתים קרובות מעשי עבור טיפול משולב ועתירת כמו מספר גדול של דגימות ביולוגיות צריכים להיות מוכנים בנפרד לניתוח של תרופות מרובות (כולל לפעמים מטבוליטים סמים). בנוסף הכריכה חלבון חזקה פלזמה של DOX ו- MMC, תאי דם אדומים יש גם יכולת עצומה לאגד ולרכז תרופות נגד סרטן רבים35,36. לפיכך, ניתוח פלזמה DOX או MMC עשויים שמאפילים על פסי דם בפועל סמים ריכוזים. העבודה הנוכחית (איור 1) מתאר פשוטה וחזק מרובים שיטת ניתוח סמים באמצעות היפוך פאזה HPLC כדי לחלץ בו זמנית quantitate DOX, MMC ו- doxorubicinol מטבוליט DOX (DOXol) של דם ורקמות שונות ( למשל, גידולים). זה יושם בהצלחה כדי לקבוע את פרמקוקינטיקה ואת ביו-חלוקת DOX MMC, כמו גם היווצרות של DOXol לאחר משלוח סמים באמצעות פתרונות חינם או טפסים ננו-חלקיק (קרי, DMPLN ו- liposomal DOX) ב- orthotopically מושתל דגם העכבר מאתר הגידול השד לאחר תוך ורידית (עירוי) הזרקה22.
Protocol
כל ניסויים בבעלי חיים היו שאושרו על-ידי חיה טיפול הוועדה של אוניברסיטת בריאות ברשת במכון הסרטן אונטריו, לפי המועצה הקנדית על הנחיות טיפול בעלי חיים-
1. ביולוגי הכנת הדוגמא
- לאסוף את כל הדם, האיברים העיקריים, ותצמידו הגידול בנקודות מראש זמן-לאחר מינהל תוך ורידית (עירוי) המכילים תרופות פורמולציות (למשל, DMPLN, liposomal DOX)
- להזריק עירוי נושאות העכבר של השד עם ניסוח מוכן המכיל סמים.
- עזים ומתנגד העכבר הזמן המיועד-נקודות (למשל, 15 דקות) על ידי מתן איזופלוריין 2% נשימים בחדר אטום.
- הנח את העכבר anesthetized על גבו, שים את האף שלו דרך nosepiece המספק כל הזמן 2% איזופלוריין.
הערה: כדי להבטיח העכבר עובר הרדמה עמוקה, בעדינות לצבוט פור איבריו של העכבר על המראה עבור כל תנועה עוויתות. - ניקוי יסודי אזורי החזה והבטן באמצעות אתנול 70% ולאחר מכן לבצע הליך מסוף פנצ'רים הלב על העכברים anesthetized עמוק באמצעות מזרק heparinized 1 mL מחט 23 גרם-
- לאסוף כל הדם לתוך נתרן שכותרתו הפארין ריסס שפופרת פלסטיק ו מערבולת בעדינות את הצינור כדי להבטיח דם שנאספו בא במגע עם הפרין מצופה של הקיר שפופרת. לאסוף מינימום של 50 µL של דם מלא. תמיד שומרים את הדגימות על קרח
- להקליט את כל ארבעת הגפיים של העכבר כדי לאבטח אותו ולפתוח את חלל הבטן ואת בית החזה של העכבר באמצעות זוג מלקחיים ומספריים. משמרת את המעיים לצד ודחף את הכבד כלפי מעלה כדי מספיק לחשוף את וריד שער הכבד. לחתוך וריד שער הכבד ניקוז דם.
- Perfuse העכבר כל הגוף עם 50 מ ל תמיסת 0.9% קר כקרח דרך הלב באמצעות מזרק 10 מ"ל עם מחט 25 גרם-
הערה: לכופף את המחט ב- 90° עבור המנחה את המזרק לתוך וריד שער הכבד.
סדר - בלו האיברים הבאים: לב, ריאות, כבד, טחול, כליות. לאחר מכן, להפריד את הגידול השד רקמות מסביב בעזרת זוג מספריים החתך משטח שומן החלב נכון של העכבר. לאסוף את כל האיברים בנפרד לתוך צינורות פוליפרופילן 1.5 mL ולהקפיא אותן במהירות בחנקן נוזלי.
הערה: להפריד את כיס המרה מהכבד. - לאחסן את כל. הדם 4 ° C ורקמות נכרת במקפיא-80 ° C עד ניתחה HPLC.
- DOX לחלץ, MMC ו- DOXol של מטריצות ביולוגי.
- שוקל כל רקמות ביתור קפוא במהירות ולהעביר אותם לתוך צינור חרוטי התחתון מעוגל מ"ל 13. כדי למנוע את חילוף החומרים סמים אפשריות או השפלה, שומרים את הדגימות על קרח
- להוסיף 1-5 מ של מאגר פירוק התא קר כקרח לתוך הצינור.
הערה: הנפח של מאגר להשתמש תלוי משקל הרקמה המבוסס על יחס רקמות-מאגר של ז' 1: 5 מ"ל (w/v); עבור איברים קטנים, כגון הלב, הטחול, היחס הוא ז' 1: 2 מ"ל. - השתמש תנועה מעלה-מטה שבץ כדי homogenize את דגימות רקמה על הקרח במהירות של 18,000 סל ד באמצעות מהמגן יד חשמלי של.
הערה: המגון שהושלמו דורש כ 3 עד 5 חזרות של תהליך המגון קצרה של פחות מ- 15 s, ואחריו רקמות קירור מעל הקרח בין כל המגון קצר. - לרחוץ את המכשיר מחולל שיני המסור 10 מ מ מהמגן עם מזוקקים יונים (DDI) H 2 O, 70% אתנול, ולאחר מכן DDI H 2 O בין כל דגימה רקמה כדי למנוע זיהום צולב. µL
- µL 50 העברה של רקמת homogenate או דם מלא לתוך צינור מיקרו-צנטריפוגה פוליפרופילן 1.5 mL ספייק עם 5 של פנימי רגיל (I.S.) 4-methylumbelliferone (4-MU) (2000 ng/mL) לתוך הצינור.
הערה: פתרון 4-MU הוכן בשנת מתנול כאן. - 250 להוסיף µL החומר הממיס החילוץ כקרח לתוך הצינור המכילים דם מלא או רקמות homogenate.
הערה: הממס חילוץ מורכב של 60% acetonitrile (לחצן מצוקה) ו- 40% אמוניום אצטט (5 מ"מ) עם pH להתאים ל- pH = 3.5 באמצעות חומצה פורמית 0.05%. להשתמש במדגם (v/v) 1:5: חילוץ הממס יחס נפח. - נמרצות מערבולת התערובת למשך 2 דקות, צנטריפוגה, ב-3,000 x כוח g ב 4 o C עבור 10 דקות ו- pipet 200 µL supernatant לתוך צינור אחר מיקרו-צנטריפוגה טרום מקורר טריים.
- תגובת שיקוע Evaporate ב 60 מעלות צלזיוס תחת זרם איטי של גז חנקן עם הגנה מפני האור.
- לשקם את שאריות מיובשים עם 100 µL של מתנול קר כקרח, נמרצות מערבולת עבור 30 s ו צנטריפוגה ב 3000 g x ב 4 ° C עבור עוד 5 דק.
- להעביר את תגובת שיקוע לתוך הוספה בקבוקון HPLC ומניחים מדגם בקבוקונים במגש תעשיה להזרקה.
2. מכשור HPLC ופרמטרים מבצע
- HPLC להכין נייד-פאזי עם עקבי הפארמצבטית
- למדוד 500 מ"ל של HPLC-כיתה ח 2 O באמצעות משורה של.
- למדוד 500 מ"ל של כיתה HPLC acetonitrile (לחצן מצוקה) באמצעות משורה נפרדים של.
- בזהירות להוסיף 0.5 מ ל חומצה trifluoroacetic (TFA) (זהירות) לתוך כל אחד 500 מ"ל של H 2 O ולחצן מצוקה כדי להשיג את שלב ניידים של H 2 O ולחצן מצוקה המכיל 0.1% TFA, בהתאמה.
הערה: TFA קורוזיבי ועוד רעילים, צריך להיות מטופל ברדס fume מעבדה. כל הממס תערובות מוכנות בטמפרטורת החדר. - מסנן שלבים נייד דרך פילטר ממברנה ניילון עם מיקרומטר 0.45 גודל הנקבוביות ולהעביר אותו לתוך בקבוקים נקיים של מאגר HPLC.
- מכשור HPLC הגדרת גילוי בו זמנית של 4-MU DOX, MMC, ו DOXol ו I.S..
- לעבור על משאבת הדרגתיות, דה-גסר, אוטומטי-סמפלר, גלאי מערך פוטודיודה, רב גלאי קרינה פלואורסצנטית λ.
- קלט את התנאים הראשוני של הנייד-הרכב ל- 16.5% H 2 O (0.1% TFA) ו- 83.5% לחצן מצוקה (0.1% TFA) (v/v).
- להגדיר את גלאי UV על שני ערוצים, אחד 310 ננומטר עבור 4-MU (I.S.) והאחר על 360 nm עבור MMC.
- להגדיר את גלאי קרינה פלואורסצנטית על שני ערוצים, אחד בכל λ ex / λ em = 365/445 nm עבור 4-MU והשני -λ ex / λ em = 480 ננומטר nm/560 עבור DOX ו- DOXol, בהתאמה.
- לקבוע את שיעור זרימת איזוקראטית של 1.0 מ"ל לדקה
- Equilibrate עמודה 18 שהותקנו מראש הפוכה שלב C (4.6 מ מ x 250 מ מ, 5 מיקרומטר) בטמפרטורת החדר במשך 10 דקות של הממסד בסיסית.
- להפריד בין תרופות (DOX, MMC, DOXol ו- 4-MU) באמצעות תנאי נייד-שלב מעבר.
- µL להזריק 15 דוגמאות שחולצו ומרוכז מחדש באמצעות auto-סמפלר.
- בהדרגה לשנות את התנאי נייד-שלב ראשוני (עיין פרוטוקול שלב 2.2.2) ל- 100% לחצן מצוקה (0.1% TFA) מעל 18 דקות באמצעות המשאבה הדרגתיות אוטומטיות.
הערה: במהלך תהליך ההפרדה, ארבעה ערוצי (שני ספיגה UV ו פלורסנט שני) מופיעים בו זמנית עם אחד מהערוצים הצגת סמים תרכובת (עיין פרוטוקול שלב 2.2.3 ו 2.2.4). - לשמור על 100% של לחצן מצוקה (0.1% TFA) 1 דקות, ואז לשוב התנאי ראשוני ניידים בתוך מינימלית 1
- מחדש להתנות את העמודה עם ניידים בשלב ראשון בקצב הזרימה של 1.5 mL/min במשך 4 דקות על הזריקה הדוגמה הבאה.
3. אימות HPLC
- להכין עבודה בסטנדרטים של DOX, MMC ו- DOXol ו- 4-MU (I.S.).
- שוקלים בנפרד 1 מ ג של אבקת סם DOX ו- MMC (זהירות), 4-MU-רעננה קטנות במשקל של נייר (3 x 3 ס"מ 2).
הערה שכל תרופות נגד סרטן נחשבים סיכון בריאותי שיכולים לגרום המוטגניות רעילות, תא הנבט חריפה על שאיפה או בליעה. הם צריכים להיות מטופלים בזהירות עם כפפות ומסכות. - להעביר את שנשקל DOX, MMC ו 4-MU חדש mL 1.5 בודדים פוליפרופילן מיקרו-שפופרת צנטרפוגה.
- להוסיף 1 מ"ל של מתאמפטמיןanol ו מערבולת לזמן קצר כדי להשיג ריכוז 1 מ"ג/מ"ל DOX ו- MMC.
- להוסיף 1 מ"ל של מתנול לתוך בקבוקון המכיל מראש שנשקל 1 מ ג של DOXol (זהירות) ו מערבולת בקצרה כדי לקבל 1 מ"ג/מ"ל ריכוז DOXol.
הערה: DOXol הוא מטבוליט רעיל סיבולת לב ריאה ויש לטפל בזהירות. - µL פיפטה 20 פתרונות מניות מוכן DOX, MMC, DOXol, 4-MU חדש נפרד צינור מיקרו-צנטריפוגה פוליפרופילן 1.5 mL ולהוסיף 980 µL של מתנול כדי לקבל תקן עובד של µg/mL 20 של כל תרופה.
- µG/mL 20 לדלל DOX, MMC, DOXol באמצעות מתנול כדי להשיג עבודה בסטנדרטים של 50 ng - /mL 20 µg DOX, MMC של DOXol ו- 2000 ng/mL עבור I.S. 4-MU-
- לסגור את הפקק של הצינור של פתרונות עבודה עם חתיכה הצר של פרפין כיסוי הסרט כדי למנוע אידוי מתנול, לעטוף את הצינור כולו ברדיד אלומיניום, כדי למנוע חשיפה אור ישיר חנות ב-20 מעלות צלזיוס
- שוקלים בנפרד 1 מ ג של אבקת סם DOX ו- MMC (זהירות), 4-MU-רעננה קטנות במשקל של נייר (3 x 3 ס"מ 2).
- לקבוע את ליניאריות, דיוק, דייקנות DOX, MMC ו- DOXol בביולוגי מטריצות (קרי, דם והגידול homogenate).
µL
- בו זמנית ספייק 5 עובדים הסטנדרטים של DOX ו- DOXol (50 ng/mL-µg 20/mL), MMC (1,000 ng/mL-µg 16/mL), ו- 4-MU (2 µg/mL) לתוך µL 50 של דם מלא ריק או רקמות homogenate צינורות פוליפרופילן מיקרו-צנטריפוגה כדי להשיג את עקומת ריכוז רגיל החל 5-2000 ng/mL עבור תרכובות סמים ו 200 ng/mL עבור 4-MU (I.S.).
- ביצוע וזמינותו החילוץ הסמים המתוארות פרוטוקול 1.2.
- השתמש נמוך, חציון וגבוה ריכוזי DOX DOXol (50, 500 ו- 2,000 ng/mL) ו- MMC (100, 1000, 2,000 ng/mL) במשך היום "אינטרה" בין דיוק ודיוק.
הערה: להכין טרי ריכוזים רגיל ביום של ניתוח.
- ניתוח דוגמאות של
- µL 15 להזריק המדגם באמצעות auto-סמפלר.
- בהדרגה לשנות את השלב ניידים מ 0 עד 18 דקות, הגדלת את ההרכב של לחצן מצוקה על מרווח הזמן.
- אחרי 18 דקות, להחזיק התנאי שלב נייד דק 1
- לחזור למצב הראשוני מעל הבא 2 דקות, ולאחר מכן equilibrate מחדש במשך 4 דקות לפני הזריקה הבאה.
- לאחר כל מדגם לרוץ, שימו לב כי הפסגות של סמים תרכובות עם זמן השמירה שלהם מוצגים כדלקמן: MMC, DOXol, 4-MU (I.S.) ו DOX.
- לשלב את האזור שיא תחת עקומת (AUC) של תרכובות סמים באמצעות תוכנה HPLC.
- לחשב את יחס חאן אל בין מתחם בודדים סמים I.S. (משוואה 1) ולהשתמש העקומות סטנדרטי מוכן תחת אותם מיצוי הליכים כדי לקבוע את הסמים ריכוזי DOX, MMC DOXol בניסוח DMPLN.
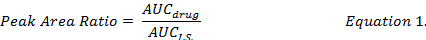
- חישוב האחוזים שחזור סמים (משוואה 2) על-ידי השוואת הריכוזים סמים מחדש באמצעות מתנול של תמציות של דגימות ביולוגיות מחודדים לזה תקן (" מסודר ") סמים פתרון מתנול.
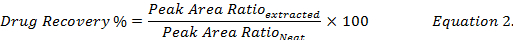
תוצאות
שתי תרופות נגד סרטן, DOX MMC, כמו גם של המטבוליט DOX, DOXol, התגלו בו זמנית בלי התערבות ביולוגי באותו יישומית הדרגתיות HPLC בתנאי שימוש 4-MU I.S. עבור קרינה פלואורסצנטית והן גלאי UV. DOX, MMC, DOXol ו- 4-MU היו היטב מופרדים אחד מהשני עם השמירה פעמים של 5.7 מינימום עבור MMC, מין 10.4 עבור DOXol, 10.9 דקות עבור ...
Discussion
לעומת שאר שיטות כרומטוגרפיות המאפשרים הגילוי של זן סמים אחד בכל פעם, פרוטוקול HPLC הנוכחי הוא מסוגל בו זמנית quantitate שלוש תרכובות סמים (DOX, MMC ו- DOXol) המטריצה הביולוגי אותו ללא צורך לשנות השלב ניידים. שיטה זו הכנה וניתוח יושם בהצלחה כדי לקבוע את פרמקוקינטיקה, ביו-והפצה של שתי מערכות משלוח סמים מבו...
Disclosures
המחברים יש אין אינטרסים כלכליים מתחרים ניגודי עניינים.
Acknowledgements
המחברים בהכרת תודה לאשר את המענק ציוד מדעי הטבע, הנדסה מחקר (NSERC) המועצה של קנדה לבדיקות, המענק ההפעלה של המכון הקנדי של הבריאות מחקר (CIHR), למחקר סרטן השד קנדי (CBCR) הברית X.Y. וו, המלגה אוניברסיטת טורונטו זאנג R.X., ג'אנג טי.
Materials
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
References
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved