Method Article
חיים הדמיה ואחריו תא בודד מעקב צג Cell Biology, ההתקדמות שושלת היוחסין של אוכלוסיות עצבית מרובים
* These authors contributed equally
In This Article
Summary
פרוטוקול חזקים כדי לפקח אוכלוסיות עצבית על ידי זמן לשגות וידאו-מיקרוסקופיה ואחריו-מבוססות תוכנה שלאחר עיבוד מתואר. שיטה זו מייצגת כלי רב עוצמה לזיהוי אירועים הביולוגי בקרב אוכלוסיה הנבחר במהלך הניסויים הדמיה בשידור חי.
Abstract
הבנת המנגנונים השולטים אירועים ביולוגי קריטיים של אוכלוסיות של תאי העצבים, כגון התפשטות, בידול או החלטות גורל התא, יהיה גורם מכריע בעיצוב אסטרטגיות טיפוליות למחלות רבות המשפיעות על מערכת העצבים. שיטות כדי לעקוב אחר תאים אוכלוסיות להסתמך על תוצאות הסופי שלהם בתמונות עדיין, הם בדרך כלל נכשלים לספק רזולוציה טמפורלית מספיק כדי לזהות תכונות התנהגותיות של תאים בודדים. יתר על כן, וריאציות של מוות של תאים, הטרוגניות. התנהגותית בתוך אוכלוסיה תא, דילול, מפיצים או יעילות נמוכה סמני להשתמש בה כדי לנתח את התאים הם כל מגבלות חשובות תוביל הקריאות של שגוי או מוטעה של התוצאות. לעומת זאת, ביצוע הדמיה בשידור חי, תא בודד מעקב בתנאים המתאימים מייצג כלי רב עוצמה כדי לפקח על כל אחד המאורעות. . הנה, פרוטוקול זמן לשגות וידאו-מיקרוסקופיה, ואחריו שלאחר עיבוד, מתואר לאתר אוכלוסיות עצביים עם רזולוציה תא בודד, העסקת תוכנה ספציפית. בשיטות המתוארות לאפשר לחוקרים כתובת שאלות מהותיות לגבי תא ביולוגיה ו שושלת היוחסין ההתקדמות של אוכלוסיות עצביות שונות.
Introduction
כדי לפתח אסטרטגיות טיפוליות חדשות ויעילות יותר, להתחדש אוכלוסיות עצבית, עלינו תחילה להבין את המנגנונים הבסיסיים המקיימות תאים עם פוטנציאל הרגנרציה עצבית. רודף מטרה זו דורשת ידע נרחב מהגורמים המווסתים את האיזון בין תרדמה, התפשטות/בידול, מצב ואת העיתוי של החטיבה, אורך מחזור התא, קיבולות נודדות, הכדאיות, וכו '. למרות זאת גישה טכנית זה כבר מועסקים במשך שנים רבות1, חיים הדמיה, התבוננות ישירה נותרו עדיין האפשרות הטובה ביותר לעקוב אחר האירועים המפורטים לעיל. בניגוד הרבה גישות אחרות התרכזו מובילים המפרט, לחיות הדמיה, תא בודד מעקב לספק מידע לכל אורך ניסוי2,3,4,5, 6. לפיכך, התוספת של רזולוציה טמפורלית מאפשר מוות של תאים, בהתנהגות התא הטרוגניות או החלטות גורל התא, רבים אחרים אירועים קריטיים להיות מזוהה אולי לעבור אחרת מבלי שיבחינו בו. באופן אידיאלי, תכונות אלה של תאים צריך הטוב לב למצלמות של תא בודד רמת ויוו, שבו שני מהותי (תאים אוטונומיים) ו חיצוני (גומחת תאי) רמזים נלקחים בחשבון.
עם זאת, למרות במבחנה המצב שהאירועים מתרחשים בסביבה לא לשכפל את חצרו טבעי, התנאים תרבות בצפיפות נמוכה המשמש בדרך כלל פרוטוקולים אלה מתאימים יותר לגלות מאפיינים מהותיים של תאים. יתר על כן, פקד חצרו שמסביב, על-ידי שינוי פשוט מדיום הגידול, יותר פשטני עלולה להוות כלי חשוב לחקור את התפקיד בודדים של כל גורם extrinsic המגדיר את הנישה עצבית, וכן גורמים סביבתיים עשויים ושאת תרחישים פתולוגיים7,8,9,10,11,12,13. לכן, כאשר מוגדר כהלכה, כמו פרוטוקול המוצע כאן, הדמיה חיה מספק פתרון ריאלי במבחנה כדי לטפל רוב השאלות בעבר לספור.
בקצרה, פרוטוקול זה מתאר את החומרה, התוכנה, תרבות תנאים, השלבים העיקריים הנדרשים לבצע בהצלחה ניסוי הדמיה חיה ואחריו תא בודד מעקב. גישה זו מציעה מידע חשוב, המסייע כדי לחשוף את ההיבטים הבסיסיים של הביולוגיה, ואת ההתקדמות שושלת היוחסין, של אוכלוסיות עצבית מרובים.
Protocol
הסעיפים הבאים מתארים את השלבים הדרושים לביצוע הדמיה חיה ולאחריו מעקב תא בודד של אוכלוסיות מרובות עצבית (איור 1). כל ההליכים חיות מעורבים שמתואר פרוטוקול זה חייב להיות מתבצעת על פי ההנחיות של המועצה הבינלאומית עבור המדע חיות מעבדה (ICLAS).
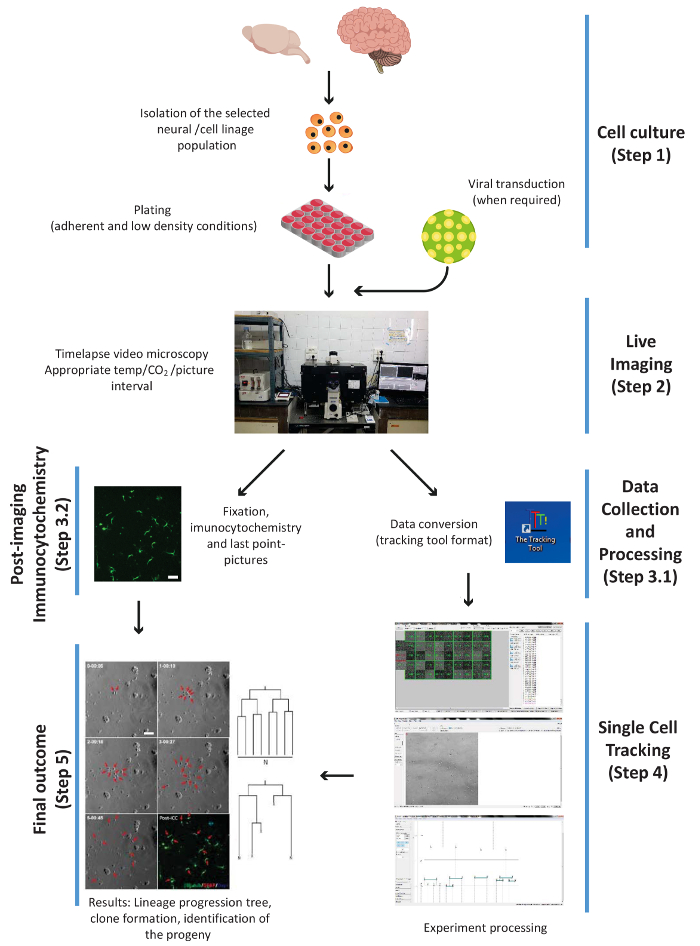
איור 1. ערכת הממחישות את השלבים ניסיוני העיקרי של ההליך, קרי: תא תרבות, הדמיה בשידור חי, PICC ואיסוף נתונים, תא בודד מעקב, ואת התוצאה הסופית. השלבים ממוספרים על פי זרימת העבודה של הפרוטוקול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
1. תא תרבות: בידוד, ציפוי של הנבחר האוכלוסייה עצבית או שושלת היוחסין של תאי
הערה: בשילוב עם פרוטוקול זה, דוגמאות של היישום שלה לאוכלוסיות שונות תא ניתנות לאימות השירות שלה לנתח את הביולוגיה של תאים עצביים. אלה כוללים: תאי גזע עצביים למבוגרים (aNSCs) נגזר מן העכבר SubEpendymal אזור (להלכה) (עבור בידוד מפורט פרוטוקול ראה14); האסטרוציטים קורטיקלית כמחנכת ללמוד התכנות עצביים (עבור בידוד מפורט פרוטוקול ראה15); כמחנכת האסטרוציטים אסטרוציטומה (עבור בידוד מפורטת שיטת ראה16); העכבר נוירו-2a נוירובלסטומה תאים בטור (N2a).
- הזרע התאים ישירות על פולי-D-ליזין מצופה לוחות 24-. טוב. השתמש 1 מ"ל של תרבות בינוני לכל טוב. דגירה הלוחות 37 ° C ו- 8% CO2 עבור aNSCs, או ב- 37 ° C ו- 5% CO2 עבור שורת האסטרוציטים תא כבר שעתיים לפני הדמיה בשידור חי. הימנע משימוש coverslips כדי למנוע תנועה בלתי רצויה כמו השלב מיקרוסקופ ממונע הוא שנעקרו שהופך לתא בודד מעקב אחר ישים.
הערה: תא צפיפויות ומדיה תרבות המועסקים בניסויים הם: 30-40,000 תאים/טוב aNSCs ב Dulbecco המתואמת של בינוני הנשר (תערובת מזין DMEM:F12 בינוני); 20,000 תאים/טוב עבור תאים N2a DMEM גלוקוז גבוה בינוני, 80,000 תאים/טוב עבור האסטרוציטים אסטרוציטומה במדיום גלוקוז גבוהות DMEM; 55-65,000 תאים/טוב בשביל האסטרוציטים כמחנכת במדיום תערובת חומרי מזון DMEM:F12. - לתקנן את פרוטוקול תרבות על-ידי התאמת הצפיפות תא של התרבות למספר הנמוך של תאים ריאלי. למרות זאת, צפיפות תא חייב להיות גבוה מספיק כדי לשמור על הכדאיות של התרבות.
הערה: אם תא צפיפות גבוהה מדי, עודף פסולת או דיסוציאציה המסכן (גושים) שעלולות להפריע מעקב של תאים בודדים.
2. חיים הדמיה על ידי מיקרוסקופיה-וידאו בצילום מואץ
- להפעיל את המערכות מיקרוסקופ, מצלמה, חומרה, דגירה. הגדר את הטמפרטורה, אוויר בלחץ 37 ° C ו- 8% CO2 עבור aNSCs, או ל- 37 ° C ו- 5% CO2 עבור שורת האסטרוציטים תא. לאפשר את הטמפרטורה ורמות2 CO לייצב עבור h 1-2.
הערה: ציוד ספציפי נדרש לבצע ניתוח וידאו זמן לשגות, לרבות: שדה בהיר/שלב מיקרוסקופים ניגודיות/זריחה עם רכיבים חשמליים; התקנים הדגירה השולטים טמפרטורה, CO2 ולחות; לבסוף, אמין וחזק מספיק חומרה ותוכנה מסוגל לרכוש וטיפול הנפח של תמונות שהתקבל במהלך הניסויים הדמיה בשידור חי (נא בדוק את הטבלה של חומרים). - ברגע התאים מחוברים בחוזקה על הלוח (2h לאחר ציפוי), להשתמש עט טוש לעשות סימן קטן בתחתית באר אחת זה לא ישמש למעקב אחר, קרי, לבאר שאינו מכיל תאים.
הערה: הסימן הזה ישמש כהפניה לאפס את הקואורדינטות xyz, ניתן להשתמש בכל עת במהלך או לאחר הניסוי, או בין השינויים של מדיום, כדי להחזיר האפס. - למקם את הצלחת בתוך תא דגירה של המיקרוסקופ וצרף בחוזקה את הצלחת על הבמה כדי למנוע כל תנועה בלתי רצויה במהלך העקירה של שלב ממונע של המיקרוסקופ.
- לאפשר את הטמפרטורה של המדיום התרבות התא כדי equilibrate בבית הבליעה למשך כ 20 דקות. שלב זה תוכל להימנע אובדן מיקוד במהלך ההקלטה עקב התרחבות של רכיבים.
- הפעל את תוכנת הדמיה לחיות ובחר את המודול בצילום מואץ כדי להגדיר את הניסוי.
- להגדיר את משך הזמן הכולל של הניסוי ומחזורי רכישה את התמונה "תפריט בכרטיסיה לוח זמנים". עקב phototoxicity הטבועה של ששודרו או זריחה האור בשימוש, הגדר מרווח נאותה כדי לאזן בין הפתרון הזמני של הניתוח של מות תאים פוטנציאליים.
הערה: לדוגמה, סכום כולל של 120 h נבחרה עבור תרבויות aNSC, רכישת תמונות brightfield כל 5 דק שקול רכישת h 120 לש יברמה בתצורה זו תדרוש 120-150 ג ' יגה בייט של שטח אחסון חינם את ההתקן למחשב. - בחר את העמדות התמונה שהוגדרו על-ידי ה-x קואורדינטות y, ואת מרחק מוקד (הקואורדינטה z) "תפריט tab xyz נקודות". כוללות את נקודת ההתייחסות (קואורדינטות xyz אפס) המיקום הראשוני כדי לאחזר את נקודות הציון בכל עת.
- בחר את הסוג של רכישת "גל הבחירה tab בתפריט", brightfield בלבד או בשילוב עם עירור epifluorescence בעת הצורך. בחר את זמן החשיפה. יש לזכור כי חשיפת יתר ששודרו, אור ניאון במיוחד, עלול לפגוע תא הכדאיות (כמצוין לעיל).
- עבור aNSCs, האסטרוציטים אסטרוציטומה ותאים N2a, בחר brightfield (זמן חשיפה ms 10-50).
- עבור האסטרוציטים קורטיקליים transduced בוחר brightfield (זמן חשיפה של 10-50 ms) בשילוב עם פלורסצנטיות אדום/ירוק, תלוי על הכתב המשמש את הניסוי (אורך גל עירור אדום: 550 ננומטר ו- 400 ms זמן חשיפה; עירור ירוק גל: 460-500 ננומטר, זמן החשיפה 100 ms).
- להגדיר את שם הניסוי ואת התיקיה שבה יאוחסנו התמונות. לשמור את רשימת תפקידים כדי לטעון מחדש את הניסוי בכל עת, לאחר כל התנאים הוגדרו, הפעל את הניסוי על-ידי לחיצה על לחצן "הפעל כעת".
- להשהות את הניסוי והתאם מחדש את התנאים המוקד לחיצה על "החלף כפתור z" פעם ביום עד השלמת הניסוי. אם השינויים במדיום נדרשים במהלך ההדמיה בשידור חי, להשהות את הניסוי ולאחזר את הצלחת מהתא זמן לשגות.
הערה: השינויים ב- pH של המדיום עקב מות תאים או התפשטות יתר, וכן וריאציות הטמפרטורה בחדר, עשוי להשפיע על מיקוד נכון של המיקרוסקופ על התאים. עבור תרבויות רגיש (כגון aNSCs) אנו ממליצים על השימוש בינוני בתוספת חומצה-(2-hydroxyethyl)-1-piperazineethanesulfonic 4 (HEPES) (הריכוז הסופי: 1 מ מ).
3. פוסט-הדמיה Immunocytochemistry (PICC), אוסף נתונים ועיבוד
- עם סיום הניסוי, להשהות את התוכנה ולאחזר את הצלחת עבור קיבוע ו- PICC, כמתואר בצעדים הבאים.
- לבצע קיבוע תא: לשטוף את התאים פעם אחת עם 1 מ ל תמיסת מלח פוספט buffered (PBS) ולהוסיף 500 µL של paraformaldehyde (PFA) (4% ב- PBS), המקננת 10 דקות בטמפרטורת החדר (RT).
התראה: Paraformaldehyde מקבע חזק, צריך להיות מטופל בקפידה כדי למנוע מגע עם העור או העיניים. זה חייב להשפיע רק בתוך ברדס fume. - לשטוף את התאים שלוש פעמים עם 1 מ"ל של PBS ולהוסיף 500 µL של הפתרון חסימה (PBS המכיל 2% (wt/כרך) של אלבומין שור (BSA) ו- 0.2% (vol/כרך) חומרים פעילי שטח ללא יונית). דגירה h 1-RT.
- להסיר את הפתרון חסימה ולהוסיף 250-400 µL של הפתרון העיקרי נוגדנים. דגירה 2 h-RT. הפתרון העיקרי נוגדנים מכיל נוגדנים העיקרי מדולל ב- PBS המכיל 2% (wt/כרך) של BSA ו- 0.2% (vol/כרך) חומרים פעילי שטח ללא יונית. נוגדנים המשמשים את הניסויים המתוארים כאן: GFAP (שבערך), βIII-טובולין (1:1, 000) וα-טובולין (1:1, 000). כמו זה מתבצעת ישירות בתוך הבאר, אחסון גדולים יותר של הפתרונות נדרשים (250-400 µL) כדי לכסות את כל התאים.
- לשטוף שלוש פעמים עם 1 מ"ל ל- PBS, להוסיף 250-400 µL של הפתרון נוגדנים משניים (מדולל כפי שמתואר בשלב 3.4). נוגדנים משניים המשמשים את הניסויים המתוארים כאן: אנטי-העכבר Fluorescein (FITC) (1:800), ארנב אנטי Cy3 (שבערך). דגירה h 1 ב RT בחושך.
- רחץ שלוש פעמים ב 1 מ"ל ל- PBS. שמור את התאים 1 מ"ל של PBS עבור והשלבים הבאים של הפרוטוקול.
- למקם את הצלחת בחזרה על הבמה מיקרוסקופ וצרפם בחוזקה על הבמה כדי למנוע תנועה בלתי רצויה במהלך העקירה של השלב מיקרוסקופ ממונע.
- אחזר את xyz האפס באמצעות הסימן שבוצעו בשלב 2.2, להגדיר מחדש את העמדות לנקודה זו הפניה על-ידי לחיצה על כפתור "לקזז כל X, Y, Z". להגדיר מחדש את מרחק מוקד לכל תפקיד.
- לרכוש סיבוב הסופי של תמונות, הגדרת התנאים הדרושים עבור פליטת קרינה פלואורסצנטית ב "תפריט בכרטיסיה בחירה גל" כדי לזהות אנטיגנים ממוקד בעבר PICC.
- בקצרה, בנוסף brightfield, להפעיל את FITC (עירור: 495 ננומטר) ו Cy3 (עירור: 550 ננומטר) אפשרויות רכישת התוכנה. השתמש 10-50 ms לחשיפה 400 ms brightfield כדי לזהות את fluorophores ולחץ על הכפתור "לולאת זמן 1", לרכוש סיבוב הסופי של תמונות.
הערה: עוצמת קרינה פלואורסצנטית עשויות להשתנות בהתאם לתוצאה PICC. שינוי משך הזמן תערוכות על מנת לקבל את איכות התמונה המיטבית.
- בקצרה, בנוסף brightfield, להפעיל את FITC (עירור: 495 ננומטר) ו Cy3 (עירור: 550 ננומטר) אפשרויות רכישת התוכנה. השתמש 10-50 ms לחשיפה 400 ms brightfield כדי לזהות את fluorophores ולחץ על הכפתור "לולאת זמן 1", לרכוש סיבוב הסופי של תמונות.
- בחר באפשרות קובץ/יצוא של התוכנה ולייצא את התמונות שתייגת פורמט קובץ התמונה (Tiff) או בתבנית משותפת קבוצת מומחים הצילום (Jpeg) אל תיקיית יעד מוגדר מראש.
- להמיר את התמונות לייצא בפורמט הנדרש על-ידי תוכנת מעקב: הכלי מעקב17 (tTt). כדי להשיג זאת, להגדיר את הקלט פלט תיקייה "tTt ממיר בכלי" הפועלים חלון, כמו גם את סמני המשמש עבור תפקידים (xy), ערוצי (c), בזמן נקודות (t), ואת לחצו על כפתור "להמיר תמונות".
הערה: התמונות חייב ישונו בהתאם להגדרות ספציפיות, הם להיות מאוחסן בתיקיות נפרדות לכל תפקיד המשמשים את הניסוי. הוראות ההתקנה, דרישות, שינוי שם של עמדות/תמונות, ושימוש בכלי מעקב זמינים להורדה בכתובת: https://www.bsse.ethz.ch/csd/software/tTt-and-qtfy.html.
4. תא ותא מעקב
- לאחר שינוי שם את הנתונים, להפעיל את התוכנה tTt. בחר משתמש tTt ושם העבודה בתיקיה.
הערה: את המעקב אחר כלי עבודה התיקיה תאחסן כל הנתונים והתוצאות המיוצא. תיקיית עבודה צריך להיקרא בשם tTtexport, המכילה תיקיות משנה בשם "AVIexport", "Configs", "TreeExport" ו- "tTtfiles". - בחר את הניסוי שיש לטעון, "ניסוי בחר תיקיה בחלון", המציינת את נתיב התיקיה שבה מאוחסן הניסוי, ולאחר מכן לחץ על כפתור "טען ניסוי".
- הפעל את הממיר קובץ יומן הרישום כדי להפוך את התמונות שנטענו לתוך תבנית שניתן לקריאה על-ידי תוכנת מעקב (לניסויים טעון בפעם הראשונה, זה יבקש באופן אוטומטי על-ידי התוכנה).
- בחר מיקום עבור מעקב על ידי לחיצה על הסימן שלה (לאחר ההמרה, סקירה כללית של עמדות שנרשם במהלך הניסויים יוצגו בחלון"פריסת המיקום"). לכל תפקיד ייוצג על-ידי סימן המורכב בתמונה של העמדה לבין מספר המקביל שלו (ראה איור 1).
- לאחר שנבחר המיקום, מוצגת רשימה של תמונות זמינות בצד ימין של "מיקום חלון הפריסה", בחר אותם ולחץ על הלחצן "לטעון תמונות".
- לאחר הטעינה הושלמה "בחלון העורך תא" מופיע, בחר את אורכי הגל ואת התמונה מרווח לבצע אחריהם מעקב בחלון"העורך תא". גל 0 מקביל brightfield, 1 מקביל FITC, 2 Cy3, ו- 3 כדי דאפי. הניסויים המתוארים כאן, שימשה מרווח 1, דהיינו, כל התמונות שנטענו. כדי להבהיר, מרווח 2 פירושו הטעינה של כל תמונה שנייה.
- לאחר טעינת התמונות, לחזור "מיקום חלון הפריסה" ולחץ פעמיים על הסמל המייצג את מיקום שנטען קודם לכן. "חלון הסרט" יופיע המאפשר את המעקב אחר לתא בודד שיש לבצע.
- בעקבות ההוראות כלי מעקב, המשך מעקב. בחרו בערוץ 0 (תואם ל- brightfield), להתאים את הבהירות והניגודיות ("התאמת גמא כפתור"). להתחיל את המעקב אחר על-ידי הקשה על מקש F2.
הערה: במהלך מעקב, התא מסומנים לאחר מכן על-ידי הצבת מצביע העכבר עליה והקשה על מקש "0". חלוקת התא, התא אפופטוזיס והלחצנים תא לאיבוד זמינים לעקוב אחר אירועים אלה תאים מסוים.
5. התוצאה הסופית
- לאחר תא בודד מעקב הושלמה, הוא צאצא מזוהה, להציל את הניסוי (הכרטיסיה תא עורך חלון/קובץ / שמור עץ הנוכחי כמו) והמשך לייצא את התוצאות.
- לייצא את שושלות היוחסין והנתונים תא "ייצוא בתפריט" ממוקם בחלון"תא העורך". באופן דומה, לייצא את התא תמונות וסרטים דרך תפריט"ייצוא" נגיש דרך החלון"סרט". תמונות, שושלות היוחסין, נתונים וסרטים ייוצאו אל תיקיית עבודה tTt.
תוצאות
השיטה המתוארת מאפשר קריטי שאלות הנוגעות ביולוגיה של התא של אוכלוסיות עצבית מרובים כדי להיפתר. למשל, היה אפשר לעקוב אחר ההתקדמות של שושלת היוחסין neurogenic ו oligodendrogliogenic של aNSCs7,8,14,18. על ידי מעקב אחר aNSCs אחד הצאצאים שלהם (איור 2 א, ב'), ניתן להדגים את aNSCs היה מבודד במבחנה לשמור על הטבע neurogenic שלהם, בעיקר להפקת neuroblasts, והציע שיעשו את רצף ב ויוו19 אבל הפגינו בעבר לא ברמה תא בודד. יתר על כן, מערכת תרבות זו מותרת חלוקות תאים אסימטרית ניתן לאבחן בפעם הראשונה בשושלת aNSC מ להלכה (איור 2B), מתן מודל ייחודי ללמוד לבטחון לאומי התחדשות עצמית8,14. באופן דומה, וללא קשר השושלת ניתח, ניתן היה להשיג נתונים חשובים לגבי צמיחת תאים, את הסיבוב של החטיבה, הכדאיות התא או אורך מחזור התא.
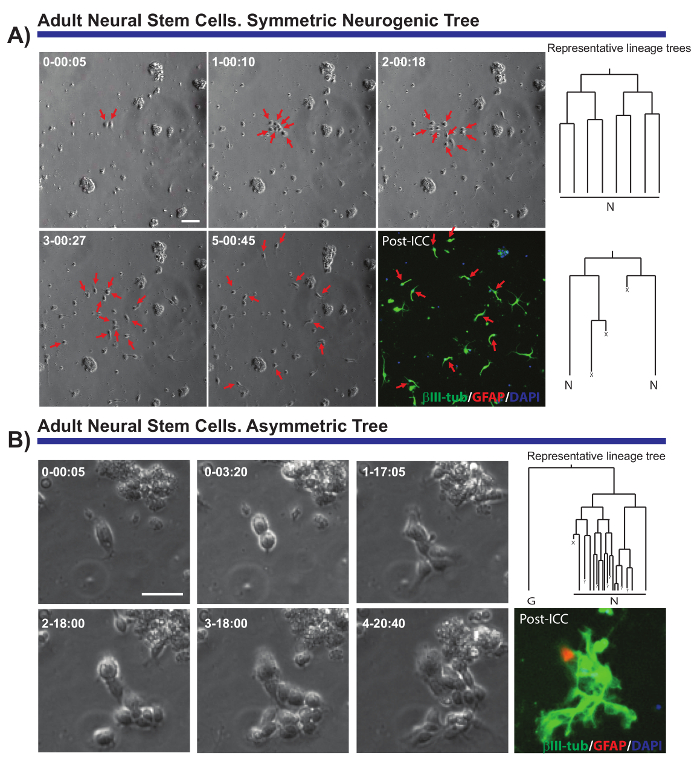
איור 2- דוגמה aNSCs מבודד להלכה, נותחו על ידי הדמיה בשידור חי, תא בודד מעקב. תמונות חדות שלב מתארים את ההתקדמות של השיבוט בנקודות זמן שונות (יום-ח': דקות). התמונה הסופית מקביל ההדמיה שלאחר immunocytochemistry (PICC) גליה החלבונים חומצי fibrillary (GFAP, אדום), βIII-טובולין (ירוק) ו- 4', 6-diamidino-2-phenylindole (דאפי, כחול). (א) ניתוח של עצים neurogenic הסימטרי באמצעות סיבובים שונים של הגברה חטיבות ליצירת פוסט-mitotic neuroblasts. חצים אדומים הצבע התאים הכלולים העצים סימטריים. מימין, שושלות היוחסין המתאים השיבוטים, שנוצר על ידי התוכנה tTt מוצגים. (B) דוגמה אב קדמון יצירת עץ neurogenic אסימטרי, עם סניף אחד העוברים הגברה חטיבות כדי לייצר neuroblasts בעת עליית נותן אחרים כדי השבתה הדרגתית GFAP תאים חיוביים עד אירוע פוטנציאל התחדשות עצמית. בצד הימין, עץ היוחסין שנוצרו על-ידי התוכנה tTt מוצג. כל העצים השושלת: "N" מתארת פוסט-mitotic neuroblasts; "G", תאים GFAP-חיוביות השבתה הדרגתית; "X", מוות של תאים; "?" תא אבוד. סרגל קנה מידה מייצג 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
חיים הדמיה, תא בודד מעקב ניתוח גם מספק מדויק readout הקיבולות הנדידה של אוכלוסיה עצבית. מידע כזה היה המתקבלים כמחנכת האסטרוציטים אסטרוציטומה להגיש פצע שריטה assay20, הפקת מידע לגבי המרחק הממוצע המאופיינת את האסטרוציטים בעת סגירת הפצע (איור 3). יתר על כן, ניתן היה לראות כי חלק האסטרוציטים לחלק במהלך תהליך הריפוי, בעוד אחרים תשארנה לאורך כל הניסוי. להפליא, אלה מחולקים נראה שהפגינו התנהגות נודדות פורה יותר מאשר מקביליהם שאינם חלוקת (נוסע פעמיים בתור רחוק בממוצע). תופעה זו עולה הזה מאוד מעניין בקיבולת האסטרוציטים ליצירת צלקת על פגיעה, אשר מדוללים החוצה ב- read-out של ניסוי ניתוח מובילים קלאסית.
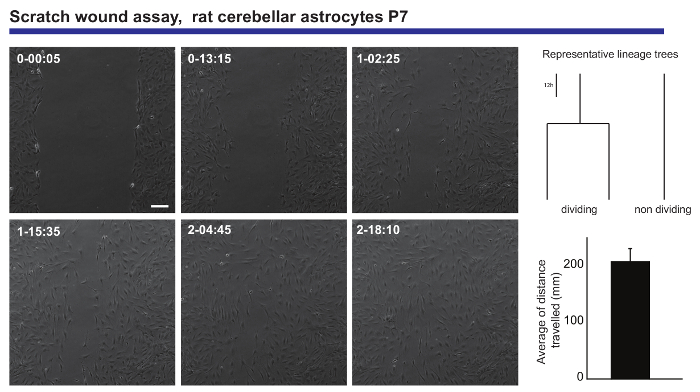
איור 3- ניתוח של ההתנהגות הנדידה של כמחנכת האסטרוציטים אסטרוציטומה ב שריטה פצע וזמינותו. תמונות חדות שלב מתארים את הפצע בנקודות זמן שונות (יום-ח': דקות). שושלות היוחסין, שנוצר על ידי תוכנה tTt, להמחיש את התנהגות נציג, מבחינת חלוקת התא, של האסטרוציטים בעת סגירת הפצע. ההיסטוגרמה מציגה את המרחק הממוצע המאופיינת את האסטרוציטים נותחו על ידי תא בודד מעקב (זאת אומרת ± S.E.M.). סרגל קנה מידה מייצג 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
תכונה מעניינת נוספת של הניסויים מיקרוסקופיה-וידאו זמן לשגות הוא היכולת להשוות התפשטות ובידול בקרב אוכלוסיה התא. בדקנו תאים N2a מצופה בתנאים לקדם הפצת (בנוכחות 10% עוברית שור סרום (FBS)) או בידול (בנוכחות 0.5% FBS + חומצה ארכידונית 10 מיקרומטר). ניתן לעקוב אחר ההתקדמות שושלת היוחסין של תאים אלה בתנאים המקדימות (איור 4A), ואילו תאים המבדילים לא להתרבות, הם יוצרים neurites (איור 4B) היה. למרבה הפלא, תא בודד מעקב אחר מותר מושבות עם שונה התפשטות יכולות להיות מכובד, התארכות neurite (נסיגה) להערכה, מתן נתונים כמותיים ומדויק לאחר מכן ניתן לייצא.
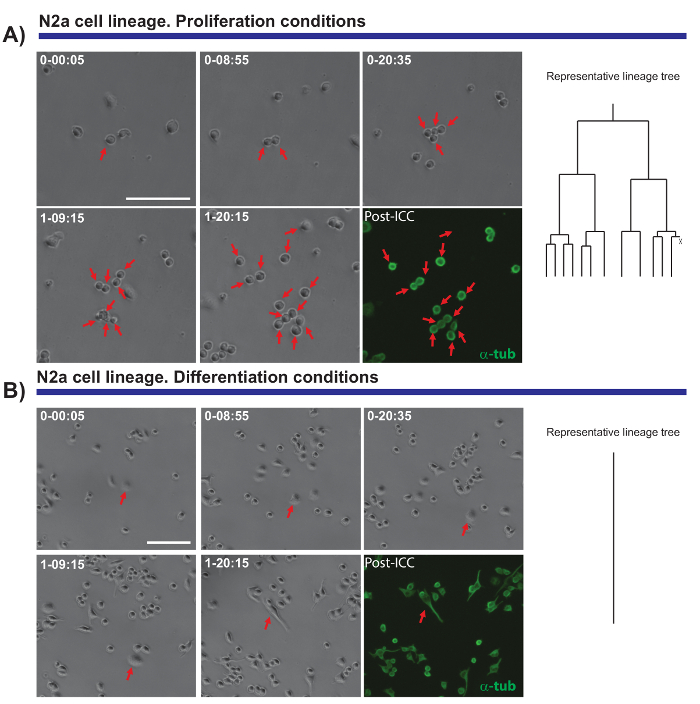
איור 4. הפיקוח על ביולוגיה של התא N2a התפשטות (A) או בידול תנאים (B). שלב חדות תמונות המתארות את ההתקדמות של השיבוט בנקודות זמן שונות (יום-ח': דקות). התמונה הסופית מקביל immunocytochemistry פוסט-דימות (PICC) עבור α-טובולין (ירוק). (א) ותא מעקב מאפשר את הסיבוב של אגף לפיקוח, כמו גם את הטרוגניות בתגובה שגשוג של תאים שונים. בצד הימין, עץ היוחסין שנוצרו על-ידי התוכנה tTt ממחיש את התנהגות שגשוג של תאים N2a. (B) התאים בתנאים בידול יציאה מחזור התא, צור neurites, תהליך זה ניתן למדוד בצורה יעילה על ידי הדמיה שלאחר ניתוח. מעקב תא יחיד, המיוצג על-ידי עץ היוחסין בצד הימין, מדגים כיצד תאים N2a לצאת מחזור התא ולהפסיק את חלוקת התא בתנאים בידול. סרגל קנה מידה מייצג 50 מיקרומטר.אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
לבסוף, חיים הדמיה, תא בודד מעקב הוא מאוד שימושי לעקוב אחר השינויים המולקולריים מורפולוגיים כאשר תאים מוגשים על התכנות. הדמיה חיה של האסטרוציטים כמחנכת transduced עם homolog Achaete-scute 1 (Ascl1) מספק נתונים חשובים לגבי שינויים מורפולוגיים המתרחשים במהלך התכנות או החסימה של חלוקת התא כאשר האסטרוציטים מתבצעת מחדש (ראה איור 5). יתר על כן, כאשר Ascl1 התמרה חושית משולב עם התמרה חושית של הבונה קידוד החלבונים פלורסצנטיות ירוק (GFP) תחת השליטה של האמרגן Cortin כפולה (DCX), זה אפשרי להגדיר את נקודת זמן מדויק כאשר עצביים סמני ספציפי מתחילים לבוא לידי ביטוי בתאי reprogrammed (איור 5). מיקרוסקופיה-וידאו בצילום מואץ גם מאפשר מספר תאים להשלים בהצלחה את התכנות לכמת, לעומת התאים מתים בתהליך זה. ניטור אירועים כאלה הובילו לזיהוי של קריטי "מחסומים" את התאים היו בהצלחה היו9.
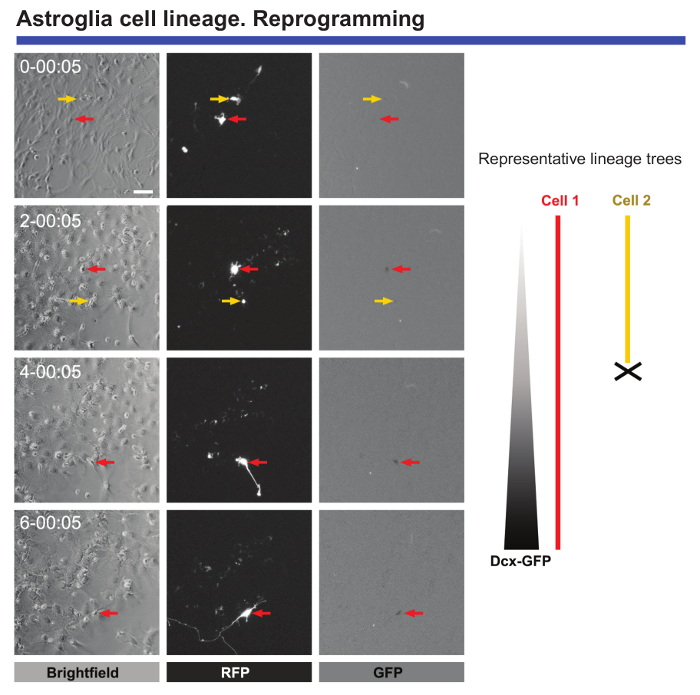
איור 5. ניתוח של כמחנכת האסטרוציטים קורטיקלית נתון התכנות עצביים. התכנות היה המושרה על ידי התמרה חושית עם פרו-neurogenic וקטורים חלבון (RFP) זריחה Ascl1-אדום. המרה עצביים אובחן על ידי שיתוף התמרה חושית וקטור קידוד GFP תחת השליטה של מקדם DCX. שלב תמונות חדות מראים את ההתקדמות של התכנות בנקודות זמן שונות (יום-ח': דקות). קרינה פלואורסצנטית תמונות של RFP והביטוי GFP, בהתאמה. חיים הדמיה ואת תא בודד מעקב אחר מותר אירועים מכריע להיות אחריו, כגון שינויים מורפולוגיים, העדר של חלוקת התא במהלך התכנות, מוות של תאים, ניתן להגדיר את הזמן המדויק מתי להתחיל מחדש תאים לבטא סמנים עצביים . סרגל קנה מידה מייצג מיקרומטר 80. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
אחד הערכים החשובים ביותר של הדמיה חיה היא האפשרות לבצע מעקב אחר שושלת היוחסין מדויק, שחקרתי היבטים קריטיים שושלת היוחסין התקדמות בקרב אוכלוסיה עצבית. השושלת עקיבה מוגדרת הזיהוי ויצרו ניטור כל צאצאים של אב קדמון יחיד, המייסד של השיבוט לעותק השכפול עוקבות של21. למרבה הפלא, שיטות אלטרנטיביות מועסק השושלת עקיבה (למשל, התמרה חושית ויראלי או כתב ססגוניות בונה21) יש חיסרון קריטי, לפיו התוצאה הסופית מבוסס על עוד תמונות, ויש לזה. לא בהכרח מהווים את הרצף כולו. משמעות הדבר היא כי מות תאים, הטרוגניות בהתנהגות של האוכלוסייה תא, דילול, יעילות מריחה או עניים סמנים, יחד עם מגבלות חשובות אחרות, להוביל הקריאות של שגוי או מוטעה של תוצאות2. יתר על כן, הדמיה חיה מאפשר לנתח את התכונות החשובות של הביולוגיה של אוכלוסיות עצבית, כגון מצב, העיתוי של חלוקת התא, צמיחת תאים, הגירה, התפשטות לעומת הבחנה, אורך מחזור התא, neurite היווצרות, המורכבות ואת אורך, התא גורל לבחירה (בידול) או המרה (התכנות).
בנוסף, הדמיה חיה יכולה בקלות השלמה עם אחרים ניתוח שנועד להשיג נתונים של תאים בודדים כגון, לדוגמה, רצפי RNA. עם זאת, כדי להשיג יתרון בשילוב הדמיה חיה והן בטכניקות אחרות מחייבת תאים אלה פיקוח בעבר בסרטים הם מאוחר יותר מחדש לזהות שנאספו בנפרד לניתוח משני. זו יכולה להיות מושגת באמצעות מיקרוסקופים הכוללים קואורדינטות לפי מיקום, על-ידי החלת כתבים פלורסנט עבור תאים ספציפיים או ניתוח ההתפלגות של קבוצות של תאים כהפניות. אכן, השילוב של הפרופיל transcriptome והתנהגות של תאים בודדים עשוי לייצג מסלול חזק התירי רמזים מולקולרי חדש מעורב הביולוגיה של תאים.
אחת הבעיות העיקריות שעלולים לפגוע ניסוי הדמיה חיה היא צפיפות התרבות תאים לקוי. כפי שצוין קודם לכן, ב צפיפות גבוהה עודף של פסולת או דיסוציאציה המסכן (סבך היווצרות) עשוי להשפיע על האיכות והרזולוציה המרחבית של התמונות, ביצוע מעקב תא ותא ישים. לפיכך, התנאים של אוכלוסיות תאים נפרדים שנבחנה צריך להיות מותאם למספר הנמוך של תאים אפשרי מבלי להתפשר על הכדאיות של התרבות תאים.
התדירות של ייבוא תמונות היא קריטית גם ומתואם צריך להיות בזהירות, במיוחד כאשר קרינה פלואורסצנטית תאורה משמש. חשיפת יתר ששודרו, במיוחד לאור זריחה עלול לפגוע תא הכדאיות. לחלופין, עיכוב מוגזמת בין התפיסה של התמונות עלולים להפריע הפתרון הזמני של הניתוח.
עוד צעד קריטי במהלך הניסוי הדמיה חיה הוא ההתאמה התקופתי של התמקדות. כשל הנכון ההגדרה/מחדש-setting של המרחק מוקד שעלולות להפריע מעקב תא בודד. יתר על כן, יש לבדוק בזהירות תא הדגירה שומרת על טמפרטורה נאותה, לחות ו- CO2 רמות, המתקנת וריאציות רצויה שעלול לגרום מוות של תאים.
בסופו של דבר, ברגע PICC בוצעה, חשוב להחזיר כראוי את התנוחה xyz אפס לפני הסיבוב האחרון של ייבוא תמונות. שגוי מחדש הגדרה של xyz האפס עלולה להקשות להתאים את התמונות חדות שלב ו- immunofluorescence, הפגיעה זיהוי צאצאים התא.
אף-על-פי גישה זו יש היבטים חיוביים רבים, מספר מגבלות על ההדמיה בשידור חי של אוכלוסיות עצבית עדיין נמשכות. למשל, צפיפות נמוכה תא הדרושים לביצוע מעקב תא בודד מוצלחת של aNSCs ככה אי אפשר להעסיק. את מבחני ביוכימיים, כגון המערבי סופג14. בנוסף, ניטור מהר חלוקת אוכלוסיות כמו האסטרוציטים אסטרוציטומה או תאים N2a מוגבלת חנותם כפי לעתים קרובות קשה מדי לעקוב אחר תאים כמו התרבויות ליד הנהרות. יתר על כן, שיטות תרבות רבות, כמו גם ההגבלות ביולוגי הגלום המשויך הבידוד של תאים, לעיתים קרובות להתפשר תא הכדאיות על תקופות ממושכות, הגבלת משך הזמן של הניסויים הדמיה בשידור חי. לבסוף, לבודד תאים מן הסביבה הטבעית שלהם יש השפעות חיוביות וגם שליליות. תאים מבודד את הנישה פיזיולוגיים שלהם עלול להיכשל לקבל אותות חשוב לווסת את ההתנהגות שלהם בזמן בו זמנית, הוא מייצג אמצעי רב עוצמה כדי לבחון את ההשפעה של האותות האלה בנפרד התקדמות שושלת היוחסין הספציפי עצבית אוכלוסיות.
בהינתן המגבלות שתוארו לעיל, ברור כי התרחיש מתודולוגי המושלם יהיה ביצוע חי הדמיה ורווק תא ניסויים מעקב תחת תנאים נורמליים פיזיולוגיים vivo בתוך. עם זאת, טכניקות הנוכחי אינם מסוגלים לעקוב אחר תאים בודדים במשך פרקי זמן ארוכים באזורים עמוקים של המוח2. לכן, העתיד של הדמיה חיה צריכים להתמקד להתגבר על מגבלה זו, שמטרתה לנתח באופן מלא את ביולוגיה של התא של תאים בודדים ויוו עם ביותר האפשרי להפרעות מזעריים ביותר של הסביבה פיזיולוגיים3.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים Gascon ביאטריס על עבודתה סיוע ואמנות באיור1. אנו מודים גם ד ר ג. נוריס על עזרתו. העבודה המוצגת כאן נתמכה על ידי מענקי מחקר, "דה אדום excelencia יוזמה תעלת יונים ספרדית Consolider-Ingenio" (BFU2015-70067REDC), רמון Fundación UCM-סנטאנדר (PR26/16-18 ב- 3), BRADE-ס (S2013/קרח-2958), MEC (BFU2014-53654-P) Areces גרנט תוכנית (PR2018/16-02). פליפה אורטגה מודה רמון y Cajal תוכנית של משרד הכלכלה הספרדית, תחרותיות (MEC: RYC-2013-13290).
Materials
| Name | Company | Catalog Number | Comments |
| Poly-D-lysine | Sigma | P0899 | Working solution 0.02 mg mL-1 |
| 24 wells plate | Falcon | 352047 | |
| Dulbecco’s modified Eagle’s medium (DMEM): F12 Nutrient Mixture medium (-L Glutamine) | Invitrogen | 21331-020 | |
| DMEM High Glucose medium | Sigma | D6546 | |
| Bovine Serum Albumin | Sigma | A6003 | |
| Triton X-100 | Merck | 11869 | non-ionic surfactant |
| Mouse anti-β III Tubulin | Sigma | T8660 | |
| Rabbit anti-GFAP | DakoCytomation | Z0334 | |
| Mouse anti-α Tubulin | Sigma | T5168 | |
| Anti-Mouse FITC | Jackson Laboratories | 715-095-150 | |
| Anti-Rabbit Cy3 | Jackson Laboratories | 711-165-152 | |
| Brightfield/Phase contrast/fluoresence microscope | Nikon | TE-2000-E | |
| CFI PLAN FLUOR DLLL 10X objetives | Nikon | Ref 280MRH10101 | |
| CFI SUPER PLAN FLUOR ELWD AMD 20X objetives | Nikon | Ref 280MRH48230 | |
| pE-300 LED fluorescence | Cool LED | Ref Number 1981 | |
| 310M-201 Incubation system (temperature) | OKO-Lab | Serial Nº VOF007307 | |
| Pro-ScanII Motorized stage system | Prior | Serial Nº 60018 | |
| High precision microscope camera version 4.2 | ANDOR Zyla | VSC-03650 | |
| Specifc software for live imaging with timelapse module: NIS-Elements AR4.5 | Nikon | NIS-Elements AR4.5 -Hasp ID: 13CE819E | |
| OKO touch Incubation system (CO2) | OKO-lab | Serial number 1716 | |
| Murine Neuro-2a Neuroblastoma Cell line | ATCC | ATCCCCL131 | |
| HEPES buffer solution 1 M | Invitrogen | 15630-056 |
References
- Conklin, E. G. The Mutation Theory From the Standpoint of Cytology. Science. 21 (536), 525-529 (1905).
- Ortega, F., Costa, M. R. Live Imaging of Adult Neural Stem Cells in Rodents. Front Neurosci. 10, 78 (2016).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nat Biotechnol. 34 (11), 1137-1144 (2016).
- Schroeder, T. Tracking hematopoiesis at the single cell level. Ann N Y Acad Sci. 1044, 201-209 (2005).
- Schroeder, T. Imaging stem-cell-driven regeneration in mammals. Nature. 453 (7193), 345-351 (2008).
- Etzrodt, M., Endele, M., Schroeder, T. Quantitative single-cell approaches to stem cell research. Cell Stem Cell. 15 (5), 546-558 (2014).
- Ortega, F., et al. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling. Nat Cell Biol. 15 (6), 602-613 (2013).
- Costa, M. R., et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro. Development. 138 (6), 1057-1068 (2011).
- Gascon, S., et al. Identification and Successful Negotiation of a Metabolic Checkpoint in Direct Neuronal Reprogramming. Cell Stem Cell. 18 (3), 396-409 (2016).
- Karow, M., et al. Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 11 (4), 471-476 (2012).
- Kleiderman, S., et al. Conversion of Nonproliferating Astrocytes into Neurogenic Neural Stem Cells: Control by FGF2 and Interferon-gamma. Stem Cells. 34 (12), 2861-2874 (2016).
- Bunk, E. C., et al. Prox1 Is Required for Oligodendrocyte Cell Identity in Adult Neural Stem Cells of the Subventricular Zone. Stem Cells. 34 (8), 2115-2129 (2016).
- Aravantinou-Fatorou, K., et al. CEND1 and NEUROGENIN2 Reprogram Mouse Astrocytes and Embryonic Fibroblasts to Induced Neural Precursors and Differentiated Neurons. Stem Cell Reports. 5 (3), 405-418 (2015).
- Ortega, F., et al. Using an adherent cell culture of the mouse subependymal zone to study the behavior of adult neural stem cells on a single-cell level. Nat Protoc. 6 (12), 1847-1859 (2011).
- Heinrich, C., et al. Generation of subtype-specific neurons from postnatal astroglia of the mouse cerebral cortex. Nat Protoc. 6 (2), 214-228 (2011).
- Jimenez, A. I., et al. Potentiation of ATP calcium responses by A2B receptor stimulation and other signals coupled to Gs proteins in type-1 cerebellar astrocytes. Glia. 26 (2), 119-128 (1999).
- Hilsenbeck, O., et al. Software tools for single-cell tracking and quantification of cellular and molecular properties. Nat Biotechnol. 34 (7), 703-706 (2016).
- Ortega, F., Berninger, B., Costa, M. R. Primary culture and live imaging of adult neural stem cells and their progeny. Methods Mol Biol. 1052, 1-11 (2013).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Yu, A. C., Lee, Y. L., Eng, L. F. Astrogliosis in culture: I. The model and the effect of antisense oligonucleotides on glial fibrillary acidic protein synthesis. J Neurosci Res. 34 (3), 295-303 (1993).
- Kretzschmar, K., Watt, F. M. Lineage tracing. Cell. 148 (1-2), 33-45 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved