A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת במבחנה נזק לדנ א שימוש Assay שביט
In This Article
Summary
שביט וזמינותו היא שיטה יעילה לאיתור נזק לדנ א כולל יחיד, כפול גדילי ה-DNA שובר. אנו מתארים שביט אלקליין ונייטרלי מבחני למדוד נזק לדנ א בתאים סרטניים כדי להעריך את השפעת טיפולי כימותרפיה.
Abstract
נזק לדנ א היא תופעה נפוצה עבור כל תא במהלך תוחלת החיים שלה, מוגדר שינוי של המבנה הכימי של הדנ א. טיפולים בסרטן, כגון רדיו, כימותרפיה, להציג כמות עצומה של נזק לדנ א נוסף, המוביל אפופטוזיס של מחזור התא מעצר כדי להגביל את התקדמות סרטן. הערכה כמותית של נזק לדנ א במהלך טיפול ניסיוני בסרטן היא צעד המפתח כדי להצדיק את האפקטיביות של סוכן genotoxic. במחקר זה, אנו מתמקדים assay אלקטרופורזה תא בודד, ידוע גם בשם השביט וזמינותו, אשר יכולים לכמת יחיד, כפול-גדיל DNA שובר במבחנה. וזמינותו שביט היא שיטה כימות של ה-DNA נזק יעיל, קל לביצוע, ויש לו דרישות הזמן/תקציב נמוך ו הפארמצבטית גבוהה. כאן, אנחנו להדגיש את התועלת של שביט וזמינותו למחקר פרה על ידי הערכת אפקט genotoxic של טיפול משולב olaparib/temozolomide לתאים glioma U251.
Introduction
וזמינותו שביט פותחה לראשונה על ידי Ostling ג'והנסון בשנת 1984 על ידי הפגנת שההעברה של ה-DNA שברים הגרעינים תחת מצב ניטראלי1. הטכניקה פותחה מאוחר יותר על ידי סינג. et al., מראה כי תנאי בסיסי גדל באופן משמעותי את ירידה לפרטים ואת הפארמצבטית assay2. מאז, וזמינותו שביט ניטרלי משמש בעיקר כדי לזהות כפול גדילי DNA מעברי, בעוד וזמינותו שביט אלקליין רגיש יותר עבור כמויות קטנות יותר של ה-DNA נזק, לרבות יחיד כפול גדיל DNA שובר, אתרי אלקלי-יציב, DNA-DNA או חלבון-דנ א cross-linking, מעברי יחיד-גדיל DNA המשויך כריתה לא שלם תיקון אתרי3,4. שני מבחני לאפשר ויזואליזציה של DNA מפוצלים, מספקים דרך פשוטה באופן כמותי להעריך נזק לדנ א. וזמינותו שביט נחשבת שיטה רגישה מחקרים רעילות גנטיים בתוך חוץ גופית וויוו , החלים על שטחי מחקר שונים, כגון מבחר סמים-המועמד מוקדם, ניטור סביבתי, אפידמיולוגיה סביבתית אנושית, ו הבסיסית מחקר נזק לדנ א ותיקון5.
עקרון וזמינותו היא תחת שדה חשמלי, DNA מפוצלים נודד אל מחוץ לגוף נוקלאואיד (הידוע גם בשם "ראש שביט") יוצרת כתם DNA הג'ל agarose (הידוע גם בשם "זנב השביט"). עם נוקלאוטיד מכתים, ניתן לכמת את מידת נזק לדנ א על-ידי ניתוח "שביט" שהוקמה על ידי אלקטרופורזה תא בודד זה. חישוב של הרגע הזנב יכול לסייע עוד יותר להשוות נזק לדנ א בין קבוצות שונות ניסיוני. לעומת שיטות מסורתיות של זיהוי ה-DNA נזק, וזמינותו שביט היא ישירה, רגיש, זולות, פשוטות יחסית.
הקרנות chemotherapies נמצאים אסטרטגיות נפוצות לטיפול בסרטן על ידי יצירת לחוט אחד, שובר זוגי גדיל DNA כרומוזום6. ההתקדמות האחרונה ב- DNA תיקון מעכבי מאפשר השפעה genotoxic יעיל יותר על-ידי שילוב כימותרפיה, לכן, פוטנציאל מפחית את תופעות מערכתיות כגון אנמיה, דלקת ו מח עצם דיכוי7, 8. במחקר זה, הראנו החקירה של מעכב פולימראז (PARP) פוליפוני (ADP-ריבוז), olaparib (אולה)9. PARP הוא חלבון גרעיני בשפע והוא אחראי על DNA כריתה הבסיס לתקן על ידי יצירת פולימר פוליפוני (ADP-ריבוז)10. Temozolomide (TMZ) הוא סוכן החומר זמין, כבר בשימוש נרחב לטיפול החולה glioma. באמצעות וזמינותו שביט לכמת נזק לדנ א, נדגים שילוב olaparib עם temozolomide עמוקות מגבירה את הנזק ה-DNA בתאי glioma, אשר מציע טיפול משולב olaparib/temozolomide היא אסטרטגיית יעיל לטיפול glioma, לעומת לבד temozolomide11.
Protocol
1. להכין ריאגנטים
- 1 x PBS
- לדלל PBS 10 x 100 מ עם 900 מל dH 2 O ולהתאים את ה-pH ל 7.4 באמצעות מד pH. חנות בטמפרטורת החדר.
- פירוק פתרון (LS)
- להכין 2.5 M NaCl, EDTA ניתרן 100 מ מ, 10 מ מ טריס בסיס ו-200 מ מ NaOH 900 מל dH 2 O; זה בדרך כלל לוקח בערך 20 דקות כדי לאפשר את התערובת עד התמוססות מלאה. להתאים את ה-pH 10 באמצעות מד pH. להוסיף 1% נתרן לאוריל sarcosinate ו 1% X-100 טריטון, ולכוונן את העוצמה הסופי 1,000 מ ל. מגניב עד 4 ° C במשך לפחות 30 דקות לפני השימוש.
- הפתרון אלקטרופורזה אלקליין (AES), pH > 13
- להכין 200 מ"מ NaOH, 1 מ ניתרן EDTA 800 מ ל dH 2 O. התאם את ה-pH, לוודא כי זה pH > 13. לכוון את עוצמת הקול הסופי 1,000 מ. להפוך טריים לפני השימוש. ומגניב עד 4 ° C במשך לפחות 30 דקות לפני השימוש.
- Sollution אלקטרופורזה נייטרלי (נס)
- מאגר אלקטרופורזה נייטרלי mL 1,000 להכין על ידי ערבוב 100 מ מ טריס 300 מ"מ, בסיס סודיום אצטט 1,000 מ ל dH 2 O. התאם את ה-pH ל 9.0 עם חומצה אצטית. מגניב עד 4 ° C במשך לפחות 30 דקות לפני השימוש.
- DNA משקעים פתרון (DPS)
- הכנה של 10 מ ל 7.5 מ' אמוניום אצטט מניות. עבור 50 מל ' של ה-DNA משקעים פתרון, מערבבים 6.7 מ ל 7.5 מ' אמוניום אצטט עם 43.3 מ ל 95% אתנול. חנות בטמפרטורת החדר.
- Staining פתרון
- µL 1 להוסיף 10,000 x כתם ירוק ניאון חומצת גרעין (למשל, SYBR Green) ב 30 מ ל טריס-EDTA מאגר (טריס-HCl, EDTA ניתרן 1 מ מ, 10 מ מ pH 7.4) וחנות ב-4 ° C. הגן על מ אור-
- 1% נמוך נמס agarose
- להמיס התכה נקודת agarose (1 גרם 100 מ ל dH 2 O) במיקרוגל נמוכה 1%. מערבולת agarose כל 15-20 s כדי לוודא agarose מותך לחלוטין. מניחים את agarose באמבט מים 37 º C למשך לפחות 20 דקות לפני השימוש.
- פיפטה חם מראש טיפים
- לחתוך את הקצוות הצרים של P200 פיפטה טיפים על ידי 3 מ מ וחמים ב 37 מעלות צלזיוס לפני pipetting agarose.
2. להכין שביט שקופיות
- שקופית ציפוי
- להמיס 1% agarose (1 גרם 100 מ ל dH 2 O) במיקרוגל למשך 2-3 דקות או עד agarose זה לגמרי מותכת. טובלים את שקופיות מיקרוסקופ זכוכית לתוך agarose ונגב בצד אחד של השקופית באמצעות מגבון נטולת מוך.
- להניח את השקופיות על משטח שטוח מילה נהדרת או חום ב 50 מעלות צלזיוס לייבוש מהיר יותר; סרט שקוף agarose צריך להיווצר לאחר הייבוש. מקם את השקופיות מצופה ב- 37 מעלות צלזיוס לפני השימוש.
- הכנה של תא בודד המתלים
- התרבות ועל לטיפול התא glioma
- התרבות התאים מ ג U251 F-12 DMEM-חזיר בינוני בתוספת 10% FBS, פניצילין U/mL 100 ו- 10 סטרפטומיצין µg/mL-37 & # 176; C עם 5% CO 2.
- לעכל את התאים באמצעות טריפסין 1 מ"ל למשך 3 דקות, ולנטרל טריפסין באמצעות DMEM-חזיר F-12 בינוני עם FBS. לאסוף בצינור 15 מ"ל, ספין ב g x 300 במשך 4 דקות, תשאף המדיום, וכן להשעות תאים בחלק 2 x 10 5 תאים למ"ל ב- PBS 1 x.
הערה: המדגם התא צריך להיות מוכן מיד לפני תחילת וזמינותו ויש לטפל כל דוגמאות בסביבה כהה או מעומעמים כדי למנוע נזק לדנ א של אור- - לשלב התליה תא עם 1% agarose נקודת התכה נמוכה מותכת (ב 37 מעלות צלזיוס) ביחס של 1:10 (v/v), לערבב בעדינות על ידי pipetting למעלה ולמטה, מיד פיפטה µL 30 לשקופית. השתמש בצד כף הטיפ פיפטה להפיץ את התערובת תא agarose על מנת להבטיח את היווצרות שכבה דקה.
- למקם את השקופית שטוח 4 ° C בחושך במשך 10 דקות הגדלת הזמן ג'לי 30 דקות משפר את דבקותה של דגימות בסביבות לחות גבוהה.
- לטבול את השקופית ב 4 ° C LS בחושך 1 h ללון.
- התרבות ועל לטיפול התא glioma
3. יחיד אלקטרופורזה תא
- להמשיך לשלב אלקליין (3.2) או נייטרלי (שלב 3.3) שביט assay
- עבור assay שביט אלקליין
- להסיר בעדינות שקופיות LS לנקז עודף מאגר, בעדינות לטבול AES עבור 1 h-4 ° C כדי לאפשר רגיעה הדנ א. לשמור את השקופיות בחושך.
- הוסף AES טרום מקורר במגש שקופית אלקטרופורזה, לא יעלה על 0.5 ס מ מעל השקופיות (זה תלוי בגודל של היחידות אלקטרופורזה), מקום של שקופיות בתוך ולכסות עם כובע. הגדר המתח V 1/ס מ (האורך בין האלקטרודות) ולהפעיל למשך 30 דקות ב- 4 מעלות צלזיוס
- ניקוז עודפי אלקטרופורזה פתרון משקופית לשקופית. בעדינות לטבול פעמיים בשקופיות dH 2 O עבור 5 דקות כל בטמפרטורת החדר.
- לטבול בעדינות שקופיות אתנול 70% למשך 5 דקות בטמפרטורת החדר. המשך לשלב 4.
- עבור שביט נייטרלי assay
- בעדינות להסיר את השקופיות האם לנקז עודף מאגר, בעדינות לטבול נס למשך 30 דקות ב-4 ° C. לשמור השקופית בחושך.
- הוסף מאגר מראש צוננת אלקטרופורזה נייטרלי במגש שקופית אלקטרופורזה, לא יעלה על 0.5 ס מ מעל שקופיות (זה תלוי בגודל של היחידות אלקטרופורזה), מקום של שקופיות בתוך ולכסות עם כובע. הגדר המתח V 1/ס מ (האורך בין האלקטרודות) ולהפעיל למשך 45 דקות ב-4 מעלות צלזיוס
- ניקוז מאגר עודף מהשקופיות. בעדינות לטבול בשקופיות DPS למשך 30 דקות בטמפרטורת החדר.
- לטבול בעדינות את השקופיות אתנול 70% למשך 30 דקות בטמפרטורת החדר. המשך לשלב 4.
4. כתם כוכב השביט שקופיות
- יבש שקופיות ב 37 מעלות צלזיוס למשך 10-15 דקות בחושך.
- במקום 50-100 µL ירוק ניאון חומצת גרעין מכתים פתרון על גבי כל אחד מיובש agarose, הכתם למשך 15 דקות בטמפרטורת החדר בחושך.
- שוטפים את השקופיות בקצרה dH 2 O ומייבשים לחלוטין ב 37 מעלות צלזיוס בחושך. להמשיך ייבוא תמונות וניתוח.
5. תמונה של רכישת ניתוח
הערה: ויזואליזציה של כימות של ה-DNA מעברי מבוססים על מיקרוסקופ epifluorescence את התוכנה assay שביט (ראה טבלה של חומרים) 12 .
- מקום השקופיות על המיקרוסקופ עם בעל שקופיות. ודא שהג'ל agarose פונה על העדשה אובייקטיבי. באופן אקראי ללכוד תמונות משקופיות שביט מוכתם באמצעות מיקרוסקופ זריחה עם עדשה המטרה 10 x. להימנע הקצוות ואזורים סביב כל בועות האוויר. זנב השביט
- ודא כל מופץ בצורה אופקית. שביט ראשי צריכה לנבוע שמימין ואת הזנב מימין.
- לשמור כל תמונה בפורמט TIF בינארי עם כתם בהיר דנ א, רקע כהה. טעינת תמונות באמצעות התוכנה " בחר קבצים כדי לנתח " כפתור, הנמצא בצד השמאל של סרגל הכלים. חלון התצוגה של התמונה אמורה להופיע ( איור 1).
- לצייר מסגרת מדידה על המסך ולהתאים את גודלו לפי כוכב השביט של התא. לחץ " התאם " כפתור כדי להגדיר את הסף של הראש, שביט, הזנב לפי התמונה ולאחר מכן לחץ על " להתחיל מדידות " לחצן ( איור 1).
- בחר תא באמצעות המסגרת ולהפעיל את המדידה על ידי לחיצה עם העכבר על " Assay כוכב השביט " לחצן; עוצמת של התמונה מופיע " פרופילים " חלון עם הפרמטרים מדידה שנבחרה. ניתן לשמור את התוצאות על-ידי לחיצה " לאחסן תוצאות " לחצן ( איור 1).
הערה: התוכנה מחשבת את הפרמטרים כולל אורך הזנב שביט, האחוז של ה-DNA זנב, מהרגע הזנב (TM) וברגע הזנב זית (OTM). הרגעים הזנב מחושבים לפי הנוסחאות כדלקמן:

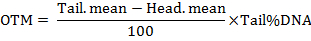
- לנתח לפחות 50 תאים לכל טיפול.
תוצאות
בפרוטוקול הנוכחי מתאר צעד אחר צעד זרימת עבודה כדי להפוך את כוכב השביט וזמינותו של ביצוע ניתוח נתונים (איור 1). תוצאות מבחני שביט אלקליין ונייטרלי הראה כי זנב השביט של תאים U251 שטופלו דוקסורוביצין (1 מיקרומטר, 20 h) היה ארוך וכי היה בעוצמה גבוהה יותר דנ א, רומז ה?...
Discussion
וזמינותו שביט הוא כלי יעיל למדידת יחיד כפול-גדיל DNA ומעברי ברמה התאית. וזמינותו הוחל נרחב בתור "תקן הזהב" מחקרים בנוגע genotoxicity, אפידמיולוגיה סביבתית13, החל נגעים הבסיס, DNA crosslinks, פיתוח תרופות, ואתרים אלקליות רגיש. במחקר הנוכחי, הראנו שני פרוטוקולים ברורים צעד אחר צעד עבור מבחני שב?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
מחקר זה נתמך על ידי תוכנית מחקר מגזר של NIH, NCI, CCR. כל המחברים קיבל מענק מחקר מגזר NIH, NCI, CCR.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 10x PBS(Ca++, Mg++ free) | TEKnova | P0196 | |
| NaCl | Sigma | S5886 | |
| EDTA | TEKnova | E0308 | |
| Trizma base | Sigma | T1503 | |
| NaOH | Sigma | 72068 | |
| Sodium lauryl sarcosinate | Sigma | L7414 | |
| Triton X-100 | Sigma | 93443 | |
| Sodium acetate | Sigma | 32318 | |
| Glacial acetic acid | Sigma | 695092 | |
| Ammonium acetate | Sigma | A1542 | |
| SYBR Green | Invitrogen | S33102 | |
| Low melting point agarose | Invitrogen | 16520 | |
| Agarose | Invitrogen | 16500 | |
| 95% ethanol | WARNER-GRAHAM | #64-17-5 | |
| Trypsin | GIBICO | 25300-054 | |
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| Glass tissue slides | ELECTRON MICROSCOPY SCIENCES | 63422-11 | |
| Kimwipes | KIMberly-Clark | ||
| 1.5 mL Microcentrifuge Tubes | DENVILLE | ||
| Pipette Tips | SHARP | ||
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Microwave | Avanti | ||
| Waterbath | PRECISION | ||
| Horizontal electrophoresis chamber | TREVIGEN | Cometassay ES II | |
| Power supply | Bio-Rad | ||
| Incubator | Quincy Lab | Model 12-140E | |
| Fluorescent microscope | Zeiss | LSM700 | |
| Micropipettor | Eppendorf |
References
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem Biophys Res Commun. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 175 (1), 184-191 (1988).
- Tice, R. R., et al. Single cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen. 35 (3), 206-221 (2000).
- Shah, A. J., Lakkad, B. C., Rao, M. V. Genotoxicity in lead treated human lymphocytes evaluated by micronucleus and comet assays. Indian J Exp Biol. 54 (8), 502-508 (2016).
- Azqueta, A., Collins, A. R. The essential comet assay: a comprehensive guide to measuring DNA damage and repair. Arch Toxicol. 87 (6), 949-968 (2013).
- Goldstein, M., Kastan, M. B. The DNA damage response: implications for tumor responses to radiation and chemotherapy. Annu Rev Med. 66, 129-143 (2015).
- Gavande, N. S., et al. DNA repair targeted therapy: The past or future of cancer treatment?. Pharmacol Ther. 160, 65-83 (2016).
- Torgovnick, A., Schumacher, B. DNA repair mechanisms in cancer development and therapy. Front Genet. 6, 157 (2015).
- Weston, V. J., et al. The PARP inhibitor olaparib induces significant killing of ATM-deficient lymphoid tumor cells in vitro and in vivo. Blood. 116 (22), 4578-4587 (2010).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA Repair in Cancer: Beyond PARP Inhibitors. Cancer Discov. 7 (1), 20-37 (2017).
- Lu, Y., et al. Chemosensitivity of IDH1-Mutated Gliomas Due to an Impairment in PARP1-Mediated DNA Repair. Cancer Res. 77 (7), 1709-1718 (2017).
- Konca, K., et al. A cross-platform public domain PC image-analysis program for the comet assay. Mutat Res. 534 (1-2), 15-20 (2003).
- Valverde, M., Rojas, E. Environmental and occupational biomonitoring using the Comet assay. Mutat Res. 681 (1), 93-109 (2009).
- Collins, A. R. The comet assay for DNA damage and repair: principles, applications, and limitations. Mol Biotechnol. 26 (3), 249-261 (2004).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Sci Rep. 4, 7200 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved