A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חוקרים את מזיקה אפקטים של נמוך לחץ פלזמה עיקור על ההישרדות של Bacillus subtilis הנבגים באמצעות Live התא מיקרוסקופ
In This Article
Summary
פרוטוקול זה ממחיש את הצעדים החשובים רצופים הנדרש כדי להעריך את הרלוונטיות של ניטור חיוניות פרמטר בתהליכי תיקון ה-DNA להחיות Bacillus subtilis נבגים לאחר הטיפול עם לחץ נמוך פלזמה על-ידי מעקב מתויג פלורסצנטיות DNA תיקון חלבונים באמצעות מיקרוסקופ אלקטרונים זמן לפתור קונפוקלית וסריקה.
Abstract
פלזמה-עיקור הוא אלטרנטיבה מבטיחה שיטות העיקור קונבנציונאלי למטרות תעשייה, קליני, ומטרות בחלל. לחץ נמוך פלזמה (LPP) הפרשות מכיל קשת רחבה של מינים הפעילים, אשר להוביל איון מיקרוביאלי מהירה. ללמוד את היעילות ואת מנגנוני עיקור מאת ל"י/נ, אנו משתמשים נבגים של האורגניזם מבחן Bacillus subtilis בגלל עמידותם יוצאת דופן מפני תהליכי עיקור קונבנציונלי. אנו מתארים את הייצור של B. subtilis נבג monolayers, תהליך עיקור פלזמה לחץ נמוך ב כור פלזמה inductively בשילוב כפול, אפיון מורפולוגיה נבג באמצעות מיקרוסקופיית אלקטרונים סריקה (SEM), ו ניתוח של נביטה, תוצר של נבגים על ידי מיקרוסקופ תא חי. יעד עיקרי של מינים פלזמה הוא חומר גנטי (DNA), תיקון פלזמה-induced נגעים DNA בעת התחייה נבג הוא חיוני להישרדות של האורגניזם. כאן, אנחנו לומדים את קיבולת נביטה של נבגים ותיקון התפקיד של ה-DNA במהלך נבג, תוצר לאחר הטיפול עם ל"י/נ באיתור מתויג fluorescently DNA תיקון חלבונים (רקה) עם זמן לפתור פלורסצנטיות קונאפוקלית מיקרוסקופ. מטופלים, נבג לא מטופל monolayers הם מופעלים עבור נביטה, דמיינו במיקרוסקופ הפוכה קונאפוקלית תא חי לאורך זמן לעקוב אחרי התגובה של נבגים בודדים. התצפיות שלנו לחשוף השבר של הנבטת ו. הנוכחי נבגים תלויה משך הטיפול-LPP להגיע למינימום לאחר 120 ס' רקה-YFP קרינה פלואורסצנטית (חלבון פלורסצנטיות צהוב) זוהה רק כמה נבגים ופיתח בכל . הנוכחי תאים עם העלאה קלה בנבגים שטופלו ל"י/נ יתר על כן, חלק מהחיידקים וגטטיבי נגזר שטופלו LPP נבגים הראו עלייה ציטופלזמה, נטו lyse. השיטות שתואר לניתוח של נבגים בודדים יכול להיות למופת לחקר היבטים אחרים של נבג ותוצר.
Introduction
יעד מרכזי של חקר החלל הוא החיפוש אחר חתימות של צורות חיים ושל מולקולות על גופים פלנטריים וירח אחרים במערכת השמש שלנו. העברת מיקרואורגניזמים או מולקולות כדור הארץ לאזורים קריטי של חקר הוא סיכון מסוים לפגיעה פיתוח, שלמות של החיים-זיהוי משימות על גופים פלנטריים כגון מאדים ואת אירופה1. ההנחיות הבינלאומי של הגנה על כוכבי הלכת, הוקמה על ידי הוועדה של שטח מחקר (COSPAR) בשנת 1967, לכפות חוקים נוקשים על משימות רובוטיות ומזומן כוכבי לכת אחרים, ירחים שלהם, אסטרואידים וגופים שמימיים אחרים ולווסת ניקוי ועיקור של חללית, רכיבי חומרה קריטיים מוקדמת להשיק כדי לשלול זיהום מיקרואורגניזמים יבשתי ולמנוע זיהום לחצות של גופים שמימיים2. במהלך העשור האחרון, היישום של הלא-thermal פלזמות צבר רחב לב במחקר ביו-רפואי, תזונה, כמו גם בחלל יישומים3,4,5. פלזמה-עיקור הוא אלטרנטיבה מבטיחה שיטות העיקור קונבנציונאלי כפי שהוא מציע איון חיידקים מהיר ויעיל6, בעת היותו עדין כדי רגיש וחומרים יציב חום. פלזמה הפרשות מכילות תערובת של תגובתי סוכני כגון פוטונים אולטרה סגול (UV) ולאחר ספקטרום אולטרה סגול ואקום (VUV) אשר להוביל איון מיקרוביאלי מהירה3אטומים מתרגש/נייטרלי, חלקיקים טעונים, רדיקלים חופשיים. במחקר זה, אנו משתמשים בלחץ נמוך פלזמה שנוצר על ידי זוגי בשילוב inductively פלזמה בלחץ נמוך (DICP) מקור7,8 כדי להשבית Bacillus subtilis endospores מופץ על זכוכית בדיקת השטח.
חיידקים גראם חיוביים של משפחת Bacillaceae מופצים באופן נרחב בבתי-גידול טבעיים של אדמה, משקעים אוויר כמו כמו דופן סביבות כגון מתקני חדר נקי, תחנת החלל הבינלאומית9,10 ,11. התכונה ברורים ביותר של הסוג של Bacillus היא יכולת ליצור עמידים מאוד endospores רדום (ןלהל נבגים) כדי לשרוד את התנאים שלילי, כגון דלדול מזין12. הנבגים עמידים בדרך כלל הרבה יותר מאשר עמיתיהם תא וגטטיבית מגוון של טיפולים, לחצים סביבתיים, כולל חום, UV, הקרנה גמא, לייבוש, הפרעה מכנית של כימיקלים רעילים, כגון המחמצנים חזק או סוכני שינוי ב- pH (נבדקה הפניות13,14) ולכן הם אובייקטים האידיאלי לבדיקת היעילות של שיטות איון מיקרוביאלי. מאז הדנ א הגנומי יעד עיקרי של טיפול פלזמה של15,חיידקים16, תיקון פלזמה-induced נגעים דנ א (למשל שוברת הד כפול) על נבג התחייה חיונית להישרדות של חיידקים13, 17.
לכן, אנחנו לומדים את קיבולת נביטה של נבגים ואת התפקיד של DNA לתקן במהלך נבג, תוצר לאחר בטיפול את הנבגים עם לחץ נמוך ארגון פלזמה על-ידי נבגים בודדים הבאים ותיקון שלהם ביטוי של DNA מתויג קרינה פלואורסצנטית חלבון רקה עם מיקרוסקופ פלורסצנטיות קונאפוקלית זמן לפתור. אנחנו נותנים הוראה צעד אחר צעד של הכנת B. subtilis נבגים ב monolayers להשגת תוצאות הבדיקה לשחזור, הטיפול של ספורה monolayers עם לחץ נמוך פלזמה עבור עיקור, הכנת פלזמה מטופלים נבגים עבור ultrastructural הערכה באמצעות מיקרוסקופ אלקטרונים סריקה (SEM), וניתוח מיקרוסקופיה של תא חי ברמה של נבגים בודדים בהופעה עם ניטור פעיל הדנ א תיקון תהליכים המתרחשים בתוך התא בתגובה טיפול פלזמה.
Protocol
1. ייצור נבג bacillus subtilis , טיהור
- לייצור נבג, להעביר לילה מ ל תרבות של בהתאמה זן B. subtilis , בתוספת אנטיביוטיקה מתאימה, 200 מ ל כפול-כוח נוזלי שפר הנבגה לבינוני (לכל ליטר 16 גרם מרק מזין, אשלגן כלורי 2 g, 0.5 ג'י MgSO 4* 7 שעות2O, 2 מ ל 1 מ' Ca (3)2, 2 מ ל- 0.1 M-MnCl-2 * • 4 H2O, 2 mL מ"מ 1 מכל4, 2 מ ל- 50% (w/v)-גלוקוז-18) ולטפח אותו עם לערבב נמרצת ב 37 ° C 72 h או עד > 95% של התרבות יש sporulated. הנבגים של זנים הבאים משמשים: B. subtilis PY79 (סוג פראי) B. subtilis PY79Δרקה:: ניאו (לקויה של חלבון תיקון ה-DNA רקה) PY79 B. subtilis רקה-yfp:: חתול (רקה התמזגו עם צהוב חלבון פלואורסצנטי [YFP]19).
- הקציר נבגים על ידי צנטריפוגה למשך 15 דקות ב 3000 g x 50 מ ל צינורות ולטהר את הדוגמאות על-ידי כביסה חוזרות שלבים (עד 15 פעמים) באמצעות סטרילי מזוקקים H2O ולבדוק לקבלת מעמד של טוהר, נביטה על-ידי ניגודיות שלב מיקרוסקופ. ודא נבג המתלים מורכבות מתוך שלב בהיר נבגים (> 99%) הינם ללא תאים וגטטיבי (מוטות), נבגים מונבטים (מראה שחור / אפור) ופסולת תאים, אחרת עוד ניסויים מיקרוסקופ יכול לעשות. לשטוף את הדגימה עד טוהר הרצוי.
- קבוע כייל הנבג על ידי ציפוי החוצה µL 50 של דילולים טורי 10-fold על LB-אגר (קרי: שימוש 30 מדגם µL + 270 µL במים סטריליים לקבלת 1:10 דילול. לקחת µL 30 מ דילול מסוים 270 µL H2O לדילול מטריים וכך הלאה) לחשב את CFU (המושבה יוצרי יחידות), דגירה הלוחות ב 37 מעלות צלזיוס למשך הלילה. לאחר CFU נחישות, להתאים את הדגימה כדי נבגים9 10 לכל mL ריכוז או דילול עם מים סטריליים.
2. דגימה הכנת שהופקדו תרסיס Bacillus subtilis נבגים
הערה: הצטברות חופפים של נבגים עשויים לגרום צל אפקטים במהלך הטיפול, בסופו של דבר וכתוצאה קינטיקה איון זייף. כדי למזער את הבעיה, הכן נבג בדגימות באמצעות טכניקה העדות תרסיס20. בקצרה, שולט הצינור 2-חומר ברמת דיוק גבוהה עם שעון העצר של חשמלי המווסת את התפוקה נוזלי בהופעה עם הזרם המוביל בלחץ גז (כאן N2). לפזר את הדגימה נוזלי מוזרק דרך שקע זרבובית באמצעות זרימת גז חנקן.
- מקום נשא לדוגמה בטופס של שקופיות מיקרוסקופיים סטיריליים (עבור הישרדות קינטיקה) או עגולה coverslips 25 מ מ (לצורך מעקב פלורסנט של DNA לתקן תהליכים/cLSM; סריקת מיקרוסקופ לייזר קונפוקלי) בתוך בתרסיס המופעלים חשמלית ריסוס יחידה מזדהים עם הזרבובית. ריכוז נבג משומש צריך להתאים לחצית הריכוז הסופי הרצוי.
- העברת 1 מ"ל של התרבות נבג לים נוזלים זרבובית וליזום את תהליך התזת של 0.1 s, בלחץ של 1.3 בר. נבג מותז ההשעיה (1 x 107) טפסים סרט דק בשקופית מיקרוסקופיים מתייבש במהירות בתוך שניות כדי ליצור טפט של נבג מבוזרות בצורה אחידה. חנות נשאיות שטופלו הדגימה במיכל סטרילי בטמפרטורת החדר.
3. טיפול פלזמה לחץ נמוך
- להכין את מערכת פלזמה לטיפול של דגימות ביולוגיות, להפעיל את המערכת-5 הרשות הפלסטינית עם ארגון פלזמה-500 ואט במשך 5 דקות. על ידי זה, כל המשטחים במערכת הם מנקים את לחמם. זה מפחית דבק של מולקולות של אויר, כלומר חנקן, חמצן ומים, תוך אוורור המערכת. לאחר רעלני של המערכת, לפרוק את התא, למקם את הדוגמאות בזהירות במרכז הספינה הכור בעזרתו של ארונות זכוכית.
- השתמש משכפל ביולוגית לפחות שלושה. לסגור את התא ותתפנה מתחת 2 אבא אחר כך, מילוי הגז תהליך לתוך החדר. לווסת את הלחץ במערכת כדי 5 הפלסטינית.
- אחרי הפעם תהליך מוגדר, לבטל את אספקת חשמל וגז, בזהירות לפרוק את המערכת כדי למנוע לפוצץ את הדגימות ממחזיק מדגם. לאחר אוורור, להסיר את הדגימות ולמקם את הדגימות עבור הפרמטר הבא במערכת. עבור פקדים שאינם פלזמה-מטופלים לחשוף דגימות אבק בלבד (5 הרשות הפלסטינית) בנוכחות של הגז תהליך מקביל לזמן הארוך ביותר יישומית פלזמה.
4. שחזור והערכה של הישרדות נבג
- להכין פתרון של בלוק 10% דבק פלסטי (PVA), לכסות המוביל מדגם בזהירות עם-500 µL ולתת להם air-dry עבור 4 h רצועת את השכבה PVA מיובשים (מכיל כעת המדגם נבג) באמצעות מלקחיים סטרילי והעברתה 2 מ ל תגובת הרכבת התחתית. להוסיף 1 מ"ל של מים סטריליים הצינור, להמיס את שכבת PVA ויה vortexing. הליך זה מוביל > 95% התאוששות של נבגים ואינו משפיע על היכולת שלהם נביטה21.
- באופן סדרתי לדלל את הדגימה ב 1:10 במים סטריליים בצלחת 96-ובכן (קרי 270 µL סטרילי H2O + דילול מדגם/לשעבר 30 µL). צלחת החוצה µL 50 של כל דילול על Lysogeny מרק מזין אגר (ליברות), דגירה הלוחות ב 37 מעלות צלזיוס למשך הלילה ולספור את מספר מושבות מבוגר (CFU).
5. חיים התא מיקרוסקופ ומעקב תהליכי תיקון ה-DNA הנבטת נבגים
- לניסויים נביטה, להכין 1 מ"מ עובי 1.5% LB-אגר פנקס, הרתחה 700 µL בינונית, pipet אותו לתוך צלחת פטרי מיקרוסקופ סטרילי. לאחר 10 דקות, לגזור 8 מ"מ x 8 מ"מ x 1 מ מ LB-אגר pad עם איזמל סטרילי ולהעביר את אגר בזהירות על גבי monolayers נבג אשר מונחות על coverslips זכוכית דקה 25 מ מ.
הערה: שלב זה הוא קריטי עבור ויזואליזציה של נבגים בודדים ולאפשר בעקבות התגובה שלהם, לקראת ההפעלה של נביטה שנגזרות אגר מזין. לפיכך, LB-אגר משמשת לשתי מטרות, (1) כדי לתקן את הנבגים על פני השטח, אשר מונע relocalization לאורך פני השטח, ממוקד אופטי, ו- (2) כדי להפעיל את הנבג עבור נביטה. - לאחר המכסה את הדגימה עם אגר, להעביר coverslip זכוכית במהירות לתוך תא הדמיה מיקרוסקופ הדגימות עם קונאפוקלית סריקה בלייזר במיקרוסקופ אוטומטי עם אופטיקה הפוכה באמצעות 63 X / 1.3 מטוס apochromatic שמן טבילה אובייקטיבי.
-
בצע הדמיה של קרינה פלואורסצנטית (YFP) עם עירור אורך גל של nm ו פליטה 514 ניתן להבחין בין 520 ו 560 ננומטר.
- תמונות מלון הרשומה בהיר-שדה באחת מכפילי צילום (נתיב אור ששודרו) במצב סריקה.
- להקליט סדרת בצילום מואץ עם כוח לייזר של 2.6%, וקבעו את הצמצם קונאפוקלית ל 5 יחידות אוורירי, בתדר דגימה של מסגרת 1 לכל 30 s מ- 0 h עד 5 שעות, תלוי בניסוי. . זה בולטת במיוחד כי מינונים גבוהים של מונוכרומטי לייזר תאורה-514 nm לחלוטין לעכב נביטה (איור 1א', ב').
- שומרים את הדגימות ב 37 מעלות צלזיוס (לחות אויר) בשלב חימום במהלך התהליך הדמיה. עבור כל תנאי לצפות בקבצים יש להשתמש בתוכנת עריכה התומכת בפורמט משכפל ביולוגית לפחות שלושה. במקרה של צבירת נבג, נבג מרובה שכבות הפצה או זיהום על ידי חלקיקי אבק, חסימה של הטיפול פלזמה ("צל") עלולה להתרחש ולאפשר נביטה של נבגים מוצלל (איור 1C, D).
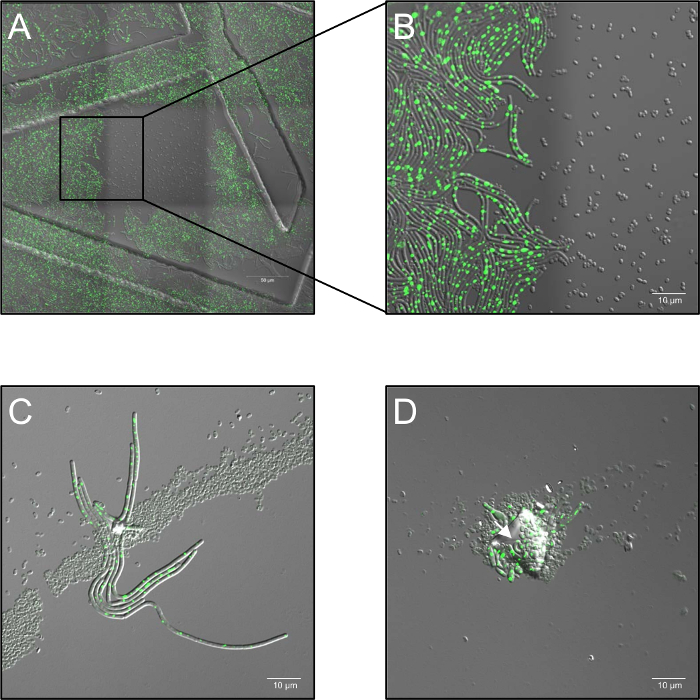
איור 1: בעיות פוטנציאליות ציין במהלך תא חי קונאפוקלית מיקרוסקופ פלורסצנטיות פלזמה מטופלים נבגים. (A, B) עיכוב של נבג נביטה על ידי מינונים גבוהים של מונוכרומטי (514 ננומטר) לייזר תאורה. (א) סקירה (3 x 3 מסגרות תפור) של B. subtilis (LAS72, רקה-YFP) נבגים 180 דקות לאחר החניכה של נביטה. המסגרת באמצע נחשף במרווחי s 30 למינונים גבוהים של אור לייזר (514 ננומטר, עוצמת הלייזר 70%), ואילו האזורים שמסביב (= מסגרות) היו לא מואר (התמונה הממוזגת של שדה בהיר וערוץ רקה-YFP פלורסצנטיות; הורה היו מבנים נגרמת על-ידי שימוש 35 מ מ הדמיה מנות עם רשת מוטבעים מיקרומטר 500). (B) מדגים 4 X תצוגה מוגדל של הגבול בין אזור מואר, שאינו מואר מראה כי נבגים, אשר נחשפו מינונים גבוהים של תאורה לייזר מונוכרומטי לא לנבוט ולגדול, ואילו נבגים ב אזורים שאינו מואר לשחזר באופן מלא חיידקים וגטטיבי לבטא בהיר רקה-YFP קרינה פלואורסצנטית (אות ירוק). (C, D) נבגים מכוסה על ידי זיהום חלקיקי או שכבות מרובות של נבג (חיצים) נראה מפני נבגים כבסיס איון על ידי טיפול פלזמה ולאפשר שלהם נביטה, תוצר ("צל אפקט"). נבגים (ג) היו שטופלו פלזמה 60 s ו שבעורך 180 דקות לאחר החניכה של נביטה או (ד) תמורת 120 s ולא עם תמונה לאחר מינימום 240 אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
6. סריקה מיקרוסקופ אלקטרונים (SEM)
- השתמש מיקרוסקופ אלקטרונים סריקה כדי לספק ultrastructural מידע אודות המורפולוגיה משטח של נבגים פלזמה מטופלים בהשוואה פקדים ללא טיפול. מעיל monolayers נבג מיובשים על coverslips עם זהב-פלדיום (3 ננומטר) באמצעות לרעוד. להוציא-coater. השתמש במיקרוסקופ אלקטרונים סריקה שדה פליטה הדמיה הדגימות, פעלו עם 5 מתח ההאצה kV כולל של גלאי בעדשה משני אלקטרונים כדי לחשוף את הטופוגרפיה חדות.
7. ניתוח נתונים
- לקבוע נבג הישרדות בין המנה N/N0, כאשר N הוא מספר הממוצע CFU של דגימות שטופלו ו- N0 הוא הממוצע CFU של פקדים ואקום ללא טיפול. מגרש נבג איון על ידי ארגון טיפול פלזמה כפונקציה של הזמן (בשניות). אקספרס כל הנתונים ממוצעים, סטיות תקן (n = 3).
- ניתוח תמונות מתקבל על ידי הדמיה תא חי שימוש בתוכנת הדמיה. לכמת את הפרופורציה של נבג ולספור. הנוכחי לאחר טיפול פלזמה, נבגים במסגרות נציג בתחילת הניסוי, כמו גם אחרי 4 שעות. קביעת משמעות מבחני הישרדות נבג, לשימוש חד-כיווני אנובה-בדיקות (ניתוח השונות) עם תוכנה סטטיסטית). P ערכים < 0.05 נחשבים כמו סטטיסטית.
תוצאות
ההישרדות של מטופלים-פלזמה B. subtilis נבגים
טיפול פלזמה של נבגים B. subtilis להשתמש בתוכנית לימוד ירידה בהישרדות עם הגדלת משך הטיפול פלזמה (איור 2). נבגים של המתח לבטא את רקה-ין דבוקה YFP הראה הישרדות עקומות הדומה נבגים של...
Discussion
עיקור וסירוס של משטחים באמצעות בטמפרטורה נמוכה, פלזמה בלחץ נמוך היא חלופה מבטיח עיקור די קונבנציונלי הליכים כגון טיפול עם מייננת קרינה, כימיקלים (למשל גזים כמו H2O2 או אתילן אוקסיד) או חום לח ויבש23. שיטות העיקור רגילים מספקים בעיקר של עיקור יעיל, אך הם ידועים כדי...
Disclosures
שאין ניגודי אינטרסים הכריז.
Acknowledgements
המחברים תודה אנדריאה שרדר לסיוע טכני מעולה שלה במהלך חלקים של עבודה זו, Nikea ג'יי אולריך על הסיוע במהלך הצילומים וידאו. כן נרצה להודות לייל א סימונס על התרומה הנדיבה שלו של זנים Bacillus subtilis : LAS72 ו- LAS24. עבודה זו נתמכה חלקים על ידי מענקים מ קרן מחקר גרמני (DFG) Paketantrag (PlasmaDecon פאק 728) הפלסטינית (או 7/3-1), RM (2023 מו/2-1) ואת ה-DLR להעניק חיים ISS DLR-FuW-פרויקט, Programm RF-FuW, Teilprogramm 475 (F.M.F, M.R., חומרי גלם). F.M.F. נתמך על ידי מלגה לתואר שלישי של אסכולת מחקר מדעי החיים שטח (SpaceLife) הלמהולץ-הגרמני וחלל מרכז (DLR) בקלן, גרמניה, אשר מומן על ידי האגודה הלמהולץ (הלמהולץ-Gemeinschaft) על פני תקופה של שש שנים ( מענק מס VH-KO-300) וקיבל כספים נוספים מבית ה-DLR, לרבות המנהלים וחלל, המכון לרפואה התעשייה האווירית לישראל. התוצאות של מחקר זה ייכלל את עבודת הדוקטורט של פליקס מ פוקס.
Materials
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
References
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved