A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניצול של T-Maze ששונה כדי להעריך את תוצאות תפקודי זיכרון לאחר דום לב
In This Article
Summary
פרוטוקול זה מתאר את השימוש T-maze ששונה להערכת תפקודי למידה/בזיכרון דום-induced איסכמיה מוחית חנק.
Abstract
רקע: הערכת מתון עד ליקוי קוגנטיבי מתון במודל של אנמיה קליפתית גלובלית (קרי דום) יכול להיות קשה בשל עניים גפיים לאחר הניתוח. לדוגמה, חולדות לעבור ניתוחים, ותוחלת מבוך המים מוריס לא יוכל לשחות, ובכך הרקה הניסוי.
שיטה חדשה: הקמנו מבחן T-maze ששונה חילוף ספונטנית התנהגותית. היתרון העיקרי של פרוטוקול T-maze ששונה הוא עיצוב פשוט יחסית שלה, כי הוא חזק מספיק כדי להעריך את תפקודי למידה/זיכרון אחרי איסכמיה. בנוסף, ניתוח הנתונים היא פשוט וברור. השתמשנו את T-maze כדי לקבוע גירעונות למידה/זיכרון של החולדות הן נוכחות או היעדרות של עד בינוניות (6 דקות) דום asphyxial (ACA). חולדות יש נטייה טבעית לחקר, נחקור את הזרועות חלופי ב T-maze, ואילו חולדות בהיפוקמפוס-lesioned נוטים לאמץ העדפת צד וכתוצאה מכך ירידה חילוף ספונטנית יחסי, חושף את בהיפוקמפוס קשורים תפקודי למידה/זיכרון ב נוכחות או היעדרות של ACA.
תוצאות: קבוצות ACA יש יחסי העדפת צד גבוה מסעה נמוכה יותר לעומת שליטה.
השוואה עם פעולות שירות הקיים: מוריס את המים ואת המבוך בארנס בולטות יותר להערכת תפקוד למידה/זיכרון. אולם, מבוך המים מוריס הוא יותר מלחיץ מבוכים אחרים. המבוך בארנס נעשה שימוש נרחב כדי למדוד את הזיכרון הפניה (לטווח ארוך), בעוד נוירוקוגניטיבי ACA-induced גירעונות קשורה קשר הדוק יותר עבודה (זיכרון).
מסקנות: פיתחנו אסטרטגיה פשוטה, אך יעילה על עובד (זיכרון לטווח קצר) באמצעות T-maze המודל שלנו קליפתית גלובלית (ACA).
Introduction
על פי איגוד הלב האמריקני (2017), דום לב (CA)-התמותה המושרה מתרחשת כל 4 דקות, ומשפיע יותר מ-400,000 איש בשנה ארה ב1. זה מתועד היטב כי CA יכול לגרום פגיעה מוחית עצביים כתוצאה דם מספקת זלוף2,3,4. פגיעה מוחית CA-induced מתרחשת באזור CA1 רגיש איסכמיה של ההיפוקמפוס5,6,7, המשפיעים על נוירונים קריטית לימוד, זיכרון8,9, 10,11,12. יתר על כן, אובדן צפיפות דנדריטים בעמוד השדרה, בתנאים איסכמי בהיפוקמפוס (קרי CA1 נוירונים), ממלא תפקיד קריטי זיכרון מרחבי ליקוי13,14,15. עקב שינויים פתולוגיים אלו לאחר CA התנהגותיות והפרעות כגון: חרדה, דיכאון, הפרעה פוסט טראומטית, אובדן זיכרון נפוצים יותר. אמנם היו ההתקדמות בטכנולוגיית רפואי (קרי אמבולטורי שירות יעיל), עם שיפור שיעורי ההישרדות של CA, רוב הטיפולים neuroprotective (למעט היפותרמיה) להיכשל כדי לשפר את התוצאות פונקציונלי לאחר CA16 ,17. CA ניצולים בדרך כלל יש איכות חיים עניים, הם נטל רפואי מצטבר מבלה16.
הערכות מצב קוגניטיבי קליפתית באמצעות מבחנים התנהגותיים חשובים לקבוע יעילות התרופות שני בסופו של דבר לפתח ניסוי קליני מוצלח. בשנות ה-40, אדוארד טולמן תוכנן במשפט התנהגות הראשון ללמוד המבוסס על ההיפוקמפוס בזיכרון המרחבי18. לאחר מכן, מבוכים שונים (כלומר מבוך המים מוריס, מבוך רדיאלי, T - או Y-מבוך, ו ברנס מבוך) פותחו כדי להעריך למידה מרחבית מבוססת על בהיפוקמפוס וזיכרון חולדות19,20,21,22 ,23. אחד של המבחן ההתנהגותי יותר נפוץ הוא מבוך המים מוריס, אשר בוחן למידה מרחבית, זיכרון בעכברוש מודלים24. עם זאת, מבוך המים מוריס דורש את החולדה לשחות ולעשות מאמץ מלא המוטורית ושליטה. לניסויים איסכמיה כגון דגם asphyxial דום (ACA, מודל עכברוש של CA), תעלות של עורק הירך/הווריד של נדרשים להשיג לחץ דם חיוניים, גזים בדם, הקדמה של סמים שונים. מאז עורק הירך/וריד תעלות יכול לעכב ניידות הרגל עיבוד היכולת של החולדה לשחות כראוי, ייתכן מבוך המים מוריס המתאים ביותר לבדוק ליקויים קוגניטיביים תחת ACA.
המבוך בארנס הוא המבחן בשימוש נרחב אחרים של התנהגות לבחון מרחבי למידה וזיכרון במודלים מכרסמים. המבוך בארנס לא דורשת מהפעלת מלא המוטורית ושליטה, ולכן פחות. מלחיץ מאשר מבוך המים מוריס. בעבר, אנחנו ביצע ניסויים באמצעות המבוך בארנס כדי לקבוע אם תפקודי למידה/זיכרון ההבדלים להתרחש בין פקד או מזויפים נגד חולדות ACA-induced. הנתונים שהושגו במבוך בארנס לא היה את הרזולוציה כדי לבדוק ליקויים קוגניטיביים בעקבות קלה עד מתונה ACA, בשל העובדה כי המבוך בארנס נעשה שימוש נרחב כדי למדוד את ההפניה (לטווח ארוך) זיכרון25,26, בזמן ACA-induced נוירוקוגניטיבי גירעונות יותר קשורה קשר הדוק עובד (לטווח קצר) זיכרון27,28,29,30 רומז המבוך בארנס הוא פחות מעשית להערכת תפקוד הזיכרון אצל ACA שלנו מודל.
לכן פיתחנו את T-maze ששונתה באמצעות בדיקת חילוף ספונטני כדי להעריך עבודה (זיכרון) לאחר ACA. היתרון העיקרי ששונה T-maze חילוף ספונטנית המבחן הוא הפשטות שלה ואת לחץ מינימלי על החולדות לעומת מבחנים התנהגותיים אחרים בשל העובדה כי T-maze ששונה אינו דורש הכשרה מוקדמת בבעלי חיים, כמו גם שיותר כבד חישובית ניתוח או רוטינות משנה (קרי וידאו והדמיה של העכברוש) כנדרש על ידי מבוך המים מוריס בארנס מבוך. הנה אנחנו מראים כי המבחן חילוף ספונטנית T-maze ששונה הוא עדיין מאוד יעיל ופשוט התנהגותית למשפט פרדיגמה יכולה להציע רזולוציה מספיק לזהות ולהעריך במדויק פונקציה בהיפוקמפוס במחלות הגורמות לאיבוד זיכרון קצר-טווח (כלומר ACA).
Protocol
כל ההליכים ניסיוני היו לפי הקווים המנחים של מכוני הבריאות הלאומיים, אושרה על ידי טיפול בעלי חיים מוסדיים שימוש הוועדה (LSU למדעי הבריאות מרכז-בשריבפורט) עבור השימוש זכר (חולדות Dawley ספראג 300-350 גר', 9-10 שבועות). חולדות היו התענה בלילה לפני הניתוח ACA.
1. T-maze מכשיר עיצוב והגדרת
הערה: לבסס את העיצוב T-maze על דיקון ואשתו של רולינס 2006 מודל31.
- עיצוב מבנה תלת-ממדי של המבוך ניצול SketchUp32. כדי ליצור מבנה תלת-ממדי של T-maze, לבנות את הזרוע התחלה של אורך חיצוני של 200 מ מ, רוחב של 165 מ מ, גובה 148 מ מ שיתאים מידות ההדפסה במדפסת תלת-ממד. השתמש עובי קיר של 5.5 מ מ, עובי הרצפה של 8 מ מ.
- להדפיס מן המבוך באמצעות מדפסת תלת-ממד (ראה טבלה של חומרים)32. אם מדפסת תלת-ממד אינה זמינה במעבדה, השתמש חומרים אחרים כגון עץ, בינוני צפיפות fiberboard או פלסטיק (קרי פוליוויניל כלוריד), אשר ניתן לרכוש בחנויות שפץ ביתך.
- בשל מגבלות גובה באזור ההדפסה, לבנות קירות המבוך ב 2 תמונות תלת-ממד נפרד ולהצטרף יחד עם מבוך הרכבה (קרי, גובה החומה השנייה נוספה בסעיף מבוך כדי להגדיל את הגובה על ידי 140 מ מ, עבור גובה קיר הכולל 280 מ מ). כל בסיס הדפסה 3D נפרד הכיל "טי" בצורת מנגנון הנעילה, איפה מקטע אחד מחובר הבא.
- בצומת של הזרוע התחלה עם הזרועות המטרה ליצור מקטע 165 מ מ רחב להצטרף הרוחב של הזרוע להתחיל עם זה של הזרועות המטרה. לבנות את הזרועות המטרה באמצעות שיטה דומה עיצוב כזרוע התחלה; עם זאת, להפחית את הרוחב של הזרוע ל- 100 מ מ לכל העיצוב של דיקון ואשתו רולינס.
- נא עיין באיור 1 לקבלת מפרטים טכניים/מידות מפורטת T-maze.
- כוללים מחיצה מרכזית על עיצוב בצומת של הזרוע התחלה והזרועות המטרה. להאריך מחיצה זו מן הקיר האחורי של T-maze ו- 200 מ מ לתוך הזרוע התחלה כדי לחלק את הזרועות המטרה. מחיצה זו גם הרחיב את הגובה של המבוך (איור 1).
2. asphyxial דום (ACA)
- אוטוקלב כלי כירורגי (121 מעלות צלזיוס למשך 15 דקות) לפני טקס החניכה של ניתוח. לחטא הטבלה כירורגי על ידי 70% אתנול במשך 15 דקות גילוח שיער בעלי חיים באתר של הניתוח. להחיל פתרון betadine העור משטחים עבור הפעולה הכירורגית.
- ההרדמה
- עזים ומתנגד חולדות עם 4% איזופלוריין 30:70 תערובת של O2 ו- N2O (300 mL/min O2 ו- 700 מ"ל לדקה N2O) באמצעות המסכה.
- תן חולדות צנרור אנדוטרכאליות אוורור מכני (לאחר צנרור, חולדות היו מחוברים מכונת הנשמה).
- לשמור על הרדמה על-ידי הורדת איזופלוריין בין 4% ל-2% עם תערובת 30:70 של O2 N2O. שימוש בשיטת קמצוץ-תגובה לקביעת עומק ההרדמה.
- למרוח משחה על העיניים למניעת יובש תחת הרדמה. Regulae טמפרטורת הגוף על ידי מכרסם חימום משטח עם לוויין כהפניה טמפרטורה.
- אנדוטרכאליות צנרור
- מקם את החולדה בבית הבליעה אינדוקציה. עזים ומתנגד החולדות עם 4% איזופלוריין 30:70 תערובת של O2 ו- N2O.
- הסר את החולדה התא אינדוקציה. המקום ומורדמת חיה במצב פרקדן עם הפרצוף של החולדה, לכיוון המסכה הרדמה.
- בעדינות להזיז את הלשון לכיוון השמאלי או הימני של החיה האגודל השמאלית ובאצבע.
- להחליק-14 גמיש תוך ורידי צנתר (49 מ מ באורך) על מחט pipetting קצה קהה 17-מד (93 מ מ באורך 10 מעלות זווית שבקצהו של המחט). הכנס את המחט pipetting 17-מד קצה קהה לתוך קנה הנשימה.
- משוך בעדינות את המחט pipetting 17-מד מן קנה הנשימה. להתחבר הרכזת קתטר 14-מד ההנשמה. התאם ההנשמה נפח פעימה 0.67 גרם/100 גרם, קצב נשימה של 60 נשימות לדקה.
- לשמור על טמפרטורה ראש וגוף ב 37 מעלות צלזיוס במהלך ההליך כולו על ידי מכרסם חימום משטח עם לוויין כהפניה טמפרטורה.
- צנתור ובורידים הירך
- לגלח את השיער בסמוך לאזור במפשעה (משני הצדדים) ולהחיל betadine העור משטחים עבור הפעולה הכירורגית.
- להציב את החולדה במצב פרקדן. לעשות חתך (10 מ מ) באזור במפשעה עם מספריים כירורגיים.
- הפרד רקמת חיבור על ידי מלקחיים עצה בוטה עד רצועה מפשעי חשוף. השתמש עוצר דימום להבין רצועה במפשעה. עורק הירך ואת הווריד נמצאים מתחת רצועה במפשעה.
- להשתמש מלקחיים קצה קהה כדי להפריד את רקמת החיבור עד עורק הירך ואת הווריד, נחשפים.
- הפרד בעדינות העצב הירך אשר נמשך לאורך הירך באמצעות מלקחיים עצה משובחים. בזהירות להפריד בין עורק הירך, הווריד כיחידה באמצעות מלקחיים עצה משובחים.
- השתמש בסדר עצה מלקחיים להפריד הוריד עורק הירך.
- מקום 2 חתיכות של 5-0 משי תפר (אחד לכיוון הרגל והשני לכיוון הגוף) תחת הווריד.
- לקשור קשר רופף בצד ליד הגופה. השתמש עוצר דימום כדי להחזיק ומשוך את התפר ככל האפשר לכיוון הצד הנגדי של הגוף.
- לקשור קשר רופף בצד ליד הרגל. אחוז ומשוך את התפר כלפי הרגל ויה עוצר דימום כדי לאפשר את הווריד למלא עם דם.
- עושים חתך קטן בווריד (כ- 0.1 מ"מ) על ידי מספריים לנתח מיקרו (בזווית של 45°). לספוג דם עם גזה מעוקר.
- לצרף מזרק המחט קצה קהה (מלא עם תמיסת מלח עם הפרין U/mL 20) קטטר PE-50. למלא את הצנתר PE-50 עם תמיסת מלח עם 20 U/mL הפארין. חותכים את הצנתר PE-50 עם חיתוך מספריים בזווית של 45° ' כדי ליצור נקודה או חדים סוף. השתמש קצה קהה מלקחיים להחזיק את הקצה של הקטטר PE-50. הכנס בעדינות את הצנתר PE-50 לווריד הירך.
- לאחר הקטטר הוכנסה במלואה, לאט לנהל 0.1 מ"ל תמיסת הפרין/כדי לוודא שאין שום דליפה. תפר המשרד קשרים (יחיד-קשר) כדי לייצב את הצנתר PE-50 לקשור. שמור את הצנתר PE-50 עבור רציף לעירוי הזרקה (IV) של תרופות שונות.
- שימוש מזרק 1 מ"ל קשור 23 מד סכינים סטריליים מתאם stub לניהול היא רועדת ברומיד (0.67 מ"ג/ק"ג, מנוהל כל 10 דקות) דרך הווריד של הירך כדי לשתק את החולדה לאורך כל ההליך.
- מקום 2 חתיכות של 5-0 משי תפר (אחד לכיוון הרגל והשני לכיוון הגוף) תחת העורק.
- לקשור קשר רופף בצד ליד הרגל. השתמש עוצר דימום כדי להחזיק ומשוך את התפר ככל האפשר לכיוון הרגל.
- לקשור קשר רופף בצד ליד הגופה. אחוז ומשוך את התפר כלפי הגוף דרך עוצר דימום כדי לאפשר את העורק למלא עם דם.
- עושים חתך קטן בעורק (כ- 0.1 מ"מ) על ידי מספריים לנתח מיקרו (בזווית של 45°).
- לצרף מזרק המחט קצה קהה (מלא עם תמיסת מלח עם הפרין U/mL 20) קטטר PE-50. למלא את הצנתר PE-50 עם תמיסת מלח עם 20 U/mL הפארין. חותכים את הצנתר PE-50 במספריים לנתיחה בזווית של 45 מעלות כדי ליצור קצה נקודות או שארפ. השתמש קצה קהה מלקחיים להחזיק את הקצה של הקטטר PE-50. השתמש קצה קהה מלקחיים להחזיק את הקצה של הקטטר PE-50. הכנס בעדינות את הצנתר PE-50 לתוך עורק הירך.
- לאחר הקטטר הוכנסה במלואה, לאט לסגת המזרק כדי להבטיח שאת הצנתר יהיה פונקציונלי. תפר המשרד קשרים (יחיד-קשר) כדי לייצב את הצנתר PE-50 לקשור. שמור את הצנתר PE-50 עבור הקלטה רציפה של גזים ולחץ דם עורקי.
- הליך דום (ACA) asphyxial
- התאם פיסיולוגיים (קרי פו2pCO2, לחץ דם, ערך ה-pH) כנדרש על ידי הכוח ויסות נפח פעימה, O2 או רמות2O N. השתמש טווחים פיזיולוגי נורמלי של פרמטרים אלה: פו2: 100 מ מ כספית, pCO2: 35-40 מ מ כספית, לחץ דם: 100 מ מ כספית, ו- pH: 7.4.
- שימוש מזרק 1 מ"ל מחובר עם מתאם stub סכינים סטריליים מד 23 לנהל היא רועדת ברומיד (0.67 מ"ג/ק"ג, עירוי) דרך וריד הירך ולחכות 2 דק לוודא כי לחץ הדם הוא או בסביבות 100 מ מ כספית לפני ביצוע ACA.
- לגרום דום נשימה (6 דקות) על ידי ניתוק הצינור אנדוטרכאליות (14-מד קטטר hub) של ההנשמה. בהמשך, לחסום את הצינורית אנדוטרכאליות על ידי מזרק 1 מ"ל כדי להבטיח דום נשימה מלאה.
הערה: הזמן 6-מין חנק מוגדר בתקופה שבין ההנשמה הניתוק לבין תחילתו של החייאה. דום לב מלאה מוגדרת לחץ עורקי הממוצע נמוך מ 10 מ מ כספית. - במהלך מין האחרון של דום נשימה, להתאים את קצב נשימה של ההנשמה כדי נשימות לדקה 80, ולהגדיל את O2 ל- 2 L/דקה עם 0% N2O. פעולה זו תפוצץ כל איזופלוריין הנותרים או N2O שנותרו ההנשמה.
- מין בעקבות דום נשימה, להסיר 1 מ"ל המזרק מהצינור אנדוטרכאליות. להתחבר מחדש צינור אנדוטרכאליות כדי ההנשמה.
- שימוש מזרק 1 מ"ל קשור 23 מד סכינים סטריליים מתאם stub אפינפרין (0.005 מ"ג/ק"ג, עירוי) דרך וריד הירך ולפקח בעיסויים ידנית על ידי האגודל, אינדקס, באצבעות על החזה של החיה בתנועה סיבובית קלה על ה-x ואת ציר z (200/דקה) עד שובו של מחזור ספונטני (כלומר לחץ הדם בעורק ≥ 50 מ מ כספית)33,34,35.
- שימוש מזרק 1 מ"ל אחר קשור 23 מד סכינים סטריליים מתאם stub לניהול סודיום ביקרבונט (1 meq/ק"ג, עירוי) דרך וריד הירך מיד לאחר החזרה מחזור ספונטני (50 מ מ כספית או גבוה יותר)33,34, 35 כדי להקל על חמצת נשימתית.
- מדד דם גזי שוב 10 דקות לאחר החייאה כדי לקבוע את מצב חומצה-בסיס (pH לאחר ACA צריך להיות בסביבות 7.35 כדי 7.40)
- השתמש עוצר דימום כדי לצבוט את עורק הירך ואת הווריד. לאט ובעדינות להסיר קטטרים ובורידים באמצעות מלקחיים קצה קהה. מאתרים ומפסיקים את עורק הירך/וריד 5-0 בתפר משי כדי למנוע דימום. סגור את העור באתר כירורגית באמצעות בתפר משי 3-0. השתמש בטכניקה הפתולוגיים קטעה כדי לצמצם את הסיכון לפתוח מחדש הפצע.
- לחכות עד העכברוש נושם עצמה (בדרך כלל 30 דקות עד 60 דקות לאחר החייאה), נתק את החולדה ההנשמה ולהסיר בעדינות את הצינור אנדוטרכאליות.
- את הלילה נעשה המקום העכברוש בחממה התינוק (27 ° C, 50% לחות). במקום מזון מרוככת (עשוי בהשריה במים), מים לתוך החממה התינוק בן לילה.
- להעביר את החולדה הכלוב בודדים ולחזור העכברוש למתקן בעלי חיים עם צ'או רגיל ומים. בדיקות T-maze להתחיל 3 ימים לאחר ACA.
3. T-maze
-
הכנת בעלי חיים
- יום לפני הניתוח (דמה או ACA), להתמודד עם כל עכברוש בשביל 5 דקות. מעולם לא העלה חולדות מהכלוב שלהם (480 מ מ x 250 מ מ x 200 מ מ, כלוב שקוף פלסטיק) כאשר הטיפול (איור 2).
- לאחר טיפול העכברוש, בעדינות להרים את החולדה מאת זנבו ביד אחת כאשר אחרים ביד תומך שלה ' רגליים. לתת להם לקפוץ מהיד אל הכלוב (100 מ מ גובה) 5 פעמים. הפרד כל עכברוש לתוך כלובים נפרדים, אז הם לא ישלוט על מזון ו/או להילחם.
- שלושה ימים לאחר ניתוח ACA (איור 2), או העברת החולדות עם הכלוב לתוך חדר חשוך ושקט לפני תחילת ההפעלה הראשונה. רק להדליק מנורת שולחן צריכת חשמל נמוכה ולמקם אותו בפינת מחדר הבדיקות כדי לשמור על תאורה המינימום. אפשר החולדה להסתגל חושך למשך 10 דקות.
- ביצוע ניסויים כל אחר-הצהריים כדי למנוע תופעות של ההשתנות היומית וריאציה על הביצועים של חולדות. לא ממליץ לך המפעיל על איזה עכברוש התקבל או ניתוח ACA.
-
חילוף ספונטנית
- מורחים שכבה דקה של מצעים (~ 10 מ מ עובי) כדי לכסות את כל הקומה של המבוך. המקום אז העכברוש-הזרוע התחלה (בחלק התחתון של ה-"T"), המהווה נקודת ההתחלה של כל אחד, לרוץ, ולאפשר כל עכברוש 3 דקות כדי לחקור את הזרוע המטרה ימינה או שמאלה.
- ברגע העכברוש מתחייב זרוע מטרה מסוימת (ארבע רגליים של העכברוש נכנסו הזרוע המטרה), לחסום צומת "T" בין הזרוע התחלה הזרוע המטרה מנוגדות (איור 1) כדי למנוע את החולדה מלהיכנס הזרוע המטרה מנוגדות. להשאיר את החולדה במבוך למשך 30 שניות, ואז להרים את החולדה ולמקם אותו לכלוב לזמן מינימלי (~ 30 שניות). ואז להסיר את צומת "T" (125 מ מ X 230 מ מ X 65 מ מ, שנעשו על ידי מדפסת תלת-ממד) לחסום T-maze.
- למקם את החולדה הזרוע התחלה וחזור 3.2.2. חילוף מוגדרת בתור: כאשר העכברוש נכנס הזרוע הנגדית לעומת הקודם לרוץ36. יש חולדות לבצע 4 ריצות ליום כדלקמן:
1סנט לרוץ
לרוץ 2nd
10 דקות הפסקה
3rd לרוץ
4th לרוץ - להחליף את המצעים במהלך 10 דקות הפסקה, בין בעלי החיים כדי למנוע הטיה הריח. לנקות את T-maze עם 75% אתנול ואחריו מים מזוקקים, בסוף כל יום ניסיוני.
- חזור על שלבים 3.2.1. -3.2.4. עוד יומיים (12 פועל סה כ) כמו באיור 2.
-
חילוף קצב וצד בחישובי שיעור העדפה
- לחשב את % חילוף ו- % את העדפת צד, איפה
L: החולדות לבחור הזרוע השמאלית
R: החולדות לבחור את הזרוע הימנית
תקן הבחירה: 2nd לרוץ שונה 1סנט בקבוצה נתונה (כל ערכה מכילה שתי ריצות)
בחירה שגויה: החולדות לבחור אותה זרוע הדומה הפעלה קודמות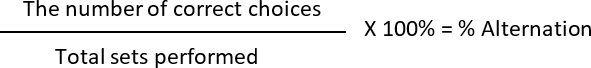
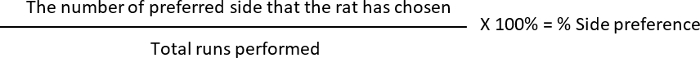
דוגמה:
יום 1: L L / L L
יום 2: L L / L R
יום 3: R L / L L
חילוף: 2 (בחירות נכונות) /6 (הכולל ערכות שבוצעה) * 100 = 33.33%
העדפת צד: 10 (L, צד מועדף) /12 (סה כ הרצפים שבוצעה) * 100 = 83.33%
- לחשב את % חילוף ו- % את העדפת צד, איפה
-
טיפול לאחר הניתוח:
- תן עכברושים. הבופרנורפין (IP 0.01 מ"ג/ק"ג) כל 12 שעות במשך יומיים לאחר הניתוח. להתבונן חולדות לשעה עד לאחר דום לב.
- צרף חולדות הנשמה ואת כרית החימום עד זה שהכרתו מספיק כדי לשמור על recumbency בחזה ובצלעות. כדי לשמור על טמפרטורת הגוף של בעלי החיים לאחר הניתוח, מקם את החולדה חממה התינוק (מוגדר ב 27 ° C, 50% לחות).
- מספקים צ'או מרוככת (שנעשו על ידי השריה במים) לבעלי 24 השעות הראשונות לאחר הניתוח. אם החולדות לא היו מי שתייה, להזריק תמיסת מלח bacteriostatic (100 מ"ל/ק"ג/יום, I.P.) עד החיה משחזרת שתיית מים באופן חופשי.
- נותנים אנטיביוטיקה אקטואלי חולדות עם משכך כאבים (משחה עצמאית, לידוקאין) כל הפצעים. העבר חולדות חזרה המתקן בעלי חיים לאחר שהם יתאושש לגמרי.
-
שיטת המתת חסד
- השתמש איזופלוריין 5% ו 100% N2O להרדים את החיות בסוף הניסוי.
תוצאות
ACA (גלובל קליפתית) גורמת בעיקר עובדים (לטווח קצר) זיכרון גירעונות28,29. כדי להעריך את הפונקציה של למידה וזיכרון לאחר ACA, השתמשנו במבחן חילוף ספונטנית ששונה כדי להעריך עובדים זיכרון (לטווח קצר)30. תוצאות בדיקת חילוף ספונטנית מראים כ?...
Discussion
השינויים נעשו במחקר הנוכחי לעומת פרוטוקול של דיקון ואשתו של רולינס-31. במדפסת תלת-ממד נעשה שימוש כדי לבנות את T-maze. 3D-ההדפסה מספק חלופות במחיר נוח, חסכוני T-maze ממוסחר. כדי להפחית את החרדה של חולדות במהלך הבדיקה, T-maze בוצעה בחדר חשוך עם תאורה המינימום. העכברוש נכנס פעם אחת הזרועות המ...
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי נבחרת מוסדות של בריאות/לאומי המכון של הפרעות נוירולוגיות ולהעניק קו 1R01NS096225-01A1, איגוד הלב האמריקני מעניקה AHA-13SDG1395001413, AHA-17GRNT33660336, AHA-17POST33660174, מענק אוניברסיטת המדינה לואיזיאנה ב מועצת המחקר סיוע, היה מלקולם פייסט לב וכלי דם מחקר האחווה, מכון המוח אוולין מק'נייט פ.
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer | MakerBot | Replicator | Fifth generation |
| 3D Printer Filament | Hatchbox | PLA, 1.75 mm filament diameter | |
| 200 Proof Pure Ethanol | Koptec | V1005SG | |
| Sani-Chips | PJ Murphy-Forest Products | Size: 8 to 20 mesh; 2.2 cubic foot/package; autoclavable bags | |
| Rat | Charles River Laboratories | Sprague-Dawley | |
| Vecuronium bromide | Sun Pharmaceutical | 47335-931-40 | 10 mg |
| Epinephrine | Par Pharmaceutical | 42023-103-01 | Adrenalin Chloride Solution 1 mg/mL, 1:1000 |
| Buprenorphine Hydrochloride Injection | Pfizer | 00409-2012-32 | 0.3mg/mL |
| SketchUp | Trimble Inc. | 3D modeling software | |
| VentElite Small Animal Ventilator | Harvard Apparatus | 55-7040 | Animals raging in size from mouse to guinea pig (10g to 1kg) |
| PowerLab 8/35 | Adinstruments | PL3508 | 8 analog input channels – 4 of which can be used in differential mode. |
| Bio Amps | Adinstruments | FE132 | The Bio Amp is a galvanically isolated, high-performance differential bio amplifier optimized for the measurement of a wide variety of biological signals such as ECG, EMG and EEG recordings. |
| Quad Bridge Amp | Adinstruments | FE224 | A four-channel, non-isolated bridge amplifier designed to allow the PowerLab to connect to most DC bridge transducers. |
| LabChart 8 | Adinstruments | ||
| ABL80 FLEX CO-OX blood gas analyzer | Radiometer | pH / p CO2 / p O2 | |
| SURFLO Teflon I.V. Catheter | Terumo | sc-361556 | Only use the flexible thin wall catheter (49-mm long) |
| Pipet/Infusion Needle | Hamilton | 7748-03 | 17-gauge; 93-mm long; 10-degree angle |
| Classic T3 Vaporizer | SurgiVet | VCT302 | Classic T3 Isoflurane Funnel Fill |
| ENVIRO-PURE Charcoal Canister | SurgiVet | 32373B10 | Designed to absorb waste anesthetic gas |
| O2 single flowmeter | SurgiVet | 32375B1 | 0-1000 mL |
| N2O Flowmeter | VetEquip | 401721 | 0-4LPM |
| Clay Adams Intramedic Luer-Stub Adapter (Sterile) | Becton Dickinson | 427565 | 23 gauge |
| Micro Forceps | Black and Black surgical | B3FRC-18 RM-8 | 7 1/4" (18 cm), 8mm RH, counterweight w/ guide pin 2mm, platform 6 x .3 mm, curved. |
| Halstead Mosquito Forceps | Roboz | RS-7111 | Curved; 5" Length, 1.3 mm tip diameter, 2.1 mm jaw width |
| Mixter Forceps | Roboz | RS-7291 | 5.25" Curved Extra Delicate, 1.1 mm tips |
| Castroviejo Micro Dissecting Spring Scissors | Roboz | RS-5650 | Straight, Sharp Points; 9 mm Cutting Edge; 0.15 mm Tip Width; 3 1/2" Overall Length |
| Mayo-Stille Scissors | Roboz | RS-6891 | 5.5" Round Curved |
| Dumont #5 Forceps | Roboz | RS-5058 | 45 Deg Dumoxel Tip Size .10 x .06 mm |
| Olsen-Hegar Combination Scissor And Needle Holder | Roboz | RS-7884 | Cross Serration Tip; 5.5" Length |
| Moloney Forceps | Roboz | RS-8254 | Serrated; Slight Curve; 4.5" Length |
References
- Writing Group, M., et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 133, e38-e360 (2016).
- Beuret, P., et al. Cardiac arrest: prognostic factors and outcome at one year. Resuscitation. 25, 171-179 (1993).
- Kim, Y. J., et al. Long-term neurological outcomes in patients after out-of-hospital cardiac arrest. Resuscitation. 101, 1-5 (2016).
- Earnest, M. P., Yarnell, P. R., Merrill, S. L., Knapp, G. L. Long-term survival and neurologic status after resuscitation from out-of-hospital cardiac arrest. Neurology. 30, 1298-1302 (1980).
- Cerchiari, E. L., Safar, P., Klein, E., Cantadore, R., Pinsky, M. Cardiovascular function and neurologic outcome after cardiac arrest in dogs. The cardiovascular post-resuscitation syndrome. Resuscitation. 25, 9-33 (1993).
- Petito, C. K., Feldmann, E., Pulsinelli, W. A., Plum, F. Delayed hippocampal damage in humans following cardiorespiratory arrest. Neurology. 37, 1281-1286 (1987).
- Schmidt-Kastner, R., Freund, T. F. Selective vulnerability of the hippocampus in brain ischemia. Neuroscience. 40, 599-636 (1991).
- Corkin, S. What's new with the amnesic patient H.M.?. Nat Rev Neurosci. 3, 153-160 (2002).
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. 1957. J Neuropsychiatry Clin Neurosci. 12, 103-113 (2000).
- Smith, T. D., Calhoun, M. E., Rapp, P. R. Circuit and morphological specificity of synaptic change in the aged hippocampal formation. Neurobiol Aging. 20, 357-358 (1999).
- Gage, F. H., Dunnett, S. B., Bjorklund, A. Spatial learning and motor deficits in aged rats. Neurobiol Aging. 5, 43-48 (1984).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8, 198-204 (1998).
- Neigh, G. N., et al. Cardiac arrest with cardiopulmonary resuscitation reduces dendritic spine density in CA1 pyramidal cells and selectively alters acquisition of spatial memory. Eur J Neurosci. 20, 1865-1872 (2004).
- Volpe, B. T., Davis, H. P., Towle, A., Dunlap, W. P. Loss of hippocampal CA1 pyramidal neurons correlates with memory impairment in rats with ischemic or neurotoxin lesions. Behav Neurosci. 106, 457-464 (1992).
- Astur, R. S., Taylor, L. B., Mamelak, A. N., Philpott, L., Sutherland, R. J. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res. 132, 77-84 (2002).
- Lee, R. H., et al. Fatty acid methyl esters as a potential therapy against cerebral ischemia. OCL. 23, D108 (2016).
- Lee, R. H., Porto, L. F., et al. Chapter 1. Palmitic acid: occurrence, biochemistry and health effects. , 1-15 (2014).
- Tolman, E. C., Gleitman, H. Studies in spatial learning; place and response learning under different degrees of motivation. J Exp Psychol. 39, 653-659 (1949).
- Koopmans, G., Blokland, A., van Nieuwenhuijzen, P., Prickaerts, J. Assessment of spatial learning abilities of mice in a new circular maze. Physiol Behav. 79, 683-693 (2003).
- Barnes, C. A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat. J Comp Psychol. 93, 74-104 (1979).
- Paul, C. M., Magda, G., Abel, S. Spatial memory: Theoretical basis and comparative review on experimental methods in rodents. Behav Brain Res. 203, 151-164 (2009).
- Vorhees, C. V., Williams, M. T. Assessing spatial learning and memory in rodents. ILAR J. 55, 310-332 (2014).
- Sharma, S., Rakoczy, S., Brown-Borg, H. Assessment of spatial memory in mice. Life Sci. 87, 521-536 (2010).
- Poon, T. P., et al. Spinal cord toxoplasma lesion in AIDS: MR findings. J Comput Assist Tomogr. 16, 817-819 (1992).
- Sunyer, B., Patil, S., Höger, H., Lubec, G. Barnes maze, a useful task to assess spatial reference memory in the mice. Nat Protoc. 390, (2007).
- Shoji, H., Hagihara, H., Takao, K., Hattori, S., Miyakawa, T. T-maze forced alternation and left-right discrimination tasks for assessing working and reference memory in mice. J Vis Exp. , (2012).
- Seeger, T., et al. M2 muscarinic acetylcholine receptor knock-out mice show deficits in behavioral flexibility, working memory, and hippocampal plasticity. J Neurosci. 24, 10117-10127 (2004).
- Olton, D. S., Feustle, W. A. Hippocampal function required for nonspatial working memory. Exp Brain Res. 41, 380-389 (1981).
- Hayashida, K., et al. Hydrogen inhalation during normoxic resuscitation improves neurological outcome in a rat model of cardiac arrest independently of targeted temperature management. Circulation. 130, 2173-2180 (2014).
- Dember, W. N., Richman, C. L. . Spontaneous alternation behavior. , (1989).
- Deacon, R. M., Rawlins, J. N. T-maze alternation in the rodent. Nature protocols. 1, 7-12 (2006).
- Wong, K. V., Hernandez, A. A review of additive manufacturing. ISRN Mechanical Engineering. 2012, (2012).
- Lin, H. W., et al. Derangements of post-ischemic cerebral blood flow by protein kinase C delta. Neuroscience. 171, 566-576 (2010).
- Lin, H. W., et al. Fatty acid methyl esters and Solutol HS 15 confer neuroprotection after focal and global cerebral ischemia. Transl Stroke Res. 5, 109-117 (2014).
- Lee, R. H., et al. Interruption of perivascular sympathetic nerves of cerebral arteries offers neuroprotection against ischemia. Am J Physiol Heart Circ Physiol. 312, H182-H188 (2017).
- Bali, Z. K., et al. Differential effects of alpha7 nicotinic receptor agonist PHA-543613 on spatial memory performance of rats in two distinct pharmacological dementia models. Behav Brain Res. 278, 404-410 (2015).
- McDonald, J. H. . Handbook of biological statistics. 2, (2009).
- Castellano, M. A., Diaz-Palarea, M. D., Rodriguez, M., Barroso, J. Lateralization in male rats and dopaminergic system: evidence of right-side population bias. Physiol Behav. 40, 607-612 (1987).
- Andrade, C., Alwarshetty, M., Sudha, S., Suresh Chandra, J. Effect of innate direction bias on T-maze learning in rats: implications for research. J Neurosci Methods. 110, 31-35 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved