A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ופשוט נמוכים Assay למדידת Ambulation במודלים של העכבר של ניוון
In This Article
Summary
פרוטוקול זה מתאר מערכת גמישה, בעלות נמוכה למדידת העכבר ambulation ב assay פעילות שדה פתוח. אנו מראים כי וזמינותו 6 דקות ambulation מבוסס על מערכת זו מזהה ירידה בהיקף התנועה הרצונית בעכברים mdx , במדויק מבדיל שיפור חילוץ שרירים ספציפיים של חיות אלו.
Abstract
מדידת תוצאות תפקודי בטיפול של ניוון שרירים היא היבט חיוני של בדיקות פרה. להערכת ambulation מרצון במודלים של העכבר נמצא assay פעילות פולשנית לשחזור ישירות מקביל מדדים של המטופל ambulation כגון הבדיקה 6 דקות הליכה, הקשורים עשרות ניידות. שיטות נפוצות רבות לבדיקת מהירות ambulation העכבר והמרחק מבוססים על הבדיקה בשדה פתוח, שבו תנועה חופשית של חיה בתוך זירה נמדד לאורך זמן. אחת החיסרון העיקרי לגישה זו תוכנה מסחרית, ציוד ברזולוציה גבוהה ההצעה מעקב יקר, עשוי לדרוש העברת עכברים מתקנים מיוחדים לבדיקה. כאן נתאר מערכת בעלות נמוכה, מבוססי-וידאו למדידת ambulation העכבר אשר מנצל תוכנה חופשית, קוד פתוח. באמצעות פרוטוקול זה, נדגים את ambulation מרצון במודל עכבר הדיסטרופין null mdx עבור ניוון שרירים דושן (DMD) היא ירידה יחסית העכבר פראי-סוג הפעילות. ב- mdx עכברים המבטאים את transgene utrophin, גירעונות אלה פעילות שאינם קיימים, המרחק הכולל נסע להבחין מגניחותיה פראי-סוג עכברים. שיטה זו יעילה למדידת שינויים ambulation מרצון המשויך פתולוגיה dystrophic, מספקת פלטפורמה תכליתי ניתן בקלות להתאים להגדרות מחקר מגוונים.
Introduction
מדידות לשחזור ואמין של תפקוד השרירים הם קריטיים עבור הערכת יעילותם של טיפולים פוטנציאליים עבור DMD. DMD היא הפרעה גנטית נגרמת על ידי מוטציות בגן הדיסטרופין, שמוביל חולשת שרירים מתקדמת, אובדן של ambulation, וכישלון כך בסופו של דבר. הדגם בעל חיים הנפוצה ביותר של DMD הוא העכבר הדיסטרופין null mdx . סדרת בדיקות תפקודי הופיעו כמו מבחני שגרתיות להערכת התקדמות המחלה mdx העכבר באותה מידה כמו דומה מודלים חייתיים של dystrophies ו myopathies אחרים. מבחני נפוץ ויוו לכלול מדידות של כוח אחיזה forelimb, חוט תלוי זמן, מקסימום rotarod, זמן עד כדי אפיסת כוחות במהלך הליכון ריצה, מנוע פעילות מעקב. יש כבר מאמץ ניכר בשטח לתקנן את בדיקות אלה, במטרה להפחית את השתנות בין מחקרים פרה, להגדלת הפוטנציאל translational הרפוי נבדק עכברים1,2.
קטגוריה חשובה אחת של בדיקות פרה הוא המדד של התנועה הרצונית, פרמטר זה היא שונה לעתים קרובות במודלים מאתר של ניוון שרירים. זה בדרך כלל נבדק על ידי מבחני בהתבסס על ניטור פעילות בשטח פתוח, אפשר להעריך (הליכה) אופקי או אנכי (גידול) תנועות במהלך מספר דקות או שעות2,3,4. מספר מחקרים הראו התנועה הרצונית לשנות בעכברים mdx , בעיקר לאחר פעילות גופנית, מדידות אלה הוכחו להיות רגיש התקדמות המחלה וטיפול סמים. מגבלה אחת גדולה בביצוע מבחני אלה הוא הצורך עבור ציוד מיוחדים, עלות גבוהה. כאן מוצגת שיטה נמוכים העוקבת אחר ambulation העכבר באמצעות משאבים זמינים.
המרחק 6 דקות הליכה הוא מדד של נפוץ ככלי הערכה קלינית אצל אנשים עם דושן ניוון שרירים5,6. שינויים של אמצעי זה שימשו כדי להעריך את תוצאות במודלים חייתיים של דושן, כולל mdx עכברים7 ו- כלבי גולדן רטריבר ניוון שרירים (GRMD)8. במחקר זה, אנחנו מקליטים תנועה התנדבותית בשטח פתוח בתוך 6 דקות מיד לאחר אתגר פעילות גופנית מתונה. מרחק ambulation מכן מחושב באמצעות תוכנת קוד פתוח בחינם כדי למדוד תנועה אופקית לאורך זמן.
היתרון העיקרי של שיטה זו הוא כי בעלי חיים יכול להיבדק במגוון של הגדרות מבלי להזדקק ציוד מיוחד או תוכנה מסחרית עלות גבוהה לצורך ניתוח. היבט אחד חשוב של ניתוח זה הוא כי זה יכול להתבצע באווירה מעבדה בסיסית ללא צורך לעבור או להעביר עכברים החוצה ביבר למתקן הליבה מיוחדים. פרוטוקול מעקב וידאו המתוארים כאן הוא מתאים היטב ההערכה של ambulation על פני תקופות זמן קצר יחסית אפשר לזהות פעילות ההבדלים בין פראי-סוג של mdx עכברים, וכן לחשוף שיפור תפקודי חילוץ דגם של DMD.
Protocol
השיטות המתוארות כאן אושרו על ידי טיפול בעלי חיים מוסדיים ועל שימוש הוועדה ב אוניברסיטת קליפורניה, לוס אנג'לס. פראי-סוג (C57BL/6J) ועכברים mdx (רקע C57Bl/10ScSn) נרכשו ממקור מסחרי. mdx: עכברים utrophin-Tg היו מתנה של ג'יימס Ervasti, באישור קיי דיוויס, ומתוחזק היו על רקע mdx . מבחני ambulation נערכו על עכברים זכרים במהלך בגיל 6 חודשים. עכברים היו מתוחזקים ביומן ביבר מדעי החיים Terasaki בעקבות הנחיות שנקבעו על-ידי טיפול בעלי חיים מוסדיים ועל שימוש הוועדה אוניברסיטת קליפורניה, לוס אנג'לס (לאישור #2000-029-43) ו אישור עבור מחקרים אלה הוענקה על ידי אבטחת רווחת החיה UCLA (אישור #A3196-01).
1. הכנת קאמרית
- לבצע איסוף נתונים בחדר שקט, מבוקרת טמפרטורה בזמן עקבית של יום9. לבצע את הבדיקות לראות את גנוטיפ והטיפול של העכבר הנבדקת.
- להתאים כל מערכת קאמרית בשדה פתוח לניתוח זה.
הערה: במחקר זה, אנו משתמשים חדר הקלטה בקלות יביל וזולה בנוי פח אשפה גדול. הזירה בשטח פתוח הוא מגש להגדיר כלוב או פלטפורמה מוגבהת דומה. - מניחים את המצלמה על מחוט מתכת מעל תא להקליט על פני הזירה המלאה.
- ניקוי תא הקלטה עם חומר חיטוי לפני כל משפט.
2. מראש תרגיל פרוטוקול ואיסוף נתונים
- באופן אופציונלי, מייד לפני פעילות הקלטה, לאתגר כל עכבר עם פרוטוקול הפעלת שרירים.
הערה: זה הוא אופציונלי אך מומלץ בניסויים המערבים עכברים mdx .- לאפשר את העכבר כדי אחיזה בבר משיכה של לאמוד כוח דיגיטלי ומשוך בעדינות בחזרה עד הבר למשוך לפרסומו. חזור על הליך זה חמש פעמים לכל משפט.
- שיא שיא המתח (N) בכל ניסוי.
הערה: בנוסף להיותם אתגר תרגיל עבור וזמינותו ambulation, הכוח שהופעל על ידי החיה במהלך הזה assay חוזק אחיזה יכול לשמש2,מדד תוצאה פונקציונלית נוספים10. - לבצע חמישה מחקרים הכולל עבור כל עכבר עם 1 דקות מנוחה בין בכל ניסוי.
- מיד לאחר וזמינותו חוזק אחיזה או פרוטוקול אחר של פעילות גופנית, מקם את העכבר בבית הבליעה פעילות.
- התחל הקלטת וידאו של התנועה של העכבר בזירה קאמרית. לאפשר את העכבר כדי לחקור באופן חופשי במשך 6 דקות.
- להפסיק את 6 דקות ולחזור על העכבר לכלוב שלה הביתה.
3. ניתוח וידאו
- לחלופין, להכין וידאו עבור ניתוח על-ידי הפחתת קצב המסגרות. על מנת להפחית את קצב המסגרות עבור מעקב אחר ניתוח, להשתמש בפרוטוקול הבא וידאו עריכה תוכנה (למשל, קדמונית או בתוכנית דומה) תשמידי את קצב המסגרות הסרטונים לפי פקטור של 2.
הערה: בהתאם אורך וקצב המסגרות של הוידאו, זה עשוי להיות שימושי כדי להקטין את קצב מוידאו לפני ניתוח. במחקר זה, צולם ב 30 מסגרות לשנייה (6 דקות הקלטה, סה כ מונעת 10,800 מסגרות).- טעינת הוידאו לתוך התוכנה.
- תחת תפריט 'מהירות', בחר ' מהירות: מהר ' והגדר מהירות 2 x.
- ייצוא וידאו המושמדות בתבנית קובץ .mp4 למעקב אחר ניתוח.
- לפתוח את הסרטון לניתוח בו התוכנה. הגדר הכיול עבור הקלטת על-ידי שימוש בכלי שורת הוידאו. צייר קו לאורך צד אחד של התא. לחץ לחיצה ימנית על הקו ובחר "מדד כיול..." הזן את הגודל הממשי של הצד קאמרית בסנטימטרים.
- כדי להתחיל מעקב אוטומטי למחצה של העמדה העכבר, לחץ על הסמן 'העברה'.
החל המסגרת הראשונית בסרט הווידאו, לחץ לחיצה ימנית על הנקודה לבצע אחריהם מעקב; נקודת מעקב מסומן בעיגול כחול.
הערה: במחקר הנוכחי, המיקום של כל בעל חיים היה מעקב ע י איתור בבסיס הזנב. - לקדם את המסגרת על-ידי לחיצה על החץ ימינה על המקלדת. נקודת מעקב תנוע באופן אוטומטי בהתבסס על מיקומה של בסיס הזנב.
- אם המיקום מעקב אינו מתואם עם נקודת עניין בתוך מסגרת נתונה, באופן ידני ליישר את העיגול הכחול אל בסיס הזנב.
הערה: בהתאם לאיכות הווידאו ואת המהירות של העכבר, המעקב עשוי לדרוש רמות מגוונות של קלט משתמש כדי לשמור על היישור באמצעות נקודת עניין. הנתיב של העכבר צריך לקדם את דרך הקורס של הוידאו.
- אם המיקום מעקב אינו מתואם עם נקודת עניין בתוך מסגרת נתונה, באופן ידני ליישר את העיגול הכחול אל בסיס הזנב.
- בתום מעקב של וידאו מלא, לשמור את הסרטונים והמעקב הכיסוי. יצא את הנתונים לפי מיקום של העקיבה על-ידי בחירה "לייצא את הגיליון האלקטרוני".
4. ניתוח נתונים
- לפתוח בנתונים מיקומיים תוכנית גיליון אלקטרוני. תוכנת ניתוח תנועה דוחות ש-x, Y לתאם בין המיקום של העכבר בכל מסגרת.
- כדי לחשב מרחק שהושג על ידי מסגרת, השתמש במשוואה הבאה (איפה עמדה במסגרת אחד x1, y1 ומסגרת שני הוא x2, y2):
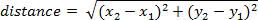
הערה: ניתן לחשב מרחק מצטבר לאורך זמן על-ידי הוספת את המרחק בין כל מסגרת.
תוצאות
וריאציות של שדה פתוח וזמינותו הוכחו להיות שיטה יעילה כדי לבחון את התקדמות המחלה במודלים של ניוון שרירים. . הנה, נדגים וידאו רב-תכליתי מעקב אחר שיטה לניתוח של תנועת העכבר מימדי באמצעות ציוד הקלטה זמינים ותוכנות קוד פתוח (איור 1 א'–B). דיווח ...
Discussion
וזמינותו בשדה פתוח מספק דרך יעילה, לא פולשנית מבחן המוטורית במודלים של העכבר של מחלת שריר, וריאציות של assay הזה יכול לשמש כאמצעי הקצה ערך מחקרים קליניים. מגבלה אחת גדולה עם סוג זה של וזמינותו היא עלות גבוהה ומוגבל הנגישות של פעילות מערכות ניטור. במחקר זה, נדגים מערכת בעלות נמוכה עבור ניתוח פע...
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מכוני הבריאות הלאומיים [R01 AR048179 ו R01 HL126204 R.C.W, T32 AR059033, F32 AR069469to כרומטוגרפיה] וארה ב ניוון שרירים האגודה [274143 ו- 416364 כדי R.C.W.].
Materials
| Name | Company | Catalog Number | Comments |
| Video camera | Apple Inc. | ME553LL/A | For recording ambulation video, iPhone 5S Plus (or equivalent) |
| Kinovea software (version 0.8.15) | Kinovea Association | Open source video analysis software. Free download, PC compatible (Version 0.8.15, www.kinovea.org) | |
| iMovie (version 10.0.6) | Apple Inc. | Any similar software can be used to reduce video frame rate (optional) | |
| Roughneck 32 Gallon Black Round Trash Bin (Open field chamber) | Rubbermaid | # 1778013 | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. |
| Avant White Plastic Tray 15"W x 10"D x 1.45"H (Open field chamber) | US Acrylic, LLC | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. | |
| C57BL/6J | Jackson Laboratory | #000664 | Male 6 month mice |
| C57BL/10ScSn-Dmd/J (mdx) | Jackson Laboratory | #001801 | Male 6 month mice |
| mdx: utrophin-Tg (fiona) | Gift from from James Ervasti, with permission from Kay Davies | Male 6 month mice |
References
- Nagaraju, K., Carlson, G., De Luca, A. Behavioral and locomotor measurements using open field animal activity monitoring system. TREAT-NMD SOP Number M2.1.002. 2. 2, (2010).
- Tatem, K. S., et al. Behavioral and locomotor measurements using an open field activity monitoring system for skeletal muscle diseases. J Vis Exp. (91), e51785 (2014).
- Kobayashi, Y. M., et al. Sarcolemma-localized nNOS is required to maintain activity after mild exercise. Nature. 456 (7221), 511-515 (2008).
- Belanto, J. J., et al. Microtubule binding distinguishes dystrophin from utrophin. Proc Natl Acad Sci U S A. 111 (15), 5723-5728 (2014).
- McDonald, C. M., et al. The 6-minute walk test in Duchenne/Becker muscular dystrophy: longitudinal observations. Muscle Nerve. 42 (6), 966-974 (2010).
- Mazzone, E., et al. Star Ambulatory Assessment, 6-minute walk test and timed items in ambulant boys with Duchenne muscular dystrophy. Neuromuscul Disord. 20 (11), 712-716 (2010).
- Kobayashi, Y. M., Rader, E. P., Crawford, R. W., Campbell, K. P. Endpoint measures in the mdx mouse relevant for muscular dystrophy pre-clinical studies. Neuromuscul Disord. 22 (1), 34-42 (2012).
- Acosta, A. R., et al. Use of the six-minute walk test to characterize golden retriever muscular dystrophy. Neuromuscul Disord. 26 (12), 865-872 (2016).
- Sousa, N., Almeida, O. F., Wotjak, C. T. A hitchhiker's guide to behavioral analysis in laboratory rodents. Genes Brain Behav. 5, 5-24 (2006).
- Gibbs, E. M., et al. High levels of sarcospan are well tolerated and act as a sarcolemmal stabilizer to address skeletal muscle and pulmonary dysfunction in DMD. Hum Mol Genet. 25 (24), 5395-5406 (2016).
- Gillis, J. M. Multivariate evaluation of the functional recovery obtained by the overexpression of utrophin in skeletal muscles of the mdx mouse. Neuromuscul Disord. 12, S90-S94 (2002).
- Tinsley, J., et al. Expression of full-length utrophin prevents muscular dystrophy in mdx mice. Nat Med. 4 (12), 1441-1444 (1998).
- Song, Y., et al. Suite of clinically relevant functional assays to address therapeutic efficacy and disease mechanism in the dystrophic mdx mouse. J Appl Physiol. 122 (3), 593-602 (2017).
- Bolivar, V. J. Intrasession and intersession habituation in mice: from inbred strain variability to linkage analysis. Neurobiol Learn Mem. 92 (2), 206-214 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved