A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פרוטוקול עבור הייצור של וקטורים Lentiviral חשוכת-Integrase עבור CRISPR/Cas9-מתווכת נוקאאוט גנטי חלוקת תאים
In This Article
Summary
אנו מתארים את האסטרטגיה הייצור של וקטורים lentiviral חשוכת-integrase (IDLVs) בתור כלי רכב להעברת CRISPR/Cas9 לתאים. עם היכולת לתווך ג'ין מהיר וחזק עריכה בתאים, IDLVs להציג דרך בטוחה יותר, פלטפורמה וקטור יעיל באותה מידה המסירה הגן לעומת integrase-המוסמכת וקטורים.
Abstract
וקטורים lentiviral הם הבחירה האידיאלית עבור אספקת רכיבים לעריכת גנים בתאים עקב שטמונה בהם stably transducing רחבה של תאים, מתווכים רמות גבוהות של ביטוי גנים. עם זאת, היכולת שלהם להשתלב הגנום של התא המארח מגבירה את הסיכון המוטגניות insertional ובכך מעלה חששות בטיחות, מגביל את שימושם בהגדרות קליניים. עוד, הביטוי מתמיד של רכיבים לעריכת גנים מועברים על ידי הללו עליות וקטורים אינטגרציה-כשיר lentiviral (ICLVs) ההסתברות של ג'ין מופקר מיקוד. כחלופה, דור חדש של וקטורים lentiviral חשוכת-integrase (IDLVs) פותחה הנותן מענה הרבה חששות אלה. כאן הפרוטוקול הייצור של פלטפורמה IDLV חדשות ומשופרות בתיווך CRISPR גן עריכה של רשימת הצעדים מעורב הטיהור, שמתואר הריכוז של וקטורים כזה שלהם התמרה חושית ואת יעילות לעריכת הגן באמצעות HEK-293T הודגם תאים. פרוטוקול זה הוא שניתן להרחבה בקלות והוא יכול לשמש כדי ליצור IDLVs כייל נוגדנים גבוה כי הם מסוגלים transducing תאים בתוך חוץ גופית ו vivo בתוך. יתר על כן, פרוטוקול זה ניתן להתאים בקלות לייצור של ICLVs.
Introduction
ג'ין מדויק עריכה צורות היסוד של התקדמות גדולה ביו המערבות הפיתוח של אסטרטגיות מקוריות כדי להתמודד עם מחלות גנטיות. At בחזית טכנולוגיות לעריכת ג'ין היא השיטה להסתמך על השימוש clustered regularly -אניnterspaced sהורט palindromic repeats (CRISPR) / מערכת Cas9 היה מזוהה תחילה רכיב של חיידקי חסינות מפני הפלישה של החומר הגנטי הנגיפי (נבדקה הפניות1,2). יתרון גדול של מערכת CRISPR/Cas9 על עריכת הגן כלים אחרים, כגון אבץ-אצבע nucleases (ZFNs) ו- nucleases אפקטור activator דמוי שעתוק (TALENs) (נבדקה הפניה3), הוא הפשטות היחסית של פלסמיד עיצוב ו בניית רכיבים CRISPR — תכונה יש מופעל הרחבת גן לעריכת ממעבדות מיוחדים כמה רחב יותר לקהילה מחקר רב. בנוסף, הפשטות של תכנות CRISPR/Cas9 ואת יכולת זיהוי המטרה מרובבת יש נוספת מונעת את הפופולריות שלו כטכנולוגיה חסכוניים, קל לשימוש. בין השיטות השונות לרשות החוקרים למסור לרכיבים אלה לעריכת ג'ין תאים, וקטורים ויראלי נותרו עד כה במערכת הפופולרית והיעילה ביותר.
Lentiviral וקטורים (אותו) הופיעו כמו הרכב של לספק את הרכיבים של CRISPR/Cas9 מערכת ויוו עבור יישומים שונים ומגוונים4,5,6,7. מספר תכונות מפתח להפוך אותו בחירה פופולרית עבור תהליך זה כולל את היכולת שלהם להדביק החלוקה הלא-חלוקת תאים, immunogenicity נמוך, והן רעילות מינימלית הסלולר (נבדקה הפניה8). כתוצאה מכך, LV בתיווך ריפוי גנטי כבר מועסקים בטיפולים של מחלות זיהומיות, כגון HIV-1, HBV ו- HSV-1, כמו גם את התיקון של פגמים הבסיסית האנושית מחלות תורשתיות, כגון סיסטיק פיברוזיס, ניאו-וסקולרית ניוון מקולרי 4 , 5 , 7 , 9 , 10 , 11. Moreover, הזינו אותו ביעילות שונו כדי לבצע ג'ין מולטיפלקס העריכה ברורים לוקוסים גנומית באמצעות מערכת של וקטור יחידה12.
עם זאת, המאפיין הטבועה של אותו לשלב לתוך הגנום המארח יכול להיות מוטגן, לעיתים קרובות מגבילה את השירות שלהם בתור כלי רכב משלוח transgene, במיוחד בהגדרות קליני. יתר על כן, מאז אותו משולבת stably אקספרס transgenes שלהם ברמה גבוהה בר קיימא, מערכת זו היא נועד למסירה של עריכת ג'ין רכיבים כגון CRISPR/Cas9; ביטוי של Cas9-מדריך RNA (gRNA), חלבונים דומים כגון ZFNs, קשורים עם רמות גבוהות של חופש-יעד אפקטים, הכוללים מוטציות לא רצויים13,14,15,16 , 17 פוטנציאלי יכול לשפר את cytotoxicity18. כדי להשיג דיוק לעריכת ג'ין עם תופעות מינימליות את המטרה, לכן לבריאותה של עיצוב מערכות המאפשרות עבור הביטוי ארעית של ג'ין עריכה רכיבים.
בשנים האחרונות פותחו מגוון רחב של פלטפורמות משלוח לבטא transiently CRISPR/Cas9 תאים16,19,20,21 (נבדקה הפניה22). אלה כוללים שיטות המסתמכות על ישירות ידביקו מטוהרים Cas9 יחד עם RNAs המדריך המתאים תאים, אשר הוצגה להיות יעילה יותר ממוקד לעריכת ג'ין לעומת תקנים בתיווך פלסמיד16. מחקרים הראו כי ribonucleoprotein (RNP) מתחמי המורכב מדריך RNA/Cas9 החלקיקים מופעלים במהירות לאחר תיווכה ביקוע DNA במטרות שלהם, רומז כי הביטוי לטווח קצר של רכיבים אלה מספיקה להשיג גנים חזקים עריכה16. . שכעיקרון, שילוב שאינו וקטור ויראלי פלטפורמות כגון adeno-הקשורים וקטורים ויראלי (AAVs) יכול לספק אלטרנטיבה מעשית כדי לספק מכונות לעריכת גנים לתאים. למרבה הצער, AAV capsids בעלי יכולת אריזה נמוך משמעותית מאשר אותו (< 5kb), אשר פוגעת קשות ביכולתם כדי לארוז את ערכת הכלים CRISPR רב רכיבים בתוך וקטור יחידה (נבדקה הפניה8). ראוי לציין כי תוספת של תרכובות היסטון deacetylases (למשל, נתרן butyrate23) לעכב או לעצור את מחזור התא (למשל, קפאין24) הוכחו להגביר את lentiviral titers. למרות התקדמות האחרונות, המערכות ביטוי ארעי פיתחה עד כה הם עדיין מובן חסרונות מספר, כגון יעילות ייצור נמוכה יותר, אשר להוביל titers ויראלי מופחתת ויעילות נמוכה התמרה חושית של וירוסים שנוצר דרך כך ניגש25.
וקטורים lentiviral חשוכת-Integrase (IDLVs) מייצגים לקידום המשמעותי בפיתוח של ג'ין-מסירה רכב, המשלבים את היכולת אריזה של אותו עם ערך מוסף כמו AAV תחזוקה episomal בתאים. תכונות אלה מסייעות IDLVs במידה רבה לעקוף את הנושאים העיקריים הקשורים עם שילוב של וקטורים, ושהבנק vis ביטוי רציף של פוטנציאל genotoxic רכיבים, המוטגניות בתיווך אינטגרציה. בעבר הוכח כי ניתן לשנות בהצלחה IDLVs כדי לשפר את ג'ין episomal ביטוי26,27. לגבי משלוח בתיווך IDLV CRISPR/Cas9, ייצור נמוך titers וביטוי התחתון של הגנום בעקיצות episome ביחס למערכות lentiviral integrase שולטים מגביל את השירות שלהם פיד ה בונה כלי להעברת לעריכת הגנום בונה מהונדס. לאחרונה להדגים כי הביטוי transgene והן titers ויראלי המשויך IDLV ייצור באופן משמעותי משופר על ידי הכללת מחייב אתרים עבור גורם שעתוק Sp1 בתוך קלטת הביטוי ויראלי28. IDLVs ששונה robustly הנתמכים בתיווך CRISPR גן לעריכת במבחנה (בתאים HEK-293T) והן ויוו (בתוך הנוירונים במוח mitotic פוסט), תוך גרימת מוטציות את המטרה מזערית בהשוואה המתאימה בתיווך ICLV מערכות28. בסך הכל, פיתחנו רומן, ערכת CRISPR קומפקטי, ה-all-in-one נישא על פלטפורמה IDLV, התווה את יתרונות שונים של שימוש כזה משלוח הרכב לעריכה ג'ין משופרת.
כאן, פרוטוקול הייצור של המערכת IDLV-CRISPR/Cas9 הוא כמתואר לעיל, כולל את השלבים השונים הכרוכים הרכבה, היטהרות, ריכוז, וכן טיטור של IDLVs, כמו גם אסטרטגיות כדי לאמת את היעילות לעריכת גנים של וקטורים אלה. פרוטוקול זה בקלות להרחבה כדי לענות על הצרכים של חוקרים שונים והוא נועד ליצור בהצלחה LV וקטורים עם titers בטווח של 1 x 1010 יחידות (טו) transducing / mL. הווקטורים שנוצר באמצעות פרוטוקול זה יכול להיות מנוצל ביעילות תדביק את מספר סוגי תאים שונים, לרבות קשה-עד-מגלי בתאי גזע עובריים, תאים hematopoietic (תאי-T ו מקרופאגים), ותרבותית, vivo- נוירונים מוזרק. יתר על כן, הפרוטוקול היא באותה מידה מותאם היטב עבור הייצור של וקטורים lentiviral integrase-המוסמכת בכמויות דומות.
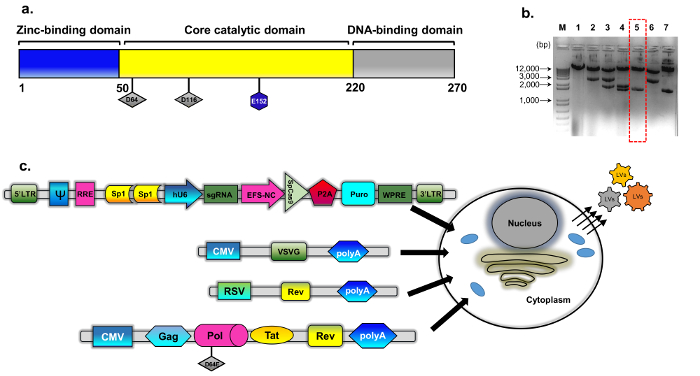
איור 1: אריזה IDLV. (א) סכמטית פראי סוג integrase חלבון (ב') פלסמיד ששונה נבעה psPAX2 (ראה שיטות בנייה פלסמיד לפרטים). נציג agarose ג'ל תמונה של שיבוטים איבחון integrase מוטציה שיבוטים. דגימות די אן איי המוכנים דנ א פלסמיד רגיל בידוד ערכת מיני נותחו על ידי עיכול עם EcoRV ו- SphI. מתעכל כראוי השיבוט (מס ' 5, תיבת אדום מקווקו) נוסף אומתה על ידי רצף ישיר (סנגר) עבור החלפה D64E ב INT. בקלטת האריזה לקויה integrase נקרא pBK43. (ג) תיאור סכמטי של פרוטוקול תקנים ארעי מועסקים ליצירת וקטורים IDLV-CRISPR/Cas9, מציג 293T תאים transfected עם VSV-G, אריזה transgene קלטות (Sp1-CRISPR/Cas9 ה-all-in-one פלסמיד). נגיפים זה באד של קרום התא להכיל את הרנ א באורך מלא של וקטור (הביע מ הקלטת transgene). הדור השני של מערכת IDLV-אריזה שימש, אשר כוללת את חלבוני Tat, הכומר Rev ביטוי נוסף מצורפים מ קלטת נפרדת (RSV-REV-פלסמיד). Abbrev: משמאל לימין-ארוך-מסוף stomatitis vesicular אני חוזר, VSV-G, וירוס גרם חלבון, יזם pCMV-cytomegalovirus; סרקומה ראוז יזם וירוס (RSV); הכנה-(רכיב תשובה Rev). רכיבים אחרים רגולטוריות בקלטת ביטוי כוללות אתרים מחייב Sp1, רכיב Rev תשובה (הכנה), מרמיטה הפטיטיס וירוס Posttranscriptional תקינה רכיב (WPRE), מקדם 1α גורם התארכות הליבה (EFS-NC), האריזה וקטור רכיב ψ (psi), אנושי המקדם Cytomegalovirus (hCMV) ויזם U6 אנושי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. culturing HEK-293T תאים ותאים זריעה על תרביות תאים
הערה: כליות עובריים אנושיים 293T (HEK-293T) התאים גדלים DMEM, מדיה גלוקוז גבוהות בתוספת 10% שור עגל סרום בתוספת ברזל וצמיחה היזמים, 1 x פתרון אנטיביוטיקה-antimycotic (פתרון x 100 מכיל 10,000 יחידות פניצילין סטרפטומיצין 10 מ ג, 25 µg שהוא גוסס B לכל מ"ל). התקשורת היא גם בתוספת 1 x נתרן פירובט, תערובת חומצות אמיניות שאינם חיוניים 1 x ו- 2 מ מגלוטמין (מניות 200 מ מ- alanyl-L-גלוטמין dipeptide 0.85% NaCl). תאים מתורבתים ב- 100 מ מ תרביות רקמה צלחות (שטח גידול משוער הוא 55 cm ²). טיפוח משנה יחס של 1:10 משמשת עם תת culturing כל 2-3 ימים. טריפסין-EDTA 0.05% משמש דיסוציאציה של תאים בין קטעים. כדי לשמור על עקביות בין ניסויים, אנו ממליצים על בדיקות עגל סרה כאשר מחליפים הרבה/אצווה שונים לעקוב אחר כל השינויים צמיחת תאים, יעילות תרביות תאים, ו וקטור הייצור.
- מתחילים תרבות חדשה באמצעות תאי המעבר נמוך (מומלץ לא להשתמש בתאים לאחר המעבר 15 או אם הגידול מואט) על-ידי זריעת לתוך צלחת תרביות רקמה ס מ-10. השתמש DMEM בתוספת 10% נסיוב צמיחת תאים. לגדל תאים ב 37 ° C עם 5% CO2 בחממה תרביות רקמה סטנדרטי. השתמש hemocytometer סטנדרטי לספור תאים עבור כל השלבים הבאים.
- ברגע התאים להגיע 90-95% צמיחה confluent, reseed לתוך 15 ס מ תרביות רקמה צלחות (להלן, צעדים 1.3 - 1.5).
- כדי reseed, תשאף מדיה מהצלחת confluent ולשטוף בעדינות עם PBS עקר 1 x. דגירה תאים עם 2 מיליליטר דיסוציאציה ריאגנט (למשל, טריפסין-EDTA) ב 37 מעלות צלזיוס במשך 3-5 דקות להוסיף 8 מ של המדיה המכילה סרום בטל הכימית דיסוציאציה, triturate 10 - 15 פעמים עם פיפטה סרולוגית 10 מ ליצירת תא בודד ההשעיה. Resuspend תאים בתקשורת התרבות כדי להשיג צפיפות התאים של 4 x 106 תאים למ"ל.
- כדי לשפר את הדבקות המצע, מעיל מראש צלחות 15 ס מ עם ג'לטין 0.2%, הוספת 8 מ של ג'לטין לכל צלחת. נמרח על פני-השטח של הצלחת, דגירה בטמפרטורת החדר במשך 10 דקות, לשאוב את הנוזל.
- להביא את הנפח הכולל של כל צלחת 25 מ ל חם (37 מעלות צלזיוס) מדיה טי HEK-293 (ראה הערה תחת שלב 1), זרע את הצלחות על-ידי הוספת 2.5 מ של תאים (סה כ ~ 1 x 107 תאים/צלחת). דגירה צלחות ב 37 ° C עם 5% CO2 למשך הלילה או עד 70-80% confluency.
הערה: עד 15 ס מ 6 צלחות יכול לשמש לייצור. לכוון את עוצמת הקול של מדיה לכל צלחת ~ 20-22 מ ל בעת שימוש יותר מארבעה לוחות (עיין בשלב 5 של הפרוטוקול של רציונל).
2. HEK transfecting-293T תאים באמצעות פרוטוקול מבוסס סידן פוספט
-
ריאגנטים תרביות תאים
- כדי להכין 2 x פתרון באגירה ולבס BBS (50 מ מ ולבס, 280 ממ NaCl, 1.5 מ מ נה2HPO4), לשלב 16.36 g של NaCl, 10.65 גר' ולבס (N, N-bis (2-hydroxyethyl)-2-אמינו-חומצה ethanesulfonic), ו- g 0.21 נה2HPO4. להוסיף מזוקק פעמיים H2O (dd-H2O) עד 900 מ ל. התמוססות, titrate את ה-pH 6.95 עם 1 M NaOH ולהביא נפח למסנן ל' 1 באמצעות יחידת מסנן מיקרומטר 0.22. חנות ב-20 ° C.
- להכין CaCl 1 מ'2. לסנן פתרון באמצעות מסנן 0.22 מיקרומטר. חנות ב 4 º C.
- להתבונן הפלטות שיש היו נזרע לכהן ביום. התאים מוכנים תרביות תאים, ברגע שהם יגיעו confluency 70-80%.
- האחות המדיה הישנה מן הלוחות ומוסיפים בעדינות טריות מדיה ללא סרום.
הערה: ראה קובץ משלים 1-פלסמידים לקבלת פרטים אודות פלסמידים שבחרת את והכנות שלהם. - הכן את התמהיל פלסמיד באמצעות aliquoting ארבעת פלסמידים לתוך צינור חרוטי 15-mL. לשימוש תכשיר יחיד צלחת 15 ס מ, µg 37.5 של CRISPR/Cas9-העברת וקטור (pBK198 או pBK189), 25 µg של pBK43 (psPAX2-D64E), 12.5 µg pMD2.G, µg 6.25 של הקודם (איור 1 c).
- הוסף 312.5 µL 1 מ' CaCl2 לתערובת פלסמיד. זה, להוסיף עד 1.25 מ ל סטרילי dd-H20.
- לאט לאט (drop-wise) הוסף mL 1.25 של פתרון 2 x BBS בעת vortexing המיקס. תקופת דגירה של 30 דקות בטמפרטורת החדר.
- להוסיף את התערובת תרביות תאים dropwise כל צלחת 15-ס"מ (2.5 מ לכל צלחת). מערבולת הלוחות בעדינות, דגירה ב 37 ° C עם 5% CO2 על 2-3 h. לאחר מכן, להוסיף סרום 2.5 מ ל (10%) לכל צלחת ולהמשיך המקננת לילה (12-18 h).
הערה: מעבדות כמה להשתמש 3% CO2 חממות לייצב את המדיה pH. עם זאת, אנחנו לא להתבונן כל הבדל בין 3% ל 5% CO2תרביות תאים יעילות. בנוסף, בגודל של קאפו4 ארגונייט שוקע חיונית ליעילות תרביות תאים; המיקס תרביות תאים חייב להיות ברור לפני תוספת שלה אל התאים. אם השילוב הופך מעוננים במהלך הדגירה, להכין טרי x BBS 2 (ה-pH = 6.95).
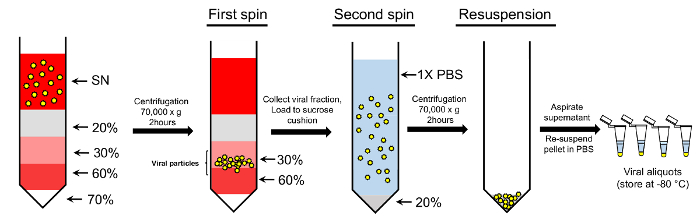
איור 2: ריכוז של חלקיקי נגיפי באמצעות פרוטוקול מעבר צבע כפול-סוכרוז. נגיפים שנאסף את תגובת שיקוע (SN) נטענים על מעבר הדרגתי סוכרוז. 70%, 60%, 30%, 20% סוכרוז ופתרונות משמשים כדי ליצור מעבר הצבע. בעקבות צנטריפוגה, החלקיקים שנאסף 30-60% סוכרוז שברים נוספים מעמיסים אותו על כרית 20% סוכרוז, זירז. בגדר הסופי המכיל נגיפים מזוכך הוא resuspended ב 1 x PBS לשימוש נוסף (ראה טקסט לפרטים נוספים). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
3. יום אחרי תרביות תאים
- לבחון את התאים על מנת להבטיח כי הם מתקרבים 100% confluency בשלב זה עד מוות התא. החלף מדיה על-ידי הוספת 25 מ של DMEM טריים + סרום 10% על כל צלחת. המשך המקננת ב 37 ° C עם 5% CO2 עבור h 48 נוספים.
הערה: להתאים את עוצמת הקול של מדיה בשלב 3.1 אם משתמש יותר משישה צלחות 15 ס מ (ראה צעד 5.2, שימו לב).
4. קצירת וירוס
- בזהירות לאסוף את תגובת שיקוע צלחות תרביות רקמה המכילות את התאים transfected באמצעות פיפטה תרביות רקמה סטרילי 10 מ"ל בריכת צינורות צנטריפוגה 50 מ.
- ברור ההשעיה על ידי צנטריפוגה ב 400-450 g x 10 דקות באמצעות צנטריפוגה שולחן. לסנן את תגובת שיקוע דרך יחידת מסנן ואקום 0.45 מיקרומטר.
הערה: תגובת שיקוע מסוננים יכולה להיות מאוחסנת ב 4 ° C עד 4 ימים לפני שתמשיך עם ריכוז, או aliquoted, המאוחסנת ב- 80 ° c Titers הצפויות של IDLV-Sp1-CRISPR/Cas9 (שאינם מרוכזים) ויראלי ההכנות צריך להיות ~ 2 x 107 TU/mL (עיין לשלב 6 לקביעת כייל נוגדנים). עם זאת, יש להימנע העמדת את ההכנות ויראלית כדי מספר מחזורים ההקפאה-הפשרה, כמו כל סיבוב של הקפאה והפשרה תוצאות 10-20% הפסד titers תפקודית.
5. ריכוז של נגיפים על ידי Ultracentrifugation
הערה: אנו מנצלים שיטת כפול-סוכרוז טיהור זה כרוך בשני שלבים: שלב מעבר צבע סוכרוז וצעד כרית סוכרוז (איור 2).
- לטעון את הצינורות ultracentrifugation חרוט לפי הסדר הבא כדי ליצור מעבר הדרגתי סוכרוז: 0.5 מ ל-70% סוכרוז (מומס 1 x PBS), 0.5 מ ל 60% סוכרוז (מומס DMEM), 1 מ ל 30% סוכרוז (מומס DMEM) ו- 2 מ ל 20% סוכרוז (מומס 1 x PBS).
-
הוסף את תגובת שיקוע המכיל וירוס בזהירות מעבר הצבע. כמו הנפח הכולל של תגובת שיקוע של ארבעה לוחות 15 ס מ 100 מ ל, להשתמש 6 צינורות ultracentrifugation לכל ספין כדי לעבד הכרך המלא של הנגיף supernatant.
- כל שפופרת ultracentrifugation המשמש עבור שלב זה בעל קיבולת אחסון של עד 30 מ ל (כולל הנפח של סוכרוז), פזר הנגיפי תגובת שיקוע באופן שווה בין צינורות, משאיר לפחות 10% קראוון למניעת זליגת.
- לכוון את עוצמת הקול של תרבות עד ~ 20-22 מ"ל לכל צלחת בעת השימוש יותר מארבעה לוחות 15 ס מ עבור כל ניסוי, כך הנפח הסופי של תגובת שיקוע במאגר נגיפי בקלות ניתן לאכלס בתוך צינורות ultracentrifugation 6.
- מילוי ultracentrifugation צינורות כדי לפחות שלושה רבעים קיבולת הנפח הכולל שלהם, אחרת שבירה של צינורות יכול להתרחש במהלך צנטריפוגה, וכתוצאה מכך איבוד אפשרי של נזק מדגם ו/או ציוד.
- לאזן את הצינורות עם 1 x PBS דגימות צנטריפוגה-g 70,000 x עבור 2 h ב 17 ° C (ראה טבלה של חומרים לפרטים רוטור).
הערה: כדי למנוע הפרעה של השכבה סוכרוז במהלך ההאצה, להגדיר את ultracentrifuge להאיץ לאט את הרוטור כדי 200 סל ד במהלך הראשון 3 דקות הסיבוב. באופן דומה, להגדיר את ultracentrifuge כדי לאט להאט הרוטור מ 200 סל ד כדי 0 סל ד מעל 3 דקות בסוף הסיבוב. - בזהירות לאסוף 30-60% סוכרוז שברים לתוך צינורות נקיים (איור 2). להוסיף 1 קר x PBS כדי שברים במאגר ולהביא את הווליום עד 100 מ"ל; מערבבים על-ידי pipetting למעלה ולמטה מספר פעמים.
- המשך לשלב כרית סוכרוז על ידי בקפידה שכבות ההכנה ויראלי על כרית סוכרוז. בשביל זה, להוסיף מ 4 ל 20% סוכרוז (ב 1 x PBS) ברכבת התחתית, ואחריו ~ 20-25 מ של הפתרון ויראלי למחזור. אם הן פחות שלושה רבעים מלא, למעלה למעלה עם PBS x 1 סטרילי.
- בזהירות לאזן, centrifuge את הדגימות-g 70,000 x עבור 2 h ב 17 ° C, כמו קודם. יוצקים את תגובת שיקוע ולאפשר הנותרים נוזל ניקוז על ידי היפוך צינורות על מגבות נייר.
- האחות טיפות הנותרים על מנת להסיר כל נוזל בגדר. בשלב זה, כדורי המכיל וירוס צריך להיות בקושי נראה קטן. נקודות שקופות.
- Resuspend כדורי על-ידי הוספת µL 70 ל- PBS 1 x שפופרת הראשון ו ביסודיות pipetting ההשעיה, לאחר מכן מעביר את המתלים הצינור הבא, ערבוב כמו לפני, שתמשיך עד כל החבילות הן resuspended.
- לשטוף את הצינורות עם µL 50 נוספים של 1 קר-PBS ומיקס כמו קודם. ודא האחסון משולב של התליה האחרון ~ 120 µL, מופיע מעט חלבי; ברור זה על ידי צנטריפוגה ב g x 10,000 ל 30 s ב- microcentrifuge השולחן.
- להעביר את תגובת שיקוע צינור microfuge טריים, להפוך 10 µL aliquots, ולאחסן אותם ב- 80 ° c
הערה: הימנעו מביצוע מחזורים ההקפאה חוזרות ונשנות-הפשרה על הדגימות lentiviral. מלבד מתי צנטריפוגה נדרש, המאמצים צריך כדי לבצע את השלבים הנותרים בברדסים תרביות רקמה או המיועד חדרים תרביות רקמה באמצעות אמצעי אבטחה המתאימה (ראה דיון).
6. הערכה של Titers ויראלי
-
p24 -אנזים-מקושרים immunosorbent assay (אליסה) שיטה
הערה: וזמינותו מתבצע באמצעות לוחות 96-ובכן גבוהה מחייב כפי לפי ההוראות של התוכנית חיסון לאיידס NIH עבור HIV-1 p24 לכידת הנוגדנים קיט (ראה טבלה של חומרים) עם שינויים29.- למחרת, לשטוף את הבארות שלוש פעמים עם 200 µL 0.05% 20 Tween ב- PBS קר (פתרון PBS-T). מעיל לצלחת עם 100 µL של נוגדן anti-p monoclonal24 לדילול 1:1500 ב 1 x PBS, דגירה בין לילה ב 4 º C.
- כדי למנוע מחייב שאינם ספציפיים, לחסום את הצלחת עם 200 BSA 1% µL ב- PBS; תשטוף שלוש פעמים עם 200 µL 0.05% 20 Tween ב- PBS קר (פתרון PBS-T) במשך לפחות שעה בטמפרטורת החדר.
-
הכין דוגמיות: על ההכנות וקטור מרוכז, לדלל 1 µL מדגם 100-fold על-ידי הוספת µL 89 של dd-H20 ו-10 µL של טריטון X-100 (ריכוז סופי של 10%). על ההכנות שאינם מרוכזים, להכין ten-fold דגימות מדולל (להוסיף 80 µL של µL dd-H20 ל- 10 של טריטון X-100 (ריכוז סופי של 10%) µL 10 של המדגם).
הערה: דוגמאות שניתן לאחסן ב-20 ° C בשלב זה לתקופה ממושכת של זמן לשימוש מאוחר יותר. - הכנת תקנים HIV-1 על-ידי החלת לדילול טורי 2-fold (עם ההתחלה ריכוז 5 ננוגרם למ"ל).
- לדלל מרוכז דגימות (1: 100 מניות מראש מדולל) ב- RPMI 1640 בתוספת 0.2% Tween 20 ו- 1% BSA להקים 1:10, 000, 1:50, 000, 1:250,000 דילולים. לדלל דגימות שאינם מרוכזים (מ 1:10 מראש בדילול המניות) ב- RPMI 1640 בתוספת 0.2% Tween 20 ו- 1% BSA להקים דילולים שבערך, 1:2500 ו- 1:12,500.
- להחיל דוגמיות בצלחת ב triplicates, דגירה בין לילה ב 4 º C.
- למחרת, לשטוף הבארות שש פעמים, דגירה ב 37 מעלות צלזיוס במשך 4 שעות עם 100 נוגדן anti-p24 ארנב polyclonal µL, 1:1000 מדולל ב RPMI 1640, 10% FBS, BSA 0.25% ו- 2% העכבר הרגיל סרום (NMS).
- לשטוף שש פעמים. כאמור לעיל, דגירה ב 37 ° C עבור h 1 עם עז ארנב נגד חזרת peroxidase 1:10,000 IgG מדולל ב RPMI 1640 בתוספת סרום עז רגילה 5%, 2% NMS, BSA 0.25% ו- 0.01% Tween 20.
- רוחצים את הצלחת, כמפורט לעיל, את דגירה עם שוייץ סובסטרט peroxidase בטמפרטורת החדר למשך 15 דקות.
- לעצור את התגובה על ידי הוספת µL 100 של 1 N HCL. למדוד את ספיגת מדגם ב-450 nm באמצעות את ספיגת צלחת הקורא.
-
מדידה של הכתב פלורסנט בעוצמה
- שיטת FACS
הערה: היקף GFP דלדול אותות בתאים יכול להיות מדויק מוערך על ידי מדידת קרינה פלואורסצנטית רשע בעוצמה של התאים transduced ויה cytometry זרימה. נא לפנות הנייר האחרונות 28 ניתוח נתונים FACS, מצגת של פרשנות. הפרוטוקול מתוארת כדלקמן.- לגרום לדילול טורי ten-fold ההכנה (מתוך 10-1 כדי 10-5) התכשיר ויראלי ב- PBS 1 x.
- זרע כ 5 x 105 293T תאים כל טוב של צלחת 6-ובכן באמצעי אחסון הסופי של 2 מ לכל טוב. להוסיף 10 µL של כל דילול ויראלי לתאים, דגירה תאים ב 37 מעלות צלזיוס במשך 48 שעות.
- קציר תאים לניתוח FACS כדלקמן: להוסיף 200 µL של 0.05% טריפסין-EDTA פתרון, דגירה תאים ב 37 מעלות צלזיוס במשך 5 דק הוסף 2 מ"ל של התקשורת DMEM מלאה, לאסוף דגימות לתוך צינורות חרוט 15 מ"ל.
- גלולה תאים על ידי צנטריפוגה ב 400 x g ב 4 ° C, resuspend בגדר ב µL 500 ל- PBS קר 1 x.
- עבור קיבעון, להוסיף אמצעי שווה של 4% פורמלדהיד פתרון ההשעייה, תקופת דגירה של 10 דקות בטמפרטורת החדר.
- גלולה תאים קבוע, resuspend ב מ 1 ל 1 x PBS. לנתח GFP ביטוי באמצעות מכשיר FACS, כמתואר ב. Ortinski et al. 28 . בקצרה, להשתמש בנוסחה הבאה כדי לקבוע כייל פונקציונלי וירוס:
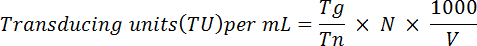
הערה: כאן Tg = מספר התאים GFP-חיוביות בספירה. Tn = המספר הכולל של תאים בספירה. N = מספר כולל של תאים transduced; V = נפח (µL) המשמש עבור התמרה חושית. לדוגמה: אם עונה 1 פרק 106 תאים היו transduced עם µL 10 של וירוס, 2 x 104 תאים היו שנספרו ו 5 x 103 היו GFP-חיובית, בהתבסס על המשוואה הנ ל כייל פונקציונלי יהיה:
- ספירת תאים GFP-חיובית
- לחשב את הריבוי של זיהום (MOI) המשמש עבור התמרה חושית. מבחן של טווח רחב של MOIs (1-10), עם הגדלת MOIs והתוצאה היא יעילות גבוהה יותר התמרה חושית.
- לפני תרביות תאים, זרע צלחת 6-ובכן עם 3-4 x 105 תאים לכל טוב. ברגע התאים מגיע > 90% confluency (בדרך כלל תוך 24 שעות), מגלי עם הווירוס מטוהרים-MOIs שנקבע מראש.
- תקופת דגירה צלחת ב 37 ° C עם 5% CO2 בתרבות רקמה סטנדרטי ותאים צג במרווחי זמן קבועים של 1-7 ימים לקראת שינויים אות ה-GFP.
- לספור את מספר תאי ה-GFP-חיובית עם מיקרוסקופ פלואורסצנטי (תוכנית 4 X המטרה, 0.1 N.A, 40 X הגדלה) מצוידים עם ערכת מסנן GFP (ננומטר אורך גל-470 עירור, פליטה ננומטר אורך גל-525), באמצעות תאים (לא transduced) תמים כדי להגדיר את האוכלוסיה תאי ה-GFP-שלילי וחיובי.
- להעריך את כייל הסופי על-ידי התאמת הגורם דילול, האחסון, באמצעות הנוסחה הבאה:
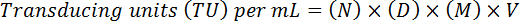
הערה: כאן, N = מספר התאים GFP-חיובית, D = דילול פקטור, M = פקטור ההגדלה (בדרך כלל 20 X), V = נפח של וירוס המשמש עבור התמרה חושית. לדוגמה, עבור 20 תאים GFP-חיוביות (N) נספרים לדילול 10-4 (1:10, 000) במדגם 10 µL (V) בגיל 20 X הגדלה (ז) (D) כתוצאה פונקציונלי כייל של (20 x 104) x (20) x x (10) (100 *) = 4 x 108 TU/mL.
(* להסתגל לכל mL)
- שיטת FACS
Access restricted. Please log in or start a trial to view this content.
תוצאות
אימות של נוקאאוט-היעילות של וקטורים IDLV-CRISPR/Cas9
השתמשנו GFP-לבטא 293T תאים כמודל כדי לאמת את היעילות של CRISPR/Cas9-מתווכת נוקאאוט גנטי. GFP + תאים נוצרו על ידי התמרה חושית של תאים HEK-293T עם pLenti-GFP (vBK201a)-MOI של 0.5 (איור 3b, "לא-וירוס" לוח). הקלטת sgRNA-כדי-GFP/Cas9 ה-all-in-one וקט...
Access restricted. Please log in or start a trial to view this content.
Discussion
IDLVs החלו להסתמן כמו הרכב של ויוו ג'ין-עריכה, במיוחד בהקשר של מחלות גנטיות, בעיקר בשל הסיכון נמוך מוטגנזה מכוונת המשויך וקטורים אלה בהשוואה שילוב פלטפורמות משלוח22 , 28. בחוברת הנוכחית חיפשנו לפרט פרוטוקול המשויך הייצור של המערכת IDLV-CRISPR/Cas9 ה-all-in-one משופרת שפ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
פטנטים USC-499-P (1175) הוגשה על-ידי באוניברסיטת דרום קרוליינה ביחס העבודה המתוארת בכתב היד.
Acknowledgements
ברצוננו להודות המחלקה לנוירוביולוגיה, בית הספר לרפואה של אוניברסיטת דיוק ו- Office של דין עבור המדע הבסיסי, אוניברסיטת דיוק. אנו מודים גם חברי הגרעין וקטור ויראלי הדוכס להערות על כתב היד. פלסמיד pLenti CRISPRv2 היה מתנה ג'אנג פנג (במכון). מערכת LV-האריזה כולל את psPAX2 פלסמידים, VSV-G, pMD2.G, pRSV-Rev היה מתנה נחמדה Trono דידייה (EPFL, שווייץ). תמיכה כספית עבור עבודה זו העניקה של דרום קרוליינה מהפקולטה לרפואה באוניברסיטה, להעניק RDF18080-E202 (B.K).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 - BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
References
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146(2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987(2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968(2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147(2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27(2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O'Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products - Revisiting Current FDA Recommendations. , Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017).
- CDC. Biosafety in Microbiological and Biomedical Laboratories. , Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017).
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved