A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
במבחנה , גישות In Vivo כדי לקבוע חדירות תאים אפיתל המעי
* These authors contributed equally
In This Article
Summary
שתי שיטות מוצגים כאן כדי לקבוע פונקציה מכשול המעי. מטר אפיתל (וולט/אוהם) משמש עבור מדידות של ההתנגדות החשמלית transepithelial של epithelia בתרבית ישירות בבארות תרביות רקמה. בעכברים, שיטת gavage FITC-לתוספי משמשת כדי לקבוע את חדירות המעי ויוו.
Abstract
המכשול מעיים מגן נגד מיקרואורגניזם פתוגניים, הרעלן מיקרוביאלי. תפקידה מוסדר על ידי צומת חזק חדירות ושלמות תאי אפיתל, שיבוש של הפונקציה מכשול המעי תורמת התקדמות המחלה במערכת העיכול ומערכתית. שתי שיטות פשוטות מתוארים כאן כדי למדוד את החדירות של אפיתל המעי. במבחנה, קאקו-2BBe תאים הם מצופים בבארות תרביות רקמה כמו טפט ואת ההתנגדות החשמלית של transepithelial (TER) נמדד על ידי מד אפיתל (וולט/אוהם). שיטה זו שהתחפש בשל פעולה ידידותי למשתמש הדיר. אין ויוו, עכברים הם gavaged עם 4 kDa fluorescein isothiocyanate (FITC)-לתוספי, ריכוז FITC-לתוספי נמדדים סרום שנאספו דגימות עכברים כדי לקבוע את החדירות אפיתל. Gavage אוראלי מספק מנה מדויקת, ולכן היא השיטה המועדפת כדי למדוד את חדירות המעי ויוו. יחדיו, שתי שיטות אלו יכולים למדוד את החדירות של אפיתל המעי בתוך חוץ גופית ו ויוו, ומכאן לשמש כדי לחקור את הקשר בין מחלות ותפקוד מכשול.
Introduction
תאים אפיתל המעי אחראים לא רק על ספיגת חומרים מזינים, אך גם טופס מכשול חשוב כדי להתגונן מפני מיקרואורגניזמים פתוגניים ורעלים מיקרוביאלי. פונקציה זו מכשול המעי מוסדר על ידי צומת חזק חדירות ותא אפיתל שלמות1,2,3, תפקוד לקוי של הפונקציה מחסום האפיתל מזוהה עם מעי דלקתיות המחלה (מחלת המעי הדלקתי). הטבעת actomyosin perijunctional (PAMR) שוכנת בתוך התא הוא קשר הדוק ורציף צמתי צר. ההתכווצות של PAMR, אשר מווסת על ידי הרשת אור צולבות הקישור חוטים שרירן (MLC), חיוני לוויסות של צומת חזק חדירות4,5,6,7,8, 9,10. הגידול נקרוזה מקדם (TNF) הוא מרכזי מכשול המעי אובדן אפיתל המעי upregulating קולטני MLC קינאז (מיק) ביטוי וגרימת הפנמה occludin11,12,13.
יונים כגון Na+ ו- Cl– תוכלו לחצות את החלל paracellular על ידי מסלול נקבובית או דליפה14. האפיתל "דולף", שינויים ב- TER משקפים בעיקר צומת חזק שינו חדירות. טר המדידה היא גישה אלקטרופיזיולוגיות נפוץ לכמת צמוד לצומת פרמאביליות, בעיקר ל נה+ ו- Cl-, מבוסס על התנגדות של תא monolayers. סוגי תאים שונים, כולל תאים אפיתל המעי, תאי אפיתל ריאתי של תאי אנדותל כלי הדם, דווחו למדידות טר. היתרונות של שיטה זו הם כי TER המידות הם בלתי פולשני, ניתן להשתמש כדי לעקוב אחר תאים חיים בזמן אמת. בנוסף, טר מדידה טכניקה שימושית עבור מחקרים רעילות התרופה15.
קאקו-2BBe תאים הם תאים אנושיים אפיתל המעי הגס אדנוקרצינומה עם מבנה ותפקוד הדומה הבדיל קטן בתאי אפיתל המעי: לדוגמה, תאים אלה יש microvilli ואנזימים הקשורים עם מברשת קטנה מעיים הגבול. לכן, monolayers קאקו-2BBe בתרבית מנוצלים כמודל במבחנה לבדיקת תפקוד המחסום.
בעכברים, דרך אחת ללמוד paracellular מעיים חדירות היא על ידי מדידת היכולת של FITC-לתוספי שיוקמו לומן לדם. לפיכך, חדירות המעי יכול להיות מוערך על ידי gavaging FITC-לתוספי ישירות לתוך ומדידה של זריחה בתוך הדם של עכברים. הפרוטוקול הבא מתאר שתי שיטות פשוטות כדי להעריך את חדירות אפיתל המעי גם במבחנה וגם בתוך vivo.
Protocol
מחקר זה אושרה על ידי טיפול בעלי חיים, שימוש בפרוטוקול של קיימברידג-סודה גנומית מרכז משאבים (פקה-סו), אוניברסיטת שבחיים.
1. ציפוי ותחזוקה של קאקו-2bbe על ממברנות פוליקרבונט נקבובי
- לגדל תאים בבקבוקון T75 עם מדיה (DMEM המכיל 10% FBS). מבחנות צריך להיות מוזן באופן קבוע, בהתאם צפיפות התאים.
הערה: עבור ציפוי אופטימלית, התאים צריכים לחלק במהירות, בעלי צורה שטוחה "הביצה", המציינת כי תאים הם בשלב הצמיחה. - לאחר תאים 80% confluent, לקחת את הבקבוק מתוך החממה ולהסיר את המדיה. לשטוף כל המדיה שיורית עם 1-2 מ של PBS סטרילי (ללא Ca2 +). Pipet 1.5 mL טריפסין-EDTA לתוך הבקבוק ובעדינות סלע את הבקבוקון; אז, במקום את הבקבוקון בחממה 37 מעלות צלזיוס במשך 20 דקות בלי נדנדה.
- בעוד התאים הם trypsinizing, המקום מוסיף המכיל ממברנות פוליקרבונט נקבובי (גודל הנקבוביות, מיקרומטר 0.4; פני השטח, 0.33 ס מ2; ראה טבלה של חומרים) לוחות 24-. טוב. הוסף 1.0 מ"ל של תרבות התקשורת בבית הבליעה הבזליים (הרווח התחתונה של הקרום).
- Pipet מ של מדיה לתוך הבקבוק ואת נמרצות pipet התאים כנגד הצד + בקבוקי שתייה צידניות 5 - 10 פעמים כדי להשיג רופף, בודדים תאים או 2-3 תא מתגבש.
-
צלחת 0.166 מ של תאים (להשגת יחס דילול של 1:8) אל החדר הפסגה (הרווח העליון של הקרום). דגירה ב 37 ° C עד 3 שבועות.
- להאכיל תאים שלוש פעמים מדי שבוע על ידי בקפידה כ רפה בעברית המדיה מן התא הבזליים של כל טוב באמצעות משאבה ללחץ. בעדינות לטפטף 1 מ"ל של מדיה לתוך התא הפסגה של כל הוספה.
2. השימוש אפיתל מטר (וולט/אוהם) למדידת טר
הערה: לאחר כשלושה שבועות של תרבות על ממברנות פוליקרבונט, קאקו-2BBe תאים הם מוכן למדידה טר.
- ללימודים ציטוקינים, יום אחד לפני המדידה, החלף את המדיה הבזליים המדיה המכילה 10 ננוגרם למ"ל של IFNγ. ביום של הניסוי, החלף את המדיה HBSS המכילים 2.5 או 7.5 ננוגרם למ"ל של TNF.
הערה: טיפול IFNγ מגביר ביטוי הקולטן TNF 2 (TNFR2)16. - כדי לתקן את המונה, הכנס האלקטרודה תיקון לתוך יציאת קלט ובחרו מצב "אוהם". התאם את הבורג R שם תואר עם מברג עד מד מציג קריאה של 1,000 Ω.
- לעקר את האלקטרודות על-ידי הצבתם אתנול 70% למשך 15-30 דקות ולאחר מכן אפשר אותם לאוויר יבש עבור שטיפה ס' 15 האלקטרודה בתקשורת תרבות תא ניסיוני.
- מאתחל את המחשב, ובחרו את מצב "אוהם". בזהירות המקום את הקצוות רב הגשרים אלקטרודה לתוך תא הבזליים, את הקצוות קצר אל החדר הפסגה. ודא כי האלקטרודות יותר לגעת בקרקעית של המנה, תוך שמירה על האלקטרודות קצר מתחת לפני השטח של התקשורת אבל מעל את הכיסויים תרביות רקמה. שמור האלקטרודות אנכי.
- למדוד את ההתנגדות של התוספות מדגם ומוסיף ריק (קרי, שהתרבות מוסיף ללא תאים אבל עם HBSS)-0, 1, 2, 3, 4 שעות לאחר הטיפול ציטוקין. להקליט את ההתנגדות.
- כדי להשיג עקביות על-פני צלחת שונה תבניות, לחשב התוצר של ההתנגדות ואת אזור ממברנה יעיל:
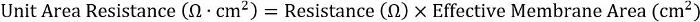
עבור מוסיף 24-. ובכן, זהו אזור ממברנה יעיל 0.33 ס מ2.
3. מודל מאתר לתוספי סולפט נתרן (DSS)-induced קוליטיס
- להוסיף DSS מים בלוק ריכוז סופי של 3.5% (wt/כרך).
- לנהל 3.5% DSS לעכברים C57BL/6 זכר בן שבוע 8 עבור סכום כולל של 7 ימים. לתת שתייה רגילים ללא DSS בקרת עכברים.
- לעבור את המים המכילים DSS שתייה רגילים לאחר יום 7.
- שוקל עכברים ולהעריך קליניים עשרות העכבר כל כל יום. לנרמל את משקל הגוף של כל בעכבר כדי משקל הגוף הראשונית שלו. ציונים מוגדרים בהתאם לחומרת המחלה ע י ארבעה פרמטרים: צניחה של פי הטבעת (0-2), צואה עקביות (0-2), דימום (0-2), פעילות (0-2)5. לסכם את התוצאות של פרמטרים אלה בשביל ניקוד קליניים הסופי.
- כדי לנתח את המצב histopathological של רקמת המעי הגס, המתת חסד עכברים באמצעות הזרקת בקרום הבטן (i.p.) 1.2% (vol/כרך) Avertin (0.6 מ"ל/10 גרם משקל) 7 ימים טיפול פוסט-DSS. כדי להכין מלאי של 100% avertin, מערבבים 10 גרם של 2,2,2-tribromoethanol עם 10 מ ל אלכוהול טרט-ניטריט. לאחסן בחושך ב 4 º C. כדי להשתמש, לדלל מניות 100% ל-2% במים.
- לבודד את המעי הגס ואת המעי האטום, למדוד את האורך של המעי הגס5.
- חותכים פלחי 0.5 ס מ מן המעי הדיסטלי תיקון צינור בז 15 מ"ל, המכיל 10 מ"ל של 10% פורמלין בן לילה. לשטוף את הרקמות קבוע עם אתנול מדורגת (75, 95 ו- 100%), קסילן. להטביע את הרקמות פרפין וחותכים סעיפים 6 מ מ עבור hematoxylin & אאוזין מכתים8.
4. מודדים את החדירות מחסום האפיתל DSS-induced קוליטיס בעכברים
- למדוד את החדירות מכשול 7 ימים לאחר תחילת ניהול DSS.
- ביום של וזמינותו, מהיר עכברים במשך 3 שעות.
- אוטוקלב gavage מחט כדי להבטיח עקרות, ואז gavage עכברים עם µL 150 80 מ"ג/מ"ל 4 kDa FITC-לתוספי במים סטריליים, ולשמור את לתוספי-FITC שאינן בשימוש כדי למדוד את העקומה רגיל אחרי אוסף סרום. שוקלים העכברים לחישוב חדירות.
הערה: הפתרון FITC-לתוספי צריכה להיעשות במים. - בעזרת זוג מספריים, קליפ קטע 1 ס מ של הזנב, לאסוף 100 µL של דם מן הזנב לתוך צינורות איסוף סרום. לסובב את הדם שנאספו ב 10,000 g x 10 דקות בטמפרטורת החדר.
- לדלל את הנסיוב 1:4 במים. כדי להפוך לסטנדרט לעקומה, לדלל שאינם בשימוש FITC-לתוספי עם מים ליד 1:300, 1:1, 000, 1:3, 000, 1:10, 000, 1:30, 000, 1: 100, 000, 1:300, 000, 1:1, 000, 000 ו- 1:3, 000, 000. להוסיף 100 µL/טוב של הסרום והדוגמאות עיקול רגיל 96-ובכן לוחות.
- קרא את זריחה בקורא צלחת עם פליטה עירור/528 485. לחשב את הערכים חדירות בהתבסס על העקומה סטנדרטי, להכפיל ב- 4 לתיקון הדילול.
- לחלק את הריכוז של FITC-לתוספי לפי המשקל לנרמל את הערכים (זה עוזר לנרמל את ההבדל בין FITC-לתוספי משלוח אם עכברים חולים. ואני איבדתי משקל).
תוצאות
בתרבות, קאקו-2BBe התאים ינבכ טפט, להבדיל לאט לתוך בוגרת enterocytes ספיגת ידע שיש גבולות מברשת. ב פרוטוקול זה, קאקו-2BBe תאים מצופים עם צפיפות גבוהה על ממברנות פוליקרבונט, והגיע תאים 100% confluency יום אחד לאחר זריעה. עם זאת, תאים הם מובחן בשלב זה: להבחין באופן מלא את התאים, התקשורת השתנתה כ...
Discussion
ישנם מספר שלבים קריטיים בפרוטוקול. קאקו-2BBe (מברשת הגבול-לבטא) תאים משמשים תמיד למדידה טר, שנבחרו מתוך שורת תאים קאקו-2 עבור ביטוי של חלבונים מברשת-הגבול. קאקו-2BBe התאים להיות פנוטיפ ספיגת ידע סיסי כאשר הבדיל לחלוטין (לאחר כשלושה שבועות של תרבות פוסט-הנהרות)17. זה הכרחי כדי למנוע זי...
Disclosures
המחברים מצהירים אין אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים ד ר ג'רלד ר טרנר, מן בריגהם אנד וימנס, הספר לרפואה בהרווארד, על עזרתו הנדיבה השלמת המחקר הזה. עבודה זו נתמכת על ידי הקרן הלאומית למדע הטבע של סין (גרנט מספר 81470804, 31401229 ו- 81200620), את מדעי הטבע קרן של מחוז ג'יאנגסו (גרנט מספר BK20180838, ו BK20140319), תוכנית חדשנות מחקר עבור המכללה הבוגרים של מחוז ג'יאנגסו (גרנט מספר KYLX16-0116), מתקדם פרוייקטים של שבחיים אוניברסיטת מחקר (גרנט מספר SDY2015_06), ו קרוהן & קוליטיס קרן מחקר מלגת פרס (להעניק מספר 310801).
Materials
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
References
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved