Method Article
וריאציות על שלילי כתם מיקרוסקופ אלקטרונים שיטות: כלים בהתמודדות עם אתגר מערכות
In This Article
Erratum Notice
Summary
כתם שלילי EM היא טכניקה חזקה להמחשת המבנה macromolecular, אבל טכניקות צביעת שונים יכול לייצר תוצאות שונות באופן תלוי מדגם. הנה מספר גישות מכתימים שלילי מתוארים בפירוט כדי לספק זרימת עבודה ראשונית בהתמודדות עם הפריט החזותי של מערכות מאתגר.
Abstract
מיקרוסקופ אלקטרונים כתם שלילי (EM) מאפשר התבוננות פשוטה ומהירה יחסית של מקרומולקולות, מתחמי macromolecular באמצעות הניגוד שיפור ריאגנט הכתם. ולמרות שהוא מוגבל מבחינה ברזולוציה מקסימלית של ~ 18-20, כתם שלילי EM שימושי למגוון רחב של בעיות ביולוגיות ומספק גם אמצעי מהיר של הערכת דגימות של הקפאה-מיקרוסקופ (הקפאה-EM). כתם שלילי זרימת העבודה היא שיטה פשוטה; הספוחה היא הדגימה על גבי מצע, ואז כתם הוא מוחל, מחק, מיובשים כדי לייצר שכבה דקה של אלקטרון כתם צפוף שבו מוטמעים החלקיקים. דוגמאות בודדות יכול, לעומת זאת, להתנהג בדרכים שונות במידה ניכרת תחת משתנים התנאים מוכתמים. זה הוביל לפיתוח מגוון רחב של טכניקות להכנת מצע, שלילי מכתים ריאגנטים, ורשת כביסה החיוורים ומכתים טכניקות. קביעת השיטה המתאימה ביותר עבור כל דגימה בודדת צריך להיעשות על בסיס מקרה לגופו, microscopist חייבת להיות לך גישה למגוון רחב של טכניקות שונות כדי להשיג את התוצאות כתם שלילי האיכותי. פרוטוקולים מפורט עבור שתי שיטות הכנה של סובסטרט שונים, שלוש טכניקות שונות סופג הינם מסופקים, ושיחות דוגמה מדגם המציג תוצאות שונה במידה ניכרת בהתאם שיטת מוצג. בנוסף, הכנת כמה נפוץ ריאגנטים מכתימים שלילי, שני חדשניים מבוססי לנתניד כתמים, מתואר עם דיון בנוגע לשימוש של כל אחד.
Introduction
למרות תשומת לב לאחרונה הרזולוציה המהפכה הנובע התקדמות משמעותית הקפאה-אלקטרון מיקרוסקופ1 (הקפאה-EM), שלילית כתם EM שרידים טכניקה חזקה והוא מרכיב חיוני של ארגז הכלים של אלקטרון microscopists. צביעת שלילי נותרה השיטה הטובה ביותר עבור הערכה מהירה של מדגם לפני מיטוב תנאי הקפאה-רשת2. חדות גבוהה ואת המהירות של רשת הכנת דוגמאות מוכתם שלילי הופך אותו לאידיאלי עבור הערכת מדגם טוהר, ריכוז, הטרוגניות, גמישות הסתגלותי3. מבנים רבים ביולוגית אינפורמטיבי נבעה שחזורים כתם שלילי, למרות הרזולוציה של הטכניקה מצטמצם ~ 18 Å רזולוציה4,5,6, ו כמה דגימות להניב תוצאות טובות יותר בכתם הקפאה-EM עבור מגוון רחב של סיבות7.
בכתם שלילי EM, החלקיק עניין הספוחה על פני רשת EM, עטוף בקליפה מטריקס אמורפי של אלקטרון כתם צפופה המורכבת. ניגוד היחסית גבוהה המיוצר בין הרקע לבין החלקיק מעניינים, עם החלקיק להיות אלקטרונים פחות צפוף מאשר הכתם שמסביב8. החלקיקים מופיעים אזורים בהירים בגלל כוחם פיזור האלקטרונים נמוכה יחסית הכתם שמסביב צפופה, אשר מחליקי האלקטרונים יותר נראית כהה. תכונות substructural של חלקיקים יכול להסיק מכל בחינה מפורטת של תמונות תוצאות כמו כתם לחדור לתוך הבקיע בכל ולייצר את הניגודיות לא סדירה פרט9.
מתחיל תהליך צביעת שלילי עם הכנת מצע תמיכה בו החלקיקים מדגם נלכדים, השכבה של הכתם מיובשים נתמך. המצע התמיכה הנפוצות ביותר היא שכבה של פחמן אמורפי, לפעמים נתמך על ידי שכבה דקה של פוליוויניל (למשל Formvar) או פולימר ניטרוצלולוזה (למשל Collodion). מצעים אלה ניתן לרכוש מסחרית או מוכן ללא צורך במיקור חוץ באמצעות פרוטוקולים המתוארים להלן.
לאחר המצע תמיכה מוכן, ניתן להחיל את הדגימה, הפתרון עודף מחק את. דוגמאות המחבוש במאגר מתאים עבור מכתים שלילי. עדיף למנוע השימוש של מאגר פוספט, ריכוז המלח גבוה, אשר יכולים להצמיח פוחת משקעים גבישיים זה ניתן להסתיר את הדגימה. צמצום סוכנים, דטרגנטים, סוכרוז, גליצרול, ריכוזים גבוהים של נוקלאוטיד יש גם להימנע ככל הם גם משפיעים על איכות הכתם4. כאשר הרכב המאגר לא ניתן לשנות, שטיפת המשטח של הרשת EM עם מים או מאגר מתאים יותר לאחר ספיחה, לפני צביעת עשוי להפחית את היווצרות של מאגר הקשורים חפצים ולשפר באופן כללי על רקע הכתם. אם מאגר חפצים חשודים, זה יכול להיות אינפורמטיבי כתם רשת מאגר בלבד כדי לקבוע אם הרכיבים מאגר הם המקור של הממצאים שנצפו.
לאחר המדגם הספוחה, מחק ואני שטפתי במידת הצורך, ריאגנט מכתימים מוחל. מגוון רחב של ריאגנטים נמצאו להיות כתמים שליליים יעיל (טבלה 1), אבל הכתם להיבחר כדי להתאים את הדגימה. 'הילה' של הכתם צורות סביב החלקיק בשל שני העקירה של מולקולות כתם על ידי האזורים הידרופוביות של חלבונים ודחיה מאת טעונה קבוצות. לכן, הכתם להיבחר כך המדינה פרוטונציה של כל קבוצות טעונות פוטנציאליים על החלבון היא זהה לזו של הכתם על ה-pH עבודה. מול האשמות על פני השטח של החלבון יכול לתרום מכתים חיובית השפעה, אשר למרות טכניקה שימושית משלו נכון10 אינו בתוך הטווח של מאמר זה. ריאגנטים מכתימים שליליות הנפוצות ביותר הן uranyl אצטט uranyl formate. הכתמים האלה יש גודל גרעין קטן יחסית (4-5 Å)9 לספק תמונות ברזולוציה גבוהה מעל כתמים אחרים כגון פוספו-טונגסטטים (8-9 גודל גרגר Å)9,11, אמוניום molybdate11, וחלק מבוסס לנתניד כתמי12. Uranyl אצטט, formate משמשים גם מקבע, שמירה על אינטראקציות חלבון-חלבון רבים ב מילי-שניות זמן בקנה מידה13, למרות ה-pH נמוך של הכתם, הנטייה שלו, כדי לזרז ב- pH פיזיולוגיים. עלולים לפגום דגימות14 . למרות השירות שלהם, המלחים uranyl מציגים גם אתגרים לוגיסטיים כפי שהם הם רעילים והן רדיואקטיבי במתינות, אשר עשויים לדרוש טיפול מיוחד, אחסון, ודרישות לרשות, אשר מוביל חלק מהמשתמשים לחפש חלופות לא רדיואקטיבי.
יש מגוון גדול של שיטות המתואר לשם הכנת הרקע, דוגמת יישום, ו מכתים של רשתות EM. השיטה המתאימה ביותר לשימוש מדגם תלויות, יכולים להיות קשה לאמת כאשר בהתמודדות עם מערכת חדשה. כתב יד זה מתאר שתי שיטות של הכנת הרקע ואת שלוש שיטות סופג; בצד סופג, יתנגש5ורפיד שטיפה15. סופג צד הוא הפשוט ביותר של שיטות המתוארות. השיטה יתנגש והן בשיטת שטיפה מהירה קשים יותר ליישם אבל להגביל את משך הזמן קשר המדגם עם הסרט תמיכה לפני קיבוע, הוכחו להפחיתם להיווצרות כתם, פריטים כמה דוגמאות5. המטרה של כתב יד זה היא לפיכך לספק זרימת עבודה ראשונית עבור בהתמודדות עם הפריט החזותי של מערכות מאתגר על ידי EM שלילית-כתם.
Protocol
1. הכנת EM רשתות
- שיטת גיליון פחמן
- הכנת גיליון נציץ cleaved טרי.
- הכנס בעדינות מחט מזרק דיוק או סכין גילוח בפינה אחת של גיליון נציץ, כמה מ מ בין השכבות. הוסף את הכלי כמו קרוב למרכז אנכי של הגיליון ככל האפשר לייצר שתי פיסות בעובי שווה בקירוב.
- בזהירות מתמקח לגזרים את שני החצאים של גיליון נציץ. זה יכול לפי העין, או תחת מיקרוסקופ ויבתר.
- חותכים את אחת הפינות של כל הסדינים נציץ cleaved לאחרונה. בכל מקרה שבו הסדין מתהפך ב המאייד פחמן במהלך שחרור ואקום, ניתן לזהות הצד פחמן מצופה של הגיליון.
- מקם את הגיליון נציץ cleaved/s בחדרו של המאייד פחמן, עם משטח ביקע טרי פונה כלפי מעלה.
- ודא שהמאייד פחמן היא הגדרת בצורה נכונה עם אלקטרודה פחמן הוכנו כראוי.
הערה: השיטה של הכנת המוטות פחמן משתנה בהתאם למפרטים של המאייד פחמן. פרוטוקול לכלי אחד הוא כדלקמן עד שלב 1.1.5.- בצעו חידוד מוט פחמן עם משחיז יש קצה חד ולאחר מכן פולנית זה עם מגבת נייר כדי להסיר כל הזיזים קשה.
- באמצעות נייר זכוכית עדין לשטח את הסוף של מוט השני ולהבריק שוב אותה חלקה עם מגבת נייר.
- למקם את המוטות פחמן שני המאייד לפי הנחיות היצרן. ודא שסוף מחודדים על מוט הראשון יוצר קשר איתן עם הפנים שעברו שיטוח של המוט השני.
- מניחים חתיכת נייר סינון נקי, יבש חלקית תחת נציץ קטן אם פחמן בעובי הולך להיות נאמד מול תורתו באופן חזותי. לחלופין, במקום שקופית מיקרוסקופ חלבית לבנה עם קמצוץ קטן של גריז ואקום לצד נציץ למדוד את עובי פחמן.
- להפקיד פחמן על גבי מישה לפי הנחיות היצרן.
- משאבת הוואקום למטה ולחכות עד זה ב 10-5 mbar. הגדר את המתח של האלקטרודה 4.0 V (עד 5 V העשויים להידרש, בהתאם לסוג מקור מוט פחמן).
- הפעלת מספר פולסים קצרים של 3.5 s במשך דרך האלקטרודה להפקיד 1-2 ננומטר evaporations עבה של פחמן על פני נציץ.
הערה: כפי הנוכחי חל על מוט פחמן אותו זוהר אדום ולאחר מכן לבן. לא לבהות הבהיר כמו זה יכול לפגוע בעיניים שלך. - לאפשר את הפחמן. להפקיד על מישה עד לעובי הרצוי, כפי שהיא נמדדת על ידי מד עובי של המאייד פחמן או התצפית הויזואלית של פחמן שהופקדו על נייר סינון או שקופיות מיקרוסקופ. ודא כי השכבה האחרונה פחמן בעובי 5-10 ננומטר.
- אם העובי פחמן נאמדת חזותית להשוות את החלק עמומה של השקופית מיקרוסקופ מצופה עם גריז ואקום לאזור החשוף, הוא יהיה כהה יותר בזמן פחמן יותר משולמת לזכאים.
הערה: יש אין שיטה כמותית כדי לקבוע את עובי פחמן כאשר משתמשים בשיטה זו.
- אם העובי פחמן נאמדת חזותית להשוות את החלק עמומה של השקופית מיקרוסקופ מצופה עם גריז ואקום לאזור החשוף, הוא יהיה כהה יותר בזמן פחמן יותר משולמת לזכאים.
- וונט תא ואקום ולהסיר את מישה מצופים פחמן המאייד פחמן.
הערה: מישה מצופים פחמן יכול להיות שמאל ליישב בין לילה לפני שתמשיך עם והשלבים - השתמש באחת שני מיכלי המים לצוף הסרט פחמן על גבי הרשתות EM: מיכל עם שסתום הניקוז התחתון אז יכול להיות מנוקז מים, השכבה פחמן הוריד את רשתות להסיעם או מעטה הרמה הרשתות ניתן להגדיר מתחת למים פני השטח, אשר לאחר מכן יכול להעלות את הרשתות עד הסרט פחמן על פני המים.
- למלא את המיכל עם מים מזוקקים הנדסה גנטית כך פני המים היא כ- 5 מ מ מהקצה העליון. לנקות את השטח של מים על-ידי גרירת סדין או שניים רקמת העדשה על פני השטח כדי להסיר חלקיקים צפים כלשהם.
- מניחים חתיכת רשת נירוסטה נקי (1 אינץ ' על-ידי 2.5 אינץ הוא גודל המתאים של) מתחת לפני השטח של המים.
- בעזרת זוג מספריים בסדר, שכב נקי, יבש EM רשתות עם הפנים למעלה (על פי תיאור של היצרן) על רשת השינוי נירוסטה. לארוז את הרשתות יחד חזק ככל האפשר, אך אינם מאפשרים להם להיות חופפים.
- ברגע הרשתות מסודרים, לאחוז בחוזקה את גיליון נציץ מצופה פחמן עם זוג מלקחיים או הסרט פיתוח מלקחיים.
- להציג את גיליון נציץ לתוך המים. ודא כי זאת בזווית מאוד רדוד (~ 10 מעלות).
הערה: מישה צריך לפרוץ דרך פני המים ויציפו, בזמן הסרט פחמן צריך להפריד מישה לצוף על פני המים. שלב זה צריך להתבצע לא ישירות על הרשתות, כדי למנוע נזק ו/או זיהום.- כדי למזער את האפשרות של הרצון הסרט פחמן לא ניפרד מן הגיליון נציץ, ציון סביב קצה הסדין נציץ עם סכין גילוח או לחתוך בפינה אחת את בעזרת מספריים קטנות לפני החדרת אותו לתוך המים.
- לאחר הסרט פחמן יש תלושים, להסיר את גיליון נציץ או תיתן לו ליפול לתחתית המיכל.
- באמצעות פינצטה משופעת משובחים, החל לחץ עדין מאוד, בתנועות איטיות מדריך הסרט פחמן על החלק העליון של הרשתות.
- להביא את הגיליון פחמן במגע עם המשטח של הרשתות או על-ידי לאט מרוקנים את המים או לגדל את הטבעת הרמה, בהתאם לסוג ממנגנוני.
- בזהירות הרימו רשת השינוי מפלדת (עכשיו עם רשתות מצופים פחמן) מן המנגנון הפתיל משם חלק עודפי המים באמצעות פיסת נייר סינון. ודא כי זאת על ידי נגיעה נייר הסינון לקצה מאוד רשת פלדה אבל לא באה במגע עם רשתות או פחמן סרט.
- מניחים על הרשת של רשתות בצלוחית המכילה פיסת נייר סינון יבש, לאפשר לזה יבש לחלוטין.
הערה: זה מושפע בצורה הטובה ביותר ע י ייבוש ללילה בטמפרטורת החדר, אך יכול להחיש את הצעד על-ידי הצבת את הרשתות בתנור כ 60 ° C.
- הכנת גיליון נציץ cleaved טרי.
- ציפה והמעיל (פחמן ישירה בתצהיר). בשיטה זו יש שתוארו בפירוט בעבר16
- לחלוטין למלא קערה זכוכית נקי גדול עד הקצה, לזכותו מים מזוקקים אז מניסקוס טפסים בחלק העליון.
- להחיל טיפת collodion פתרון (ניטרוצלולוזה באצטט עמילן) השטח של מים באמצעות פיפטה נקי של פסטר, לאפשר את ה-droplet פרושים, להתייבש לחלוטין. ברגע יבש שכבה דקה של collodion לצוף מעל פני המים יהיה גלוי.
- הסר בעדינות את השכבה collodion בעזרת קיסם להסיר אבק או זיהום אחרים מפני השטח של המים.
- להחיל droplet collodion השני על המים ולאפשר התפרסו ויבשה במשך 2-3 דקות.
הערה: חזור על צעדים 1.2.3-1.2.4 עד גיליון שטוח קמטים חינם של collodion מתקבל. - באמצעות זוג מלקחיים בסדר במקום EM רשתות הפנים כלפי מטה (על פי תיאור של היצרן) על הסדין collodion צף. לארוז את הרשתות יחד בחוזקה במערך משושה, אך אינם מאפשרים להם להיות חופפים.
הערה: אם רשת במקומה או להציב הפוך מומלץ בדרך כלל להשאיר את זה למקום יותר מאשר הסיכון פגיעה הגיליון collodion בעת ניסיון להעביר אותו. - לאחר כל הרשתות ממוקמים, בעדינות שכבה גיליון של נייר סינון מעליהם. לאפשר את הנייר להפוך ושרויה נימיות.
הערה: בכל גודל ובכל עובי נייר סינון היא מתאימה במקרה זה מכסה לחלוטין את הרשתות. - השתמש קיסם כדי להסיר כל סרט collodion אשר חורג נייר הסינון.
- אחיזה נייר הסינון בקצה, לקלף אותו מפני השטח המים.
הערה: הרשתות צריך להישאר מודבקת על הנייר. - במקום על נייר שטוח והפנים collodion בצלחת פטרי ולאפשר לו להתייבש לחלוטין.
- מניחים את נייר סינון עם הרשתות בחדרו של המאייד פחמן עם אלקטרודות פחמן הוכנו כראוי כמפורט 1.1.2.
- בצע את ההליך אידוי פחמן כמתואר עבור שיטת פחמן גיליון
- לאפשר מספר שניות בין פולסים כדי למנוע התחממות יתר ופגיעה הגיליון ניטרוצלולוזה.
הערה: אם רצונך בכך השכבה פולימר ניתן להסיר לאחר הרשתות היה פחמן מצופה, למרות השלב זה נחוץ רק לעתים רחוקות. המקום הצד פחמן רשתות על פיסת נייר סינון טרי ולשים מספר טיפות אצטון על הנייר ליד, אבל לא על הרשתות. לאפשר אצטון פרושים תחת הרשתות, להמיס, לספוג את השכבה פולימר.
2. הכנת ריאגנטים מכתים שלילי
-
הכנת Uranyl אצטט
- מביאים נפח קטן של הנדסה גנטית מים לרתיחה ולאפשר להרתיח 10 דקות ביסודיות דגה. לאפשר לה להתקרר מעט, ולאחר מכן להשתמש בו כדי להמיס uranyl אצטט (UA) ב 1-2% (w/v).
הערה: בצע את ההליך הזה בארון fume ועם ציוד מגן אישי המתאים. - לאחר הפתרון הוא מקורר, לסנן דרך 0.2 µm מזרק מסנן או מסנן נייר.
- אחסן את UA מוגנת מאור ו- 4 הלעפה תרוטרפמט. הפתרון הוא יציב עד 1 שנה.
- מביאים נפח קטן של הנדסה גנטית מים לרתיחה ולאפשר להרתיח 10 דקות ביסודיות דגה. לאפשר לה להתקרר מעט, ולאחר מכן להשתמש בו כדי להמיס uranyl אצטט (UA) ב 1-2% (w/v).
-
הכנת Uranyl Formate מן האבקה. שיטה זו שעבד בעיר פרט בעבר8
- לפזר אבקת formate (UF) uranyl 20 מ ג, 2 מ של מים מורתחים degassed הנדסה גנטית (כמו שלב 2.1.1) על ידי ערבוב.
- תוך לערבב, להוסיף µL 8 של 5 M NaOH, הפתרון אמור להשתנות בצבע צהוב כהה יותר, אך אין התמיסה צריך טופס.
- לסנן את הפתרון דרך מסנן מזרק 0.2 µm.
- חנות הכתם UF מוגן מפני אור. להשליך שהכתם צריך אם מישהו לזרז או חום דהוי הוא ציין. הפתרון הוא רק יציבה במשך 1-2 ימים.
-
הכנת Formate Uranyl מן Uranyl אצטט
- לזרז 1 מ"ל של 1% (w/v) UA כתם על-ידי הוספת µL 100 של 1 M NaOH.
- Centrifuge את התערובת למשך 2 דקות במהירות המרבית צנטריפוגה benchtop.
- למחוק את כל תגובת שיקוע, לפזר את התמיסה ב 100 µL חומצה פורמית 5% (v/v) על ידי vortexing נמרצת.
- לדלל לאמצעי הסופי של 1 מ"ל מים 900 של הנדסה גנטית µL להניב כתם UF חומצה פורמית 0.5% (v/v).
- חנות הכתם UF מוגן מפני אור. למחוק את הכתם אם כל precipitate או חום דהוי נצפית.
-
הכנת נוגדנים אחרים מכתים
-
הכנת לנתניד אצטט כתמים
- להמיס סמריום אצטט (SmAc), אצטט גדוליניום (GdAc), תוליום אצטט (TmAc) או ארביום אצטט (ErAc) ב 1-2% (w/v) במים הנדסה גנטית.
הערה: אם דוגמאות להראות להכתים חיובי או הדבקות המסכן לרשת בעת שימוש הכתמים האלה, הם יכולים להיות acidified עם עד 0.5% (v/v) חומצה פורמית. צביעת חיובי תוצאות המדגם מופיעה אובייקט כהה מוקפת הילה לבנה. הדבקות המסכן לרשת תגרום מולקולות מאשר הצפוי הנצפה על הרשת.
- להמיס סמריום אצטט (SmAc), אצטט גדוליניום (GdAc), תוליום אצטט (TmAc) או ארביום אצטט (ErAc) ב 1-2% (w/v) במים הנדסה גנטית.
-
הכנת אמוניום Molybdate, סודיום Phosphotungstate
- להמיס את הכתם. ב 1-3% (w/v) במים הנדסה גנטית. להתאים את ה-pH אל 7.0 באמצעות 5 M NaOH אם רצונך בכך.
-
הכנת לנתניד אצטט כתמים
3. adsorbing דגימות לפחמן המצע ולא מכתים
-
הכנה של המשטח רשת עבור יישום לדוגמה על ידי טיוח זה Hydrophilic
- מניחים את הרשת פונה כלפי מעלה בשקופית מיקרוסקופ ביחידה פריקה זוהר.
- לטפל ברשת עבור מינימום של 30 s ב-10 mA.
הערה: השיטה המדויקת של הפרשות זוהר יהיה תלוי במפרט של פיסת ציוד מסוים. - לחלופין זה יכול להתבצע על ידי הקרנת UV במשך 10 דקות באמצעות מנורת UV benchtop4.
-
לצד שיטת סופג. שיטה זו שעבד בעיר פרט בעבר8
- לאחוז את הקצה של הרשת עם זוג מספריים לחץ שלילי, ולהחיל 3-5 µL מדגם השטח תמיכה.
- לאפשר את הדגימה כדי לספוח השטח רשת 10 s כדי מינימלית 1 מטב הזמן ספיחה עליך לקבלת דוגמאות בודדות.
- לגעת בקצה של הרשת כדי גיליון של נייר סינון ולאפשר נימיות שיוציא לפועל את הנוזל.
- אופציונלי: לשטוף את הרשת. µL מקום 50 טיפות מים הנדסה גנטית או המתאים בופר נדיף על גיליון של הסרט מעבדה. בעדינות לגעת השטח פחמן של הרשת כדי האיסוף והמראה droplet קטנים על גבי המשטח של הרשת. לגעת בקצה של הרשת כדי גיליון של נייר סינון ולאפשר נימיות שיוציא לפועל את הנוזל.
- חזור על שלב זה לשטוף כמה פעמים לפי הצורך.
- מקום שני 50 טיפות µL של צביעת ריאגנט בגיליון של הסרט מעבדה.
- בעדינות לגעת השטח פחמן של הרשת כדי האיסוף והמראה droplet קטנים על גבי המשטח העליון של הרשת.
הערה: אם הכתם מעביר האחורי של הרשת ואז את הרשת צריך להיות מושלך. - לגעת בקצה של הרשת כדי גיליון של נייר סינון ולאפשר נימיות להרחיק את הנוזל. בצע את שלב צביעת הזה פעמיים.
- לאפשר את הרשת לאוויר יבש או יבש תחת מנורת להט.
-
מצליף שיטה
- לאחוז את הקצה של הרשת עם זוג מספריים לחץ שלילי, ולהחיל 3-5 µL מדגם השטח תמיכה.
- מחזיק את הפינצטה ביד אחת, כך הרשת המשופע על 45° הפונה לכיוון ההפוך, קפיצי במהירות כף היד של היד כדי 'לסתור את"הרוב המכריע של ה-droplet שנמצאת מעל הרשת.
- אופציונלי: באמצעות כוס פסטר פיפטה חלות טיפה של פתרון שטיפת המשטח תמיכה וחבוט ' את ' כמו 3.2.2. חזור על פי הצורך.
- באמצעות כוס פסטר פיפטה להחיל טיפה של צביעת ריאגנט השטח תמיכה וחבוט ' את ' כמו 3.2.2. חזור על 1 - 3 פעמים תלוי עומק הכתם הדרושים עבור ויזואליזציה של הדגימה.
הערה: זה לא הגורם היחיד מייחסת עומק הכתם הסופי (ראה דיון). - להסיר כתם עודף על-ידי נגיעה לקצה הקרוע של פיסת נייר סינון על הקצה של הרשת.
- לאפשר את הרשת לאוויר יבש או יבש תחת מנורת להט.
-
שיטה מהירה פלאשינג
- לצייר 30-70 µL של כתם (1% השתמשו UA בדרך כלל) לתוך קצה פיפטה 200 µL, להפוך את החוגה אמצעי האחסון כדי לצייר את µL 5 של אוויר, לאחר מכן צייר למעלה ריאגנט ערבול לשטוף (5-30 µL), אם נדרש, ואחריו עוד פער אוויר קטן, ואז מצייר את µL 5 מדגם.
- אחיזה בקצה של רשת עם זוג מספריים לחץ שלילי, מחזיק את הפינצטה, כך הרשת המשופע על 45° מופנה החוקרת, הוצא את כל התוכן של קצה פיפטה פני הרשת EM מצופים פחמן.
- להסיר כתם עודף על-ידי נגיעה לקצה הקרוע של פיסת נייר סינון על הקצה של הרשת.
- לאפשר את הרשת לאוויר יבש או יבש תחת מנורת להט.
הערה: עבור כל השיטות, רצוי להחליק לקצה הקרוע של גליון נייר סינון לאורך המלקחיים עד שהוא מגיע לרשת כמו פעולה זו מסירה את הפתרון לכוד בין שני הצדדים של המלקחיים, אשר יכול למשוך את הרשת מיובשים לתוך המלתעות של המלקחיים, ברגע שהם יהיו נפתח. ניתן גם להניח על הרשת ב- הפינצטה בקצה ברדס fume להתייבש. זרימת אוויר קבועה יכולה לעזור לייצר יותר אפילו מכתים.
תוצאות
כל ריאגנטים מכתימים נבדק הפיק מכתים שלילי במידה מסוימת, עם UF מניב את הדגימות עם הניגוד הגדול בין חלקיקים החדה, מפורט ביותר. עבור דוגמאות מוטבעות עמוק (איור 1) לנתניד מבוסס כתמים ErAc ו- TmAc המיוצר מכתים שלילי של איכות שוות ערך ל UA כפי שפטו את חדות לעין וחדות של החלקיקים מוכתם, עם TmAc בהפקת ברורה, תמונות חדות יותר יותר ErAc. למרות גודל גרגרים גדולים יותר TmAc הופך לכאורה בהגדלה גדולה, כאשר חלקיקי נגיף פסיפס הטבק (TMV) היו מוכתמים 1% TmAc ~ 23 Å חוזר של החלקיק TMV17 , עדיין היה נראה בבירור בעין וכן שכבת meridional שורה ב- התמרת פורייה של תמונת raw. אף אחד השני לנתניד הכתמים נבדק, ErAc, SmAc, או GdAc, הצליחו לפתור תכונה זו. מחלקה ממוצעים נוצרו על-ידי חילוץ מקטעים חופפים חלקיקים TMV איפה חזור לוליינית היה גלוי. הקטעים שחולצו היו ואז מיושר, מסווג באמצעות RELION18 משופרת בתכונת תקופתי (איור 2).
כמה דוגמאות הן רגיש במיוחד לשיטת מכתים, כגון השריר נגזר C-חלבון. C-חלבון, אשר מורכב של מחרוזת גמיש Ig ותחומים כמו Fn, מייצרת תמונות שונות באופן משמעותי על ידי EM שלילית-כתם תלויה בשיטה של צביעת בשימוש (איור 3). באמצעות השיטה צד-סופג, התמוטט מבנים דמויי טבעת שנצפו, ואילו כשהוא מוכתם על ידי שטיפה מהירה או מצליף שיטות, חלבון C נצפית כסדרה של תחומים הדומות חרוזים על חוט.
| מגיב | ריכוז | ה-pH | סוג |
| אמוניום Molybdate | 1 - 2% | 5 – 7 | Anionic |
| ארביום אצטט (ErAc) | 1 – 2% | 6 | Cationic |
| אצטט גדוליניום (GdAc) | 1 – 2% | 6 | Cationic |
| Tungstate מתילאמין | 2% | 6 – 7 | Anionic |
| סמריום אצטט (SmAC) | 1% | 6 | Cationic |
| נתרן silicotungstate | 1 – 5% | 5-8 | Anionic |
| נתרן phosphotungstate | 1-3% | 5-8 | Anionic |
| תוליום אצטט (TmAc) | 1 – 2% | 6 | Cationic |
| Uranyl אצטט (UA) | 1 – 3% | 3 – 4 | Cationic |
| Uranyl Formate (UF) | 0.75-1% | 3 – 4 | Cationic |
טבלה 1: כמה נפוץ שלילי מכתימים ריאגנטים.

איור 1: דוגמה micrographs של נגיף פסיפס הטבק צבעונית עם ריאגנטים כתם שלילי שונים (א) 1% UF (B) TmAc 2.5% (ג) 2.5% ErAc. (ד) 1% UA (E) 2.5% GdAc, (נ) 2.5% SmAc. גודל ברים הם 100 ננומטר. נציג תמונות ושכפול מרובים עם אזורים מרובים עם תמונה לכל שכפול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: צביעת מוזאיקת הטבק עם אצטט תוליום (א) , בהגדלה של אזור של מיקרוסקופ של TMV, מוכתם של 1% TmAc. סולם בר הוא 20 ננומטר. (B) שיעור ממוצע של מקטעי TMV שחולצו. (ג) התמרת פורייה של התמונה בפאנל A מראה שכבה קו השתקפויות ~ 23 Å. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
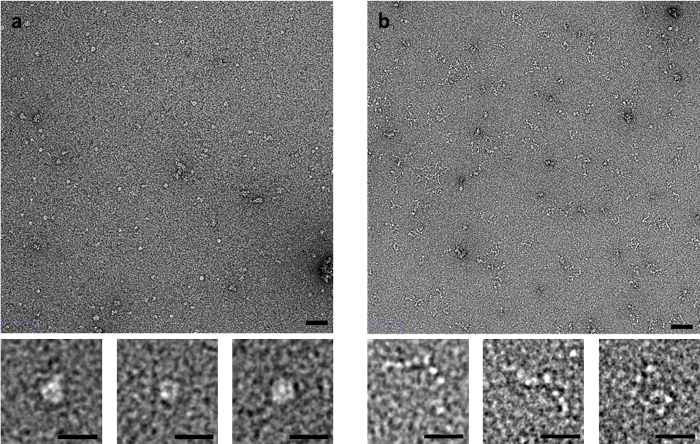
איור 3: השפעות סופג שיטה על קונפורמציה של חלבון C. (א) C-חלבון מוכתם UA באמצעות שיטת חשופה בצד שיטת יתנגש (B) . הפאנל העליון קנה מידה בר הוא 50 ננומטר, המייצג התחתון של סולם לוח ה-20 ננומטר. נציג תמונות ושכפול מרובים עם אזורים מרובים עם תמונה לכל שכפול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כתב יד זה מתאר שיטות מרובות עבור צביעת שלילי של דגימות של מיקרוסקופ אלקטרונים באמצעות מגוון של צביעת ריאגנטים, כולל שני ריאגנטים לנתניד הרומן (TmAc ו- ErAc). רבים מן השלבים של תהליך צביעת שלילי חייב להיות אופטימיזציה עבור דוגמאות בודדות כולל הבחירה של הכתם, כמות כביסה הנדרשים, אם בכלל, הטכניקה blotting. כתב יד זה ובכך מספק בסיס microscopists לפתח זרימות עבודה משלהם להתמודדות עם השלילי-צביעה של מערכות מאתגר.
הבחירה של כתם היא מאוד לטעום התלויים. דגימות צמחים רגישים במיוחד pH נמוך עשוי להיות מושפל UA ו/או UF, למרות המאפיינים לשבועיים של אלה כתמי19. במקרים אלה, לנתניד מבוסס כתמים כגון TmAc או ErAc עשוי להיות מתאים יותר, למרות רמת ה-pH הכללי של התכשיר חייב להישמר מתחת נקודה איזואלקטרית של החלבון לדוגמה כדי לסייע במניעת מכתים חיובי. זה יכול להתבצע על ידי acidifying את הכתם עם חומצה אצטית במידת הצורך. לקבלת דוגמאות רגיש pH נמוך במיוחד, כתמים tungstate או molybdate anionic עשוי להיות יעיל יותר. למרות הכתמים האלה נמצאו כדי לגרום להיווצרות חפצים במקרים מסוימים, כגון היווצרות של rouleaux ב ליפופרוטאין דוגם20. שוב, אולי ה-pH של הכתם צריכים להיות מותאמים, הפעם כדי מעל נקודה איזואלקטרית של המדגם, כדי למנוע כתמים חיובי.
כביסה של המדגם לפני צביעת עשוי להיות נחוץ אם המאגר שבו נשמר את הדגימה יש רכיב גבוה של מלח או פוספט. במקרים רבים, כביסה יכול להתבצע עם הנדסה גנטית מים אך עבור דגימות יותר רגישים, אשר עשוי לפגוע או עוברים שינויים מבניים כאשר הם נחשפים מים לבד, כביסה יתכן שיהיה צורך לבצע עם מאגר הנפיצה של עוצמת יוניים נמוכה8. אפילו בתנאים מבוקרים בקפידה, כביסה יכול לגרום כמה מבניים סידורם מחדש על פני השטח פחמן21.
השיטה שבאמצעותה רשת מוכן מבחינת מדגם ספיחה, סופג, צביעת יכול גם להשפיע באופן משמעותי על תצפית. השיטה המתאימה ביותר היא לכן, שוב, מאוד לטעום התלויים. C-חלבון, לדוגמה, הוא ציין כאל מבנה טבעתי הכדוריים בעקבות צד-כתם מכתים, אבל נראה לי חפץ של תהליך צביעת, כפי גילה כאשר רשתות מוכנות בשיטת יתנגש (או בשיטת שטיפה מהירה) (איור 3 ). בשיטות יתנגש ומהירה שטיפה, הזמן שהדגימה יש לקיים אינטראקציה עם הפחמן תמיכה השטח לפני קיבוע הוא ממוזער15. המדגם גם חוויות פחות כוחות מ מניסקוס נסוגים על סופג לפני קיבוע. משמעות הדבר היא כי ביצוע שינויים מבניים הדגימה שעלולות להתרחש בעת הקליטה ממושך זמן על הסרט פחמן או דרך פעולה נימי הן מזעריות. השיטה שטיפה מהירה יכולה לשמש גם לניתוח זמן לפתור של דגימות. המדגם ניתן לערבב עם ליגנד או כתוסף בתוך טיפ פיפטה ערכה תקופה של זמן לפני יישום רשת או רק באופן זמני על פני הרשת לפני קיבוע בתוך אלפיות השנייה.
העומק של כתם הנדרשים לאספקת תמונות אופטימלית של הדגימה מסוים הוא שוב תלוי מדגם2. אם הכתם הוא רדוד מדי, מולקולות עלולים להיפגע על ידי כשקרן האלקטרונים אבל אם הכתם סמיך מדי תכונות מבניות יכול ללכת לאיבוד. עומק הכתם מושפע על ידי גורמים רבים כגון hydrophilicity של פני השטח רשת, שויון של השכבה פחמן, הסכום של כתם חלה על הרשת, משך הזמן הכתם נמצא בקשר עם הרשת לפני סופג, היקף סופג והפעם זה טא kes עבור הרשת כדי יבש לחלוטין. רשת שלעולם לא יהיה ריפודי כתופיים של כתם על פני כולו, לכן אזורים של הרשת המתאים עבור הדמיה צריך לבחור בקפידה. אכן, רשתות להשתנות לעיתים קרובות איכות גם כאשר מוכן באותו יום תחת באותם התנאים. דוגמא טובה איך בו וריאציה לעומק הכתם משפיע על המראה של מולקולות ואת עומק הכתם המתאים עבור הדמיה ניתנת על ידי ברג'ס ואח5.
למרות שלילי מכתימים שיטה מאוד תכליתי מהירה, פשוטה, לא כל דגימות ביולוגיות נתונות ויזואליזציה בשיטה זו. הרכבות שביר יכול לכווץ או לפרק על ספיחה, מכתים או ייבוש על רשת EM22. צביעת שלילי יכול גם להוביל שיטוח של מולקולות, זירוז אוריינטציות המועדפת של מולקולות על הסרט תמיכה7פחמן.
כתם שלילי הוא כלי רב ערך עבור הערכה של דגימות בזכות עצמו, וגם לפני ניתוח הקפאה-EM אבל רבים של כוחות פיזיים שהמדגם מפגשים במהלך התהליך הם הבינו. לכן, הגישה הטובה ביותר לשימוש היא מאוד לטעום התלויים, צריכה להיקבע על ידי משפט--שגיאה ולא לימדתי בעקבות פרוטוקול קבוע.
Disclosures
המחברים מצהירים אין אינטרסים כלכליים מתחרים.
Acknowledgements
. אנחנו מאוד אסירי תודה. אל פיטר פרש על דיונים מועילים, סקירה ביקורתית של כתב היד. ברצוננו להודות לכל חברי צוות המעבדה Biostructure אסטבורי לדיונים מועיל ולמעבדות של ניל Ranson, של סטיבן Muench. עבודה זו מומן על ידי המועצה האירופית למחקר (האיחוד FP7/2007-2013) / ERC להעניק הסכם 322408. C-חלבון הופק באמצעות המשאבים המסופקים על ידי מענק קרן לב (BHF פ ג/13/83/30485). אנו מודים גם טרסט עבור ציוד מימון לתמוך מיקרוסקופ אלקטרונים בלידס (090932/Z/09/Z ו- 094232/Z/10/Z). CS ממומן על ידי מענק Wellcome אמון ISSF.
Materials
| Name | Company | Catalog Number | Comments |
| 200 mesh copper EM grids | Sigma-Aldrich | G4776-1VL | Other materials and/or mesh sizes can also be used |
| Ammonium Molybdate | Sigma-Aldrich | 277908 | |
| Carbon evaporator | Ted Pella Inc. | 9620 | Cressington 208 or equivalent |
| Collodion solution 2% in amyl acetate | Sigma-Aldrich | 9817 | |
| Dumont #5 negative pressure tweezers | World Precision Instruments | 501202 | Or other tweezers as preferred |
| Erbium Acetate | Sigma-Aldrich | 325570 | |
| Gadolinium Acetate | Sigma-Aldrich | 325678 | |
| Mica Sheets. 75x25x0.15mm. | AGAR Scientific | AGG250-1 | |
| Microscope slides, white frosted | Fisher Scientific | 12607976 | Or equivalent |
| Parafilm | Fisher Scientific | 10018130 | Or equivalent |
| Pasteur pipette (glass) | Fisher Scientific | 10343663 | Or equivalent |
| Razor blade | Fisher Scientific | 11904325 | Or equivalent |
| Sandpaper | Hardware store | Wet and dry sandpaper with grit finer that 200 (600 suggested) | |
| Samarium Acetate | Sigma-Aldrich | 325872 | |
| Sodium Hydroxide | Sigma-Aldrich | 1.06462 | |
| Sodium Phosphotungstate | Sigma-Aldrich | P6395 | |
| Stainless Steel Mesh, 150x150 mm (cut to size). | AGAR Scientific | AGG252 | |
| Thulium Acetate | Sigma-Aldrich | 367702 | |
| Two Step Carbon Rod Sharper, for 1/4" rods | Ted Pella Inc. | 57-10 | Or equivalent for carbon evaporator used |
| Ultra pure water | |||
| Uranyl Acetate | Electron Microscopy Sciences | 22400 | |
| Uranyl Formate | Electron Microscopy Sciences | 22450 | |
| Vacuum grease | Fisher Scientific | 12719406 | Or equivalent |
| Whatman #1 Filter paper. | Fisher Scientific | 1001 090 | Or equivalent |
| Whatman #40 filter paper | Fisher Scientific | 10674122 | Or equivalent |
References
- Merk, A., et al. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell. 165 (7), 1698-1707 (2016).
- De Carlo, S., Harris, J. R. Negative staining and cryo-negative staining of macromolecules and viruses for TEM. Micron. 42 (2), 117-131 (2011).
- Thompson, R. F., Walker, M., Siebert, C. A., Muench, S. P., Ranson, N. A. An introduction to sample preparation and imaging by cryo-electron microscopy for structural biology. Methods. 100, 3-15 (2016).
- Ha, J. Y., et al. Molecular architecture of the complete COG tethering complex. Nat Struct Mol Biol. 23 (8), 758-760 (2016).
- Burgess, S. A., Walker, M. L., Thirumurugan, K., Trinick, J., Knight, P. J. Use of negative stain and single-particle image processing to explore dynamic properties of flexible macromolecules. J Struct Biol. 147 (3), 247-258 (2004).
- Fabre, L., Bao, H., Innes, J., Duong, F., Rouiller, I. Negative-stain single particle EM of the maltose transporter in nanodiscs reveals asymmetric closure of MalK2 and catalytic roles of ATP, MalE and maltose. J Biol Chem. , (2017).
- Zhang, L., et al. An optimized negative-staining protocol of electron microscopy for apoE4 POPC lipoprotein. J Lipid Res. 51 (5), 1228-1236 (2010).
- Ohi, M., Li, Y., Cheng, Y., Walz, T. Negative Staining and Image Classification - Powerful Tools in Modern Electron Microscopy. Biol Proced Online. 6 (1), 23-34 (2004).
- Haschemeyer, R. H., Myers, R. J. . Negative Staining in Principles and Techniques of Electron Microscopy. 2, 101-147 (1972).
- Massover, W. H. Positive staining of protein molecules for electron microscopy: polyiodination of the apoferritin shell in ferritin. Ultramicroscopy. 52, 383-387 (1993).
- Harris, J. R., Bhella, D., Adrian, M. Recent Developments in Negative Staining for Transmission Electron Microscopy. Microsc Microanal. 20, 17-21 (2006).
- Hosogi, N., Nishioka, H., Nakakoshi, M. Evaluation of lanthanide salts as alternative stains to uranyl acetate. Microscopy (Oxf). 64 (6), 429-435 (2015).
- Zhao, F., Craig, R. Capturing time-resolved changes in molecular structure by negative staining. J Struct Biol. 141, 43-52 (2003).
- Cao, B., Xu, H., Mao, C. Transmission electron microscopy as a tool to image bioinorganic nanohybrids: the case of phage-gold nanocomposites. Microsc Res Tech. 74 (7), 627-635 (2011).
- Imai, H., et al. Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules. Nat Commun. 6, 8179 (2015).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. J Vis Exp. (58), (2011).
- Kendall, A., McDonald, M., Stubbs, G. Precise determination of the helical repeat of tobacco mosaic virus. Virology. 369 (1), 226-227 (2007).
- Scheres, S. H. A Bayesian view on cryo-EM structure determination. J. Mol. Bio. 415 (2), 406-418 (2012).
- Bremer, A., Henn, C., Engel, A., Baumeister, W., Aebi, U. Has negative staining still a place in biomacromolecular electron microscopy?. Ultramicroscopy. 46, 85-111 (1992).
- Garewal, M., Zhang, L., Ren, G., Kleinschmidt, J. . Lipid-Protein Interactions. Methods Mol Biol (Methods and Protocols). 974, 111-118 (2012).
- Walker, M. L., et al. Two-headed binding of a processive myosin to F-actin. Nature. 405 (6788), 804-807 (2000).
- Orlova, E. V., Saibil, H. R. Structural Analysis of Macromolecular Assemblies by Electron Microscopy. Chem Rev. 111 (12), 7710-7748 (2011).
Erratum
Formal Correction: Erratum: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems
Posted by JoVE Editors on 1/30/2020. Citeable Link.
An erratum was issued for: Variations on Negative Stain Electron Microscopy Methods: Tools for Tackling Challenging Systems. An author name was updated.
One of the authors' names was corrected from:
Matthew G. Iadaza
to:
Matthew G. Iadanza
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved