Method Article
אפיון של תאים חיסוניים בתוך רקמת שומן אנושי באמצעות Cytometry זרימה
* These authors contributed equally
In This Article
Summary
מאמר זה מתאר שיטה לניתוח תוכן תא החיסון של רקמת שומן על ידי בידוד של תאים חיסוניים של רקמת שומן וניתוח עוקבות באמצעות cytometry זרימה.
Abstract
חדירה של תאים חיסוניים בתוך רקמת שומן תת עורית, מהבטן (ב) הפקדות מוביל דלקת בדרגה נמוכה תורמים להתפתחות סיבוכים הקשורים להשמנה כגון סוכרת מסוג 2. לחקור באופן כמותי ובאופיו תת-קבוצות תא החיסון-אנוש-פיקדונות, פיתחנו בגישה cytometry זרימה. סטרומה וסקולרית השבר (SVF), המכיל תאים חיסוניים, מופרד מן תת עורית מהבטן-ביופסיות על ידי collagenase עיכול. Adipocytes מוסרים לאחר צנטריפוגה. התאים SVF מוכתמים עבור מספר סמני ממברנה מכורך שנבחרו כדי להבדיל בין קבוצות משנה של תאים חיסוניים, נותחה באמצעות cytometry זרימה. בעקבות גישה זו, pro - ו אנטי - inflammatory מקרופאג קבוצות משנה, תאים דנדריטים (Dc), תאי-B, CD4+ ו CD8+ תאי-T, ואת תאי NK ועוזרת לכמת. שיטה זו מעניקה מידע מפורט אודות תאים חיסוניים ב- AT ואת מידת משנה ספציפי. מאז יש נוגדנים פלורסנט רבים זמינים, בהתקרבות cytometry זרימה יכול להיות מותאם כדי למדוד את סמני הסלולר, תאיים שונים של עניין.
Introduction
השמנת יתר מאופיין עם AT בדרגה נמוכה דלקת1 וחדירה של תאים חיסוניים הפרו דלקתיים הקרביים והן תת עורית-(מע"מ, ישב). הצטברות של תאים חיסוניים הפרו דלקתיים ב במע מ מוביל עמידות לאינסולין הוא גורם הסיכון העיקרי לפיתוח סוג 2 סוכרת2. תאי המערכת החיסונית של שני מולדת, מסתגלת המערכת החיסונית מצויים AT מהשמנת יתר, כגון מקרופאגים, תאי פיטום, נויטרופילים, CD4+ ו CD8+ תאי-T ו B-תאים3,4,5,6 ,7. אלו תאים חיסוניים, יחד עם תאי אנדותל, סטרומה תאים, adipocyte אבות, fibroblasts ו pericytes, מהווים את SVF8 , המקור העיקרי של חומרים פרו-דלקתיים ב AT9.
מצב דלקתי של AT נפוץ נחקר על ידי טכניקות כולל תספיג10, qPCR11אימונוהיסטוכימיה11. עם זאת, בעת שימוש הטכניקות הללו, AT כולו, adipocytes ו SVF, משמש. דבר זה הופך קשה לקבוע את הכמות ואת קבוצות משנה של תאים חיסוניים נוכח AT. תאים חיסוניים יש סמנים שונים תא כדי להגדיר ולסווג אותם, כגון מקרופאגים. מקרופאגים הצג הטרוגניות משמעותי הפונקציה והן תא השטח סמן ביטוי12. לכן, לעתים קרובות הם מסווגים לתוך שתי האוכלוסיות מקרופאג: M1 ו- M2. M2 macrophages נקראים בדרך כלל מופעל לחלופין מקרופאגים12,13 , שוכנים AT של בני אדם רזה, סמויה רגילה14. עם זאת, במהלך השמנה, מתג פנוטיפי למועצה של מקרופאגים M2 M1 מקרופאגים. אלה מופעלות בסגנון קלאסי M1 מקרופאגים אקספרס CD11C12 ולצבור סביב adipocytes מת כדי ליצור מבנים דמויי-כתר13. הוכח כי CD11C+ מקרופאגים ב- AT לפגום אינסולין פעולה והן משויכות תנגודת לאינסולין שמנים בני15. כדי לזהות מקרופאגים M1 ו- M2 ב- AT, אימונוהיסטוכימיה הוא אופציה. טכניקה זו מעניקה מידע על מיקום המקרופאגים ברקמה. עם זאת, תגביל את מספר סמנים יכולים לשמש מכתים אחד. יתר על כן, זה גם קשה לכמת. לכן, כדי לחקור את קבוצות משנה של תאים חיסוניים שונים מע מ ו הלווייני מרבצי, פיתחנו בגישה cytometry זרימה. גישה זו נותן לנו את ההזדמנות להשתמש מספר סמני בכל תא עם ניתוח cytometry זרימה אחת להגדיר קבוצות משנה תא ולספור את המספרים של כל משנה נוכח ההפקדות AT.
Protocol
הקרביים תת עורית על דוגמאות נלקחו מן הנבדקים שהשתתפו במחקר אושרה על ידי מינהל חולים Jessa ועדה רפואית אתית, הסלט, אוניברסיטת האסלט, בלגיה, בהתאם הצהרת הלסינקי.
1. הכנת נוגדנים
- פתרון collagenase
- להמיס 1 g של Collagenase אני ב- 10 מ"ל של פוספט buffered תמיסת מלח (PBS, בלי סידן ומגנזיום) כדי להפוך פתרון מניות 100 מ"ג/מ"ל. להכין 200 µL aliquots ולאחסן ב-20 ° C.
- להמיס 1 g של שי Collagenase ב- 10 מ"ל של PBS לעשות פתרון מניות 100 מ"ג/מ"ל. להכין 200 µL aliquots ולאחסן ב-20 ° C.
- להמיס 10 מ"ג DNase. אני ב- 10 מ"ל של PBS לעשות פתרון מניות 10 מ"ג/מ"ל. להכין 180 µL aliquots ולאחסן ב-20 ° C.
- להוסיף 100 µL Collagenase אני (100 מ"ג/מ"ל), µL 100 Collagenase XI (100 מ"ג/מ"ל) ו 90 µL DNase I (10 mg/mL) 10 מיליליטר F12 של DMEM חזיר. להפוך את פתרון collagenase טריים כל בידוד.
- מאגר פירוק כדוריות דם אדומות
- להמיס 0.84 g NH4Cl ב- 100 מ של מים הנדסה גנטית.
- להגדיר את ה-pH 7.4 לפני השימוש. לאחסן בקבוקון זכוכית ב 4 º C.
- במקום המאגר פירוק כדוריות דם אדומות על הקרח לפני השימוש.
- מאגר FACS
- להמיס 0.5 ג'י אלבומין שור (BSA) ב- 100 מ של PBS להשיג PBS BSA 0.5%.
- להמיס 65 מ"ג של נאן3 ב- 100 מ ל 0.5% BSA PBS לקבל 10 מ מ נאן3 0.5% BSA PBS. לאחסן פתרון בקבוקון זכוכית ב 4 º C.
- מאגר FACS המקום על הקרח לפני השימוש.
התראה: נאן3 הוא רעיל מאוד. לעבוד בשכונה fume וללבוש בטיחות משקפיים וכפפות להגנה בעת טיפול נאן3.
- בלוק IgG אנושי
- להמיס 10 מ ג של IgG האנושי ב- 10 מ"ל PBS כדי לקבל 1 מ"ג/מ"ל. להכין 100 µL aliquots ולאחסן ב-20 ° C.
- המקום הרחוב IgG אנושי על הקרח לפני השימוש.
2. בידוד של SVF מ- AT
- לחתוך 1 גר'-ביופסיה לחתיכות קטנות (2 מ מ ±2) עם האזמל, העברת שפופרת צנטרפוגה 50-mL (למשל, צינור בז). להוסיף 10 מ של פתרון collagenase כל אחד בלדוגמה.
הערה: סגור את המכסה של הצינור לחלוטין ולשוב את המכסה ¼ התור. - תקופת דגירה של 60 דקות ב 37 מעלות צלזיוס בתוך אמבט מים תחת עדין רועדות (60 מחזורים/דקה).
- לסנן את המתלים וכתוצאה מכך עם מסנן מיקרומטר 200 ולאסוף את הדגימה בתוך שפופרת צנטרפוגה 50-mL החדש. להוסיף 7 מ ל PBS מעל המסנן כדי לשטוף את המסנן ולקבל כל התאים.
- Centrifuge הדגימה ב g x 280 דקות 5-4 מעלות צלזיוס.
- הסר את השבר adipocyte צף על-ידי pipetting. בגדר התא הוא SVF.
הערה: הסר את השבר adipocyte להשיג SVF. הימנע בקצה כל המדגם כי רק תסיר את PBS, לא את adipocytes צפה. - Resuspend את SVF ב 5 מ של PBS כדי להסיר collagenase, לסנן את הבולם עם מסנן מיקרומטר 70, יש לשטוף את המסנן עם 5 מ"ל PBS ו centrifuge הדגימה ב g x 280 דקות 5-4 מעלות צלזיוס.
- הסר את תגובת שיקוע ולאחר resuspend בגדר ב- 3 מ"ל של מאגר פירוק כדוריות דם אדומות.
- תקופת דגירה של 5 דקות על קרח. להוסיף 7 מ של PBS לאחר דגירה.
- Centrifuge הדגימה ב g x 280 דקות 5-4 מעלות צלזיוס.
3. צביעת של SVF לניתוח Cytometry זרימה
- להמיס בגדר תא במאגר FACS 4 ° C µL 90 ולהוסיף µL 10 של גוש IgG האנושי 1 מ"ג/מ"ל. לחלק התליה תא בבארות 2 של צלחת טוב v 96-צורה. מניחים את הצלחת על הקרח ותנו הרחוב IgG האנושי תקופת דגירה של 15 דקות.
- להוסיף 100 µL FACS מאגר כל מדגם לשטוף את centrifuge את הצלחת. בשביל חמש דקות עם ג'י 280 x ב- 4 מעלות צלזיוס. הסר את תגובת שיקוע על ידי המפנה את הצלחת הפוך בתנועה חלקה אחת מבלי לנגוע לצלחת.
הערה: הקפד להסיר את כל הנוזל הנותר מהחלק העליון של הצלחת עם רקמה תוך שמירה על הצלחת במהופך. - להכין נוגדן קוקטיילים מקרופאג DC קבוצות משנה (FACS לוח 1) וכן קבוצות משנה T - ו B-cell (FACS לוח 2) כפי שמתואר בטבלה 1 ו- 2 בטבלה. אמצעי האחסון המתוארות בטבלה 1 ו- 2 בטבלה נבחרו לאחר מיטוב ריכוז נוגדן והם מספיק עבור מע מ אחד או לטעום לווייני.
הערה: בלוח FACS 1, השתמש את סמני CD303 ו- CD141 כדי לאשר את CD11C+ CD11B תאיםנמוך הם בקרי קבוצת מחשבים. עם זאת, מומלץ לכלול סמנים אלה מהחלונית ' ' כדי לכלול של צביעת חי/מת. ניתן לשלב שני לוח FACS 1 ו- 2 הכדאיות חי/מת שניתן לתקן אדום מת תא כתם ערכת מכתים בעת למעט CD303 בלוח 1 כערוץ PE יהיה בשימוש. לבצע הכדאיות מכתים בהתאם להוראות היצרן. - Resuspend בגדר ב 29.5 נוגדן µL קוקטייל לחלונית FACS 1, נוגדן µL 23 קוקטייל לחלונית FACS 2. תקופת דגירה של 30 דקות בחושך על קרח.
- להוסיף 150 µL FACS מאגר כל טוב, resuspend בגדר תא לביצוע שלב שני לשטוף. Centrifuge את הצלחת. בשביל 5 דקות ב 280 x g ו- 4 מעלות צלזיוס. הסר את תגובת שיקוע על ידי המפנה את הצלחת במהופך.
- להוסיף 150 µL 1% פורמלדהיד פתרון כל טוב לתקן את התאים. העברה התליה תא מכל קידוח הצינור FACS המתאים על-ידי pipetting עם פיפטה P200. לאחסן FACS צינורות ב 4 ° C עד 7 ימים אפלים.
הערה: מדידה ישירה אפשרי גם כן. להוסיף 150 µL FACS מאגר כל טוב במקום 1% פורמלדהיד, להעביר את התאים על ידי pipetting עם פיפטה P200 כדי הצינורות FACS המתאימים, וכן לנתח את התאים.
התראה: פורמלדהיד הוא רעיל מאוד. להכין פורמלדהיד פתרונות תוך כדי עבודה בשכונה fume כדי למנוע שאיפת ללבוש כפפות ומשקפיים בטיחות להגנה.
4. לזרום Cytometry ניתוח
- לפני המדידה הראשונה, השתמש בפקד שלילי וללא רבב כדי לקבוע את פיזור קדמי (FSC) לצד פיזור (האס). התאם את המתחים של cytometer הזרימה על פי הוראות היצרן כך כל האוכלוסיות עניין גלויים בגרף FSC ואת האס ולא ניתן לבצע הפרדה בין פסולת לבין תאים חיים.
- לבצע ניתוח צבע רב פיצוי עם נוגדן לכידת חרוזים לפי הפרוטוקול של היצרן.
- הכן פלורסצנטיות מינוס אחד פקדים (FMO) על ידי המיקס נוגדן אך לא לכלול סוג נוגדן אחד מהתערובת. . עושה את זה בשביל כל נוגדן, יצירת נוגדנים 8, תערובות FACS בלוח 1, נוגדנים 6, תערובות FACS לוח 2 תערובות נוגדנים אלה FMO משמשים כתם SVF כפי שתואר לעיל בפרוטוקול זה.
- למדוד את כל פקדי FMO ולהגדיר את האסטרטגיה המגביל בהתבסס על פקדים FMO. השתמש בפקדי FMO כדי לזהות אוטומטית-זריחה אפשרי של התאים.
הערה: על-ידי הסרת סוג נוגדן אחד מהתערובת, בכל רמת קרינה פלואורסצנטית זוהה ערוץ זה היא אות רקע/autofluorescent. לפיכך, על-ידי השוואת FMO שונים של שליטה תוצאות FACS, השערים ניתן להסיק על אוכלוסיות ספציפיות להבטיח כי gatings המבוסס על תאים חיוביים, אינה מבוססת על אוטומטי-זריחה. - מערבולת FACS צינורות-800 סל ד לפני הכנסתם cytometer זרימה, מתחילים את המדידה.
הערה: מומלץ מינימום של 50,000 אירועים בשער בשידור חי כדי להבטיח שמספיק תאים נמדדים כל subpopulation.
תוצאות
SVF מבודד מע מ, וישב נמדדה באמצעות cytometry זרימה. מדידות cytometry זרימה ליצור מתווה מציג אוכלוסיות תאים שונים בהתבסס על סמנים הסלולר (איור 1A ו 1B). ראשית, על ידי התוויית פארווערטס פיזור רוחב (FSC-W) והעבירו פיזור אזור (FSC-A), תא אגרגטים ניתן לסלק מן ניתוח נוסף מאת gating את התאים כמו FSC נמוך-וו הבא, בשידור חי תאים נבחרים, ו פסולת הסלולר הוא נשלל על ידי gating התאים בגודל הנכון והמורכבות באמצעות FSC-צד ואת פיזור אזור (האס-A), בהתאמה. תאים מתים הם קטנים ולכן גלוי כאוכלוסייה ברורים עם קטן FSC-א הבא, המערכת החיסונית תאים נבחרו על-ידי שימוש בסמן פאן-ליקוציט CD45 (לוח 1 ו-2, איור 1 א'). כדי לנתח מקרופאגים, תאי החיסון אחרים כגון תאי-טי (CD3), תאי-B (CD19), נויטרופילים (CD66b+ CD11b+), ואת תאי ה-NK (CD56) נכללו ניתוח נוסף באמצעות נוגדנים ייחודיים מיקוד תאים אלה, אבל עם אותו fluorochrome. חלוקה נוספת של התאים הנותרים התבססה על הביטוי CD11b ו- CD11c. כתוצאה מכך האוכלוסיות הבאות: CD11b+ CD11c+ מקרופאגים, CD11b+ CD11c– , מאקרופאגים CD11bנמוך /- CD11c+ בקרי קבוצת מחשבים (FACS לוח 1, איור 1B). מדידה של עוצמת קרינה פלואורסצנטית רשע (MFI) מותר כימות של הביטוי של CD303 (סמן plasmacytoid DC) ו CD141 (DC מרקר), על CD11b+ CD11c+ CD11b מאקרופאגיםנמוך /- CD11c+ DCs. ביטוי של שני הסמנים הללו היו גבוהים יותר CD11bנמוך /- CD11c+ תאים המאשרת את CD11bנמוך /- CD11c+ היו תאים בקרי קבוצת מחשבים (איור 1C).
CD45+ תאים (איור 1 א') חולקו תאי T ותאי B באמצעות CD3 ו- CD19, בהתאמה. תאי-T היו מחולק תאי T-helper (CD4+), תאי-T ציטוטוקסיות (CD8+). לבסוף, CD3–CD19 תאים–שורטטו לכמת תאי NK-שימוש בסמן CD56 (FACS לוח 2, איור 1D). מספר התאים בתוך כל שער הוא לכמת והוא יכול לשמש כדי לחשב את האחוז בסוג התא החי כל התאים (טבלה 3).
ניתן לחשב את אחוז תאים חיים עבור כל נושא המאפשר חישוב ממוצע של כל הנושאים בקבוצה של למשל גברים רזים או שמנים מציג השפע של המערכת החיסונית תא מוגדר, קרי, CD11b פרו דלקתיים+ CD11c+ מקרופאג ב- AT הקרביים (איור 2).
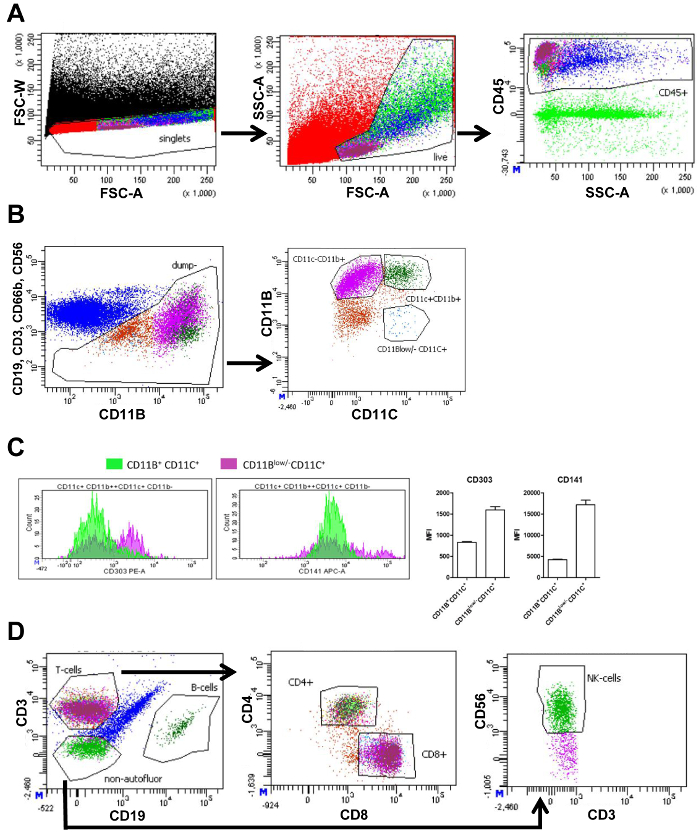
איור 1. FACS gating אסטרטגיה של רקמת שומן הקרביים. (א) FACS העלילה של כל האירועים (שחור) עם עוצמת רוחב פיזור קדמי (FSC-W) ועוצמת באזור פיזור קדמי (FSC-A) המכיל שער כדי לבחור רק תאים בודדים (אדום) ואחריו מגרש FACS בהתבסס על פיזור FSC-A ואת הצד אזור עוצמת (האס-A) המכיל שער בחירת תאים חיים (ירוק בהיר). העלילה הבאה עם האס-A עוצמת קרינה פלואורסצנטית CD45 מכיל שער בחירת כל CD45+ (החיסון) תאים (כחול). (B) FACS מגרש של עוצמת קרינה פלואורסצנטית CD19, CD3, CD66b ו CD56 מול עוצמת קרינה פלואורסצנטית CD11b, ושער בחירת התאים הם CD19, CD3, CD66b ו- CD56 שלילי (חום) לחלוקה נוספת לאוכלוסיות. חלוקה נוספת העלילה הבאה בהתבסס על עוצמת קרינה פלואורסצנטית CD11b ו- CD11c. גייטס מוצגים המכיל CD11b+ CD11c+ מקרופאגים (ירוק כהה), CD11b+ CD11c– (סגול), מאקרופאגים CD11bנמוך /- CD11c+ תאים דנדריטים (כחול). (ג) סכום של CD11b+, CD11c+, או CD11bנמוך /- CD11c+ תאים (ציר y) הצגת דרגות עוצמת קרינה פלואורסצנטית (ציר x) עבור CD303 CD141, ואת כימות המקביל של הממוצע עוצמת קרינה פלואורסצנטית (MFI). מגרש (D) FACS מציג את CD45 הקודם+ האוכלוסייה (כחול) מבוסס על עוצמת קרינה פלואורסצנטית CD3 ו CD19 המכיל השערים בחירת תאי-T (מגנטה), תאי-B (ירוק כהה) ותאים שאינם-autofluorescent (ירוק) שלילי עבור שניהם CD3 CD19. העלילה הבאה מבוססת על ידי קרינה פלואורסצנטית CD4 ו CD8 השערים בחירת CD4+ (ירוק בהיר) ו CD8+ (מגנטה) תאי-T. אסטרטגיית המגביל זהים משמשת רקמת השומן התת עורית. אסטרטגיית המגביל זהים משמשת רקמת השומן התת עורית. דמות זו שונתה מ. ואוטרס et al. 16 אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
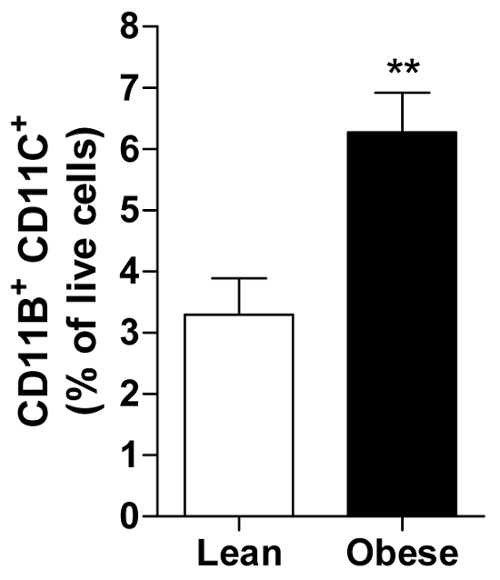
באיור 2. מע מ שמנים מכיל מקרופאגים הפרו דלקתיים יותר. כמות CD11b+ CD11c+ מקרופאגים הציג כאחוז של כל התאים החיים מע מ של גברים שמנים ובעלי רזה. כל הנתונים הם אמצעי ± SEM; n = 20 עבור רזה ו- n = 31 עבור מהשמנת יתר. p ≤ 0.01 לעומת רזה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| היעד | הגדרת המטרה | להציג על | Fluorochrome | כמות | שיבוט |
| CD11B | אינטגרין מיאלואידית סמן | גרנולוציטים ומונוציטים/מקרופאגים, תאים דנדריטיםנמוך , תאים רוצח טבעי | BV421 | 2.5 ΜL | ICRF44 |
| CD19 | אנטיגן B cell נפוצות | פיתוח תא b מתא pro-B תא B blastoid, פלזמה B cell | Fitc | 3 ΜL | HIB19 |
| CD3 | נפוץ תא T אנטיגן | לימפוציטים מסוג T, T תאים הרוצח הטבעי ו- thymocytes | Fitc | 3 ΜL | UCHT1 |
| CD66B | חבר של אנטיגן carcinoembryonic (CEA)-כמו משפחה גליקופרוטאין | גרנולוציטים | Fitc | 5 ΜL | G10F5 |
| CD56 | בכבדות glycosylated אדהזיה חלבון | תאים רוצח טבעי ולא טבעי T תאים הרוצח | Fitc | 5 ΜL | B159 |
| CD303 | סוג II transmembrane גליקופרוטאין | תאים דנדריטים plasmacytoid | PE | 1 ΜL | 201A |
| CD141 | thrombomodulin | ומונוציטים/מקרופאגיםנמוכה, subpopulation של תאים דנדריטים | APC | 1 ΜL | M80 |
| CD11C | מסוג גליקופרוטאין transmembrane; אינטגרין αx | ומונוציטים/מקרופאגים, תאים דנדריטים, גרנולוציטים, תאים רוצח טבעי, משנה של תאי B ו- T | APC-Cy7 | 0.5 ΜL | Bu15 |
| CD45 | אנטיגן לויקוציטים נפוצות | כל לויקוציטים אנושיים כולל לימפוציטים ומונוציטים, גרנולוציטים, אאוזינופילים, thymocytes | PE-Cy7 | 1 ΜL | HI30 |
| מאגר FACS | - | - | - | 7.5 µl | - |
טבלה 1. נוגדן קוקטייל עבור FACS panel 1 כדי לזהות קבוצות משנה מקרופאג אוכלוסיות תאים דנדריטים. כמות נוגדנים המתוארת היא לניתוח של דוגמא אחת.
| היעד | הגדרת המטרה | להציג על | Fluorochrome | כמות | שיבוט |
| CD19 | אנטיגן B cell נפוצות | פיתוח תא b מתא pro-B תא B blastoid, פלזמה B cell | BV421 | 1 ΜL | HIB19 |
| CD3 | נפוץ תא T אנטיגן | לימפוציטים מסוג T, T תאים הרוצח הטבעי ו- thymocytes | V500 | 3 ΜL | UCHT1 |
| CD56 | בכבדות glycosylated אדהזיה חלבון | תאים רוצח טבעי ולא טבעי T תאים הרוצח | APC | 5 ΜL | HCD56 |
| CD4 | Ig superfamily, מסוג גליקופרוטאין transmembrane | תא T מסייע, thymocytes, ומונוציטים/מקרופאגים, הקלד II טבעי T תאים הרוצח | PerCP-Cy5.5 | 1 ΜL | RPA-T4 |
| CD8 | Α-יחידת משנה של תסביך ריאקציה דו-מולקולרית מקושרים דיסולפידי | T ציטוטוקסיים, thymocytes, קבוצת משנה של תאים רוצח טבעי | APC-H7 | 2 ΜL | SK1 |
| CD45 | אנטיגן לויקוציטים נפוצות | כל לויקוציטים אנושיים כולל לימפוציטים ומונוציטים, גרנולוציטים, אאוזינופילים, thymocytes | PE-Cy7 | 1 ΜL | HI30 |
| מאגר FACS | - | - | - | 10 µl | - |
בטבלה 2. נוגדן קוקטייל עבור FACS לוח 2לזהות אוכלוסיות T - ו B-cell. כמות נוגדנים המתוארת היא לניתוח של דוגמא אחת.
| מקרופאג לוח | ||
| השם שער | # תאים | אחוז בשידור חי |
| תאים בודדים | 183054 | |
| לחיות | 10477 | 100 |
| CD45 | 4100 | 39.13 |
| dump– | 771 | 7.36 |
| CD11C– CD11B+ | 430 | 4.1 |
| CD11C+ CD11B+ | 104 | 0.99 |
| CD11C+ CD11Bנמוך /- | 15 | 0.14 |
| תא T, B-cell, תאי NK לוח | ||
| השם שער | #Cells | אחוז בשידור חי |
| תאים בודדים | 34616 | |
| לחיות | 3728 | 100 |
| CD45+ | 1589 | 42.62 |
| תאי NK- | 29 | 0.78 |
| CD3+ | 953 | 25.56 |
| CD4+ | 601 | 16.12 |
| CD8+ | 328 | 8.8 |
| CD19+ | 20 | 0.54 |
בטבלה 3. תא החיסון שפע של סוגי תאים שונים במע מ. מספר תאים כל שער ואת האחוז של סוגי תאים שונים בהתבסס על הסכום הכולל של תאים חיים.
Discussion
שיטות אלה מתארים כיצד לבודד את SVF ממיכל ישב, לכמת את כמויות יחסיות של תאים חיסוניים בתוך רקמות אלו. יתר על כן, השיטות המדינה כיצד לקבוע את הביטוי של סמנים על סוגי תאים ספציפיים.
Cytometry זרימה של רקמת תאים חיסוניים היא טכניקה חזקה כדי ותפקיד המדינה אימונולוגי של רקמות. כימות של רקמת תאים חיסוניים יכולים להיות יישומים רבים. כפי שמתואר את התוצאות, זה אפשרי להשוות בין הנוכחות של תאים חיסוניים מסוימת בין קבוצות של חולים (למשל, רזה לעומת שמנים). בנוסף, על-ידי ביצוע גם cytometry זרימה בדם של החולים באותו, השיוכים בין מחזורי תאים ותאים רקמות יכול ייחקרו. עם יישום זה הצלחנו לקבוע כי קבוצת משנה מסוימת של מחזורי ומונוציטים קשורה הפרו דלקתיים CD11C+ רקמת שומן מקרופאגים16.
התאמות הפרוטוקול המתואר ירחיב וביישומיה כמו רבים זמינים נוגדנים פלורסנט להפוך cytometry זרימה מאוד תכליתי. עם נוגדנים שונים ניתן להבחין כמעט כל סוגי תאים, הביטוי של סמנים רבים יכולים להתגלות. יתר על כן, זה אפשרי כתם סמנים intracellularly על ידי permeabilizing את קרום התא כדי לאפשר מחייב תאיים של הנוגדנים פלורסנט. מאפיינים אלה מאפשרים הבחנה של אוכלוסיות מקרופאג מגוונת מאוד מעבר סוגי מקרופאג פשוט יותר מדי המשנה M1 ו- M2. מלבד מדידה של השטח סמן ביטוי, חלבונים (קרי, ציטוקינים) יכול להיות מוכתם intracellularly המספקים מידע על מקרופאג פונקציונליות. בנוסף, התפשטות סמנים כגון Ki67 משמשים כדי לכמת את התפשטות המחירים. כפי שתואר, ההבחנה בין מקרופאגים בקרי קבוצת מחשבים התבססה על MFI רמות של סמנים DC. סמן מקרופאג כלליות, כגון CD68 ניתן לשלב לתוך לוח מקרופאג (FACS לוח 1). עם זאת, CD68 צריך להיות מוכתם permeabilization intracellularly דרישה של קרום התא אשר לא עדיפה, להאריך את הפרוטוקול. סמנים אחרים מקרופאג הם סמנים משנה כגון CD163, CD206 או CD11c, האחרון להיות משולב בלוח מקרופאג המוצג כאן.
פאנלים FACS שלנו, לא היה סמן כדי להבחין בין תאים מתים וחיים כלולים, וזה יהיה עדיף, משום שהיא מאפשרת הדרה מדויקת יותר של תאים מתים מאשר השימוש FSC האס. שימוש תכוף הם ה-DNA מכתים הכדאיות צבעי propidium יודיד (PI) או 4', 6-diamidino-2-phenylindole (דאפי) וכן אמין חינם מגיבה צבעי כגון חי/מת שניתן לתקן מת תא כתם הערכה, אשר זמינה בצבעים שונים לצבוע. עם זאת, PI, דאפי לא ניתן להשתמש בעת תיקון התאים. כמפורט בפרוטוקול, ההכתמה הכדאיות תא מת שניתן לתקן חי/מת אדום ניתן לשלב שני לוחות מבלי להשפיע על FACS הכוללת gating אסטרטגיה.
בנוסף, הנתונים מבוטאים כאחוזים של תאים חיים, כלומר שכל הנתונים הם יחסיים. רק על-ידי הזנת המדויק, ידוע מספר תאים לתוך cytometer הזרימה, האם זה אפשרי לקבוע את המספרים המדויקים של כל סוג התא. מספר משוער של תאים יכול לחשב לאחר ספירת התאים השבר SVF באמצעות חדר הספירה. עם זאת, מספר זה חייב להיות מותאם עבור כמות הרקמה ביופסיה נהגו לבודד את SVF, אבל יש מגבלות בהשוואת רזה כדי שמנים. מסה דומה של AT שמנים מורכבת פחות adipocytes כפי שהם מלאים ליפידים הורחב באופן משמעותי. זה יכול להוביל underestimation של מספר תאים חיסוניים אם הציג מספר של תאים חיסוניים לגרם של או לפי adipocyte.
מחקרים בבני אדם, הכללה של חולים נעשית בדרך כלל לאורך תקופה ארוכה יותר של זמן לעשות סטנדרטיזציה של נהלים ניסיוני חשיבות רבה. לשם השוואה של נתונים cytometry זרימה בין המטופלים, קיימות מספר אפשרויות. כפי שמתואר פרוטוקול זה, ניתן לתקן תאים לפני המדידה המאפשר ניתוח של מספר דגימות באותו יום. זה יכול להיעשות גם על ידי הקפאת את SVF לפני מכתימה אותם, מה שמאפשר ההליך מכתימים כשווה בין כל דוגמאות, אך עלולים להיות מושפעים הכדאיות של תאים. לבסוף, מועסק גם במחקר זה, הן חרוזים פלורסנט להתקין רמות הפיצוי, cytometer מעקב חרוזים שימשו דו-שבועי לתקנן את המידות היומי של cytometer. אפשרות אחרונה זו היא היעילה ביותר כאשר מדידת דגימות מחקר המתפרסות על-פני תקופה ארוכה של זמן.
גורם מגביל עבור cytometry זרימה באופן כללי הוא השימוש של זריחה. מספר התוויות פלורסנט שניתן לאתר בו זמנית הוא מוגבל בשל חפיפה ב ספקטרום הפליטה. עם זאת, עם פיתוח לוח FACS חכם, השימוש קוקטיילים מספר נוגדנים לכל מע מ או לטעום הלוויני, בעיה זו ניתן להתגבר כפי שמתואר פרוטוקול זה. היבט חשוב של פיתוח לוח FACS היא שולטת FMO. באמצעות לכל הנוגדנים של הפאנל חוץ מאחד, רמות autofluorescence פוטנציאליים ניתן להערכה כאשר משווים את FMO עם הפאנל מלאה. דבר זה מאפשר gating מדויק של אוכלוסיות, הליכים אלה יש לבצע בעת הגדרת פאנל FACS חדש. בנוסף, הדור החדש של התקנים FACS יכול לזהות פרמטרים עד 50 המאפשר זיהוי סימולטני של מאפיינים רבים בכל תא. בעיה נוספת הקשורה ההיבט פלורסצנטיות היא autofluorescence של תאים, בעיקר מקרופאגים. לאחר עירור של התאים עם לייזר FACS (בעיקר עם 488 ננומטר אורך גל עירור), תאים אלה פולטים אותות פלואורסצנט (בעיקר < 640 ננומטר) אותם ניתן חפיפה עם ספקטרום פליטה של הנוגדן מתייג17,18. כדי להסביר זאת, יש למדוד תאים וללא רבב כדי לקבוע את autofluorescence בכל אחד מהערוצים. עם הידע הזה, fluorochromes כדאי שנבחר להציג חוזק האות שחורג האות autofluorescent. . האות רקע autofluorescent הזה צריך להילקח בחשבון בקביעת האסטרטגיה חסימה של האוכלוסיות. לכן, על-ידי יישום של פרוטוקול זה תכנון תבוני של החלונית FACS אפשרי בעומק פנוטיפ מקרופאג יחוברו. AT ברורים חדשים מקרופאגים והתפקוד שלהם ניתן לאפיין.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
ברצוננו להודות ג'יי ואן דה Gaar Vroomen מ' (אוניברסיטת מאסטריכט, הולנד) לתמיכה טכנית שלהם. בנוסף, ברצוננו להודות ק' Verboven, ד הנסן, ג'יי Jocken, ומשמשת Blaak אי מתן דם ורקמות והביופסיות עבור הגדרת פרוטוקול זה ואת הניסויים הבאים.
Materials
| Name | Company | Catalog Number | Comments |
| Centrifuge | Hettich Rotanta 460R | 5660 | |
| Dulbecco’s Modified Eagle’s Medium (DMEM)-Ham’s F12 | Gibco ThermoFisher | 31330-095 | |
| Collagenase XI from Clostridium histolyticum | Sigma Aldrich | C7657-1g | |
| Collagenase I from Clostridium histolyticum | Sigma Aldrich | C0130-1g | |
| DNAse I from bovine pancreas | Sigma Aldrich | DN25 | |
| NH4Cl | Merck | 1.01145.0500 | |
| Bovine Serum Albumine | Sigma Aldrich | A4503-100 | |
| NaN3 | Merck | 1.06688.0100 | |
| 200 µM syringe Filcons | BD Biosciences | 340613 | |
| 70 µM filter | Greiner Bio-one | 542070 | |
| Fc block / human IgG | Sigma Aldrich | 14506 | |
| Formaldehyde | Merck | 1.04003.2500 | |
| CD11b-BV421 | Biolegend | 301324 | |
| CD19-Fitc | BD Biosciences | 555412 | |
| CD3-Fitc | BD Biosciences | 561807 | |
| CD66b-Fitc | BD Biosciences | 555724 | |
| CD56-Fitc | BD Biosciences | 562794 | |
| CD11c-APC-Cy7 | Biolegend | 337218 | |
| CD45-PE-Cy7 | BD Biosciences | 557748 | |
| CD19-BV421 | Biolegend | 302234 | |
| CD3-V500 | BD Biosciences | 561416 | |
| CD56-APC | Biolegend | 318310 | |
| CD4-PerCP-Cy5.5 | Biolegend | 300528 | |
| CD8-APC-H7 | BD Biosciences | 641400 | |
| CD303-PE | Biolegend | 354204 | |
| CD141-APC | Biolegend | 344106 | |
| FACS-Canto II | BD Biosciences | ||
| 96 v-shape well plate | Greiner Bio-one | 651101 | |
| PBS PH 7.4 | Gibco ThermoFisher | 10010023 | |
| FACS tube 5 mL polystyrene round-bottom tube | Corning | 352052 | |
| IgG from human serum | Sigma Aldrich | I4506 | |
| Anti-Rat Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552844 | |
| Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD Biosciences | 552843 | |
| LIVE/DEAD Fixable Red Dead Cell Stain Kit | ThermoFisher | L23102 | |
| IKA MS 3 basic shaker | Sigma Aldrich | Z645028-1EA |
References
- McNelis, J. C., Olefsky, J. M. Macrophages, immunity, and metabolic disease. Immunity. 41 (1), 36-48 (2014).
- Makki, K., Froguel, P., Wolowczuk, I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm. 2013, 139239 (2013).
- DeFuria, J., et al. B cells promote inflammation in obesity and type 2 diabetes through regulation of T-cell function and an inflammatory cytokine profile. Proc Natl Acad Sci U S A. 110 (13), 5133-5138 (2013).
- Elgazar-Carmon, V., Rudich, A., Hadad, N., Levy, R. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding. J Lipid Res. 49 (9), 1894-1903 (2008).
- Han, J. M., Levings, M. K. Immune regulation in obesity-associated adipose inflammation. J Immunol. 191 (2), 527-532 (2013).
- Liu, J., et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice. Nat Med. 15 (8), 940-945 (2009).
- Nishimura, S., et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity. Nat Med. 15 (8), 914-920 (2009).
- Koh, Y. J., et al. Stromal vascular fraction from adipose tissue forms profound vascular network through the dynamic reassembly of blood endothelial cells. Arterioscler Thromb Vasc Biol. 31 (5), 1141-1150 (2011).
- Peinado, J. R., et al. The stromal-vascular fraction of adipose tissue contributes to major differences between subcutaneous and visceral fat depots. Proteomics. 10 (18), 3356-3366 (2010).
- Leggate, M., et al. Determination of inflammatory and prominent proteomic changes in plasma and adipose tissue after high-intensity intermittent training in overweight and obese males. Journal of Applied Physiology. 112 (8), 1353-1360 (2012).
- Divoux, A., et al. Mast cells in human adipose tissue: link with morbid obesity, inflammatory status, and diabetes. J Clin Endocrinol Metab. 97 (9), E1677-E1685 (2012).
- Harford, K. A., Reynolds, C. M., McGillicuddy, F. C., Roche, H. M. Fats, inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue. Proc Nutr Soc. 70 (4), 408-417 (2011).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Morris, D. L., Singer, K., Lumeng, C. N. Adipose tissue macrophages: phenotypic plasticity and diversity in lean and obese states. Curr Opin Clin Nutr Metab Care. 14 (4), 341-346 (2011).
- Wentworth, J. M., et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity. Diabetes. 59 (7), 1648-1656 (2010).
- Wouters, K., et al. Circulating classical monocytes are associated with CD11c+ macrophages in human visceral adipose tissue. Sci Rep. 7, 42665 (2017).
- Duan, M., et al. Distinct macrophage subpopulations characterize acute infection and chronic inflammatory lung disease. J Immunol. 189 (2), 946-955 (2012).
- Li, F., et al. Autofluorescence contributes to false-positive intracellular Foxp3 staining in macrophages: a lesson learned from flow cytometry. J Immunol Methods. 386 (1-2), 101-107 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved