A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות המרחבי של תרופות נגעים שחפת הריאה על ידי לייזר ללכוד Microdissection נוזלי כרומטוגרפיה ספקטרומטר מסה (LCM-LC/MS)
In This Article
Summary
כאן, אנו מתארים את פרוטוקול באמצעות לייזר לכידת microdissection בשילוב עם ניתוח LC/MS במרחב-לכמת הפצות סמים בתוך גרנולומות שחפת הריאה. הגישה יש ישימות רחבה כדי לכימות ריכוז סמים בתוך רקמות-פירוט מרחבית גבוהה.
Abstract
השחפת היא עדיין גורם התחלואה והתמותה ברחבי העולם. שיפורים משטרי סמים הקיים ופיתוח של הריפוי דרושים בדחיפות. היכולת של תרופות במינון טרה-בתים כדי להגיע, לעקר את החיידקים בתוך גרוע vascularized נמק מחוזות (caseum) גרנולומות ריאתי חיונית התערבות טיפולית מוצלחת. משטרי טיפולית יעילה ולכן חייב להכיל תרופות עם סגולות חדירה caseum חיובית. השיטות הקיימות LC/MS עבור לכימות רמות התרופה ברקמות ביולוגיות מוגבלת ליכולות הרזולוציה המרחבית, ולכן קשה לקבוע במדויק ריכוז סמים מוחלטת בתוך תאי רקמת קטן כמו אלה שנמצאו בתוך גרנולומות נמק. כאן אנו מציגים פרוטוקול המשלב לייזר לכידת microdissection (LCM) של רקמות באופן פתולוגי, נבדל אזורים עם ביופידבק כמת. טכניקה זו מספקת כימות מוחלטת של סמים בתוך caseum גרנולומה, סביב הנגע הסלולר ואת רקמת הריאה מעורב, לכן, באופן מדויק קובע אם ריכוזים אחרים להיות מושגת. בנוסף המחקר שחפת, הטכניקה יש יישומים פוטנציאליים רבים על כימות נפתרה במרחב של סמים לרקמות החולות.
Introduction
היכולת לזהות ולכמת רמות התרופה במרחב היא דרישה חיונית לקביעת אם תרופות נגד שחפת להגיע subpopulations חיידקי בתוך נגעים ריאתי-לחיטוי ריכוזים1. חשיבות מיוחדת הוא בקביעת סמים חדירה לתוך הליבה נמק של הנגע (שנקרא caseum), אשר בדרך כלל מכילה את המספר הגבוה ביותר של החיידקים, וייתכן שהוא לקוי נגיש לסמים עקב העדר vascularization.
שיטות מסורתיות כדי להעריך את הנגע חדירה, שכרוכים המגון הנגעים ריאתי נכרת ואחריו החילוץ הממס וניתוח ספקטרומטר מסה (LC/MS) כרומטוגרפיה נוזלית, הם מאוד רגישים, סלקטיבי עבור הסמים של ריבית. עם זאת, שיטות אלה מציעים מידע מרחבי המסכן, מוגבל לגודל של הרקמה homogenized המקורי. מסה ספקטרומטר הדמיה גישות, כגון לייזר בסיוע מטריקס desorption יינון (MALDI)2,3, desorption ספקטרומטריית electrospray יינון (דסי)4 או חילוץ שטח משופרת נוזל5, 6 מציעים יכולות הדמיה מאוד במרחב-נפתרה, אבל כימות ישיר יכול להיות מאתגר מאוד או בלתי אפשרי בשל היעילות חילוץ שונות של analyte מהתא שונים ואפקטים של דיכוי יון הטרוגניות או רקמות סוגי7. בנוסף, גישות הדמיה הישירה ביותר של רקמות MS הם מטבעם פחות רגישים יותר LC/MS עקב חוסר ההפרדה כרומטוגרפי של אנדוגני מינים מתחרים על יינון ואת היעילות החילוץ הממס נמוכה יותר של הסם מרקמות.
לייזר לכידת microdissection (LCM) בשילוב עם ניתוח LC/MS יש כבר מיושם באופן שגרתי כדי לבודד לאפיין אזורים רקמה נפרדות עבור פרוטיאומיה מבנית מחקרים8,9 , לאחרונה מנוצל על כימות סמים ב עצומות ברקמות בעלי חיים10. כאן אנו מציגים פרוטוקול ממוטבת החלת LCM בשילוב עם ניתוח LC/MS (LCM-LC/MS) לכמת תכשירים נגד שחפת בתוך תאים נפרדים גרנולומה. בתהליך microdissection לכידת לייזר, לייזר UV הוא מרוכז באמצעות המטרה מיקרוסקופ לתוך מקטע רקמות, אשר חותך ומבודד אזור הרקמה הרצויה על-ידי ביצוע נתיב המוגדר על-ידי המשתמש. עבור בסיוע הכובד LCM (בטכניקה השתמשו לצורך מחקר זה), סעיף הרקמה הוא רכוב לשקופית קרום דק פולימרי (PET או עט), הרקמה נלכד בתוך הצינורית אוסף מוצב מתחת לשקופית. הסמים מופקים מכל רקמת נכרת, לכמת באמצעות גישות LC/MS סטנדרטי. כמות רקמת נדרש להיות שנאספו נקבעת בסופו של דבר את ריכוז התרופה נוכח הרקמה הצפוי, הרגישות של שיטת ביופידבק. עבור רוב ניתוחים של סמים עצומות ברמות טיפולית וניתח באמצעות ספקטרומטר מסה פאול טריפל שגרתית, 3 מיליון מיקרומטר2 (3 מ מ2) של רקמת שטח מספיקה.
פרוטוקול זה מתאר שילוב רב עוצמה של פרופיל המרחבי, כימות מלא מוצעים על ידי אופנת LCM-LC/MS, מתן סמים מוחלטת ריכוזים בתוך התאים של גרנולומות טרה-בתים. ניתן להחיל את הטכניקה גם לקביעת ריכוזי התרופה ברקמות רבות חולה אחר מתן מידע חיוני סמים בגילוי ופיתוח.
Protocol
מחקרים שנעשו בבעלי חיים כל בוצעו על פי המדריך על טיפוח ועל שימוש של חיות מעבדה של מכוני הבריאות הלאומיים באישור בעלי חיים מוסדיים אכפת והוועדה שימוש של NIAID (NIH), בבתסדה, מרילנד
1. הניסויים ואוסף רקמות
סעיף זה של הפרוטוקול מתאר נהלים בעלי חיים וגבייה מדגם בתנאים אבטחה ברמה 3 (BSL3). הפרוטוקולים מפורט של שחפת Mycobacterium תרסיס זיהום הליך התרופות, המינהל היה הפרוטוקולים ארנבים שתוארה לעיל11,12.
- להדביק ארנבים ניו זילנד הלבן (זכר ונקבה -בת 4-5 חודשים) עם מ. שחפת HN878 באמצעות מערכת תרסיס האף בלבד, כפי שצוין בעבר תיאר11.
- לנהל את הסמים שבחרת (Ethambutol בדוגמה המובאת כאן) דרך המסלול המועדף, המתת חסד החיות של 2, 6 ו- 24 שעות לאחר ניהול. ראשית, עזים ומתנגד הארנב בזריקה תוך שרירית של קטמין 35 מ"ג/ק"ג, חריגות השירותים הווטרינריים-5 מ"ג/ק"ג. לחכות 10 דקות ואשר ההרדמה המתאים על-ידי צובט את הזנב ונגיעה בעדינות את העין. אם אין תגובה, המתת חסד על ידי עירוי לוריד של פנטוברביטל, פניטואין (ראה טבלה של חומרים) ב 1 מ"ל/4.5 ק"ג ב 2 מ ל תמיסת מלח סטרילית.
הערה: אלה timepoints אופטימלית לחפות את הפרופיל פרמוקוקינטיים Ethambutol, מחייבים התאמת/אופטימיזציה עבור תרופות מחקר אחרות. - באמצעות מלקחיים, מספריים, ו/או אזמל, להסיר את הריאות בחלל החזה, נכרות ביופסיות הריאה המכיל גדול גרנולומות נמק נעוץ סביב רקמת הריאה מעורב (כמתואר קודם לכן3). נמק גרנולומות מופיעות בז, צבע, בדרך כלל בולטות מעט מן הריאות שצבעו אדום/ורוד שמסביב. כדי להקל על cryosectioning קל, ודא ביופסיות יותר מ- 2 x 1.5 x 1.5 ס מ.
- באמצעות מלקחיים, מקם את הביופסיה על גבי מגש cryomold שכותרתו מראש עם משטח החיתוך הרצוי במגע ישיר עם הבסיס של המגש. לאחר הקפאה, פעולה זו תספק משטח שטוח שממנו יהיה לחתוך cryosections.
- להקפיא את הביופסיה ב אדי חנקן נוזלי. למלא את מיכל קלקר עד לעומק של 2 ס מ עם חנקן נוזלי ומניחים מתלה צינור מתכת. המתלה צריכים לבלוט מעל פני השטח של החנקן הנוזלי מתן משטח שטוח שעליו ממוקמים המגשים רקמות. מקם את המכסה על המכולה קלקר ולהשאיר רקמות ל-10 דקות להקפיא באופן מלא.
- להסיר את המגשים רקמות, במהירות לעטוף בסרט אלומיניום, למקם באופן אינדיבידואלי עם התווית שקיות פלסטיק לסגירה חוזרת וחותמת. להעביר ל-80 מעלות צלזיוס מקפיא לאחסון.
הערה: השלבים 1.1-1.6 מבוצעות בתנאים BSL3 (כולל כל העבודה בעלי חיים וטיפול של האיברים הנגועים). גמא שקסמה מקרין והביופסיות ריאות ב- 3 Megarads כדי לאפשר טיפול מחוץ BSL3 הבלימה. ניתן לבצע לייזר microdissection לכידת על רקמות הפטריה בתוך BLS3 המתקן אם תאושר פרוטוקול הבטיחות נמצאים במקום. עם זאת, השארית של פרוטוקול זה מתאר עיבוד במורד הזרם במתקן BSL-2.
2. רקמת חלוקתה
- הגדר את cryostat הטמפרטורה הרצויה חיתוך. להעביר את הביופסיה ריאות מוקרן-גמא-80 ° C אחסון cryostat ולהשאיר למשך 30 דקות equilibrate הטמפרטורה ברקמות. הערה:-20 ל-22 ° C הוא אופטימלי ביופסיות הנגע טרה-בתים.
- באמצעות פינצטה, לתקן את הביופסיה לצ'אק cryostat באמצעות כמות קטנה של דבק טמפרטורה אופטימלית חיתוך (אוקטובר) לדבוק הבסיס של רקמות הצ'אק. אוריינט הרקמה כך משטח שטוח (זה היה בקשר עם בסיס cryomold) הוא השטח החשוף לחיתוך. ודא ש-OCT לא לזהם את השטח רקמות, כמו זה עלולים להפריע הניתוח ספקטרומטר מסה עוקבות.
- חותכים לשלושה חלקים רקמות-עובי 25 מיקרומטר והר אל מחמד ממברנה שקופיות. בעדינות לגעת הקרום בסעיף רקמות והסר. אם מוחל מדי לחץ, קרום דק לגזרים.
- הימנע טיפול מופרז של השקופיות לפני הרכבה כפי התוצאה תהיה קרום חיית המחמד להיות טעון ועניים הידבקות של הסעיפים רקמות. ודא כי השקופית הממברנה נשמרת בטמפרטורת החדר, כדי לאפשר אדהזיה ההפשרה-הרכבה ומוצלח של הרקמה למוח.
- הסר את השקופית cryostat, מאפשרים מילה נהדרת. במשך 3 דקות. אם הפונקציה LCM-LC/MS/MS לא תתבצע באופן מיידי, חותם את השקופית בתיק קטן אטום sealable, העברת אחסון-80 ° C עד נדרש ניתוח.
- לגזור מקטע הסמוך ב 10-12 מיקרומטר, הפשרה-mount על משטח זכוכית רגילה עבור Hematoxylin ואאוזין (H & E) צביעת והפניה. סעיפים נוספים ניתן לחתוך בשלב זה עבור אחרים כתמים להסטולוגיה הרצוי (כגון צביעה-Niellsen להמחשת שחפת Mycobacterium (MTB)).
3. Microdissection
- להסיר את שקית אטומה המכילה את השקופית מ-80 מעלות צלזיוס אחסון ומאפשרים להגיע בטמפרטורת החדר למשך 5 דקות.
הערה: אם השקופית קר חשוף מיד לאווירה מעבדה, הרקמה להפוך מצופה עיבוי, עלולה לסכן את שלמות המרחבי של התרופה. - הפעל את המיקרוסקופ ואת לייזר (לייזר דורש 5-10 דקות להתחמם לפני חיתוך יכול להתחיל). לטעון mL 0.20 כובע שטוח המבחנות לתוך למחזיק.
- הסר שקופיות מתוך התיק ולקחת תמונה אופטי של סעיף הרקמה בשקופית מחמד באמצעות סורק משטח אופקי.
- מקם את השקופית לתוך מחזיק שקופיות (רקמות פונה כלפי מטה) והקצה אוסף נפרד צינורות לאזורים ספציפיים גרנולומה עניין שימוש בתוכנה מיקרוסקופ. בדרך כלל, אלה יהיו 'ריאות מעורב,' 'הסלולר גרנולומה,' ו- 'caseum' (נמק במרכז), אבל עשוי להשתנות בהתאם פתולוגיה ספציפית של גרנולומה/הביופסיה.
- מתמקדים הרקמה באמצעות 5 X מיקרוסקופ אובייקטיבי. ההגדלה זה צריך לספק תמונה כללית של הרקמה המכילה בשני התחומים גרנולומה הסלולר, נמק. התוכנה בחר את הצינור המיועד 'caseum' כדי להעבירו למצב תחת הרקמה.
- הזן את הפרמטרים הרצויים לנתיחה. הגדרות אופייניות עבור מקטע ריאות עבה מיקרומטר 25 הם עוצמת הלייזר 30, 15, ומהירות צמצם 35 (שרירותי יחידות). עם זאת, אלו ישתנו בהתאם המיקרוסקופ משמש ופוטנציאל פוחתת כוח בגלל גילו של הלייזר.
- בחרו בכלי 'חינם-draw' ו, באמצעות עט או עכבר או מסך מגע, המתאר את האזור הרצוי לצורך ניתוח. פני השטח של האזור יוצג בתוכנה. לשמור על אזורים שנבחרו תחת 500,000 מיקרומטר2 (0.5 מ מ2) כדי להקל על ניתוח קל יותר. חזור על הקרע עד 3 מיליון מיקרומטר2 (3 מ מ2) שנאסף בסך הכל הצינורית.
- לעיתים, באזור גזור עשוי להשאר תקועים למוח שמסביב (למשל עקב משיכה סטטית), אל תיפול לתוך הכיפה אוסף. להסיר אזורים אלה מצטברים שטח הפנים הכולל על-ידי בחירת והסרה ידנית בתוך התוכנה.
- בחר את הכובע על 'הנגע הסלולר' ולאסוף 3 מיליון מיקרומטר2 של רקמות שימוש באותו התהליך כמתואר בשלב 3.7.
- בחר את הכובע 'ריאות מעורב' ולאסוף 3 מיליון מיקרומטר2 של רקמות שימוש באותו התהליך כמתואר בשלב 3.7. שימו לב כי רקמת הריאה מעורב מכיל bronchioles רבים ורווחים מכתשי. שים לב כדי לא לכלול את אלה מאזורים רקמות שהוגדרו עבור ניתוח.
- בעל כיפה, בזהירות להיפרם, חותם, שלוף כל שפופרת. להגן על הרקמות גזור סביב אוויר הפרעות (למשל מאנטנת זרימת אוויר התפרצותם דלת הפתיחה). לנתח את רקמות גזור באופן מיידי, או לאחסן ב-80 מעלות צלזיוס, להפשיר לפני עיבוד וניתוח איכות המזון.
4. הפקת וניתוח איכות המזון
- הכנת מיצוי פתרון של acetonitrile 1:1 / Ethambutol d-10 תקן פנימי המכיל מתנול. בעת בחירת תקן פנימי, שימוש טופס שכותרתו יציב של התרופה analyte (כגון התווית על-ידי דאוטריום EMB המשמש ההדגמה) עם shift המוני מספיק כדי להימנע איזוטופ לחצות לדבר בין סמים analyte תקן (בדרך כלל מינימום של 4 daltons) .
הערה: יצירת תקנים ב- homogenate של כל אחד מסוגי רקמות בהתאמה קשה כי יש שליטה מוגבלת מאוד רקמות עם אשר כדי ליצור סטנדרטים homogenate. בתור חלופה להפיכת תקנים מתוך מדגם homogenate מחודדים, תקן יכולים להיווצר על-ידי הוספת רקמות ריק מבחן מתחם יחד, לחילוץ. נפח של רקמות שליטה homogenate שמתאים האחסון היעד מהסעיפים המחקר דגימת רקמה משולבת ישירות עם כמות של הבדיקה מתחם זה יהיה נוכח ריכוז נתון. - לחשב האחסון רקמות יישוב מבוסס על פני השטח ואת עובי של סעיף הרקמה ולקבוע את גורם הכרחי דילול homogenate שימוש באמצעי האחסון של homogenate אשר יתווספו תקן ו- QC דגימות. חישובים מומחשים מתחת לאזור היעד גזור2 (3 מ מ2) 3 מיליון מיקרומטר עם מיקרומטר עובי 25, 2 µL נפח של homogenate.
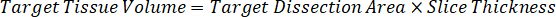
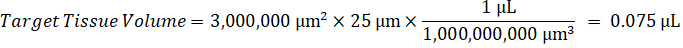
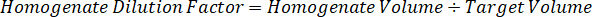

- בהנחה צפיפות רקמה של 1 g/mL, להכין את המניה homogenate על-ידי במשקל של 50 מ"ג של רקמות שליטה והוספת PBS מאגר לדלל (באמצעות הגורם דילול 26.67 homogenate שחושבו בצעד 4.2, diluent זה 1.283 מ"ל). Homogenize על ידי להכות רקמת הריאה ומאגר PBS במשך 5 דקות ב- 1750 סל"ד על מהמגן חרוז חרוז.
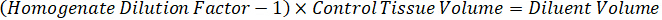
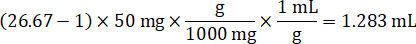
- למהול 1 מ"ג/מ"ל ריכוז התרופה מניות ב- 1:1 acetonitrile/מים כדי ליצור עיקול רגיל עולה פתרונות. לקבוע עולה ריכוז רגיל המבוסס על ספייק ונפח האחסון רקמת המטרה. הדוגמה מאויר מיועדת 100 ננוגרם למ"ל רגיל באמצעות אמצעי אחסון ספייק µL 10.
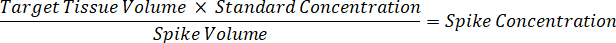
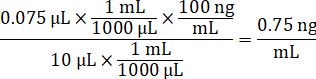
- להסיר את הצינורות המכילים הרקמות microdissected מ-80 מעלות צלזיוס אחסון ומאפשרים להגיע בטמפרטורת החדר למשך 5 דקות.
- להוסיף 10 µL של פתרון 1:1 acetonitrile/מים ו- 2 µL PBS מאגר הצינורות המכיל רקמות microdissected.
- עיקול רגיל וצינורות בקרת איכות, להוסיף 10 µL של עולה פתרון 2 µL של שליטה ריאות homogenate.
- להוסיף 50 µL של פתרון מיצוי כל שפופרת.
- מערבולת כל שפופרת למשך 5 דקות, sonicate במשך 5 דקות, צנטריפוגה-5000 סל ד למשך 5 דקות כדי ליצור גלולה של הסרט ורקמות בתוך כל שפופרת.
- להעביר 50 µL של תגובת שיקוע צלחת עמוקה 96-טוב-טוב, לדלל עם µL 50 נוספים מים יונים מכל קידוח.
- לבצע ניתוח LC/MS/MS באמצעות כלי אופטימיזציה פרמטרים עבור Ethambutol ו- Ethambutol-d10 תקן פנימי (כאמור שמתואר פרט12).
- השתמש גורם לדילול כדי לתקן את הסכום המדויק של רקמות גזור עבור כל דגימה.
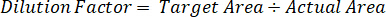
5. שיטת אימות
- ליצור homogenate של רקמת הריאה שליטה על-ידי שילוב ריאות חלק 1, PBS חלקים 2 ו- 3-4 חרוזים פלדה. לנצח את רקמת הריאה ומאגר PBS למשך 5 דקות ב- 1750 סל"ד באמצעות מהמגן חרוז.
- ספייק homogenate על-ידי הוספת 10 µL של 1 מ"ג/מ"ל Ethambutol דימתיל סולפוקסיד מניות לתוך 990 homogenate µL כדי ליצור ריכוז סופי של 10,000 ng/mL (10 mg/mL) ו מערבולת במשך דקה אחת.
- יצירת בלוק קפוא homogenate על-ידי לשפוך את homogenate לתוך cryomold במהירות קפוא בקרח יבש למשך 5 דקות.
- להכין 25 סעיפים עבה מיקרומטר מהגוש homogenate כמתואר בצעדים 2.1-2.5.
- לנתח אזור הרקמה היעד כמפורט בשלבים 3.2-3.10.
- להוסיף 10 µL 1:1 acetonitrile/מים ו- 2 µL PBS מאגר הצינורות המכיל רקמות microdissected.
- להוסיף 50 µL של פתרון מיצוי כל שפופרת. בצע שלבים 4.9-4.12 כדי ליצור עיקול רגיל ולקבוע את ריכוז התרופה בבלוק homogenate רקמות.
- לחשב יעילות חילוץ באמצעות הנוסחה שלהלן:
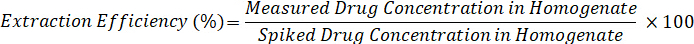
תוצאות
סקירה כללית של הגישה LCM-LC/MS מוצג באיור1. לאחר לחיטוי הרקמה על ידי גמא-הקרנה, כל השלבים הבאים (מתוך רקמת חלוקתה ואילך) מתקיימים מחוץ BSL3 תנאים. איור 2 מציג הנגע מקטעים ביופסיה לפני ואחרי רקמות בידוד על ידי אופנת LCM. אזורי נמק הסלולר של נגעים טרה-ב...
Discussion
נפתרה במרחב כימות של סמים בתוך נגעים שחפת הריאה נדרשת כדי לקבוע אם התרופה חשיפה מגיע ריכוזים לחיטוי על אוכלוסיות חיידקים השוכנים התאים הנגע שונים. השיטה LCM-LC/MS המתוארות כאן מאפשר כימות מוחלטת של תכשירים נגד שחפת בתוך הנגע התאים, כולל את caseum חיידקים-עשיר, שימוש רק 1-3 מקטעי רקמת בסך הכל. רקמה מ...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים פול אובריאן, מינה Marizel, איזבלה פרידמן לניסויים בבעלי חיים, Jacquie גונזלס, ויינר דניאל מ- NIH/NIAID לעזרה עם גמא הקרנה של רקמות ארנב לפני לייזר לכידת microdissection ו Jansy Sarathy עבור כתב יד מחשבות ועצות. עבודה זו נתמכה על ידי מימון הצעת החוק ולהעניק ומלינדה גייטס (OPP1174780) ומכשור NIH משותפים 1S10OD018072. אנו מודים Eliseo א Eugenin על מתן גישה המיקרוסקופ לייקה LMD 6500 ושיתוף מומחיות וייעוץ. הרכישה, ותמיכה מתמשכת של, 6500 LMD מומן על ידי מענק של לאומי המכון לבריאות הנפש, MH096625, המכון הלאומי של הפרעות נוירולוגיות, שבץ מוחי, NS105584, PHRI מימון (E.A.E) GSK תרומות (E.A.E).
Materials
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
References
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved