A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פורסטר זמן לפתור הומוגנית תהודה אנרגיה מבוססת על העברת Assay גילוי של הפרשת האינסולין
In This Article
Summary
כאן, אנו מציגים הומוגנית זמן נפתרה תדאג (HTRF) בתור שיטה יעילה לגילוי מהיר של אינסולין מופרש מתאי.
Abstract
הגילוי של הפרשת האינסולין הוא קריטי עבור שחקרתי מנגנוני הפרשת מוסדרים גם כמו מחקרים של חילוף החומרים. על פי מבחני אינסולין רבות קיימות כבר עשרות שנים, התפתחות הטכנולוגיה פורסטר תהודה אנרגיה העברה (HTRF) זמן לפתור הומוגנית האחרונות פישטה משמעותית מדידות אלה. זהו מהיר, חסכוני, הדירים חזקים אופטי assay על נוגדנים מצומדת כדי fluorophores בהיר עם פליטה לאורך זמן המאפשרת זמן לפתור פורסטר תהודה אנרגיה העברה. יתר על כן, גילוי האינסולין HTRF הוא לשכנוע הפיתוח של מבחני המיון תפוקה גבוהה. כאן אנו משתמשים HTRF כדי לזהות את הפרשת האינסולין בתאים הארצי-1E, קו תא אינסולינומה-derived חולדה. זה מאפשר לנו להעריך את רמות הבסיס של אינסולין בתגובה לגירוי הגלוקוז שלהם לשינויים. בנוסף, אנו משתמשים זו מערכת איתור של אינסולין כדי לאשר את התפקיד של דופמין כרגולטור שלילי של הפרשת האינסולין מגורה-גלוקוז (GSIS). באופן דומה, אחרים דופמין D2-כמו אגוניסטים לקולטן, quinpirole ו ברומוקריפטין, להפחית GSIS באופן תלוי-ריכוז. התוצאות שלנו להאיר את התועלת של התבנית HTRF assay אינסולין בקביעת את התפקיד של תרופות רבות GSIS ופרופילים תרופתי שלהם.
Introduction
ויסות חילוף החומרים האנרגיה יסודי על ידי הורמון אנאבולי הגדולות, אינסולין. אינסולין מסונתז והוא שוחרר על ידי בתאי בטא בלבלב כתגובה רמות גלוקוז מוגברת חוץ-תאית. האינסולין שפורסמו מפעיל את קליטת הגלוקוז על ידי רקמות הרגישים אינסולין1,2. מבחינה פיזיולוגית, זה מקושר את העלאת ריכוז הגלוקוז לאחר ארוחה, ואחריו הפרשת אינסולין כדי לווסת את ספיגת הגלוקוז. הפרעות גלוקוז הומאוסטזיס להוביל ליקויי מטבולית לשיאה תנגודת לאינסולין, ובסופו של דבר בתחילתה של סוג 2 סוכרת2,3,4.
למרות הפרשת האינסולין נחקרה בהרחבה, את מנגנוני הרגולציה נותרים ממעטים להבין. אזור קריטי של החקירה היה זיהוי של הרומן מאפננים הפרשת האינסולין על ידי בתאי בטא5,6,7,8. מחקרים אלו דורשות הבנה טובה יותר של הקשר צימוד בין גלוקוז גירוי הפרשת האינסולין. לכן, היכולת לפקח במדויק ולכמת את רמות הפרשת האינסולין מגורה-גלוקוז (GSIS) היה חיוני. עם זאת, עד כה, רק מספר מצומצם של שיטות היו זמינות לאפשר כימות של GSIS באמצעות הורמון האינסולין שורות תאים ו/או לנגרהנס. אחד הוא רדיו אימונולוגי (RIA), אשר מנצל אינסולין מתויג radioisotope, נוגדנים. המגבלות העיקריות של גישה זו כוללות בעיות בטיחות עקב טיפול לסילוק חומרים רדיואקטיביים. בנוסף, שיטה זו היא מהגידולים, מעורבים מרובים כביסה ארוך והשלבים הדגירה. מקושרים-אנזים immunosorbent assay (אליסה) הוא גישה יקר, עתירי עבודה אחרת אשר מנצל נוגדנים לגילוי אינסולין. וריאציה נוגדן הזיקות, היעילות של זיהוי אינסולין המגבילים את הגורמים של שיטה זו, והוא יכול להשפיע על הפארמצבטית את התוצאות. אליסה וגם ריאה תוכנן עבור ניסויים תפוקה גבוהה. AlphaScreen הוא assay הומוגנית המשמש עבור איתור של מדידת רמות של הפרשת האינסולין. AlphaScreen הטכנולוגיה מבוססת על ההמרה של תאורת הסביבה חמצן לתוך מצב גופיה חמצן נרגש זה יכול להגיב עם מינים chemiluminescent, וכתוצאה מכך הדור של chemiluminescence. מכיוון וזמינותו היא הומוגנית, רבים מן השלבים כביסה המשויך ריאה ואליסה נמחקות. אולם, חוסר היציבות של האות בשל אופיו של התגובה היא גורם מגביל שעשויים להשפיע על המדידה של וזמינותו. (TR-מלקחיים, שפותחה על ידי Heyduk ועמיתיו9, היא גישה הומוגנית נוספת למדידה אינסולין בהתבסס על הכריכה של שני נוגדנים נפרד epitopes שונים על מולקולת האינסולין. הנוגדנים הם כל הדנ א תקועים מבחינה כימית מקושר כפול עם קצר משלימים יחיד נטושים DNA המסוכך. איגוד של הנוגדנים לאינסולין מפגיש ביניהם ומוביל דופלקס DNA כפול נטושים. כל נוגדן קשורה גם fluorophore בהתאמה תורם או מקבל, איגוד דופלקס ה-DNA מפגיש את אלה fluorophores כדי ליצור העברת האנרגיה של תהודה פורסטר (סריג). מגבלה אפשרית אחת של TR-מלקחיים, עם זאת, מוטלת סריג עצמה. חוסר היכולת להפיג במהירות רקע זריחה במהלך התגובה סריג עשוי להוביל רמות גבוהות יחסית של קרינה פלואורסצנטית רקע אות חלש ליחס רעש בתוך וזמינותו. לכן, צריך עדיין קיימת עבור וזמינותו אמין, חזקה וחסכונית לכימות תנועת GSIS באופן תפוקה גבוהה.
התפתחויות אחרונות ביופיזיקה יש לשיאה התפתחות assay העברה (HTRF) המבוסס על תהודה זריחה זמן לפתור הומוגנית אנרגיה. באופן ספציפי, בזמן העברת האנרגיה בתוך וזמינותו ייתכן שתואר מבוסס סריג, ליתר דיוק, ש-HTRF מסתמך על הפריה חוץ גופית אנרגיה תהודה העברה (LRET)10 אשר ההעברה הלא-קרינה של אנרגיה בין התורם מקבל מינים11,12,13. ההבחנה זו חשובה, מאז העיתוי של פלורסצנטיות או להרוות מבוסס סריג אינטראקציה היא שונה בהרבה מאשר LRET, למרות אותם סוגים של gating יכול לשמש עבור סריג ו- LRET. יתר על כן, השימוש נדיר earth לנתניד cryptate תרכובות כגון אירופיום או טרביום cryptate ב HTRF מייצר קרינה פלואורסצנטית זמן מחצית החיים12,14. זה מציע את היתרון הייחודי של המבוא של השהיית זמן (µsec) בין התורם עירור מדידת פליטת מ מקבל (קרי, זמן לפתור assay). השהיית הזמן מאפשר זמן מספיק רקע זריחה להתפוגג לפני המדידה של מקבל פליטת קרינה פלואורסצנטית. כתוצאה מכך, המדידה היא ללא קרינה פלואורסצנטית שאינם ספציפיים, לפיכך, יחס אות לרעש גבוה מושגת (איור 1). יתר על כן, הטבע הומוגנית של HTRF מבטל את הצורך לכביסת צעדים לשטוף את המין לא מאוגד, ביצוע וזמינותו הרבה מהירה יותר מאשר אליסה או שיטות מבוססות-ריאה.
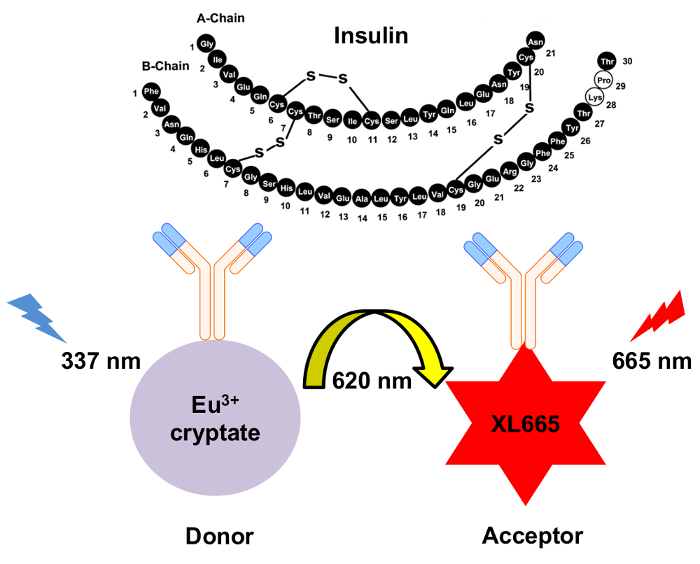
איור 1: סכימטי של המנגנון לגילוי אינסולין HTRF. שני נוגדנים חד-שבטיים באופן עצמאי שנוצר במיוחד מזהה, לאגד אינסולין באתרים נפרדים. נוגדנים אלה הם מצומדת התורם cryptate אירופיום או מקבל את XL665. עירור של התורם 337 תוצאות nm בפליטה-620 ננומטר. העברת אנרגיה וכתוצאה מכך גורמת XL665 לפלוט על אורך גל ארוך יותר, 665 ננומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
כאן, אנו מספקים פרוטוקול מפורט עבור משתמש בגישה מבוססת-HTRF כדי לקבוע את הרמות של GSIS מתאי הארצי-1E, ומבוססת הורמון האינסולין תאי בטא-derived עכברוש אינסולינומה תא קו15. בנוסף, וזמינותו הזה עשוי לשמש לזיהוי לפרופיל תרופתי של ווסתי מולקולרית של הפרשת האינסולין. אנו מיישמים את זה אינסולין מבוססי HTRF assay לבחון דופמין D2-כמו ויסות הקולטן GSIS. הגדלת מחקרים גילו כי הנוירוטרנסמיטר דופמין היא הרגולטור חשוב של GSIS8,16,17,18,19,20, 21 , 22. דופמין משפיע על GSIS בצורה autocrine/paracrine נגטיבית באמצעות פעולות על דופמין D2-כמו רצפטורים (D2, D3, קולטנים4 D) בא לידי ביטוי על פני השטח של תאי הלבלב בטא8 , 16 , 19. אנו שימוש assay זו, לאשר את תפקידו של הדופמין כרגולטור שלילי של GSIS, ידגים את השיטה דופמין D2-כמו ברומוקריפטין אגוניסטים לקולטן, quinpirole גם להפחית GSIS.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. INS-1E תאים: תחזוקה, ציפוי
- לשמור על תוספות-1E תאים של humidified 37 ˚C/5% CO2 מגשים, בתרבית בינונית RPMI 1640 בתוספת 5% (v/v) לא פעיל חום העובר שור סרום, 2 מ מגלוטמין, 10 מ מ HEPES, 1 מ מ נתרן פירובט, פניצילין U/mL 100/סטרפטומיצין... פתרון, 50 מיקרומטר β-mercaptoethanol. התרבות התאים במדיום RPMI 1640 להשלים 10 מ"ל (לכל צלחת), עד שיגיעו למפגש 80-90%, כאשר ניתן trypsinized, passaged או משמש וזמינותו הפרשת אינסולין.
- יום 1: תשאף מדיה ותרחץ תאים פעם אחת עם 5 מ של PBS ומחוממת מראש. להוסיף 0.5 מ של טריפסין (0.025%) מדולל 1:1 ב- 0.5 מ"ל PBS trypsinize את התאים ואת תקופת דגירה של 3-4 דקות ב 37 הלעפה תרוטרפמט. לבטל טריפסין על-ידי הוספת מדיה מלאה 9 מ ל העברת תאים שפופרת צנטרפוגה 15 מ"ל על-ידי pipetting.
- גלולה תאים על ידי צנטריפוגה, מחדש להשעות בגדר תא בתקשורת כ מ ל טריים.
- לקחת 10 µL של התאים מחדש על תנאי ומערבבים עם 10 µL Trypan Blue צבע חיוני לבדיקת הכדאיות של התא. לספור תאים מתים וחיים µL 10 של תערובת זו באמצעות hemocytometer. רמת הכדאיות צריכה להיות מעל 90%. לדלל את התאים מחדש על תנאי בתקשורת טרי 1 מיליון תאים לכל mL.
- זרע 0.5 mL הארצי-1E תאים לכל טוב בפולי-L-ליזין מצופים מראש צלחת 24-. ובכן, על צפיפות של תאים 500,000/טוב.
- יום 2: להסיר מדיה 18-24 שעות אחרי ציפוי ולהוסיף 500 µL טוב של מדיה RPMI 1640 טריים. דגירה את התאים עבור עוד 24 שעות לאפשר תאים להחלים לגמרי מהשלב passaging מוקדמת. הפעם נוספים מאפשרת את התאים לפזר בצלחת תרביות רקמה.
2. אינסולין הפרשת Assay (יום 3)
- הכנת מאגר KRB: 132.2 מ מ NaCl, 3.6 מ מ אשלגן כלורי, 5 מ מ NaHCO3, 0.5 מ מ- NaH-2PO-4, MgCl 0.5 מ מ2, 1.5 מ מ CaCl2ו- 0.001 g/mL אלבומין שור (BSA), pH 7.4.
- האחות מדיה מתאי ולשטוף פעמיים עם PBS ומחוממת מראש.
- השלב הרעבה גלוקוז, הוסיפו 450 µL/טוב KRB (המכיל BSA) ללא גלוקוז עבור 1 h-37 ˚C/5% CO2.
- במהלך השלב הרעבה גלוקוז, להכין דילולים טורי של drug(s) ב KRB המכיל 200 מ"מ גלוקוז (10 x ריכוז).
- להכין תרופות 10 x הריכוז הסופי של KRB בתוספת 200 מ"מ גלוקוז (גם 10 x ריכוז הגלוקוז הסופית assay). אם המניה סמים (בנוסף הוסיף 10 x גלוקוז) הוא דימתיל סולפוקסיד, ודא כי אחוז דימתיל סולפוקסיד נשמרת לאורך וזמינותו (אידיאלי הסופי אחוז של פחות מ- 0.1% דימתיל סולפוקסיד).
- עבור טיפולים דופמין quinpirole, להשתמש בטווח ריכוז סמים הסופית assay מיקרומטר 100 100 pM (מהגבוה הריכוז הנמוך ביותר), עם הנקודה האחרונה של התגובה מנה המכילה אין תרופה. ברומוקריפטין, לשימוש מגוון ריכוז הסופית assay 10 מיקרומטר עד השעה 22:00, עם הנקודה האחרונה של התגובה מנה להיות הפקד מסמים.
- לאחר הרעבה גלוקוז, להוסיף דילולים טורי סמים וזמינותו לייצר תגובה מינון.
- להוסיף µL 50/טוב של דילול טורי כל הבארות המתאים (assay סה כ נפח 500 µL).
- עבור השלב גירוי גלוקוז, תקופת דגירה תאים עם דילולים סדרתי התרופה המתאימה (בנוכחות גלוקוז 20 מ מ) של 90 דקות ב 37 ˚C/5% CO2- כולל קבוצת בקרה בארות: (1) גירוי עם לבד בהיעדר גלוקוז 20 מ מ של כל תרופה נוספת, תאים (2) הם גם גירוי עם סמים ולא גלוקוז (המספק קצב הבסיס של הפרשה).
- לאחר השלב גירוי, הסר בזהירות את supernatants (שימוש ישירות או בחנות הלעפה תרוטרפמט 4).
הערה: שלב צנטריפוגה עדין 5 דקות נוספות (x 600 גרם, 1 דקות) עשוי להיות מוצג בשלב זה כדי להסיר כל התאים הנותרים supernatants assay.
3. HTRF את הפרשת האינסולין מידה
- לדלל assay supernatants 1:10 KRB (ללא BSA), רצוי ב- 96-ובכן ברור צלחות.
- להכין את עקומת סטנדרטי של אינסולין וזמינותו אינסולין HTRF (טבלה 1).
| פתרון מניות 500 ננוגרם למ"ל | דילולים טורי | לעבוד [אינסולין] ng/ml |
| סטיית תקן 7 | 30 מניות µl + 140 µl KRB | 150 |
| סטיית תקן 6 | 30 µl STD 7 + 45 µl KRB | 60 |
| סטיית תקן 5 | 30 µl STD 6 + 45 µl KRB | 24 |
| מחלת מין 4 | 30 µl STD 5 + 45 µl KRB | 9.6 |
| STD 3 | 30 µl STD 4 + 45 µl KRB | 3.84 |
| סטיית תקן 2 | 30 µl STD 3 + 45 µl KRB | 1.54 |
| סטיית תקן 1 | 30 µl STD 2 + 45 µl KRB | 0.61 |
| סטיית תקן 0 | KRB 45 µl | 0 |
| הערה: STD שהמניה 500 ng/ml | ||
טבלה 1. דילולים טורי כדי להפוך את עקומת סטנדרטי של אינסולין.
- הוסף את הדגימות עיקול רגיל את supernatants assay מדולל לצלחת HTRF. המדד של אינסולין המופרש על-ידי HTRF יכול להתבצע ב 96-ובכן או תבנית צלחת 384-. טוב, במחשבה שיש האחסון assay יותאם מחדש. שימוש 10 µL/טוב דוגמה 96-ובכן לבן חצי-אזור צלחות או 5 µL טוב בצלחת מצומצמות, סיבוב המדרגה 384-ובכן לבן (ראה טבלה של חומרים).
- להכין נוגדן מיקס במאגר זיהוי (ראה טבלה של חומרים) בתורם 1:2 (cryptate) / יחס מקבל (XL-665).
הערה: עוד פרטים ספציפיים לגבי וזמינותו HTRF זמינים מהיצרן. - מוסיפים נוגדן מיקס וזמינותו 30 µL היטב (עבור תבנית 96 assay טוב-plate) או 15 µL היטב (עבור תבנית assay 384-ובכן צלחת).
- לאטום את הצלחת, דגירה בטמפרטורת החדר.
- לקרוא צלחת לאחר 2 h, 4 שעות, ו/או הדגירה לילה עם נוגדנים באמצעות צלחת הקורא את המודול המתאים אופטיים HTRF (337 665 620 ננומטר) (ראה טבלה של חומרים , הוראות היצרן). להגדיר את ההתחלה אינטגרציה 60 µs ויראה אינטגרציה בזמן 400 µs. שימוש 200 לכל טוב.
הערה: פרמטרים אלה התבססו על השימוש שלנו קורא מסוים. המדידה-620 ננומטר ולאחר 665 ננומטר עשויים להשתנות בין מכשירים שונים. זה אחד הסיבות שאנו ממליצים להשתמש היחס 665/620. לחישוב היחס הזה, כל ההבדלים הפוטנציאליים מקורא לקורא אפשרות לנרמל ומספקים ערכים עקביים ללא קשר הכלי המשמש למדידת HTRF.
4. נתוני ניתוח ונורמליזציה
- לחשב את ריכוזי אינסולין הבארות assay באמצעות אקסטרפולציה של רציומטרי קריאות קרינה פלואורסצנטית (665 ננומטר/620 ננומטר) לעקומה שניה סדר ריבועית פולינום (איור 2).

איור 2 : עיקול רגיל אינסולין. מלאי אינסולין אנושי של ריכוזים ידועים נעשה שימוש כדי ליצור את עקומת סטנדרטי של אינסולין. היחס HTRF וכתוצאה מכך (665 ננומטר / 620 ננומטר) שורטטו כנגד ריכוז האינסולין. הנתונים היה מיטבית לעקומה שניה סדר ריבועית פולינום (R2 = 0.99996). . זה עיקול רגיל נציג. קווי שגיאה = ב- SEM אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- עם נתונים משוערים כמו ng/mL של אינסולין מופרש, לנרמל (אינסולין מופרש בתגובה הגדלת ריכוזים ליגנד) לערך הממוצע של הבארות assay הפרשת אינסולין המרבי (20 מ מ גלוקוז לבד תנאי) %.
- להשתמש את התאמת עקומה (R2) מניסוי יחיד לחישוב וריאציית intraplate. במסגרת הניסוי, נגזר את הערכים הבודדים של2 R הכפילויות התוך ניסיוני, המאפשר חישוב השגיאה הסטנדרטית של הממוצע של העקומה מתאימה.
- לקביעת וריאציית interplate, להשתמש בנתונים לפחות שלושה ניסויים בודדים לחישוב שגיאת התקן של הממוצע עבור הערך2 R של העקומה קולקטיבית.
Access restricted. Please log in or start a trial to view this content.
תוצאות
אנחנו לאמת שלנו assay HTRF האינסולין על ידי יצירת מעגל אינסולין רגיל באמצעות אינסולין אנושי מטוהרים סטנדרטים של ריכוזים מוגדרים מראש (איור 2). הדור של העקומה רגיל מותר לנו להסיק שהקריאות זריחה רציומטרי ובכך לקבוע את רמות האינסולין המופרש כתגובה הטיפולים סמים ...
Access restricted. Please log in or start a trial to view this content.
Discussion
וזמינותו אינסולין HTRF המתוארים כאן מציע מערכת מהירה, יעילה כדי למדוד את הפרשת האינסולין ממערכת מבוססי תאים בתרבית. בין היתרונות החשובים ביותר שלה, זו assay מציע אות רקע נמוך בשל יחס אות לרעש גבוה. בנוסף, יש לנו אישר כי האות HTRF הוא יציב במשך פרקי זמן ארוכים (> 24 שעות ביממה)7. עם זאת, מא?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אנו מודים ניקולס פייר (Cisbio Bioassays) לקבלת עצות מועילות, ד ר פייר Maechler (אוניברסיטת ז'נבה) בנדיבות מתן תוספות-1E תאים. עבודה זו נתמכה על ידי מימון של משרד ההגנה (גרנט PR141292 כדי Z.F.), ואת John F. ננסי א Emmerling קרן של קרן פיטסבורג (ל Z.F.).
Acknowledgements
המחברים אין לחשוף.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
References
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684(2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432(2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved