Method Article
אפיון של Glycoproteins עם הקיפול בנוגדנים על ידי קריסטלוגרפיה באמצעות קרני רנטגן וטכניקות ביופיזיקלי
In This Article
Summary
אנו מציגים גישות עבור biophysical ומבניים אפיון glycoproteins עם הקיפול בנוגדנים אינטרפרומטריה biolayer, calorimetry איזותרמי טיטור ו קריסטלוגרפיה באמצעות קרני רנטגן.
Abstract
Glycoproteins על פני השטח של תאים לשחק תפקידים חיוניים תפקוד התאים, לרבות איתות, אדהזיה ותעבורה. על לויקוציטים, כמה glycoproteins האלה מחזיקים בנוגדנים (Ig) מתקפל, הן גורם מרכזי זיהוי מערכת החיסון ורגולציה. כאן, אנו מציגים פלטפורמה עבור עיצוב, ביטוי ואפיון ביופיזיקלי של התחום חוץ-תאי של תא B האנושי קולטן CD22. אנו מציעים כי הגישות הללו חלים בהרחבה אפיון גליקופרוטאין בתרבית של ectodomains המכילה Ig תחומים. שני ההשעיה כליה אנושית עובריים (HEK) שורות תאים, HEK293F, HEK293S, משמשים כדי לבטא glycoproteins יקולל glycans מורכבים ולא גבוהה-מנוז, בהתאמה. אלה glycoproteins רקומביננטי עם glycoforms שונים מאפשרים לחקור את ההשפעה של glycan גודל והרכב על איגוד ליגנד. נדון פרוטוקולים ללמוד קינטיקה של התרמודינמיקה של קשירה גליקופרוטאין ליגנדים ביולוגית רלוונטית ומועמדים נוגדן טיפולית. Glycoproteins רקומביננטי המיוצר בתאי HEK293S נתונות התגבשות glycan הומוגניות, גמישות מופחתת וכתוצאה רגישות לטיפול endoglycosidase H. אנו מציגים שיטות שישכיחו גליקופרוטאין קריסטלים עם כבדים אטומים ומולקולות קטנות עבור שלב קביעת וניתוח של ליגנד הכריכה בהתאמה. הפרוטוקולים ניסיוני דנו הנה תחזיקי את ההבטחה של אפיון glycoproteins בתרבית של לתת תובנות תפקידם ולחקור את מנגנון הפעולה של הרפוי.
Introduction
פני שטח חלבונים לשחק תפקידים חיוניים תפקוד התאים. דרך חזקותיה חוץ-תאית, חלבונים אלה קרום יכול לווסת תא-תא אינטראקציות, הדבקות, תחבורה, איתות1,2. לוקליזציה חוץ-תאי של חלבונים אלה גורם להם יעדים אטרקטיביים לפיתוח הרפוי לטיפול במגוון רחב של מחלות, כולל סרטן, מחלות אוטואימוניות3,4,5 , 6 , 7. אחד קפלי ממברנה האנושי חלבון ectodomains הנפוץ ביותר הוא הקיפול (Ig) דמוי נוגדן, אשר נוצרת על ידי שבעה או יותר β-גדילי המסודרות שני גליונות β8,9. לרוב, glycoproteins איג המכילים הן מרובות מבנים עם תחומים Ig מסודרים ברצף על החלק חוץ-תאי של חלבון ממברנה10. שינויים post-translational של חלבונים תא-פני אלה, במיוחד N-O-מקושרים גליקוזילציה, הוכחו ממלאים תפקידים חיוניים בתקנה שלהם, קיפול, הפרשת ו פונקציה11. כדי לשפר את ההבנה שלנו של הפונקציה שלהם וכדי הרפוי עיצוב טוב יותר שיכולות היעד אותם, נדרשות טכניקות המאפשרות אפיון מולקולרי מפורט שלהם. כאן, אנו מציגים שילוב של טכניקות לאפשר הביו-פיסיקלי (biolayer אינטרפרומטריה (בלי) ו calorimetry איזותרמי טיטור (ITC)) ואפיון מבנה (קריסטלוגרפיה באמצעות קרני רנטגן) של התחום חוץ-תאי של המכילות איג קרום glycoproteins, לבד, במתחם עם ליגנדים ביולוגית רלוונטית שלהם הטיפוליות מולקולות (איור 1).
גליקוזילציה מקושרים-N הוא אחד השינויים שלאחר התרגום הנפוץ ביותר על יונקים חלבונים, מתרחשת במהלך ההבשלה חלבון בתוך רשתית תוך-פלזמית גולג'י12,13. שורות תאים, כגון תאים כליה אנושית עובריים (HEK) 293, פותחו עבור הביטוי רקומביננטי של כמויות גדולות של glycosylated בתרבית של חלבונים14,15. שורת תאים זו פותחה בתבנית ההשעיה, אשר מאפשר כדי להקל על שינוי קנה מידה את ייצור החלבון כדי כמויות גדולות יותר בהשוואה שורות תאים חסיד. כאן, אנו מנצלים את שתי שורות תאים HEK293: HEK293F, HEK293 אנשים אני- / - (HEK293S), להיות שונה בגלל היעדר N-acetylglucosaminyl טרנספראז (אנשים אני) בחודש האחרון. בתורו, הייצור של glycans מורכבים (כמו ב HEK293F) אינה אפשרית, glycans מסוג מנוז במקום גבוה (בעיקר אדם5GlcNAc2) שוכנים ב N-מקושרים glycan אתרים18,19,20 . באמצעות קווים אלה שני תאים במקביל מאפשרת ללמוד את ההשפעה של glycan גודלו ומורכבותו על תפקוד ביולוגי והיעדים טיפולית. אכן, glycoproteins המיוצר בתאי HEK293F יהיה glycans גדול יותר, מורכבים יותר בהשוואה את אותו גליקופרוטאין המיוצר בתאים HEK293S. Glycoproteins מיוצר בתאים HEK293S הם יותר בעניין. התגבשות, בשל הטרוגניות הסתגלותי כימיכאלים מופחתת של שלהם glycans מקושרים-N. לשפר עוד יותר crystallizability, glycoproteins המיוצר בתאי HEK293S (אך לא HEK293F) יכולים להיות מטופלים עם endoglycosidase האנזים H (אנדו H), אשר התוצאות המחשוף של glycans מנוז גבוה כזה רק יחיד N-acetylglucosamine (GlcNAc) moiety נשאר כל21,אתר מקושרים-N גליקוזילציה22. שיטות אחרות יכול לשמש גם כדי להגביל את N-glycan עיבוד בתוך התאים, כגון התוספת של מעכבי glycosyltransferase במהלך הביטוי גליקופרוטאין, kifunensine23. גישות אלטרנטיביות לערב את הביטוי של glycoproteins מקורי (בתאים HEK293F) ואחריו deglycosylation אנזימטי באמצעות פפטיד F N-glycosidase (PNGaseF). עם זאת, deglycosylation עם PNGaseF הוכח להיות יעיל פחות תחת תנאים מקומיים, מגדילה מצבור בחלבונים מסוימים; במקרים כאשר החלבון נשאר מסיס לאחר הטיפול, שהוא רוכש מטענים שליליים על פני השטח שלו עקב deamidation של השאריות אספרגין כדי חומצה אספרטית24, אשר עשוי להיות מזיקות עבור להתגבשותו. אתרים N-גליקוזילציה החזוי יכול גם להיות מוטציה, לרוב כדי שאריות אלנין או גלוטמין, כדי למנוע מקושרים-N גליקוזילציה באתרים אלה וכדי ליצור גליקופרוטאין דגימות של הומוגניות גבוהה. לחלופין, glycoproteins יכול להיות מיוצר, בתרבויות אחרות התאים האיקריוטים כולל שמרים, חרק, מערכות מפעל או קווים בתרבית של תאים אחרים כגון אוגר סיני השחלות (CHO) תאים16,17.
וקטורים ביטוי יונקים רבים, כולל pHLsec, מאפשרים הפרשת ectodomains גליקופרוטאין רקומביננטי לתוך תא בינוני25. הפרשת glycoproteins מתאי HEK293 מאפשר טיהור מהירה וקלה ללא צורך פירוק התא. תוספת של טיהור תגיות (למשל, לו תג, תג דלקת, דגל-תג, תג Myc, HA-תג) כדי הסופית N או C של המטרה גליקופרוטאין מאפשר טיהור באמצעות כרומטוגרפיית צעד אחר צעד. לאחר מכן, ניתן להשתמש בגודל אי-הכללה של כרומטוגרפיה להניב מדגם monodisperse עבור אפיון biophysical ומבניים.
מדגם גליקופרוטאין וטהור מאוד הומוגנית תחת תנאים מתאימים עלולים לגרום גבישים diffracting היטב. לאחר dataset מלא עקיפה של קרני רנטגן התקבל מקריסטלים כזה, שלבים הראשונית צורך להיקבע לחישוב צפיפות אלקטרונים גליקופרוטאין. בזכות מספר גדל והולך של מבני נתונים הבנק חלבון (PDB), השיטה הנפוצה ביותר עבור בהדרגה הפך עד כה החלפת מולקולרית (MR), אשר משתמשת מבנה החלבון קשורים כדי לקבל שלבים הראשונית26. עם זאת, כאשר מר מצליח לפתור את בעיית הפאזה, לעתים כבר כתב הגנה רב-Ig תחום glycoproteins27,28,29, נדרשות שיטות אלטרנטיביות. במאמר זה, אנו מפרטים שיטה כדי להשרות קריסטלים עם אטומים כבדים (HA) בהדרגה, אשר נדרש עבור מבנה ectodomain CD2228. זיהוי הזכות HA עבור בהדרגה היא תהליך איטרטיבי התלוי תגובתיות HA, זמין האטומים גליקופרוטאין סריג הגביש נתון, התגבשות פתרון30,31. לחלופין, ניתן להשתמש אטומי גופרית טבעית שאריות ציסטאין ומתיונין עבור בהדרגה אם נוכח בבית יחס גבוה מספיק כדי אטומים אחרים גליקופרוטאין, ואם ניתן לאסוף נתונים קרני רנטגן עם יתירות מספיק גבוה32, 33.
תפקוד glycoproteins ממברנה ביולוגית לעיתים קרובות מתווך על ידי אינטראקציות חלבון-חלבון או אינטראקציות חלבון-ליגנד, כמו למשל עם פחמימות. כאשר ליגנד הוא קטן מספיק כדי לפזר מהפתרון לאתר איגוד גליקופרוטאין סריג הגביש, לספוג את הניסויים יכול להיות מוצלח כדי לקבל מבנה הגביש שיתוף גליקופרוטאין-ליגנד להבין טוב יותר את זיהוי ליגנד.
הפרוטוקולים המובאים כאן הם גם רלוונטי להבנת פעולת הגומלין בין משטח glycoproteins עם ליגנדים טיפולית סינתטי34,35 ו נוגדן הרפוי36,37. בשילוב עם מידע מבניים, איגוד קינטיקה ו תרמודינמיקה יכול להיות חזק כדי להבין ולשפר את מנגנון פעולה. טכניקה אחת המאפשרת לניתוח קינטי של נוגדנים טיפולית איגוד גליקופרוטאין הוא38,מתה על39. מתה על משתמש ביולוגיים עם ליגנד קיבוע כדי למדוד את קינטיקה דיסוציאציה וארגון עם שותף מחייב, קביעת בסופו של דבר קבוע דיסוציאציה של שיווי משקל (דK). מתה על היא גישה אטרקטיבית בגלל כמויות קטנות של glycoproteins נדרשים (< 100 µg), זמן הניסוי הוא מהיר (~ 10-15 דקות לכל הפעלה), ואת זה יכול להיות אוטומטי. ITC שימושי גם לימוד הזיקות בין glycoproteins לבין האיגוד שותפים40,41,42,43. בעוד ITC יותר זמן, ריאגנט אינטנסיבית, ניתן לקבל מידע רב ערך לגבי התרמודינמיקה של האינטראקציה (ΔG, ΔH, ΔS וסטויכיומטריה). המרכז לטניס בישראל הוא גם מאוד שימושי עבור לימוד אינטראקציות חלשות הקשורים לעתים קרובות עם הכריכה ארעית של פני השטח glycoproteins כדי ליגנדים. יתר על כן, שיטות אלה ניתן להשתמש בשיתוף כדי להעריך את הכריכה של מבנים שונים, להעריך את השפעת שונים מקושרים-N glycoforms המתקבל לבטא את גליקופרוטאין בשורות תאים שונים. מבצע מתה על המרכז לטניס בישראל עם glycoproteins מיוצר HEK293F, HEK293S ו שטופלו אנדו H יכול לספק מבט מעמיק על התפקיד של glycans פעילות ביולוגית, מעורבות טיפולית.
אנחנו הוחלו בהצלחה פרוטוקולים אלה כדי לאפיין את התחום חוץ-תאית (ECD) של האדם CD2228, חבר גליקופרוטאין של משפחת לקטינים (Siglecs) Ig כמו חומצה sialic מחייב כי הוא חיוני לשמירה על הומאוסטזיס B-cell44 . אנו לבצע עיצוב לבנות מעמיק כדי להקל על התגבשות, בהדרגה את ערכת הנתונים רנטגן מאת HA השריה עם כספית. אנו גם ספוג CD22 קריסטלים בחומצה sialic שלה ליגנד (α2-6 sialyllactose) כדי לקבל מבנה של המתחם קולטן המערכת החיסונית-ליגנד, ובכך סיפק את השרטוטים על עיצוב מונחה מבנה של glycan מימטיקה45,46. בנוסף, יצרנו הכריכה אנטיגן פרגמנט (Fab) של epratuzumab טיפולית נוגדן anti-CD22 - מועמד טיפולית כעת בשלב III בניסויים קליניים עבור לימפומה הודג'קין47- כדי לקבוע שלו זיקה מחייבת מאת רבנות בלי ו המרכז לטניס בישראל כדי באופן שונה glycosylated CD22 ECD בונה. מחקרים אלה חשף תפקיד קריטי עבור N-מקושרים גליקוזילציה ב epratuzumab אירוסין, עם השלכות פוטנציאליות להכרה CD22 על תאי B לא מתפקדת.
Protocol
1. לבנות עיצוב עבור גליקופרוטאין ECD
- להעריך את רצף חומצה אמינית האנושית CD22 (Uniprot) באמצעות שרתי ה InterPro ו- Phyre2 לזיהוי רכיבי מחשבים החזוי וגבולות ממוקם בתוך48,חלבון49.
- לשכפל את רצף CD22 האנושי, חסר את האות פפטיד, תחומים transmembrane ו- cytosolic (שאריות 20-687, להלן CD22 תחום חוץ-תאית, CD22 ECD) לתוך pHLsec ביטוי בתרבית של וקטור25 באמצעות אנזימי הגבלה AgeI ו- KpnI ( איור 2 A) 50.
הערה: וקטור pHLsec ממוטב על ביטוי של חלבונים מסיסים, המופרש תאים בתרבית של25. וקטור זה מכיל אות הפרשת כדי לאפשר הפרשת glycoproteins מסיסים חוץ-תאית. pHLsec מכיל תג6 x C-מסוף (שלו) כדי להקל על זיקה טיהור של תא supernatants בשיטות ביולוגיה מולקולרית קיבוע זיקה מתכת. - שיבוט קטום בונה CD22 ECD עם מחיקות רציפים של התחומים C-מסוף איג: תחומים 1-6 (שאריות 20-687), תחומים 1-5 (שאריות 20-592), תחומים 1-4 (שאריות 20-504), תחומים 1-3 (שאריות 20-330) (דמויות 2B ו- 2 C)50 .
- להעריך את רצף CD22 ECD באמצעות שרת NetNGlyc כדי לזהות אתרי גליקוזילציה מקושרים-N החזוי נוכח לבנות51העיקרי.
- באמצעות מוטגנזה, באמצעות פרוטוקולים סטנדרטיים52 או חופפים PCR53, מוטציה בכל אתר גליקוזילציה מקושרים-N החזוי (Asn כדי זאת שוב ו/או Asn ל Ala) כדי ליצור מבנים של CD22 ECD המכילים אחד או מספר מקושרים-N גליקוזילציה מוטציות.
- לאחר אימות רצף של מבנים משובטים, להפוך המוסמכת e. coli DH5α תאים54 ומקסי-הכנה ה-DNA (לפי הוראות היצרן) כדי להתכונן תרביות תאים.
2. HEK293F והקמת תא HEK293S
הערה: כל מניפולציה של תאים HEK293F או HEK293S עם ריאגנטים נחוץ ציוד חייב להתבצע בתוך מתקן רמה 2 אבטחה אבטחה מתאים לארון. המשטח החיצוני של כל הפריטים חייב להיות מעוקר עם 70% אתנול פתרון או ריאגנט שוות ערך.
- להשיג תאים הבולם HEK293F ו- HEK293S (ראה טבלה של חומרים) ולאחסן ב-80 מעלות צלזיוס עד מוכן לשימוש.
- חם המדיה (ראה טבלה של חומרים) עבור h 1 באמבט מים 37 º C. העברה מ 24 ל מדיה ומחוממת בקבוקון תרבות תא במבוכה 125 מ עם פקק של פרקו.
- לקבל 1 מ"ל תא aliquot מ-80 מעלות צלזיוס והעברת לקרח.
- דגירה תאים בתוך אמבט מים 37 מעלות צלזיוס במשך כ- 1 דקות, להפשיר חלקית את התאים. להעביר 1 מ"ל של תאים הבקבוקון הבקבוקון תרבות תא במבוכה של 125 מ ל המכיל את המדיה.
- סגור את תא תרבות את הבקבוק בפקק פרקו ואת המקום הבקבוק ב שייקר מוגדר כ- 37 מעלות צלזיוס, סל ד 130, 70% לחות, ו- 8% CO2.
3. HEK293 תא תחזוקה
הערה: צפיפות התאים, הכדאיות של תאים חייב להיות מסומן כ- 24 שעות לאחר מפשיר. שלב זה מבטיח כי תאים מחלים בעקבות חיסון; הקיום הראשוני צריך להיות > 80%.
- בזהירות להסיר הבקבוקון 125 מ ל המכילות את התאים ההשעיה טריים 10 µL של תאים, להעבירו microtube mL 1.5 סטרילי. לסגור את הבקבוק ולהחזיר את החממה.
- פיפטה 10 µL של פתרון Trypan blue לתוך microtube 1.5 mL המכילות את התאים, לערבב ביסודיות, להעביר 10 µL התא של השקופית ספירה.
- מכניסים את השקופית הספירה מונה אוטומטי תא הניתן ולקבל ערכים עבור תא צפיפות (ביחידות של תאים מ ל-1), תא הכדאיות (באחוזים).
- לחשב את עוצמת הקול של תאים יידרשו לחסן תרבות טריים 200 מ ל- צפיפות הסופי של ~0.8 x 106 תאים מ ל-1 באמצעות המשוואות הבאות:
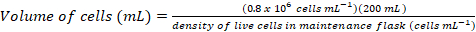 (1)
(1)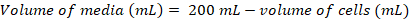 (2)
(2)
הערה: ייתכן שיחלפו ~ 5 d כדי להשיג צפיפות תא מתאים עבור חיסון לתוך תרבות 200 מ ל. - ברגע צפיפות תא מספיקה עבור חיסון של תרבות 200 מ ל, חימום מדיה עבור h 1 ב 37 ° C רשמים ו להעביר את המדיה ומחוממת אבטחה הקבינט.
- בזהירות באמצעות פיפטה סרולוגית, להעביר את אמצעי האחסון הדרושים של מדיה (כפי שמחושבת במשוואה 2) לתוך בקבוקון תרבות תא במבוכה 500 מ עם פקק של פרקו.
- באמצעות פיפטה סרולוגית, להעביר את הנפח הנדרש של תאים ההשעיה (המחושב משוואה 1) לתוך הבקבוק תרבות תא במבוכה 500 מ"ל המכיל את המדיה.
- שווי המניה החדשה של תחזוקה 200 מ ל ולהחזיר את החממה. מגדלים תאים צפיפות של 3 x 106 תאים מ ל-1. מעבר תאים על צפיפות של 0.8 x 106 תאים מ ל-1 כל 2-3 d כדי לשמור על תרבות יציב של תאים (כמתואר בסעיף 3.4-3.7). אל תאפשר את התאים תעלה על צפיפות של ~ 4 x 106 תאים מ ל-1.
4. תקנים של תאים HEK293 לביטוי גליקופרוטאין
- לחשב את עוצמת הקול של תאים ומדיה הנדרשת עבור תרבות 200 מ עבור תרביות תאים ב- 0.8 x 106 תאים מ ל-1 (באמצעות משוואות 1 ו- 2 של סעיף 3.4).
הערה: מספר transfections 200 מ ל שניתן לבצע תלוי צפיפות התאים של המניה תחזוקה. - להעביר את הנפח הנדרש של מדיה ותאים עבור תרביות תאים לתוך בקבוקון תרבות תא 500 mL החדש עם כובע פרקו וחוזרים המניה תא החממה.
- דגירה תאים עבור h 1 לפני תרביות תאים כדי לאפשר תאים להתאקלם בעקבות פיצול.
- העברת µg 50 מהדנ א לתוך צינור חרוטי סטרילי 50 מ ל ו לדלל 5 מ של מדיה. אבק לסנן מדולל הדנ א באמצעות מערכת סינון מיקרומטר 0.22 לתוך צינור סטרילי אחר.
- מיקס מדולל, מסוננים הדנ א על יחס 1:1 מסה: נפח עם ריאגנט תרביות תאים. בעדינות מערבולת הפתרון ריאגנט DNA: תקנים כדי לערבב דגירה הפתרון בטמפרטורת החדר במשך 10 דקות.
- הוספת ה-DNA: תקנים ריאגנט פתרון ישירות אל התאים. דגירה transfected תאים ב- 37 מעלות צלזיוס, סל ד 130, 70% לחות, ו- 8% CO2 ב שייקר עבור 5-7 d.
5. אופטימיזציה של תנאים תקנים תא
הערה: כדי למטב את התא תנאים תקנים עבור תשואה מקסימלית גליקופרוטאין, transfect תאים, במגוון צפיפויות תא ראשוני והערכת חלבון תשואה לאורך זמן (איור 3א). Transfect תאים כמתואר בסעיף 4, ב צפיפות התאים הראשונית החל מ 0.5 x 106 2 x 106 תאים-1 מ ל 55. Transfections משפט וניתן לשנותם הנפח הכולל 25 מ ל (ב- 125 מ ל תא במבוכה את הבקבוק תרבות) עם 6 µg של ה-DNA כדי לחסוך שטח, ריאגנטים. כמות ה-DNA ניתן גם אופטימיזציה55.
- תקנים שלאחר כל יום (ימים 1-7), העברה של aliquot 500 µL מתרבות תא אל microtube mL 1.5 סטרילי (בארון אבטחה).
- לסובב תאים aliquoted-g x 12,000 עבור 5 דקות ב- microcentrifuge מיד לאחר איסוף. להעביר את תגובת שיקוע microtube 1.5 mL החדש, חנות ב 4 ° C עד כל דוגמאות מתקבלים.
- Quantitate גליקופרוטאין המופרש על ידי densitometry
- לאחר כל דוגמאות מתקבלים, aliquot 20 µL של כל אחד לטעום לתוך microtube החדש 1.5 mL ומערבבים עם 6 µL-צמצום מאגר מדגם x Laemmli 4.
- מרתיחים הדוגמאות עבור 5 דקות ב 95 ° C בבלוק-תרמו. ספין הדוגמאות עבור 1 דקות ב- g x 12,000 ב microcentrifuge.
- לטעון µL 20 של כל מדגם לכל טוב ב- 10-ובכן 4-15% ג'ל מרחביות-דף הדרגתיים. כוללים ליין אחד עבור סמני גודל חלבונים. הפעל ג'ל-250 V עבור 20 דקות ב בופר טריס/גליצין/מרחביות.
- בעקבות סיום הריצה, להעביר ג'ל Coomassie כתם (ראה טבלה של חומרים) במשך 20 דקות מבטל את כתם ג'ל ב- ddH2O עבור 20 דקות תמונת ג'ל.
- לבצע densitometry עם ImageJ, בעקבות פרוטוקולים סטנדרטיים57,58.
- הידור, להתוות נתונים עם 'ימים שלאחר תקנים' בציר ה-x וערכי ' densitometry' על ציר-y (איור 3א).
הערה: לחלופין, אם ביטוי חלבון אינה מספיקה עבור ויזואליזציה מאת מרחביות-דף, טכניקות כגון סופג המערבי עשוי להיות בשימוש56.
- Quantitate גליקופרוטאין המופרש על ידי רבנות בלי
- שימוש ביולוגיים Ni-נ, quantitate את כמות גליקופרוטאין המופרש באמצעות מתה על59.
- הידור, להתוות נתונים עם 'ימים שלאחר תקנים' בציר ה-x ' חלבון ריכוז (µg/mL)' בציר ה-y (איור 3א).
6. טיהור של גליקופרוטאין מסיסים של תגובת שיקוע HEK293
- קציר תאים על ידי צנטריפוגה-g x 6,371 עבור 20 דקות ב 4 º C. שומרים על תגובת שיקוע המכיל המופרש CD22 ECD, סינון באמצעות מסנן 0.22 מיקרומטר.
- תגובת שיקוע-מינימום 4 מ ל-1 על equilibrated מראש לטעון עמודה Ni-נ (20 מ מ טריס pH 9.0, 150 מ מ NaCl, imidazole 5 מ מ) (5 מ"ל נפח) באמצעות מערכת כרומטוגרפיה benchtop.
הערה: טכניקות אחרות מבוססות-זיקה טיהור עשוי לשמש, בהתבסס על התגים אהדה לכלול במעצב מבנה בסעיף 1. - לאחר טעינת supernatant, לשטוף את עמודת זיקה עם 3-4 כרכים עמודה (CV) שטיפת מאגר (20 מ מ טריס pH 9.0, 150 מ מ NaCl, imidazole 5 מ מ).
- Elute גליקופרוטאין מטוהרים מן העמודה באמצעות הדרגה 4-100% (4 CVs) • תנאי מאגר (20 מ מ טריס pH 9.0, 150 מ מ NaCl, imidazole 500 מ מ) תוך איסוף השברים (איור 3ב).
- שברים בריכה המכילה הפסגה eluted ב התקן סינון צנטריפוגלי עם מגבלת משקל מולקולרי הנומינלי kDa (NMWL), תתרכז 10 על-ידי צריך שתוציאו ב g 4,000 x ב 4 מעלות צלזיוס למשך 15 דקות, או עד המדגם מגיע נפח של 500 µL.
- להזריק גליקופרוטאין מרוכז לתוך לולאה דגימה µL 500 עומס על מין 0.5 מ ל-1 על גבי טרום equilibrated (20 מ מ טריס, pH 9.0, 150 מ מ NaCl) ביצועים גבוהים גודל אי-הכללה של עמודה (כ נפח מ"ל 24)-כרומטוגרפיה נוזלית חלבון מהיר (FPLC) מערכת ב 4 ° C תוך איסוף השברים (איור 3ג').
- הפעל מרחביות-דף ג'ל שברים eluted לזיהוי שברים המכיל את גליקופרוטאין ולאחר בריכה שברים המתאימים. ניתן להפעיל את הג'ל מרחביות-דף כמתואר בסעיף 560.
7. Deglycosylation של גליקופרוטאין מטוהרים
- למדוד את הריכוז של חלבון מטוהרים בעקבות גודל אי-הכללה של כרומטוגרפיה, באמצעות ספיגת 280 ננומטר מחולק המקדם הכחדה (למשל, 1.418 ז-1 ס מ-1 עבור CD22 ECD).
הערה: המקדם הכחדה תיאורטי של חלבונים של עניין ניתן לחשב באמצעות שרתי כגון ExPASy ProtParam61. - דגירה חלבון מטוהרים עם אנדו H עבור h 1-37 מעלות צלזיוס, ביחס של 1 מ ג של חלבון מטוהרים כדי 10 µL של אנזים מסחרי במאגר H אנדו X 1 (לפי הוראות היצרן).
הערה: H אנדו cleaves glycans מנוז גבוהה המיוצר ב HEK293S יוצא moiety GlcNAc יחיד של כל אתר גליקוזילציה21. אנדו H לא קליב glycans על חלבוני המיוצר HEK293F תאים22, אולם אנזימים אחרים יכול לשמש למטרה זו (למשל,PNGaseF24). - להתרכז deglycosylated ECD כדי 500 µL ולהפעיל ג'ל כרומטוגרפיה סינון על עמודה אי-הכללה של גודל בעל ביצועים גבוהים (כ נפח מ"ל 24)-מין 0.5 מ ל-1 על FPLC להסיר אנדו H ולהפריד כל אגרגטים וכתוצאה מכך.
- לאחסן את החלבון deglycosylated ב 4 ° C עד שימוש בניסויים במורד הזרם.
8. התגבשות של Glycoproteins
הערה: לבצע ניסויים התגבשות באמצעות מסכי זמינים מסחרית ולהקים ישיבה הנפתחת ניסויים באמצעות רובוט התגבשות.
- רכז טהור, deglycosylated ECD כ 10 מ ג מ ל-1 שימוש בהתקן צנטריפוגלית סינון עם 10 kDa NMWL ב x 4,000 g (4 ° C) עד הריכוז הרצוי מתקבל.
- לקבוע ריכוז חלבון באמצעות ספיגת ב- 280 nm ו חלוקה המקדם הכחדה.
- צנטריפוגה לדוגמה ב- g x 12,000 עבור 5 דקות ב 4 ° C לפני התגבשות ניסויים כדי להסיר אבק לא רצויים או מזהמים אחרים מהדגימה.
- מילוי המאגר בארות של 96-ובכן ישיבה זרוק התגבשות צלחות עם 80 µL של התגבשות פתרון ממסך התגבשות מסחרי.
הערה: אנו משתמשים מטריצה דלילה מסחרי מסכי עוצבו בהתאם לתנאים התגבשות המוצלח ביותר ביחס למבנים שהופקדו ה-PDB. - באמצעות רובוט התגבשות, לוותר על טיפות לתוך הבאר של התגבשות צלחת עם נפח סה כ ירידה של 200 nL ביחס של חלבון מטוהרים: התגבשות פתרון 1:1.
- לאחר הצלחת כולה ויתרה, חותם לצלחת עם הקלטת ומקום לתוך imager צלחת לבדיקה על ידי אור אולטרה סגול וברורות.
- בדיקת לוחות התגבשות מיד לאחר ההתקנה, בשבועות הבאים, באמצעות האור לעין וגם אולטרה סגול לזיהוי תנאים שנותנים גליקופרוטאין הראשונית קריסטל להיטים.
- נוספים מיטוב גבישים המתקבלים להיטים התגבשות ראשונית באמצעות מסכי בסדר המבוסס על התנאי של הקריסטל פגע או מטריצה אקראית זורעות מיקרו שיטות62,63,64,65.
- הקפאה-להגן על כל גבישי חסר הקפאה-חדש מספיק בתוך התנאי התגבשות למסמס את הקריסטל אמא ליקר פתרון בתוספת 20% (v/v) גליצרול פתרון (או שווה ערך הקפאה-חדש, כגון אתילן גליקול או פוליאתילן גליקול 400).
- גבישים הר cryoloops ו- flash להקפיא אותם בחנקן נוזלי לפני איסוף נתונים של diffractometer מקור הביתה או באמצעות סינכרוטרון קרינה.
9. בהדרגה באמצעות אטום כבד Derivatization
הערה: לפני כל מניפולציה של תרכובות HA, היבטי בטיחות יש לקחת בחשבון. חה ותרכובות בשימוש חלבון קריסטלוגרפיה שנבחרו עבור שלהם זיקה חזקה מולקולות ביולוגיות, מהווים סיכון לבריאות האדם מחשיפה ממושכת. בצעדים בטיחות המתאים עבור תרכובות HA כאמור שלהם גליונות נתונים הבטיחות של החומר.
- לבדיקת תרכובות שונות של HA, ריכוזים ושעות דגירה, לשחזר היטב diffracting קריסטלים שהתקבל בסעיף 8 בצלחת 24-ובכן התגבשות באמצעות שיטת דיפוזיה66תלוי-שחרור קיטור.
- להחליט אילו HA יהיה המשמש קריסטל derivatization. שרתים (למשל, הכבד-האטום מערכת מסד נתונים67) יכול לסייע עם בחירת מתחם HA, הבטחת שהם מתאימים עבור התנאי חלבון וגיבוש.
הערה: HA המסכים הם גם זמינים מסחרית להקרנה קל של תרכובות HA היעיל ביותר עבור בהדרגה. קבוצה של תרכובות HA 'קסם שבע' תוארו קודם לכן יש סבירות גבוהה של הצלחה derivatization HA68. - להגדיר את תחנת העבודה עבור HA השריה (איור 4א). שימוש של cryoloop, להעביר במהירות גבישים 0.2 µL להפיל על תגית כיסוי 22 מ"מ המכיל HA הפתרון מדולל התגבשות מצב כזה כי הריכוז הסופי של HA נע בין 1-20 מ מ. לאטום את המסירה, תקופת דגירה של אורכים שונים של זמן (איור 4B). נקודת התחלה טובה היא 5, 10, 60, 90 min ולילה.
- בדוק חזותית קריסטלים עם מיקרוסקופ אור כדי לזהות סדקים אפשרי או שינויים בצבע, אשר יכולה להצביע על תופעות לוואי גליקופרוטאין קריסטל או קריסטל derivatization.
- הר גבישים cryoloops וקריסטלים הגב-להשרות ב-30 s בשלושה ברציפות µL 0.2 טיפות המכיל פתרון המשקאות של אמא, בתוספת 20% (v/v) גליצרול (או הקפאה חלופי-חדש)69. חזרה-השריית הקריסטלים מסיר HA מתחם זה הרומן הלא ספציפית ומפחית תפוסה חלקית נגרמת על-ידי איגוד HA חלש. פלאש קריסטלים הקפאה בחנקן נוזלי (איור 4B).
- איסוף נתונים, עיבוד, מבנה הפתרון של עידון, שימוש בפרוטוקולים שתואר לעיל26,70,71,72.
10. השריית גליקופרוטאין קריסטלים עם ליגנד שלה
- לשחזר היטב diffracting קריסטלים שהתקבל בסעיף 8 בצלחת 24-ובכן התגבשות בשיטת דיפוזיה ושחרור תלוי vapor.
- להכין פתרון מניות של ליגנד 50 מ מ, 20 מ מ טריס, pH 9.0, 150 מ מ NaCl.
הערה: ריכוז ליגנד כדאי להיערך בהתאם זיקה גליקופרוטאין שלה. אם בזיקה אינו ידוע, זה עשוי להידרש לשימוש בשיטה כגון ITC (סעיף 12.2) כדי לקבוע את הזיקה לפני תחילת לספוג את הניסויים. ודא ליגנד מסיסים-הריכוז הרצוי במאגר הדרושים. - להוסיף ריכוזים שונים של ליגנד הקריסטלים ECD המכיל טיפה ויסגור את המסירה עבור דגירה-אורכים זמן הנעים בין 5 דקות ל- 5 d.
- מבחינה ויזואלית לעקוב אחר קריסטלים עם מיקרוסקופ אור כדי לזהות שינויים אפשריים מורפולוגיה.
- הר גבישי cryoloops, הקפאה-להגן עליהם בפתרון אלכוהול אמא בתוספת 20% (v/v) גליצרול (או אחרים הקפאה-תרכובת כגון אתילן גליקול או משקל מולקולרי נמוך פוליאתילן גליקול 400)69.
- איסוף נתונים, עיבוד, מבנה הפתרון, עידון, שימוש פרוטוקולים שתואר לעיל73,74,75.
11. הייצור של אנטיגן פרגמנט מחייב (Fab)
- Subclone הגנים המתאימים ל Fab שרשרת כבדה (HC), שרשרת אור (LC) רצפים של נוגדנים אנטי-ECD, למשל,epratuzumab.
הערה: לחלופין, IgG יכולים להיות ביקע מאת האנזים פפאין ליצירת שברי Fab76. - Transfect תאים כמתואר בסעיף 4, עם השינויים הבאים:
- השתמש מסה הכולל של ה-DNA עבור תקנים של Fab שברי µg 90 לכל 200 מ של תרבות.
- Transfect פלסמידים HC ו- LC ביחס 2:1 כדי להקטין את היווצרות דיימר LC.
- לאחר d 7 של דגירה, לקצור תאי, שומרים על תגובת שיקוע, סינון עם מכשיר סינון מונחה ואקום 0.22 מיקרומטר.
- Equilibrate אנטי-LC (לקאפה או למדא) זיקה עמודות ב- PBS המאגר באמצעות מערכת כרומטוגרפיה benchtop.
הערה: אם LC דיימר היווצרות בעיה במהלך טיהור, חלבון G כרומטוגרפיית זיקה יכול לשמש כחלופה קאפה/למדא LC זיקה טיהור. - לטעון את תגובת שיקוע על זיקה עמודה בכל מין מ 4 ל-1. בעקבות טעינה הדגימה, לשטוף עמודה עם 3-4 CVs של PBS.
- Elute חלבון מעמודה באמצעות • על תנאי איזוקראטית עם 100 מ מ גליצין, pH 2.2, מיד נטרול שברים eluted עם 10% (v/v) 1 מ' טריס, pH 9.0 של כל שבר.
הערה: Fab eluted נוסף יטוהר כרומטוגרפיה חילוף יונים ו/או גודל אי-הכללה של כרומטוגרפיה באמצעות FPLC של 4 מעלות צלזיוס.
12. אפיון של מולקולה Fab וקטנים איגוד גליקופרוטאין
- אינטרפרומטריה Biolayer
- להכין 50 מ של 1 x קינטיקה מאגר (1 x PBS, 0.002% (v/v) Tween-20, 0.01% (w/v) BSA).
- מימה ביולוגיים Ni-נ 6 ב- µL 200 x 1 קינטיקה מאגר 10 דקות בצלחת הרטבה מראש.
- לדלל את מתויג ECD ב 1 מ"ל של מאגר קינטיקה 1 x-ריכוז סופי של 25 ng µL-1. פיפטה דילולים טורי של Fab מטוהרים לתוך µL 200 1 x מאגר קינטיקה, עם ריכוז גבוה של 500 ננומטר, דילולים טורי עוקבות של 250 ננומטר, 125 ננומטר ולאחר 62.5 ננומטר.
- ריאגנטים aliquot לתוך microplate 96-ובכן פוליפרופילן בתחתית שטוח שחור, כפי שמוצג באיור 5א, איפה כל טוב מכיל 200 µL של הפתרון המוצע.
- איסוף נתונים באמצעות את מבחני קינטיקה בתוכנה קירור והקפאה, כפי שתואר לעיל38,39,77 (איור 5א).
- בקצרה, להעביר את ביולוגיים לתוך בארות המכיל 1 x קינטיקה מאגר בסיסית עבור 60 s לפני טעינת 25 µL ng-1 של גליקופרוטאין עבור 240 s (או עד לסף מסוים של 1.0 ננומטר מתמלאת)-1000 סל ד.
- לאחר תוכנית בסיסית שניה של 60 s ב- 1 x מאגר קינטיקה, להעביר את ביולוגיים לתוך בארות המכיל את הדילול טורי של Fab. השלב האגודה s 180 לאחר מכן ואחריו s 180 דיסוציאציה שלב 1 x קינטיקה מאגר.
הערה: ביולוגיים חוזר אם הפרוטוקול הנ לאחר שלב התחדשות, אשר מורכב של שלושה מחזורי כביסה ביולוגיים, בנוכחות אחר מאגר (PBS עם 500 מ מ imidazole) עבור 5 s אחריו 5 s ב- 1 x קינטיקה מאגר על נטרול. ביולוגיים חוזר עד ~ 10-20 פעמים במהלך באותו היום, או עד נתונים המסכן איכות נצפית.
- לנתח את הנתונים באמצעות ניתוח תוכנה (איור 5א'):
- תחת לשונית 1, וייבוא נתונים בחר.
- תחת לשונית 2, שלב 1: בחירת הנתונים, בחר באפשרות 'בחירה חיישן' ווולס הפניה האר (שורות E ו- F, איור 5א), לחץ לחיצה ימנית והגדר הפניה היטב. תחת שלב 2: חיסור, בחר באפשרות 'הפניה וולס'. תחת ' שלב 3: ליישר ציר ה-y, בחר 'בסיסית' מתוך טווח הזמן של 0.1 ל 59.8 s. תחת שלב 4: שלב בין תיקון, בחר 'יישור לדיסוציאציה.' תחת שלב 5: תהליך, בחר 'Savitzky-Golay סינון' והקש נתוני התהליך.
- תחת לשונית 3, בחר 'האגודה ו דיסוציאציה' תחת שלב על נתח עם דגם 1:1. בחר 'התאמה הגלובלי' 'קבץ לפי צבע'. קליק ימני ' עקומות ', בחר 'לשנות צבע', בחר כל עקומות לצבע של בחירה שלך. בחר 'התאם ' עקומות' '. אם הנתונים הינם מצוידים היטב, ניתן לייצא דוח על-ידי בחירת 'שמור דוח'.
- חזור על הניסוי עם גליקופרוטאין המיוצר בתאי HEK293F ו- HEK293S (סעיף 5), בעקבות טיפול אנדו H (סעיף 7) כדי להעריך את ההשפעה, אם בכלל, של glycoforms שונים על זיהוי Fab. יתר על כן, חזור על הניסוי עם ECD truncations כדי לספק תובנות קבוצות מחשבים מחוייב Fab.
- טיטור איזותרמי calorimetry של Fab-גליקופרוטאין אינטראקציה
הערה: ITC הניסויים המתוארים כאן מבוצעות באמצעות מכשיר ITC אוטומטית. מתבצעים ניסויים 1 מ"ל סביב רחוב 96-ובכן התחתון.- Dialyze ECD של Fab בתוך 4 L בודד של 20 מ מ טריס, pH 8.0, 150 מ מ NaCl ב 4 מעלות צלזיוס למשך הלילה עם בר מערבבים.
- להתרכז דיאליזה ECD, Fab 5 מיקרומטר ו 50 מיקרומטר, בהתאמה, באמצעות מסנן צנטריפוגלי עם 10 kDa NMWL, הבטחת לשטוף את הקרומים רכז שלוש פעמים עם 5 מ של דיאליזה מאגר ב g x 4,000 עבור 5 דקות ב 4 ° C לפני השימוש.
הערה: כל התאמה במאגר בין דגימות תאים, מזרק יכול לגרום חום בלתי רצויה להשתחרר במהלך הניסוי ITC, תוצאת בנתוני איכות ירודה. - עבור ניסוי 1: הוספת µL 400 של ECD ל A1 ייטענו בתא, µL 120 של Fab ל A2 טוב שיש לטעון במזרק. ובכן A3 שנשאר ריק כדי להחזיר הבאות לדוגמה מעורב ניסוי השלמה. ניסוי הבאים ניתן להוסיף לצלחת באותו הסדר (קרי, ניסוי 2: תא - A4, מזרק - A5, ריק טוב - A6; איור 5 B).
הערה: כולל מאגר לתוך מאגר פקדים (כדי לאשר המכשיר מתנהג טוב)-ההתחלה ואת הסוף של כל ריצה, וכן ליגנד (במזרק) לתוך מאגר (בתא) פקדים כדי לחשב את החום של דילול עבור המדגם במזרק. זה מחושב החום של דילול צריך ואז להיות מופחתים נתונים גולמיים ניסיוני במהלך ניתוח נתונים (איור 5B). - הפעל את סכום כולל של 16 זריקות עם נפח של 2.5 μL עבור כל זריקה. משך ההזרקה הוא 5 s, עם 180 s המרווח בין זריקות. הגדר את טמפרטורת תא 25 ° C, עם מהירות מלהיב של 750 סל ד, תקופה מסנן של 5 s.
הערה: בהתבסס על זיקה התרמודינמיקה של אינטראקציה ECD:Fab, יתכן צורך לשנות את הריכוז לדוגמה, מספר זריקות או טמפרטורת התא. - לנתח את הנתונים עם התוכנה ניתוח, כפי שתואר לעיל40,41,43 (איור 5B).
- חזור על הניסוי לפחות למצב שבו כפילויות, חישוב ערכי KD ומרושע תקן שגיאות. חזור על הניסוי עם ECD של glycoforms שונים (סעיפים 5 ו- 6) כדי להעריך את ההשפעה, אם בכלל, של glycoforms על התרמודינמיקה של אינטראקציה Fab: גליקופרוטאין.
- עבור טיטור איזותרמי calorimetry של ליגנד-גליקופרוטאין אינטראקציות, להגדיר את הניסוי ITC כפי שמתואר בסעיף 12.2, עם השינויים הבאים:
- Dialyze ECD ב- 4 L מאגר דיאליזה למשך הלילה. התמוססות של ליגנד באמצעות מאגר דיאליזה לאחר השלמת תהליך של דיאליזה.
- ביצוע ניסויים ITC בריכוזים גבוהים באופן משמעותי כדי להיות מסוגל לזהות אינטראקציות נמוך-זיקה. עבור האינטראקציה ECD וליגנד, לבצע ניסויים ITC בריכוזים של 100 מיקרומטר של ECD תא ו 1 מ מ ליגנד במזרק.
תוצאות
בונה מספר CD22 ECD בהצלחה משובטים לתוך הווקטור ביטוי pHLsec, overexpressed בקווים בתרבית של HEK293F ו- HEK293S תא (איור 2 ו 3 א). כל המבנים היו מטוהרת על הומוגניות גודל על-ידי גודל אי-הכללה של כרומטוגרפיה, הניב דוגמית טהורה ביותר ללימודי התגבשות (איור 3B ו- 3 C). הבונה CD22 שהובילו קריסטלים היטב diffracting היה העיגול d1-d3 (שאריות 20-330), עם חמישה אתרי גליקוזילציה מקושרים-N החזוי שישה מוטציה של Asn ל Ala (N67A, N112A, N135A, N164A ו N231A), המיוצר בתאי HEK293S, כאלה שרק האתר גליקוזילציה במיקום N101 נשמר (מבנה זה נקרא CD2220-330, 5A). קריסטלים התקבלו אצל מספר תנאים של המסך מטריצה דלילה MCSG-1, אך הקריסטלים הכי טוב ממצב המכיל 30% (w/v) פוליאתילן גליקול 4000, 0.2 מ' ליתיום כלוריד ו 0.1 M טריס, pH 8.5. גבישים אלו יליד diffracted לרזולוציה Å 2.1; באמצעות מבנים ידועים של Ig תחומים של חלבונים הקשורים Siglec לא נכנע פתרונות מר בחיפושים.
לרכוש מידע בהדרגה, אנחנו ספוג קריסטלים מקורית עם פאנל של תרכובות HA שכלל Hg Pt, Os, ת א, Br בריכוזים הנע בין 1-20 מ מ הא מתחם למשך זמן דגירה מ- 5 דקות עד 1 ד (איור 4). אנחנו במעקב קריסטלים לשינויים במורפולוגיה, ומצא כי גבישים ספוגה HA תרכובת-20 מ מ הביא את הסדיקה מהירה, המסת של הגביש. . הקפאנו סך של גבישים 63 שמר את צורתם בעקבות הדגירה קבוע שלעתים היו ספוגים עם אשכול ברומיד טנטלום, כלוריד פלטינה, mercuric אצטט mercuric כלוריד הקריסטלים ספוגה 7 מ מ של כלוריד mercuric למשך 30 דקות הראה אות חריג על סריקת קרינה פלואורסצנטית ב מקור האור קנדי (CLS) 08-מוניטור הפרעות לקרן החלקיקים (קנדה), מותר עבור פיזור חריגה גל רב רנטגן איסוף נתונים על יחיד קריסטל. אלה נתונים (datasets) אפשרה לנו לפתור את המבנה התחתי כספית של CD2220-330, 5A, אשר חשף אטום כספית יחיד מאוגדים של ציסטאין חינם במיקום C308, בסופו של דבר מותר לנו לבנות את המבנה של CD225A 20-330, לתוך מדורג מפת צפיפות אלקטרונים באמצעות AutoBuild78.
ברגע המבנה unliganded נפתרה, היינו מעוניינים בפתרון המבנה של CD22 קשורה ליגנד שלה, α2-6 siallylactose. אנחנו לחשב קודם את זיקתו של CD22 לכיוון sialyllactose α2-6 באמצעות המרכז לטניס בישראל כדי לאפיין את התרמודינמיקה איגוד של האינטראקציה. נצפתה זיקה של מיקרומטר ~ 280 ואנו להשתמש במידע זה כדי לזהות של הריכוז ההתחלתי (~ 100 x KD) של ליגנד להשתמש שישכיחו הקריסטלים שלנו יליד CD2220-330, 5A . אנו ספוג CD2220-330, 5A הקריסטלים עם 25 מ מ siallylactose במשך 5 דקות, 2 h. 14 h, 40 h ו- 5 d, פיקוח לשינויים במורפולוגיה קריסטל. סך של ~ 75 גבישי קפוא מן נקודות זמן שונות ושלח למזהה CLS סינכרוטרון הפרעות לקרן החלקיקים 08-(קנדה) לאיסוף נתונים מרחוק. סכום כולל של 6 רנטגן datasets נאספו מקריסטלים היטב diffracting. המבנה של כל ערכת נתונים רנטגן נפתרה על-ידי מר באמצעות את unliganded CD2220-330, 5A מבנה כמודל החיפוש הראשוני. צפיפות אלקטרונים שנוצר עבור כל datasets היה אז בדק צפיפות חיובית במפת Fo-Fc התואמים כרוך α2-6 sialyllactose בתוך אתר איגוד של CD22. למרבה הפלא, כל datasets אסף, אפילו אלה מקריסטלים ספוג אחרי רק 5 דקות של זמן הדגירה, הכיל צפיפות חיובית המקביל ליגנד באתר האיגוד. מבנים הכולל של unliganded, liganded CD22 היו מאוד דומים בשינויים הסתגלותי מינימלי, אשר עשוי להסביר את ההצלחה של השריית ניסויים α2-6 sialyllactose.
אנחנו הבא מאופיין השטח antigenic של CD22 מוכר על ידי נוגדנים טיפולית epratuzumab בניסויים רבנות בלי ו- ITC (איור 5). פרופילים קינטיקה, תרמודינמיקה של קשירה ללונג epratuzumab CD22 בונה עם glycoforms שונים חשף זיקה הגוברת כדי CD22 עם גודל glycan N-מקושרים מופחתת, עם עד הטבה 14-fold אהדה עבור glycans קטנים יותר (327 nM לעומת 24 nM ברבנות בלי; 188 nM לעומת 58 nM, ITC). מקושרים-CD22 N glycan הגבלת הגישה של הנוגדן ל epitope שלה זוהה על ידי רבנות בלי באמצעות מוטציות נקודה אחת של CD22 על ידי פתרון epratuzumab Fab-CD22 d1-d3 קריסטל שיתוף מבנה28.
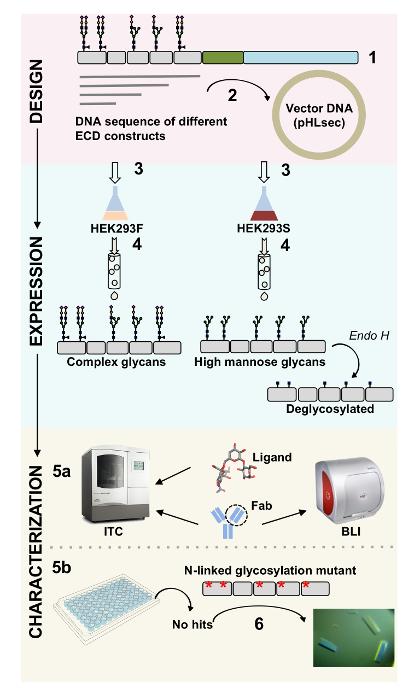
איור 1 . סקירה של אפיון גליקופרוטאין מעיצוב לבנות על אפיון biophysical ומבניים. (1) רצף הראשי ניתוח של נציג גליקופרוטאין. אפור, התחום חוץ-תאית (ECD); בירוק, הקטע (TM) transmembrane; בצבע כחול, תחום cytosolic של גליקופרוטאין. Glycans מקושרים-N החזוי מסומנות. שיבוט (2) של בונה ECD. (3) ביטוי ECD בונה בתאי יונקים. (4) גליקופרוטאין טיהור. בעוד חלבונים שבאה לידי ביטוי HEK293F יכיל glycans מורכבות, חלבונים שבאה לידי ביטוי HEK293S יהיה מנוז גבוהה glycans. טיפול אנזימטי של glycoproteins מיוצר בתאים HEK293S עם אנדו H תוצאות ב- glycoproteins עם רק GlcNAc moiety באתרים המקושרים N גליקוזילציה. Glycoproteins (5a) נבדקים לכריכה שלהם כדי נוגדנים על ידי אינטרפרומטריה biolayer (בלי) ו calorimetry איזותרמי טיטור (ITC). ניתן גם למדוד זיקה ליגנדים קטן ע י ITC. (5b) ניסויים התגבשות של glycoproteins עם הומוגניות מקושרים-N glycans, כגון אלה לידי ביטוי HEK293S ו- deglycosylated עם ה אנדו (6) במקרים מסוימים, מוטציה של אתרי גליקוזילציה מקושרים-N יש צורך להשיג קריסטלים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 . העיצוב של ectodomain CD22 DNA בונה עבור ביטוי בתאי יונקים. A) ייצוג פלסמיד pHLsec המשמש עבור תקנים ארעית של המבנים CD22 ECD. AgeI KpnI אתרים המשמשים שיבוט מסומנים עם התיבות האדומות. B) CD22 ECD מכיל Ig שבעה תחומים (d1-d7) ו- 12 אתרי גליקוזילציה מקושרים-N החזוי (בכחול). ארבעה מבנים תוכננו מן CD22 ECD. C) .1% ג'ל agarose מציג PCR amplicons של CD22 ECD בונה לקראת שיבוט לתוך הווקטור בתרבית של ביטוי pHLsec. ליין הראשון מכיל סמן הדנ א 1 kb. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
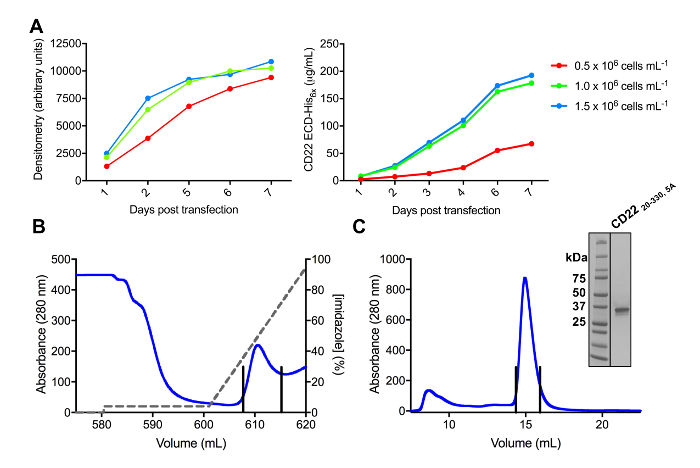
איור 3 . ביטוי וטיהור של glycoproteins. A) השפעת צפיפות התאים על הביטוי התשואות. גליקופרוטאין ביטוי בתרבות מ"ל 25 בקנה מידה קטן של תאים הבולם HEK293F transfected באמצעות שלושה צפיפויות שונות ההתחלתי של תאים (0.5 x 106 תאים מ ל-1, 1.0 x 106 תאים מ ל-1ו- 1.5 x 106 תאים מ ל -1). כימות לבצע densitometry מדף-מרחביות בחלונית השמאלית ועל ידי רבנות בלי כמותיים בחלונית הנכון. ערכים הם נציג של הכנה גליקופרוטאין אחד. B) Chromatogram של טיהור השלב הראשון לבנות CD2220-330, 5A מ 600 מ של תגובת שיקוע באמצעות עמודת זיקה Ni-נ. ת. גליקופרוטאין היה eluted באמצעות שיפוע של imidazole (קו אפור), שבו 100% תואם למאגר • תנאי, אשר מכיל 500 מ מ imidazole. שברים במאגר מתוארים עם קווים אנכיים. C) גודל-הדרה chromatogram בשביל לבנות CD2220-330, 5A באמצעות בעל ביצועים גבוהים ג'ל עמודה סינון. שברים במאגר מהשיא • תנאי מתוארים עם קווים אנכיים. שיבוץ: ג'ל שהוכתמו Coomassie מרחביות-דף מציג את טוהר גליקופרוטאין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 . קריסטל השריה עם אטומים כבדים. א) תחנת עבודה שישכיחו קריסטלים מקורית עם HA תרכובות הדגימה. כל הנדרשים כלים מסומנות. B) צעדים ולאחר מכן להשרות גבישים של לבנות CD2220-330, 5A עם תרכובות HA. שלב 1, פתח טוב המכיל גבישים וקריסטלים העברה באמצעות לולאה לירידה 0.2 µL על תגית כיסוי המכיל HA הפתרון מדולל התגבשות מצב כזה כי הריכוז הסופי של HA נע בין 1-10 מ מ. שלב 2, לאטום הירידה בצלחת התגבשות, דגירה קריסטלים עם HA מתחם לפרקי זמן שונים. שלב 3, לעלות את הקריסטל רטובה בתוך המעגל על הגב-להשרות ב-30 s ב- 3 ברציפות 0.2 µl טיפות המכילות את הפתרון אלכוהול אמא בתוספת 20% (v/v) גליצרול ויתרו על מכסה. בשלב 4, פלאש להקפיא את הקריסטל רכוב על לולאה עם חנקן נוזלי ולמקם אותו דיסקית למשלוח הפרעות לקרן סינכרוטרון החלקיקים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
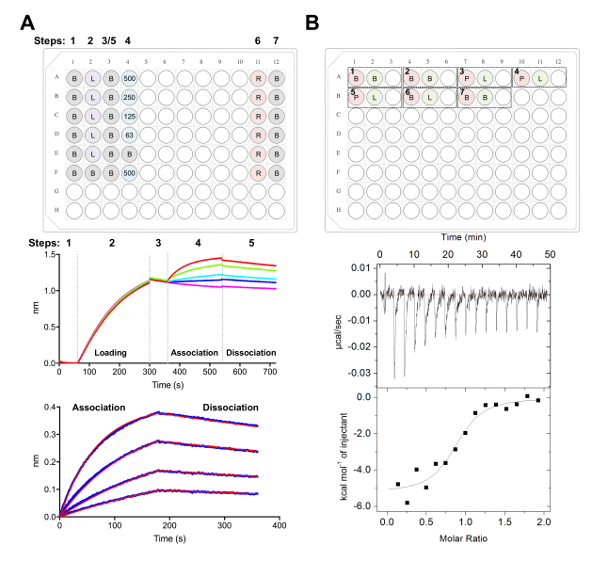
איור 5 . Biolayer אינטרפרומטריה ועל איזותרמי טיטור calorimetry מדידות. A) נציג מתה על הניסוי. הדף פאנל: דוגמה של הצלחת ההתקנה עבור ניסוי קינטיקה, איפה מסומנות הבאות: מאגר קינטיקה x 1 (ב), שלו6 x-גליקופרוטאין מתויג טעינה (L), נציג ריכוזים Fab (500 250, 125, 62.5 ננומטר), PBS + 500 מ מ התחדשות מאגר (R), ו- 1 x קינטיקה ניטרול מאגר (B). ובכן, כל אחד מכיל 200 µL של פתרון. צעד מספר עבור הניסוי קינטיקה מסומן בחלק העליון של הלוח. התיכון לוח: נציג נתונים גולמיים של רבנות בלי הניסוי המבוצעת באמצעות ביולוגיים Ni-נ ו את הצלחת תיאר בחלונית העליונה. שלב המספרים תואמים בסיסית (1), שלו גליקופרוטאין6 x טעינה (2), בסיסית (3), האגודה ב טורי דילול של Fab (4), דיסוציאציה (5). התחדשות השלבים אינם מיוצגים (שלבים 6-7). פאנל התחתונה: נציג מידע מנותח מציג raw וארגון דיסוציאציה (קו כחול) עם המתאים 1:1 מתאים (הקו האדום). B) הדף פאנל: נציג את הצלחת ההתקנה עבור ITC יחיד להפעיל מכשיר ITC אוטומטית עם שבעה ניסויים ב 96-ובכן סביב הבלוק התחתון. ניסוי מורכב משלוש בארות. הבאר הראשונה (אדום) מקבילה מדגם של התא (400 µL), הבאר השנייה (ירוק) מקבילה מדגם עבור המזרק (120 µL). השלישי טוב שנשאר ריק, הדגימות מעורב יוחזרו לזה גם בעקבות השלמת הניסוי. ניסויים 1, 2 ו- 7 הם מאגר לפקדי מאגר. ניסויים 3-5 מייצגים triplicate ניסויים עם גליקופרוטאין (P) בתא, Fab או ליגנד (L) במזרק. ניסוי 6 מייצגת חום ליגנד השליטה דילול, צריך להיות מופחתים ניסויים 3-5 במהלך ניתוח נתונים. פאנל התחתונה: נציג raw (למעלה) ונתונים ITC מעובד (למטה) מציג Fab (epratuzumab) מחייב את CD22 ECD מיוצר בתאים HEK293F. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
ממברנה-מעוגן glycoproteins קריטי לתפקוד התא והם אטרקטיביים מטרות טיפוליות. כאן, אנו מציגים את פרוטוקול עבור אפיון מבניים biophysical ECD של הממברנה glycoproteins, גם לבד וגם במתחם עם מולקולה קטנה ליגנדים, Fab שברים. אנחנו משתמשים בהצלחה פרוטוקול זה לקבוע את מבנה הגביש של שלושת תחומי Ig N-מסוף-רוב החלק חוץ-תאי של האדם CD2228, קולטן שותף קריטי בתאי B, מעורב בשמירה humoral חסינות הסימון79. יש גם מאופיין אתר איגוד של CD22 עם sialyllactose α2-6 שלה ליגנד טבעי, ואנו מוגדרת במצב של הכרה נוגדן טיפולית כלפי האדם CD22. תוצאות אלו לספק תובנות הגומלין מבנה פונקציה של חבר מפתח של משפחת Siglecs בעל מוגבלת ביטוי בתאי B, ואת מפת דרכים מולקולרי לקראת הפיתוח של מולקולה חדשה CD22 יישוב קטן, מבוסס על נוגדן הרפוי. בעוד פרוטוקול זה שימש בהצלחה קולטן תא B המכילות איג, אנו מציעים כי הגישה שלנו יכול להיות מיושם עבור biophysical מבניים אפיון כל גליקופרוטאין קרום עם ארגון תחומים ברורים. במקרים כאלה, לבנות עיצוב, glycan N-מקושרים קומבינטורית מוטציות (גם זאת שוב או Ala) ניתן להעריך למצוא מבנה מתאים הצמיחה קריסטל, עקיפה ברזולוציה גבוהה.
קבלת מדגם הומוגני וטהור גליקופרוטאין יש חשיבות קריטית קרני רנטגן וצמיחה של קריסטל, כמו גם עבור אפיון biophysical במורד הזרם. מקושרים-N glycans המצויים על glycoproteins הם מטבעם הטרוגנית, והוא יכול לגרום הטרוגניות הסתגלותי וכימיים בתוך גליקופרוטאין גורם התרעה מפני היווצרות הגביש. כדי לצמצם את זה המיקרו-הטרוגניות, אסטרטגיות להציג מוטציות נקודה כדי להסיר שאריות Asn חזו את הנמל glycans מקושרים-N, או באמצעות שורות תאים מוטציה (כגון HEK293S) ואחריו טיפול עם endoglycosidases (כגון EndoH) יכול במידה ניכרת לשפר את התגבשות הצלחה15,21,22. ב פרוטוקול זה, נדון הטיהור של glycoproteins מסיסים, פאבס המופרשים לתוך התא supernatant. הפרשת גליקופרוטאין מספק דרך פשוטה יחסית לכיוון טוהר, ללא הצורך פירוק התא או התוספת של כימיקלים קשים או בדטרגנטים. לאחר מכן להפעיל את התא supernatant, שהושג הבאים קציר תאים ישירות על עמודה בעלת זיקה חזקה החלבון עניין (למשל, Ni-נ שלו מתויג glycoproteins, או LC אהדה שברי Fab). עם זאת, בהתאם העמודה השימוש ואת התנאים של התא supernatant (למשל, pH), היכולת מחייב של החלבון לעניין העמודה עשויה להיות מושפעת. אם זה המצב, ייתכן צורך להתרכז, מאגר exchange התא supernatant כדי לשפר את איגוד לעמודה. יתר על כן, מומלץ מאוד כי צעדים בקרת איכות במהלך טיהור להיות מועסק כדי לסייע להעריך חלבון טוהר. פועל למען חברה דמוקרטית-דף ג'ל או תספיג של כל הדגימות (לפני, במהלך ואחרי טיהור צעדים) של יכולות להניב תובנות אם ערכת טיהור המוצע מתאים החלבון עניין. אם להקות מזהמים גלויים בדף-מרחביות, או אם מספר מינים מתקבלים במהלך טיהור (למשל, מספר פסגות על גודל הדרה), שלבי טיהור נוסף צריך להיחשב, למשל, יונים כרומטוגרפיה, כדי לזכות בטוהר, ולהגביר את סיכויי התגבשות במורד הזרם80.
על התגבשות macromolecular, לעתים קרובות קריטי להשגת תשואות גבוהות של החלבון עניין כדי לאפשר להקרנה של מספר רב של מצבים פוטנציאליים התגבשות בריכוזים חלבון גבוהה למצוא להיטים קריסטל מתאימים. באופן כללי, HEK293 תא הקווים שנדונו כאן (HEK293F ו- HEK293S) הן מערכות ביטוי חזקים, ניתן בקלות לשנות לייצר יותר מדגם לפי הצורך. עם זאת, ייתכן כי החלבון עניין עשוי לא לבטא מספיק בתוך שורות תאים אלה. במקרים אלה, שורות תאים אחרים, כגון תאים Expi29381,82, נמצאו כדי להציג רמות גבוהות של חלבון ביטוי ויש להתייחס כחלופה.
אם לא מסודר, diffracting קריסטלים בעקבות בדיקה של מספר מבנים של החלבון עניין למרות טוהר גבוהה, ייתכן צורך להרחיב התגבשות טכניקות כדי לקדם היווצרות הגביש. הוכח כי-Fab שברי נוגדנים, nanobodies יכול להיות משפרי התגבשות מעולה, לקדם את קריסטל ומסודרת אריזה83,84,85. קטעים אלה יכולים להיות הביע לטהר את ההומוגניות ו בשימוש מתחם עם החלבון עניין לקדם את התגבשות. חשוב, שברי Fab המיוצר כמתואר בסעיף 10 יכול להיות נטייה ליצור LC פונקציונלי הדימרים86. הדימרים הללו מזהמים, צריך להסירו במהלך טיהור. מניסיוננו, LC הדימרים לעיתים קרובות יש אמצעי אחסון שונים שמירה על גודל הדרה, או elute כמו לשיא ברורים על יונים כרומטוגרפיה, ובכך ניתן להסיר את טיהור Fab - אולם זה לא תמיד המקרה. אם שיטות אלה אינן מספיקות להסיר LC הדימרים הטיהור Fab, שיטות טיהור נוספים, כגון חלבון G זיקה טיהור, יכול להיות מועסק כדי לשפר את טוהר.
אלטרנטיבה co-complexation עם שברי Fab, טכניקות מתועדת היטב כגון microseeding מטריצה אקראית יכול לשפר את הסיכויים להשגת גבישי מסודר63,70. שיטה זו כרוכה התוספת של כמויות קטנות של גבישים כתוש, שיוצרת לתוך המצב התגבשות, מתן גביש nucleate כדי לקדם את הצמיחה קריסטל. זה יכול להתבצע באמצעות גבישים של החלבון מעניינים, או אלו עם מבנה שלישון ואדריכלות תחום דומה. יתר על כן, ניתן לבצע microseeding מטריצה אקראית בניסיונות להתגבש החלבון לבד, או במתחם עם מקטע Fab או מולקולה קטנה של עניין. התפתחויות אחרונות הקפאה-מיקרוסקופ גם לבצע טכניקה זו חלופה אטרקטיבית קריסטלוגרפיה באמצעות קרני רנטגן להשגת המידע המבני ברזולוציה גבוהה עבור מולקולות עם תכונות מתאימות87,88, 89,90,91.
כאשר בהדרגה של קרני רנטגן datasets נכשלת מאת MR HA השריית עשוי להיות נחוץ כדי לפתור את בעיית שלב על ידי פיזור חריגה או החלפת isomorphous. בדיקה של רצף חומצות אמיניות של החלבון יכול לספק רמזים על האסטרטגיה עבור derivatization HA, כולל ה-pH האופטימלי עבור איגוד. בפרט, cysteines אינטראקצית בתוך החלבון במיוחד באפשרותך לאגוד HA תרכובות המכילות כספית. השריית קריסטלים מקורית עם תרכובות HA היא תהליך איטרטיבי כדי לקבוע את זהותו של המתחם HA אופטימלית, הריכוז שלו, זמן הדגירה הנדרש. אם נסיונות השריית הראשונית לא תשואה היטב diffracting גבישים המכילים של HA מתאים בהדרגה, ייתכן שצריך להציג החלפות חומצת אמינו כדי לשפר את ההסתברות של איגוד HA ולשפר את אות חריג. דוגמאות מוטציות לכלול משקע ציסטאין חינם להיקשר ביעילות Hg, Au, Pt או חמאת בוטנים. ביטוי של חלבונים עבור דיממו חריגה בתקשורת seleno-מתיונין בתוספת ב e. coli משמש בהרחבה עבור חריגה בהדרגה, עם זאת מערכת מקבילה המשלבת באופן אמין seleno-מתיונין אינה זמינה עבור תאים בתרבית של הבולם92,93, הוא אזור ההתפתחות בעתיד.
ברגע המבנה unliganded של גליקופרוטאין עניין מתקבל, לספוג את הקריסטלים עם מולקולה קטנה ליגנדים ניתן לבצע כדי לקבל מבנה של המתחם קולטן המערכת החיסונית-ליגנד. נתונים אלה מספקים תוכנית העיצוב רציונלית של ליגנדים יותר ספציפיים, זיקה גבוהה יכול לשמש הרפוי מולקולה קטנה, כמו גם מספק תובנות ברזולוציה גבוהה תפקוד ביולוגי גליקופרוטאין. כאשר מנסים להשרות גליקופרוטאין קריסטלים עם מולקולה קטנה ליגנדים עניין, בדיקה של המבנה קריסטל unliganded יכול לציין אם השריית צריך להיות אפשרי. אם קרוב קריסטל-אריזה אנשי קשר נמצאים סביב האתר ליגנד מחייב או סביב אזורים צפוי לעבור שינויים הסתגלותי על ליגנד מחייב, השריית צפויה להיות בעייתי. במקרה זה, צריכה להתבצע בשיטות אחרות כגון שיתוף התגבשות של המתחם חלבון-ליגנד.
Disclosures
המחברים מצהירים אין אינטרסים מתחרים.
Acknowledgements
קרני רנטגן הניסויים המתוארים במאמר זה בוצעו באמצעות beamlines 08-ID ו- 08-מוניטור במקור אור קנדי, אשר נתמך על ידי קרן קנדה חדשנות, מדעי הטבע, הנדסה מחקר המועצה של קנדה, האוניברסיטה של ססקצ'ואן, הממשלה של ססקצ'ואן, גיוון כלכלי במערב קנדה, קנדה המועצה הלאומית למחקר של מכוני הקנדית לחקר בריאות. אנחנו רוצים להכיר את מבנה & מתקן הליבה Biophysical, בית חולים לילדים חולים, עבור גישה אל כלי הנגינה ITC, רבנות בלי. J.E.O. נתמך על ידי בנטינג פוסט-דוקטורט במלגת BPF-144483 מן המכון הקנדי של בריאות המחקר. ט. ס הוא הנמען של קנדה בוגר מלגת תואר פרס ואת וניהר קנדה במלגה ללימודי תואר שני מהמכון הקנדי של בריאות המחקר. עבודה זו נתמכה על ידי הפועלים מענק PJT-148811 (ג'-P.J.) מכונים הקנדי למחקר בריאות. מחקר זה נערך, בין השאר, הודות למימון התוכנית קנדה מחקר כיסאות (ג'יי-פי).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm Steritop filter | EMD Millipore | SCGPS02RE | |
| 10 well 4-15% gradient SDS-PAGE gel | Bio-Rad | 4561084 | |
| 10x glycobuffer 3 | New England Biolabs | P0702S | Comes with Endo H reagent |
| 10x Kinetics Buffer | PALL FortéBio | 18-1092 | |
| 10x Tris/Glycine/SDS Buffer | Bio-Rad | 1610732 | |
| 1 mL round bottom 96 well block | ThermoFisher | 260251 | |
| 22 mm cover slip | Hampton research | HR3-231 | |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 96-3 well INTELLIPLATE low volume reservior | Art Robbins Instruments | 102-0001-03 | |
| AgeI | New England Biolabs | R0552S | |
| ÄKTA Pure | GE Healthcare | ||
| ÄKTA Start | GE Healthcare | ||
| Amicon Ultra 15 centrifugal filtration device 10KDa MWCO | Millipore | UFC901008 | |
| Amicon Ultra 4 centrifugal filtration device 10KDa MWCO | Millipore | UFC801008 | |
| Auto-iTC200 | Malvern | ||
| Axygen MaxyClear Snaplock 1.5 mL microtubes | Fisher Scientific | MCT150C | |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| CryoLoop 18 x 0.05-0.1 mm | Hampton research | HR4-945 | |
| CryoLoop 18 x 0.1-0.2 mm | Hampton research | HR4-947 | |
| CryoLoop 18 x 0.2-0.3 mm | Hampton research | HR4-970 | |
| Digital Dry Bath | Bio-Rad | 1660562EDU | |
| E. coli DH5α | Invitrogen | 18258012 | |
| Endo H | New England Biolabs | P0702S | |
| Erlenmeyer flask (baffled base), polycarbonate, sterile, 500 mL, DuoCAP | TriForest Labware | FBC05000S | |
| Erlenmeyer flask 125 mL (baffled base), polycarbonate, sterile, 125 mL with vented cap | VWR | 89095-258 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 10 mL | Greiner Bio-One | 607180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 25 mL | Greiner Bio-One | 760180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 5 mL | Greiner Bio-One | 606180 | |
| Falcon Disposable sterile serological pipet, non-pyrogenic, 50 mL | Greiner Bio-One | 768180 | |
| FectoPRO DNA Transfection Reagent, Polyplus | VWR | 10118-842 | |
| Freestyle 293F cells | Thermo Fisher Scientific | R79007 | |
| Freestyle Expression medium | Thermo Fisher Scientific | 12338001 | |
| Heavy Atom Screens Au | Hampton research | HR2-444 | |
| Heavy Atom Screens Hg | Hampton research | HR2-446 | |
| Heavy Atom Screens M1 | Hampton research | HR2-448 | |
| Heavy Atom Screens M2 | Hampton research | HR2-450 | |
| Heavy Atom Screens Pt | Hampton research | HR2-442 | |
| HEK 293S | ATCC | ATCC CRL-3022 | |
| HisTrap Affinity Column | GE Healthcare | 17525501 | |
| HiTrap KappaSelect Affinity Columns | GE Healthcare | 17545811 | |
| HiTrap LambdaSelect Affinity Columns | GE Healthcare | 17548211 | |
| KpnI | New England Biolabs | R0142S | |
| MCSG-1 Crystal Screen 1.7 mL block | Anatrace | MCSG-1 | |
| MCSG-2 Crystal Screen 1.7 mL block | Anatrace | MCSG-2 | |
| MCSG-3 Crystal Screen 1.7 mL block | Anatrace | MCSG-3 | |
| MCSG-4 Crystal Screen 1.7 mL block | Anatrace | MCSG-4 | |
| Mercuric chloride | Sigma | 1044170100 | |
| Microplate, 96 well, polypropelene, flat bottom, black | Greiner Bio-One | 655209 | |
| Minstrel DT UV | Formulatrix | ||
| Multitron Pro shaker | Infors HT | MP25-TA-CO2HB | |
| Nanodrop 2000/2000c Spectrophotometer | Thermo Fisher Scientific | ND-2000 | |
| Nanosep 3K Omega centrifugal device | PALL Life Science | OD003C33 | |
| Ni-NTA biosensors | PALL FortéBio | 18-5102 | |
| Octet RED96 | PALL ForteBio | ||
| Oryx 4 crystallizaiton robot | Douglas Instrument | ORY-4/1 | |
| Platinum chloride | Sigma | 520632-1g | |
| Precision Plus Protein Standard | Bio-Rad | 161-0374 | |
| PureLink HiPure Plasmid Maxiprep Kit | Invitrogen | K210006 | |
| Quick Coomassie Stain | Protein Ark | GEN-QC-STAIN-1L | |
| Steriflip Sterile 50 mL Disposable Vacuum Filtration System 0.22 µm Millipore Express | EMD Millipore | SCGP00525 | |
| Superdex 200 Increase 10/300 GL | GE Healthcare | 28990944 | |
| Superose 6 10/300 GL | GE Healthcare | 17517201 | |
| Tantalum bromide cluster | Jena bioscience | PK-103 | |
| Top96 Crystallization Screen | Rigaku Reagents | 1009846 | |
| Tryphan Blue | Thermo Fisher Scientific | T10282 | |
| VDX 24-well with sealant | Hampton research | HR3-172 | |
| α2-6 sialyllactose | Sigma Aldrich | A8556-1mg |
References
- Sachs, J. N., Engelman, D. M. Introduction to the membrane protein reviews: The interplay of structure, dynamics, and environment in membrane protein function. Annu Rev Biochem. 75 (1), 707-712 (2006).
- Cournia, Z., et al. Membrane protein structure, function, and dynamics: A perspective from experiments and theory. J Membr Biol. 248 (4), 611-640 (2015).
- Macauley, M. S., et al. Antigenic liposomes displaying CD22 ligands induce antigen-specific B cell apoptosis. J Clin Invest. 123 (7), 3074-3083 (2013).
- Hyde, C. A. C., et al. Targeting extracellular domains D4 and D7 of vascular endothelial growth factor receptor 2 reveals allosteric receptor regulatory sites. Mol Cell Biol. 32 (19), 3802-3813 (2012).
- Tai, W., Mahato, R., Cheng, K. The role of HER2 in cancer therapy and targeted drug delivery. J Control Release. 146 (3), 264-275 (2010).
- Zarei, O., Benvenuti, S., Ustun-Alkan, F., Hamzeh-Mivehroud, M., Dastmalchi, S. Strategies of targeting the extracellular domain of RON tyrosine kinase receptor for cancer therapy and drug delivery. J Cancer Res Clin Oncol. 142 (12), 2429-2446 (2016).
- Rosman, Z., Shoenfeld, Y., Zandman-Goddard, G. Biologic therapy for autoimmune diseases: an update. BMC Med. 11 (1), 88(2013).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409 (6822), 860-921 (2001).
- Barclay, A. N. Membrane proteins with immunoglobulin-like domains - A master superfamily of interaction molecules. Semin Immunol. 15 (4), 215-223 (2003).
- Barclay, A. N. Ig-like domains: evolution from simple interaction molecules to sophisticated antigen recognition. Proc Natl Acad Sci. 96 (26), 14672-14674 (1999).
- Aebi, M. N-linked protein glycosylation in the ER. Biochim Biophys Acta - Mol Cell Res. 1833 (11), 2430-2437 (2013).
- Ohtsubo, K., Marth, J. D. Glycosylation in cellular mechanisms of health and disease. Cell. 126 (5), 855-867 (2006).
- Lodish, H., Berk, A., Zipursky, S., Al, E. Glycosylation in the ER and Golgi complex. Mol Cell Biol. (4), Section 17.7 (2000).
- Thomas, P., Smart, T. G. HEK293 cell line: A vehicle for the expression of recombinant proteins. J Pharmacol Toxicol Methods. 51 (3), 187-200 (2005).
- Lee, J. E., Fusco, M. L., Ollmann Saphire, E. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nat Protoc. 4 (4), 592-604 (2009).
- Betenbaugh, M. J., Tomiya, N., Narang, S., Hsu, J. T. A., Lee, Y. C. Biosynthesis of human-type N-glycans in heterologous systems. Curr Opin Struct Biol. 14 (5), 601-606 (2004).
- Yang, Z., et al. Engineered CHO cells for production of diverse, homogeneous glycoproteins. Nat Biotechnol. 33 (8), 842-844 (2015).
- Bláha, J., Kalousková, B., Skořepa, O., Pažický, S., Novák, P., Vaněk, O. High-level expression and purification of soluble form of human natural killer cell receptor NKR-P1 in HEK293S GnTI-cells. Protein Expr Purif. 140, 36-43 (2017).
- Bláha, J., Pachl, P., Novák, P., Vaněk, O. Expression and purification of soluble and stable ectodomain of natural killer cell receptor LLT1 through high-density transfection of suspension adapted HEK293S GnTI- cells. Protein Expr Purif. 109, 7-13 (2015).
- Chaudhary, S., Pak, J. E., Gruswitz, F., Sharma, V., Stroud, R. M. Overexpressing human membrane proteins in stably transfected and clonal human embryonic kidney 293S cells. Nat Protoc. 7 (3), 453-466 (2012).
- Chang, V. T., et al. Glycoprotein structural genomics: Solving the glycosylation problem. Structure. 15 (3), 267-273 (2007).
- Davis, S. J., Crispin, M. Solutions to the glycosylation problem for low- and high-throughput structural glycoproteomics. Funct Struct Proteomics Glycoproteins. , 127-158 (2011).
- Elbein, A. D., Tropea, J. E., Mitchell, M., Kaushal, G. P. Kifunensine, a potent inhibitor of the glycoprotein processing mannosidase I. J Biol Chem. 265 (26), 15599-15605 (1990).
- Zheng, K., Bantog, C., Bayer, R. The impact of glycosylation on monoclonal antibody conformation and stability. MAbs. 3 (6), 568-576 (2011).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta Crystallogr Sect D Biol Crystallogr. 62 (10), 1243-1250 (2006).
- Adams, P. D., et al. The Phenix software for automated determination of macromolecular structures. Methods. 55 (1), 94-106 (2011).
- May, A. P., Robinson, R. C., Vinson, M., Crocker, P. R., Jones, E. Y. Crystal structure of the N-terminal domain of sialoadhesin in complex with 3' sialyllactose at 1.85 Å resolution. Mol Cell. 1 (5), 719-728 (1998).
- Ereño-Orbea, J., et al. Molecular basis of human CD22 function and therapeutic targeting. Nat Commun. 8 (1), 764(2017).
- Yu, X. -L., et al. Crystal structure of HAb18G/CD147: implications for immunoglobulin superfamily homophilic adhesion. J Biol Chem. 283 (26), 18056-18065 (2008).
- Garman, E., Murray, J. W. Heavy-atom derivatization. Acta Crystallogr - Sect D Biol Crystallogr. 59 (11), 1903-1913 (2003).
- Agniswamy, J., Joyce, M. G., Hammer, C. H., Sun, P. D. Towards a rational approach for heavy-atom derivative screening in protein crystallography. Acta Crystallogr Sect D Biol Crystallogr. 64 (4), 354-367 (2008).
- Rose, J. P., Wang, B. C., Weiss, M. S. Native SAD is maturing. IUCrJ. 2 (20), 431-440 (2015).
- Olieric, V., et al. Data-collection strategy for challenging native SAD phasing. Acta Crystallogr Sect D Struct Biol. 72 (3), 421-429 (2016).
- Rillahan, C. D., et al. Disubstituted sialic acid ligands targeting Siglecs CD33 and CD22 associated with myeloid leukaemias and B cell lymphomas. Chem Sci. 5 (6), 2398-2406 (2014).
- Mesch, S., et al. From a library of MAG antagonists to nanomolar CD22 ligands. ChemMedChem. 7 (1), 134-143 (2012).
- Chiu, M. L., Gilliland, G. L. Engineering antibody therapeutics. Curr Opin Struct Biol. 38, 163-173 (2016).
- Elgundi, Z., Reslan, M., Cruz, E., Sifniotis, V., Kayser, V. The state-of-play and future of antibody therapeutics. Adv Drug Deliv Rev. 122 (2016), 2-19 (2017).
- Yang, D., Singh, A., Wu, H., Kroe-Barrett, R. Determination of high-affinity antibody-antigen binding kinetics using four biosensor platforms. J Vis Exp. (122), e55659(2017).
- Kamat, V., Rafique, A. Designing binding kinetic assay on the bio-layer interferometry (BLI) biosensor to characterize antibody-antigen interactions. Anal Biochem. 536, 16-31 (2017).
- Brautigam, C. A., Zhao, H., Vargas, C., Keller, S., Schuck, P. Integration and global analysis of isothermal titration calorimetry data for studying macromolecular interactions. Nat Protoc. 11 (5), 882-894 (2016).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J Vis Exp. (55), e2796(2011).
- Livingstone, J. R. Antibody characterization by isothermal titration calorimetry. Nature. 384 (6608), 491-492 (1996).
- Freyer, M. W., Lewis, E. A. Isothermal titration calorimetry: Experimental design, data analysis, and probing macromolecule/ligand binding and kinetic interactions. Methods Cell Biol. 84, 79-113 (2008).
- Macauley, M. S., Crocker, P. R., Paulson, J. C. Siglec-mediated regulation of immune cell function in disease. Nat Rev Immunol. 14 (10), 653-666 (2014).
- Zaccai, N. R., et al. Structure-guided design of sialic acid-based Siglec inhibitors and crystallographic analysis in complex with sialoadhesin. Structure. 11 (5), 557-567 (2003).
- Pantophlet, R., et al. Bacterially derived synthetic mimetics of mammalian oligomannose prime antibody responses that neutralize HIV infectivity. Nat Commun. 8 (1), 1601(2017).
- Leonard, J. P., et al. Epratuzumab, a humanized anti-CD22 antibody, in aggressive non-Hodgkin's lymphoma: phase I/II clinical trial results. Clin Cancer Res. 10 (16), 5327-5334 (2004).
- Finn, R. D., et al. InterPro in 2017-beyond protein family and domain annotations. Nucleic Acids Res. 45, 190-199 (2017).
- Kelley, L. A., Mezulis, S., Yates, C. M., Wass, M. N., Sternberg, M. J. E. The Phyre2 web portal for protein modeling, prediction and analysis. Nat Protoc. 10 (6), 845-858 (2015).
- Lessard, J. C. Molecular cloning. Methods Enzymol. 529, 85-98 (2013).
- Gupta, R., Jung, E., Brunak, S. NetNGlyc: Prediction of N-glycosylation sites in human proteins. , (2004).
- Liu, H., Naismith, J. H. An efficient one-step site-directed deletion, insertion, single and multiple-site plasmid mutagenesis protocol. BMC Biotechnol. 8, 91(2008).
- Heckman, K. L., Pease, L. R. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2 (4), 924-932 (2007).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253(2007).
- Akula, I., Julien, J. -P. Optimization of glycoprotein expression by transient transfection in HEK293 F/S suspension cells. , Available from: https://www.polyplus-transfection.com/wp-content/uploads/2015/09/FectoPRO-Technical-Note-031716.pdf (2015).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Mol Biotechnol. 55 (3), 217-226 (2013).
- Tan, H. Y., Ng, T. W. Accurate step wedge calibration for densitometry of electrophoresis gels. Opt Commun. 281 (10), 3013-3017 (2008).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: pitfalls of densitometry. Electrophoresis. 30 (11), 1845-1855 (2009).
- Jonnalgadda, K., Markley, L., Estes, S., Prajapati, S., Takkar, R., Kumaraswamy, S. Rapid, reliable quantitation of Fc-fusion protein in cell culture supernatants. , Available from: https://www.fortebio.com/documents/ForteBio_App_Note_13.pdf (2018).
- JoVE Science Education Database. Basic methods in cellular and molecular biology: Separating protein with SDS-PAGE. J Vis Exp. , (2018).
- Wilkins, M. R., et al. Protein identification and analysis tools in the ExPASy server. Methods Mol Biol. 112, 531-552 (1999).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. J Vis Exp. (78), e50548(2013).
- Obmolova, G., Malia, T. J., Teplyakov, A., Sweet, R., Gilliland, G. L. Promoting crystallization of antibody-antigen complexes via microseed matrix screening. Acta Crystallogr Sect D Biol Crystallogr. 66 (8), 927-933 (2010).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallogr Sect F, Struct Biol Commun. 70 (9), 1117-1126 (2014).
- Luft, J. R., et al. Efficient optimization of crystallization conditions by manipulation of drop volume ratio and temperature. Protein Sci. 16 (4), 715-722 (2007).
- Dessau, M. A., Modis, Y. Protein crystallization for X-ray crystallography. J Vis Exp. (47), e2285(2011).
- Sugahara, M., Asada, Y., Ayama, H., Ukawa, H., Taka, H., Kunishima, N. Heavy-atom Database System: A tool for the preparation of heavy-atom derivatives of protein crystals based on amino-acid sequence and crystallization conditions. Acta Crystallogr D Biol Crystallogr. 61 (9), 1302-1305 (2005).
- Boggon, T. J., Shapiro, L. Screening for phasing atoms in protein crystallography. Structure. 8 (7), 143-149 (2000).
- Vera, L., Stura, E. A. Strategies for protein cryocrystallography. Cryst Growth Des. 14 (2), 427-435 (2014).
- Pichlo, C., Montada, A. A., Schacherl, M., Baumann, U. Production, crystallization and structure determination of C. difficile PPEP-1 via microseeding and Zinc-SAD. J Vis Exp. (118), e55022(2016).
- Leslie, A. G. W., et al. Automation of the collection and processing of X-ray diffraction data - a generic approach. Acta Crystallogr Sect D Biol Crystallogr. 58 (11), 1924-1928 (2002).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallogr Sect D Struct Biol. 72 (3), 303-318 (2016).
- Cooper, D. R., Porebski, P. J., Chruszcz, M., Minor, W. X-ray crystallography: Assessment and validation of protein-small molecule complexes for drug discovery. Expert Opin Drug Discov. 6 (8), 771-782 (2011).
- Hassell, A. M., et al. Crystallization of protein-ligand complexes. Acta Crystallogr Sect D Biol Crystallogr. 63 (1), 72-79 (2006).
- Muller, I., et al. Guidelines for the successful generation of protein-ligand complex crystals. Acta Crystallogr Sect D Struct Biol. 73 (2), 79-92 (2017).
- Zhao, Y., et al. Two routes for production and purification of Fab fragments in biopharmaceutical discovery research: Papain digestion of mAb and transient expression in mammalian cells. Protein Expr Purif. 67 (2), 182-189 (2009).
- Shah, N. B., Duncan, T. M. Bio-layer interferometry for measuring kinetics of protein-protein interactions and allosteric ligand effects. J Vis Exp. (84), e51383(2014).
- Terwilliger, T. C., et al. Iterative model building, structure refinement and density modification with the PHENIX AutoBuild wizard. Acta Crystallogr Sect D Biol Crystallogr. 64 (1), 61-69 (2008).
- Walker, J. A., Smith, K. G. C. CD22: An inhibitory enigma. Immunology. 123 (3), 314-325 (2008).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Jain, N. K., et al. A high density CHO-S transient transfection system: Comparison of ExpiCHO and Expi293. Protein Expr Purif. 134, 38-46 (2017).
- Fang, X. T., Sehlin, D., Lannfelt, L., Syvänen, S., Hultqvist, G. Efficient and inexpensive transient expression of multispecific multivalent antibodies in Expi293 cells. Biol Proced Online. 19 (1), 11(2017).
- Löw, C., et al. Nanobody mediated crystallization of an archeal mechanosensitive channel. PLoS One. 8 (10), 77984(2013).
- Hunte, C., Michel, H. Crystallization of membrane proteins mediated by antibody fragments. Curr Opin Struct Biol. 12 (4), 503-508 (2002).
- Ereño-Orbea, J., Sicard, T., Cui, H., Carson, J., Hermans, P., Julien, J. -P. Structural basis of enhanced crystallizability induced by a molecular chaperone for antibody antigen-binding fragments. J Mol Biol. 430 (3), 322-336 (2018).
- Spooner, J., et al. Evaluation of strategies to control Fab light chain dimer during mammalian expression and purification: A universal one-step process for purification of correctly assembled Fab. Biotechnol Bioeng. 112 (7), 1472-1477 (2015).
- Elmlund, D., Le, S. N., Elmlund, H. High-resolution cryo-EM: The nuts and bolts. Curr Opin Struct Biol. 46, 1-6 (2017).
- Merk, A., et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell. 165 (7), 1698-1707 (2016).
- Bai, X. C., McMullan, G., Scheres, S. H. W. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wlodawer, A., Li, M., Dauter, Z. High-resolution cryo-EM maps and models: A crystallographer's perspective. Structure. 25 (10), 1589-1597 (2017).
- Bartesaghi, A., et al. 2.2 Å resolution cryo-EM structure of β-galactosidase in complex with a cell-permeant inhibitor. Science. 348 (6239), 1147-1151 (2015).
- Hendrickson, W. a, Horton, J. R., LeMaster, D. M. Selenomethionyl proteins produced for analysis by multiwavelength anomalous diffraction (MAD): A vehicle for direct determination of three-dimensional structure. EMBO J. 9 (5), 1665-1672 (1990).
- Walden, H. Selenium incorporation using recombinant techniques. Acta Crystallogr Sect D Biol Crystallogr. 66 (4), 352-357 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved