A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
באתרו מיקרוסקופיה לקביעת בזמן אמת של מורפולוגיה תא חד בBioprocesses
In This Article
Summary
צילום אופטי במכשיר מיקרוסקופ באתרו פותחה כדי לפקח על גודל של תאים בודדים ישירות בתא ההשעיה. מדידה בזמן אמת מתבצעת על ידי צימוד sterilizable הבדיקה צילום אופטי לניתוח תמונה אוטומטית. שינויים מורפולוגיים מופיעים בתלות במצב הגדילה ובתנאי הטיפוח.
Abstract
בניטור באתרו של חיידקים bioprocesses מוגבל בעיקר תכונות כימיות ופיזיות של המדיום (g., ערך ה-pH ואת ריכוז החמצן מומס). עם זאת, המבנה של התאים יכול להיות מחוון מתאים לתנאים אופטימליים, שכן הוא משתנה עם התלות במצב הגדילה, הצטברות המוצר ומתח התאים. יתרה מזאת, התפלגות הגודל בתא היחיד מספקת לא רק מידע על תנאי הטיפוח, אלא גם על הטרוגניות האוכלוסיה. כדי לקבל מידע כזה, צילום אופטי במכשיר מיקרוסקופ באתרו 1 פותחה כדי לאפשר את הניטור של התפלגות בגודל תא יחיד ישירות ההשעיה התא ב bioreactors. ניתוח תמונה אוטומטי משולב למיקרוסקופיה המבוססת על מודל רשת עצבי, אשר מאומן עם תמונות המשתמש מוערת. מספר פרמטרים, אשר השיגו מן לכידות של המיקרוסקופ, מתואמים את תהליך התכונות הרלוונטיות של התאים, כמו פעילות מטבולית שלהם. עד עכשיו, הציג את סדרת בדיקה מיקרוסקופית באתרו הוחל למדוד את גודל הגלולה בתוך שתלים פטריות filamentous. הוא שימש כדי להבדיל את הגודל תא יחיד בטיפוח מיקרואצות ולקשר אותו להצטברות השומנים. הצורה של חלקיקים סלולריים היה קשור הנצה בתרבויות שמרים. ניתוח מיקרוסקופ יכול להיות מפוצל בדרך כלל לתוך שלושה צעדים: (i) רכישת תמונה, (ii) זיהוי חלקיקים, ו (iii) ניתוח נתונים, בהתאמה. כל הצעדים צריך להיות מותאם לאורגניזם, ולכן מידע ספציפי מסומן נדרש על מנת להשיג תוצאות אמינות. היכולת לעקוב אחר שינויים במיורפולוגיה של התא ישירות בשורה או בשורה (באמצעות מעבר) מאפשרת ערכי זמן-אמת לניטור ולבקרה, בפיתוח תהליכים כמו גם בקנה מידה לייצור. אם נתוני הקו כבוי משפיעים על נתוני הזמן האמיתי, מדידות הקו המשוכבות הנוכחיות עם השפעות לא ידועות בגודל התא הופכות למיותר.
Introduction
תכונות מורפולוגיות של תאים קשורות בדרך כלל למצב הפיזיולוגי, חיבור בין הטופס לפונקציה קיים עבור יישומים רבים. המבנה של תא בודד מושפע ממצב הצמיחה, הגיל של התא, אוסמוטי ומדגיש תאים פוטנציאליים אחרים או הצטברות מוצר. שינויים מורפולוגיים של תאים הם לעתים קרובות מידה של חיוניות הצמיחה של התרבות. סינתזה המוצר התאיים, הצטברות ליפיד באצות היווצרות גוף הכללה בחיידקים, בין היתר, קשורים בגודל התא גם. הוצאת תא יכולה להיות גורם נוסף ששווה לחקור כפי שמסוכם לאחרונה2.
הטרוגניות של האוכלוסייה ניתן לכמת על בסיס תכונות מורפולוגיות של תאים בודדים. מחקרים הראו כי הטרוגניות בתוך תרבות עשויה להיות משמעותית, לדוגמה, תחת תנאי ייצור בקנה מידה גדול3 התשואה הכוללת עשויה להיות מושפעת ביצועים נמוכים של אוכלוסיות משנה4.
בדרך כלל, הערכה של תכונות מורפולוגיים של תאים מבוצעת על ידי דגימה ידנית או עם תא באמצעות מעבר זרם משולב למכשיר צילום אופטי. פעולה זו מובילה למספר הגבלות: הכמות המוגבלת של הנתונים הנרכשים בקושי יכולה לספק מדידות אמינות מבחינה סטטיסטית; עיכוב הזמן בין הדגימה לבין הנגישות של תוצאות עשוי להיות ארוך מדי בהשוואה לדינמיקה של התהליך; והחשוב ביותר, הליך הדגימה (מיקום יציאת הדגימה, טרום טיפול של המדגם לפני המדידה, תנאים שלילי בדגימה או לעקוף צינור) יכול לעורר שגיאה מוטה כמו ההליך לדוגמה עצמה יכול כבר להשפיע על התא ורפולוגיה. לבסוף, קיים תמיד סיכון גבוה לזיהום במהלך הדגימה או באמצעות העברת פתרונות, אם הם לא sterilizable במקום.
היישום של מיקרוסקופ באתרו (ISM) יכול לעקוף כמה מהבעיות הללו. אם התאים מזוהים באופן אוטומטי, ניתןלסקר אתהזיהוי הנכון של התכונות הורפולוגיות שלהם. עד היום, המגבלות העיקריות של שיטה זו היו (i) זמן ההערכה של תמונות, אשר היה ארוך מדי עבור יישומים באתרו , ו (ii) הרזולוציה הגרועה של תמונות, במיוחד בצפיפויות תאים גבוהים. למרות הפתרונות הראשונים של ISM כללו דגימה מכנית, דילול של המקדח, או היו מוגבלים על ידי-pass מערכת6,7, גישות נוספות לאפשר ללכוד את ההשעיה התא ישירות8.
ההתקדמות האחרונה ב-ISM מאפשרת את הקו או על ניטור קו של תאים על בסיס תא בודד, אשר מספק את ההתפלגות של פרמטרים מורפולוגיים בזמן אמת ישירות בתוך השעיות התא בריכוזים גבוהים במידה ניכרת של תאים. דרך ניתוח שורה של פרמטרי המפתח של התאים, היחסים עם מידע שסופקו על ידי זיהוי תא אוטומטי מצמידים ו ISM ניתן לזהות. לאחר מכן, מושגת עיצובים חדשים של חיישנים רכים, בהם פרמטר שאינו ניתן למדידה מוערך באמצעות מורפולוגיה של תא יחיד.
בדו ח זה, ISM מתנהל על ידי צימוד בדיקה צילום אופטי לניתוח תמונה אוטומטית. ISM מורכב בדיקה אחת מוט חיישן המאפשרת לכידת תמונות בתוך טווח המוקד הידוע בפער מדידה מתכווננת עם מצלמה CCD ברזולוציה גבוהה [MM-Ho = CCD GT2750 (2750x2200) ו MM 2.1 = CMOS G507c (2464x2056)]. תאורת ההבזק מתבצעת באמצעות שידור. לכן, מקורו של האור מהצד הנגדי של המצלמה9 ועוצמתו ניתן לכוונן. תאים עוברים ברציפות דרך פער זה עם הזרימה הנוזלית. לפיכך, מתקבלת אוכלוסיית דוגמה ייצוגית. הגשוש יכול להיות רכוב ישירות על ביוריאקטור כך שהוא מגיע לתוך ההשעיה התא, או שהוא יכול לשמש sterilizable by-לעבור. מעטפת חיישן מחובר למערכת לפני עיקור, חלקים אופטיים מחוברים לאחר מכן לתוך המעטפת.
, עד עכשיו מיקרואורגניזמים תעשייתיים רלוונטיים, למשל, פטריות filamentous (קוטר של עד מעל 200 μm), את הheterotrophic מיקרואצות קריפטיום cohnii (קוטר תא ממוצע של 20 μm), ואת סכביפיסים שמרים cerevisiae ס (קוטר התא הממוצע של 5 μm), נחקרו עם זה או התקנים דומים, אשר תיאר בקרוב.
פטריות filamentous נוטים ליצור כדורי בתנאי טיפוח מסוימים. אלה הם בגודל של עד כמה מאות μm. הלקורבן התאים הפטרייתיים מפתחים באורכים שונים את התלות בלחץ ההידרודינמי בשלב הנוזלים. זה יש השפעה על פעילות מטבולית וצמיחה, ספיגת המצע ושחרור המוצר. ISM הוחל על זיהוי התפלגות גודל הגלולה ואת רוחב האזורים של צפיפות ביומסה נמוכה בקצות כדורי (נתונים שלא פורסמו).
בגודל של C. cohnii משנה בין 15 ו 26 יקרומטר כאשר התאים לצבור חומצה שומן רב בלתי רווי docosahexaenoic חומצה (DHA) תחת הגבלת חנקן. תהליך הייצור הביוטכנולוגי הזה מורכב משני חלקים, שלב הצמיחה, שבו התאים להפריד ולהיות קטנים יותר, ואת שלב הייצור, שבו תאים לצבור את המוצר וכך להיות גדול יותר. לכן, גודל התא שימש כדי לקבוע את מצב התהליך, שבו הצמיחה או הייצור DHA היה חיובי. לבסוף, המתאם בין גודל התא לבין תוכן ה-DHA נמצא. במקרה זה, ISM מאפשר לפקח על הצטברות DHA תאיים בזמן אמת ללא דרישה של דגימה, שיבוש התא, ואת כרומטוגרפיה משותף ניתוח גז10.
שמרים הנצה הוא בדרך כלל בגודל בין 3 ו 8 μm. היחס בין התאים הנמצאים במצב של בגרות בכל פעם, כפי שמתואר באינדקס החיים (BI), מספק מידע על חיוניות הצמיחה11,12, ואפילו קשר עם הפרשת חלבון רקומביננטי הוכח13. עם העזרה של ISM, הנצה ושלא הנצה תאים שמרים (תאים עם ובלי ניצן) היו מכובדים14. תנאי הסטרס יכולים גם להוביל לווריאציה רחבה יותר של גודל התא בתוך אוכלוסיית שמרים, כפי שניתן לראות לאחרונה בזנים הגדלים, בהם התנאים של זנים מוגבלים בקנה מידה מוגבל של מזינים-הזנת אצווהשלושה.
לפיכך, לISM יש פוטנציאל לפקח על חיוניות הצמיחה ועל היווצרות המוצר ברמה של תא בודד במהלך כל שלבי הביורורות לזיהוי מצבי טיפוח אופטימליים, או למטרת שליטה בתהליך. השיטות המתוארות כאן מתמקדות ביישומים מיקרוביאלית עם תאים בודדים, אך חלים גם על חלקיקים גדולים יותר כמו תאים אנושיים ובעלי חיים, תא אגלוגית וכדוריות של אורגניזמים filamentous.
Protocol
הערה: השלבים הבאים נחוצים כדי להתאים את הפרמטרים לתנאי המיקרואורגניזם והתרבות המתאימים. ההתאמה של הגדרות בדיקה נמשך כ 20 דקות עבור משתמש מנוסה. תיאור מפורט של כלים ושלבים ניתן במדריך המכשיר המתאים של SOPAT GmbH. באופן כללי, יש צורך בכלים המוצגים בפרוטוקול הבא: (i) בדיקת בקר עבור כוונוני בדיקה ורכישת תמונה; (2) פיג'י (ImageJ) לביאורים בתמונות שנרכשו; (3) תמיכת Sopat ברשת עצבית מלאכותית (אן) הדרכה ויצירת תהליכי עבודה; (iv) Batcher עבור עיבוד אצווה נתונים באמצעות תמונות שנרכשו כבר עם זרימת עבודה; (v) תוצאות מנתח עבור הדמיית תוצאה והערכה על תמונות מעובדות אצווה; ו-(vi) לעקוב אחר מדידה אוטומטית בזמן אמת והדמיית תוצאה.
1. הגדרת פרמטרי חומרה
- הכינו תרבות עם ריכוז התא הגבוה ביותר שעשוי להיות מושגת במהלך הניסוי או הצנטריפוגה ולהשעות את הגלולה כדי להשיג ריכוז זה. במקרה זה, 65 g L-1 של ריכוז ביומסה יבש נבחר לזנים S. cerevisiae ס .
- הכינו מדלל שונים, הנעים בין הגבוה ביותר לריכוז הנמוך ביותר כך שהטווח הצפוי מכוסה במלואו. מומלץ לפחות 4 ריכוזים שונים.
- זהה את טווח גודל התא של מיקרואורגניזם עם מיקרוסקופ קונבנציונלי. הגדר את הקוטר המקסימלי הצפוי (dmax) של תאים בהתאמה. ערך זה מוגדר כ-8 יקרומטר במקרה של S. cerevisiae ס.
- לבחור שתי הפערים מדידה של 5x ו 10x שלמקסימום הצפוי של התאים.
- בחר את עוצמת הסטרובוסקופ המירבית. בחר בעוצמות סטרובוסקופ עבור שני הפערים עם ריכוז התאים הגבוה ביותר כך שהתאים עדיין גלויים על התמונות בעוצמת האור הנמוכה ביותר (התמונות הכהים ביותר).
- בחר את עוצמת הסטרובוסקופ המינימלית, ולאחר מכן בחר בעוצמות של כוונות סטרובוסקופ לשני הפערים, כך שהתאים עדיין גלויים בתמונות עם עוצמת האור הגבוהה ביותר (התמונות הבהירות ביותר). השתמש בריכוז התאים הנמוך ביותר, שסביר להניח שמופיע במהלך תקופת המדידה.
- בחר מיקום מיקוד אחד, אשר מניב את התמונות החדה ביותר עבור כל פער מדידה, עבור שניהם עוצמות כוונת ועבור טווח הריכוז שצריך להיבדק (ראה שלב 2 לפרטים על התמקדות). התמקד בתאים כראוי כדי שנתוני התמונה יוכלו להיות מבוארים לאחר מכן (ראה שלב 4).
- מדוד את סדרת הדילול הקודמת של ריכוז התא (ראה שלב 2) עם רוחב הפער ועוצמות הסטרובוסקופ.
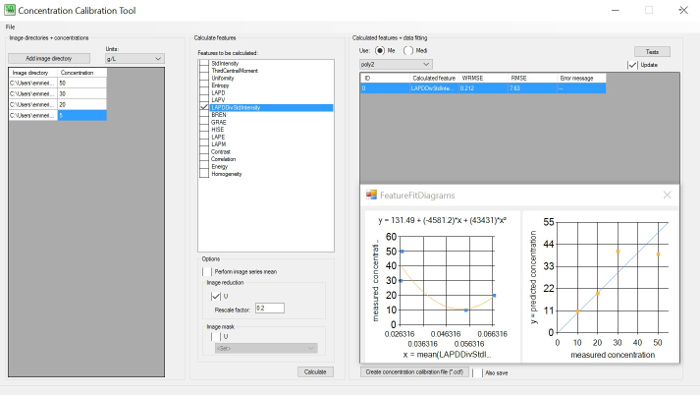
איור 1: כלי כיול הריכוז. GUI שמאל: להגדיר ספריות תמונה (לפחות 3) עם ריכוזים ידועים; GUI מרכזית: בחר תכונות שיחושבו בספריית התמונות; GUI נכונה: לבחור את השורש משוקלל ממוצע שגיאה מרובעת (WRMSE) כדי לזהות את המינימום. WRMSE ואת המתאם הטוב ביותר בין כל תכונה תמונה לבין ריכוז התא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הערכת את ניסוי סדרת הדילול.
- השתמש בכלי כיול הריכוז ( באיור 1) כדי לזהות את הקורלציה האופטימלית בין תכונות התמונה המחולצות (בהירות או חדות) והריכוזים שנמדדו בעבר על ידי המשתמש, לדוגמה, ביומסה יבש או ספירות תאים. בצע את ההוראות במדריך התוכנה לקבלת פרטים נוספים.
- זהה את הקורלציה המיטבית בין המידע שחולץ מתכונות התמונה בריכוזים שונים לעומת כל מדידות קו כבוי . ראה את האגדה של איור 1.
- לבחור את פער המדידה הסבירה ביותר ואת שורש עוצמות בהתחשב בעקומת מתאם ריכוז עם התכונות הנובעות הקטן משוקלל השורש הממוצע שגיאה ריבוע (WRMSE).
הערה: פער המדידה נקבע במהלך הניסוי, בעוד שעוצמת הסטרובוסקופ ניתנת להתאמה בהתאם לריכוז התא.
2. Off מדידה קו
- כוונן את פער המדידה הרצוי בהתאם לשלב 1 בעזרת מד עובי.
- פתח את בקרת הפיקוח של ממשק המשתמש הגרפי בלוח המחוונים של sopat.
- חבר את הגשוש הרצוי למגבר בסעיף הקטן של התוכנה ולחץ להתחבר.
- לחץ על לחצן ההפעלה כדי להתחיל בהזרמת (תצוגה חיה).
- לנקות את פער המדידה על ידי ריסוס אתנול לתוך הפער ולנגב בזהירות כל אבק או לכלוך עם נייר אופטי. בדוק כי הזכוכית של החיישן הוא ללא חלקיקים עם נוף חי ב- camcontrol.
הערה: חלקיקים ואבק מפריעים למדידות וזיהוי התא האוטומטי. - מניחים נייר אופטי יבש בפער המדידה. פתח את הכרטיסייה בקרת בדיקה וכוונן את עוצמת הסטרובוסקופ כדי להמחיש את הנייר. הפעל את בורג הכריכה עד שסיבים בודדים של הנייר ייראו בבירור.
- ממלאים צינורית עם ציר תרבות. טובלים את המיקרוסקופ בציר התרבות כך שהמרווח מכוסה במלואו בהשעיה של תאים. פתח את הכרטיסייה בקרת בדיקה וכוונן את עוצמת הסטרובוסקופ הרצויה לפי סעיף 1. התמקד בתאים על-ידי כוונון עדין של בורג איגוד המיקוד. אין לשנות את ההתמקדות כבר במהלך הניסוי
הערה: 5-6 מ ל של ציר התרבות מתווספים לצינורית צנטריפוגלית באורך של 50 מ"ל כדי לצוף לפער המדידה מספיק. - הגדר את מספר המסגרות בכל נקודת זמן [-] בממשק המשתמש בתפריט המפעיל את מסגרות GUI לכל גורם מפעיל. הגדר את מספר המסגרות ל200 מסגרות לכל גורם מפעיל.
הערה: ניתן לצמצם את מספר המסגרות לערך הנמוך ביותר, הדרוש לתוצאה אמינה וסטטיסטית. הדבר תלוי בגודל המדגם הנדרש כדי לקבל התפלגות מורפולוגית בגודל תא המייצג (ראה גם שלב 5). - הגדר את קצב המסגרות [Hz] בתפריט המפעיל את קצב מסגרתGUI. בחר קצב מסגרות המבטיח שהחלקיקים הנעים ממסגרת קודמת לא יופיעו במסגרת הבאה.
הערה: ניתן להוכיח זאת עם גורם מבחן עם 200 מסגרות. בדוק את התמונות של חלקיקים, אשר נלכדים שוב ושוב. אם זהו המצב, הקטן את קצב המסגרות. עבור מדידות קו , 1 Hz מומלץ. - הגדר את הספריה, שבה יישמרו התמונות הנרכשים, בתפריט כללי.
- בצע רכישת תמונה על-ידי הפעלת לחצן רכישת הגורם המפעיל של תמונת ההתחלה . הזז את הצינור עם השעיית תרבות בעדינות למעלה ולמטה כדי לגרום לזרימה דרך הפער מדידה.
- חזור על שלב 2.5 לאחר כל מדידה.
- בדוק את התמונות שנרכשו. תאים צריכים להיות חדים מספיק לביאור. בדוק את התמונות של חלקיקים, אשר נלכדים שוב ושוב. אם זהו המצב, הקטן את קצב המסגרות.
- שמור את ההגדרות על-ידי בחירת הנתיב הבא: C:\mgmelt\morpcuh\n התוכניות והקש על שמור.
3. זיהוי חלקיקים
- הערות ביאורים לצורך הכשרת הרשת העצבית המלאכותית (אן) (ערכת אימונים).
- העמיסו את התמונות שנרכשו לתוך כלי הביאור "פיג'י, imagej" על ידי גרירה ושחרור הקובץ לתוך החלון הראשי "imagej" (ראה הכלי "פיג'י" באיור 2)
- פתח את מנהל הROI על-ידי בחירה: לנתח | כלים | ROI מנהל.
- בחרו כלי בחירה. מומלץ לעשות שרביט (מעקב), מביד חופשית, בחירה אליפטית או אליפטית.
- ציירו עיגול סביב החלקיק שיהיה מסומן בכלי הבחירה שהוזכרו לפני ולאחר מכן לעידון הכלי מברשת.
- הוסף את הביאור למנהל הROI על-ידי הקשה על Add [t].
- סמן את כל האובייקטים המעניינים (תאים שיזוהו) על 15 תמונות.
הערה: כדי לכסות את כל המידע הדרוש, כלומר, צורות שונות, גדלים, ריכוז של תאים, בהירות וכו ', השתמש בחמש תמונות מההתחלה, חמש תמונות מתוך וחמש תמונות מסוף הניסוי. - החלט אם יש לסווג תאים במחלקות שונות עקב צורתם (לדוגמה, שלבים שונים של מחזור תאים), או אם כל התאים הם מאותה מחלקה.
- שנה את השם של כל החלקיקים שנבחרו בהתאם. הגדר שם אחד או קיצור עבור כל מחלקה ומונה עבור כל חלקיק של המחלקה (לדוגמה, cell_1, cell_2 וכד). הערות לפחות 50 חלקיקים לכל מחלקה.
- אין להוסיף ביאורים לאובייקטים, שאין לאתרם, מכיוון שהם אינם רלוונטיים לתהליך, כגון בועות גז או חלקיקים אחרים כמו רכיבי מדיה לא מומסים.
הערה: אירועים אלה לא ייכללו בהליך ההכשרה של אן ויראו כרקע. - אין להוסיף הערות לתאים שאינם מרוכזים.
- הערות ביאורים לתמונות בצורה עקבית ככל האפשר. אם יש ספקות, ניתן להחיל את האפשרות התעלם מהתווית. מומלץ מאוד שלא לנצל את השימוש בו, שכן אן תזהה רק מבנים המסומנים בתווית.

איור 2: ממשק המשתמש של הכלי פיג'י. ערכת הדרכה נוצרת עם התמונות הבוארות. ביאור ידני המורכב משתי מחלקות מתואר, מתוארת רשימת החלקיקים המוצגים במנהל הROI. ניתן להגדיר שמות וצבעים שונים עבור מחלקות שונות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- שמור את האובייקטים המוארים ואת התמונה בתבנית ZIP ושלח את הקובץ לרשת ההדרכה, באמצעות העלאה לפלטפורמה או על-ידי שליחת קובץ ה-ZIP באמצעות דואר אלקטרוני.
הערה: בדרך כלל, נדרש מספר סבבי הכשרה איטרטיביים לזיהוי תחזיות מתאימות של האובייקטים המסווגים בתמונות. כל סיבוב הדרכה מוביל לזרימת עבודה המוחזרת על-ידי התוכנית. - השתמש בזרימת העבודה (*. wf) עם אלגוריתם זיהוי אובייקט מיומן כדי לנתח תמונות מבחן עם אצווה נתונים מתקדמת התוכנית Batcher כי ניתן להפעיל את לוח המחוונים.
- בדוק את זיהוי האובייקט בתמונות הבדיקה באמצעות כימות האירועים החיוביים והשליליים השקריים.
- לכמת את הזיהוי של אירועים חיוביים כוזבים: חלקיקים שזוהו בטעות כתאים, תאים שאינם מסווגים כראוי, ותאים שהמתאר לא זוהה היטב.
- לכמת את האירועים השליליים השווא (תאים שאינם מזוהים ככאלה).
- המחש את התוצאות במנתח תוצאות הכלי על ידי הפעלת התוכנית בלוח המחוונים.
- יבא את קבצי התוצאות הרצויים עם הקובץ | יבא קובץ או קובץ | יבא תיקיות.
- המחש את התוצאות לפי תרשים | צור תרשים ב-GUI של תרשימים.
- בחר אחת מהאפשרויות הבאות: תרשים הפצה, מגרש רגישות, אופייני לאורך זמן, אופייני לנקודות הסקר ולתכונה Feature vs.
הערה: מדריך לגבי ניצול של מנתח התוצאות מגיע עם המערכת והוא זמין גם מהתמיכה. - אם התוצאות מקובלות, הפעל את זרימת העבודה ב- Batcher בכל התמונות שנרכשו של הניסוי. באותו הזמן אז את תוכנית הניטור ניתן ליצור על ידי שילוב הגדרות שנשמרו מבקר בדיקה (*. pcfg) עם זרימת העבודה (*. wf), ראה גם את המדריך.
הערה: ניתן להשתמש בזרימת העבודה גם לניטור ניסויים עתידיים במדיית תרבות זו. - אם התוצאות אינן מקובלות, בדוק את הביאור בערכת ההדרכה ו/או המשך בסיבוב אימון איטרטיבי אחר (ראה שלב 4.2).
4. בדיקת גודל לדוגמה
- הגדר את סטיית התקן (σ), המקובלת בקרב החלקיקים שאותרו.
הערה: סטיית התקן משתנה במקביל לגודל התא. סטיית התקן המירבית מציינת את המדגם עם הרמה הגבוהה ביותר של טרוגניות גודל. - הגדר את משרעת מרווח הביטחון או את הדיוק הרצוי ביחס לסטיה הצפויה של מדידות (e).
- להגדיר את השגיאה הודה (α) בין 5% (z1-α/2 = 1.96) ו 10% (z1-α/2 = 1.64).
- חשב את מספר התאים שיזוהו מכל מחלקה ממשוואה 1.
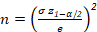 [משוואה 1]
[משוואה 1]
הערה: בהתאם למספר התאים, ניתן להגדיר את מספר התמונות שצריך לרכוש עבור כל נקודת נתונים. - לבצע ניתוח רגישות על נקודות זמן אקראיות של הניסוי כדי לבדוק כי ניתוח של חלקיקים n מוביל לשונות של קוטר Feret ממוצע Dv90 של פחות מ 5%. ניתן לחשב אותו באופן אוטומטי במנתח התוצאות.
5. על קו (לפי-מעבר) או במדידה קו
- בצע תחילה את הליך המדידה מחוץ לשורה (ראה שלב 2) כדי להגדיר את הגדרות החומרה והתוכנה כפונקציה של האורגניזם והתהליך (ריכוז או מדיה).
- העלה את ההגדרות השמורות מהמקטע הקודם על-ידי בחירה בטעינת הלחצן ובחר את הנתיב הבא: C:\pgmet\mlorcpuf\t.
- חבר את המקדח לתא הזרימה או הביוריאקטור.
הערה: במידות באתרו ניתן לבצע עם מקורבות קמצוץ. - בצע עיקור.
הערה: רק החומר הsterilizable של המכשיר הוא באמצעות עיקור קיטור. אורך המכשיר יכול לעבור מ 6 אל 222 מ"מ (איור 3).
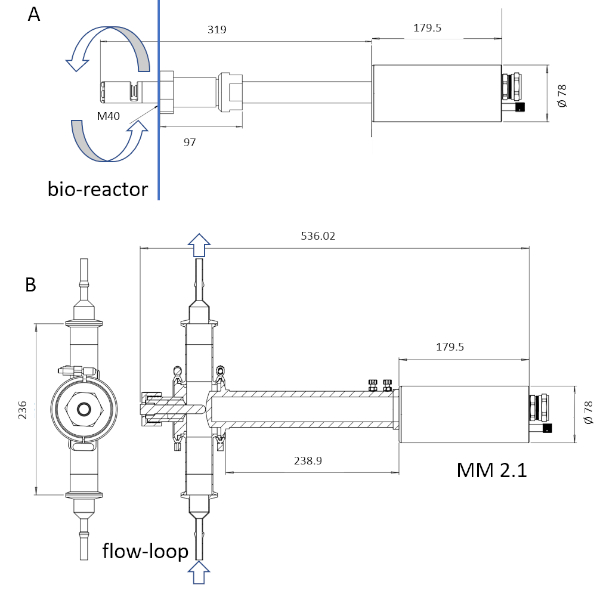
איור 3: סקיצה של התקנים ISM. הבדיקה MM-Ho (א) היא להתקנה ישירות בתוך bioreactor חקן, בעוד הבדיקה MM 2.1 (ב) ניתן להשתמש בתור על ידי-pass. המחזור של ציר התרבות מסומן בחצים בכל תמונה. גורמי ההמרה הם 0.166 יקרומטר pix-1 עבור mm-Ho ו 0.087 יקרומטר pix-1 עבור mm 2.1. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הגדרת קצב רכישת התמונה ב-GUI המפעיל את מרווח הזמן של הגורם המפעיל של השדה [s].
הערה: בהתאם לדינמיקת התהליך, ניתן להתאים את קצב רכישת התמונה. לדוגמה, אם צפוי שלב השהיה של 3 שעות, שיעור הרכישה עשוי להיות נמוך יותר, מאשר אם משמרת חילוף החומרים או הצטברות המוצר יהיו מנוטרים. בדרך כלל, הדבר דורש זמן רכישה קצר יותר בטווח הדקות. לדוגמה, רצף רכישת תמונה בין 5 ל-10 דקות במהלך טיפוח-תרגול של שמרים מספק מידע מספיק כדי ללכוד את דינמיקת התהליך. - הגדר את קצב המסגרות כפי שהוסבר בשלב 2.10.
הערה: בשורה ובמידות קו , ניתן להגדיל את קצב הפריימים, שכן הערבוב המכני יכול להגביר את קצב הזרימה דרך הפער. - התחל רכישת תמונה על ידי הפעלת הלחצן התחלת הזרמת של הלווין שנבחר.
- הפסק את הרכישה כאשר הניסוי מסתיים בעצירת הלחצן של הלווין שנבחר.
הערה: במהלך הריצההראשונה , התחל את הרכישה בדיוק לפני החיסונים של התרבות והמשך לשלב 4. עבור הרצפים הבאים, פתח את ניטור התוכנית בלוח המחוונים ובחר את זרימת העבודה שנוצרה (ראה שלב 4). התחל את הניטור ממש לפני החיסונים של התרבות על ידי לחיצה על כפתור Play .
תוצאות
הזיהוי גודל התא בתרבויות שמרים עם ISM וזיהוי תמונה אוטומטית כדי להבדיל בין התאים הנצה ושאינם המ, נערך בהצלחה. הן בעוצמת הסטרובוסקופ והן בבחירת פער המדידה מגוון של עמידות, שבה זיהוי החלקיקים אינו מושפע. לדוגמה, תאים של ס. cerevisiae ס נמדדו עם עוצמות שונות של כוונות בתוך טווח...
Discussion
ISM כפי שהוצג כאן עם מכשירים זהים או דומים מאוד השתמשו כדי למדוד דינמיקה מורפולוגית של פטריות, מיקרואצות, ותאי שמרים, אשר איפשר את קביעת פעילות הצמיחה, ובמקרה של אצות, הצטברות מוצר תאיים. החיישן אינו כולל חלקים מטלטלין והוא ישים באופן ישיר בכל ביוריאקטור מעורבב סטנדרטי, או דרך נמל רגיל או steril...
Disclosures
. למחברים אין מה להצהיר
Acknowledgements
המחברים אסירי תודה על תמיכתם של המשרד הפדרלי הגרמני לכלכלה ואנרגיה במסגרת צים-קופ, פרויקט "ביקורת תהליך חכם", להעניק לא. ZF 4184201CR5.
Materials
| Name | Company | Catalog Number | Comments |
| Sensor MM 2.1 - MFC | SOPAT GmbH, Germany | n.a. | Inline Monocular Microscopic probe Version 2.1 with a Mirco Flow Cell |
| Sofware version v1R.003.0092 | SOPAT GmbH, Germany | n.a. | |
| Thickness gauge | n.n. | It can be any supplier, DIN 2275:2014-03 | |
| Ethanol 70% | n.n. | It can be any supplier | |
| SOPAT manual Version 2.0.5 | SOPAT GmbH, Germany | ||
| Optical lense paper | VWR | 470150-460 | |
| Fiji, ImageJ | open source | ||
| 50 mL conical centrifuge tubes | It can be any supplier |
References
- Maaß, S., Rojahn, J., Hänsch, R., Kraume, M. Automated drop detection using image analysis for online particle size monitoring in multiphase systems. Computers & Chemical Engineering. 45, 27-37 (2012).
- Lemoine, A., Delvigne, F., Bockisch, A., Neubauer, P., Junne, S. Tools for the determination of population heterogeneity caused by inhomogeneous cultivation conditions. Journal of biotechnology. 251, 84-93 (2017).
- Marbà-Ardébol, A. M., Bockisch, A., Neubauer, P., Junne, S. Sterol synthesis and cell size distribution under oscillatory growth conditions in Saccharomyces cerevisiae scale-down cultivations. Yeast. 35 (2), 213-223 (2017).
- Xiao, Y., Bowen, C. H., Liu, D., Zhang, F. Exploiting nongenetic cell-to-cell variation for enhanced biosynthesis. Nature chemical biology. 12 (5), 339-344 (2016).
- Beutel, S., Henkel, S. In situ sensor techniques in modern bioprocess monitoring. Applied microbiology and biotechnology. 91 (6), 1493 (2011).
- Belini, V. L., Wiedemann, P., Suhr, H. In situ microscopy: A perspective for industrial bioethanol production monitoring. Journal of microbiological methods. 93 (3), 224-232 (2013).
- Havlik, I., et al. Monitoring of microalgal cultivations with on-line, flow-through microscopy. Algal Research. 2 (3), 253-257 (2013).
- Suhr, H., Herkommer, A. M. In situ microscopy using adjustment-free optics. Journal of biomedical optics. 20 (11), 116007 (2015).
- Panckow, R. P., Reinecke, L., Cuellar, M. C., Maaß, S. Photo-Optical In-Situ Measurement of Drop Size Distributions: Applications in Research and Industry. Oil Gas Sci. Technol. - Rev. IFP Energies. 72 (3), 14 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Neubauer, P., Junne, S. Single-cell-based monitoring of fatty acid accumulation in Crypthecodinium cohnii with three-dimensional holographic and in situ microscopy. Process Biochemistry. 52, 223-232 (2017).
- Porro, D., Vai, M., Vanoni, M., Alberghina, L., Hatzis, C. Analysis and modeling of growing budding yeast populations at the single cell level. Cytometry. Part A : the journal of the International Society for Analytical Cytology. 75 (2), 114-120 (2009).
- Brauer, M. J., et al. Coordination of growth rate, cell cycle, stress response, and metabolic activity in yeast. Molecular biology of the cell. 19 (1), 352-367 (2008).
- Puxbaum, V., Gasser, B., Mattanovich, D. The bud tip is the cellular hot spot of protein secretion in yeasts. Applied microbiology and biotechnology. 100 (18), 8159-8168 (2016).
- Marbà-Ardébol, A. M., Emmerich, J., Neubauer, P., Junne, S. Vol. P2. Prozessmesstechnik. , 222-225 (2017).
- Marbà-Ardébol, A. -. M., Emmerich, J., Muthig, M., Neubauer, P., Junne, S. Real-time monitoring of the budding index in Saccharomyces cerevisiae batch cultivations with in situ microscopy. Microbial cell factories. 17 (1), 73 (2018).
- Marquard, D., Schneider-Barthold, C., Düsterloh, S., Scheper, T., Lindner, P. Online monitoring of cell concentration in high cell density Escherichia coli cultivations using in situ Microscopy. Journal of biotechnology. 259, 83-85 (2017).
- Marquard, D., et al. In situ microscopy for online monitoring of cell concentration in Pichia pastoris cultivations. Journal of biotechnology. 234, 90-98 (2016).
- Camisard, V., Brienne, J., Baussart, H., Hammann, J., Suhr, H. Inline characterization of cell concentration and cell volume in agitated bioreactors using in situ microscopy: application to volume variation induced by osmotic stress. Biotechnology and bioengineering. 78 (1), 73-80 (2002).
- Böhm, A., Ücker, A., Jäger, T., Ronneberger, O., Falk, T. ISOODL: Instance segmentation of overlapping biological objects using deep learning. , 1225-1229 (2018).
- Davey, H. M. Life, Death, and In-Between: Meanings and Methods in Microbiology. Applied and environmental microbiology. 77 (16), 5571-5576 (2011).
- Lodolo, E. J., Kock, J. L., Axcell, B. C., Brooks, M. The yeast Saccharomyces cerevisiae-the main character in beer brewing. FEMS yeast research. 8 (7), 1018-1036 (2008).
- Albertin, W., et al. Population size drives industrial Saccharomyces cerevisiae. alcoholic fermentation and is under genetic control. Applied and environmental microbiology. 77 (8), 2772-2784 (2011).
- Gomes, J., Chopda, V. R., Rathore, A. S. Integrating systems analysis and control for implementing process analytical technology in bioprocess development. Journal of Chemical Technology and Biotechnology. 90 (4), 583-589 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved