Method Article
ניתוח של תפקוד תאי בטא באמצעות הדמיה הסידן בתא יחיד ברזולוציה איונים דג זברה
In This Article
Summary
תאי בטא פונקציונליות חשוב הומאוסטזיס הגלוקוז בדם, אשר מוערך ברזולוציה תא בודד באמצעות כתב גנטית מקודד עבור זרם סידן.
Abstract
בתאי בטא בלבלב להגיב הגדלת ריכוזים של גלוקוז בדם על ידי הפרשת הורמון ה אינסולין. תפקוד תאי בטא-מוביל היפרגליקמיה השלכות חמורות, סכנת חיים. הבנת איך תאי הבטא פועלים בתנאים פיזיולוגיים, איזה גורמים גנטיים וסביבתיים עלול לגרום שלהם לקוי עלול להוביל אפשרויות טיפול טובות יותר עבור חולי סוכרת. היכולת למדוד את רמות הסידן בתאים-בטא מהווה אינדיקטור חשוב של תפקוד תאי בטא, כמו זרם של שחרור אינסולין גורמים מפעילים של יונים של סידן. כאן נתאר פרוטוקול עבור ניטור זרם סידן מגורה-גלוקוז בתאים-דג זברה בטא באמצעות GCaMP6s, חיישן מקודדים גנטית של סידן. השיטה מאפשרת ניטור הדינמיקות סידן תאיים עם רזולוציה תא בודד ב- לשעבר vivo רכוב איונים. הגלוקוז-התגובה של תאי הבטא בתוך איון אותו ניתן ללכוד בו זמנית תחת ריכוזי גלוקוז שונים, אשר מצביע על הנוכחות של הטרוגניות פונקציונלי בין דג זברה בטא-תאים. יתר על כן, השיטה מספקת הגיאופוליטיות והמרחביות טמפורלית ברזולוציה גבוהה, אשר חושף את מהות מתנדנדות זרם סידן על גירוי גלוקוז. הגישה שלנו פתיחת הדלתות כדי להשתמש את דג זברה כמודל כדי לחקור את התרומה של גורמים גנטיים וסביבתיים אל תאי בטא ותפקוד לקוי.
Introduction
הגלוקוז בדם שלנו נשמר בטווח צר, בעיקר בזכות הפונקציה בלבלב האנדוקרינית. תפקיד האנדוקרינית הלבלב מתבצע על ידי איי לנגרהנס, אשר מכילים תאים מפריש הורמון. הורמון האינסולין-תאי הבטא אחראים הפחתת רמות הגלוקוז בדם לאחר ארוחה המכילה פחמימות. הפרשת האינסולין לקוי של תאי בטא יכול לגרום סוכרת1, אשר מאופיין על ידי מתמשכת הגלוקוז בדם גבוהה. סוג 1 וסוכרת מסוג 2, אשר פוגעת כיום יותר מ- 400 מיליון אנשים ברחבי העולם, מוביל התחלואה והתמותה2. על ידי חוקר את הגורמים המולקולריים וסביבתיים שתורמים בתפקוד תאי בטא, אנחנו יבין טוב יותר איך לפתח סוכרת מסוג 2 מתחיל ולא מתקדמת. בנוסף, היכולת להבדיל תאי גזע אנושי לתוך תאי הבטא פונקציונלי במבחנה יכול לספק מקור של בטא-תאים חדשים תא-החלפת טיפולים בסוכרת מסוג 1. לשם כך, חשוב ללמוד ההבשלה מודל גנטי אורגניזמים ותפקוד תאי בטא כדי להשיג את הידע הדרוש לייצור תאי הבטא פונקציונלי בקערה.
תאי בטא פונקציונליות ניתן לנטר באותה רמת שלמה-איון מאת לכימות הסכום הכולל של אינסולין מופרש בתגובה גלוקוז-גירוי. גישה זו מצטברת מחקרים של איון כקבוצה אחת של תאים ללא הבחנה המאפיינים הבודדים של התא. עם זאת, ניתוח הנתונים של גלוקוז תגובות של בטא-תאים בודדים גילה מגוון המאפיינים הפונקציונליים של תאי ביתא-ואת הנוכחות של הטרוגניות3. כדי להעריך את הפונקציה של בטא-תאים בודדים, זה אפשרי לעקוב אחר שינויים תאיים להוביל הפרשת אינסולין4. הפרשת האינסולין קודם כניסה של גלוקוז לתוך תאי הבטא. גלוקוזה זה מזין תאי הבטא עובר מטבוליזם במהירות ל ATP. ריכוז גבוה של ATP תאיים להקטין את ההסתברות פתוח של תעלות יונים של אשלגן תלויית ATP המוביל אל תאי בטא דפולריזציה. דפולריזציה פתיחת תעלות היונים מתח רגיש סידן ומגביר את הסידן תאיים. בתורו, הסידן מפעיל אקסוציטוזה של אינסולין, אשר מופץ במחזור הדם, מוריד את רמות הגלוקוז על ידי קידום גלוקוז-ניצול5,6,7.
מספר אסטרטגיות הוחלו לחקור את תפקוד תאי הבטא, כולל ניטור של פוטנציאל הממברנה8, פריט חזותי ישיר של אינסולין-שלפוחית אקסוציטוזה9, כימות של Ca תאיים2 + זרם כמדד גלוקוז-תגובתיות10. ביניהם, הדמיה של Ca תאיים2 + מספק את היתרון של הניתוח בתאים בודדים מרובים בתוך אותו איון11,12, המאפשר השוואה ישירה של הגלוקוז-התגובה בין למעלה-קנה מידה בטא-תאים בודדים. Ca תאיים2 + ריכוז ניתן לנטר בעזרת צבעי פלורסנט סידן רגיש13 או סידן מקודד גנטית אינדיקטורים (GECIs)14. ואילו סידן-מחוון צבע חוסר סוג התא ירידה לפרטים, GECIs יכול להתבטא סוג תא מסוים על ידי היזמים ספציפיים. בנוסף, הדור החדש של GECIs, כגון GCaMP6, מספק יחס אות לרעש טוב יותר יחד עם מהר טמפורלית dynamics15. כאן נתאר את התועלת של הדור החדש של GECIs, ב GCaMP6s מסוים, כדי להמחיש סידן בתאי בטא ברזולוציה תא בודד. אנו מיישמים שיטה זו כדי איון העיקרי דג זברה כמודל שלנו להתמקד. במהלך התפתחות עובריים, ביתא-תאים איון הראשי מקורן מהראש, הלבלב הגחוני / ניצנים16. איון העיקרי הינו ממוקם במיקום האנטומי סטריאוטיפי בתוך הלבלב דג זברה, המאפשרת בידוד וזיהוי קל שלה. בטא-תאים איון העיקרי נחוצים גלוקוז-תקנה, כפי אבלציה הגנטי שלהם מוביל היפרגליקמיה17,18. יתר על כן, הביתא-תאים אלה הופכים גלוקוז מגיב במהלך התפתחות מוקדמת של דג זברה19. פרוטוקול זה ניתן להחיל גם על הדמיה איונים המשני, המהווים בשלבים עובריים פוסט. הפרוטוקול מאפשר תמונה תאי בטא- ex-vivo, בשלבים מאוחרים יותר של התפתחות ותחת ריכוזי גלוקוז מוגדרים.
Protocol
כל ההליכים לרבות נושאים בעלי חיים אושרו על ידי חוק רווחת בעלי חיים, עם אישור של Sachsen Landesdirektion, גרמניה (AZ 24 – 9168.11-1/2013-14, טי12/2016).
1. הכנה
הערה: פרוטוקול זה הוא עבור ex-vivo הדמיה של דג זברה איון העיקרי של Tg הטרנסגניים כפול (ins:nls-Renilla-mKO2; cryaa:CFP); Tg (ins:GCaMP6s; cryaa:mCherry) 19 דג זברה. בשורה זו מהונדס, האמרגן אינסולין (ins) כוננים תאי בטא ביטוי ספציפי של שני transgenes: nls-Renilla-mKO2, אשר מסמנת את הגרעין של תאי הבטא עם Kusabira monomeric כתום 2 (mKO2) זריחה; GCaMP6s15, אשר פולט קרינה פלואורסצנטית ירוק בתגובה: גידול רמות הסידן תאיים. הביטוי בטא-תא-ספציפי של GCaMP6s מאפשר ללמוד הגלוקוז-התגובה של תאי הבטא ללא הפרעה משינויי סידן המקיף סוגי תאים.
- להכין מלאי פיברינוגן טריים (10 mg/mL) על ידי המסת 10 מ ג של פיברינוגן שור תוך 1 מ"ל של Ca2 +/Mg2 +-המכיל תמיסת מאוזנת מלח הנקס (HBSS) בשפופרת צנטרפוגה 1.5 mL. מערבולת נמרצות עד האבקה פיברינוגן מתמוסס לחלוטין. שמור את הפתרון בטמפרטורת החדר למשך לפחות עוד 15 דקות.
הערה: המניה יכול להישמר בטמפרטורת החדר במשך 2-3 ח' להשליך המניה אם הפתרון מתחיל פולימריזציה, הופך צמיגה. - הכן הפתרון עובד פיברינוגן (3.3 mg/mL) על ידי דילול המניה פיברינוגן HBSS בתוך החולוני. לדוגמה, מערבבים 300 µL של פיברינוגן מניות של 600 µL של HBSS להכין µL 900 של הפתרון עובד פיברינוגן.
- להכין תרומבין פתרון (10 U/mL) על ידי המסת 10 יחידות של תרומבין ב 1 מ"ל של HBSS או פוספט buffered תמיסת מלח (PBS).
הערה: פתרון זה יכול להיות מוכן מראש, aliquoted 50 חלקים µL, קפוא ב-20 ° C. - להכין 200 מ"מ תמיסת גלוקוז D על ידי המסת 1.8 g של D-גלוקוז ב- 50 מ ל מים. שמור 4 ° C לאחסון לטווח ארוך.
- להכין 300 מ"מ אשלגן כלורי פתרון על ידי המסת g 1.1 של אשלגן כלורי ב- 50 מ ל מים. שמור 4 ° C לאחסון לטווח ארוך.
- להשיג 35 מ מ קוטר זכוכית-התחתון מנות להרכבה על איים קטנים.
- לנתיחה, הרכבה של איון, להשתמש במיקרוסקופ סטריאו מצויד עם פלורסצנטיות המנורה ואת מסנן אדום קוביה (TRITC: עירור: 532 – 554 ננומטר, פליטה: 570-613 ננומטר; או טקסס-אדום: עירור: 540-580 nm, פליטה: 592 – 667 ננומטר).
- הדמיה זרם סידן בתאי בטא, שימוש מיקרוסקופ קונפוקלי הפוכה (Zeiss LSM 780 או דומה) עם 20 X (0.8 NA) אוויר המטרה ומצוידים בעל לוחית הכלים למטה זכוכית בקוטר 35 מ מ.
- היכונו המתות חסד את דג זברה פתרון 200 מ ג/ליטר של tricaine מתאן סולפונאט (MS222).
- להביא צלחות פטרי 90 מ מ רוברט דג זברה.
2. דג זברה ראשי איון לנתיחה מכשירי הרכבה
- המתת חסד דג באמצעות דגירה ממושך ב- MS222. בשביל זה, להסיר את הדג מן האקווריום באמצעות רשת דיג ובעדינות דגירה אותו בצלוחית המכילה את הפתרון MS222 עד החיה מראה אין תנועה opercular (זימים); בדרך כלל, זה לוקח 5 דק העברת הדג על צלחת פטרי המכילות את הפתרון HBSS עם Ca2 +/Mg2 +.
-
תחת מיקרוסקופ סטריאו מצויידים המנורה פלורסצנטיות, מסנן אדום קוביה, לנתח את העור המכסה את הצד הימני של הבטן של החיה כדי לבודד את הלבלב.
- בשביל זה, לחתוך את העור של דג זברה מפי לפין אנאלי באמצעות מלקחיים חדה. לקלף את העור לחתוך כדי לחשוף את הבטן; החיתוך הזה חושף את האיברים הפנימיים. באמצעות פלואורסצנטי אדום את הביטוי mKO2 בתאים-ביתא, לוודא שמיקום איונים בבדיקה חזותית מתחת למיקרוסקופ. במידת הצורך, הסר את אונות הכבד, כפי הם יכולים לכסות את איון, ולכן קשה למצוא.
הערה: איון הראשי ממוקם ליד האזור הקדמי של הבטן, בדרך כלל בצד ימין.
- בשביל זה, לחתוך את העור של דג זברה מפי לפין אנאלי באמצעות מלקחיים חדה. לקלף את העור לחתוך כדי לחשוף את הבטן; החיתוך הזה חושף את האיברים הפנימיים. באמצעות פלואורסצנטי אדום את הביטוי mKO2 בתאים-ביתא, לוודא שמיקום איונים בבדיקה חזותית מתחת למיקרוסקופ. במידת הצורך, הסר את אונות הכבד, כפי הם יכולים לכסות את איון, ולכן קשה למצוא.
- לנקות את איון הראשי על-ידי בקפידה הסרת הרקמה הסובבת כגון הכבד, adipocytes. לנקוט אמצעי זהירות לא כדי לפגוע או לתקוע את איון; לאחר ניקוי של הרקמה שמסביב, תאים נפרדים על פני איון להיות ניכרת.
- Pipette טיפה 30 µL HBSS במרכז צלחת זכוכית-התחתון. להעביר את איון גזור הזה טיפה.
- לשטוף היטב את איון פעם אחת עם HBSS ופעם אחת עם 30 µL של הפתרון עובד פיברינוגן (3.3 mg/mL). לוודא למנוע ייבוש של איון במהלך השלבים כביסה בגלל כשל לשם כך התוצאה היא מוות של תאים.
- לאט ובעדינות להוסיף 10 µL של הפתרון תרומבין (10 U/mL). להשאיר את איון ואת המנה לא נגעה במשך 15-20 דקות להתבונן כי הירידה פיברינוגן-תרומבין יהפכו צמיגה כמעצמה בשלב זה.
3. לשעבר Vivo לחיות-הדמיה של GCaMP עוצמת קרינה פלואורסצנטית ב איונים ראשי דג זברה
- להוסיף 200 µL של HBSS על העובש ולמקם את המנה בקפידה את המחזיק לוחית מיקרוסקופ קונפוקלי. השתמש מטרה אוויר 20 X, 0.8 NA, עבור הדמיה קונפוקלי. אתר את איון באמצעות האפשרות brightfield.
- באמצעות המסנן עבור פלואורסצנטי אדום כדי להציג את זריחה mKO2 הגרעין בתאים-בטא, להתמקד איון. גרעינים בודדים צריך להיות ברור לעין.
- אתר מטוס הדמיה ברורה על-ידי שינוי ידני של מטוס מוקד של מיקרוסקופ קונפוקלי כדי לעבור בין עובי איון לאורך ציר z. ודא כי המטוס הדמיה מכיל מספר מספיק (50-100) של תאי הבטא עבור הדמיה, בהירות זריחה mKO2 גרעיני הוא אחיד, במיוחד במרכז של איון.
- להגדיר על רכישת רציפים עבור זריחה GCaMP6s ו- mKO2 באמצעות ההגדרות הבאות ב "בתפריט הגדרה חכם": GCaMP6s, עירור: 488 ננומטר, פליטה: 500-555 ננומטר, שווא-צבע: ירוק (בחר "GFP"); mKO2, עירור: 561 nm (mCherry), פליטה: 570 – 630 ננומטר, שווא-צבע: אדום (בחר "mCherry").
הערה: עם הגדרה זו, הערוץ האדום יתעד את המיקום של גרעיני תאי בטא, בעוד לערוץ הצבע הירוק יהיה שיא עוצמת קרינה פלואורסצנטית GCaMP. - במצב של"רכישת" הגדר את רזולוציית התמונה 1,024 x 1,024 פיקסלים, מהירות ב-10 ו בממוצע ב- 1. החניך רציפה מקליט על-ידי בחירה באפשרות של "זמן-סדרה", והגדרת "משך" 500 מחזורי, עם-2 s רכישת זמן לכל מסגרת.
הערה: מסגרות 50 הראשונים של סדרת הזמן תואמות הפעילות של תאי הביתא-ריכוז גלוקוז 5 מ מ. זוהי התגובה הבסיסית. בטא-תא מגיבה יראה מתמלא, מתמעט בעוצמת פלורסצנטיות ירוק עם הזמן. הבחנו כי כמה (1 – 5%) של תאי הביתא נעים-גלוקוז 5 מ מ. -
לפקוח עין על מחזור הדמיה. לאחר הראשונה 50 מסגרות, להגדיל את ריכוז הגלוקוז הפתרון המקיף 10 מ מ בלי לעצור את ההקלטה.
- ללא perturbing רכישת התמונה, בעדינות פיפטה 5 µL של 200 מ מ D-גלוקוז פתרון על גבי הג'ל מחזיק את איון. לרכוש מסגרות 150-גלוקוז 10 מ מ.
הערה: העלייה בריכוז הגלוקוז יגדיל את מספר תאי בטא-עוברת תנודות פלורסנט GCaMP בערוץ ירוק. - להבטיח הגרעינים של התאים יישארו יציבים במהלך התהליך. אם איון היא רועדת בהרחבה במהלך רכישת ופועלים הגרעינים מהמטוס מוקד, למחוק את הדגימה (במידת הצורך).
- לחכות תקופה מספקת כדי לאפשר פלמור של העובש פיברינוגן-תרומבין על מנת להבטיח את היציבות של דגימות עוקבות.
- ללא perturbing רכישת התמונה, בעדינות פיפטה 5 µL של 200 מ מ D-גלוקוז פתרון על גבי הג'ל מחזיק את איון. לרכוש מסגרות 150-גלוקוז 10 מ מ.
- ב 200 מסגרות, להגביר עוד יותר את הריכוז של הפתרון 20 מ מ על ידי בעדינות pipetting µL 10 מ מ 200 תמיסת גלוקוז-D. לרכוש מסגרות 150 עבור ריכוז 20 מ מ.
- אחרי 350 מסגרות, depolarize את איון באמצעות 30 מ מ של אשלגן כלורי. בשביל זה, להוסיף 20 µL של 300 מ מ פתרון מניות אשלגן כלורי. בשלב זה, להתבונן תנודות זריחה GCaMP6s להפסיק ולתקן בעוצמה גבוהה; תאי הבטא שלא הגיבו לגלוקוזה יכול גם להציג עלייה בעוצמת ירוק-זריחה על תוספת אשלגן כלורי.
4. כימות של GCaMP עקבות קרינה פלואורסצנטית בטא-לתאים בודדים
הערה: כדי לאתר ולכמת את התגובות של בטא-תאים בודדים רמות משתנות של גלוקוז, לכמת את עוצמת קרינה פלואורסצנטית GCaMP עבור כל התקופה הדמיה. כימות מתבצע ברזולוציה הסלולר. לשם כך, השתמש פיג'י20 כדי לחלץ את ערכי העוצמה של זריחה GCaMP תמונות (צעדים 4.1 – 4.6), ואת תוכנת הגיליון האלקטרוני או R21 לבצע ניתוח (שלבים 4.8-4.9).
- פתח את קובץ התמונה בפיג'י באמצעות "ארגז הכלים LSM". לשם כך, בחר "תוסף | ארגז הכלים LSM | הצג את ארגז הכלים LSM". בארגז הכלים"LSM", לחץ על "פתח LSM" ובחר את קובץ התמונה.
הערה: עבור תבניות אינה נתמכת על ידי "ארגז הכלים LSM", להמיר אותם תחילה על tiff לניתוח. - לחלץ את התגובות של תאים באמצעות הכלי (ROI) אזור-של-עניין בפיג'י. פתח את 'מנהל רועי"בתפריט ' 'נתח' ' תחת"כלים". צייר באופן ידני את רועי באמצעות "הבחירה בכלי מצולע" הממוקם בסרגל הכלים.
- ציירו רועי בערוץ האדום שבו האטומים תאי בטא גלויים. בחר את רועי כזה כי זה מכסה שטח גדול יותר גרעין של התא כדי לכלול חלק הציטופלסמה של התא. ודא כי המיקום רועי עקבית בין מסגרות ולהתאים את המיקום במידת הצורך.
- להוסיף את ROIs שנבחר למנהל"רועי" על ידי לחיצה על לחצן "הוסף [t]". בחר ולהוסיף ROIs מרובים רועי להשגת נתונים על תאים מרובים.
- לאחר מכן, בתפריט ' 'נתח' ', בחר "קביעת המידות". בחר "צפיפות משולב" לציון החילוץ של עוצמת קרינה פלואורסצנטית הכולל בתוך האזור.
- להעביר לערוץ הצבע הירוק המכיל את זריחה GCaMP ובחר "ריבוי אמצעי" במנהל"רועי".
הערה: פעולה זו תספק את המידות העוצמה עבור התאים לאורך כל סדרת הזמן. - במקרה לתנוחה רועי צריכה תיקון עקב תנועת איון, באופן ידני לקמפל את המידות בעוצמה במסגרות שונות. העתק והדבק את הערכים לגיליון אלקטרוני נפרדים.
- להשיג חותמות הזמן של מסגרות תמונה של "ארגז הכלים LSM". שימוש "להחיל בולים | החלת טי בולים | שם קובץ | לטיפוסים textfile"כדי להשיג את חותמות זמן. שמור חותמות זמן שימוש באפשרות "שמור בשם", או להעתיק אותם לתוך הגיליון האלקטרוני.
- בעת קימפול את ערכי העוצמה של כל התאים, לבצע את ניתוח תא אחד בכל פעם או באופן אוטומטי (לדוגמה, שימוש בנוסחאות Excel או R).
-
לנתח תאים בודדים בשני שלבים.
- בשלב הראשון, לחשב את עוצמת קרינה פלואורסצנטית מעל לקו הבסיס. לשם כך, לחשב את עוצמת ניאון בסיסית (F0) כממוצע של עוצמות קרינה פלואורסצנטית עבור מסגרות קודם 50 (גלוקוז 5 מ מ). ואז מהמסיכה הבסיס (F0) בזמן-הסדרה כולה (F-F0).
הערה: כמה תאים באפשרותך להציג ברור תנודות GCaMP תחת הבסיס גלוקוז, אשר בדרך כלל ממשיכים בעקבות גירוי עם ריכוזים גבוהים יותר. עבור תאים כאלה, זה רק ניתן לאמוד F0 על ידי לקיחת עוצמת אכזרי של המסגרות הראשוני שבו התאים הראו ירידה זריחה. - בשלב השני של הניתוח, לקבל את עוצמת קרינה פלואורסצנטית GCaMP סופית על-ידי נרמול עוצמת קרינה פלואורסצנטית.
הערה: זה מבוצע כדי להסיר את ההבדלים בין איים קטנים של בעלי חיים שונים. איים בודדים להציג רמות משתנות של פליטת קרינה פלואורסצנטית על גירוי גלוקוז. - לנרמל את עוצמת קרינה פלואורסצנטית חילוק זה עם הערך הגבוה ביותר בעוצמה. בשביל זה, לחשב את עוצמת שיא (Fמקסימום – F0) או חילוק הערכים הבסיסיים המופחת באינטנסיביות שיא להניב את עוצמת קרינה פלואורסצנטית GCaMP הסופי (F-F0) / (Fמקסימום – F0).
- בשלב הראשון, לחשב את עוצמת קרינה פלואורסצנטית מעל לקו הבסיס. לשם כך, לחשב את עוצמת ניאון בסיסית (F0) כממוצע של עוצמות קרינה פלואורסצנטית עבור מסגרות קודם 50 (גלוקוז 5 מ מ). ואז מהמסיכה הבסיס (F0) בזמן-הסדרה כולה (F-F0).
- למחוק את התאים לא מוצג שינוי בעוצמת בעקבות גירוי אשלגן כלורי, כפי שהם עשויים להיות לא בריא או פגום.
- לביצוע הניתוח (שלבים 4.9-4.10) ב- R, להשתמש בסקריפט R (plotcelltrace. R) מסופק עם כתב היד הזה.
תוצאות
באמצעות פרוטוקול המתואר לעיל, התגובות גלוקוז של תאי-ביתא איון של דג שלאחר ההפריה (dpf) 45 ימים נותחו. בשביל זה, איון העיקרי היה גזור מחיה לאללה, רכוב ב כייר פיברינוגן-תרומבין בצלחת זכוכית-התחתון. איון היה שקוע HBSS המכילה גלוקוז 5 מ מ. ריכוז גלוקוז היה גדל באופן הדרגתיים 10 מ מ, 20 מ מ. התגובות של תאי ביתא-הגדלת ריכוז הגלוקוז נרשמו. לבסוף, תאי בטא-היו depolarized באמצעות 30 מ מ אשלגן כלורי (איור 1). דפולריזציה אשלגן כלורי באמצעות גורם סידן ערך בטא-תאים בריאים.
פיג'י באמצעות תוכנת ניתוח הנתונים, את עוצמת קרינה פלואורסצנטית GCaMP6s של בטא-תאים בודדים מופק ואת מנורמל (איור 2). כפי שניתן לראות מהעקבות בעוצמה פלורסצנטיות, ביתא-תאים בודדים להציג תנודות GCaMP6s זריחה על גירוי גלוקוז, אשר עוצר על גירוי אשלגן כלורי. הטכניקה מספק פתרון הסלולר הגלוקוז-ההיענות של הבטא-התא ואת חלון לתוך הפונקציונליות שלהם.
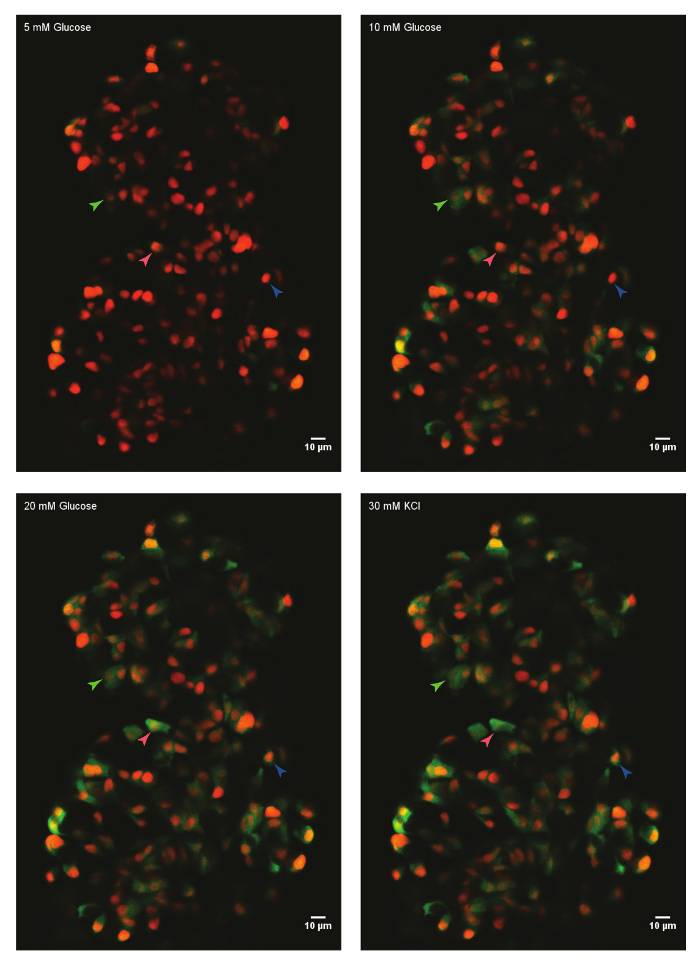
איור 1: Ex-vivo לחיות-הדמיה של זרם סידן באמצעות GCaMP6s בתאים-דג זברה בטא- איון הראשי של Tg(ins:nls-Renilla-mKO2); Tg(ins:GCaMP6s) דג זברה (45 dpf) היה רכוב של פיברינוגן-תרומבין עובש, מודגרות עם גלוקוז 5 מ מ (הבסיס). תאי בטא-תוויות עם גרעיני סמן אדום, ואילו GCaMP6s הוא נוכח לערוץ הצבע הירוק. איון הייתה מאולצת עם רמפה-גלוקוז המורכב הדגירה רציפים עם 10 מ מ, 20 מ מ D-גלוקוז, depolarized באמצעות התוספת של 30 מ מ. אשלגן כלורי. ראשי חץ לסמן פעילות אשר נותחו בטא-תאים בודדים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
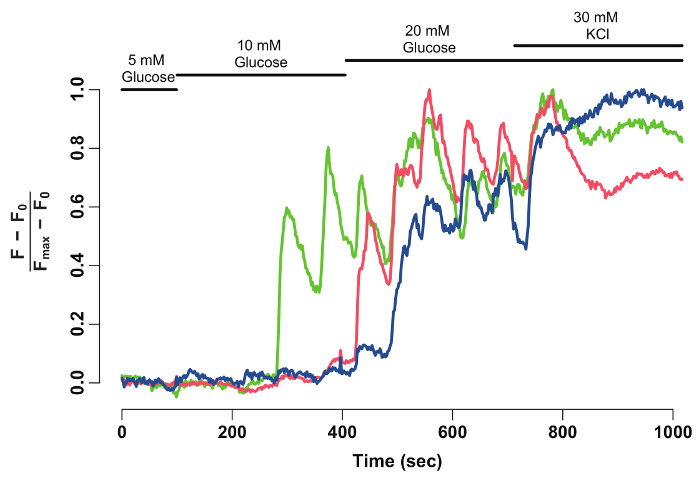
איור 2: מנורמל GCaMP6s קרינה פלואורסצנטית בעוצמה מעקב אחרי בטא-לתאים בודדים. מנורמל GCaMP6s קרינה פלואורסצנטית בעוצמה-מעקב עבור הבטא-התאים המסומנים ראשי חץ באיור1. ציר ה-x מציין את הזמן בשניות. בחלק העליון, ברים מתארים את ריכוז הגלוקוז, אשלגן כלורי במדיום HBSS. ציר ה-y מציין את עוצמת קרינה פלואורסצנטית מנורמל במהלך סדרת הזמן. בשביל זה, עוצמת בסיסית (F0) מחושבת עוצמת רשע בתקופת דגירה של גלוקוז 5 מ מ. זה יופחת מתוך נתוני זמן-סדרה שלמה (F - F0). הבסיס בעוצמה מעל זה מנורמל מאת העוצמה המקסימלית המוצגים על-ידי התא (F - F0) / (Fמקסימום- F0). המעקב מנורמל מראה מענה מתנדנדות של תאי ביתא-גלוקוז, אשר מייצבת כאשר התאים הם depolarized עם 30 מ מ אשלגן כלורי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כאן אנחנו מדגימים טכניקה עבור כימות של תאי בטא תגובתיות גלוקוז ברזולוציה תא בודד. זה התאפשר על ידי ניטור ריכוז הסידן תאיים באמצעות מחוון בקידוד גנטית סידן, GCaMP6s. פעילות תאי בטא היא הלכוד שמחוץ על ידי הרכבה של איון בתבנית פיברינוגן-תרומבין. שלב קריטי של הפרוטוקול הוא היציבות של העובש. מספיק זמן צריך להינתן עבור פיברינוגן להמיס הפתרון HBSS. בלי זה, כייר לא פולימריזציה מספיק כדי לספק יציבות במהלך הפגישה הדמיה. איון הוטענו פיברינוגן-תרומבין עובש, שקוע בתוך התא תרבות המדיה יכול להישאר בר קיימא לשבוע לפחות (נתונים לא מוצג). חלופות כייר פיברינוגן-תרומבין, כגון agarose נמוך-להמיס, יכול להיות מנוצל כדי לטעון את איון22. פרמטר קריטי נוסף הוא ניתוח איון. במהלך שלב זה, רקמות המקיפים את איון צריך להיות מוסר ללא ופצעו או תוקע איון. . הקרע מיומן מגיע עם תרגול.
מגבלה של פרוטוקול הדמיה הוא צמצום למישור קונאפוקלית אחד של איון. זה נעשה כדי ללכוד את הדינמיקה של סידן זרם בתוך ביתא-תאים בודדים. Z-מחסנית דרך כל עובי איון מוביל נמוך הדמיה מהירויות, לאבדן קשר מתנדנדות תאים בודדים. מגבלה זו יכולים להשתפר תוך שימוש באמצעים מהירים קונאפוקלית-הדמיה כגון מיקרוסקופ ספינינג-דיסק, כדי לאפשר את הדינמיקה סידן בממדים-3. גבול נוסף יהיה ויוו סידן הדמיה12. הטבע שקוף של דג זברה העובר או השימוש של פיגמנט-פחות זנים של דג זברה מבוגרים23 היתה לפתוח את האפשרות ויוו הדמיה בעתיד.
ההדמיה של פעילות תאי בטא ברזולוציה גבוהה יכולות מאפשר לחקור את הטרוגניות פונקציונלי בין ביתא-תאים בודדים. גישה זו יכולה לסייע לשפוך אור על קיומו של תאי בטא תת אוכלוסיות. לאחרונה, מחקרים רבים הראו קיומה של תת אוכלוסיות של תאי הבטא נומינלית הומוגנית24,25,26. Ex-vivo הדמיה ניתן לשלב עם כתבים גנטית כדי לאפיין מתגובה של תת-האוכלוסייה גלוקוז. בנוסף, שילוב של הגדרת הדמיה עם גירוי תרופתי יכול לאפשר להקרנה של תרכובות יכול לשפר את הפונקציונליות של תאי בטא.
לסיכום, הטכניקה המובאת כאן מאפשר כימות והשוואה בין התגובה גלוקוז בטא-לתאים בודדים. הוא מספק חלון ישירה לתוך תאי בטא פונקציונליות, פרמטר חשוב בהתפתחות סוכרת.
Disclosures
המחברים מצהירים אין אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים חברי המעבדה Ninov להערות על כתב היד, חברי מרכז למתקן דגים, מיקרוסקופיה דרזדן טיפולים משובי (CRTD) לקבלת סיוע טכני. N.N. נתמך על ידי מימון DFG-CRTD, אשכול התמחות TU-דרזדן, קרן מחקר גרמני (DFG) ואל מרכז גרמנית עבור סוכרת מחקר (DZD).
Materials
| Name | Company | Catalog Number | Comments |
| Transgenic Zebrafish line: Tg(ins:nls-Renilla-mKO2; cryaa:CFP); Tg(ins:GCaMP6s; cryaa:mCherry) | By request from authors | ||
| Stereo microscope | ZEISS | 495015-0001-000 | SteREO Discovery.V8 |
| Fluorescence lamp | ZEISS | 423013-9010-000 | Illuminator HXP 120 V |
| Red Filter Cube | ZEISS | 000000-1114-462 | Filter set 45 HQ TexasRed |
| Confocal Microscope | ZEISS | LSM 780 | |
| Bovine fibrinogen | Sigma | F8630 | |
| HBSS (Hanks' Balanced Salt solution) | ThermoFisher | 14025092 | |
| Thrombin | Sigma | T4648 | |
| D-Glucose | Sigma | G8270 | |
| KCl | Sigma | P9333 | |
| 35 mm diameter glass-bottom dishes | ThermoFisher | 150680 | |
| tricaine methane sulfonate | Sigma | E10521 | |
| Fine Forceps | Fine Science Tools | 11445-12 | |
| FIJI, using ImageJ Version: 2.0.0-rc-43/1.50e | https://fiji.sc/ | ||
| R, version 3.2.4 | https://www.r-project.org/ | ||
| RStudio | https://www.rstudio.com/ | ||
| plotcelltrace.R | A custom script provided with the manuscript |
References
- Kahn, S. E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 46 (1), 3-19 (2003).
- Ogurtsova, K., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 128, 40-50 (2017).
- Pipeleers, D. G. Heterogeneity in pancreatic beta-cell population. Diabetes. 41 (7), 777-781 (1992).
- MacDonald, P. E., Joseph, J. W., Rorsman, P. Glucose-sensing mechanisms in pancreatic beta-cells. Philos Trans R Soc Lond B Biol Sci. 360 (1464), 2211-2225 (2005).
- Hellman, B., et al. Glucose induces oscillatory Ca2+ signalling and insulin release in human pancreatic beta cells. Diabetologia. 37, S11-S20 (1994).
- Bergsten, P., Grapengiesser, E., Gylfe, E., Tengholm, A., Hellman, B. Synchronous oscillations of cytoplasmic Ca2+ and insulin release in glucose-stimulated pancreatic islets. J Biol Chem. 269 (12), 8749-8753 (1994).
- Wollheim, C. B., Pozzan, T. Correlation between cytosolic free Ca2+ and insulin release in an insulin-secreting cell line. J Biol Chem. 259 (4), 2262-2267 (1984).
- Pace, C. S., Price, S. Electrical responses of pancreatic islet cells to secretory stimuli. Biochem Biophys Res Commun. 46 (4), 1557-1563 (1972).
- Ohara-Imaizumi, M., Nakamichi, Y., Tanaka, T., Ishida, H., Nagamatsu, S. Imaging exocytosis of single insulin secretory granules with evanescent wave microscopy: distinct behavior of granule motion in biphasic insulin release. J Biol Chem. 277 (6), 3805-3808 (2002).
- Soria, B., Martin, F. Cytosolic calcium oscillations and insulin release in pancreatic islets of Langerhans. Diabetes Metab. 24 (1), 37-40 (1998).
- Kenty, J. H. R., Melton, D. A. Testing pancreatic islet function at the single cell level by calcium influx with associated marker expression. PLoS One. 10 (4), e0122044 (2015).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Bootman, M. D., Rietdorf, K., Collins, T., Walker, S., Sanderson, M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+ imaging. Cold Spring Harb Protoc. 2013 (2), 83-99 (2013).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Hesselson, D., Anderson, R. M., Beinat, M., Stainier, D. Y. R. Distinct populations of quiescent and proliferative pancreatic beta-cells identified by HOTcre mediated labeling. Proc Natl Acad Sci U S A. 106 (35), 14896-14901 (2009).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. coli nitroreductase. Mech Dev. 124 (3), 218-229 (2007).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat Protoc. 3 (6), 948-954 (2008).
- Singh, S. P., et al. Different developmental histories of beta-cells generate functional and proliferative heterogeneity during islet growth. Nat Commun. 8 (1), 664 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676 (2012).
- R Core Team. . R: A Language and Environment for Statistical Computing. , (2016).
- Friedman, R. S., et al. An evolving autoimmune microenvironment regulates the quality of effector T cell restimulation and function. Proc Natl Acad Sci. 111 (25), 9223-9228 (2014).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Bader, E., et al. Identification of proliferative and mature β-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Dorrell, C., et al. Human islets contain four distinct subtypes of β cells. Nat Commun. 7, 11756 (2016).
- Johnston, N. R., et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab. 24 (3), 389-401 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved