A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תרבות, תרביות תאים תאים ראשי דג זברה
In This Article
Summary
אנו מציגים פרוטוקול יעיל, קל לשימוש עבור הכנת תרביות תאים הראשי של דג זברה העוברים על תרביות תאים, תא חי הדמיה, כמו גם פרוטוקול להכין ראשי תאים מהמוח דג זברה למבוגרים.
Abstract
דג זברה עוברי שקופים ולפתח במהירות החוצה האמא, ובכך מאפשר עבור מעולה ויוו הדמיה של תהליכים ביולוגיים דינמי ב חוליות שלמים ולא המתפתח. עם זאת, ההדמיה מפורט של מורפולוגיות של סוגי תאים נפרדים ומבנים subcellular מוגבל כל טעינות. לכן, הקמנו פרוטוקול יעיל, קל לשימוש לתאים הראשי חיים בתרבות של דג זברה עוברי ורקמות למבוגרים.
בקצרה, 2 dpf דג זברה העוברים הם dechorionated, deyolked, עיקור, חלופה מועדפת על תאים בודדים עם collagenase. לאחר שלב סינון, התאים הראשי מצופה על גבי כלי הזכוכית התחתונה וטיפח במשך מספר ימים. תרבויות טריים, ככל ארוך המונח differenciated אלה, יכול לשמש עבור מחקרי הדמיה קונאפוקלית ברזולוציה גבוהה. התרבות מכיל סוגי תאים שונים, עם נייטרלים מפוספס, נוירונים להיות בולט על ציפוי פולי-L-ליזין. במיוחד תווית subcellular מבנים על-ידי סמן פלורסנט חלבונים, הקמנו גם פרוטוקול אלקטרופורציה המאפשר תרביות של תאים של פלסמיד DNA לתוך לסוגי תאים שונים, לרבות נוירונים. לפיכך, בנוכחות המפעיל מוגדר גירויים בהתנהגות התא מורכבת, הדינמיקה תאיים של ראשי דג זברה תאים יכול להידרש עם רזולוציה גבוהה יכולות. בנוסף, באמצעות המוח דג זברה למבוגרים, נדגים את הטכניקה המתוארת דיסוציאציה, וכן את התנאים הבסיסיים culturing, גם עובד בשביל דג זברה בוגרת רקמות.
Introduction
דג זברה (רזבורה rerio, rerio ד) הוא מודל פופולרי חוליות עבור שדות רבים של מחקר ביו-רפואי בסיסי1. דג זברה עוברי לפתח במהירות לשעבר עם רחם, שקוף, ובכושר תחת מיקרוסקופ, ובכך לספק תנאים מוקדמים מעולה ללימוד פיתוח חוליות אורגניזם חי. עקב ללקוחות שלנו גנטי של דג זברה2, קווים רבים כתב מהונדס יציב עם תא ביטוי ייחודיים לסוג של סמני פלורסנט שונים שהוקמו המאפשר התבוננות אוכלוסיות תאים מסוים. הקהילה דג זברה מציעה מגוון רחב של קווי Gal4-נהג כביכול הנושאות של transgene לבטא את Kal4TA4 סינתטי (או את GalFF KalTA3-שוות-ערך) ג'ין עם התחום Gal4-הדי-איגוד של שמרים התמזגו להפעלה תעתיק ויראלי דומיינים תחת השליטה של מוצרי טיפוח טבעיים ייחודיים לסוג התא. קווים אלה הנהג הם חצו לקווים אפקטור הנושאות transgenes המכיל המוגדר במעלה הפעלת רצף (UAS) דבוקה של גן מדווח. החלבון Kal4TA4 מאגד לרכיב UAS, ולכן מפעיל את הביטוי סלקטיבית סוג תא של3,גן4לכתב. גישה זו מאפשרת ללימודי קומבינטורית מאוד מגוונת של כמעט כל זמינות enhancer וכתבת אלמנטים בבעלי חיים כפול-הטרנסגניים.
עם זאת, מעמיק הדמיה בשידור חי עם דגש על תאים בודדים או התוכן subcellular שלהם מוגבל של העובר כל ומשתנה כל הזמן. כדי לטפל השאלות הביולוגיות תא ספציפי עם הרזולוציה הגבוהה, השימוש של תרביות תאים עדיפה לעיתים קרובות. כמה שורות תאים של דג זברה קיימים, אבל הם נחשבים בכבדות שנבחר5,6,7 , הפצת שלהם הוא לעתים קרובות גוזלת זמן. יתר על כן, כל הקווים תא זמינים הם פיברובלסט נגזר, הגבלת ניסויים באמצעות תרבית תאים לסוג אחד של תאים. לכן, הקמנו שתי פרוטוקול קל לשימוש ויעיל להכין ראשי תאים ישירות מן העוברים דג זברה והמוח דג זברה למבוגרים, יחד עם גישות להגדיל את תוחלת החיים של התרבות, להרחיב את המגוון של מעובדים סוגי תאים. בנוסף, אנו מציגים את הליך transfect תאים עובריים ראשי עם ביטוי בונה עבור סמני אברון פלורסנט. לפיכך, מורפולוגיות הסלולר ומבנים subcellular ניתן לנתח עם רזולוציה גבוהה יכולות סוגי תאים נפרדים אשר שומרים על תכונות המפתח שלהם.
Protocol
כל העבודה בעלי חיים המתואר כאן הוא בהתאם לתקנות משפטיות (האיחוד האירופי-הוראה 2010/63). תחזוקה וטיפול של דגים אושרה על ידי הרשויות המקומיות ועל ידי את רווחת בעלי חיים נציג האוניברסיטה הטכנולוגית של בראונשווייג ואת התחתון סקסוניה המדינה במשרד של הגנת הצרכן בטיחות המזון (LAVES, אולדנבורג, גרמניה; Az. §4 (02.05) TSchB TU BS).
1. הכנת ראשי תאים מעוברים דג זברה
- הכנה של 2 ימים פוסט הפריה (dpf) העוברים דג זברה
- יום 1: להגדיר את מספר המעברים של המתח דג זברה של בחירה, בהתאם למפרטים של מנהל המתקן שלך דג זברה8.
- יום 2: חבר דגים ולאסוף ביצים8 ישירות לאחר להשרצתם in 10 ס מ פטרי (פלסטיק). הסר את הביצים מת או מזוהמים עם פיפטה פסטר (פלסטיק). לשטוף ביצים 1 x עם 30% (5.8 מ מ נתרן כלורי, אשלגן כלורי 0.07 מ מ, 0.04 מ מ מגנזיום גופרתי, 0.06 מ"מ סידן חנקתי, חומצה 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic 5 מ מ, pH 7.2) Danieau8 עם כחול מתילן 0.0001% (w/v). להחליף את המדיום כדי Danieau 30% ללא מתילן כחול, כיוון מתילן כחול עלולה לגרום autofluorescence, דגירה הביצים במשך הלילה ב 28 º C.
הערה: להתחיל עם מינימום של 100 ביצים לשורה דגים על מנת לקבל כמות מספקת של תאים. לא להעלות יותר מ-150 העוברים בתוך צלחת פטרי אחת. - יום 3: הסר עוברי מת או מזוהמים ולהחליף המדיום כדי Danieau 30%. לקבוע את מספר העוברים על ידי ספירת. דגירה העוברים בין לילה ב 28 º C.
הערה: בעת שימוש קו הטרנסגניים לבטא כתב פלורסנט, ייתכן ההקרנה 1 dpf או 2 dpf שיהיה צורך.
הערה: לקבלת כמויות גדולות יותר של העוברים, מומלץ לקחת תמונה בשחור-לבן של הפטרי בהתאמה (איור 1 א') ו לכמת את מספר העוברים עם תוכנה הדמיה. - יום 4: העוברים נמצאים כעת 2 dpf. כדי להסיר את chorions, להוסיף 1 מ"ל pronase עם ריכוז של 1 מ"ג/מ"ל 10 מ"ל של 30% Danieau8 , דגירה העוברים על מטרף בטמפרטורת החדר עד chorions כל משפחתי (20-40 דקות תלוי בטמפרטורת הסביבה). תשטוף עם Danieau 30% כדי להסיר הן pronase והן chorions ולשמור עוברי בטמפרטורת החדר עד שימוש נוסף.
- הכנת מאכלים התחתון לשימוש חוזר פולי-L-ליזין מצופה זכוכית
הערה: כלי הזכוכית זמינים מסחרית התחתון מיועדים לשימוש יחיד בלבד ולא יקרים. ההליך הבא מתאר כיצד להכין מאכלים התחתון זכוכית מתוצרת עצמית לשימוש חוזר מחומרים מעבדה סטנדרטיים.- לקדוח חור בקוטר של 10 מ"מ לתוך החלק התחתון של תא סטנדרטי תרבות מנות (קוטר 6 ס"מ, פלסטיק) (איור 1B). לשטוף צלחת תחתית ביסודיות עם מים מהברז להסיר אבק קידוח.
- התפשטה גריז סיליקון סביב החור על החלק התחתון של תחתית צלחת, לצרף את coverslip באמצעות השמן כמו דבק. ודא כי המשחה חותמות הפער בין צלחת התחתון coverslip.
הערה: ודא כי העובי של coverslips בשימוש המתאימות ליישום הדמיה מאוחר יותר. - מדיח כלים תחתון זכוכית מתוצרת עצמית ביסודיות, אבל בזהירות, עם מי ברז קרים וסבון. לשטוף את כלי הזכוכית התחתונה שלוש פעמים עם מים יונים כדי להסיר את הסבון. מילה נהדרת העפעפיים צלחת, צלחת תחתית ולאחסן אותם בקופסא נקייה עד להמשך השימוש.
- ביום של תרבות הכנה (יום ד', ראה 1.1.4): להרטיב את החלק הפנימי של שניהם לחלק את העפעפיים ואת צלחת תחתית עם אתנול 70% (v/v). למקם את העפעפיים צלחת, צלחת תחתית כלפי הצד הפנימי מעלה ב ספסל עבודה סטרילית עם זרימה שכבתית, אור UV. מילה נהדרת עד האתנול הוא התאדה, ולאחר מכן להחיל אולטרא סגול במשך 20 דקות. לאחר טיפול זה, מאכלים מורכבים, נחשב סטרילי.
- לציפוי, פיפטה µL 200 של פולי-L-ליזין (0.1 mg/mL) במרכז כל צלחת תחתית זכוכית ולהפיץ את הנוזל על coverslip על ידי שבירת מתח עם טיפ פיפטה. לתת להתייבש במשך 60 דקות ולאחר מכן לשטוף 1 x 1 סטרילי x באגירה פוספט תמיסת מלח (PBS). הסר את הנוזל. לשמור מנות תחת הספסל עד שימוש נוסף.
הערה: ציפויים אחרים עשוי להיבדק בהתאם מטרת הניסוי. מצאנו פולי-L-ליזין כדי לתמוך את הצמיחה של נוירונים, ואילו מטופלים פלסטיק ללא כל ציפוי נוסף הופיע לטובת צמיחת תאי פיברובלסט דמוי (איור 1E, F).
הערה: כלי הזכוכית מתוצרת עצמית התחתון ניתן להשתמש פעמים רבות. להחליף את coverslip, לשטוף עם מים חמים מהברז, בזהירות לנתק את coverslip ולהסיר גריז הנותרים עם אתנול 70% (v/v) וסבון.
- ציפוי של ראשי תאים והכנה
- ביום של תרבות הכנה (יום ד', ראה 1.1.4): העברת העוברים לתוך תבשיל תרבות תא סטרילי (בקוטר 6 ס מ) באמצעות פיפטה פסטר פלסטיק טריים. להסיר את הנוזל step-wise עד כל העוברים מכונסים במקום משלוח גדול בקוטר של-2 ס מ או פחות.
- מקם את המנה עם העוברים על הספסל עבודה סטרילית ולהוסיף CO2-בינוני עצמאית (בתוספת 10% (v/v) בפילטר סרום שור, 1-גלוטמין ו- 1.2% (v/v) 10,000 U פניצילין-סטרפטומיצין; בינוני עם כל תוספי נמצא הבאות המכונה "תא תרבות בינוני") עד המנה מלא למחצה.
הערה: חלופות CO2-עצמאית בינוני עשוי להיבדק בהתאם מטרת הניסוי, כמו לדוגמה neurobasal בינוני, בינוני DMEM או L-15 בינונית של ליבוביץ. CO2-בינונית עצמאית, L-15 בינוני של ליבוביץ יש את היתרון של לא דורש חממה2 CO. - כדי להסיר את החלמון, פיפטה העוברים לאורך באמצעות טיפ µL 200-פיפטה. ניתן לזהות deyolking מוצלחת מאת ערפול של המדיום.
- למלא לצלחת תרבות תא עם אתנול 70% (v/v), תבשיל תרבות תא אחר תא טריים תרבות בינונית. השתמש טיפ µL-פיפטה ניתוק 1,000 להעברת העוברים לתוך מסננת סטרילית תא עם ידית (מיקרומטר 40; איור 1C). קח את מסננת בידית וטובל לתוך קערה עם אתנול כך כל העוברים טובע עבור 5 s. מיד לאחר מכן, להטביע את מסננת עם עוברי בצלחת תא טריים תרבות בינונית.
הערה: תא strainers יכול להיות שימוש חוזר מספר פעמים. לנקות עם מברשת רכה תחת ברז מים זורמים, חנות איתם אתנול 70% ויבש UV-פינוק אותם תחת העבודה סטרילי הספסל ישירות לפני השימוש (ראה גם 1.2.4). - העברת העוברים לתוך צינורות התגובה mL 1.5 סטרילי (כ 100 העוברים בצינור אחד). להוסיף collagenase (סוג 2) מדולל במדיום התרבות התא כדי ריכוז סופי של 4 מ"ג/מ"ל בהנפח הכולל של 1 מ"ל. דגירה צינורות עם העוברים על מסובב צינור אנכי מהפכות 30 כל דקות למשך 45 דקות בטמפרטורת החדר.
- מביצועם הנותרים גושים תא על-ידי pipetting את התערובת העובר-collagenase למעלה ולמטה עם טיפ µL 1,000-פיפטה. לאחר מכן לסנן התליה תא דרך מסננת סטרילית תא עם חריץ אוורור (מיקרומטר 40; איור 1D) לתוך צינור חרוטי 50 מ. יש לשטוף את מסננת עם-10 מ"ל של התא טריים תרבות בינוני.
- גלולה תאים על ידי צנטריפוגה למשך 3 דקות ב x 180 גרם. בגדר עשוי להיות בלתי נראים. בזהירות להסיר את תגובת שיקוע, resuspend את התאים 200 µL תא טריים תרבות בינוני לכל העוברים בשימוש במקור 30.
הערה: כדי להשיג גלולה גלוי, מומלץ להתחיל עם מינימום של 100 עוברי. - פיפטה µL 200 של התליה תא שהושג בשלב 1.3.7 ישירות על האזור זכוכית של צלחת התחתון פולי-L-ליזין-מצופה זכוכית מתוצרת עצמית (ראה 1.2). תקופת דגירה של 60 דקות בטמפרטורת החדר תחת הספסל עבודה סטרילית. להוסיף 6 מ של התא טריים תרבות בינוני, דגירה ראשי תאים על 28 מעלות צלזיוס.
- לבצע את היישום הרצוי הדמיה באמצעות מיקרוסקופ הפוכה ב 28 º C. חילופי המדיום תרבות תא מדי יום. תרבויות יכול לשמש עבור הדמיה במשך מספר ימים לאחר ציפוי (dap).
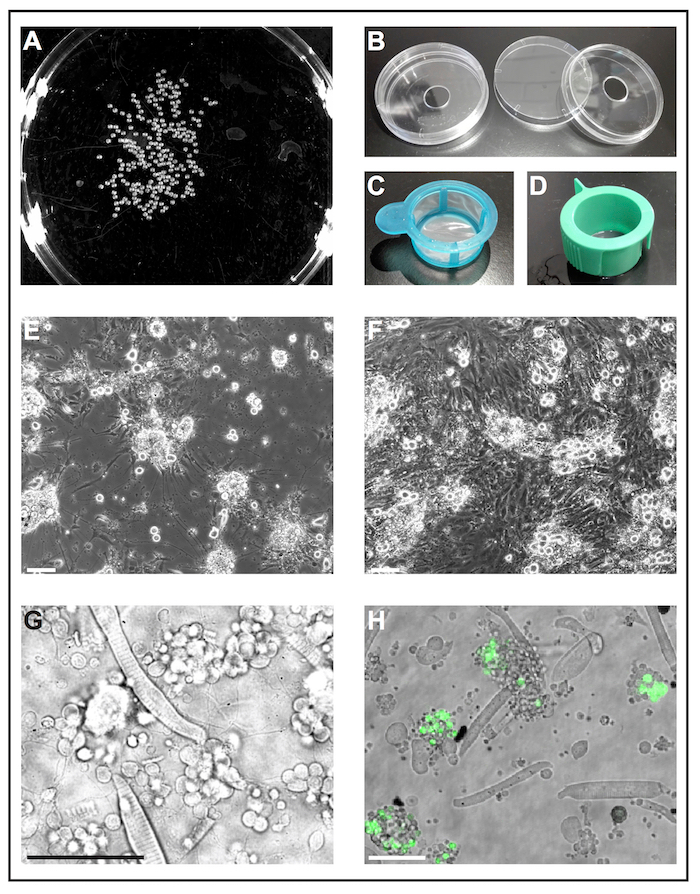
איור 1: התרבות התא העיקרי של דג זברה עוברי. (א) תמונה בשחור-לבן של 1 dap עוברי, אשר יכולים להיות מעובדים על ידי כלי תוכנה כדי לנתח את מספר העוברים. (B) תא תרבות מנות (בקוטר 6 ס מ) עם חור קדח (בקוטר 10 מ מ) משמשים להכין מאכלים התחתון לשימוש חוזר זכוכית מתוצרת עצמית. (ג) strainers תא (40 מיקרומטר) עם ידית פשוטים משמשים "נחיתה רשתות" כדי לטבול deyolked העוברים בתוך אתנול וכדי להעביר אותם במהירות בינונית תרבות תא טריים. (ד) תא strainers (40 מיקרומטר) עם אוורור חריצי משמשות לסינון תאים לאחר דיסוציאציה בתיווך collagenase. (E) לאחר 5 dap, ראשי תאים נזרע על הזכוכית מצופה פולי-L-ליזין בעיקר בצורת נוירונים עם סיומות בולטת. סרגל קנה מידה = 100 מיקרומטר. (F) לאחר 5 dap שטופלו פלסטיק ללא ציפוי, כמו פיברובלסט תאים והדבר התרבות. סרגל קנה מידה = 100 מיקרומטר. (E) ו- (F) נרכשו על ידי מיקרוסקופ פלורסנטי. (G) המועברות תמונת אור של ראשי תאים שמקורם פראי סוג דג זברה-1 dap. נייטרלים מפוספס, אשכולות של נוירונים הארכת תהליכים דק, ניתן בקלות לצפות. סרגל קנה מידה = 50 מיקרומטר. (H) תאים בתרבית של הקו הטרנסגניים Tg (ptf1a: eGFP) jh1, אשר מבטאת eGFP עצביים המוצא לאגס התרבותי בעיקר GABAergic נוירונים ב- hindbrain, תת-קבוצה של תאים ברשתית אוכלוסיות29, 30 , 31. סולם בר = 50 מיקרומטר. (G) ו- (H) נרכשו על ידי לייזר קונפוקלי מיקרוסקופ באמצעות הכלים התחתון זכוכית עשוי כמופיע ב (B) סורק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
2. תקנים של ראשי תאים עם פלסמיד דנ א
- Resuspend בפילטר וצעד מגורען תאים להשיג 1.3.7 ב- PBS 1 x במקום תא תרבות בינוני. כתם של aliquot של התליה תא עם Trypan Blue כדי לקבוע את המספר הנייד ב- הקאמרית ספירה9.
- מערבבים 0.5 מיליון תאים עם 10 µg אולטרה טהור פלסמיד DNA בשפופרת התגובה 1.5 mL ולכוונן את העוצמה הכוללת כדי µL 100 עם 1 x PBS.
הערה: לניסויים שלנו, בעיקר השתמשנו בונה ביטוי המבוסס על פלסמיד pCS2 +10. הביטוי של מסגרות קריאה פתוחה משובטים לתוך האתר שיבוט מרובים של pCS2 + הוא מונע על ידי האמרגן בכל מקום של cytomegalovirus אנושי (יזם CMV). אחרים בונה הביטויים, היזמים עשוי להיבדק (ראה גם נציג תוצאות, איור 2 ו- 3). - שילוב העברה הדי התא מיד cuvette אלקטרופורציה (0.4 ס מ), למקם את cuvette המכשיר אלקטרופורציה electroporate עם ההגדרות הבאות: דופק חד פעמית, דעיכה מעריכית, 280 V, 950 µF.
- ישירות לאחר אלקטרופורציה, להעביר את התמהיל תא-DNA לתוך צינור התגובה 1.5 mL עם 300 µL תא טריים תרבות בינוני.
- צלחת µL 200 של התליה תא כפי שמתואר 1.3.8 והמשך כמתואר 1.3.9 בהתאם הבונה ביטוי בשימוש, ביטוי של חלבונים פלורסנט ייתכן לזיהוי אחרי כמה שעות או יום למחרת.
3. צביעת תאי ראשי קבוע
הערה: מבנים Subcellular גם ניתן לאבחן על ידי immunostaining קלאסי במקום להשתמש כתבים חלבון פלואורסצנטי פיוז'ן. עבור תאים ראשי דג זברה, אנו משתמשים הפרוטוקול הסטנדרטי הבאים כדי מופת הכתם גרעין, F-אקטין טובולין acetylated עם סמנים פלורסנט.
- צלחת תאים על פולי-L-ליזין מצופה שער גולשת הניח בצלחת תא תרבות התבשיל או multiwell כפי שתואר לעיל (ראה 1.3.8).
- לתיקון, להסיר את המדיום, לכסות את התאים עם 4% paraformaldehyde ב 1 x PBS. דגירה התאים 10 דקות ב 4 ° C-מטרף. שטיפת תאים x 3 עבור חמש דקות כל עם 1 x PBS בטמפרטורת החדר. ודא כי טוב, מגניב 1 x מכסה את התאים לגמרי ותבצע את הפעולות כביסה על מטרף.
- כדי לחסום כדי permeabilize את התאים קבוע, לכסות את התאים עם PBS 1 x המכיל חלב רזה 5% ו- 0.3% טריטון X-100. מקם את התאים עבור 10 דקות בטמפרטורת החדר על מטרף. רחץ תאים כמתואר ב- 3.2.
- להוספת תווית acetylated טובולין, סמן אקסונים11, לדלל את 1:2,000 נוגדן ראשוני ב- PBS x 1 המכיל חלב רזה 1%. מכסה את התאים עם הפתרון הזה, דגירה אותם במשך הלילה ב 4 ° C-מטרף. -למחרת, לשטוף תאים כמתואר ב- 3.2.
- לדלל הנוגדן משני מצומדת עם בטחונות isothiocyanate (FITC) fluorescein fluorochrom ירוק ב- PBS 1 x המכיל 1% חלב רזה, דגירה התאים עם פתרון זה לשעה בטמפרטורת החדר בחושך (לכסות את המנה למשל עם קופסא או רדיד אלומיניום) על מטרף. רחץ תאים כמתואר ב- 3.2.
- כתם בו זמנית את שלד התא אקטין ואת הגרעינים, דגירה התאים ב- PBS 1 x בתוספת Phalloidin12 מצומדת עם fluorochrome של אדום (1:50), 4', 6-diamidino-2-phenylindole (דאפי)13 (100 ng/mL) למשך 10 דקות בחדר טמפרטורה בחושך על מטרף. רחץ תאים כמתואר ב- 3.2.
- כדי להתכונן תאים הדמיה, שם נשא אובייקט זכוכית (שקופיות מיקרוסקופ) על משטח נקי ומניחים על טיפה של הרכבה בינונית על זה. קחו פתק כיסוי עם תאים קבוע, מיטה מתוך צלחת באמצעות מלקחיים ומניחים אותו על הירידה עם תאי מול המוביל אובייקט. ודא שאותה מדיום הרכבה משתרעת על כל האזור של תגית כיסוי. תן יבש בחושך.
- חנות קבועה, רכוב תאים בחושך ב 4 ° C עד מבוצעת הדמיה היישום הרצוי.
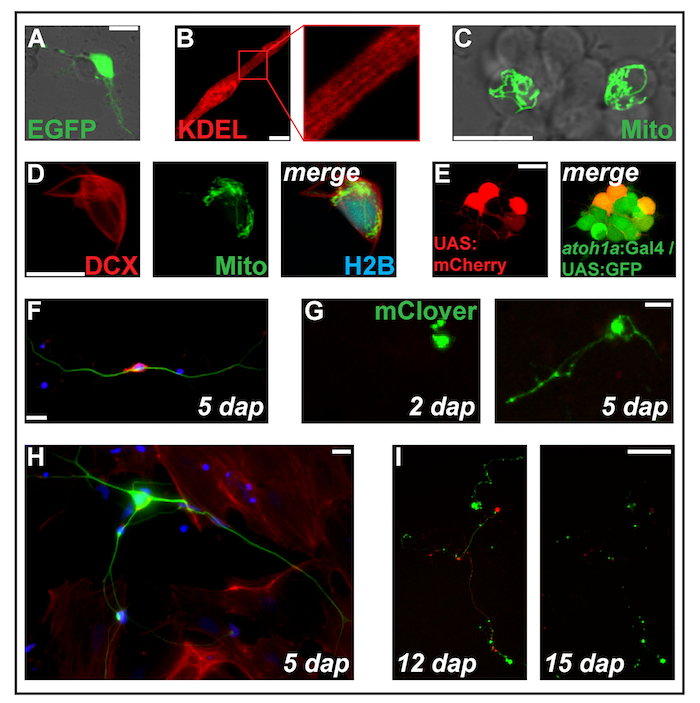
איור 2: תקנים של ביטוי בונה על ידי אלקטרופורציה. (א) Putative נוירון transfected עם מחשבים-eGFP-1 dap. Myocyte מפוספס (B) (2 dap) לבטא את החלבון, ממוקדות רשתית תוך-פלזמית ss-RFP-KDEL. (ג) שני נוירונים בתוך מקבץ עצביים transfected עם מחשבים-MitoTag-YFP-2 dap. (ד) תא (2 dap) טריפל-transfected עם מחשבים אישיים-DCX-tdTomato, מחשבים-MitoTag-YFP ומחשבים-ויזת עבודה H2B-mseCFP. PSK (E)-UAS:mCherry electroporated לתוך התאים הראשי (1 dap) נגזר מן העוברים כפול-הטרנסגניים נושאת את transgenes Tg (atoh1a: Gal4TA4) hzm222 ו- Tg (4xUAS:KGFPGI) hzm332 וכתוצאה מכך GFP ביטוי עצביים המוצא לאגס התרבותי hindbrain. גודל ברים = 10 מיקרומטר. (A-E) נרכשו על ידי לייזר קונפוקלי סורק מיקרוסקופ באמצעות הכלים התחתון זכוכית עשוי כמופיע ב איור 1B. (F) פלורסנט מכתים של נוירונים העיקרי דג זברה קבוע בחמש dap. כחול: דאפי (גרעין); אדום: Phalloidin (F-אקטין); ירוק: Acetylated טובולין (נוירונים). סרגל קנה מידה = 10 מיקרומטר. (G) נוירון דמוי תא transfected עם מחשבים אישיים-מק'לאבר. -2 dap, ללא סיומת הוא גלוי. ב-5 dap, מבנה דמוי neurite הקימה. סרגל קנה מידה = 25 מיקרומטר. (H) נוירון של הכנת אותו כמו בתא (F), מוקף כמו fibroblasts תאים. סרגל קנה מידה = 10 מיקרומטר. (אני) נוירון נגזר של העובר הטרנסגניים נושאת את transgene Tg (XITubb: DsRed) zf14828 transfected עם מחשבים אישיים-מק'לאבר. בין 12 ו- 15 dap, neurites לעבור ניוון מסיבית. סרגל קנה מידה = 100 מיקרומטר. תאים שמוצג (F-אני) היו נזרע על פולי-L-ליזין מצופה זכוכית (F, H) או פלסטיק (G, אני), מעובדים L-15 בינוני בנוכחות 10% בפילטר סרום שור ו תוספת עצביים B-27 (מדולל 1:50), עם תמונה עם מיקרוסקופ פלורסנטי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
4. הכנת ראשי תאים מהמוח דג זברה למבוגרים
-
המוח החילוץ
- בחר של דג בוגר לפחות 90 יום של גיל. אם נדרש לעבוד עם סוג תא מסוים, בחר קו מהונדס שבו כתב פלואורסצנט תאים ספציפיים ביטוי יאפשר להציג באופן חזותי את התאים הרצויים.
- מקם את הדגים בתוך מלא עם 200 מ של הרדמה Tricaine8 (0.2%) Danieau 30%. המתן עד הדג יפסיק לזוז. לטבול את הדגים anesthetized בתוך מלא 200 מ ל מים קרח למשך 15 דקות להרדים אותו.
- למלא צלחת פטרי (בקוטר 6 ס מ) עם אתנול 70% (v/v). להחזיק את הדגים בזנב עם זוג מספריים וטובל לתוך האתנול. להבטיח הדג לגמרי שקוע אתנול עבור 5 s.
- לחלץ את המוח לפי הפרוטוקול של גופטה, מולינס14 עם adaptions הבאים: להשתמש רק בכלים בלוק או סטרילי וגדוש ומנתחים בראש ב- PBS x 1 סטרילי.
- ישירות לאחר החילוץ, למקם את המוח בצלחת פטרי (בקוטר 3 ס מ) מלא עקר 1 x PBS ולעבור המנה תחת הספסל עבודה סטרילית של תרבית תאים.
-
המוח דיסוציאציה, ציפוי של ראשי תאים
- מקום שני סטים של פינצטה סטרילי (בלוק), צלחת פטרי סטריליות (בקוטר 6 ס מ) מלא 70% (v/v) אתנול, צלחת פטרי סטריליות (בקוטר 10 ס מ) מלא L-15 בינוני של ליבוביץ בתוספת 10% (v/v) בפילטר סרום שור, B-27 (1:50) ו- 1.2% (v / v) פניצילין U 10,000-סטרפטומיצין, מסננת סטרילית תא אחד עם ידית (מיקרומטר 40; איור 1C) תחת הספסל נקי.
- המקום מסננת תא לתוך הפטרי מלא עם אתנול ולהבטיח רמת נוזלי הוא גבוה יותר מאשר החלק התחתון של מסננת לפחות 5 מ.
- באמצעות הקבוצה הראשונה של פינצטה, להעביר את המוח לתוך מסננת כבר הכניסו האתנול ולהבטיח שהוא מכוסה במלואה על ידי הנוזל. לאחר 1 s, העברת מסננת עם המוח לתוך הפטרי המכיל אמצעי L-15 של ליבוביץ עם לעיל תיאר תוספי מזון.
- שימוש בערכה השניה של פינצטה, העברת המוח לתוך צינור התגובה mL 1.5 סטרילי מלא L-15 בינוני של ליבוביץ µL 500 עם לעיל תיאר תוספי מזון. להוסיף collagenase (סוג 2) ריכוז סופי של 4 מ"ג/מ"ל בהנפח הכולל של 1 מ"ל.
- דגירה הצינור ב rotator צינור אנכי מהפכות 30 כל דקות למשך 35 דקות בטמפרטורת החדר. מכנית מביצועם כגיהנום הרקמה הנותרת על-ידי pipetting למעלה ולמטה באמצעות טיפ פיפטה 1,000 µL כדי לסייע בתהליך דיסוציאציה.
- לעצור את הדיסוציאציה כאשר אין חלקיקי גלוי להישאר בפתרון. לסנן את המתלים תא דרך מסננת סטרילית תא עם חריץ אוורור (מיקרומטר 40; איור 1D) לתוך צינור חרוטי 50 מ. יש לשטוף את מסננת עם-10 מ"ל של התא טריים תרבות בינוני.
הערה: כאשר לתא בודד ההשעיה מושגת, השלב הסינון אינה במידת הצורך כמו במקרה של דיסוציאציה עוברי. המוח הוא רקמה רכה וזה ככזו נוטים יותר להיות חלופה מועדפת homogeneously לתוך תא בודד ההשעיה. - גלולה תאים על ידי צנטריפוגה למשך 5 דקות ב x 180 גרם , resuspend בגדר תא לתוך 1 מ"ל של ליבוביץ טרי בינוני L-15 עם תוספי שתואר לעיל.
- פיפטה 500 µL תא השעיה (50% מהתאים שהושג) על צלחת תחתית מתוצרת עצמית פולי-L-ליזין מצופה זכוכית אחת (ראה 1.2) או בטוב של צלחת 24-. טוב. להקטין במקרה של משטחים קטנים יותר (קרי, 125 µL פתרון טוב של צלחת 96-ובכן). תקופת דגירה של 60 דקות בטמפרטורת החדר תחת הספסל עבודה סטרילית. לאחר מכן להוסיף נפח נחוץ בינוני טריים כדי למלא את המיכל ספציפיים, דגירה ראשי תאים על 28 מעלות צלזיוס.
- לבצע את היישום הרצוי הדמיה באמצעות מיקרוסקופ הפוכה ב 28 º C. תרבויות יכול לשמש עבור הדמיה במשך מספר ימים לאחר ציפוי. להחליף 50% של המדיום על בסיס יומי.
תוצאות
איור 1 ג'י מציג תמונת אור המשודרת של תרבות טיפוסי נגזר פראי סוג העוברים עם נייטרלים מפוספס, אשכולות של נוירון כמו תאים הנפוץ ביותר. כדי לזהות את סוגי תאים מסוימים בקלות רבה יותר, יכול להיות קו הטרנסגניים עם תא ביטוי ייחודיים לסוג של החלבון הניאון משמש (
Discussion
להלן מוצגים שני פרוטוקולים שונים לתאים ראשי תרבות 2 dpf דג זברה עוברי או דג זברה בוגרת המוח.
הכנת תרביות תאים הראשי של דג זברה dpf 2 קל יחסית לבצע עבור מישהו עם ניסיון בטכניקות התרבות התא הבסיסי. עם זאת, כדי להשיג תוצאות טובות לשחזור, מספר מספיק של עוברי כמתחילה חומר חיוני (100 הוא ה...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים Fritsch ט, א וולף-Asseburg, אני לינדה, ש- M. Tokarski טיפול בבעלי חיים מעולה ותמיכה טכנית. אנו אסירי תודה לכל חברי המעבדה Köster לדיונים אינטנסיבי ויעיל. אנו להכיר בהכרת תודה ממימון של פתוח (KO 1949/5-1) ובין המדינה הפדרלית סקסוניה התחתונה, Niedersächsisches Vorab (VWZN2889).
Materials
| Name | Company | Catalog Number | Comments |
| Fish lines | |||
| AB (wild-type) | established by Streisinger and colleagues, available from the Zebrafish International Resource Center (ZIRC) | ||
| Tg(ptf1a:eGFP)jh1 | stable transgenic line in which the enhancer of the zebrafish gene ptf1a drives expression of the fluorescent protein EGFP (Parsons et al., 2007) | ||
| Tg(XITubb:DsRed)zf148 | stable transgenic line in which the Xenopus neural-specific beta tubulin promoter drives expression of the fluorescent protein DsRed (Peri and Nüsslein-Volhard, 2008) | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| centrifuge | Eppendorf | model 5804 R | |
| ChemiDoc MP imaging system | BioRad | model XRS+, used to acquire black-and-white images of Petri dishes containing 1 da embryos | |
| confocal laser scanning microscope | Leica microsystems | model SP8, equipped with 28 °C temperature box and a 63X objective | |
| epifluorescent microscope | Leica microsystems | model DM5500B, equipped with 28 °C temperature box and a 40X objective | |
| Gene Pulser Xcell with capacitance extender | BioRad | 1652661 | electroporation device |
| Horizontal shaker | GFL | model 3011 | |
| incubator for cell culture (28 °C) | Memmert | model incubator I | |
| incubator for embryos (28 °C) | Heraeus | type B6120 | |
| light microscope | Zeiss | model TELAVAL 31 | |
| micro pipettes | Gilson | ||
| sterile work bench | Bio Base | with laminar flow and UV light | |
| tweezers | Dumont | Style 5, Inox | |
| vertical tube rotator | Labinco B.V. | model LD-79 | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Image Lab Software | BioRad | for the ChemiDoc MP imaging system from BioRad | |
| ImageJ | National Institutes of Health | used for counting 1 dpf embryos by applying the Count particles-tool to the respective black-and-white images; Rasband, W.S., ImageJ, U. S. National Institutes of Health, Bethesda, Maryland, USA, https://imagej.nih.gov/ij/. (1997-2016). | |
| LAS X | Leica Microsystems | for both confocal and epifluorescent microscopes from Leica Microsystems | |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| pCS-DCX-tdTomato | Köster Lab | # 1599 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-eGFP | Köster Lab | # 7 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-H2B-mseCFP | Köster Lab | # 2379 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-mClover | Köster Lab | # 3865 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-MitoTag-YFP | Köster Lab | # 2199 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-ss-RFP-KDEL | Köster Lab | # 4330 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pCS-VAMP1-mCitrine | Köster Lab | # 2291 | based on the backbone pCS2+ (Rupp et al., 1994) |
| pSK-UAS:mCherry | Köster Lab | # 1062 | based on the pBluescript-backbone of Stratagene |
| Plasmid numbers refer to the database entries of the Köster lab. Plasmids are available upon request. | |||
| Name | Company | Catalog Number | Comments |
| Plastic and glass ware | |||
| BD Falcon Cell Strainer (40 µm) | FALCON | REF 352340 | distributed by BD Bioscience, used as “landing net” to dip deyolked embryos into ethanol and to transfer them quickly to fresh cell culture medium |
| 1.5 mL reaction tubes | Sarstedt | 72690550 | |
| 24-well plate | Sarstedt | 83.3922 | |
| 50 mL falconic tube | Sarstedt | 62.547.004 | |
| 96-well plate | Sarstedt | 83.3924.005 | |
| EasyStrainer (40 µm) | Greiner Bio-One | 542 040 | with venting slots; used to filter cells after collagenase-mediated dissociation |
| electroporation cuvette (0.4 cm) | Kisker | 4905022 | |
| glass coverslips | Heinz Herenz Medizinalbedarf GmbH | 1051201 | |
| Microscope slides | Thermo Fisher Scientific (Menzel Gläser) | 631-0845 | |
| Neubauer chamber | Henneberg-Sander GmbH | 9020-01 | |
| Pasteur pipettes (plastic; 3 mL) | A. Hartenstein | PP05 | |
| Petri dishes (plastic; diameter 10 cm) | Sarstedt | 821473 | for zebrafish embryos |
| pipette tips | Sarstedt | Blue (1000 µl): 70762; Yellow (200 µl): 70760002; White (10 µL): 701116 | |
| sterile cell culture dishes (plastic; diameter 3 cm) | TPP Techno Plastic Products AG | 93040 | |
| sterile cell culture dishes (plastic; diameter 6 cm) | Sarstedt | 72690550 | |
| sterile Petri dishes (plastic; diameter 10 cm) | Sarstedt | 83.3902 | for brain dissection |
| Name | Company | Catalog Number | Comments |
| Chemicals and Reagents | |||
| sodium chloride | Roth | 0601.1 | |
| 4 % paraformaldehyde in 1x PBS | Sigma-Aldrich | 16005 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| calcium nitrate tetrahydrate | Sigma-Aldrich | C1396 | |
| ethanol p.a. 100% | Sigma-Aldrich | 46139 | |
| goat α-mouse IgG (Fc specific) FITC conjugated | Thermo Fisher Scientific | 31547 | |
| HEPES | Roth | 9105.4 | |
| high vacuum grease | DOW CORNING | 3826-50 | silicon grease used for self-made glass bottom dishes |
| magnesium sulfate heptahydrate | Merck | 105886 | |
| methylene blue | Serva | 29198.01 | |
| Monoclonal Anti-Tubulin, Acetylated antibody | Sigma-Aldrich | T6793 | |
| Aqua-Poly/Mount (mounting medium) | Polyscience | 18606 | |
| poly-L-lysine | Biochrom | L 7240 | |
| potasssion chloride | Merck | 104938 | |
| Skim milk | Roth | 68514-61-4 | |
| Texas Red-X Phalloidin | Thermo Fisher Scientific | T7471 | |
| Tricaine | Sigma-Aldrich | E10521 | Synonym: Ethyl 3-aminobenzoate methanesulfonate |
| Triton X-100 | BioRad | 1610407 | |
| Trypan Blue | Gibco by Life Technologies | 15250061 | |
| Name | Company | Catalog Number | Comments |
| Enzymes | |||
| collagenase (Type 2) | Thermo Fisher Scientific | 17101015 | dissolve powder in cell culture medium (8 mg/mL) and sterile-filter the solution, store aliquots at -20 °C |
| pronase (from Streptomyces griseus) | Roche | 11459643001 | distributed by Sigma-Aldrich, dissolve in 30% Danieau (10 mg/mL) and store aliquots at -20 °C |
| Name | Company | Catalog Number | Comments |
| Medium and solutions for cell culture | |||
| 1x PBS (Dulbecco's Phosphate Buffered Saline) | Gibco by Life Technologies | 14190-169 | distributed by Thermo Fisher Scientific |
| CO2-independent medium | Gibco by Life Technologies | 18045054 | distributed by Thermo Fisher Scientific |
| filtrated bovine serum (FBS) | PAN-Biotech | individual batch | |
| glutamine 100x | Gibco by Life Technologies | 25030081 | distributed by Thermo Fisher Scientific |
| Leibovitz's L-15 medium | Gibco by Life Technologies | 11415049 | distributed by Thermo Fisher Scientific |
| PenStrep (10,000 U/mL) | Gibco by Life Technologies | 15140148 | distributed by Thermo Fisher Scientific |
References
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends in Cell Biology. 23, 584-586 (2013).
- Sassen, W. A., Köster, R. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. , 151 (2015).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80, 153-158 (1999).
- Köster, R. W., Fraser, S. E. Tracing transgene expression in living zebrafish embryos. Developmental Biology. 233, 329-346 (2001).
- Driever, W., Rangini, Z. Characterization of a cell line derived from zebrafish (Brachydanio rerio) embryos. In Vitro Cellular & Developmental Biology - Animal. 29A, 749-754 (1993).
- Badakov, R., Jaźwińska, A. Efficient transfection of primary zebrafish fibroblasts by nucleofection. Cytotechnology. 51, 105-110 (2006).
- Senghaas, N., Köster, R. W. Culturing and transfecting zebrafish PAC2 fibroblast cells. Cold Spring Harbor Protocols. , (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. Journal of Visualized Experiments Available from: https://www.jove.com/science-education/5048/using-a-hemacytometer-to-count-cells (2017)
- Rupp, R. A., Snider, L., Weintraub, H. Xenopus embryos regulate the nuclear localization of XMyoD. Genes & Development. 8, 1311-1323 (1994).
- Piperno, G., Fuller, M. T. Monoclonal antibodies specific for an acetylated form of alpha-tubulin recognize the antigen in cilia and flagella from a variety of organisms. Journal of Cell Biology. 101 (6), 2085-2094 (1985).
- Barden, J. A., Miki, M., Hambly, B. D., Dos Remedios, C. G. Localization of the phalloidin and nucleotide-binding sites on actin. European Journal of Biochemistry. 162 (3), 583-588 (1987).
- Kapuscinski, J. DAPI: a DNA-specific fluorescent probe. Biotechnic & Histochemistry. 70 (5), 220-233 (1995).
- Gupta, T., Mullins, M. C. Dissection of organs from the adult zebrafish. Journal of Visualized Experiments. 37, E1717 (2010).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Stornaiuolo, M. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Molecular Biology of the Cell. 14, 889-902 (2003).
- Lithgow, T. Targeting of proteins to mitochondria. FEBS Letters. 476, 22-26 (2000).
- Nagai, T., Ibata, K., Park, E. S., Kubota, M., Mikoshiba, K., Miyawaki, A. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nature Biotechnology. 20, 87-90 (2002).
- Sassen, W. A., Lehne, F., Russo, G., Wargenau, S., Dübel, S., Köster, R. W. Embryonic zebrafish primary cell culture for transfection and live cellular and subcellular imaging. Developmental Biology. 430, 18-31 (2017).
- Horesh, D., et al. Doublecortin, a stabilizer of microtubules. Human Molecular Genetics. 8, 1599-1610 (1999).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N. G., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22, 1567-1572 (2004).
- Distel, M., Hocking, J. C., Volkmann, K., Köster, R. W. The centrosome neither persistently leads migration nor determines the site of axonogenesis in migrating neurons in vivo. Journal of Cell Biology. 191, 875-890 (2010).
- Matsuda, T., Miyawaki, A., Nagai, T. Direct measurement of protein dynamics inside cells using a rationally designed photoconvertible protein. Nature Methods. 5, 339-345 (2008).
- Archer, B. T., Ozçelik, T., Jahn, R., Francke, U., Südhof, T. C. Structures and chromosomal localizations of two human genes encoding synaptobrevins 1 and 2. Journal of Biological Chemistry. 265, 17267-17273 (1990).
- Griesbeck, O., Baird, G. S., Campbell, R. E., Zacharias, D. A., Tsien, R. Y. Reducing the environmental sensitivity of yellow fluorescent protein. Mechanism and applications. Journal of Biological Chemistry. 276, 29188-29194 (2001).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10, 407-409 (2013).
- Campbell, R. E., et al. A monomeric red fluorescent protein. Procedings of the National Academy of Sciences of the United States of America. 99, 7877-7882 (2002).
- Peri, F., Nüsslein-Volhard, C. Live imaging of neuronal degradation by microglia reveals a role for v0-ATPase a1 in phagosomal fusion in vivo. Cell. 133, 916-927 (2008).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132, 5069-5079 (2005).
- Jusuf, P. R., Harris, W. A. Ptf1a is expressed transiently in all types of amacrine cells in the embryonic zebrafish retina. Neural Development. 4, 34 (2009).
- Kani, S., et al. Proneural gene-linked neurogenesis in zebrafish cerebellum. Developmental Biology. 343, 1-17 (2010).
- Distel, M., Wullimann, M. F., Köster, R. W. Optimized Gal4 genetics for permanent gene expression mapping in zebrafish. Procedings of the National Academy of Sciences of the United States of America. 106, 13365-13370 (2009).
- Choorapoikayil, S., Overvoorde, J., den Hertog, J. Deriving cell lines from zebrafish embryos and tumors. Zebrafish. 10, 316-332 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved