A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכה של הממשק סינפטית של תאי T האנושי העיקרי של דם היקפיים ורקמות הלימפה
In This Article
Summary
הפרוטוקול מתאר טכניקה ללמוד את היכולת של ראשי תאי T polyclonal האנושי כדי ליצור ממשקים סינפטית באמצעות השומנים מישורי bilayers. אנו משתמשים בטכניקה זו כדי להראות את היכולת היווצרות סינפסה דיפרנציאלית של האדם בתאי T העיקרי נגזר לימפה ודם היקפי.
Abstract
להבנת הדינמיקה הנוכחי ותכונות מבנית של T-cell ממשקי סינפטית כבר נקבע במידה רבה באמצעות הנתמכות על-ידי זכוכית bilayers מישורי, במבחנה-תא T נגזר שיבוטים או קווים1,2 3, ,4. כמה ממצאים אלה חלות ראשי T תאים אנושיים מבודד מן הדם או הלימפה ברקמות אינו ידוע, בין השאר בשל קשיים משמעותיים בהשגת מספר מספיק של תאים עבור ניתוח5. כאן נוכל לטפל בבעיה זו דרך פיתוח טכניקה ניצול הזרימה רב-ערוצי שקופיות כדי לבנות השומנים מישורי bilayers המכילה מולקולות הפעלת והצמדות. הגובה הנמוך של השקופיות זרימה מקדם שקיעת תאים מהירה כדי לסנכרן מצורף תא: bilayer, ובכך לאפשר לחוקרים ללמוד את הדינמיקה של היווצרות ממשק סינפטית וקינטיקה של המהדורה גרגירים. אנו מיישמים גישה זו כדי לנתח את ממשק סינפטית של מעטים כמו 104 עד 105 ראשי cryopreserved תאי T מבודד מן בלוטות הלימפה (LN) ודם היקפי (PB). התוצאות חושפים כי הטכניקה bilayer השומנים מישורי הרומן מאפשר חקר המאפיינים ביופיזיקלי של ראשי האנושי T תאים שמקורם דם ורקמות בהקשר של מחלה ובריאות.
Introduction
הידע המדעי של התכונות מבנית של תא T החיסון הסינפסות ולקשר שלהם לפעילות פונקציונלי של תאי T נוצרה בעיקר מן המחקר של שורות תאים, שיבוטים נגזרת PB. כדי באיזו מידה ממצאים אלה מתייחסות העיקרי בתאי T שהתקבל מן הדם או הלימפה ברקמות אנושיות עדיין לא ברור, כפי שיש הממשקים סינפטית של תאי T המתגוררים רקמות הלימפה ואחרים לא נותחו עד כה. חשוב, המתעוררים הנתונים מראים כי תאי T רקמות תושב ו הלימפה איברים-נגזר יכול להיות הבדלים משמעותיים שלהם פנוטיפ ופעילות תפקודית בהשוואה לאלו ב PB6,7. זה התחזק עוד יותר את הצורך להבין טוב יותר את התכונות של הממשק סינפטית T-cell בתאי T אדם ראשי
לשם כך, פיתחנו בגישה מידה מיני הרומן ניצול שומנים בדם bilayers בנוי לתוך שקופיות רב-ערוצי זרימה המאפשרת לנו לבצע ההדמיה של T-תא/bilayer ממשקים עם פחות מ- 105 ראשי תאי T מבודד PB אנושי, LN. טכניקה חדשנית זו מאפשרת חקר המאפיינים ביופיזיקלי של ראשי אדם T-cell סינפטית ממשקים כדי מודל טוב יותר ולהבין ויוו תא-תא אינטראקציות.
Protocol
מחקר זה נערך בהתאם הצהרת הלסינקי. ממנו כל המשתתפים הושג בכתב הסכמה מדעת, דגימות דם, לימפה נרכשו עם האישור של ועדת הבדיקה מוסדיים ב אוניברסיטת פנסילבניה (IRB #809316, IRB # 815056). כל הנבדקים האדם היו מבוגרים. דגימות דם טבורי נמסרו באדיבות על ידי העבודה ואספקה במחלקת יולדות & גינקולוגיה באוניברסיטת תומאס ג'פרסון. כל הדגימות היו de-מזוהה.
1. בידוד של CD4+ T תאים עבור ניתוח תמונה
-
להפשיר aliquot 1 מ"ל המכילה 107 קפוא היקפיים תאי תאי דם (PBMCs) או תאים תאי לימפה (LNMCs) מן הדוגמאות שנאספו. בשכונה סטרילי, להוסיף את התאים המופשרים 9 מ של RPMI בתוספת פניצילין/סטרפטומיצין, גלוטמין.
- Centrifugate התאים 10 דקות ב x 300 גרם ב 4 ° C, וארוקן את תגובת שיקוע ולאחר resuspend את התאים ב 5 מ של RPMI שהושלם המכיל 10% FBS (בינוני מלא). דגירה בין לילה בתאים חממה2 CO ב 37 º C.
- למחרת, לטהר CD4+ T תאים על-ידי immunomagnetic שלילי מיון באמצעות ערכת זמינים מסחרית על פי הוראות היצרן.
- כדי למדוד את מספר CD4 טרי מטוהרים+ T תאים, לערבב µL 5 של התליה תא עם אמצעי אחסון שווה של פתרון trypan blue. לטעון hemocytometer עם תא-trypan כחול תערובת ולספור את התאים הפועלים בתוך הסעיפים 5 של hemocytometer.
- לקחת את הממוצע של מספר תאים וקבע את מספר התאים ההשעיה תא המקורית: מספר תאים/1 מ"ל = הרוזן ממוצע x 2 x 104. אם המספר הכולל של תאים בודדים הוא קטן מדי, השתמש התאים כמו מבלי לספור.
- Centrifuge התאים ב x 300 גרם במשך 10 דקות, resuspend אותם בתוך מאגר assay (20 מ מ HEPES, pH 7.4, 137 מ מ NaCl, 2 מ מ נה2HPO4, 5 מ מ D-גלוקוז, 5 מ מ אשלגן כלורי, 1 מ MgCl2, 2 מ מ CaCl2ו- 1% אנושי אלבומין) ב-105 < /c13 > תאים/50 µL או פחות לשמור את התאים 4 ° C (עבור 1 – 2 h) עד מוכן להשתמש בניסויים.
- השלך כל פסולת ביולוגית על פי הנחיות מוסדיים הרלוונטיים.
- במידת הצורך כאוכלוסייה תא בקרה, להכין הופעל CD8 T תאים מדם טבורי PBMC, במקום 107 תאים ב 5 מ של בינוני מלא בבקבוקון תרבות T25 מכוסה בתערובת של נוגדנים אנטי CD3 ו- anti-CD28 µg/מ"ל, 1 µg/mL , בהתאמה.
- למחרת, להסיר תאים דם טבורי מופעל הבקבוק, ותוא וקינ 1 x טריים להשלים בינוני ולהרחיב את התאים בנוכחות il-2 רקומביננטי (100 U/mL) למשך שבועיים.
- לטהר את הדם הטבורי CD8+ T תאים על-ידי immunomagnetic שלילי מיון באמצעות ערכת זמינים מסחרית על פי הוראות היצרן. לספור את התאים ולהחליף את המדיה אל המאגר assay כמתואר בצעדים 1.3-1.6 LN ו PB CD8+ T תאים.
2. מרכיבי הכנת השומנים מישורי Bilayers
- להכין 3 מין ליפוזומים כמתואר5: (א) 0.4 מ מ DOPC (1, 2-dioleoyl -sn- glycero-3-phosphocholine) ליפוזומים, ליפוזומים DOPC (ב) 0.4 מ מ המכיל mol 33% כלבים-נ (1, 2-dioleoyl -sn- glycero - 3-[(N-(5- אמינו-1-carboxypentyl) חומצה iminodiacetic) succinyl] (אמוניום מלח)) שומנים, ליפוזומים (ג) 0.4 מ"מ DOPC המכיל mol 4% Biotinyl-קאפ-PE (1, 2-dioleoyl -sn- glycero-3-phosphoethanolamine - N-(cap biotinyl) (נתרן מלח)).
-
להכין 5% קזאין הפתרון כפי שתואר לעיל5.
- להמיס 5 גר' קזאין אבקה ב- 100 מ של מים הנדסה גנטית, להוסיף 350 µL של 10 מ' נתרן הידרוקסידי. מערבבים הכל על פגים קבוע במהירות איטית לקנה זמין, בטמפרטורת החדר במשך שעתיים, ואני אז לילה ב 4 º C. להתאים את ה-pH 7.3, ultracentrifuge הפתרון עבור 2 h ב g x 100,000 ב 4 º C. לסנן את תגובת שיקוע עם מסנן סטרילי מיקרומטר 0.22 ואחסן את הפתרון aliquots ב-80 מעלות צלזיוס.
התראה: נתרן הידרוקסידי פתרון יכול לגרום כוויות כימיות, עשוי לגרום עיוורון תמידי על מגע עם העיניים. השתמש בכפפות גומי, ביגוד בטיחות והגנה העין בעת הטיפול הכימי או פתרונות שלה.
- להמיס 5 גר' קזאין אבקה ב- 100 מ של מים הנדסה גנטית, להוסיף 350 µL של 10 מ' נתרן הידרוקסידי. מערבבים הכל על פגים קבוע במהירות איטית לקנה זמין, בטמפרטורת החדר במשך שעתיים, ואני אז לילה ב 4 º C. להתאים את ה-pH 7.3, ultracentrifuge הפתרון עבור 2 h ב g x 100,000 ב 4 º C. לסנן את תגובת שיקוע עם מסנן סטרילי מיקרומטר 0.22 ואחסן את הפתרון aliquots ב-80 מעלות צלזיוס.
-
נוגדן אנטי-CD3 תווית עם ביוטין לייצר מולקולות הנוגדן מונו-bionylated עם גישה שתואר לעיל8.
- להכין פתרון של ביוטין-PEO4-NHS ב דימתיל סולפוקסיד (דימתיל סולפוקסיד)-0.1 מ"ג/מ"ל. להוסיף µL 3.7 של הפתרון ביוטין-PEO4-NHS 1 מ ג של נוגדנים ב- 0.5 מ ל תמיסת באגירה פוספט (PBS) המכיל 100 מ מ סודיום ביקרבונט.
- דגירה התערובת כבר שעתיים בטמפרטורת החדר. להכין פתרון של אסתר אלקסה עבור חיל הים 488 NHS-10 מ"ג/מ"ל ב דימתיל סולפוקסיד. להוסיף את הפתרון אסתר אלקסה עבור חיל הים 488 NHS הנוגדן המתויגים באמצעות ביוטין-PEO4-NHS-עודף שן טוחנת 10-fold.
- דגירה התערובת לשעה בטמפרטורת החדר עם ערבוב איטי על פגים רגיל. הפרד את הצבע לא מאוגד באמצעות כרומטוגרפיה גודל-הדרה.
- לקבוע ריכוז נוגדן על ידי מדידת צפיפות אופטית של הפתרון נוגדן-280 ננומטר (280). למדוד את הצפיפות האופטית של נוגדנים שכותרתו-577 nm (577).
- לקבוע את היחס לצבוע-כדי-נוגדן באמצעות המשוואה הבאה:
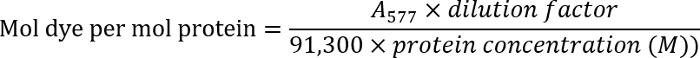
הערה: למצוא פרטים נוספים בהפרוטוקול של היצרן.
-
מבטאים חלבון רקומביננטי ICAM-1 מסיסים במערכת הביטוי דרוזופילה כפי שתואר לעיל3,4,9,10.
- שיבוט, עם cDNA קידוד, ectodomain של ICAM-1 לידי ביטוי דרוזופילה וקטור pMT/V5-שלו עם יזם inducible metallothionein לייצר חלבון רקומביננטי לשמות שלו6 תג בקצה C-מסוף.
- שיתוף transfect S2 תאים עם פלסמיד המכיל וכתוצאה מכך את ICAM-1 ווקטור ביטוי G418. בחר transfectants יציבה באמצעות מדיה דרוזופילה של שניידר בתוספת 10% עגל עוברית סרום (FCS) ו- 0.5 מ"ג/מ"ל של G418 למשך 3 שבועות. הרחב את התאים ללא סרום חרקים בינוני ' זירוז ביטוי חלבון עם 0.5 מ מ CuSO4 עבור בתלת-ממד.
- להתרכז תרבות x 10 supernatant, dialyze נגד PBS באמצעות רכז זרימה וצורניים כפי שתואר לעיל11.
- להחיל את התרבות מרוכז supernatant עמודה המכילה Sepharose עם נוגדן חד שבטי קיבוע covalently anti-ICAM-1, elute ICAM-1 מאוגד עם מאגר גליצין 50 מ מ, pH 3.0. מיד לנטרל את החלבון ICAM-1 eluted באמצעות בופר טריס 2 מ', pH 8.0.
- Dialyze את החומר eluted נגד PBS, pH 8.0 ולהוסיף את החומר dialyzed עמודה המכילה agarose Ni-נ. ת. Elute מסיס ICAM-1 עם 200 מ"מ imidazole, pH 8.0. Dialyze את החומר eluted נגד מאגר PBS, pH 8.0.
- תווית מטוהרים ICAM-1 עם אסתר Cy5 NHS לפי הוראות היצרן.
הערה: היחס הטוב ביותר צבען-כדי-חלבון הסופי הוא 1:1.
- לייצר Fab שברים נוגדן anti-CD107a על ידי עיכול פפאין ולטהר את Fab קטעים על ידי יונים כרומטוגרפיה כפי שתואר לעיל3. תווית Fab קטעים עם אלקסה עבור חיל הים 568 NHS אסתר לפי הוראות היצרן.
3. היווצרות ליפיד מישורי הנתמכות על-ידי זכוכית Bilayers
- להכין פתרון פיראניה חומצי טריים על ידי ערבוב 140 מ של חומצה גופרתית מרוכזת ו- 60 מיליליטר 30% מימן על-חמצני. לשטוף את coverslips זכוכית דקה של השקופיות זרימה בהשריה בפתרון פיראניה חומצה במשך 30 דקות להחזיק את coverslip זכוכית עם מלקחיים מסוג מספריים פוליפרופילן.
התראה: פתרון פיראניה הוא מחמצן חזק מאוד. זכור ללבוש בטיחות משקפיים או משקפי מגן עטיית יחד עם כפפות גומי עבה בכל עת בזמן טיפול הפתרון. עובד רק עם פתרון פיראניה ברדס fume. הימנע חימום, שינוע או לרעוד זה בכל עת במהלך השימוש, כמו זה עלול להתפוצץ. לאסוף את הפסולת פיראניה לתוך בקבוק זכוכית עם חור המכיל עופרת. צור קשר עם ועדת הבטיחות מוסדית על ומשבצת פסולת. -
לשטוף את שטף coverslips 7 x עם הנדסה גנטית המים על ידי להעביר אותם ברצף בקבוקונים המכילים מים מתוקים. סט coverslips רטוב הצידה כדי לאפשר את המים הנותרים מתגלגלים הכוס נקי, כשמאחוריו הזכוכית יבש.
- לחלופין, השתמש טיפ פיפטה המצורפת משאבת ואקום בזהירות להסיר את טיפות המים שנותרו coverslips.
- בשכונה סטרילי, ביצוע דילולים של ליפידים שונים כדי לייצר את התמהיל ליפוזום להכנת bilayers. ראשית, לשלב µL 37 של ליפוזומים DOPC 3 µL של Biotinyl-קאפ-PE ליפוזומים. שנית, לערבב µL 14 של ליפוזומים DOPC 15 µL של כלבים-נ ליפוזומים. שלישית, להוסיף 1 µL של המיקס הראשון µL 29 של המיקס השני כדי לפברק את התערובת ליפוזום הסופי.
-
בשכונה סטרילי, הגדרת סביבת עבודה עם coverslips יבשה בקרבת מקום. Aliquot 2 µL של תערובת ליפוזום הסופי (ראה שלב 3.3) בדיוק במרכז של ערוץ הכורך בשקופית. מיד ובדיוק מאוד ליישר coverslip נקי ויבש כאשר השקופית, והורד בעדינות את coverslip על הצד הדביק של השקופית.
- אם מכינים יותר משקופית אחת, לעבוד על שקופית אחת בכל פעם מאז התערובת ליפוזום מתאדה במהירות. . תהפוך את השקופית ולהשתמש הטבעת החיצונית של פוליפרופילן סוג מספריים מלקחיים להחלת לחץ עדין על המגע היקפיים של coverslip כאשר השקופית, מוודא כי תגית מחובר בחוזקה אל השקופית כדי למנוע דליפה.
הערה: אין להקיש נגד הערוצים של השקופית כדי למנוע שבירת או פיצוח את coverslip. - פנו את השקופית שוב ושוב ושוב, לסמן את המיקום של bilayer בנוי, שנראה כמו טיפה בין coverslip את השקופית בערוץ, באמצעות ציור 4 נקודות עם סמן קבוע סביב bilayer בצד השקופית חיצוני של ההרכבה.
- אם מכינים יותר משקופית אחת, לעבוד על שקופית אחת בכל פעם מאז התערובת ליפוזום מתאדה במהירות. . תהפוך את השקופית ולהשתמש הטבעת החיצונית של פוליפרופילן סוג מספריים מלקחיים להחלת לחץ עדין על המגע היקפיים של coverslip כאשר השקופית, מוודא כי תגית מחובר בחוזקה אל השקופית כדי למנוע דליפה.
- לפני הזריקה הראשונה של נוזל לתוך התעלה, יציאה אחת של הערוץ תייעד את יציאת הפוסט ואת הצד השני כ היציאה ולשמור כייעוד לאורך כל הניסוי.
- כדי למנוע יצירת בועות, הכנס הקצה של הקצה pipet ישירות לתוך יציאת הכניסה של הערוץ. לאט לאט למלא את הערוצים של השקופית עם 50 µL חמים (לפחות חדר טמפרטורה) מאגר assay (ראה שלב 1.5 עבור הרכב המאגר).
- להכין פתרון כלוריד nickel(II) 0.5 M. להפשיר את aliquot 2 מ"ל של קזאין פתרון באמבט מים ב 37 מעלות צלזיוס למשך 30 דקות, משלימים את זה עם פתרון כלוריד ניקל-ריכוז סופי של 200 מיקרומטר.
- לשטוף את bilayers על ידי הזרקת קודם µL 100 של הפתרון קזאין בנמל הכניסה של הערוץ ולאחר מכן להסיר מיד 100 µL מחוץ לנמל היציאה בשקופית על-ידי pipetting. לחסום את bilayers עם הפתרון אותו על ידי הזרקת µL 100 של הפתרון קזאין לתוך יציאת הכניסה של כל אחד מערוצי המקננת השקופית למשך 45 דקות בטמפרטורת החדר.
- הפשרת aliquots של חלבונים6 ו- streptavidin Cy5-ICAM-1-שלו. לשלב את החלבונים במאגר assay בבית הריכוז הסופי של 2 µg/mL בכל. Centrifuge הפתרון למשך 30 דקות ב20, 000-g ו- 4 ° C להוציא אגרגטים כלשהו.
- להסיר את שארית הפתרון חסימת היציאה של הערוץ שקופית על-ידי pipetting. מזריקים µL 100 של התמיסה המכילה ICAM-1 ו- streptavidin ליציאת ה-ערך.
- דגירה השקופית למשך 45 דקות בטמפרטורת החדר. הסר כל עודף של הפתרון חלבון היציאה. לשטוף את bilayer 2 x על ידי הזרקת קודם µL 100 המאגר assay בנמל הכניסה של הערוץ ולאחר מכן להסיר מיד 100 µL מחוץ לנמל היציאה.
- לדלל נוגדן anti-CD3 אלקסה-עבור חיל הים-488-מתויג עם המאגר assay כדי ריכוז סופי של 2 µg/mL. מזריקים µL 100 של הפתרון נוגדן לתוך יציאת הפוסט של השקופית, דגירה זה למשך 45 דקות בטמפרטורת החדר. הסר כל עודף של הפתרון חלבון היציאה. לשטוף את bilayer 2 x עם 100 µL של המאגר assay כמו שלב 3.11.
4. הדמיה של תאי T אינטראקציה עם Bilayer מישורי
-
מחממים את הבמה ואת המטרה של מיקרוסקופ קונפוקלי או הכולל השתקפות פנימית קרינה פלואורסצנטית (TIRF) עד הטמפרטורה היא equilibrated ב 37 º C. להגדיר את השקופית הכוללת bilayer(s) על הבמה מחוממת. לעבור על הבמה עמדה ראויה על פי הסימנים דיו ולהתמקד bilayer העסקת זריחה של מולקולות מתויג Cy ICAM-1.
- השתמש מטרה X 61 עבור מיקרוסקופ קונפוקלי, או מטרה X 100 המיקרוסקופ TIRF, עם הגדרות הסינון המתאימה.
-
עבור גרגר לשחרר הדמיה על ידי מיקרוסקופ TIRF, להוסיף אלקסה-עבור חיל הים-568-שכותרתו anti-CD107a נוגדנים חיובי קטעים על התליה תא-ריכוז סופי של 4 µg/mL לפני הזרקת התאים לתוך היציאות כניסה.
- Resuspend של CD4 מוכן+ T תאים מבודדים LN או חמאת בוטנים או כבל דם ולהזריק µL 50 של התליה תא ליציאת הכניסה של הערוץ השקופית המכילה את bilayer.
- לבחור את המספרים הרצויים של שדות ותמונות הרשומה של כל שדה 1 x כל 2 דקות למשך 30 דקות לאחר ההזרקה.
- לנצל בהיר-שדה, משתקף האור, פלורסנט וערוצי (488 אלקסה ו- Cy5) של מיקרוסקופ קונפוקלי לרכוש את התמונות. השתמש במצב TIRF עבור קרינה פלואורסצנטית אלקסה-עבור חיל הים-488, אלקסה-עבור חיל הים-568 ו widefield Cy5 פלורסצנטיות, כמו גם הדמיה בהיר-שדה, על המיקרוסקופ TIRF.
5. התמונה ניתוח
- לנתח את התמונות הנרכש באמצעות תוכנה מתאימה. להתבונן תא מורפולוגיה תמונות אור המשודרת, תכלול מקובצים באשכולות ופגעו בעליל או מוות תאים מן הניתוח. לכלול הניתוח תאים המקיימים אינטראקציה באופן פרודוקטיבי עם פני השטח bilayer (כלומר, תאים צבירת פלורסצנטיות אלקסה-עבור חיל הים-488 (נוגדנים anti-CD3)-הממשק) בלבד.
- לקבוע את גודלו של אזור אדהזיה תא 20 דקות לאחר אתחול של התא-bilayer האינטראקציה.
הערה: האזור אדהזיה הוא אזור כהה שפותחה הממשק תא-bilayer על הפרעה השתקפות תמונות מיקרוסקופ (IRM). - להתבונן כל הצטברות של זריחה Cy5-ICAM-1 והיווצרות של צומת טבעת על ידי מולקולות הפרדה Cy-ICAM-1-הממשק תא-bilayer. אם נצבר ICAM-1 מולקולות נוצר של צומת טבעת אדהזיה לפחות שתי תמונות עוקבות, לייעד תאים כאלה כתאי פיתוח של הפריפריה סופרא מולקולרית הפעלת אשכול (pSMAC)12.
- להעריך את שחרור גרגר על ידי מדידת עוצמת קרינה פלואורסצנטית אלקסה-עבור חיל הים-568-הממשק תא T-bilayer מעל זריחה רקע מחוץ לאזור קשר בסמיכות לתא. לייעד תאים עם יחס של אלקסה-עבור חיל הים-568 האות--לרקע לפחות 1.3 כתאים degranulating.
תוצאות
ראשית, השווינו את המבנה של הממשק סינפטית הנוצרת על-ידי הופעל CD8 כבל דם-נגזר+ T תאים נחשפים השומנים bilayers נבנה גם זרימה בקנה מידה גדול מסורתיים בתוך מערכות התא (ראה את הטבלה של חומרים לפרטים)1 ,2,3,
Discussion
הטכניקה הרומן שמתואר כאן מנצל ריאגנטים דומה הנדרש כדי לבנות מישורי bilayers תא הזרימה קונבנציונלי5 , יכול להיות מיושם בהצלחה לביצוע ההדמיה של תא T אנושי ראשוני – bilayer ממשקים3,4 ,15. הטכניקה מציע ירידה משמעותית השימוש מולקולות פלורס...
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק R01AI118694 NIH מייקל ר'. בטס, כולל פרס תת 566950 יורי Sykulev. אנו מודים סידני קימל סרטן מרכז Bioimaging משותפים המשאב עבור תמיכה מצוינת שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
References
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved