A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיית כליות קורטקס חוץ-תאית מטריקס-Derived הידרוג
In This Article
Summary
כאן אנו מציגים פרוטוקול כדי לבדות של הכליה קורטקס חוץ-תאית מטריקס-derived הידרוג כדי לשמור על הכליה יליד מטריצה חוץ-תאית (ECM) הרכב הביוכימי מבניים. תהליך ייצור ויישומיה מתוארים. לבסוף, נדון פרספקטיבה על שימוש זה הידרוג לתמיכה ספציפית כליות הסלולר ורקמות רגנרציה ומחזור בביו-הנדסה.
Abstract
מטריצה חוץ-תאית (ECM) מספק רמזים biophysical וביוכימי חשוב כדי לשמור על הומאוסטזיס רקמות. Hydrogels סינתטי הנוכחי מציעים תמיכה מכנית חזקה במבחנה תרבית תאים אך חוסר הרכב צורך חלבון וליגנד שמעודדים התנהגות פיזיולוגית מתאי. כתב יד זה מתאר שיטת ייצור הידרוג נגזר ECM קליפת הכליה עם חוסן מכני תקין והרכב ביוכימי תומכת. הידרוג מפוברק על ידי מכנית homogenizing ו solubilizing decellularized כליה אנושית קליפת ECM. המטריקס משמר כליה יליד קליפת ECM חלבון יחסי תוך גם מתן אפשרות gelation כדי stiffnesses מכני פיזיולוגיים. הידרוג משמש מצע על כליה אילו תאים בקליפת המוח-derived יכול להישמר בתנאים פיזיולוגיים. יתר על כן, ניתן לטפל ההרכב הידרוג לדגם סביבה חולה אשר מאפשר חקר מחלות כליה לעתיד.
Introduction
מטריצה חוץ-תאית (ECM) מספק רמזים biophysical וביוכימי חשוב כדי לשמור על הומאוסטזיס רקמות. ההרכב המולקולרי מורכבים מסדיר מאפיינים מבניים והן תפקודית של רקמות. חלבונים מבניים לספק תאים עם מודעות מרחבית ולאפשר הדבקה והעברה1. ליגנדים מאוגד אינטראקציה עם קולטני פני שטח התא כדי לשלוט בהתנהגות התא2. כליות ECM מכיל שפע של מולקולות של מי הרכב ומבנה משתנה בהתאם למיקום האנטומי, שלב התפתחותי מחלות המדינה3,4. Recapitulating את המורכבות של ECM הוא היבט מרכזי בלימוד תאי כליה-derived בתוך חוץ גופית.
ניסיונות קודמים-שכפול ECM microenvironments התמקדו decellularizing כל רקמות כדי ליצור פיגומים מסוגל recellularization. Decellularization בוצעה עם חומרי ניקוי כימיים כגון נתרן גופרתי dodecyl (מרחביות) או בדטרגנטים ללא יונית, הוא מנצל גם כל האיבר זלוף או טבילה ועצבנות שיטות5,6,7 ,8,9,10,11,12,13. פיגומים המובאת כאן לשמר את המקלות הביוכימי מבניים נמצא ברקמת יליד ECM; יתר על כן, recellularization עם תאי התורם ספציפי יש הרלוונטיות הקלינית ניתוח שיחזור14,15,16,17,18, 19. עם זאת, אלה פיגומים חוסר גמישות מבנית, ולכן הם תואם התקנים רבים הנוכחי המשמש עבור מחקרים במבחנה . כדי להתגבר על מגבלה זו, קבוצות רבות יש עיבוד נוסף decellularized ECM לתוך hydrogels20,21,22,23,24. Hydrogels אלה עולים בקנה אחד עם הזרקת פלסטיק, bioink, לעקוף מיקרומטר סולם באילוצים המרחבי decellularized המקום פיגומים על תאים. יתר על כן, ההרכב המולקולרי של יחסי נמצאו ב- ECM יליד נשמרים3,25. כאן נדגים שיטה כדי לבדות של הידרוג שמקורם קליפת הכלייה ECM (kECM).
המטרה של פרוטוקול זה היא לייצר הידרוג משכפל את microenvironment של האזור קורטיקלית בכליה. רקמת קליפת הכלייה הוא decellularized בפתרון מרחביות 1% תחת עצבנות מתמדת כדי להסיר חומר הסלולר. מרחביות משמש בדרך כלל כדי decellularize רקמות בשל היכולת להסיר במהירות חיסוניות תאית גשמי6,-7,-9,-26. KECM מכן כפוף המגון מכני ו- lyophilization5,6,9,11,26. Solubilization ב חומצה חזקה עם פפסין תוצאות20,מניות פתרון הסופי הידרוג27. יליד kECM חלבונים חשובים מבני תמיכה, האות התמרה חושית נשמרים3,25. הידרוג יכול גם להיות הג'לי כדי בתוך סדר גודל אחד של כליה אנושית יליד קליפת28,29,30. מטריצה זו מספק סביבה פיזיולוגיים שבו נעשה שימוש כדי לשמור את תרדמה של תאים ספציפיים הכליה בהשוואה hydrogels של חלבונים אחרים מטריקס. יתר על כן, מטריקס הרכב יכול להיות מתומרן, לדוגמה, באמצעות התוספת של קולגן-אני, מודל המחלה סביבות לצורך המחקר של פיברוזיס כליות ו31,אחרים מחלות כליה32.
Protocol
הכליות האנושי היו מבודדים מערב LifeCenter בעקבות מנחים שנקבעו על ידי האגודה של איברים רכש הארגונים. פרוטוקול זה מנחים בעלי חיים והטיפול תא תרבות שתואר על ידי אוניברסיטת וושינגטון.
1. הכנת רקמות כליה אנושית
- הכנת decellularization פתרון
- לעקר את גביע מ ל 5000 ובר מערבבים 70 x 10 מ מ.
- מערבבים 1:1000 (משקל: נפח) dodecyl סולפט נתרן (מרחביות) במים יונים בלוק במיכל. להשאיר את הפתרון על צלחת stir כ 200 סל ד 24 שעות או עד התפרקה לחלוטין זמנים תוססים.
הערה: בדרך כלל, 2500 מ של 1% פתרון מרחביות מספיקה decellularize כליה אנושית אחת. - להעביר את הפתרון מסנן ואקום סטרילי 500 מ"ל ולסנן אותו לתוך מיכלים sealable מעוקר.
- עיבוד של רקמת כליה
- רוחצים את החיטוי זוג מלקחיים, עוצר דימום שני מלחציים, שירות כללי כיתה מספריים, שתי ידיות להב אזמל, גביע 1000 מ"ל מכוסה עם רדיד אלומיניום, וכן בר מערבבים 36 x 9 מ מ.
- קו ברדס תרביות רקמה עם underpad. מקם את הספל, תבשיל תרביות רקמה סטרילי (150 x 25 מ מ), האיבר כליות כל וחטף. למלא את. הספל עם 500 מ של 1% פתרון מרחביות.
הערה: הכליות האנושי התקבלו על הקרח LifeCenter מערב. - מקם את הכליה המנה תרביות רקמה סטרילי (איור 1 א'). להסיר את כל השומן perirenal על ידי גילוח בקלילות סביב הקפסולה כליות עם איזמל (איור 1B).
- עושים חתך רדוד 8-10 ס מ עם האזמל, רק עמוק מספיק. כדי לשבור פתוח הקפסולה כליות ללא פגיעה הרקמה קליפת הבסיסית, מעבר לקצה עליון של הכליה. הסר את הקפסולה כליות על ידי פילינג זה מן הרקמה קליפת עם עוצר דימום שני תופסנים (איור 1C).
- קטיעות הכליה לאורך המטוס הילתית באמצעות את האזמל לאורך הצד הלטראלי של הכליה (איור 1D). לבודד רקמת קליפת לשני חצאים באמצעות גילוף את האזור medullar עם האזמל (איור 1E) ולגזור את רקמת קליפת 0.5 ס מ3 חלקים (איור 1F). הסר את כל כלי גלוי גדול.
- בידוד של מטריצה חוץ-תאית
- בשכונה תרביות רקמה, למלא גביע 1000 מ ל 500 מ של 1% פתרון מרחביות. מניחים את קוביות קליפת רקמות ומערבבים הבר לתוך כשהספל המכיל פתרון מרחביות. לכסות את. הספל עם רדיד אלומיניום בלוק ומניחים אותו על צלחת stir כ 400 סל ד מחוץ למכסה תרביות רקמה.
- לאחר רקמת קליפת כבר בצלחת מערבבים במשך 24 שעות ביממה, להכניס את. הספל ברדס תרביות רקמה ולהוסיף מסננת סטרילית תא 40 מיקרומטר עם רשת ניילון. למלא גביע 1000 מ ל נפרד עם 200 מ של אקונומיקה ולמקם אותו מכסה המנוע של תרביות רקמה.
- פיפטה את הפתרון מרחביות דרך מסננת התא לתוך כשהספל המכילים מלבין. פיפטה החוצה כל פתרון מרחביות עד רק רקמת decellularized, את מסננת תא להישאר במיכל.
הערה: מסננת התא צריך למנוע כל רקמות מפני הוסר במהלך פתרון השאיפה. - לעזוב את מסננת תא הספל, מילוי עם 500 מ"ל של פתרון מרחביות טריים. לכסות את. הספל עם רדיד האלומיניום אותו ומניחים על צלחת מערבבים באותה מהירות כמו בעבר.
- חזור על צעדים 1.3.1-1.3.3 כל 24 שעות עם פתרון מרחביות טריים עבור סכום כולל של חמישה ימים.
- רקמת decellularized שטיפה במים DI בלוק כל 24 שעות סה כ 3 ימים, בעקבות הטכניקה המתוארים 1.3.1-1.3.3 צעדים.
- שטיפה decellularized הרקמה תא תרבות כיתה מים בכל 24 שעות סה כ 2 ימים בעקבות הטכניקה המתוארים 1.3.1-1.3.3 צעדים.
- חזור על שלבים 1.3.1-1.3.2. להעביר את הרקמה decellularized (המכונה kECM מנקודה זו על) לתוך 30 מ ל עצמי עומד צינור חרוטי ולמלא אותה עם תא תרבות כיתה מים עד שקוע כל הרקמה.
2. פבריקציה נוספת של מניות הידרוג פתרון
- עיבוד מכני של רקמת decellularized
- בשכונה תרביות רקמה, מכנית homogenize את kECM בתוך הצינור חרוט עם רקמות מהמגן למשך 2 דקות.
הערה: kECM הומוגני כדאי דומים פתרון אטום עם אין חתיכות ECM גלוי. - להטביע את צינור חרוטי המכיל את kECM של חנקן נוזלי עד רתיחה סביב הצינור כבר לא נמשכת. אחסן את kECM ב-4 הלעפה תרוטרפמט בן לילה.
- בשכונה תרביות רקמה, מכנית homogenize את kECM בתוך הצינור חרוט עם רקמות מהמגן למשך 2 דקות.
- Lyophilization של רקמת decellularized קפוא
- שחרר מעט את הצינורית חרוט כדי לאפשר חילוף הגזים ומניחים את הצינור לתוך מכונה lyophilization. Lyophilize את kECM במשך שלושה ימים או עד דומה אבקה לבנה. חנות ב-4 הלעפה תרוטרפמט.
- לעיכול כימי, solubilization של ג'ל
- אוטוקלב בקבוקון נצנוץ 20 מ ל, קאפ, בר מערבבים 15.9 x 7.9 מ מ, וכן זוג מלקחיים פיין-טיפ.
- לשקול את kECM lyophilized לחשב את עוצמת הקול של HCl והמסה של פפסין צריך solubilize את kECM את הפתרון 3% (30 מ"ג/מ"ל) באמצעות המשוואות הבאות, איפה זפפסין המסה של פפסין, מ'רקמות היא המסה של רקמה lyophilized, VHCl היא הנפח של 0.01 N HCl:
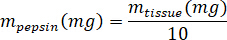
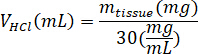
- בשכונה תרביות רקמה, להוסיף חזירי פפסין קיבה 0.01 N HCl, הבר מערבבים המבחנה נצנוץ, תשאיר את זה על צלחת stir כ 500 סל ד עד כל פפסין יש התפרקה. להעביר את kECM lyophilized המבחנה נצנוץ ולהשאיר את הפתרון צלחת stir כ 500 סל ד במשך שלושה ימים.
3. הידרוג Gelation
- כליות ECM הידרוג הכנה
- ג'ל את הידרוג על ידי ערבוב הפתרון מניות של הידרוג kECM עם 1 N NaOH, 10 x תוספת מדיה (M199), והתא תרבות המדיה. שמור את כל הפתרונות על קרח.
הערה: ג'ל הסופי ריכוזים של 7.5 מ"ג/מ"ל שימשו תרבית תאים. 1 מ"ל של ג'ל kECM היה מספיק עבור ניסויים התרבות התא המוצג. - לקבוע את עוצמת הקול של kECM עביד ג'ל המיוצר ואת עוצמת הקול של kECM מניות הידרוג הדרושים באמצעות המשוואה הבאה, היכן Vהסופי הוא אמצעי של הג'ל שנוצר, VkECM מניות היא הנפח של הידרוג kECM מניות לצורך, CkECM מניות הוא ריכוז הידרוג kECM מניות, Cהסופי הוא הריכוז של הג'ל הסופי:
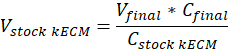
- לקבוע את עוצמת הקול של נטרול ריאגנטים הדרושים באמצעות המשוואות הבאות, איפה VNaOH הנפח של 1 N NaOH, 10 X V הוא הנפח של M199 תוספת של 10 X מדיה, V1 X הוא נפח תא תרבות המדיה:
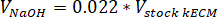
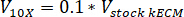
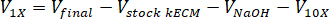
- בשכונה תרביות רקמה, pipette של ריאגנטים נטרול (NaOH, M199 ומדיה תא תרבות) לתוך סטרילי 30 מ ל עצמי עומד צינור חרוטי. מערבבים את הפתרון ריאגנט נטרול עם microspatula.
- השתמש מזרק 1 מ"ל סטרילי כדי להעביר את אמצעי האחסון המתאים של kECM מניות הידרוג הפתרון ריאגנט נטרול. השתמש microspatula לערבב בעדינות את הפתרון עד הומוגניות בפתרון הידרוג צבע מתקבל.
הערה: להימנע היכרות עם בועות אוויר על ידי ערבוב לאט ובעדינות. - לשלב תאים הידרוג kECM, מהמסיכה 10 µL של התא תרבות המדיה (V1 X) חישובי נפח נטרול פתרון בשלב 3.1.1.3.
- להשעות תאים לתוך µL 10 תא תרבות המדיה. לקבוע את מספר התאים להיות מושעים באמצעות המשוואה הבאה, כאשר #תאים מרמז על מספר התאים להשעות ו- Vהסופי הוא הנפח של הג'ל שנוצר:
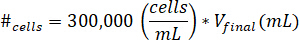
הערה: תאים למ"ל 300,000 הוא הריכוז של תאים המשמשים את הג'ל kECM. - Pipette את µL 10 של פתרון תא מושעה לתוך הג'ל kECM הסופי לאחר הפתרון מניות kECM יש מעורב עם נטרול ריאגנט פתרון. ומערבבים את הפתרון עם microspatula עד התאים מפוזרים באופן אחיד.
- להשעות תאים לתוך µL 10 תא תרבות המדיה. לקבוע את מספר התאים להיות מושעים באמצעות המשוואה הבאה, כאשר #תאים מרמז על מספר התאים להשעות ו- Vהסופי הוא הנפח של הג'ל שנוצר:
- ג'ל את הידרוג על ידי ערבוב הפתרון מניות של הידרוג kECM עם 1 N NaOH, 10 x תוספת מדיה (M199), והתא תרבות המדיה. שמור את כל הפתרונות על קרח.
- השתמש מזרק 1 מ"ל למילוי מכשיר התרבות התא הרצוי הידרוג kECM.
- לאפשר את הג'ל להגדיר ב- 37 הלעפה תרוטרפמט לשעה לפני העברת או ציפוי תאים.
תוצאות
הידרוג kECM מספק מטריצה כליות תרבית תאים עם הרכב כימי דומה כמו microenvironment הכליה מקורית. כדי להמציא את הידרוג, רקמת קליפת הכלייה מופרד באופן מכני כליות כל איבר, קצוץ (איור 1). Decellularization עם חומר ניקוי כימיים (איור 2 א.1-A.3) ואחריו שטיפות עם מ?...
Discussion
מטריצות מספקים רמזים חשובים מכאני וכימי המפקחים בהתנהגות התא. Hydrogels סינתטי מסוגלים לתמוך המתבנת תלת-ממדי מורכב אך נכשלים לספק את רמזים חוץ-תאית מגוונים שנמצאו microenvironments פיזיולוגי במטריקס. Hydrogels נגזר ECM מקורית הן בחומרים אידיאלי ללימודי הן vivo והן במבחנה . מחקרים קודמים השתמשו decellul...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להכיר את לין ואת מייק גארווי הדמיה מעבדה במכון תאי גזע של רפואה רגנרטיבית ו LifeCenter. הם רוצים גם לקבל סיוע כספי של מכוני הבריאות הלאומיים מענקים, TR000504 UH2/UH3 (כדי ג'יי-אייץ) ו DP2DK102258 (ל Y.Z.), מענק הכשרה NIH T32 DK0007467 (ל R.J.N.) מתנה בלתי מוגבלת ממרכזי כליות מערב מכון המחקר כליות.
Materials
| Name | Company | Catalog Number | Comments |
| Preparation of Kidney Tissue | |||
| 5000 mL Beaker | Sigma-Aldrich | Z740589 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma-Aldrich | 436143 | |
| Sterile H2O | Autoclaved DI H2O | ||
| Stir Bar (70 x 10 mm) | Fisher Science | 14-512-128 | |
| 500 mL Vacuum Filter | VWR | 97066-202 | |
| Stir Plate | Sigma-Aldrich | CLS6795420D | |
| 1000 mL Beaker | Sigma-Aldrich | CLS10031L | |
| Forceps | Sigma-Aldrich | F4642 | Any similar forceps may be used |
| Scissor-Handle Hemostat Clamp | Sigma-Aldrich | Z168866 | |
| Dissecting Scissors | Sigma-Aldrich | Z265977 | |
| Scalpel Handle, No. 4 | VWR | 25859-000 | Any similar scalpel handle may be used |
| Scalpel Blade, No. 20 | VWR | 25860-020 | Any similar scalpel blade may be used |
| Stir Bar (38.1 x 9.5 mm) | Fisher Science | 14-513-52 | |
| Absorbent Underpad | VWR | 82020-845 | |
| Petri Dish (150 x 25 mm) | Corning | 430597 | |
| Autoclavable Biohazard Bag | VWR | 14220-026 | |
| Sterile Cell Strainer (40 um) | Fisher Science | 22-363-547 | |
| Cell Culture Grade Water | HyClone | SH30529.03 | |
| 30 mL Freestanding Tube | VWR | 89012-778 | |
| Fabrication of ECM Gel | |||
| Tissue Homogenizer Machine | Polytron | PCU-20110 | |
| Freeze Dryer | Labconco | 7670520 | |
| 20 mL Glass Scintillation Vials and Cap | Sigma-Aldrich | V7130 | |
| Stir Bar (15.9 x 8 mm) | Fisher Science | 14-513-62 | |
| Pepsin from Porcine Gastric Mucosa | Sigma-Aldrich | P7012 | |
| 0.01 N HCl | Sigma-Aldrich | 320331 | Dilute to 0.01 N HCl with cell culuture water |
| Kidney ECM Gelation | |||
| 1 N NaOH (Sterile) | Sigma-Aldrich | 415413 | Dilute to 1 N in cell culture grade water |
| Medium 199 | Sigma-Aldrich | M4530 | |
| 15 mL Conical Tube | ThermoFisher | 339651 | |
| Cell Culture Media | ThermoFisher | 11330.032 | Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) |
| Fetal Bovine Serum (FBS) | Gibco | 10082147 | |
| Antibiotic-Antimycotic 100X | Life Technologies | 15240-062 | |
| Insulin, Transferrin, Selenium, Sodium Pyruvate Solution (ITS-A) 100X | Life Technologies | 51300-044 | |
| 1 mL Syringe | Sigma-Aldrich | Z192325 | |
| Microspatula | Sigma-Aldrich | Z193208 |
References
- Lelongt, B., Ronco, P. Role of extracellular matrix in kidney development and repair. Pediatric Nephrology. 18 (8), 731-742 (2003).
- Yue, B. Biology of the Extracellular Matrix: An Overview. Journal of Glaucoma. 23, S20-S23 (2014).
- Miner, J. H. Renal basement membrane components. Kidney International. 56 (6), 2016-2024 (1999).
- Petrosyan, A., et al. Decellularized Renal Matrix and Regenerative Medicine of the Kidney: A Different Point of View. Tissue Engineering Part B. 22 (3), 183-192 (2016).
- Caralt, M., et al. Optimization and Critical Evaluation of Decellularization Strategies to Develop Renal Extracellular Matrix Scaffolds as Biological Templates for Organ Engineering and Transplantation. American Journal of Transplantation. 15 (1), 64-75 (2015).
- Nakayama, K. H., Batchelder, C. A., Lee, C. I., Tarantal, A. F. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Engineering Part A. 16 (7), 2207-2216 (2010).
- Nakayama, K. H., Lee, C. C. I., Batchelder, C. A., Tarantal, A. F. Tissue Specificity of Decellularized Rhesus Monkey Kidney and Lung Scaffolds. Public Library of Science ONE. 8 (5), (2013).
- Orlando, G., et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Annals of Surgery. 256 (2), 363-370 (2012).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33 (31), 7756-7764 (2012).
- Choi, S. H., et al. Development of a porcine renal extracellular matrix scaffold as a platform for kidney regeneration. Journal of Biomedical Materials Research Part A. 103 (4), 1391-1403 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Engineering Part A. 22 (19-20), 1140-1150 (2016).
- Gupta, S. K., Mishra, N. C., Dhasmana, A. Decellularization Methods for Scaffold Fabrication. Methods in Molecular Biology. , 1-10 (2017).
- Hudson, T., et al. Optimized Acellular Nerve Graft is Immunologically Tolerated and Supports Regeneration. Tissue Engineering. 10 (11), 1641-1651 (2004).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246 (2006).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B., et al. Organ reengineering through development of a transplantable recellularied liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Nagao, R. J., et al. Preservation of Capillary-beds in Rat Lung Tissue Using Optimized Chemical Decellularization. Journal of Materials Chemistry B. 1 (37), 4801-4808 (2013).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine. 19 (5), 646-651 (2013).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29 (11), 1630-1637 (2008).
- Wolf, M. T., et al. A hydrogel derived from decellularized dermal extracellular matrix. Biomaterials. 33 (29), 7028-7038 (2012).
- Fisher, M. B., et al. Potential of healing a transected anterior cruciate ligament with genetically modified extracellular matrix bioscaffolds in a goat model. Knee Surgery, Sports Traumatology, Arthroscopy. 20 (7), 1357-1365 (2012).
- Ghuman, H., et al. ECM hydrogel for the treatment of stroke: Characterization of the host cell infiltrate. Biomaterials. 91, 166-181 (2016).
- Rijal, G. The decellularized extracellular matrix in regenerative medicine. Regenerative Medicine. 12 (5), 475-477 (2017).
- Lennon, R., et al. Global Analysis Reveals the Complexity of the Human Glomerular Extracellular Matrix. Journal of the American Society of Nephrology. 25 (5), 939-951 (2014).
- Bonandrini, B., et al. Recellularization of Well-Preserved Acellular Kidney Scaffold Using Embryonic Stem Cells. Tissue Engineering Part A. 20 (9-10), 1486-1498 (2014).
- O'Neill, J. D., Freytes, D. O., Anandappa, A. J., Oliver, J. A., Vunjak-Novakovic, G. V. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials. 34 (38), 9830-9841 (2013).
- Streitberger, K. -. J., et al. High-resolution mechanical imaging of the kidney. Journal of Biomechanics. 47 (3), 639-644 (2014).
- Bensamoun, S. F., et al. Stiffness imaging of the kidney and adjacent abdominal tissues measured simultaneously using magnetic resonance elastography. Clinical Imaging. 35 (4), 284-287 (2011).
- Moon, S. K., et al. Quantification of Kidney Fibrosis Using Ultrasonic Shear Wave Elastography. Journal of Ultrasound in Medicine. 34, 869-877 (2015).
- Genovese, F., Manresa, A. A., Leeming, D. J., Karsdal, M. A., Boor, P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis?. Fibrogenesis & Tissue Repair. 7 (1), (2014).
- Hewitson, T. D. Fibrosis in the kidney: is a problem shared a problem halved?. Fibrogenes & Tissue Repair. 5 (1), S14 (2012).
- Wolf, M. T., et al. Polypropylene surgical mesh coated with extracellular matrix mitigates the host foreign body response. Journal of Biomedical Materials Research Part A. 102 (1), 234-246 (2014).
- Faulk, D. M., et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh. Biomaterials. 35 (30), 8585-8595 (2014).
- Jeffords, M. E., Wu, J., Shah, M., Hong, Y., Zhang, G. Tailoring Material Properties of Cardiac Matrix Hydrogels To Induce Endothelial Differentiation of Human Mesenchymal Stem Cells. ACS Applied Materials & Interfaces. 7 (20), 11053-11061 (2015).
- Kim, M. -. S., et al. Differential Expression of Extracellular Matrix and Adhesion Molecules in Fetal-Origin Amniotic Epithelial Cells of Preeclamptic Pregnancy. Public Library of Science ONE. 11 (5), e0156038 (2016).
- Paduano, F., Marrelli, M., White, L. J., Shakesheff, K. M., Tatullo, M. Odontogenic Differentiation of Human Dental Pulp Stem Cells on Hydrogel Scaffolds Derived from Decellularized Bone Extracellular Matrix and Collagen Type I. Public Library of Science ONE. 11 (2), e0148225 (2016).
- Viswanath, A., et al. Extracellular matrix-derived hydrogels for dental stem cell delivery. Journal of Biomedical Materials Research Part A. 105 (1), 319-328 (2017).
- Uriel, S., et al. Extraction and Assembly of Tissue-Derived Gels for Cell Culture and Tissue Engineering. Tissue Engineering Part C Methods. 15 (3), 309-321 (2009).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Faust, A., et al. Urinary bladder extracellular matrix hydrogels and matrix-bound vesicles differentially regulate central nervous system neuron viability and axon growth and branching. Journal of Biomaterials Applications. 31 (9), 1277-1295 (2017).
- Pouliot, R. A., et al. Development and characterization of a naturally derived lung extracellular matrix hydrogel. Journal of Biomedical Materials Research Part A. 104 (8), 1922-1935 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 3935 (2014).
- Pati, F., et al. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials. 62, 164-175 (2015).
- Wang, R. M., Christman, K. L. Decellularized myocardial matrix hydrogels: In basic research and preclinical studies. Advanced Drug Delivery Reviews. 96, 77-82 (2016).
- Jang, J., et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair. Biomaterials. 112, 264-274 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (Pt 24), 4195-4200 (2010).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology. 15 (12), 771-785 (2014).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Hinderer, S., Layland, S. L., Schenke-Layland, K. ECM and ECM-like materials - Biomaterials for applications in regenerative medicine and cancer therapy. Advanced Drug Delivery Reviews. 97, 260-269 (2016).
- Uriel, S., et al. The role of adipose protein derived hydrogels in adipogenesis. Biomaterials. 29 (27), 3712-3719 (2008).
- Singelyn, J. M., et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30 (29), 5409-5416 (2009).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- Loneker, A. E., Faulk, D. M., Hussey, G. S., D'Amore, A., Badylak, S. F. Solubilized liver extracellular matrix maintains primary rat hepatocyte phenotype in-vitro. Journal of Biomedical Materials Research Part A. 104 (4), 957-965 (2016).
- Hill, R. C., Calle, E. A., Dzieciatkowska, M., Niklason, L. E., Hansen, K. C. Quantification of extracellular matrix proteins from a rat lung scaffold to provide a molecular readout for tissue engineering. Molecular & Cellular Proteomics. 14 (4), 961-973 (2015).
- Li, Q., et al. Proteomic analysis of naturally-sourced biological scaffolds. Biomaterials. 75, 37-46 (2016).
- Tanaka, T., Yada, R. Y. N-terminal portion acts as an initiator of the inactivation of pepsin at neutral pH. Protein Engineering. 14 (9), 669-674 (2001).
- Ligresti, G., et al. A Novel Three-Dimensional Human Peritubular Microvascular System. Journal of the American Society of Nephrology. 27 (8), 2370-2381 (2016).
- Mozes, M. M., Böttinger, E. P., Jacot, T. A., Kopp, J. B. Renal expression of fibrotic matrix proteins and of transforming growth factor-beta (TGF-beta) isoforms in TGF-beta transgenic mice. Journal of the American Society of Nephrology. 10 (2), 271-280 (1999).
- Romanowicz, L., Galewska, Z. Extracellular matrix remodeling of the umbilical cord in pre-eclampsia as a risk factor for fetal hypertension. Journal of Pregnancy. 2011, 542695 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved