A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכה כמותית למחצה באמצעות מעקב FDG [18F] בחולים עם פגיעה מוחית חמורה
In This Article
Summary
[18F]-fluorodeoxyglucose (FDG) שחושב טומוגרפיית פליטת פוזיטרונים טומוגרפיה שימושית לצורך לימוד מטבוליזם הגלוקוז הקשורים תפקוד המוח. כאן, אנו מציגים פרוטוקול עבור מעקב FDG [18F] הגדרת והערכה semiquantitative של הניתוח באזור-של-עניין יישוב באזורים המשויכים הביטויים הקליניים בחולים עם פגיעה מוחית טראומטית חמורה.
Abstract
חולים עם פגיעה מוחית טראומטית חמורה (sTBI) יש קושי לדעת אם הם נמצאים במדויק להביע מחשבות ורגשות שלהם בגלל הפרעות של התודעה, שיבשו גבוה יותר המוח פונקציה, והפרעות מילולית. כתוצאה מספיקה היכולת לתקשר, נדרשים הערכה אובייקטיבית של בני המשפחה, הצוות הרפואי המטפלים. אחד הערכה כזו היא להערכת תפקוד אזורים במוח. לאחרונה, נעשה שימוש הדמיה מוחית עם מודאלים מרובים כדי לחקור את הפונקציה של אזורים במוח שניזוק. [18F]-fluorodeoxyglucose שחושב טומוגרפיית פליטת פוזיטרונים טומוגרפיה ([18F] FDG-PET/CT) הוא כלי מוצלח לבחינת תפקוד המוח. עם זאת, ההערכה של מטבוליזם הגלוקוז במוח מבוסס על [18F] FDG-PET/CT אינה אחידה, תלוי במספר פרמטרים שונים, כמו גם מצבו של החולה. כאן, אנו מתארים סדרה של הערכה semiquantitative פרוטוקולים עבור ניתוח התמונה (ROI) אזור-של-עניין באמצעות מתוצרת עצמית [18F] FDG המשדרים בחולים עם sTBI. הפרוטוקול מתמקד הקרנת המשתתפים, להכין את רכיב המעקב FDG [18F] במעבדה חם, תזמון רכישת תמונות [18F] FDG-PET/CT מוח, ואתה למדידת מטבוליזם הגלוקוז באמצעות ניתוח ROI מאזור המוח יישוב.
Introduction
חולים עם sTBI מוצגים עם קשיים נוירולוגיות בלתי חזויה במהלך שיקום הכוללים גירעונות מוטורית חושית גירעונות, יציבות פסיכיאטריות1. למרות ההערכה הקלינית בדרך כלל מבוצע באופן מילולי, חולים עם sTBI כגון תסמונת ערנות לא להגיב או מצב בהכרה מינימלית יש קושי מסוים לדעת אם הם נמצאים במדויק להביע מחשבות ורגשות שלהם בשל הפרעות של התודעה, הפרעת תפקוד המוח גבוה יותר ו-2,הפרעות מילוליות3. בני המשפחה, הצוות הרפואי המטפלים הם לפעמים מבולבל על ידי חזויה שינויים נוירולוגיים או חוסר התגובה שיכולה לנבוע לא מספקת יכולת communicatory4,5.
לאחרונה, נעשה שימוש הדמיה מוחית עם מודאלים מרובים כדי לחקור את אזורי המוח פונקציה6,7,8,9. המוח הוא הצרכן העיקרי של אנרגיה נגזר גלוקוז, עם מטבוליזם הגלוקוז מספקים כ 95% אדנוזין טריפוספט (ATP) הדרושים עבור המוח לתפקד10. ספיגת [18F]-fluorodeoxyglucose (FDG) הוא סמן הקליטה של גלוקוז על ידי רקמת המוח. [18נ] FDG-PET/CT ניתן לזהות ספיגת FDG [18F], ולכן, כלי שימושי לבחינת תפקוד המוח11. באופן כללי, ניתוח תמונות של FDG [18F] מחולקת לשתי קטגוריות: רועי ניתוח וניתוח מבוססת voxel (VBA)12. בדו"חות קודמים מראים כי ניתוח ROI הוא מועדף ללמוד אזורים ספציפיים של פגיעה טראומטית. זה הוא כי VBA (כגון מיפוי פרמטרית סטטיסטי [SPM]) דורש coregistration ונורמליזציה במוח רגיל, אשר לא עובד טוב במקרים של TBI עקב דפורמציה רקמת המוח כגון ניוון מוחי, נפיחות, הגדלה, כיווץ של שטח חדרית7,12. למרות אלגוריתמים ותוכנה שונים פותחו עבור ניתוח נתונים דימות תהודה מגנטית (MRI), מתכות השתמשו בניתוח נוירוכירורגי החלוץ אורטופדי ליצור רעש חפצי אמנות7,12,13 . לאחרונה, השימוש photomultipliers עם PET/CT התקנים השתפרה הרזולוציה המרחבית של PET/CT-derived המוח תמונות14. בפרוטוקול הנוכחי מתמקד באופן כמותי למחצה מדידה גלוקוז ספיגת דרך רועי ניתוח בשימוש FDG-PET/CT [18F] המיוצר עצמית [18F] המשדרים FDG בחולים עם sTBI.
Protocol
מחקר זה היה תרגיל בדרישות ועדת הבדיקה מוסדיים (אישור מס ' 07-01), דבקה עקרונות הצהרת הלסינקי. הסכמה מדעת לשימוש רפואי רשומה והמוח התמונה הושג מן הנציגים המשפטיים המטופלים. המחקר נערך לאחר אישור על ידי ועדת אתיקה מוסדית (2017-14). פרוטוקול זה היה עשוי לבצע את ההנחיות של החברה היפנית של רפואה גרעינית, אירופה האגודה לרפואה גרעינית כמו התייחסות15,16.
1. הקרנה של המשתתפים
- לקבל הסכמה מדעת לשימוש את הרשומות הרפואיות ואת המוח התמונות של החולים מן הנציגים המשפטיים המטופלים. בטח ≤ ניקוד מדד גלאזגו 8 בזמן של תאונה תועדו של כל מטופל הרשומה הרפואית17,18,19.
- החזק נוירולוגיה, פסיכולוגיה וועידות הצוות הרב-תחומי מדי שישה חודשים כדי להעריך את הביטויים הקליניים.
הערה: חברי הועידה צריך לכלול את הצוות הרפואי כגון רופאים, אחיות, פיזיותרפיסטים, בעיסוק, קלינאי, תזונאים, של עובדים סוציאליים רפואיים. הקפידו לבדוק כל הזמן חולים יכול לתקשר (מילולית או בין חיינו) ולקבל החלטות עבור עצמם כי עוררות והסטטוס נוירולוגיות יציבים בדרך כלל. - לנהל את ההערכות הציניות של הפונקציה השמיעתית, תפקיד הראייה, המוטורית, פונקציה oromotor/מילולית, תקשורת פונקציה, מצב עוררות, הבעת פנים, פונקציות רלוונטיות אחרות, באמצעות סוללות הערכה סטנדרטיים כגון לתרדמת שחזור עריכה בקנה מידה (CRS-R), קנה המידה של תרדמת Nociception ו המטריקס פגיעת הראש וסקס20,21,22.
- לוח הזמנים [18F] FDG-PET/CT סורק עבור המטופלים אשר יציבים מבחינה רפואית, בבטחה יכולים להשתתף בבחינות. רק לתזמן את אלה אשר סיפקו מדעת או שנציגיו משפטי סיפקו מדעת, כאמור טופס ההסכמה מדעת. לתזמן ייבוא תמונות של FDG-PET/CT [18F] ליד היום של הערכה קלינית.
2. הכנת רכיב המעקב FDG [18F] במעבדה חם
- במעבדה חם, להתחיל לייצר ריאגנט ערכות עבור ייצור אוטומטי של FDG למידותיו סינתיסייזר FDG (ראה טבלה של חומרים). הקפד להשתמש בתוכנה אוטומטית כדי לבדוק את הניידות של מערכת שאיבה סינתיסייזר FDG, כדי להבטיח כי האוויר אינה דולפת ריאגנט הערכה. לעקר את איזור המגע של המכונה (זוהי שעת ההתחלה).
הערה: הקפד בדוק את המוניטור קרינה במעבדה חם ולהשתמש את dosimeters קרינה נייד כדי לבדוק את רמת הקרינה של כל אדם לפני שהם נכנסים המעבדה חם. - בדוק את עוצמת [16O] - [18O] ומים - הנפח של הליום, מימן, חנקן במיכל הדלק והמים. בדוק אם הטמפרטורה ברז מים לקירור העיקרית היא מתחת לגיל 25 ° C, לקירור משני זה מתחת לגיל 22 מעלות צלזיוס. השתמש כל המים במערכת סגורה (30 דקות לאחר תחילת) לייצור.
- להתחיל את ההקרנות ראשוני של [16O]-מים ציקלוטרון (1h לאחר ההתחלה). בדוק את המוניטור כדי לוודא כי 2-3 מ"ל של [16O]-מים הוא מוקרן בתנאים אופטימליים (למשל, 20 µA, 5 דקות) באזור היעד ציקלוטרון. לאחר ההקרנה להתקין את הבקבוקון [16O]-מים radioisotope מיגון ולמדוד את הרמה של רדיואקטיביות (ראה טבלה של חומרים).
הערה: הדעיכה הרדיואקטיבית צריך להיות מחושבת באמצעות הנוסחה הבאה.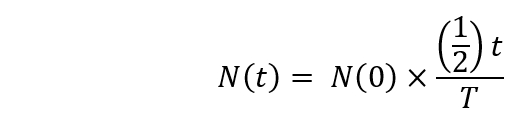
כאן,
N(t) הוא מספר רדיואקטיבית גרעינים ב t = t שניות;
N(0) הוא מספר רדיואקטיבית גרעינים ב t = 0 שניות.
T = זמן מחצית החיים. - להתחיל את ההקרנות [18O]-מים ציקלוטרון (ארבע וחצי שעות לאחר ההתחלה). הגדר הפגזה זמן עד 20 דקות ואת האנרגיה של פרוטונים impinging תהליך 16.5.
- התחל את סינתיסייזר FDG לפי ידנית מפעיל22 (2h לאחר ההתחלה). הליך שונה היא כדלקמן.
- לאחר ההקרנה משתמשים בגז הליום להעביר 2-3 מ"ל של [18O]-מים ציקלוטרון למקבל פוליפרופילן של סינתיסייזר FDG.
- הוק מזרקים אל מנהלי ההתקנים המתאימים מזרק, לחצים ריאגנט בקבוקונים, לפזר את 1,3,4,6-Tetra-O-acetyl-2-O-trifluoromethanesulfonyl-β-D-mannopyranose ב בקבוקון אחד (7 ± 0.2 מ ל) של acetonitrile (טוהר ≥ 99.5%), ולשטוף את הקלטת עם acetonitrile.
- לאחר ההפצצה, להעביר את לקרינה [16O] - [18O] ומים - מים כדי סינתיסייזר FDG.
הערה: לאחר הסינתזה החלה, לקרינה [18O]-מים עובר מחסנית exchange אניון (ראה טבלה של חומרים). הקפד תנאי ולהמיר את המחסנית קרבונט לפני הסינתזה. - לאחר העברת את eluent המכיל את הפעילות [18F] ללא נוזל לתוך כלי התגובה, לאפשר את ממיסים מתמוססות עד יבש. במהלך תהליך הייבוש, להוסיף כמויות קטנות של acetonitrile הספינה תגובה 3 x (בכל פעם, להוסיף 80 µL). מבצעים האידוי ב 95 ° C תחת זרימה חנקן וואקום.
- להוסיף מנוז triflate מבשר (25 מ ג) שאריות יובש לאחר המסת זה כ 3.5 מ ל acetonitrile (עם טוהר ≥ 99.5%). תגובת התמרה נוקלאופילית מתרחשת ב 85 מעלות צלזיוס ב סינתיסייזר FDG.
- כמו טיהור ראשוני, מערבבים את הפתרון שכותרתו עם 26 מ ל מים מזוקקים. לשלוח כ 4 מ"ל של תיוג הפתרון מדולל בחזרה מיכל התגובה לשחזר את הפעילות הנותרים. להעביר את הפתרון באמצעות המחסנית הפוכה-פאזי (ראה טבלה של חומרים). לשטוף את מחסנית המכילה את לכודה שכותרתו קודמן 4 x באמצעות 10 מ"ל, 10 מ ל, מ ל 13 ו- 13 מיליליטר מים מזוקקים על מנקי רצופים.
- להמיר את המתחם acetylated (קודמן שכותרתו) FDG בתוך מיכל הדיו באמצעות אלקליין הידרוליזה, באמצעות µL 750 של 2 N NaOH למשך 2 דקות בטמפרטורת החדר.
- לאחר הידרוליזה, לאסוף את הפתרון FDG אלקליין ב 7 מ ל מים ומערבבים אותו עם הפתרון ניטרול (5 מ"ל של מאגר ציטראט, 1 מ"ל של 2 N HCl).
- לטהר הפתרון שיתקבל FDG ינוטרלו.
- . תעביר את הפתרון FDG ינוטרלו באמצעות מחסנית הפוכה-השלב השני (ראה טבלה של חומרים), שמירה על תרכובות הידרוליזה חלקית ותוצרי פולרי.
- להעביר את זה דרך מחסנית אלומינה N (ראה טבלה של חומרים), שמירה על עקבות האחרון של unreacted [18F] פלואוריד יונים. לאחר מכן, להעביר את זה דרך מסנן 0.22-מיקרומטר.
- לשטוף את הקלטת ואת המחסניות, סינון עם 3 מ ל מים כדי לשחזר את FDG שיורית שנותר שורות ומסננים, ואז, של FDG לתוך המבחנה האחרונה, אשר מכיל 15-17 מ ל נוזל.
- לבצע ניתוח איכותי של חיצי מעקב FDG [18F] (2 שעות 30 דקות לאחר התחלת).
- להתבונן באופן חזותי את המבחנה. לאשר כי זה שקוף, כי זה אינו כולל כל החלקיקים.
- למדוד את כמות הנוזל באמצעות האיזון של Roberval (צריך להיות mL 15-17).
- למדוד את הרדיואקטיביות ואת מחצית חיים באמצעות מיגון radioisotope (כמו שלב 2.3, ראה טבלה של חומרים) (קריטריון: 105-115 דקות).
- לוותר על 0.5 מ"ל של המבחנה. ביצוע טוהר רדיוכימי מבחן דרך פחמימות ניתוח. להשתמש עמודות של 3.9 x 300 מ מ עבור ביצועים גבוהים כרומטוגרפיה נוזלית (ראה טבלה של חומרים) כדי לזהות את שיא רדיואקטיביות (מעל 95).
הערה: לשיא יחיד אומר טוהר גבוהה. - למדוד את רמת החומציות (pH 5.0-8.0) על ידי שימוש בנייר בדיקת pH (ראה טבלה של חומרים). למדוד את משקעי 4,7,13,16,21,24-Hexaoxa-1,10-diazabicyclo [8.8.8] hexacosane (ראה טבלה של חומרים) (< 40 ppm) באמצעות מבחן נייר (ראה טבלה של חומרים). למדוד את endotoxins עם מכשיר מדידה-אנדוטוקסין המתאים דרך ספיגת מדידה (ראה טבלה של חומרים) (0.25 האיחוד האירופי/mL). נעשה בדיקה בשביל בעקרות (מציאת אין בקטריות לאחר 8 יח ב 37 מעלות צלזיוס).
- ממלאים את הצנצנת מכוסה על ידי עופרת ו טונגסטן עם חיצי מעקב FDG [18F] במינון של 5 MBq/ק"ג משקל גוף.
- להעביר את רכיב המעקב FDG [18F] מהמעבדה חם לחדר עבודה (3 שעות 25 דקות לאחר התחלת).
3. זמן הקורס לצורך רכישת תמונות FDG-PET/CT מוח [18נ]
- לתזמן את המטופלים. הקפידו ליידע את הצוות להפסיק תזונה ו האכלה דרך גסטרונומית. לא מפסיקים אספקת מים. המטופלים צריכים מהר ההתחלה 7 שעות לפני הרכישה התמונה.
- להכין את המסלול תוך ורידי [18F] FDG נותב ניהול. לאבטח מחט 22 - ל 24-G עם 5 מ של הפארין נתרן (10 יחידות/mL) באחת הגפיים התחתונות לפני כניסה לשטח שבשליטת קרינה.
- יש את החולים לשכב על אלונקה אור לפני כניסה לשטח שבשליטת קרינה. להביא את החולים האזור שבשליטת קרינה ולחכות 30 דקות, בשתיקה, ואילו הצוות הרפואי למצב המתנה.
- בדוק מחדש patency של המסלול תוך ורידי על ידי ציור דם עם מזרק 10-mL. למדוד את רמות הגלוקוז בדם עם מד הסוכר.
- אחרי שהעביר את רכיב המעקב FDG [18F] מהמעבדה חם לחדר עבודה, להגדיר אותו במערכת לחילוק אוטומטי, הזרקת (ראה טבלה של חומרים).
- בדוק את המידע הבא (באמצעות הצוות הרפואי): מספר זהות המטופל, שם, יום הולדת, גובה ומשקל הגוף; השם של המעקב על כמות מעקב (מים 3.5 מ של מעקב FDG [18F] + 12 מ של תמיסת מלח), רדיואקטיביות מתוכנת (5 MBq/kg), בזמן ההזרקה, מספר מעקב-הרבה של FDG [18F], מהירות הזרקת (בדרך כלל, 0.3 מ ל/s), ו רמת הרדיואקטיביות היה למדידה במעבדה חם.
- לתעד את המדידה אוטומטית לרדיואקטיביות preinjected המופיע בתצוגה של לחילוק אוטומטי ומערכת הזרקת.
- להזריק את [18F] FDG מעקב באמצעות המסלול תוך ורידי מוכן בשלב 3.2 (3 שעות 30 דקות לאחר התחלת).
- שיא נפח מעקב FDG [18F], אשר מוצג באופן אוטומטי בתצוגה של לחילוק אוטומטי ומערכת הזרקת שיורית.
- יש חולים לחכות בחדר ההמתנה של האזור שבשליטת קרינה למשך 50 דקות.
- העברת החולים מחדר ההמתנה למכונה PET/CT (ראה טבלה של חומרים). לתעד את הדימויים המוח 10 דקות (4 שעות 30 דקות לאחר התחלת).
הערה: הפרמטרים הדמיה לתמונות FDG-PET/CT [18F] הם מצב רשימת 10 דקות. לשחזר את המידע פחי 10 דקות. הנתונים מתחת לגיל 3 דקות לא משמשים כי האותות בעוצמה נמוכה אינן מספיקות. לקבוע תמונת שחזור פרמטרים: באלגוריתם שחזור בלוק למיקסום ציפייה התפלגות רציפה (ראה טבלה של חומרים); גודל מטריצה = 192; שדה הראייה = 25 ס מ; Β-ערך: 100-200; סינון ציר z: אף אחד. - לאחר לקיחת התמונות, לבדוק את אזור ההזרקה עבור extravasation. להתעלם שתן אם לחולה יש קטטר שתן עם שקית שתן.
- הסר את החולה מן האזור שבשליטת קרינה (4 שעות 50 דקות אחרי ההתחלה).
הערה: ראה איור 1 סכימטי של הזמנים של אירועים (הליך החולה, סינתזה של רכיב המעקב FDG [18F]).
4. ניתוח של תמונות FDG-PET/CT [18נ]
- להעריך את כל נתוני התמונה עבור ספיגת סטנדרטית הערך (SUV) מדידה שימוש בתוכנת הדמיה (ראה טבלה של חומרים).
- בחר את המטופלים.
- להקצות את הנתונים שזרימת העבודה אונקולוגיה מ מ .
- לחץ על הלחצן עבור Functional דפדפנים.
- לחץ VOI (נפח עניין) הסף לחצן.
- הגדר לספרה VOI הדפדפן תלת מימדי.
הערה: מרבית שטח (SUVmax) ואת כלומר רכב שטח (SUVmean) נמדדים באופן אוטומטי עבור הקול בהתאם לסף SUVmax שבחרת. הקפד לצייר גבול סביב הקול יישוב על הדפדפן באמצעות הספרה תלת מימדי, למעט מטרות נוספות, השרירים extraocular, ויש על הקרקפת כי הם נוטים להפריע הסף רכב שטח הגדר. בדוק אזור היעד על פרוסות צירית, הילתית ואת הווריד. - לאחר בחירת כל את ההגדרות, לחץ על לחצן ערוך המדד .
- לשנות את ערך הסף (לדוגמה, 50%) של הקול ' ולחץ על ' אישור'.
- להקליט את SUVmax SUVmean, אחסון של יעד, הסף של אזור המטרה, אשר נמדדים באופן אוטומטי.
- Sterically להמחיש את חילוף החומרים של הגלוקוז של פני השטח כולו-מוח, להשתמש בתוכנה (ראה טבלה של חומרים) כדי להגדיר מפת צבע לתמונות FDG-PET/CT [18F] המבוסס על רמת הגלוקוז בדם.
- לבסוף, להשוות את ההערכה הקלינית עם תמונות FDG-PET/CT [18F].
תוצאות
גבר בן 63 שנה היה מנוהל על ידי מכונית בעת רכיבה על אופניים הובא לחדר המיון באמצעות האמבולנס. בבדיקה נמצא מדד גלאזגו ציון של 7 (פתיחת העין = 1, הכי טובים תגובה מילולית = 2, הכי תגובה מוטורית = 4), anisocoria (נכון: 2 מ מ, ושמאלה: 3 מ מ), של תגובה שלילית הקרנית17. סי. טי של הרא?...
Discussion
פרוטוקול זה מספק את האמצעים לקיים סדרה של המוח-הגלוקוז מטבולית הערכות באמצעות FDG-PET/CT [18F] המיוצר עצמית [18F] מעקב FDG במוסד אחד.
הייצור של מעקב FDG [18F] בעקבות ההליך המתואר במדריך מפעיל סינתיסייזר FDG; עם זאת, זהירות הכרחי לגבי שלוש נקודות. ראשית, הפגזה הזמן והאנרגיה (...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצים להודות ד ר Uchino בבית החולים Sousen עבור כל שגרות. המחברים מודים גם אדם פיליפס מקבוצת Edanz (www.edanzediting.com/ac) על עריכת טיוטה של כתב יד זה.
Materials
| Name | Company | Catalog Number | Comments |
| 20ml syringe | Terumo | SS-20ESZ | |
| 10ml syringe | Terumo | SS-10ESZ | |
| 1ml syringe | Terumo | SS-01T | |
| Protective plug | Top | ML-KS | |
| Three-way cock L type 180° | Terumo | TS-TL2K | |
| Extension tube | Top | X1-50 | |
| Indwelling needle 22G or 24G | Terumo | SR-OT2225C | |
| Tegaderm transparent dressing | 3M | 1624W | |
| Hepaflash 10U/ml 10ml | Terumo | PF-10HF10UA | |
| Auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01 | |
| Fluid for auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01-001 | |
| Millex-GS Syringe Filter Unit | Millipore | SLGSV255F | |
| Air needle | Terumo | XX-MFA2038 | |
| Check valve | Hakko | 23310100 | |
| Saline 500ml | HIKARI pharmaceutical Co., Ltd. | 18610155-3 | |
| Yukiban 25x7mm | Nitto | 3252 | |
| Elascot No.3 | Alcare | 44903221 | |
| Presnet No.3 27x20mm | Alcare | 11674 | |
| Steri Cotto a 4x4cm | Kawamoto | 023-720220-00 | |
| StatstripXp3 | Nova Biomedical | 11-110 | |
| Statstrip Glucose strips | Nova Biomedical | 11-106 | |
| JMSsheet | JMS | JN-SW3X | |
| Injection pad | Nichiban | No.30-N | |
| Stepty | Nichiban | No.80 | |
| Advantage Workstation | GE Healthcare | Volume Share 7. version 4.7 | |
| Discovery MI PET/CT | GE Healthcare | ||
| EV Insite | PSP | ||
| GE TRACERlab MXFDG synthesizer reagent kit | ABX | K-105TM | |
| TRACERlab MXFDG cassette | GE Healthcare | P5150ME | |
| Extension tube | Universal Giken Co., Ltd | AT511-ST-001 | |
| TSK sterilized injection needle 18x100 | Tochigiseiko | AT511-ST-004 | |
| TSK sterilized injection needle 18x60 | Tochigiseiko | AT511-ST-002 | |
| TSK sterilized injection needle 21x65 | Tochigiseiko | AT511-ST-003 | |
| Seal sterile vial -N 5ml | Mita Rika Kogyo Co., Ltd. | SSVN5CBFA | |
| k222 TLC plate | Universal Giken Co., Ltd. | AT511-01-005 | |
| Anion-cation test paper | Toyo Roshi Kaisha | 7030010 | |
| Endospecy ES-24S set | Seikagaku corporation | 20170 | |
| Sterile evacuated vial | Gi phama | 10214 | |
| 5ml syringe | Terumo | SS-05SZ | |
| Extension tube | Top | X-120 | |
| Finefilter F | Forte grow medical Co.Ltd. | F162 | |
| Millex FG | Merck | SLFG I25 LS | |
| Vented Millex GS | Merck | SLGS V25 5F | |
| Injection needle 18x38 | Terumo | NN-1838R | |
| Injection needle 21x38 | Terumo | NN-2138R | |
| Water-18O | Taiyo Nippon Sanso | F03-0027 | |
| Distilled water | Otsuka phrmaceutical | ||
| Hydrogen gas G1 | Hosi Iryou Sanki | ||
| Helium gas G1 | Hosi Iryou Sanki | ||
| Nitrogen G1 | Hosi Iryou Sanki | ||
| TRACERlabMXFDG | GE Healthcare | ||
| Sep-Pak Light Accell Plus QMA | WATERS | ||
| Sep-Pak Plus tC18 | WATERS | ||
| Sep-Pak Plus Alumina N | WATERS | ||
| HPLC with 3.9 X 300 mm columns | WATERS | ||
| US-2000 | Universal Giken CO. Ltd. | ||
| Kryptofix222 | Merck | ||
| EG Reader SV-12 | Seikagaku Corporation | ||
| UG-01 | Universal Giken Co., Ltd. | ||
| syngo.via | Siemens Healthineers | ||
| Advantage Workstation Volume Share 7, version 4.7 | GE Healthcare | ||
| Q clear | GE Healthcare | ||
| CRC-15PET dose calibrator | CAPINTEC, INC. |
References
- Godbolt, A. K., et al. Disorders of consciousness after severe traumatic brain injury: a Swedish-Icelandic study of incidence, outcomes and implications for optimizing care pathways. Journal of Rehabilitation Medicine. 45 (8), 741-748 (2013).
- Klingshirn, H., et al. Quality of evidence of rehabilitation interventions in long-term care for people with severe disorders of consciousness after brain injury: A systematic review. Journal of Rehabilitation Medicine. 47 (7), 577-585 (2015).
- Fischer, D. B., Truog, R. D. What is a reflex? A guide for understanding disorders of consciousness. Neurology. 85 (6), 543-548 (2015).
- Klingshirn, H., et al. RECAPDOC - a questionnaire for the documentation of rehabilitation care utilization in individuals with disorders of consciousness in long-term care in Germany: development and pretesting. BMC Health Services Research. 18 (1), 329 (2018).
- Stéfan, A., Mathé, J. F. SOFMER group. What are the disruptive symptoms of behavioral disorders after traumatic brain injury? A systematic review leading to recommendations for good practices. Annals of Physical and Rehabilitation. 59, 5-17 (2016).
- Liu, S., et al. Multimodal neuroimaging computing: a review of the applications in neuropsychiatric disorders. Brain Informatics. 2 (3), 167-180 (2015).
- Wong, K. P., et al. A semi-automated workflow solution for multimodal neuroimaging: application to patients with traumatic brain injury. Brain Informatics. 3 (1), 1-15 (2016).
- Chennu, S., et al. Brain networks predict metabolism, diagnosis and prognosis at the bedside in disorders of consciousness. Brain. 140 (8), 2120-2132 (2017).
- Di Perri, C., et al. Neural correlates of consciousnes s in patients who have emerged from a minimally conscious state: a cross-sectional multimodal imaging study. The Lancet Neurology. 15 (8), 830-842 (2016).
- Erecińska, M., Silver, I. A. ATP and brain function. Journal of Cerebral Blood Flow & Metabolism. 9 (1), 2-19 (1989).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807 (2015).
- Byrnes, K. R., et al. FDG-PET imaging in mild traumatic brain injury: a critical review. Frontiers in Neuroenergetics. 5, 13 (2014).
- Mortensen, K. N., et al. Impact of Global Mean Normalization on Regional. Glucose Metabolism in the Human Brain. Neural Plasticity. , 6120925 (2018).
- Wagatsuma, K., et al. Comparison between new-generation SiPM-based and conventional PMT-based TOF-PET/CT. Physica Medica. 42, 203-210 (2017).
- Fukukita, H., et al. Japanese guideline for the oncology FDG-PET/CT data acquisition protocol: synopsis of Version 2.0. Annals of Nuclear Medicine. 28 (7), 693-705 (2014).
- Varrone, A., et al. EANM procedure guidelines for PET brain imaging using [18F]FDG, version 2. European Journal of Nuclear Medicine and Molecular Imaging. 36 (12), 2103-2110 (2009).
- Teasdale, G., Jennett, B. Assessment of coma and impaired consciousness. A practical scale. The Lancet. 2 (7872), 81-84 (1974).
- Valadka, A. B., Moore, E. J., Feliciano, D. V., Moore, E. E. Injury to the cranium. Trauma. , 377-399 (2000).
- Carney, N., et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 80 (1), 6-15 (2017).
- Giacino, J. T., Kalmar, K., Whyte, J. The JFK Coma Recovery Scale-Revised: measurement characteristics and diagnostic utility. Archives of Physical Medicine and Rehabilitation. 85 (12), 2020-2029 (2004).
- Schnakers, C., et al. The Nociception Coma Scale: a new tool to assess nociception in disorders of consciousness. Pain. 148 (2), 215-219 (2010).
- Shiel, A., et al. The Wessex Head Injury Matrix (WHIM) main scale: a preliminary report on a scale to assess and monitor patient recovery after severe head injury. Clinical Rehabilitation. 14 (4), 408-416 (2000).
- GE Healthcare. . TRACERlabMXFDG operator manual, Version 1. , (2003).
- Yamaki, T., et al. Association between uncooperativeness and the glucose metabolism of patients with chronic behavioral disorders after severe traumatic brain injury: a cross-sectional retrospective study. BioPsychoSocial Medicine. 12, 6 (2018).
- Schwaiger, M., Wester, H. J. How many PET tracers do we need?. Journal of Nuclear Medicine. 52, (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved