Method Article
תלת מימדי הרתי תרבות מערכת לייצר Murine המושרה תא גזע Pluripotent-הגידול הנגזר אנטיגן-מהגרים ספציפיים הרתי
* These authors contributed equally
In This Article
Summary
מאמר זה מתאר את השיטה הרומן לייצר אנטיגן הגידול-ספציפי המושרה ביותר תאים גזע מהגרים הרתי (iTE) על ידי תלת מימדי (3D) מערכת התרבות הרתי. iTE הינם תת-קבוצה הומוגנית של תאי T הקשורים היטב לתאי T תמימים עם יכולת התפשטות, היווצרות הזיכרון ודיכוי הגידול.
Abstract
הירושה של מראש קולטנים תא T (TCRs) ואת התחדשות אפיגנטית שלהם לעשות המושרה תא גזע מושרה (iPSC)-תאי T נגזר מקור מבטיח טיפול תא T המאמצת (ACT). עם זאת, קלאסי בשיטות מבחנה להפקת תאי T מחדש מתוך iPSC תוצאה או מולדים כמו או סופני תאי T הבדיל, אשר פנופנבדרך כלל ומבחינה פונקציונלית נפרד מתאי T נאיבי. לאחרונה, הרומן תלת מימדי (3D) מערכת התרבות הרתי פותחה כדי ליצור תת-קבוצה הומוגנית של CD8αβ+ אנטיגן מסוים תאים t עם הפנוטיפים תמים תא t פונקציונלי, כולל את הקיבולת של התפשטות, זיכרון היווצרות , ודיכוי הגידול בvivo. פרוטוקול זה נמנע מגורל התפתחותי חריג, המאפשר את הדור של התאים הרלוונטיים מבחינה קלינית iPSC-נגזר מהגרים (iTE), תוך שהוא גם מספק כלי חזק כדי להבהיר את הפונקציות העוקבות הדרושים עבור התבגרות תא T לאחר הבחירה הרתי.
Introduction
טיפול תא T המאמצת (ACT) יכול להיות טיפול יעיל עבור חלק מהחולים עם סרטן מתקדם. למרבה הצער, חולים רבים אינם חווים רגרסיה הגידול, ותאים הועברו לא להימשך לאחר העירוי. זה יכול להיות בגלל איכות התאים T החדרת. מודל העכבר משחק הראה כי בהשוואה נאיבי או פחות הבדיל הזיכרון המרכזי T תאים, התאים המובחנים סופני הם פחות חזקים בשל עניים בהתמדה vivo1, התבוננות נתמכת גם על ידי נתונים קליניים2, 3. שלוש.
במאמץ לשפר את היעילות של הפעולה הנוכחית, תא T נגזר המושרה תאים גזע pluripotent t-ipsc) נחקרו בהרחבה4,5. כאשר תאי T מתוכנת מחדש ל-T-iPSC ו-re-מובחנת לתוך תאי T, את התצורה המחודשת של גנים TCR הוא ירש על ידי T-iPSC, ולאחר מכן הבדיל מחדש תאים T. לכן, היכולת של T-iPSC לעבור בלתי מוגבל הרחבת מבחנה היתרי שכפול יעיל של תאים T בוגרים נושא את קולטני התא הספציפי T-אנטיגן (TCR) כאשר תאים כגון מהונדסים אנטיגן הגידול ספציפיים תאים T6 ,7. עם זאת, את השיטה המדויקת עבור הבידול של T-iPSC לתוך תאים T בוגרים, אשר יאפשר ייצור של סרטן אנטיגן ספציפי בתאי T עם פנוטיפ פחות הבדיל ועוצמת הגידול טוב יותר אנטי סרטניים, נשאר להבהיר.
T-ipsc בידול העסקת שיתוף התרבות של OP9 murine בתאי סטרומה מעל-הביטוי האדם הדרגה האנושית DLL1 היא שיטה מבוססת היטב כדי לייצר תאי T ב מבחנה6,7. בעכברים ובבני אדם, זו מערכת שיתוף התרבות יכול בעקביות להבדיל ipsc, ובכך לכידה של אירועים התפתחותיים משלב בלסטוציסט עד השלב בוגר T שושלת היוחסין6,7. למרות ההתקדמות הביוטכנולוגית, הבידול הפיזיולוגי אחרי CD4+CD8+ כפול (DP) הבמה עדיין קשה להשיג. אחת הסיבות היא כי ב vivo CD4+CD8- ו CD4-CD8+ יחיד חיובי (SP) תאים t נוצרות ב בלוטת התימוס, איבר האחראי על ההבשלה והבחירה של תאים t כי יש אנטיגן זר-ספציפיות אבל לא מחדש אוטומטי של פעילות8. תהליכים סלקטיביים אלה מוגדרים כבחירה חיובית ושלילית, בהתאמה. עם זאת, רוב המנגנונים המולקולריים הדרושים לתאי T בוגרים בתימוס עדיין לא מובנים לגמרי, מה שמקשה לשחזר תהליך זה בתוך מבחנה. בניסיון להתגבר על משוכה פיזיולוגית זו, מספר קבוצות הגירוי מורכבות TCR באמצעות נוגדנים anti-CD3 או הפפטידים אגוניסט. אלה טכניקות מבחנה ליצור מוצרי תא אשר לבטא סמנים תא T מפתח, כמו CD3, CD8αβ, TCRαβ, ו CD62L, ואילו עדיין שמירה על אנטיגן הגידול-ספציפיות. למרבה הצער, תאי T שנוצרו על ידי אלה השיטות החוץ מהווים אוכלוסיה הטרוגניים רחב של תאים המאופיינת בחירה חיובית לא מלאה, תכונות מולדת, הריגת TCR לא ספציפי, חוסר יכולת ליצירת זיכרון, ו לא מתמשך השפעות נגד הגידול ב vivo8,9,10,11. חריגות אלה העלו חששות כי תאים כאלה עשויים לעורר מגוון של תופעות לוואי, כולל לימפומה הן מומים העור והן העצם, אם משמש יישומים טיפוליים12,13,14 .
כדי לשחזר את האותות הפיסיולוגיים חסר במערכות בידול חוץ גופית, הגידול אנטיגן ספציפי T-iPSC הובשלו באמצעות בלוטת התימוס שנקטפו. התרבות העובר בלוטת התימוס הקלאסית (FTOC) מערכת, אשר נועדה ללמוד את הפיתוח הפנים הרתי של תאים T, שופרה באמצעות מערכת התרבות 3D אשר הפיק בהצלחה תאים T השלימה החינוך הרתי. אלה תאים שלאחר הרתי, אשר הוצגו כמהגרים iPSC הרתי (iTE), הציגו מאפיינים תמימים כמו15. iTE הראה התפשטות, היווצרות זיכרון, ואפקטים הולמים נגד הגידול במודל העכבר מפני הקים B16 מלנומה גידולים. מאמר זה מתאר בפרוטרוט את הפרוטוקול של מערכת FTOC מקורית זו באמצעות מערכת תרבות תלת-ממדית (איור 1).
Protocol
כל הניסויים בבעלי חיים אושרו על ידי טיפול בעלי חיים מוסדיים וועדות השימוש של המכון הלאומי לסרטן (NCI) והופיע בהתאם הנחיות NIH.
1. הכנת תאים OP9/DLL1 עבור תרבות שיתוף עם iPSC
- תרבות OP9/DLL1 תאים ב-OP9 מדיה (α-בינוני חיוני מינימלי [α-הגברת] + 20% ללא חום סרום העוברי בלתי מופעל [FBS] + 1x פניצילין-סטרפטומיצין + החומצה האסקורבית [50 ng/mL] ו-מונו-תאיוגלינול [100 nM]) ב 37 ° c. כאשר OP9/DLL1 תאים להגיע 80-95% השטף, לשטוף פעם אחת עם מגנזיום 1x, סידן, ו פנול אדום חינם פוספט באגירה מלוחים (להלן המכונה PBS).
- הוסף 4 מ ל של 0.05% טריפסין ו דגירה עבור 5 דקות ב 37 ° c. לאחר מכן להוסיף 4 מ ל של OP9 מדיה, הנתק את שכבת התא על ידי ליטוף לעשות השעיה תא אחד.
- להעביר את ההשעיה התא לתוך שפופרת 50 mL באמצעות מסננת תא 100 יקרומטר. צנטריפוגה ב 300 x g עבור 5 דקות ב 4 ° c, משאכל את סופרנטאנט, ומשהה מחדש ב 12 מ ל של מדיה OP9.
- צלחת 2 מ ל של OP9/DLL1 cell הבולם על חדש 10 ס"מ התרבות התא צלחת פטרי להוסיף נוספים 8 מ ל של OP9 מדיה. חזור על מעבר מדי יומיים עד 3 ימים.
הערה: האיכות של FBS ותנאי התרבות הם קריטיים כדי לשמור על התרחבות של OP9/DLL1 תאים מבלי לאבד את היכולת שלהם תמיכה iPSC בידול. לכן, מומלץ להעריך מראש את הרבה FBS ומעבר בעקביות ב 80% השטף כדי למנוע בידול התא והזדקנות. חשוב גם לעשות מספיק מלאי קפוא של OP9/DLL1 תאים ולהפשיר מלאי חדש כל 4 – 6 שבועות.
2. בבידול חוץ גופית של iPSC אל תאים T בוגרים
-
ביום 0, התחילו שיתוף תרבות iPSC על מאכלים OP9/DLL1 confluent.
- בציר iPSC כמו תא אחד השעיה על ידי טריסיזציה (5 דקות ב 0.05% טריפסין ב 37 ° c), לאסוף את התאים, ואת צנטריפוגה ב 300 x g עבור 5 דקות ב 4 ° c.
- משף את התאים האלה ומשהה מחדש ב-1.0 x10ipsc לכל 10 mL של מדיה OP9. פלייט 1.0 x 105 ipsc על a CONFLUENT OP9/DLL1 10 ס מ צלחת.
הערה: OP9/DLL1 10 מנות ס מ משמשות לבידול iPSC כאשר הם מגיעים 90-100% שטף. הבדלים בשטף יכול להשפיע על היעילות של iPSC בידול.
- ביום 3, מאכלת מדיה ישנים ולהחליף עם 10 מ ל של OP9 מדיה טריים.
-
. ביום 6, בתאי מעבר
- כביסה כל 10 ס מ confluent OP9 צלחת עם 10 מ ל של PBS. הוספת 3 מ ל של 0.05% טריפסין לכל מנה ומודטה עבור 3 – 5 דקות בטמפרטורת החדר (RT).
- הוסף 4 מ ל של OP9 מדיה ולאסוף תאים על ידי ליטוף עדין. להעביר תאים דרך מסננת תא 100 יקרומטר ו צנטריפוגה ב 300 x g עבור 5 דקות ב 4 ° c. . להיפטר מסופרנטאנט
- להשעות את התאים ב 10 מ ל של בידול מדיה (OP9 מדיה עם 5 ng/ml Flt3 ליגנד [FLT3L] ו 5 ng/ml העכבר IL-7) ואת התא צלחת ההשעיה אל חדש 10 ס מ OP9/DLL1 הצלחת confluent.
- ביום 9, מותיקים את המדיה הישנה ומחליפים עם 10 מ ל של מדיה בידול טרי.
-
ביום 11 כאשר קרדיוציטים הם נצפו במושבות ipsc, ניתוק מכני תאים שאינם מחסיד על ידי ליטוף ולסנן דרך מסננת תא 100 יקרומטר. ספין ב 300 x g עבור 5 דקות ב 4 ° c.
- ומשהה מחדש 24 מ ל. של בידול מדיה הלוח iPSC לתוך confluent OP9/DLL1 6-בסדר צלחת (4 מ"ל/טוב).
-
ביום 15, לאסוף את כל התאים הלא מחסיד ולסנן דרך מסננת תא 40 יקרומטר.
- ספין ב 300 x g עבור 5 דקות ב 4 ° c.
- המשך לדרוך על התאים הלא-מחסיד כל 3 עד 4 ימים על-ידי 2.5.1 צעד חוזר.
3.3D הרתי עוגב תרבות כדי ליצור הניט
- הקציר העכבר העוברי האונות ולפרוס של לימפוציטים אנדוגניים ידי deoxyguanosine (dGUO) הטיפול כפי שתוארה בעבר16.
- ביום 7 של הטיפול dGUO, לקחת ארבעה חדשים 10 ס מ מנות ולמלא כל אחד עם 20 מ ל של מדיה מלאה (Rosswell פארק הזיכרון המכון מדיה 1640 [RPMI 1640] + 10% FBS + 1x L-alanyl-ל-גלוטמין + 1x נתרן פירובט + 1x בינוני חיוני מינימלי עם חומצות (הגברת-NEAA) + 1x פניצילין-סטרפטומיצין + [1:1000] 2-mercapto אתנול).
- העבר את כל הממברנות תאית עם האונות הרתי לתוך 1 10 ס"מ צלחת. ניתוק האונות הבודדות מן הקרום עם מלקחיים, מה שמאפשר להם להיות שקוע במדיה. . להשליך את הקרומים . מודטה בשביל 1 h ב-RT
- העבר את האונות הרתי לצלחת חדשה 10 ס מ עם מדיה שלמה ו-מודטה עבור 1 h ב RT. חזור על שלב זה 2 פעמים נוספות.
- באמצעות מלקחיים, לתקן את האונות הרתי אל המנה (אחד בכל פעם), עם היד האחרת לעשות 100-200 יקרומטר חתך עמוק במרכז והארכת חצי קוטר האונה כדי להקל על הגירה תא מחולל T לתוך האונה.
- העברת האונות הרתי למנה חדשה 10 ס מ מלא מדיה בידול מלא (מדיה מלאה + 5 ng/mL העכבר IL-7 + FLT3L ng/mL העכבר + 5 ng/mL SCF).
- באופן אופציונלי, אם משתמשים בלוחות תרבות תלת-ממדיים עם רשתות ברמה נמוכה יותר, מלא את שתי הרשתות עם ה-PBS הסטרילי כדי למנוע אידוי וייבוש של טיפות תלויות.
- העברה 30 μL של מדיה מלאה המכילה האונה הרתי dGuo מטופלים אחד משלב 3.6 לתוך כל טוב של צלחת התרבות 3D.
- לאסוף שאינם חסיד תאים שושלת היוחסין (iPSC-נגזר תאים T בוגרים) מ OP9/DLL1 שיתוף התרבות (ימים 16-21) (שלב 2.6.2) ו להשעות ב 2 – 5 x 103 תאים השושלת T לכל 20 מדיה μl.
- הוסף 20 μL של השעיית תא השושלת T לאונה כל הרתי בצלחת התרבות התלת-ממדית. דגירה לילה ב 37 ° צ' עם 5% CO2.
- להגדיר את P200 pipet 30 μL ו לבשל את התקשורת לאחר ליטוף מספר פעמים מכל טוב כדי להסיר את כל התאים המקיפים את האונות הרתי. למחוק מדיה ולהוסיף 30 μL של מדיה מלאה. חזור על הליך זה 5 – 7 פעמים כדי להסיר כל התאים T בוגרים נוספים אשר אינו להגר לתוך האונות. שינוי 25 – 30 μL של מדיה מדי יום לאחר מכן.
- לאשר את היווצרות של הילה של מהגרים הרתי iPSC הנגזר (iTE) סביב האונות החל ביום 4 – 5 על ידי מיקרוסקופ אור.
- לאסוף את הקיט מדי יום על ידי ליטוף מדיה ללא הפרעה באונה. שנה מדיה כל יום והמשך לאסוף עד 12 ימים בקירוב.
- הניט שנקטפו מוכנים לשימוש עבור ניתוחים מולקולריים (איור 2, איור 3, איור 4, איור 5) או בניסויים vivo השתלת.
4. הכנת תאים אנטיגן המציג (APC)
- להקריב עכבר C57BL/6 על ידי פריקה צוואר הרחם מקום על מחצלת פלסטרים מעבדה כמתואר לעיל.
- להסיר את הטחול ולמקם אותו על מסננת תא 100 יקרומטר. דחיסת הטחול על המסננת באמצעות מזרק 12 מ ל כדי ליצור תא השעיה אחת.
- העברת ההשעיה התא באמצעות מסננת תא 40 יקרומטר סטרילי. צנטריפוגה את ההשעיה ב 300 x g עבור 5 דקות ב 4 ° צ' כדי לצנפה את התאים.
- משאת הסופרנטאנט ומשהה מחדש את הגלולה בתא 2 מ ל של אמוניום-כלוריד-אשלגן (ACK) מאגר לפירוק כדי להוציא את כדוריות הדם האדומות (RBC). דגירה עבור 5 דקות ב RT.
- כיבוי מאגר הליזה ACK על-ידי הוספת 10 מ ל של PBS. כדור התאים על ידי צנטריפוגה ב 300 x g עבור 5 דקות ב 4 ° c.
- משאת הסופרנטאנט ומשהה מחדש את הגלולה ב -10 מ ל של אמצעי תקשורת מלאים ומעבירים לצלחת פטרי בגודל 10 ס מ.
- הקרנת טחול עם 3500 rad באמצעות מכשיר הקרנה (קרינה γ) כדי למנוע הפצת תאים.
- החזר מיד את התאים שעברו לקרינה לחממה ולתרבות של 37 ° c בלילה.
- השתמש בתאים שעברו הקרינה כמו APC או להקפיא בנקאי התא.
5. פעימות APC עם אנטיגן
- הרוזן APC חי לקרינה באמצעות הומוציטוטומטר נויבאואר וטריקון צבע כחול. מיכל APC עם פפטידים (hgp100) או נואופלפרוטאין עבור 30 דקות ב 37 ° c.
- לשטוף APC פעמיים עם 10 מ ל של PBS להסיר כל פפטיד נוסף.
- לספור iTE ולערבב עם APC ביחס 1:1 במדיה המלאה עם 100 IU IL-2 ו 5 ng/mL IL-7. Aliquot 100 μL של התערובת של תאים (ריכוז סה כ: 1 x 106 תאים/mL) לתוך כל באר של מצורף אולטרה נמוכה התחתון U 96 בצלחת ותרבות עבור 48 h ב 37 ° c.
- לאחר 48 h, להעביר את התאים לצלחת חדשה באמצעות מעבר הצינורות רב-ערוצי כל 2 – 3 ימים לאחר מכן.
-
ביום 3, לנתח את הפרשת ציטוקינים פרופיל על ידי צביעת התאים עם נוגדן תאיים ולנתח ידי cy, שלוש זרימה (איור 3).
- הוסף 0.67 μL/mL של מעכב הובלה חלבונים (למשל, GolgiStop) ו-דגירה ב 37 ° צ' עבור 6 h כדי לשפר את הצטברות תאיים של ציטוקינים. שטוף עם 10 מ ל של PBS.
- השהה את התאים במהירות של 3 מ ל (4 ° צלזיוס) PBS והוסיפו באיטיות 1 מ ל קר 4% פאראפורמלדהיד.
- לאחר 10 דקות, לסובב את התאים ב 300 x g עבור 5 דקות ב 4 ° c, להיפטר supernatant ולשטוף עם 10 מ ל של PBS.
- השהה תאים מחדש ב-1 מ"ל PBS + 1% FBS + 0.1% nonionic סטנט, והמקום ב 4 ° c עבור 10 – 15 דקות.
- הוסף נוגדנים, להגן על דגימות מאור ומקום ב 4 ° c עבור 30 דקות.
- לסובב את התאים ב 300 x g עבור 5 דקות ב 4 ° c, למחוק supernatant, ולשטוף עם 10 מ ל של PBS.
- לסובב את התאים ב 300 x g עבור 5 דקות ב 4 ° c ו להשעות את התאים מחדש 1 מ ל של PBS. תאים מוכנים להיות מנותח בתוך cytometer זרימה.
תוצאות
שיתוף מתורבת העוברי שימושים היו מנות לנתח אם בתאי השושלת iPSC-נגזר יכול להגר לתוך האונות הרתי. האונות לשלוט בלתי מופרה היה ארכיטקטורה רקמה המאופיינת באינטרנט האפיתל כמו הרתי בסגנון astrocyte17, פרוס של CD3+ תאים. מצד שני, האונות הרתי הזרע עם התאים הנגזרים iPSC-נגזר מאוכלס מחדש עם CD3+ מונמונומנט תאים, המציין הגירה של תאים הנגזרים ipsc-נגזר לתוך האונות (איור 2א).
תאי T שהיגרו לתוך והתבגר בתוך המיקרו הסביבה הרתי לאחר מכן גרבו בתור iTE. כדי לבדוק את האפיון פנוטיטי שלהם, ניתוח cyC57BL6 הזרימה של הזרע, Pmel iPSC-נגזר תאים T בוגרים (הרתי), תאים שגרחו מן האונות הרתי (iTE) בוצעה. בתאי T הרתי ב OP9/DLL1 הראה CD4+CD8+ (DP) תאים t CD8αSP תאים ללא ביטוי של סמן בחירה חיובית mhc-i, בעוד הייט היה אוכלוסייה ברורה של CD8αSP mhc-i+ T תא פנוטיפים, המציין שלהם מעבר מוצלח דרך בחירה חיובית לפני לגרסינג מן האונות הרתי. באופן עקבי לבטא mhc-I ו CD62L, שהם סמנים הקשורים ביכולות ההתרבות גבוה, הייצור cy, הישרדות היקפית, ו הלימפה מתביית18,19,20. פנוטיפ זה תואם M2 הSP thymocytes כי הם האוכלוסייה הבוגרת ביותר של תאים חיוביים בודדים 1 ב בלוטת התימוס20, אשר מרמז כי הניט העבר דרך תוכנית נורמלית התפתחותית הרתי (איור 3). כדי לעקוב אחר היעילות של הדור הניט, תאים שגרזו מתוך האונות הרתי הפרט היו מבודדים. ביום 7, האונות הרתי שנוצר ממוצע של 1 x 103 חי CD8SP cd 45.1+ CD3 ו -iTE ליום (איור 3ב). שיעור דומה של ייצור iTE הוא נצפה מיום 6 עד יום 12 של תרבות שיתוף 3D הרתי.
אנטיגן תלוי הפעלה הפרשה של ציטוקינים נותחו כדי להתבונן המאפיינים הפונקציונליים של thymically משכילים iPSC-נגזר בתאי T בוגרים. בנוכחות פפטיד לא רלוונטי (נואופלפרוטאין), Pmel-iTE לא שחרר כמויות משמעותיות של TNF-α, IL-2, או IFN-γ. כאשר מגורה עם פפטיד קנצוני עבור תאים T (hgp100), pmel-iTE שוחרר כמויות חזקות של tnf-α ו-IL-2, תוך שהוא גם הפקת כמויות נמוכות של ifn-γ (איור 4), המציין כי משכילים thymically iTE יכול לזהות פפטיד קנצוני שלהם ו להפריש ציטוקינים עם פרופיל הדומה לזה של מהגרים הרתי האחרונים (כביש).
כדי לבחון את ההבדלים הטרנססבועיים בין התאים הנגזרים לשושלת היוחסין של iPSC, המובחנים ב-OP9/DLL1 עם או בלי השכלה הרתי (כלומר, הליט לעומת התאים T), ניתוח RNA-seq בוצע על שתי האוכלוסיות הללו ובהשוואה זה של התאים DP T היוחסין הבדיל באמצעות OP9/DLL1 (DP) ו נאיבי הראשי CD8+ Pmel T תאים. הביטוי של 102 גנים אשר משחקים תפקידים מהותיים בתוך הקימוט תא T, thymocyte הפעלה, ואת היווצרות הזיכרון נותחו15,20,21,22. ניתוח המרכיב העיקרי של אלה ארבע האוכלוסיות שנחקרו הפגינו כי extrathymically שנוצרו CD8SP T תאים מקובצים יחד, בעוד iTE מקובצים קרוב תאי T תמים (איור 5). באופן קולקטיבי, נתונים אלה מדגימים כי iTE יש פנוטיפ קרוב יותר לתאי T התמימים מאשר תאי השושלת המופקים שנוצרו על ידי שיטות חוץ.
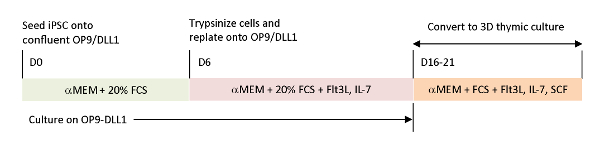
איור 1 : תרשים סכימטי של הבידול של iPSC כדי iTE באמצעות OP9/DLL1 ותרבות הרתי 3d. הפרוטוקול כולל שלושה צעדי בידול נפרדים; (משמאל) מתאי ipsc לתאי היוחסין של השושלת ב OP9/DLL1 (יום 0 כדי 6),(באמצע) מתאי השושלת המטפאות לתאי T בוגרים ב OP9/DLL1 עם ציטוקינים (יום 6 עד 16 – 21), ו (מימין) מתאי t בוגרים (יום 16 – 21) כדי ל ניט משתמש במערכת תרבות תלת-ממדית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
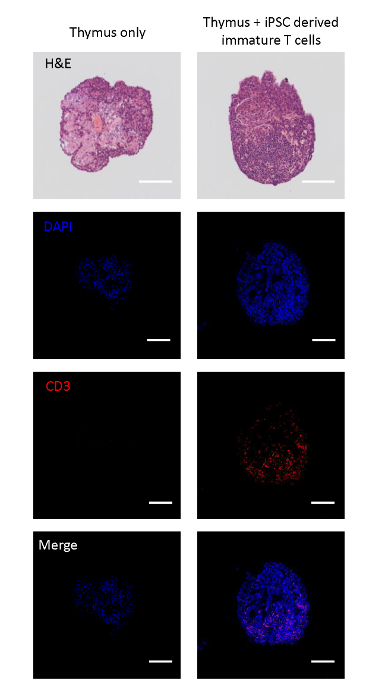
איור 2 : אימונוכימיה של האונות הרתי שנזרע עם תאים iPSC-נגזרות לא בוגרים. למעלה: H & E כתמים של האונה הרתי עם ומבלי לזריעה של תאים T בוגרים נגזרות iPSC. משני העליונים לתחתית: תמונות מיקוד של האונות מנות המוכתמים עם DAPI (הגרעין), CD3 (T תא), ומיזוג. קנה מידה ברים = 100 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
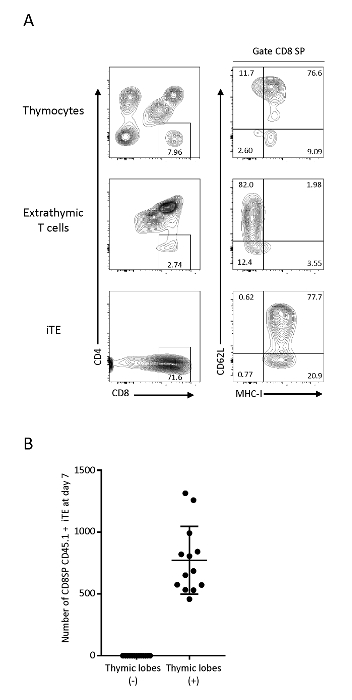
איור 3 : הופעה של תא T. שלאחר הרתי (א) ניתוחים של thymocytes, תאי T הרתי (OP9/DLL1 שיתוף התרבות מערכת) ו Pmel-iTE. תאים חיים היו מגודרת על congenic CD45+. אוכלוסיות CD8 SP נותחו עוד יותר עבור הביטוי CD62L ו-MHC-I. (ב) מספר ממוצע של CD8SP Cd 45.1 iTE המיוצר לילה לכל אונה 7 ימים לאחר זריעה מראש. הנתונים נאספו 12 ניסויים עצמאיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
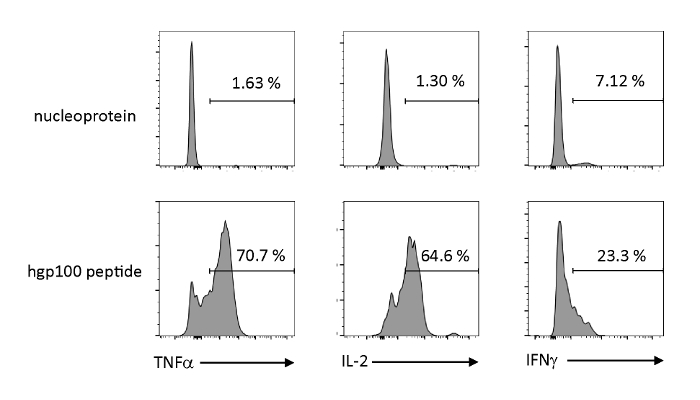
איור 4 : iTE לייצר ציטוקינים שונים ידי גירוי ספציפי אנטיגן. ניתוח של FACS של ייצור פנים-סלולריים של ציטוקינים על ידי iTE. הניט היו מתורבתים עם APCs טעון מראש עם לא רלוונטי (נואופלפרוטאין) או hgp100 (ב) פפטיד במשך שלושה ימים. המספרים המוצגים ברבעים הימניים העליונים מציינים את אחוזי הפקת הציטוקין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
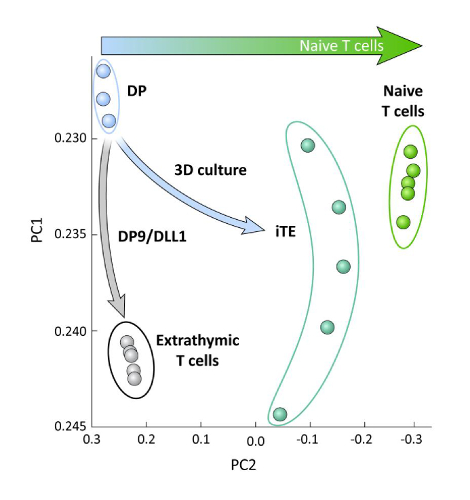
איור 5 : כל הניתוח הטרנס-מראה שינוי בביטוי הגן הiTE לקראת CD8 נאיבי + תוכנית התאים T. ניתוח המרכיב העקרוני (PCA) של נתוני RNA-seq מ-DP, אקסטררתי CD8 SP, iTE, ותאי T תמימים. (ניתוח של 102 גנים הקשורים לבידול הרתי באמצעות מסד נתונים ציבורי GSE105110) 15. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
שימוש T-iPSC להתחדש אנטיגן גידולים ספציפיים תאים T עלול להתגבר על רבים של המכשולים הנוכחיים של ACT על ידי יצירת תאים צעירים עם התמדה משופרת. למרות שכמה שיטות באמצעות מערכת OP9/DLL1 שיתוף התרבות דווחו לייצר CD8 SP תאים6,7,10,13 לבטא מולקולות CD8 ו אנטיגן הגידול ספציפי TCRs, הגן הגלובלי דפוסי ביטוי וניתוח פונקציונלי מראים שתאים מextrathymically מחדש CD8 SP שונים מתאי T תמימים (איור 4). כאן, אנו מתארים מערכת תרבות 3D הרתי שיכולים ליצור מהגרים הרתי iPSC-נגזר (iTE) עם נאמנות גבוהה והומוגניות מ-murine T-iPSC. הייט דומה לתאי T תמימים בצורת הביטוי הגנטי הגלובלי ובפונקציונליות, כגון היווצרות זיכרון ובvivo נגד הגידול נגד גידול מבוסס15.
מערכת ה-FTOC הקלאסית היא דרך ללכוד את הבחירה הרתי באופן מתורבת. הוא שימש ללימוד התפתחות פנים-הרתי של thymocytes23, ויש כמה דיווחים של ftoc לשמש להפקת כביש24. עם זאת, למערכת FTOC יש מספר מגבלות. כדי להתמודד עם חוסר החמצן בתרבות העוגב המלאכותי, מספר קבוצות השתמשו בתרבות המבוססת על ממברנה למחצה יבשה,23, או מערכות התרבות הגבוהות ביותר25. עם זאת, אין שיטות נוכחיות יכול ליצור כל הזמן אוכלוסיה הומוגנית של תאי T שלאחר הרתי. כדי להתגבר על מגבלות של מערכת FTOC קלאסית, עיצבנו מערכת תרבות 3D הרתי המספקת שיפורים טכניים על שיטות קונבנציונאלי15. לדוגמה, באמצעות שיטת תרבות 3D הרתי שלנו, החלפת חמצן מקסימלית והעדר לחץ מכני משטח האונה לשמור על האונות הרתי בסביבה פיזיולוגית יותר. בנוסף, התרבות לטווח ארוך מאפשרת תאי T בוגרים ליציאה באופן טבעי מן האונות הרתי. לבסוף, התבוננות בזמן אמת מיקרו מניפולציה לאפשר המרת מדיה ואוסף קבוע של iTE ללא מפריע פיזית האונות הרתי. כך, שיטת תרבות 3D הרתי מספק שיפורים טכניים משמעותיים, כמו גם שדרה ללמוד thymically שנבחרו תמים T-תאים שלא היה זמין קודם לכן.
יש כמה נקודות מפתח עבור הדור המצליח של iTE באמצעות מערכת זו תרבות 3D הרתי. האיכות של FBS ותנאי התרבות הוא קריטי כדי לשמור על התרחבות של OP9/DLL1 תאים מבלי לאבד את היכולת שלהם תמיכה iPSC בידול. לכן, אנו ממליצים מראש הערכה של FBS הרבה, כמו גם לעבור בעקביות באופן עקבי ב 80% שליטה כדי למנוע בידול התא והזדקנות. בנוסף, התרבות OP9/DLL1 confluent נדרש עבור בידול בלתי מתורבת של ipsc לתוך תאי T בוגרים, כמו הבדלים בשטף יכול להשפיע על היעילות שלהם. לבסוף, הגיל העובריים של האונות הרתי הוא קריטי עבור הדור של iTE. אנו ממליצים להשתמש ב-E 14.5-15.5 האונות הרתי.
כמו בכל פרוטוקול חדש, לשיטה זו יש מגבלות והיא נתונה לשיפור. טכניקת התרבות המוצגת כאן יוצרת כ-1000 iTE ליום למשך תקופה של שבועיים. הייצור המוגבר עשוי להיות אפשרי עם שינויים נוספים, כולל אופטימיזציה של ריכוז החמצן, נפח התקשורת, וסוג של צלחת התרבות 3D. בנוסף או הסרה של ציטוקינים, כמו גם שינויים בריכוז cy, יכול גם לתרום לשיפור התשואה הiTE.
בהינתן כי מערכת תרבות הרתי 3D הציג כאן יכול ליצור מהגרים הרתי במערכת vivo לחלוטין לשעבר, טכניקה זו ניתן להחיל על מגוון רחב של העברה חיסונית והמאמצת העברת פרויקטים מחקר כולל, אבל לא מוגבל T בידול התא, לאחר הרתי T התבגרות תא, והדור של אנטיגן ספציפיים תאים T מתוך מחולל המטמין או בתאי גזע. למרות ששיטה זו אינה ישימה באופן ישיר לדגימות אנושיות, מערכת התרבות ההורית והתלת-ממדית מחזיקה בפוטנציאל רב להסבר מנגנונים מולקולריים של בחירה חיובית ושלילית ועשויים להקל על יצירת מערכת תרבות המאפשרת הדור של התאים הרלוונטיים קלינית הגידול הספציפי אנטיגן-כמו תמים בתאי T עבור ACT.
Disclosures
המחברים ראול ויז, ניקולס ד. קליימן, ו ניקולס P. Restifo הם ממציאים על המתנה בינלאומית באפליקציה הפטנט PCT/US2017/65986, הגישו דצמבר 13, 2017, זכאי "שיטות של הכנת אוכלוסייה מבודדים או מטוהרים של הרתי המיענק תאים ודרכי הטיפול באמצעות אותו הדבר.
Acknowledgements
אנו מודים לירושי קאוומוטו ולקיוקו מאסדה לספק את קו התא OP9/DLL1. אנחנו מודים לאלן ב. הוצ וארנה זי . הוא לסיוע גרפי מחקר זה נתמך על ידי תוכנית מחקר הפנים של המכון הלאומי לסרטן בארה ב (ZIA BC010763) ואת התוכנית מונשוט הסרטן עבור המרכז עבור טיפול מבוסס התא ב NCI, NIH. העבודה תמכה גם בקרן משפחת מילשטיין.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals, Peptides and Recombinant Proteins | |||
| 2-deoxyguanosine | Sigma-Aldrich | 312693-72-4 | |
| 2-Mercaptoethanol (1,000x) | Thermo Fisher Scientific | 21985-023 | |
| ACK Lysing Buffer | Gibco | A1049201 | |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| Blasticidin | Thermo Fisher Scientific | R21001 | |
| FBS | Gemini | 100-500 | |
| Flt-3 ligand | R&D Systems | 427-FL | |
| GlutaMAX (100x) | Thermo Fisher Scientific | 35050-061 | |
| hgp100 | Genscript | 282077-1, KVPRNQDWL | |
| Interleukin-2 | R&D Systems | 402-ML | |
| Interleukin-7 | R&D Systems | 407-ML | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| MEM powder | Gibco | 61100061 | |
| Monothioglycerol | Sigma-Aldrich | M-6145 | |
| Nucleoprotein | Global Peptides | ASNENMETM | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | |
| Phosphate buffered saline pH 7.4 (1x) | Thermo Fisher Scientific | 10010-023 | |
| Puromycin | Thermo Fisher Scientific | A1113803 | |
| RPMI 1640 | Gibco | 11875093 | |
| Sodium Pyruvate | Thermo Fisher Scientific | 11360-070 | |
| Stem Cell Factor (SCF) | R&D Systems | 455-MC | |
| Stemfactor LIF, Mouse Recombinant | STEMGENT | 03-0011-100 | |
| Trypsin-EDTA (0.05%), phenol red | Thermo Fisher Scientific | 25300-062 | |
| Cell Culture Vessels and others | |||
| 10 cm dish | Corning, Inc. | 353003 | |
| 12 mL Syringe | Covidien Monoject | 22-652-090 | |
| 6 well plate | Corning/Coster | 3516 | |
| Cell strainer 100 μm | Fisher Scientific | 22-363-549 | |
| Cell strainer 40 μm | Fisher Scientific | 22-363-547 | |
| Forceps | DUMONT | 0108-5PO | |
| Lab soaker mat | Versi-Dry | Cat. EF2175CX 74018-00 | |
| Membrane filters ( 0.8 μm, 47diam) | Whatman | WHA7408004 ALDRICH | |
| Perfecta3D Hanging Drop Plate | Sigma-Aldrich | HDP1096 | |
| U Bottom 96 well plate | Corning/Coster | 3799 | |
| Experimental Cell lines | |||
| CD3-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| MEF-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Mouse Embryonic Fibroblasts (MEF) | ATCC | SCRC-1040; RRID:MGI:5007926 | |
| OP9/N-DLL1 | Riken Bioresource center | Cat# RCB2927; RRID:CVCL_B220 | |
| Pmel-iPSC | Vizcardo et al., Cell Report 2018 | N/A | |
| Experimental mouse models | |||
| B6.SJL-PtprcaPepcb/BoyCrCrl | Charles River | Strain Code 564; RRID:IMSR_CRL:564 | |
| C57BL/6N | NCI/Charles River | N/A | |
| Pmel-1 mice | Overwijk et al. | J Exp Med 198(4):569-80 | |
| Antibodies | |||
| Anti-aTCR | Biolegend | 109202; RRID:AB_313425 | |
| Anti-CD3 | abcam | ab11089; RRID:AB_369097 | |
| Anti-CD4 | BD Biosciences | 553730; RRID:AB_395014 | |
| Anti-CD44 | BD Biosciences | 559250; RRID:AB_398661 | |
| Anti-CD45.1 | BD Biosciences | 553775; RRID:AB_395043 | |
| Anti-CD45.2 | BD Biosciences | 553772; RRID:AB_395041 | |
| Anti-CD62L | BD Biosciences | 560516; RRID:AB_1645257 | |
| Anti-CD69 | BD Biosciences | 552879; RRID:AB_394508 | |
| Anti-CD8a | BD Biosciences | 557959; RRID:AB_396959 | |
| Anti-CD8b | BD Biosciences | 550798; RRID:AB_393887 | |
| Anti-H-2Kb | BD Biosciences | 553570; RRID:AB_394928 | |
| Anti-IFN-g | BD Biosciences | 557998; RRID:AB_396979 | |
| Anti-IL-2 | BD Biosciences | 554428; RRID:AB_395386 | |
| Anti-TCRb | Thermo Fisher Scientific | 35-5961-81; RRID:AB_469741 | |
| Anti-TCRVb13 | BD Biosciences | 553204; RRID:AB_394706 | |
| Anti-TNFa | BD Biosciences | 557644; RRID:AB_396761 |
References
- Gattinoni, L., et al. Wnt signaling arrests effector T cell differentiation and generates CD8+ memory stem cells. Nature Medicine. 15 (7), 808-813 (2009).
- Rosenberg, S. A., et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clinical Cancer Research. 17 (13), 4550-4557 (2011).
- Singh, N., Perazzelli, J., Grupp, S. A., Barrett, D. M. Early memory phenotypes drive T cell proliferation in patients with pediatric malignancies. Science Translational Medicine. 8 (320), 320-323 (2016).
- Crompton, J. G., Clever, D., Vizcardo, R., Rao, M., Restifo, N. P. Reprogramming antitumor immunity. Trends of Immunology. 35 (4), 178-185 (2014).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Vizcardo, R., et al. Regeneration of human tumor antigen-specific T cells from iPSCs derived from mature CD8(+) T cells. Cell Stem Cell. 12 (1), 31-36 (2013).
- Nishimura, T., et al. Generation of rejuvenated antigen-specific T cells by reprogramming to pluripotency and redifferentiation. Cell Stem Cell. 12 (1), 114-126 (2013).
- Takada, K., Kondo, K., Takahama, Y. Generation of Peptides That Promote Positive Selection in the Thymus. Journal of Immunology. 198 (6), 2215-2222 (2017).
- Yamagata, T., Mathis, D., Benoist, C. Self-reactivity in thymic double-positive cells commits cells to a CD8 alpha alpha lineage with characteristics of innate immune cells. Nature Immunology. 5 (6), 597-605 (2004).
- Themeli, M., et al. Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nature Biotechnology. 31 (10), 928-933 (2013).
- Serwold, T., Hochedlinger, K., Inlay, M. A., Jaenisch, R., Weissman, I. L. Early TCR expression and aberrant T cell development in mice with endogenous prerearranged T cell receptor genes. Journal of Immunology. 179 (2), 928-938 (2007).
- Lei, F., et al. In vivo programming of tumor antigen-specific T lymphocytes from pluripotent stem cells to promote cancer immunosurveillance. Cancer Research. 71 (14), 4742-4747 (2011).
- Maeda, T., et al. Regeneration of CD8alphabeta T Cells from T-cell-Derived iPSC Imparts Potent Tumor Antigen-Specific Cytotoxicity. Cancer Research. 76 (23), 6839-6850 (2016).
- Serwold, T., et al. T-cell receptor-driven lymphomagenesis in mice derived from a reprogrammed T cell. Proceedings of the National Academy of Sciences of the United States of America. 107 (44), 18939-18943 (2010).
- Vizcardo, R., et al. Generation of Tumor Antigen-Specific iPSC-Derived Thymic Emigrants Using a 3D Thymic Culture System. Cell Reports. 22 (12), 3175-3190 (2018).
- Jenkinson, W., Jenkinson, E., Anderson, G. Preparation of 2-dGuo-treated thymus organ cultures. Journal of Visualized Experiments. (18), (2008).
- Hamazaki, Y., Sekai, M., Minato, N. Medullary thymic epithelial stem cells: role in thymic epithelial cell maintenance and thymic involution. Immunological Reviews. 271 (1), 38-55 (2016).
- Vivier, E., et al. Innate or adaptive immunity? The example of natural killer cells. Science. 331 (6013), 44-49 (2011).
- Rosen, S. D. Ligands for L-selectin: homing, inflammation, and beyond. Annual Review of Immunology. 22, 129-156 (2004).
- Hogquist, K. A., Xing, Y., Hsu, F. C., Shapiro, V. S. T Cell Adolescence: Maturation Events Beyond Positive Selection. Journal of Immunology. 195 (4), 1351-1357 (2015).
- Best, J. A., et al. Transcriptional insights into the CD8(+) T cell response to infection and memory T cell formation. Nature Immunology. 14 (4), 404-412 (2013).
- Schmitz, I., Clayton, L. K., Reinherz, E. L. Gene expression analysis of thymocyte selection in vivo. International Immunology. 15 (10), 1237-1248 (2003).
- Nitta, T., Ohigashi, I., Takahama, Y. The development of T lymphocytes in fetal thymus organ culture. Methods in Molecular Biology. 946, 85-102 (2013).
- Ueno, T., et al. Role for CCR7 ligands in the emigration of newly generated T lymphocytes from the neonatal thymus. Immunity. 16 (2), 205-218 (2002).
- Watanabe, Y., Katsura, Y. Development of T cell receptor alpha beta-bearing T cells in the submersion organ culture of murine fetal thymus at high oxygen concentration. European Journal of Immunology. 23 (1), 200-205 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved