A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
גישות התנהגותיות לחקר הלחץ הטבוע בדג זברה
In This Article
Summary
כתב יד זה מתאר שיטה פשוטה למדוד מתח במהלך הפעולה במהלך בגרות דג מבוגר. הגישה מנצלת את הנטייה הטבועה שדגים מעדיפים את החצי התחתון של הטנק כאשר במצב מלחיץ. כמו כן, אנו מתארים שיטות לזיווג עם פרמקולוגיה.
Abstract
מגיבים בהתאם לגירויים מלחיצים חיוני להישרדות של אורגניזם. מחקר נרחב נעשה על מגוון רחב של מחלות הקשורות למתח והפרעות פסיכיאטריות, אך מחקרים נוספים לתוך הרגולציה הגנטית והעצבית של הלחץ עדיין נדרשים לפתח therapeutics טוב יותר. הדג מספק מודל גנטי רב עוצמה כדי לחקור את הגבולות העצביים של מתח, כפי שקיים אוסף גדול של קווי מוטציה וטרנסגניים. יתר על כן, פרמקולוגיה יכולה בקלות להיות מיושם על דג zebrafish, כמו רוב התרופות ניתן להוסיף ישירות למים. אנו מתארים כאן את השימוש ' מבחן הטנק הרומן כשיטה ללמוד התגובות לחץ מולדים ב zebrafish, ולהדגים כיצד תרופות נגד חרדה פוטנציאלי יכול להיות מאומת באמצעות הבקשה. השיטה יכולה בקלות להיות ביחד עם הקווים דג זברה מחסה מוטציות גנטיות, או אלה שבהם גישות הטרנסגניים לתפעול מעגלים עצביים מדויקים משמשים. ניתן להשתמש באפשרות זו גם בדגמי דגים אחרים. ביחד, הפרוטוקול המתואר צריך להקל על אימוץ הדבר הפשוט הזה למעבדות אחרות.
Introduction
תגובות מצוקה משנות מצבים התנהגותיים ופיסיולוגיים כתוצאה מגירויים עלולים להזיק או מזיקים. תגובות הלחץ נשמרים ברחבי ממלכת החיות, והם קריטיים להישרדות של אורגניזם1. עשרות שנים של מחקר הרחיבו מאוד את הידע שלנו על חלק מהמנגנונים הגנטיים והעצביים שבבסיס מצבי הלחץ. כיום, אזורי המוח כגון האמיגדלה והסטריאטום2, וגורמים גנטיים כגון קורטיקוטרופין שחרור הורמון (crh), ו glucocorticoid (gr) ו מינרלוקורטיקואידים קולטנים ( mr) נחקרו בהרחבה3,4,5,6. למרות הממצאים הקריטיים הללו, הרבה נשאר לא ידוע על הרגולציה הגנטית והעצבית של הלחץ. ככאלה, הפרעות הנוגעות ללחץ רב סובלות ממחסור בtherapeutics.
אורגניזמים amendable מודל גנטית לספק כלי שימושי במחקר של שליטה גנטית ועצבית של התנהגות. מודלים דגים, בפרט, הם חזקים ביותר: הם אורגניזמים קטנים עם פעמים הדור הקצר, השימוש שלהם בסביבה מעבדה הוא facile, גנום שלהם הם שונה בקלות, ו, כמו בעלי חוליות, הם חולקים לא רק גנטית, אלא גם נוירואנטומי הומולוגיה עם היונקים המקבילים שלהם7,8. התקן סטנדרטי עבור מדידת לחץ יכול להיות מזווג עם שורות דג זברה מחסה מוטציות גנטיות, או אלה שבהם מניפולציה של ערכות המשנה נוירואליות מדויקת אפשרי, ואת ההשפעות של גנים בודדים או נוירונים מוגדרים ניתן להעריך במהירות וביעילות.
ביהביואורלי, התגובות לחץ יכול להיות מאופיין דגים כתקופות של היפר-פעילות או תקופות ממושכות של חוסר פעילות (בדומה "הקפאה")9, מופחתת מחקר10, נשימה מהירה, צריכת מזון מופחת11, ומ העדפת מקום בתחתית טנק12. לדוגמה, כאשר ממוקם לתוך טנק לא מוכר, דג מבוגר ודגמים קטנים אחרים דגים להראות העדפה ראשונית למחצית התחתונה של המיכל, עדיין, לאורך זמן, הדג להתחיל לחקור את החצאים העליון והתחתון עם תדר כמעט שווה12. טיפול של מבוגרים עם תרופות הידוע כדי להפחית את החרדה לגרום דגים לחקור מיד את החלק העליון10,13. לעומת זאת, תרופות המגבירים את החרדה גורמות לדגים להפגין העדפה חזקה לחצי התחתון של המיכל12,14,15. כך, מופחתת בחיפושי והעדפה למחצית התחתונה של הטנק הם אינדיקטורים פשוטים ואמינים של מתח.
כמו רוב החוליות, התגובות המתח בדגים מונעים על ידי הפעלת היפותלמי-יותרת הכליה-אינטר-כליות ציר (hpi; מקבילה ההיפותלמי-יותרת הכליה-האדרנל [hpi] ציר יונקים)14,16. נוירונים היפותלמי המבטא הורמון קורטיקוטרופין שחרור הורמון (CRH) האות לבלוטת יותרת ההיפופיזה, אשר בתורו לשחרר אדרנוקורטיקוטרופי הורמון שחרור (ACTH). Acth לאחר מכן אותות לבלוטת הבין-כליות כדי לייצר ולהפריש קורטיזול, אשר יש מספר של מטרות במטה16, אחד מהם להיות משוב שלילי של ה-crthal, הנוירונים היפותלמי 3,17, 18,19.
כאן, אנו מתארים שיטה להערכת אמצעים התנהגותיים של הלחץ הטבוע. לגבי ההתנהגות, אנו מפרטים פרוטוקולים באמצעות בדיקת הטנק הרומן צולל12,14. לאחר מכן אנו מדגימים, כדוגמה, כי תרופה נגד חרדה מוכרת, בוטרון, מפחיתה את צעדי ההתנהגות של הלחץ.
Protocol
הפרוטוקול אושר על ידי המוסד לטיפול בבעלי חיים מוסדיים והשתמש בועדה האוניברסיטה האטלנטית בפלורידה.
1. הכנה
- הגדר חדר מבודד לביצוע לימודי התנהגות, או סגור קטע בחדר כך שהוא מבודד.
הערה: החדר צריך להיות מופרעת יש תנועה נמוכה כדי למנוע שיבוש התנהגות נורמלית של הדג. - העבר את החומרים והציוד הבאים לחדר התנהגותי: (i) מצלמה ועדשה, (ii) מסנן אינפרא אדום אשר ניתן לצרף את העדשה, (iii) לעמוד מצלמה, (iv) מחשב עם תוכנה לרכישת מצלמה, (v) שולחן יציב המשרד לבצע את התשובה על, (vi) האורות אינפרא אדום (אורות IR; 850 nm או 940 nm), (vii) מפזר אקרילי לבן, אשר ארוך יותר מאשר אורך של מיכל ההקלטה (viii) 1.8 L מיכל שיטת פלסטיק הטרפז (המכונה "טנק הרומן"; האחד המשמש כאן הוא 12 x 18 אינצ'ים) , ו-(ix) דלי של מי מערכת הדגים.
הערה: עבור הטנק הרומן, המעבדה שלנו משתמשת בכלי פלסטיק זמינים מסחרית, אשר הם הבסיסי בצורה. הממדים של הטנק הם בערך 6 ב x 9 ב (ממדים מפורטים ניתנים באיור 1א). לוח מפזר אנו משתמשים הוא קצת יותר גדול מאשר הטנק הרומן (12 ב x 18 ב). ניסויים הטנק הרומן בוצעו עם טנקים שיש צורות שונות, כגון אלה אשר מלבני או אלה עם מידות טרפז שונים20,21. בדרך כלל, התנהגות הדג דומה בכל הטנקים ללא קשר לממדים שלהם: עבור כל המכולות, דגים בתחילה מעדיפים את החצי התחתון, אך עם הזמן להתחיל לחקור את המחצית העליונה עם תדר גדול יותר. - חבר את מסנן האינפרא-אדום לעדשת המצלמה. אורכי הגל של האור אינפרא אדום רצועות בדרך כלל נע בין 850 nm ל 940 nm. המסנן הוא מסנן מעבר ארוך המגביל את האור של אורכי גל פחות מ 720 ננומטר מלשדר דרך המצלמה.
- בחר את הפרמטרים המתאימים עבור תוכנת רכישת המצלמה. עבור רוב ההקלטות, הגדר את רכישת המצלמה לקצב של 30 מסגרות לשניה, ומשך ההקלטה ל-10 דקות.
הערה: פרמטרים אלה עשויים להיות שונים, בהתאם לניסוי. לדוגמה, כדי ללמוד הרגלה בטנק הרומן22,23, הקלטות ארוכות יותר עשוי להידרש.
2. התקנה
הערה: השלבים בסעיף זה מתארים את הגדרת שיטת הטנק הרומן. דיאגרמה של מוצר הקצה ניתנת באיור 1B.
- הניחו את מיכל הרומן באמצע השולחן.
- מקמו את אורות האינפרא-אדום מאחורי המיכל ומניחים את גיליון אקריליק לבן או מסך מפזר בין המיכל לבין מקור אור LED.
- מניחים את המפזר כך שהוא מקסימאלי את האור המגיע מהנוריות, ועוצמת האור מספיקה כדי להאיר את המיכל הרומן. ככל שהלוח מתקרב למקור האור, האורות יהיו בהירים יותר, ובכל זאת הוא יהיה פחות מפוזר. לעומת זאת, הצבת לוח המפזר הרחק ממקור האור תפחית את עוצמת האור, אך תפיץ את האור טוב יותר.
- ממלאים כ -3 רבעים של הטנק הרומן עם מים מערכת הדגים.
הערה: מי מערכת נוצרת באמצעות אוסמוזה הפוכה של מי ברז, ואחריו מינון כזה מוליכות שווה 900 ± 100 μS, כי pH הוא נייטרלי (7.2), וכי הטמפרטורה היא 27 ± 1 ° צ'. - חבר את המצלמה למעמד המצלמה וחבר את המצלמה למחשב. פתח את תוכנת רכישת וידאו ולהתאים את המצלמה לפני החזית של הטנק ולהבטיח את הטנק הרומן כולו ניתן לראות וכי אין אזורים מטושטשים בווידאו. כוונן את המיכל ואת אורות האינפרא-אדום כך שיש מספיק ואפילו תאורה בכל המיכל כאשר הוא נצפה דרך המצלמה.
הערה: לפני שתמשיך בניסויים, לעתים קרובות הוא עשוי להיות שימושי לביצוע ניסיון, שבו וידאו של דג נלכד ומעקב מבוצע. פעולה זו תבטיח שההתקנה מספיקה לניסויים בהתנהגות.
3. הגדרת בדיקת טנק הרומן
- הכינו גביע 250 mL שמולא מראש במים של מערכת דגים, ולפחות שני מיכלי מחזיק.
- בבוקר של הבדיקה, להעביר לפחות 10 המבחן דג זברה לשמש עבור כל מצב ניסיוני (שולטת וניסיוני מבוגרים) ממתקן דגים לתוך טנק מחזיק, להעביר אותם לחדר התנהגות, ולאפשר להם התאקלם לפחות אחד שעה.
הערה: יש לבצע ניתוח כוח לפני ניסויים, אך בידינו, n = 10 הוא בדרך כלל מספיק כדי לזהות משמעות סטטיסטית. יתר על כן, המיכל צריך להכיל לא יותר מחמישה אנשים לכל ליטר מים. הסתגלות של שעה אחת מספיקה כמו בוגרים דג זברה הוכחו habituate בתוך 30 דקות של טנק חדש22. כמו כן, מקצבים התנהגותיים מושפעים מתהליכים מעגליות, ולכן יש לבצע את השכפל הנסיוני בימים שונים בתוך אותם שעות. אנחנו בדרך כלל לבצע את כל הניסויים בין השעות 11:00 am ו 6:00 pm. - סמן את הטנקים כך שהמצב או הגנוטיפ של בעלי החיים יהיו עיוורים לניסויים.
הערה: ניתן לעוור בקלות ניסויים בעזרת מיכלי תיוג באמצעות מערכת מכתב או מספר (כלומר, טנק אחד מתויג ' A ', עוד ' ב' ', וכו '). מפלגה שאינה מעורבת בניסויים מתייגת את הטנקים באמצעות מערכת כזו, ומסיכה את הזהויות מניסוי הנסבית עד לאחר השלמת הניתוח. - באמצעות רשת, בעדינות למקם מבוגר אחד בגביע מלא מראש משלב 3.1. הרשו לדגים מבוגרים לעשות את האקלים בגביע במשך 10 דקות.
הערה: הקלט את מין המבוגר, מאחר שהוא עשוי להיות חשוב לאחר ניתוח כדי לחפש הבדלים ספציפיים למין. - לאחר הסתגלות בגביע, להחדיר את הדג לתוך הטנק הרומן (להגדיר בסעיף 1) על ידי שפיכת בעדינות את המים ומבוגר מן הגביע.
- לאחר שהציג את המבוגר לתוך הטנק הרומן, להתחיל את ההקלטה המצלמה, ולהתרחק ההתקנה כדי למנוע מצוקה נוספת הדג.
- לאחר סיום ההקלטה, להסיר את האדם מן הטנק הרומן מקום לתוך מיכל אחזקות חדש.
הערה: מיכל החזקה שונה מאחד בשלב 3.2 צריך לשמש כדי למנוע בדיקות חוזרות על אותם אנשים. - חזור על שלבים 3.4 עד 3.7 עבור כל מבוגר עד שכל בעלי החיים נבדקו.
הערה: בנוסף לתנאים מסנוור או גנוטיפים, מבחנים באקראי. השתמש במחולל מספרים אקראיים או בכל כלי המאפשר לאחד לאקראי בין המבחנים. יש לעשות זאת לפני ניסויים כך שכל ניסוי ייקבע לפני תחילת הניסויים. - , בסוף כל הבדיקות. תחזיר את הדג למתקן הדגים
4. טיפול מקדים בסמים
הערה: מטרת השלבים הבאים היא להשוות את אופן הפעולה של אדם לפני ואחרי השימוש בסמים. השוואה זו מושגת על ידי הראשון ביצוע מבחן טנק הרומן כמו בשלב 3.4 כדי 3.6, ואחריו טיפול בסמים, ולאחר מכן מבחן טנק הרומן השני (איור 3a).
- הכינו פתרון מניות של הסם, כולל פקדים חיוביים ושליליים.
הערה: אם נעשה שימוש בתרופה בעבר בספרות, מצא מינון עבודה מתאים והשתמש באפשרות זו. לדוגמה, עבור בינורון בתוצאות הנציג, אנו עושים פתרון מניות 100x ולהשתמש 0.05 mg/mL כריכוז הסופי, כפי שמתואר בספרות13,20. אם המינון המוצע אינו ידוע, יש לבצע עקומת תגובת מינון על-ידי בחינת מספר ריכוזים. הגדר עוד כוסות עם. מדלל סדרתיות של סמים אם הסם אינו מדלל במים, השתמש בדימתיל סולפוקסיד (DMSO) כממס. - מדלל את הסמים כדי לעבוד בריכוז ב-250 mL עם מים מערכת. לדוגמה, אם הפתרון 100x נעשה, לדלל 1:100 במים המערכת. הגדר גביע עם מי מערכת בלבד כפקד.
הערה: אם DMSO שימש ממיס בשלב 3.1, השתמש בנפח שווה של DMSO בגביע הבקרה. - בעזרתו של חוקר אחר, מסכה של הזהויות של כוסות הסמים והבקרה כדי להבטיח שהבודק יהיה עיוור לתנאי הטיפול עד שלאחר הניתוח.
הערה: ניתן להשתמש במספר או במערכת אותיות. - בצע בדיקת טנק רומן על-ידי ביצוע השלבים 3.1 כדי 3.6 כדי להשיג תגובה התנהגותית בסיסית לחץ.
- לאחר ההקלטה הבסיסית, השתמש ברשת כדי להסיר מיד את הדג המבוגר ממיכל הרומן ומניחים אותו בתוך הגביע עם התרופה או הרכב, כפי שמתואר בשלב 4.2. אפשר למבוגר להישאר בגביע במשך 10 דקות.
הערה: ודא שהרשת אינה נוגעת במים בתוך הספלים כדי למנוע זיהום בסמים. להבטיח את המינון הנכון וזמן הניהול בהתאם לתרופה שבשימוש. זמן טיפול של 10 דקות עלול לא לעבוד עבור כל התרופות. - לאחר הטיפול, להשתמש ברשת כדי להסיר את המבוגר מן הגביע בשלב 4.5 ולמקם אותו בגביע אחר מלא מים מערכת טריים בלבד. זוהי תקופת הכישלון כדי למזער מינון נוסף במהלך הבדיקה השנייה של טנק הרומן. הרשו למבוגר לשהות בגביע השטיפה במשך 10 דקות נוספות.
הערה: יש להשתמש ברשתות נפרדות עבור כל תנאי תרופה כדי למנוע טיפול בלתי רצוי בסמים. את תקופת הכישלון ניתן לדלג אם משאלות הניסויים. - בצע את הבדיקה הרומן מבחן צלילה בפעם השנייה על ידי הסרת כי מבוגר מן הגביע בשלב הקודם, למקם אותו טנק רומן חדש, ובצע את השלבים 3.5 כדי 3.6.
- לאחר בדיקת טנק הרומן השני, להסיר את האדם לתוך מיכל החזקת נפרד. יוצקים את מי המערכת במיכל הספר השני ומלאו אותו במים מערכת טריים למבחן הבא. צעד זה מונע זיהום מזהמים של כל סם.
הערה: בהתאם לחצי החיים של התרופות, יש לעשות כוסות טריות המכילות סמים כל 3 שעות. לבוספינה, הופכים פתרונות טריים כל 3 שעות. בנוסף, בעקבות ההערה בשלב 3.8, המבחנים צריכים להיות אקראיים בין שליטה וטיפול תרופתי. - בסוף כל המבחנים, החזר אנשים. בחזרה למתקן הדגים
הערה: בהתאם לסוג התרופה המשמשת, ההשפעות של הטיפולים הללו על אנשים יכולים להיות ארוכות טווח. לכן, אין להשתמש באנשים אלה בניסויים אחרים.
5. ניתוח וידאו
- לאחר כל הנסיונות, טען קבצי וידאו לתוך מעקב אחר תוכנות הבחירה.
הערה: אנו משתמשים בדרך כלל בתוכנת מעקב זמינה מסחרית, אך ניתן להשתמש במספר חבילות תוכנה זמינות בחופשיות. השלבים להשגת מעקב עשויים להשתנות בהתאם לחבילת התוכנה שבשימוש. - באמצעות מסגרת עדיין מן הווידאו, להגדיר גבולות דמיוני סביב (אני) את הזירה כל הטנק הרומן כי הוא מלא מים, וגבולות סביב (ii) השלישי העליון, (iii) באמצע השליש, ו (iv) השני התחתון של הטנק. השתמש באלה כדי לקבוע את הזמן שהדגים בילו בכל חלק של מיכל הרומן.
- חישוב הזחה של x-y לכל מסגרת עבור כל זירה המוגדרת בשלב 5.2.
- הגדר את האזורים העליונים, האמצעיים והתחתונים של המיכל. כל אזור צריך להיות דומה בגודלו. שיטה קצרה לקביעת אזורים אלה היא לחשב את אורך המיכל בכיוון y, ולחלק זאת ב-3.
הערה: וריאציות לפרוטוקול הכללי קיימות. לדוגמה, חלק מהמעבדות משתמשות בחצאים במקום בשלישים14. - לקבוע את הזמן המושקע בכל זירה, המרחק, ואת המהירות.
הערה: רוב חבילות המעקב יחושבו באופן אוטומטי עבור המשתמש. עם זאת, אם תוכנת המעקב אינה פועלת, ניתן לחשב אותן בקלות מערכי ההזחה של x-y. לדוגמה, ניתן לקבוע את המרחק באמצעות הנוסחה: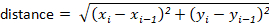
וניתן לקבוע מהירות בעקבות הנוסחה: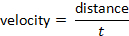
- חזור על שלבים 5.2 כדי 5.4 כדי לרכוש מסלולים ומדידות עבור כל המבחנים.
הערה: וריאציות לפרוטוקול כללי זה
6. בדיקת נורמליות
- בצע סטטיסטיקה לפני שתמשיך לחשב הבדלים סטטיסטיים. בדוק אם הנתונים מופצים בדרך כלל באמצעות מבחן שפירו-Wilk.
- אם ההשערה הריקה שהנתונים מופצים בדרך כלל נדחית (כלומר, הנתונים אינם מופיעים אחרי התפלגות גאוסיאנית), בצע את כל הבדיקות באמצעות בדיקות לא פרמטרית. לעומת זאת, אם הנתונים מצויים לאחר התפלגות נורמלית, המשיכו להשתמש בבדיקות פרמטרית.
הערה: אנו משתמשים בתוכנה זמינה מסחרית כדי לבצע סטטיסטיקות; עם זאת, ניתן להשתמש גם בשפת התיכנות R. ניתן לבצע ניתוח שפירו-וילק באמצעות שפירו של R. הפונקציה test.
תוצאות
בחינת המתח בדגי הזברה
כדי לבחון את התנהגות הלחץ לאורך זמן בתוך פראי סוג zebrafish, בדקנו דגים מבוגרים מן AB זן24 במבחן הטנק הרומן. מבוגרים AB היו חשופים לפרוטוקול כמתואר לעיל. לאחר זמן קצר, ניתנו לדגים תקופת הסתגלות אחת במיכל בחדר ההתנהגות. אדם הוצב בגביע במשך 1...
Discussion
זברפיש מפגין תגובת מתח חזקה במיכל הרומן
כאן, אנו מתארים גישה התנהגותית פשוטה לבדיקת התגובות המתח של zebrafish מבוגרים, ולאמת את הגישה כמדד פשוט של הלחץ באמצעות פרמקולוגיה.
מבחן טנק הרומן הוא מבחן בשימוש נרחב לבדיקת מתחים מולדים ב-דג זברה ומינים אחרים של דגים12...
Disclosures
המחברים מצהירים כי אין להם אינטרסים מתחרים או פיננסיים.
Acknowledgements
עבודה זו הייתה נתמכת על ידי מימון מיוזמת יופיטר למדעי החיים באוניברסיטת פלורידה אטלנטיק. עבודה זו היתה נתמכת גם על ידי מענקים R21NS105071 (הוענק ACK ו-הורד) ו R15MH118625 (הוענק ל-למטה) מן המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| Camera | We use Point Grey Grasshopper3 USB camera with lens from Edmund Optics. | ||
| Infrared filter | Edmund Optics | ||
| Video Acquisition Program | Use programs such as Virtualdub or FlyCapture because the acquisition framerate can be set. | ||
| Infrared LED lights | |||
| Assay tank | Aquaneering | Part number ZT180 | Size: M3 1.8 liter |
| Stand and clamp, or standard tripod for camera | |||
| 250mL beaker | |||
| Tracking software | We use Ethovision XT 13 from Noldus Information Technology | ||
| Buspirone chloride | Sigma-Aldrich | B7148 | |
| Randomized trial generator | We use the RANDBETWEEN function in Microsoft Excel |
References
- McEwen, B. S. Stress, adaptation, and disease. Allostasis and allostatic load. Annals of the New York Academy of Sciences. 840, 33-44 (1998).
- Tovote, P., Fadok, J. P., Lüthi, A. Neuronal circuits for fear and anxiety. Nature Reviews Neuroscience. 16 (6), 317-331 (2015).
- Facchinello, N., et al. Nr3c1 null mutant zebrafish are viable and reveal DNA-binding-independent activities of the glucocorticoid receptor. Scientific Reports. 7 (4371), (2017).
- Ziv, L., et al. An affective disorder in zebrafish with mutation of the glucocorticoid receptor. Molecular Psychiatry. , (2013).
- Grone, B. P., Maruska, K. P. Divergent evolution of two corticotropin-releasing hormone (CRH) genes in teleost fishes. Frontiers in Neuroscience. , (2015).
- Fuller, P. J., Lim-Tio, S. S., Brennan, F. E. Specificity in mineralocorticoid versus glucocorticoid action. Kidney International. , (2000).
- Zhdanova, I. V. Sleep and its regulation in zebrafish. Reviews in the Neurosciences. 22 (1), 27-36 (2011).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. , (2001).
- Duboué, E. R. E. R., Hong, E., Eldred, K. C. K. C., Halpern, M. E. M. E. Left Habenular Activity Attenuates Fear Responses in Larval Zebrafish. Current Biology. 27 (14), 2154-2162 (2017).
- Facchin, L., Duboue, E. R., Halpern, M. E. Disruption of Epithalamic Left-Right Asymmetry Increases Anxiety in Zebrafish. Journal of Neuroscience. 35 (48), 15847-15859 (2015).
- Øverli, &. #. 2. 1. 6. ;., Sørensen, C., Nilsson, G. E. Behavioral indicators of stress-coping style in rainbow trout: Do males and females react differently to novelty. Physiology and Behavior. , (2006).
- Levin, E. D., Bencan, Z., Cerutti, D. T. Anxiolytic effects of nicotine in zebrafish. Physiology & behavior. 90 (1), 54-58 (2007).
- Bencan, Z., Sledge, D., Levin, E. D. Buspirone, chlordiazepoxide and diazepam effects in a zebrafish model of anxiety. Pharmacology Biochemistry and Behavior. 94 (1), 75-80 (2009).
- Cachat, J., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nature Protocols. 5 (11), 1786-1799 (2010).
- Mathuru, A. S., et al. Chondroitin fragments are odorants that trigger fear behavior in fish. Current Biology. , (2012).
- Alsop, D., Vijayan, M. The zebrafish stress axis: Molecular fallout from the teleost-specific genome duplication event. General and Comparative Endocrinology. , (2009).
- Evans, A. N., Liu, Y., MacGregor, R., Huang, V., Aguilera, G. Regulation of Hypothalamic Corticotropin-Releasing Hormone Transcription by Elevated Glucocorticoids. Molecular Endocrinology. , (2013).
- Fenoglio, K. A., Brunson, K. L., Avishai-Eliner, S., Chen, Y., Baram, T. Z. Region-specific onset of handling-induced changes in corticotropin- releasing factor and glucocorticoid receptor expression. Endocrinology. , (2004).
- Liposits, Z., et al. Ultrastructural localization of glucocorticoid receptor (GR) in hypothalamic paraventricular neurons synthesizing corticotropin releasing factor (CRF). Histochemistry. , (1987).
- Facchin, L., Duboué, E. R., Halpern, M. E. Disruption of epithalamic left-right asymmetry increases anxiety in Zebrafish. Journal of Neuroscience. 35 (48), (2015).
- Chin, J. S., et al. Convergence on reduced stress behavior in the Mexican blind cavefish. Developmental Biology. , (2018).
- Wong, K., et al. Analyzing habituation responses to novelty in zebrafish (Danio rerio). Behavioural Brain Research. 208 (2), 450-457 (2010).
- Matsunaga, W., Watanabe, E. Habituation of medaka (Oryzias latipes) demonstrated by open-field testing. Behavioural Processes. 85 (2), 142-150 (2010).
- Walker, C. Chapter 3 Haploid Screens and Gamma-Ray Mutagenesis. Methods in Cell Biology. , (1998).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327, 348-351 (2010).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. Journal of Cardiovascular Translational Research. , (2010).
- Murphey, R., Zon, L. Small molecule screening in the zebrafish. Methods. 39 (3), 255-261 (2006).
- Gammans, R. E., et al. Use of buspirone in patients with generalized anxiety disorder and coexisting depressive symptoms. A meta-analysis of eight randomized, controlled studies. Neuropsychobiology. 25 (4), 193-201 (1992).
- Maaswinkel, H., Zhu, L., Weng, W. The immediate and the delayed effects of buspirone on zebrafish (Danio rerio) in an open field test: A 3-D approach. Behavioural Brain Research. , (2012).
- Gebauer, D. L., et al. Effects of anxiolytics in zebrafish: Similarities and differences between benzodiazepines, buspirone and ethanol. Pharmacology Biochemistry and Behavior. , (2011).
- Maximino, C., et al. Fingerprinting of psychoactive drugs in zebrafish anxiety-like behaviors. PLoS ONE. , (2014).
- Horváth, J., Barkóczi, B., Müller, G., Szegedi, V. Anxious and nonanxious mice show similar hippocampal sensory evoked oscillations under urethane anesthesia: Difference in the effect of buspirone. Neural Plasticity. , (2015).
- Costall, B., Kelly, M. E., Naylor, R. J., Onaivi, E. S. Actions of buspirone in a putative model of anxiety in the mouse. Pharm Pharmacol. 40 (7), 494-500 (1988).
- Barros, M., Mello, E. L., Huston, J. P., Tomaz, C. Behavioral effects of buspirone in the marmoset employing a predator confrontation test of fear and anxiety. Pharmacology Biochemistry and Behavior. , (2001).
- Heinen-Kay, J. L., et al. Predicting multifarious behavioural divergence in the wild. Animal Behaviour. 121, 3-10 (2016).
- Thompson, R. R. J., Paul, E. S., Radford, A. N., Purser, J., Mendl, M. Routine handling methods affect behaviour of three-spined sticklebacks in a novel test of anxiety. Behavioural Brain Research. 306, 26-35 (2016).
- Hamilton, T. J., et al. Establishing zebrafish as a model to study the anxiolytic effects of scopolamine. Scientific Reports. , (2017).
- York, R. A., Fernald, R. D. The Repeated Evolution of Behavior. Frontiers in Ecology and Evolution. 4, 143 (2017).
- Jakka, N. M., Rao, T. G., Rao, J. V. Locomotor behavioral response of mosquitofish (Gambusia affinis) to subacute mercury stress monitored by video tracking system. Drug and Chemical Toxicology. , (2007).
- Hu, C. K., Brunet, A. The African turquoise killifish: A research organism to study vertebrate aging and diapause. Aging Cell. , (2018).
- Maximino, C., et al. Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214 (2), 157-171 (2010).
- Maximino, C., Marques de Brito, T., Dias, C. A. G., Gouveia, A., Morato, S. Scototaxis as anxiety-like behavior in fish. Nature protocols. 5 (2), 209-216 (2010).
- Godwin, J., Sawyer, S., Perrin, F., Oxendine, S., Kezios, Z. Adapting the Open Field Test to assess anxiety related behavior in zebrafish. Zebrafish Protocols for Neurobehavioral Research. , 181-189 (2012).
- Agetsuma, M., et al. The habenula is crucial for experience-dependent modification of fear responses in zebrafish. Nature Neuroscience. 13 (11), 1354-1356 (2010).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning and Memory. , (2012).
- Baker, M. R., Goodman, A. C., Santo, J. B., Wong, R. Y. Repeatability and reliability of exploratory behavior in proactive and reactive zebrafish, Danio rerio. Scientific Reports. , (2018).
- Friedrich, R. W., Genoud, C., Wanner, A. A. Analyzing the structure and function of neuronal circuits in zebrafish. Frontiers in Neural Circuits. , 7 (2013).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit Neuroscience in Zebrafish. Current Biology. 20 (8), (2010).
- Marquart, G. D., et al. A 3D Searchable Database of Transgenic Zebrafish Gal4 and Cre Lines for Functional Neuroanatomy Studies. Frontiers in Neural Circuits. , (2015).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nature Methods. 12 (11), 1039-1046 (2015).
- Gupta, T., et al. Morphometric analysis and neuroanatomical mapping of the zebrafish brain. Methods. 1046 (18), 30011-30012 (2018).
- Marquart, G. D., et al. High-precision registration between zebrafish brain atlases using symmetric diffeomorphic normalization. GigaScience. , (2017).
- Ronneberger, O., et al. ViBE-Z: A framework for 3D virtual colocalization analysis in zebrafish larval brains. Nature Methods. , (2012).
- Subedi, A., et al. Adoption of the Q transcriptional regulatory system for zebrafish transgenesis. Methods. 66 (3), 433-440 (2014).
- Scheer, N., Campos-Ortega, J. A. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 80 (2), 153-158 (1999).
- Chatterjee, D., Tran, S., Shams, S., Gerlai, R. A Simple Method for Immunohistochemical Staining of Zebrafish Brain Sections for c-fos Protein Expression. Zebrafish. , (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved