A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Agrobacterium tumefaciens , Agrobacterium rhizogenes-מתווכת טרנספורמציה של תפוחי אדמה, יזם פעילות של גן Suberin על ידי גאס Staining
In This Article
Summary
כאן, אנו מציגים שני פרוטוקולים להפוך את תפוחי האדמה צמחים. הטרנספורמציה Agrobacterium tumefaciens מוביל צמח מהונדס מלאה בעוד Agrobacterium rhizogenes מייצרת הטרנסגניים שורשים שעירים יורה פראי סוג זה יכול להיות עצמי שעבר בירושה. אנחנו מכן לזהות יזם פעילות על-ידי גאס צביעת שורשים טרנספורמציה.
Abstract
Agrobacterium sp. הוא אחד מהשיטות הנפוצה ביותר כדי להשיג את הצמחים הטרנסגניים כפי זה יש את היכולת להעביר ולשלב משלו-T-DNA הגנום של הצמח. כאן, אנו מציגים שתי מערכות טרנספורמציה לשינוי גנטית צמחים תפוחי אדמה (סולנום יכולת להתקשר אלי). בשינוי tumefaciens א , עלים נגועים, התאים טרנספורמציה נבחרו, מפעל חדש טרנספורמציה מוחלטת נוצר מחדש באמצעות phytohormones ב- 18 שבועות. בשינוי rhizogenes א , נובעת נגועים על ידי הזרקת החיידקים עם מחט, חדשים המתגלים טרנספורמציה שעיר השורשים מזוהים באמצעות סמן ניאון אדום, השורשים הלא-טרנספורמציה יוסרו. ב- 5-6 שבועות, המפעל וכתוצאה מכך הוא שילוב של צילומים פראי סוג עם שורשים שעירים טרנספורמציה מפותחת. להגברת ביומסה, שורשים שעירים טרנספורמציה יכול להיות טוחנות, מופצות עצמית. אנחנו מוחלים הן Agrobacterium -מתווכת שינוי שיטות להשגת שורשים לבטא את גן מדווח גאס מונחה על ידי יזם ג'ין biosynthetic הוחלף נגזר suberin. ההליך מכתימים גאס מסופק ומאפשר תא לוקליזציה של אינדוקציה יזם. שתי השיטות, הראו השורשים תפוחי אדמה טרנספורמציה מכתים suberized endodermis, exodermis, ובנוסף, בשורשים rhizogenes א הפכה הפעילות גאס גאס זוהה גם הופעתה של השורשים הצדדיים. תוצאות אלו מראים כי rhizogenes א יכול להיות כלי אלטרנטיבי מהר ללמוד הגנים מבוטאים שורשים.
Introduction
מלבד האינטרס הכלכלי, הדור של הצמחים הטרנסגניים כולל הרלוונטיות שלה במחקר כדי להדגים את הפונקציה האולטימטיבי של גנים, להבין טוב יותר את פיזיולוגיה של הצמח ופיתוח. הנפוצים ביותר שיטה עבור צמח DNA ההכנסה הוא Agrobacterium-מתווכת טרנספורמציה. Agrobacterium tumefaciens הוא מסוגל לייצר עפצים הכתר הרקמה הנגועה מיני צמחים רבים על ידי הפעולה של שלה פלסמיד (Ti) בתדר הגידול. פלסמיד מכיל אזור T-DNA עם קבוצה של גנים אשר ניתן לשלב הגנום צמח, זירוז רקמת dedifferentiation1,2. ההחלפה של גנים אלה בתוך T-DNA על ידי transgene אפשרה את הדור של שינויים צמח מסוים הימנעות אפקטים פנוטיפי3. כדי להקל את transgene שיבוט לתוך T-DNA, האזור T-DNA יש כבר חתכתם ב פלסמיד עצמאי הנקרא פלסמיד בינארי, בעוד ששאר הגנים של פלסמיד Ti (הגנים התקפה אלימה לאפשר את מנגנוני העברת והוספה של T-DNA) היה להציב אותם פלסמיד המסייע. לחקר הביוטכנולוגיה צמח, שינוי על-ידי tumefaciens א יש מספר יתרונות: זה אינו צריך מכשירים יקרים, הוא מסוגל לייצר טרנספורמציה צמח ארעית ויציבה, והן מספר נמוך של ג'ין עותקים משולבים כרומוזום4. עם זאת, רוב הצמחים, אבל לא תודרנית, הדור של transformants יציב דורשת התחדשות הצמח בודד או מספר תאים באמצעות phytohormones אקסוגני, ביצוע תהליך זה מפרך וצורכת זמן. Rhizogenes א הוא גם מסוגל לשנות את הגנום צמח, בהפקת שורשים שעירים או שורשים adventitious באתרים זיהום עקב הביטוי של גנים rol ( לוקוסיםכבסיס) המקודדת בתדר שורש (Ri) פלסמיד5. למרות פחות למד יותר tumefaciens א, א rhizogenes משמש גם לקבלת הטרנסגניים שורשים. במקרה זה, rhizogenes א מכיל את המקורי T-DNA על פלסמיד רי ו פלסמיד בינארי עם השנייה T-DNA נושא את transgene. כאשר האתר זיהום גבעולים או hypocotyls, צמח מורכב ניתן להשיג, עם שורשים חדשים שעיר הטרנסגניים הבוקע פראי סוג יורה. לחלופין, שורשים טרנספורמציה שעיר יכול לגדול באופן עצמאי במבחנה בתקשורת עם כניסות מקור פחמן. השימוש rhizogenes א במקום tumefaciens א כדי לייצר רקמות הטרנסגניים הוא צובר רלוונטיות כאשר הבסיס הוא איבר המטרה, כי התחדשות הצמח לא נדרש, מכאן זה יותר מהר ויקרות פחות. מחקרים קודמים הדגימו מתודולוגיה זו הופקעו עבור אפיון פנוטיפי שורש גנים ספציפיים6,7,8,9.
תפוחי האדמה (יכולת להתקשר אלי סולנום) הוא היבול הרביעי החשוב ביותר בעולם על פי המזון והחקלאות של האו ם (FAO) מאז פקעת יש רלוונטיות התזונתיות לצריכה אנושית על היותך מקור טוב של ויטמינים ומינרלים. מסיבה זו, תפוחי אדמה מוקם באור הזרקורים של ביוטכנולוגיה חקלאית, ונחשב גם כמו מודל ביולוגיים גנטיים, התפתחותית מחקרים10,11. תפוחי אדמה טרנספורמציה תרמה בצורה משמעותית להבנת המנגנונים המולקולריים שבבסיס הרקמות suberized דרך אפיון גנים המעורבים suberin, שעווה ביוסינטזה12,13,14 ,15,16,17, suberin מונומר התחבורה18 ו שעתוק בתקנה19. Suberin feruloyl טרנספראז הגן, לריב, הוא אחד הגנים biosynthetic הוחלף נגזר מאופיין האלה; downregulation שלה מעורר ליקוי חזקה של ההגנה periderm, אשר הוא מתואם עם ירידה חזקה אסטרים ferulate של suberin, שעוות פקעות תפו א14. / ת, שורשים, זרעים של תודרנית, הסתרה באמצעות של שלו בשם orthologue (ASFT/RWP1) הפגינו גם תפקידה בהפקת אלקיל ferulates20,suberin21. תפוחי אדמה, הקו כתב תעתיק לריב , הנוגדן לריב הראה בהתאמה כי הפעילות יזם החלבון נמצאים את exodermis, endodermis, phellogen-הנגזרים, רקמות הפצועים15.
בעבודה זו, אנחנו פירוט נוהל באמצעות rhizogenes א כדי לייצר שורשים שעירים הטרנסגניים נשמרים ביורה פראי סוג, תפוחי אדמה ללא הפרדות צבע מפעלים לייצור או טוחנות לגדול באופן עצמאי בתוך חוץ גופית. אנו מספקים גם את הפרוטוקול באמצעות tumefaciens א כדי לקבל תפוחי אדמה הטרנסגניים מלאה צמחים. כמקרה, rhizogenes א tumefaciens א טרנספורמציה עם וקטור בינארי זהה משמשים להשגת שורשים עם האמרגן לריב נהיגה גאס כתב גנים. התוצאות שדווחו, בהשוואה.
Protocol
פרוטוקול טרנספורמציה rhizogenes א הותאם ושינית קרן ואח7 והיה גנוטיפ נבדק ssp יכולת להתקשר אלי ס . יכולת להתקשר אלי (cv. דזירה). פרוטוקול טרנספורמציה tumefaciens א היה הותאם שונה בנרג'י ואח22 ו אחרים שנבדקו היו יכולת להתקשר אלי ס ssp. יכולת להתקשר אלי (cv. דזירה) ואת יכולת להתקשר אלי ס ה-ssp andigena. השלבים העיקריים של נהלים לשתיהן מסוכמות באיור 1 ו- 2 איור, בהתאמה.
הערה: כל השלבים של ההליך ביצוע העברות במבחנה , לעשות זאת במהירות, במידת האפשר, לתחזק את צלחות או סירים סגור, ובכך לחסוך צמח חשיפה לאוויר כדי להימנע כמישה וזיהום. צוין אחרת, כל incubations הצמח נעשו בו ארונות בתנאים של 12 שעות של 24 ° C h אור/12 של 20 ° C כהה, 67 µmol ז-1 s-1. צוין אחרת, לבצע כל החיידקים במחרוזות, במבחנה צמח ההעברות aseptic בתנאי תא למינארי. כל שאר המתכונים מדיה עבור Agrobacterium במבחנה צמח תרבויות ניתנים שולחן S1.
התראה: להפקיד כל חיידקים מהונדסים, צמחים לגורם פסולת הופקעו.
1. Agrobacterium תרבויות המשמש לשינוי
הערה: המתח המשמש לשינוי א rhizogenes C58C1:Pri15837 (באדיבות שסופק על-ידי ד ר ברואר Inge) וזה עבור tumefaciens א היה GV2260 (לנוחיותנו מאת ד ר Salomé Prat). Rhizogenes א הפך עם וקטור בינארי PK7GWIWG2_II-RedRoot (VIB-המחלקה לביולוגיה מערכות צמח Universiteit Gent; http://gateway.psb.ugent.be) המכילה של T-DNA נושא סמן שינוי כדי לנטר את השורש שעיר צורה. כדי להשוות את השורשים טרנספורמציה שנוצר על ידי rhizogenes א tumefaciens א, הן נהפכו עם pKGWFS7 וקטור בינארי המכיל את T-DNA נושא ייצוג המקדם לריב נהיגה הגן β-glucoronidase (גאס) כתב הגן ההתנגדות Kanamycin סמן לבחירה15.
- לבחור מושבה של Agrobacterium , לגדל את זה בן לילה (O/N) ב 5 מ של בינוני YEB בתוספת אנטיביוטיקה (טבלה S1) בשפופרת צנטרפוגה 50 מ ל- 28 מעלות צלזיוס ברעידות-200 סל ד.
- לטרנספורמציה tumefaciens א , למדוד את הצפיפות האופטית, אשר חייב להיות OD600 = 0.6-1.0.
- אם הצפיפות האופטית גבוהה, לעשות שתרבות הורדתו כדי OD600 = 0.3 עם מדיה טריים ולחכות עד התרבות מגיע OD600 = 0.6-1.
- צנטריפוגה 1 מ"ל של תרבות Agrobacterium ב x 3000 g ומפרידה ספסל-top 10 דקות בטמפרטורת החדר.
- הסר את תגובת שיקוע על-ידי pipetting, resuspend תאים 1 מ"ל של מדיום YEB טריים ללא אנטיביוטיקה. חזור על שלב זה כדי להבטיח הסרה מלאה של אנטיביוטיקה.
- לטרנספורמציה tumefaciens א , ב- resuspension האחרון להוסיף האחסון YEB המתאים כדי להשיג צפיפות אופטית הסופי של יתר600 = 0.8.
- לשמור תאים על הקרח תוך הכנת הצמחים כדי להיות נגוע.
2. לשתול חומר לשינוי
- להפוך את אחד או שניים צומת גזע ייחורים המכיל גם הפסגה או בלוטות עזר מצמחים סטרילי במבחנה תפוחי אדמה (התורם צמחים); לגדל אותם במדיום מוצק 2 אלפיות השנייה בעציצים במשך 3 עד 4 שבועות (איור 1A ואיור 2A).
3. הצמח טרנספורמציה באמצעות rhizogenes א (איור 1)
הערה: הליך זה מאפשר קבלת של טרנספורמציה שורשים שעירים. להעריך את הביטוי transgene, דרוש פקד שלילי. כדי להכין את הפקד שלילי, בצע את ההליך באמצעות זן rhizogenes א untransformed או טרנספורמציה עם הווקטור ריק הכולל את הגן סמן טרנספורמציה.
- השתמש לוחות מדיה טריים; לחלופין, הלוחות ניתן לשמור ב 4 ° C עם הצד המכסה, אטומה בחוזקה עם סרט שקוף למניעת התייבשות מדיה. כדי להכין את הצלחות מדיה מרובע, שיפוע אותם ~ 15°, מילוי עם 40 מ של MS, ולתת להם לחזק. זה יצמצם את איש הקשר של החלק אווירי של הצמח עם המדיום.
- להעביר בזהירות רבה צמח התורם של המדיום 2 אלפיות השנייה צלחת 120 מ"מ x 120 מ"מ מרובע.
- להזריק את גזע אחד internode 3 μL של התרבות rhizogenes א באמצעות מחט כירורגית ויש לחזור על זה פעמיים לכל צמח בפרקי הגבעולים שונים במידת האפשר.
הערה: לשקול כל זריקה כאירוע טרנספורמציה עצמאית (איור 1B). - להעביר מיד את הצמח כולו צלחת מרובעת בינונית MS מוצק בתוספת acetosyringone 0.1 מ מ. להכיל צמחים 2 לכל צלחת.
הערה: הפתרון 1 מ' מניות acetosyringone מוכן ב דימתיל סולפוקסיד, שניתן לאחסן ב-20 ° C. - לאטום את הצלחת באמצעות הדבקה, לארגן אותו אנכית בתוך ארון גידול במשך 4 ימים.
- להעביר את הצמח צלחת מרובע חדש MS בינונית עם נתרן cefotaxime [500 µg/mL] להרוג rhizogenes א.
- לאחר 10-12 ימים, שורשים שעירים יתחילו להופיע (איור 1C,ד 1). לאחר מכן, לסלק את שורשי הצמח מקורית, להעביר את הצמח צלחת מרובע חדש MS בינונית עם נתרן cefotaxime [500 µg/mL].
הערה: שורשים שעירים טרנספורמציה ניתן לבדוק על ידי פלואורסצנטי אדום בעת שימוש בסמן שינוי DsRed (דמות תלת-ממד). - כדי להשיג צמח ללא הפרדות צבע (איור 1E), תן את השורשים שעיר הטרנסגניים לגדול במשך 3-4 שבועות ב MS בינוני עם נתרן cefotaxime [500 μg/mL] (לשנות המדיום כל שבוע).
- בהתאם למטרה, להפיץ את השורשים שעיר הטרנסגניים והפקדים שלילי כדלקמן.
- העברת המפעל כולו מורכב הידרופוני (טבלה S2) או אדמה בינוני כדי לאפשר פיתוח מאסיבי.
- להפיץ בנפרד את השורשים שעיר טרנספורמציה, באמצעות אזמל לחתוך את השורשים לבטא את סמן אדום טרנספורמציה פלורסנט (חלבון DsRed) כאשר הם 4 – 8 ס"מ (איור 1E), להעביר אותם לתוך צלחת פטרי בינונית מוצק Gamborg B5 בתוספת 2% סוכרוז, cefotaxime נתרן [500 μg/mL]. חותם הצלחות עם מעבדה פלסטיק הסרט ואגדל אותם בחושך ב 20 º C.
הערה: ניתן לטפל בשורשים תחת stereomicroscope מצויד כדי לזהות את פלורסצנטיות בתנאים סטריליים (ראה טבלה של חומרים). - לייצור ביומסה (קרי, ניתוח ביטוי של גנים), לחתוך שורש הארוכה והשעירה נגעה 5 ס"מ ו להפיץ אותה ב 150 מ Erlenmeyer את הבקבוק עם 20 מ של Gamborg B5 בינוני נוזלי בתוספת 2% סוכרוז, cefotaxime נתרן [500 µg/mL]. לגדל את זה 6 שבועות בחושך-20 ° C ו- 60 סל ד.
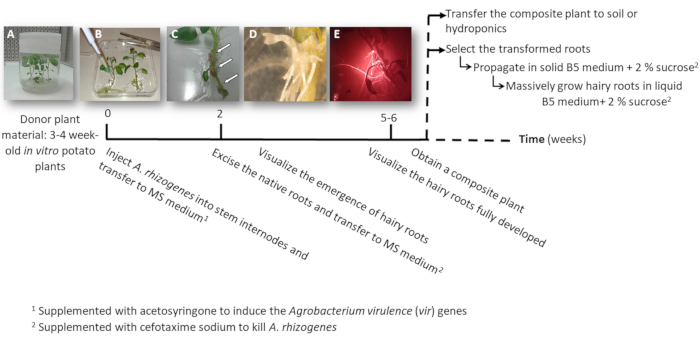
איור 1: ציר הזמן כדי לקבל תפוחי אדמה הטרנסגניים שורשים שעירים באמצעות א rhizogenes. השבועות המצטבר כדי להגיע בכל שלב של תהליך שינוי, והשלבים הבאים לצמוח שורשים שעירים מוצגים. להחליפן בתמונות של שלבים שונים מתוארים: אתחול של התהליך באמצעות בת שבוע-3 במבחנה צמחים (A), ואז זיהום של הצמחים על ידי הזרקת rhizogenes א (B), היווצרות שגשוג רקמה (C, חצים) עם שורשים שעירים המתעוררים (D), שורשים שעירים מפותחת לבטא את סמן אדום טרנספורמציה פלורסנט DsRed (E). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
4. הצמח טרנספורמציה באמצעות tumefaciens א (איור 2)
הערה: הליך זה מאפשר קבלת של צמחים טרנספורמציה. כדי להעריך את ההשפעה של transgene, דרוש פקד שלילי. אפשרות אחת היא ללכת בעקבות ההליך משתמש של tumefaciens א טרנספורמציה עם הווקטור ריק. לחלופין, ניתן להשתמש פראי סוג צמחים.
- לחתוך ומניחים עלה מצמחים 3-4-בת שבוע (איור 2 א) בצלחת פטרי. באמצעות אזמל לא לכלול הפטוטרת, לבצע קיצוץ רוחבי (1-3 תלוי בגודל העלה) במרכז העלה הקצוות הימנעות לניתוקם (איור 2B).
- מיד למקם העלה צף על 10 מ"ל של 2 אלפיות השנייה טריים נוזל מדיית בצלוחית עם הצד abaxial למעלה, ולסגור את הצלחת. חזור על השלב אדיב עד 15 יוצא cv. דזירה ומשאיר 25 עבור ה-sspndigena (תלוי בגודל העלה).
- מיד להוסיף 80 µL התרבות tumefaciens א -OD600 = 0.8 בתקשורת נוזלי, homogenize את הצלחת באופן ידני עבור 1 דקות להפיץ את הפתרון חיידקי.
- בזהירות חותם עם איטום הסרט, מכסים ברדיד אלומיניום, תקופת דגירה של 2 ימים בחדר ב 24 ° C כדי לאפשר את השינוי להתרחש.
- להעביר את העלים שומרים בצד abaxial עד בינוני CIM (איור 2B), דגירה אותם במשך שבוע אחד על גידול בארון.
- לגרד את המדיום CIM עם הפינצטה כך העלים ניתן לאכלס יותר באמצעי התקשורת.
- להעביר את העלים שומרים בצד abaxial עד ה-SIM בינוני (איור 2C), דגירה אותם בגידול cabinet, מרעננים המדיום כל 7-10 ימים, עד יורה בערך 2 ס מ גבוה.
- לגרד את המדיום SIM עם הפינצטה כך העלים יהיה מוקף באופן מלא ע י התקשורת. כאשר נצרי המתגלים להגיע את המכסה, לעבוד עם צלחות פטרי גבוה (100 x 20 מ מ, גובה x קוטר).
הערה: קסם יהוו לאחר 2-3 שבועות ב- SIM בינוני (איור דו-ממדי) ויורה אחרי 6-7 שבועות (2E איור). נצרי ייחשבו אירועים טרנספורמציה עצמאי כאשר הם מגיחים קסם נוצר הפצעים עצמאית.
- לגרד את המדיום SIM עם הפינצטה כך העלים יהיה מוקף באופן מלא ע י התקשורת. כאשר נצרי המתגלים להגיע את המכסה, לעבוד עם צלחות פטרי גבוה (100 x 20 מ מ, גובה x קוטר).
- לחתוך שלוש יורה המתגלים בין כל קסם (נחשב לאותו אירוע טרנספורמציה) (איור 2E), העברת להם תרבות מבחנות בינונית מ"ג בתוספת cefotaxime נתרן [250 mg/L] כדי לאפשר השתרשות, תווית המשנה עם מספר, דגירה ב גידול בארון במשך 3-4 שבועות או עד נצרי נמרצת (2F איור).
הערה: כאשר אתה מבתר את יורה, להסיר גם את קסם אחרת שלא יהוו הבסיס.- חזור על השלב כמה שיותר פעמים הקווים עצמאי יש צורך. עד 5 טרנספורמציה שונים ניתן למקם אירועים בבקבוקון תרבות בקוטר של 8 ס מ לעבוד בביטחון מלא כי הצמחים מאירועים שונים לא מעורבבים.
- בחר הצמח נמרצת ביותר של כל אירוע, לחתוך את הקטע הפסגה של הצילומים עם 3-4 פרקי הגבעולים ומניחים אותו בבקבוקון תרבות חדשה בינונית 2 אלפיות השנייה בתוספת cefotaxime נתרן [250 mg/L].
הערה: 3-6 שבועות שהצמח יגדל בצורה יעילה, פיתוח לצלם נמרצת ושורשים.- להחזיר לחדר את יורה שלא נבחרו עד הצמח שנבחר פיתחה באופן מלא.
- לחתוך קטעים גזע מהמפעל עם internode אחד לפחות או עם ניצן הפסגה ולהעביר אותם למדיום חדש 2 אלפיות השנייה, בתוספת cefotaxime [250 mg/L]. דגירה אותם בבית הגידול בארון.
- לשכפל כל 3-4 שבועות להקים את הקווים במבחנה טרנספורמציה.
הערה: נתרן cefotaxime נדרש לפחות שלוש העברות עוקבות למדיום 2 אלפיות השנייה כדי להיות בטוח כדי להרוג את tumefaciens א; לאחר מכן, אם נצפית overgrowth tumefaciens א , להעביר את הצמחים שוב למדיה 2 אלפיות השנייה, בתוספת cefotaxime נתרן.
- לשכפל כל 3-4 שבועות להקים את הקווים במבחנה טרנספורמציה.
- כדי לאפיין את הצמח פנוטיפ, העברת צמחים קרקע שלהם אפיון מלא או לתרבות הידרופוניקה לבדיקה שורש.
- שמור את פקעות המיוצר בקרקע להפיץ ולשמור על הקווים הוקמה.

איור 2: ציר הזמן כדי להשיג את תפוחי האדמה הפכה צמחים באמצעות א tumefaciens. השבועות המצטבר כדי להגיע בכל שלב של תהליך שינוי, והשלבים הבאים כדי לגדל את הצמחים מוצגים. להחליפן בתמונות של שלבים שונים מתוארים: אתחול של התהליך באמצעות עלים מצמחים 3 - בן שבועיים במבחנה (), העברת הפצועים ואת נגוע עלים למדיה CIM (B), העלים כאשר הועבר SIM מדיה (C), את החזיית קסם סביב האזורים הפצועים לאחר 2-3 שבועות ב SIM מדיה (D), היווצרות לירות אחרי 9-11 שבועות בתקשורת SIM (E), ויורה את לאחר שהועבר למדיה MG (F). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
5. הידרופוני תרבות
- להכין הפתרון של הוגלנד חצי כוח (0.5 x) (טבלה S2) בתוך דלי 10 L.
- לטבול משאבת אקווריום כדי לשמור על הומוגניות ותנאי מספיק חמצן.
- לכסות את הקירות של הדלי עם רדיד אלומיניום לצמוח שורשים בתנאי כהה.
- הימנעות נזק הבסיס, להעביר במבחנה צמחי תרבות הידרופוני.
הערה: הסר בינוני כל במבחנה הנותרים שורשים כדי למנוע התפשטות מיקרואורגניזם במהלך הדגירה ע י ניעור בקפידה את השורשים הושקע במים. - לכסות את הצמחים עם סרט שקוף כמו החממה כדי לאפשר הסתגלות נאותה דגירה בבית הבליעה הולך וגדל.
- לחורר הסרט לאחר 3 ימים ולהסיר אותו לחלוטין שבוע אחד לאחר.
- החלף מדיה טריים כל עשרה ימים.
6. גאס כתב פתולוגיה ג'ין assay
הערה: במקרה שלנו גאס ניתוח בוצע עם שורשים של 2-3 שבועות גדלו ב הידרופוניקה או בתוך חוץ גופית.
- לתקן את השורשים עם אצטון 90% מקורר (v/v), דגירה זה במשך 20 דקות על קרח.
- לבצע שתי מכונות שטיפה עם מים מזוקקים.
- להוסיף גאס טריים מכתים פתרון (טבלה 1) ולהחיל ואקום (-70 הרשות הפלסטינית) במשך 20 דקות.
- דגירה ב 37 מעלות צלזיוס בחושך כדי להגן על גאס פוטוסנסיטיבית במשך 4 שעות או עד צבע כחול יהיה גלוי.
הערה: הנוכחות של פרי, ferrocyanide בתמיסה גאס למזער פעפוע של התגובה מוצרים, מספקים לוקליזציה מדויקת יותר.
התראה: שימוש ברדס fume, ללבוש ביגוד מגן בעת טיפול את רעל הציאניד נגזרים בפתרון גאס (אשלגן ferricyanide ו- ferrocyanide אשלגן). המצע גאס, סילוק החומר צריך להיות מסולק בבטחה. - להסיר את גאס מכתים פתרון וזורקים אותו במיכלים מתאימים.
- לבצע שתי כביסות עם אתנול 70% (v/v).
- להתבונן במיקרוסקופ שדה בהיר.
הערה: גאס מכתים יציב במשך כמה שבועות; עם זאת, במהלך השבוע הראשון, האות גאס ברור, מפזרת פחות לתוך תאים שכנים. לאחסון ארוך יותר, לאטום את הצינור ואחסן אותו ב 4 º C.
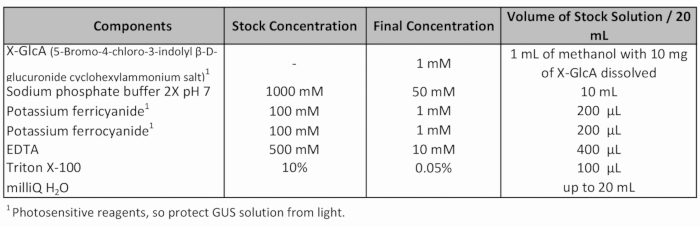
טבלה 1: מתכון פתרון מכתימים. גאס.
תוצאות
Agrobacterium rhizogenes -מתווכת תפוחי אדמה טרנספורמציה
כתב יד זה, מוצג התהליך צעד אחר צעד כדי להשיג root טרנספורמציה עם rhizogenes א . איור 1 מציג סקירה של ההליך, אשר בסך הכל לוקח כ 5-6 שבועות (מתוך הזרקה של rhizogenes ?...
Discussion
תפוחי אדמה, המערכת השכיחה ביותר להשגת יציבה הצמחים הטרנסגניים מלאה משתמשת הטרנספורמציה על ידי זנים Agrobacterium tumefaciens הדורשים organogenesis באמצעות phytohormones אקסוגני. למרות שהפרוטוקולים Agrobacterium מבוסס יש פוטנציאל להשתלב וקטור הלא-T-DNA רצף25, מתודולוגיה זו זמינה עדיין הכי קל ופחות ?...
Disclosures
המחברים יש שאין ניגודי אינטרסים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי y Ministerio דה Innovación Ciencia (AGL2009-13745, FPI מענק PB), Ministerio דה Economía y Competitividad פדר מימון (AGL2012-36725, AGL2015-67495-C2-1-R), ואת אוניברסיטת ז'ירונה (PhD גרנט SF, גרנט SING11/1). המחברים מודים Inge ד ר ברואר (המכון לחקר שימושי קרקע, באוניברסיטת רוסטוק, רוסטוק, גרמניה), ד ר Salomé פרת (Centro נאסיונאל דה Biotecnología, מדריד, ספרד) למתן את rhizogenes א ואת המתח tumefaciens א , בהתאמה, ד ר מקסים סולר ואת ד ר אנה פלסנסיה בעזרה ותמיכה קיבל ב ייזום הניסויים טרנספורמציה rhizogenes א (Toulouse השלישי פול סבטייה אוניברסיטת — CNRS, צמח מחקר מעבדה (LRSV), Castanet Tolosan, צרפת). המחברים תודה שרה גומז (Departament de Biologia, UdG, גירונה) שלה סיוע חשוב בביצוע העבודה מעבדה, מטפל של צמחים, ואת Ferran Fontdecaba Sánchez קרלה שעזר בחלק מהניסויים בעוד הם עושים הפרויקטים התואר הסופי שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | Panreac | 1.310.071.21 | |
| Acetosyringone | Acros | 115540050 | |
| Aquarium pump | Prodac | MP350 | |
| Autoclave | Ragpa Strelimatic | ||
| Bacteriological agar | Lab Conda | 1800 | |
| BAP | Duchefa | B0904 | |
| Beef extract | Lab Conda | 1700 | |
| Plant growing cabinet | Nuaire | ||
| Carbenicillin | Duchefa | C0109 | |
| Cefotaxime sodium | Duchefa | C0111 | |
| DMSO | Merck | 1029310161 | |
| Ecotron infors | HT | 29378 | |
| Ethanol | Merck | 1,009,831,011 | |
| Falcon tube | Control tecnica | CFT011500 | |
| Ferricyanate | Sigma | 101001081 | |
| Ferrocyanate | Sigma | 100979088 | |
| Flask (8.06 cm diameter and 11.3 cm height) and plastic lid for in vitro culture | Apiglass | ref16 | |
| GA3 | Sigma | G7645 | |
| Gamborg B5 media | Duchefa | G0210 | |
| Gelrite | Duchefa | G1101 | |
| Glucosa | Sigma | G5767 | |
| Kanamycin | Sigma | K1377 | |
| Leukopor tape | BSN Leukopor | BDF47467 | |
| Lupe | Wild-Heerbrugg | M420 | |
| Magnetic shaker | Agimatic | 7000243 | |
| MES hydrate | Sigma | M2933-25G | |
MgSO4 | Panreac | 131404 | |
| Microscope | Olympus | ||
| Minufugue centrifugue 5415R | Eppendorf | ||
| Murashige and Skoog media | Duchefa | M0254.0050 | |
Na2HPO4 | Panreac | 131679 | |
| NAA | Duchefa | N0903 | |
| NaCl | Panreac | 131659 | |
NaH2PO4 | Sigma | 58282 | |
| NightSea Stereo | SFA Moonting Adapter | ||
| Parafilm | Anorsa | PRFL-001-001 | |
| Peptone | Lab Conda | 1616 | |
| Petri dishes (90 x 14) | Anorsa | 200200 | |
| pHmetre | Crison | ||
| Phytotron | Inkoa | RFTI-R5485 | |
| Plant Agar | Duchefa | P1001 | |
| Refrigeratot | Liebherr Medline | ||
| Rifampicin | Duchefa | R0146 | |
| Spectinomycin | Sigma | 59007 | |
| Spectrophotometer | Shimadzu | ||
| Square plates (120 x 120) | Deltalab | 200204 | |
| Streptomycin | Sigma | S6501 | |
| Sucrose | Panreac | 131621 | |
| Surgical blades | Swann-Morton | 201 | |
| Surgical needle | NIPRO | 015/0204 | |
| Triptone | Lab Conda | 1612 | |
| Triton | Serva | 37240 | |
| Unimax 1010 shaker | Heidolph | ||
| Vacuum | Dinko | ||
| x-GlcA (5-Bromo-4-chloro-3-indoxyl-beta-D-glucuronic acid, sodium salt anhydrous) | Biosynth | B-7398 | |
| Yeast extract | Lab Conda | 1702.00 | |
| Zeatin riboside | Sigma | 1001042850 |
References
- Gelvin, S. B. Traversing the Cell: Agrobacterium T-DNA's journey to the host genome. Frontiers in Plant Science. 3, 1-11 (2012).
- Lacroix, B., Citovsky, V. The roles of bacterial and host plant factors in Agrobacterium-mediated genetic transformation. The International Journal of Developmental Biology. 57 (6-8), 467-481 (2013).
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Ishida, Y., et al. High efficiency transformation of maize (Zea mays L.) mediated by Agrobacteriumtumefaciens. Nature Biotechnology. 14 (6), 745-750 (1996).
- White, F. F., Taylor, B. H., Huffman, G. A., Gordon, M. P., Nester, E. W. Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes. Journal of Bacteriology. 164 (1), 33-44 (1985).
- Dinh, P. T. Y., Brown, C. R., Elling, A. A. RNA Interference of effector gene Mc16D10L confers resistance against Meloidogyne chitwoodi in Arabidopsis and Potato. Phytopathology. 104 (10), 1098-1106 (2014).
- Horn, P., et al. Composite potato plants with transgenic roots on non-transgenic shoots: a model system for studying gene silencing in roots. Plant Cell Reports. 33 (12), 1977-1992 (2014).
- Plasencia, A., et al. Eucalyptus hairy roots, a fast, efficient and versatile tool to explore function and expression of genes involved in wood formation. Plant Biotechnology Journal. 14 (6), 1381-1393 (2015).
- Ron, M., et al. Hairy root transformation using Agrobacteriumrhizogenes as a tool for exploring cell type-specific gene expression and function using tomato as a model. Plant Physiology. 166 (2), 455-469 (2014).
- Zhang, W., et al. Development and application of a universal and simplified multiplex RT-PCR assay to detect five potato viruses. Journal of General Plant Pathology. 83 (1), 33-45 (2017).
- Almasia, N. I., et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies. BMC Biotechnology. 17 (1), 1-11 (2017).
- Serra, O., et al. Silencing of StKCS6 in potato periderm leads to reduced chain lengths of suberin and wax compounds and increased peridermal transpiration. Journal of Experimental Botany. 60 (2), 697-707 (2009).
- Serra, O., et al. CYP86A33-Targeted gene silencing in potato tuber alters suberin composition, distorts suberin lamellae, and impairs the periderm's water barrier function. Plant Physiology. 149 (2), 1050-1060 (2008).
- Serra, O., et al. A feruloyl transferase involved in the biosynthesis of suberin and suberin-associated wax is required for maturation and sealing properties of potato periderm. The Plant Journal. 62 (2), 277-290 (2010).
- Boher, P., Serra, O., Soler, M., Molinas, M., Figueras, M. The potato suberin feruloyl transferase FHT which accumulates in the phellogen is induced by wounding and regulated by abscisic and salicylic acids. Journal of Experimental Botany. 64 (11), 3225-3236 (2013).
- Serra, O., Chatterjee, S., Figueras, M., Molinas, M., Stark, R. E. Deconstructing a plant macromolecular assembly: chemical architecture, molecular flexibility, and mechanical performance of natural and engineered potato suberins. Biomacromolecules. 15 (3), 799-811 (2014).
- Vulavala, V. K. R., et al. Identification of genes related to skin development in potato. Plant Molecular Biology. 94 (4-5), 481-494 (2017).
- Landgraf, R., et al. The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. The Plant Cell. 26 (8), 3403-3415 (2014).
- Verdaguer, R., et al. Silencing of the potato StNAC103 gene enhances the accumulation of suberin polyester and associated wax in tuber skin. Journal of Experimental Botany. 67 (18), 5415-5427 (2016).
- Molina, I., Li-Beisson, Y., Beisson, F., Ohlrogge, J. B., Pollard, M. Identification of an Arabidopsis feruloyl-coenzyme A transferase required for suberin synthesis. Plant Physiology. 151 (3), 1317-1328 (2009).
- Gou, J. Y., Yu, X. -. H., Liu, C. J. A hydroxycinnamoyltransferase responsible for synthesizing suberin aromatics in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18855-18860 (2009).
- Banerjee, A. K., Prat, S., Hannapel, D. J. Efficient production of transgenic potato (S. tuberosum L. ssp. andigena) plants via Agrobacterium tumefaciens-mediated transformation. Plant Science. 170 (4), 732-738 (2006).
- Sunil Kumar, G. B., Ganapathi, T. R., Srinivas, L., Revathi, C. J., Bapat, V. a. Expression of hepatitis B surface antigen in potato hairy roots. Plant Science. 170 (5), 918-925 (2006).
- Schmidt, J. F., Moore, M. D., Pelcher, L. E., Covello, P. S. High efficiency Agrobacteriumrhizogenes-mediated transformation of Saponariavaccaria L. (Caryophyllaceae) using fluorescence selection. Plant Cell Reports. 26 (9), 1547-1554 (2007).
- Petti, C., Wendt, T., Meade, C., Mullins, E. Evidence of genotype dependency within Agrobacteriumtumefaciens in relation to the integration of vector backbone sequence in transgenic Phytophthorainfestans-tolerant potato. Journal of Bioscience and Bioengineering. 107 (3), 301-306 (2009).
- Gaudin, V., Vrain, T., Jouanin, L. Bacterial genes modifying hormonal balances in plants. Plant Physiology and Biochemistry. 32 (1), 11-29 (1994).
- Nemoto, K., et al. Function of the aux and rol genes of the Ri plasmid in plant cell division in vitro. Plant Signaling &. Behavior. 4 (12), 1145-1147 (2009).
- Visser, R. G. F., et al. Expression and inheritance of inserted markers in binary vector carrying Agrobacteriumrhizogenes-transformed potato (Solanumtuberosum L.). Theoretical and Applied Genetics. 78 (5), 705-714 (1989).
- Guillon, S., Trémouillaux-Guiller, J., Pati, P. K., Rideau, M., Gantet, P. Hairy root research: recent scenario and exciting prospects. Current Opinion in Plant Biology. 9 (3), 341-346 (2006).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Ooms, G., Lenton, J. R. T-DNA genes to study plant development: precocious tuberisation and enhanced cytokinins in A. tumefaciens transformed potato. Plant Molecular Biology. 5 (4), 205-212 (1985).
- de Vries-Uijtewaal, E., et al. Fate of introduced genetic markers in transformed root clones and regenerated plants of monohaploid and diploid potato genotypes. TAG. Theoretical and applied genetics. 78 (2), 185-193 (1989).
- Bird, D., et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal: For Cell and Molecular Biology. 52 (3), 485-498 (2007).
- Luo, B., Xue, X. Y., Hu, W. L., Wang, L. J., Chen, X. Y. An ABC transporter gene of Arabidopsis thaliana, AtWBC11, is involved in cuticle development and prevention of organ fusion. Plant and Cell Physiology. 48 (12), 1780-1802 (2007).
- Panikashvili, D., et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiology. 145 (4), 1345-1360 (2007).
- Panikashvili, D., et al. The Arabidopsis DSO/ABCG11 transporter affects cutin metabolism in reproductive organs and suberin in roots. Molecular Plant. 3 (3), 563-575 (2010).
- Bjelica, A., et al. Fatty acid ω-hydroxylases from Solanum tuberosum. Plant Cell Reports. 35 (12), 2435-2448 (2016).
- Ding, Y., et al. Abscisic acid coordinates nod factor and cytokinin signaling during the regulation of nodulation in Medicago truncatula. The Plant Cell. 20 (10), 2681-2695 (2008).
- Isayenkov, S., Mrosk, C., Stenzel, I., Strack, D., Hause, B. Suppression of allene oxide cyclase in hairy roots of Medicagotruncatula reduces jasmonate levels and the degree of mycorrhization with glomus intraradices 1[w]. Plant Physiology. 139 (3), 1401-1410 (2005).
- Dalton, D. A., et al. Physiological roles of glutathione S-Transferases in soybean root Nodules 1[C][W][OA]. Plant Physiology. 150 (1), 521-530 (2009).
- Limpens, E., et al. RNA interference in Agrobacteriumrhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55 (399), 983-992 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved