Method Article
דיסקציה של Ca מקומי2 + אותות בתאים בתרבית על ידי קרום, ממוקדות Ca2 + אינדיקטורים
In This Article
Summary
כאן אנו מציגים פרוטוקול עבור Ca2 + הדמיה של נוירונים ותאי גלייה, המאפשרת את הקרע של Ca2 + אותות ברזולוציה subcellular. תהליך זה הוא החלים על כל סוגי תאים לאפשר הביטוי של Ca מקודדים גנטית2 + מחוונים.
Abstract
יון סידן (Ca2 +) הוא מולקולה messenger תאיים אוניברסלי כוננים מרובים איתות המסלולים, שמוביל פלטי ביולוגי מגוונות. התיאום של Ca שני2 + אות מקורות – "Ca2 + זרם" מ שנמצא מחוץ לתא "Ca2 + שחרור" מתאיים Ca2 + חנות (ER) רשתית תוך-פלזמית – נחשבת ביסוד דפוסי-עתיים מגוונות Ca 2 + איתותים שגורמים מרובות פונקציות ביולוגיות בתאים. המטרה של פרוטוקול זה היא לתאר Ca2 + הדמיה שיטה חדשה המאפשר פיקוח הרגע של "Ca2 + זרם" ולשחרר "Ca2 + ". השניה-GCaMP6f הוא מקודד גנטית Ca2 + מחוון (GECI) הכוללת GCaMP6f, אשר מיועד הממברנה החיצונית ER. השניה-GCaMP6f יכולים לפקח על Ca2 + שחרור ברזולוציה הטמפורלית גבוהה יותר מאשר GCaMP6f קונבנציונלי. בשילוב עם GECIs, ממוקדות קרום פלזמה, ניתן לתאר-עתיים Ca2 + אות התבנית ברזולוציה subcellular. Subcellular במיקוד Ca2 + הסימנים המתוארים כאן, באופן עקרוני, זמין עבור כל סוגי תאים, אפילו בשביל ויוו הדמיה של נוירונים Caenorhabditis elegans . ב פרוטוקול זה, אנו להציג Ca2 + הדמיה בתאים שורות תאים, נוירונים, תאי גליה בתרבויות העיקרי הפומבית, לתאר את הכנת מלאי קפוא של החולדה הנוירונים קורטיקלית.
Introduction
Ca2 + אותות מייצגים את העלאת רמת הריכוז2 + Ca תאיים. Ca2 + הוא השליח השני אוניברסלי עבור התאים האיקריוטים. באמצעות Ca2 +, התאים לתפקד באמצעות מגוון תאיים איתות המסלולים, זירוז פלטי ביולוגיים שונים. לדוגמה, בנוירונים, שלפוחית סינפטית השחרור במסוף presynaptic, ביטוי גנים גרעין ולאחר אינדוקציה של פלסטיות סינפטית ב postsynapse מוסדרים על ידי Ca2 + אותות ברורים במדויק להפעיל המתאים אנזימים במורד הזרם באתרים נכון ועם תזמון מדויק1.
דפוסים מסוימים ייתכן של Ca2 + איתותים להפעיל את אנזימי במורד הזרם הספציפי. Ca2 + מאותת מופקים על ידי התיאום בין שני Ca2 + מקורות שונים: Ca2 + זרם מרחב חוץ-תאית, Ca2 + לשחרר רשתית תוך-פלזמית (ER), אשר משמש Ca תאיים2 + לאחסן. משמעותית ייתכן Ca2 + איתות התבנית לזירוז פונקציה תא ספציפי נתמך גם על ידי nanodomains של 10 – 100 מיקרומטר Ca2 + שנוצר באזור Ca2 + ערוצי קרום פלזמה או קרום אר2. חשוב, המקור של Ca2 + אותות הוא אחד הגורמים הקריטיים ביותר בקביעת הפלט ביולוגי במורד הזרם. בנוירונים, Ca2 + זרם ושחרור2 + Ca יש מול השפעות על קיבוץ באשכולות של גאמא אמינו בוטירית (GABA)של קולטנים (GABAAR)-הסינפסות GABAergic, אשר אחראית על עיכוב של דעתנית עצביים3. Ca2 + זרם מלווה על ידי עירור עצביים מסיבית המניע את הפיזור של אשכולות GABAAR סינפטית, ואילו Ca מתמידים2 + שחרור מחדר המיון מקדמת את קיבוץ באשכולות של ר'אגאבא סינפטית. קבוצות אחרות דיווחו גם כי הכיוון כוונון של קונוסים הצמיחה תלויה באופן ביקורתי מקור האות2 + Ca: Ca2 + זרם מעוררת סלידה, בעוד Ca2 + שחרור מנחה את המשיכה של הגידול עצביים קונוס4. לכן, כדי להבין באופן מלא את Ca2 + מסלולי שבבסיס פלטי סלולרית ספציפית איתות, חשוב לזהות את המקור של Ca2 + אותות דרך המתאר Ca2 + אותות ברזולוציה subcellular.
ב פרוטוקול זה, אנו מתארים Ca2 + הדמיה שיטה לדווח Ca2 + אותות ברזולוציה subcellular, אשר מאפשר הערכת המקורות Ca2 + אות (איור 1). Ca2 + microdomains מתחת קרום פלזמה בהצלחה המפוקחים על-ידי מקודדים גנטית Ca2 + אינדיקטורים (GECIs) המיועד קרום פלזמה באמצעות ההחזקה של האות קרום פלזמה-לוקליזציה Lck בתוך Src קינאז ל N-טרמיני GECIs5. כדי לזהות את Ca2 + אות הדפוס באזור המיון ברזולוציה יותר יכולות, לאחרונה פיתחנו השניה-GCaMP6f, באיזה GCaMP6f6 מטרות המיון הממברנה החיצונית, באמצעות טראנסממברנלי את חדר המיון. השניה-GCaMP6f יכול לדווח ברגישות Ca2 + השחרור מחדר המיון ברזולוציה ייתכן טוב יותר מאשר GCaMP6f nontargeted המקובלת ב- COS-7 תאים7 ו- HEK293 תאים8, על ידי הימנעות פעפוע של Ca2 + ו- GECIs . אנחנו גם אישר כי Ca ספונטנית2 + גובה ב בתרבית האסטרוציטים בהיפוקמפוס שדווחו על-ידי השניה-GCaMP6f הראו דפוס ייתכן שונה בהשוואה זה בפיקוח, ממוקדות קרום פלזמה GCaMP6f (מזל-GCaMP6f)7 ,9, המציין כי Ca2 + הדמיה עם השניה-GCaMP6f בשילוב עם מזל-GCaMP6f תורם הקרע של Ca2 + אותות ברזולוציה subcellular לזהות את המקורות שלהם.
תוך זמן קצר, אנו מפרטים את פרוטוקול Ca2 + אות רוברט הלה תאים, תא עצב-אסטרוציט לערבב תרבויות מצופה על coverslips זכוכית דקה. Ca2 + טכניקת דימות עם GECIs שצוין כאן, מזל-GCaMP6f, פלזמה-ממברנה-ממוקד RCaMP210 (מזל-RCaMP2), ואת השניה-GCaMP6f (איור 1) חלים על כל התאים בו ניתן לבטא את GECIs האלה.
Protocol
כל הניסויים המתוארים כאן אושרו על ידי ועדת בטיחות RIKEN ועדת ניסויים בבעלי חיים, על פי שזמן שהונפקו על ידי היפנים משרד החינוך, התרבות, הספורט, המדע והטכנולוגיה.
1. הכנת תאים
- הכנת פוליפוני (ethyleneimine)-מצופה coverslips
הערה: ציפוי Poly(ethyleneimine) (פיי) מומלצת המנגנון זכוכית, שכן היא מאפשרת נוירונים, האסטרוציטים כדי לצרף בחוזקה coverslips מבלי למנוע את התפתחותם. עם זאת, שיטות ציפוי אחרות (למשל, פולי-ornithine, פוליפוני L-ליזין, laminin ציפוי) זמינים גם, במידת הצורך, זכוכית-התחתון מנות.- מקום coverslip זכוכית של 18 מ מ קוטר כל טוב של צלחת 12-. טוב. להכין פתרון פיי 0.04% (צלחת mL/12-ובכן 12.5) באמצעות מים מעוקר.
- להוסיף 1 מ"ל של 0.04% פיי פתרון טוב לכל. ודא כי ישנם אין בועות מתחת coverslips.
- דגירה הצלחות בסדרה חממה2 CO בן לילה ב 37 º C.
- למחרת, לשטוף את coverslips מצופה 3 x עם 1 מ ל מים מעוקר. להסיר את הפתרון פיי עם העצמות להוסיף 1 מ"ל של מים סטיריליים מכל קידוח, לנער את הצלחת 12-ובכן כך הפתרון פיי בין coverslip את הלוח ניתן לשטוף ביסודיות. כמו שאר פיי הוא רעיל עבור תאים, להבטיח כי המים לאחר כביסה הסופי הוא aspirated לחלוטין.
- יבש ולחטא את coverslips בתוך המנוע עם אולטרה סגול (UV) אור למשך 15 דקות לפחות. ניתן לאחסן את המנה מצופים פיי ב 4 ° C עד 2 חודשים. להאיר את הכלים עם UV אור למשך 15 דקות לפני השימוש.
- הוסף 5 מ ל מים מזוקקים סטריליים במרחב שבין הבארות כדי למנוע אידוי של המדיום תרבות.
- שורות תאים יופיצ
הערה: פרוטוקול זה מספק דוגמה אחת של תרביות תאים לתוך תאים בתרבית של תאים שורות, כגון הלה תאים ותאים COS-7. המשתמשים יכולים להחיל פרוטוקולים אחרים תרביות תאים שעברו אופטימיזציה עבור הניסויים שלהם. בסעיף זה, נתאר פרוטוקול התרבות התא הלה, אשר גם הוא החלים COS-7 תאים.- ביום שלפני תרביות תאים, התרבות התאים לצלחת תרבות 10 ס מ עד ובהישגיות הנהרות 70% – 90%.
- Prewarm המדיום תרבות (ראה טבלה של חומרים) ל- 37 מעלות צלזיוס.
- לשטוף את התאים 2 x עם באגירה פוספט תמיסת מלח ללא Ca2 + ו- Mg2 + (PBS [-]).
- מחוק לגמרי את PBS(-), להוסיף 1 מ"ל של 0.5% טריפסין-ethylenediaminetetraacetic חומצה (EDTA) פתרון, דגירה התאים ב 37 מעלות צלזיוס במשך 90 s עד ובהישגיות עגול.
- להוסיף 9 מיליליטר בינוני תרבות prewarmed להפסיק את trypsinization. לדלל את התאים תרבות בינונית ביחס של 1:6.
- זרע 1 מ"ל של התאים מדולל על coverslips מצופים פיי לוחית 12-. טוב.
- הכנת בהיפוקמפוס נוירון-אסטרוציט מעורב תרבות חולדות או עכברים
הערה: סעיפים 1.3 ו 1.4 קודם דורשים בדיקה שאושר על ידי טיפול בעלי חיים מוסדיים הוועדה להשתמש ו לציית באופן רשמי שאושר נהלי טיפול ושימוש חיות מעבדה. תרשים הזרימה של פרוטוקול תרבות עצביים מוצג באיור2.- להכין את כל ריאגנטים מתחת למכסה המנוע זרימה שכבתית. הנשר של המקום Dulbecco ששונה בינוני (DMEM) לתוך שני 100 מ מ תרבות מנות (כ 20 מ ל/תבשיל) כי הם במקרר.
- הכנת 50 מ של המדיום ניתוח מורכב DMEM וחומצה-(2-hydroxyethyl)-1-piperazineethanesulfonic 20 מ מ 4 (HEPES) (ראה טבלה של חומרים) ונותנות המדיום 60 מ מ 3 תרבות מנות (כ 7 מ ל/תבשיל), שמונה 35 מ מ תרבות מנות (כ 2 מ ל/תבשיל). מקם את הכלים הקפאה נוספת.
- הכנת 50 מ ל תמיסת המלח דגירה, המורכבת של תמיסת מלח מאוזנת של הנקס, בתוספת 20 מ מ HEPES (ראה טבלה של חומרים), ומניחים 8 מ ל תמיסת המלח פנימה צינור חרוטי 15 מ"ל על קרח.
- להכין את המדיום ציפוי בינונית מזערי חיוני (מאמ) בתוספת B-27, גלוטמין ו פניצילין-סטרפטומיצין (ראה טבלה של חומרים). לשמור על בינוני בטמפרטורת החדר (20-28 מעלות צלזיוס).
- לעקר את מכשירי הניתוח עם 70% אתנול.
- מניחים מגבת נייר בתוך צנצנת זכוכית עם מכסה, 1 מ"ל של איזופלוריין. תן את איזופלוריין להתאדות במשך 1 דקה.
- במקום עכבר או חולדה בהריון בצנצנת המוכנים לפי שלב 1.3.6 ולשמור את בעל החיים בצנצנת עד זה עמוק. הוא מורדם (כ-30 s כדי 1 דקות).
- הביאו את החיה anesthetized מצנצנת ולחטא את החיה ואת הציוד לנתיחה על ידי התזת אותם 70% אתנול. לחתוך האמצע הגחון עם פינצטה ומספריים סטנדרטיים ויבתר ולחלץ את הרחם בהריון חולדה או עכבר.
- לחלץ E18-19 העוברים מן הרחם של מרדימים עכברוש נקבה או העכבר, באמצעות מספריים ויבתר עדין, והניחו העוברים שחולצו עם מלקחיים טבעת אל תוך קר כקרח DMEM בקערה 10 ס מ עבור הרדמה קר.
- לערוף את העובר עם מספריים לנתיחה בסדר ולמקם את הראש DMEM קר כקרח בקערה 10 ס מ.
- לחלץ את המוח כל העובר עם מלקחיים Semken 13 ס מ מעוקל, מלקחיים עם טיפים בסדר. שמור את המוח המדיום לנתיחה כקרח בקערה 60 מ מ.
- להסיר את hippocampi, באמצעות מלקחיים שני טיפים בסדר, במדיום לנתיחה כקרח במנות 35 מ מ ולשמור על הרקמה מבודד בתמיסת המלח הדגירה למקם צינור חרוטי 15 מ"ל על קרח.
- לשטוף את hippocampi בתמיסת דגירה, דגירה טריפסין (1.25 מ"ג/מ"ל), DNase אני (0.25 mg/mL) בתמיסת המלח הדגירה למשך 5 דקות ב 37 º C. אמצעי האחסון הדגירה המומלץ הוא 2.7 מ"ל של תמיסת המלח דגירה, 150 µL של 20 x מניות טריפסין µL 150 x 20 מניות DNase (ראה טבלה של חומרים).
- לשטוף את hippocampi 3 x בתמיסת הדגירה קר כקרח.
- ריקון נוזלים מלוחים הדגירה ולהוסיף 1 מ"ל של המדיום ציפוי המכיל DNase אני (10 µL של פתרון מניות; ראה טבלה של חומרים). להשעות את הרקמה על ידי יותר מ 20 x pipetting ולמדוד את צפיפות התאים קיימא, באמצעות מונה תא Trypan blue וזמינותו.
- לדלל התאים בהיפוקמפוס צפיפות של 1.4 x 105 קיימא תאים למ"ל על חולדות ו 2.5 x 105 קיימא תאים למ"ל על עכברים. זרע 1 מ"ל של המתלים תא מדולל על גבי coverslips מצופים פיי ב 12-ובכן תרבות צלחות.
- לשמור על התאים ב- 37 מעלות צלזיוס ב חממה CO2 2-3 ימים.
- הסר את המדיום ציפוי. אל תתנו את התאים להתייבש. בעדינות ובמהירות להוסיף המדיום תחזוקה prewarmed (ראה טבלה של חומרים).
- הכנה של עכברוש קורטיקלית נוירון-אסטרוציט מעורב תרבות תאים קפואים, ואת התחייה המחודשת של התרבויות קפוא
הערה: שיטת הקפאה קריוגנית תאים קורטיקליים היה previously11 המתואר. כאן, מסופק ששונה פרוטוקול שבו תאים קורטיקליים שניתן לאחסן ב-80 מעלות צלזיוס במשך לפחות 3 חודשים. תרשים הזרימה עבור פרוטוקול זה מוצג באיור2.- להכין DMEM, דיסקציה בינוני, דגירה תמיסת מלח ו ציפוי בינוני כפי שמעידה צעדים 1.3.1–1.3.4, ואת הטבלה של חומרים.
- להכין המדיום שטיפת היוו של DMEM חום-להשבית את העובר סרום שור, פניצילין-סטרפטומיצין (ראה טבלה של חומרים), במידת הצורך.
- תמצית E18-19 העוברים מן הרחם של מרדימים עכברוש נקבה או העכבר, באמצעות מספריים דיסקציה עדינה, ולהשתמש טבעת מלקחיים כדי למקם את כל העובר שחולצו DMEM קר כקרח עבור הרדמה קר.
- הסר את השכל של העוברים ולשמור אותם לנתיחה כקרח בינוני. להסיר את cortexes ולתחזק אותם בתמיסת המלח הדגירה למקם צינור חרוטי 15 מ"ל על קרח.
- לשטוף את cortexes בתמיסת דגירה, דגירה של cortexes עם טריפסין (1.25 מ"ג/מ"ל), DNase אני (0.25 mg/mL) בתוך תמיסת מלח הדגירה למשך 5 דקות ב 37 º C. 5.4 מ של תמיסת מלח דגירה, µL 300 של 20 x מניות טריפסין µL 300 x 20 מניות DNase שאמצעי האחסון הדגירה המומלצת עבור 12 cortexes אני.
- לשטוף את cortexes 3 x בתמיסת הדגירה קר כקרח.
- הסר את תגובת שיקוע והוסף 2 מ של ציפוי בינוני בתוספת 150 µL של DNase אני מניות. לבטל את התאים על ידי pipetting משיחות פחות מ-20, לסנן את התאים באמצעות מסננת תא עם גודל הנקבוביות של 70 מיקרומטר.
- לשטוף את מסננת תא עם 20 מ של המדיום ציפוי עבור ציפוי. עבור הכנת מלאי תא קפוא, לשטוף את התאים עם 20 מ של המדיום לשטוף (ראה טבלה של חומרים)
- מודדים את צפיפות התאים קיימא, באמצעות מונה התא ואת שיטת Trypan blue.
- לדלל את התאים בקליפת המוח כדי צפיפות של 1.4 x 105 קיימא תאים למ"ל עם המדיום ציפוי ולהוסיף 1 מ"ל של התליה תא מדולל מצופים פיי coverslips לוחית תרבות 12-. טוב.
- לשמור על התאים ב- 37 מעלות צלזיוס חממה2 CO 2-3 ימים ושנה המדיום תרבות המדיום תחזוקה.
- לאחר שלב 1.4.9, הכן את המניה סלולרי קורטיקלית קפוא על ידי צריך שתוציאו את התאים ב 187 x g למשך 3 דקות, באמצעות רוטור הנדנדה.
- וארוקן את תגובת שיקוע והוסף המדיום הקפאה קריוגנית (ראה טבלה של חומרים) שמרו ב 4 ° C, כדי להשיג צפיפות התאים של עונה 1 פרק 107 תאים/מ ל.... Aliquot 1 מ"ל של התליה תא לתוך צינורות ההקפאה.
- מקם את הצינורות בתא הקפאה מיכל עם קצב הקפאה של-1 ° C/דקה, עד לטמפרטורה של-80 ° C ולאחר להעביר את מיכל ההקפאה מקפיא-80 ° C. התאים ניתן לאחסן במשך 3 חודשים לפחות ב- 80 ° c
- להחיות תאים הקפוא, prewarm את שטיפת בינוני (כ 13 מ"ל לכל שפופרת קריוגני) ואת תחזוקה בינונית עבור תאים קורטיקליים קפואים (ראה טבלה של חומרים).
- להפשיר את התאים קפואות במהירות ב 37 מעלות צלזיוס בתוך אמבט מים.
- לדלל את התאים המופשרים בעדינות עם שטיפת prewarmed בינונית. Centrifuge התאים ב x 187 g למשך 3 דקות, באמצעות רוטור הנדנדה.
- להשעות את צניפה ב 1 מ"ל של שטיפת בינוני ולמדוד את צפיפות התאים קיימא.
- לדלל את התאים עם המדיום תחזוקה עבור תאים קורטיקליים קפוא להניב צפיפות התאים של 3.0 x 105 קיימא תאים למ"ל זרע 1 מ"ל של התליה תא לוחית 12-ובכן מצופים פיי.
2. הבעת ממוקדות קרום GECIs
-
תרביות תאים תאים
- להוסיף 250 ננוגרם של פלסמיד GECI (קרי, מזל-GCaMP6f, Lck-RCaMP2 או השניה-GCaMP6f עם CMV יזם)7,8,9 כדי µL 100 של מדיום מופחת סרום (ראה טבלה של חומרים) לכל טוב. עבור cotransfection של Lck-RCaMP2, השניה-GCaMP6f, שימוש 250 ננוגרם של כל פלסמיד ב 100 µL של מדיום מופחת סרום כל היטב.
- להוסיף 0.5 µL של תרביות תאים ריאגנט (ראה טבלה של חומרים) לכל היטב לתערובת בינוני סרום פלסמיד-מופחתת. Cotransfection של Lck-RCaMP2, השניה-GCaMP6f, הוסיפו 0.5 µL של תרביות תאים מגיב לכל טוב.
- דגירה את התערובת למשך 30 דקות בטמפרטורת החדר (20-28 מעלות צלזיוס).
- להוסיף 100 µL של התערובת כל coverslip באופן drop-wise.
- דגירה את התאים עבור 48-72 ש ח בחודש חממה2 CO ב 37 ° C כדי לאפשר הביטוי של GECIs.
-
תרביות תאים, זיהום בנגיף adeno-הקשורים של נוירונים בהיפוקמפוס או בקליפת המוח
הערה: תרביות תאים במבחנה 3-5 ימים (DIV) תוצאות תעריף תרביות תאים גבוה של נוירונים. תרביות תאים-6-8 DIV היא עדיפה לביטוי האופטימלי של GECIs ב האסטרוציטים. הביטוי של GECIs בנוירונים תרבות חלופה מועדפת לאחר 9 DIV, הזיהום של הווקטורים adeno-הקשורים וירוס (AAV) מספק יעילות טובה יותר של ביטוי. וקטורים AAV עבור הביטוי של Lck-GCaMP6f, Lck-RCaMP2 השניה-GCaMP6f תחת EF1a היזמים הוכנו כפי שתואר לעיל, באמצעות HEK293 תאים12 (ראה טבלה של חומרים).- עבור תרביות תאים 3 – 8 ימים לאחר ציפוי, תווית שני צינורות, אחד עבור הדנ א פלסמיד והשני עבור ריאגנט תרביות תאים.
- להוסיף 50 µL של מדיום מופחת סרום (ראה טבלה של חומרים) לכל טוב כל שפופרת.
- להוסיף 0.5 µg של פלסמיד DNA לכל coverslip µL 1 של מוסף בליווי ריאגנט תקנים עבור נוירונים (ראה טבלה של חומרים) לכל טוב הצינור דנ א פלסמיד. עבור cotransfection של Lck-RCaMP2, השניה-GCaMP6f, 0.5 µg של כל פלסמיד, µL 1 של תוספת מעורבבים ב- 50 µL של מדיום מופחת סרום לכל טוב.
- להוסיף 1 µL של תרביות תאים ריאגנט (ראה טבלה של חומרים) לכל טוב בצינור ריאגנט תרביות תאים. כמות זהה של תרביות תאים ריאגנט משמש cotransfection.
- מערבולת שני צינורות עבור s 1 – 2.
- להוסיף את התערובת ריאגנט של תרביות תאים (מתוך שלב 2.2.4) לתערובת דנ א (מתוך שלב 2.2.3). לערבב על-ידי pipetting בעדינות, דגירה התערובת (100 µL לכל coverslip) למשך 5 דקות בטמפרטורת החדר.
- לטעון את התערובת על התאים באופן drop-wise.
- דגירה התאים חממה2 CO 2-3 ימים עד החלבונים סמן באים לידי ביטוי.
- זיהום AAV, להוסיף 3 µL של AAV לכל טוב התרבות נוירון מעורבת-אסטרוציט. מערבבים בעדינות במוזיקת המנה. בשביל הזיהום כפול של Lck-RCaMP2, השניה-GCaMP6f, 3 µL של כל AAV הוא הציג לכל טוב. במקרה המספרים של תאים לבטא GECIs אינן מספיקות, הסכום AAV אופטימלית עבור זיהום צריכים להיקבע.
- לשמור על התרבות במשך 1-2 שבועות עד GECIs באים לידי ביטוי.
3. Ca2 + הדמיה
-
הדמיה סימולטני של תאים המבטאים מזל-RCaMP2, השניה-GCaMP6f
הערה: כדי במקביל להקליט הסימנים Lck-RCaMP2 ו- GCaMP6f השניה, אופטיקה פיצול התמונה נדרשים. האופטיקה מאפשרות ההפרדה של RCaMP2 ו- GCaMP6f והקרנה שלהם על גבי המסגרת הצילום של המצלמה (איור 3 א). הדמיה בו זמנית גם דורש מקורות אור (1) בו זמנית יכול לפלוט אור בכחול (450 – 490 nm) עירור ספקטרה ירוק (500-560 ננומטר), (2) כפול-band מסנן ומראה ודיקרואיק זוהר מגדיר את המיקרוסקופ ו (3) פליטת מסננים עבור RCaMP2 ו GCaMP6f. לקבלת פרטים, עיין בטבלה של חומרים.- הפעל את התקני הדמיה ואת מחשבים לפחות 30 דקות לפני ההקלטה. Prewarm המיקרוסקופ חימום לבית 37 מעלות צלזיוס. להגדיר את התקן פיצול התמונה, מסננים, מקור האור. יישר את אופטיקה מפצלת את התמונה כך באותו שדה הראייה מופיע במצלמה. לבחור את העדשה המתאימה אובייקטיבי (ראה טבלה של חומרים).
- הר coverslip המכילות את התאים transfected עם מזל-RCaMP2, השניה-GCaMP6f בבית הבליעה הקלטה, להוסיף את המדיום הדמיה המתאימה או מאגר (400 µL על coverslips 18 מ מ) בבית הבליעה, ולמקם אותו על הבמה מיקרוסקופ. במקום מכסה על תא הקלטות כדי למנוע האידוי של המדיום.
- אתר את התאים לבטא Lck-RCaMP2 וגם השניה-GCaMP6f על-ידי הדמיה פלורסנט. מזער את עוצמת האור עירור למניעת photobleaching ו phototoxicity.
- הסר את המכסה ולהתחיל הקלטה זמן לשגות ב-10 הרץ. במהלך ההקלטה הזאת, מוסיפים אגוניסט תא לעורר תגובות2 + Ca (למשל, היסטמין עבור הלה תאים, ATP עבור COS-7 תאים).
- לשמור את הנתונים בצילום מואץ של הכונן הקשיח (HDD).
- לנתח את הנתונים באמצעות תוכנות ניתוח התמונה.
-
הקלטת פעילות ספונטנית של האסטרוציטים לבטא Lck-RCaMP2, השניה-GCaMP6f
הערה: ללא פיצול התמונה אופטיקה, ניתן לנטר את האותות2 + Ca ב קרום פלזמה ואת אלו, הסובבים בחדר המיון באותו התא. . כאן, ההקלטה רציפים של Lck-RCaMP2, השניה-GCaMP6f ב האסטרוציטים זהה המתואר. אובייקטיבית שמן-טבילה עם צוהר מספרית גדולה יותר 1.3 מומלץ מאוד לפעילות2 + Ca ספונטנית.- הפעל את המיקרוסקופ, מצלמה, מקור האור, החימום מיקרוסקופ קאמרית לפחות 30 דקות לפני הקלטה.
- הר coverslip המכילות את התאים transfected עם מזל-RCaMP2, השניה-GCaMP6f בבית הבליעה הקלטה ולהוסיף 400 µL של המדיום הדמיה. המקום מכסה על החדר.
- לבחור את המסנן עבור GCaMP6f, מקור האור (עירור אור, למשל 470– 490 כחול ננומטר; ראה טבלה של חומרים). אתר את האסטרוציטים לבטא השניה-GCaMP6f.
- בחר ערכת מסנן מקור האור על RCaMP2 (עירור אור, למשל, 510 – 560 nm ירוק; ראה טבלה של חומרים), לאשר אם Lck-RCaMP2 מתבטאת האסטרוציטים אותו. למנוע חשיפה ארוכה מקור האור כדי למנוע photobleaching.
- הרשומה תמונות בצילום מואץ של Lck-RCaMP2-2 הרץ עבור 2 דק לשמור את הנתונים הדמיה על HDD.
- שנה את המסנן להגדיר את זה עבור GCaMP6f. הרשומה תמונות בצילום מואץ של השניה-GCaMP6f באותו שדה הראייה, ב 2 הרץ למשך 2 דק לשמור את הנתונים על HDD.
- ניתוח נתונים באמצעות התוכנה ניתוח התמונה.
-
הקלטה ספונטנית פעילות. עצבית ו- Ca המושרה2 + העלאת בנוירונים
הערה: הגדרת מיקרוסקופ עבור הדמיה עצביים הוא זהה לזה המתואר בסעיף 3.2. . הנה, מתואר ההדמיה של Ca2 + העלאת ספונטני עקב Lck-GCaMP6f ו- Ca2 + העלאת המושרה על ידי הפעלת mGluR עקב השניה-GCaMP6f.- כדי להקליט ספונטנית פעילות. עצבית, הר coverslip המכילות את התאים לבטא Lck-GCaMP6f בבית הבליעה הקלטה ולהוסיף µL 400 הדימות בינוני. המקום מכסה על החדר.
- הגדר את המסנן ואת מקור האור (עירור כחול, למשל 470 – 790 ננומטר; ראה טבלה של חומרים) לאלה עבור GCaMP6f. למצוא את הנוירונים לבטא Lck-GCaMP6f, מציג פעילות ספונטנית.
- לרכוש תמונות ב- 2 הרץ or מהר יותר. לשמור את הנתונים על HDD.
- ניתוח נתונים באמצעות התוכנה ניתוח התמונה.
- כדי להקליט Ca המושרה2 + הגברה, הר על coverslips המכילות את התאים לבטא השניה-GCaMP6f עם 400 µL הדמיה בינוני. המקום מכסה על החדר.
- באמצעות המסנן עבור GCaMP6f, למצוא את הנוירונים לבטא השניה-GCaMP6f.
- הסר את המכסה. . תתחיל להקליט זמן לשגות ב 2 הרץ or מהר יותר במהלך ההקלטה, להוסיף את אגוניסטים עבור קולטן Gq-חלבון בשילוב (למשל, mGluR5 אגוניסט [ר'] - 3.5 - dihydroxyphenylglycine [DHPG]) כדי לעורר Ca2 + שחרור מחדר המיון.
- לשמור את תמונות בצילום מואץ על HDD ולנתח את הנתונים.
תוצאות
מזל-RCaMP2, השניה-GCaMP6f באו לידי ביטוי בתאים הלה, שני אותות נרשמו בו זמנית באמצעות פיצול התמונה אופטיקה, 24 שעות לאחר תרביות תאים (איור 3 א ו- Video 1). התמונות נרכשו ב- 10 Hz. היסטמין (שלו, 1 מיקרומטר), אשר גורם Ca2 + השחרור מחדר המיון, נוספה במהלך ההקלטה. על היישום שלו, עוצמת האות של Lck-RCaMP2, השניה-GCaMP6f גדל, כפי שמוצג על ידי הצגת מדומה ΔF/F0, אשר מייצג את השינוי של עוצמת קרינה פלואורסצנטית הראשונית (איור 3B). הקורסים זמן של Ca2 + העלאת רמת הרשאות (ΔF/F0) דיווחו על ידי מזל-RCaMP2 השניה-GCaMP6f הושוו באזור באותו עניין (ROI) (איור 3C). הערכים ΔF/F0 היו מנורמל לערכי שיא כדי לאפשר זמן הקורס ההשוואה בין שני GECIs שונים, אשר יש רמות ביטוי שונה, הפצות. שני חיישנים דיווח תנודה דמוי Ca2 + גובה. מזל-RCaMP2, השניה-GCaMP6f הראו באותו מסלול הזמן להעלאה2 + Ca בשני תאים בין תא חמש בחן (איור 3C, רועי 1 ו- 3). עם זאת, Ca2 + הגבהים שמוצג על ידי מזל-RCaMP2 נשאר ברמה גבוהה יותר לעומת המוצג על-ידי השניה-GCaMP6f (איור 3 C, רועי 2, 4 ו- 5). התוצאות מצביעות על כך Ca2 + גובה מוארך בקרבת קרום פלזמה, בעוד שהסתיים קודם לכן סביב חדר המיון, אשר הוא המקור של Ca2 + האות הזה המושרה על ידי גירוי שלו.
Ca ספונטנית2 + האותות האסטרוציטים בתוך הנוירון-אסטרוציט מעורב תרבות של עכברוש hippocampi (איור 4A) ו cortexes (איור 4B) הוצגו על ידי מזל-RCaMP2 השניה-GCaMP6f (איור 4, סרטון 2, וידאו 3 , וידאו 4, וידאו 5). תרבויות קורטיקלית היו לתחייה מן המלאי קפואים זה הוכן כפי שמתואר פרוטוקול זה. אותות Lck-RCaMP2 ו- GCaMP6f השניה נרשמו ברצף ב 2 הרץ את התאים אותו. ROIs שלושה היו שנבחרו באזור הראה Ca2 + העלאת על ידי כל GECI, מהלך הזמן של ΔF/Fהבסיס (קרי, עוצמת קרינה פלואורסצנטית) משתנה מעוצמת קרינה פלואורסצנטית הממוצע בתקופת הקלטת כולה (נבסיס ). כאשר הבסיס הוא יציב Ca2 + הגבהים שכיחים פחות, Fהבסיס הופכת תוכנית בסיסית שימושית לזיהוי Ca2 + העלאת אירועים. Ca ספונטנית2 + הגבהים היו גלויים רק את תהליך astrocytic, לא כלפי גוף התא. התוצאה זו עקבית עם הדוחות הקודמים astrocytic ספונטנית Ca2 + אותות על ידי אחרים GECIs במבחנה מטמיעים13 , ויוו14. האסטרוציטים בהיפוקמפוס והן קורטיקלית, Ca2 + הגבהים שמוצג על ידי מזל-RCaMP2 (למעלה) היו תכופים יותר מאלו המוצגות על-ידי השניה-GCaMP6f. תוצאה זו עולה בקנה אחד עם ההדגמה. הקודם שלנו כי Ca2 + הגבהים ב האסטרוציטים עקב Lck-GCaMP6f אותרו בתדירות גבוהה יותר מאשר אלה בשל השניה-GCaMP6f7 , מציע כי מושג זה הוא גם ישים- רמת תא בודד.
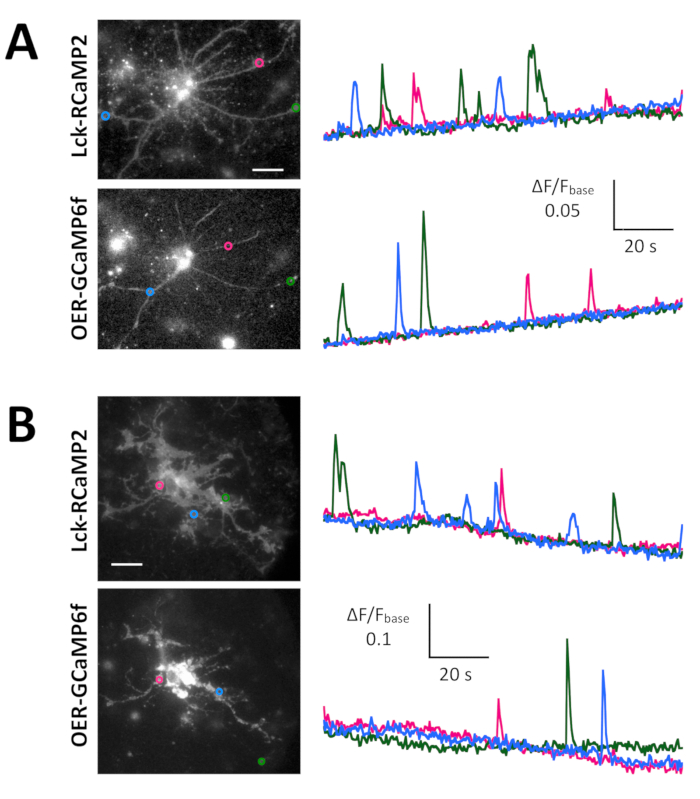
ספונטני Ca2 + הגבהים ידי Lck-GCaMP6f בלא בוגר החולדה הנוירונים בהיפוקמפוס (10 DIV) נראו ב 2 הרץ (איור 5 א ווידאו 6). הקורסים זמן של ΔF/F0 ב חמש ROIs שונים מראים כי Ca2 + הגבהים אלה נכלאים באופן מקומי לתחומים subcellular. איור 5B (וידאו 7) מראה Ca2 + התגובות עכבר בוגר נוירונים בהיפוקמפוס (30 DIV) נגוע השניה-GCaMP6f-ביטוי AAV וקטורים. נוירונים היו מגורה עם 100 מיקרומטר DHPG, אשר הוא אגוניסט עבור metabotropic רצפטורים גלוטמט, גרימת Ca2 + שחרור. DHPG-induced Ca2 + לשחררו בשל השניה-GCaMP6f זוהה.
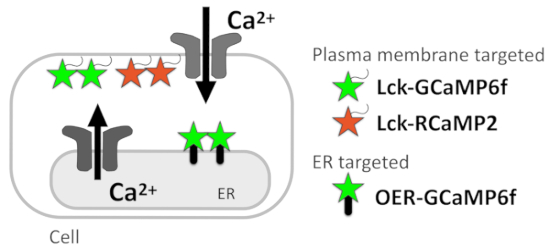
איור 1: דיאגרמה המציגה ממוקדות ממברנה GECIs. תרשים סכמטי של קרום פלזמה, ממוקדות GECIs (מזל-GCaMP6f ו- Lck-RCaMP2), חדר המיון החיצוני ממברנה במיקוד GCaMP6f (השניה-GCaMP6f).
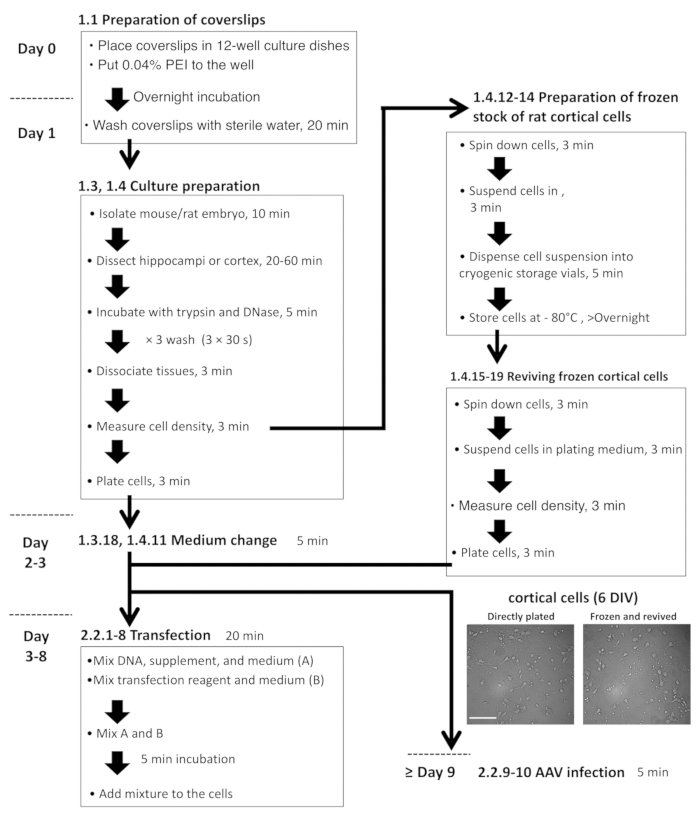
איור 2: תרשים זרימה עבור תאים בהיפוקמפוס ואת קורטיקלית הכנה, תרביות תאים פלסמיד AAV זיהום. הדימויים מיקרוסקופיים נציג, טרי מצופה DIV-6 קורטיקלית תאים (משמאל), קם לתחייה תאים מן המלאי קפואים (מימין). סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
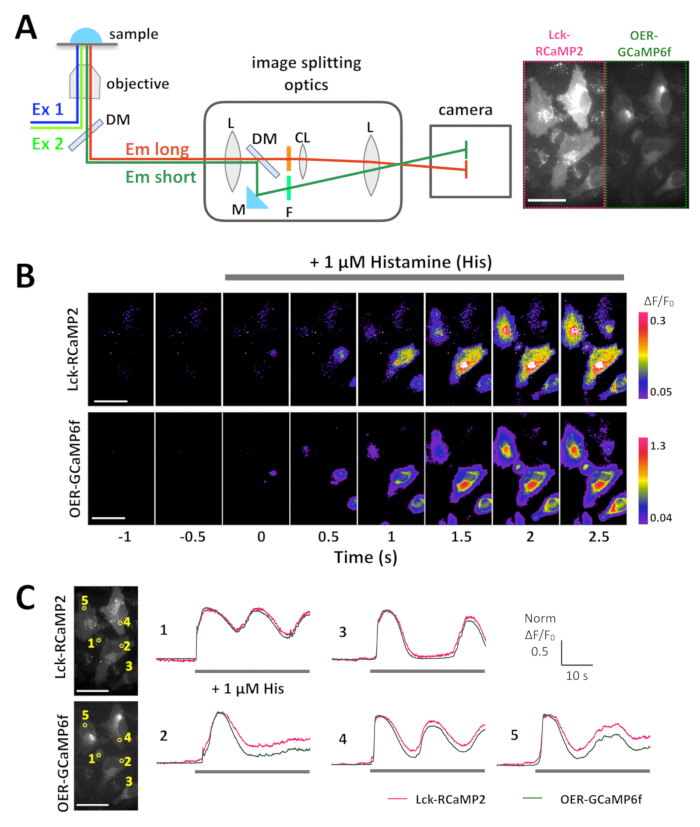
איור 3: דוגמה של ההדמיה סימולטני של Lck-RCaMP2, השניה-GCaMP6f בתאים הלה. (א) ייצוג סכמטי של האות ההפרדה עם פיצול התמונה אופטיקה. שדה הראייה באותו מזל-RCaMP2, השניה-GCaMP6f במקביל מוקרן על המצלמה. הקלטה נציג שרכשה ב-10 הרץ מצלמת CMOS מסופק 1 וידאו, תמונה אחת מתוך הקלטה זו מוצג בחלונית A (מימין). (B) תמונות צבע מדומה של ΔF/F0 Lck-GCaMP2 (למעלה), השניה-GCaMP6f (למטה). היסטמין (שלו, 1 מיקרומטר) נוספה ב 0-ס' (C) נציג מסלול הזמן ΔF/F0 המנורמל של Lck-GCaMP2 (מגנטה), השניה-GCaMP6f (ירוק). הנתונים היו מנורמל לערך ΔF/F0 המרבי עבור כל מגרש. שהפסים לציין את התזמון של היישום שלו. הנתונים נותחו עם תוכנה בהזמנה אישית TI עבודה, שעליו מונחים15. סרגל קנה מידה = 50 מיקרומטר (תמונה מיקרוסקופית). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
איור 4: ספונטני Ca2 + העלאת ברמת האסטרוציטים פיקוח לביטוי Lck-RCaMP2, השניה-GCaMP6f. (א) נציג בהיפוקמפוס, האסטרוציטים בקליפת המוח (B) transfected עם מזל-RCaMP2 (למעלה), השניה-GCaMP6f (למטה). תאים קורטיקליים היו לתחייה מתרבויות מניות קפוא. Lck-RCaMP2 ותמונות השניה-GCaMP6f נרכשו ברצף באותו תא, ב 2 הרץ, עם מצלמה EM-CCD. החלקות בתכנית השמאלי הקורסים זמן של ΔF/Fbase נמדד ROIs מצוינת בתמונה מיקרוסקופית. הנתונים נותחו עם TI עבודה, שעליו מונחים. סרטים בפועל הינם מסופקים בכל סרטון 2, 3 וידאו, וידאו 4ו- 5 וידאו. סרגל קנה מידה = 20 מיקרומטר (תמונה מיקרוסקופית). הסחף בסיסית מציע את השינויים ב- Ca2 + ברמה הגלובלית בתא. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
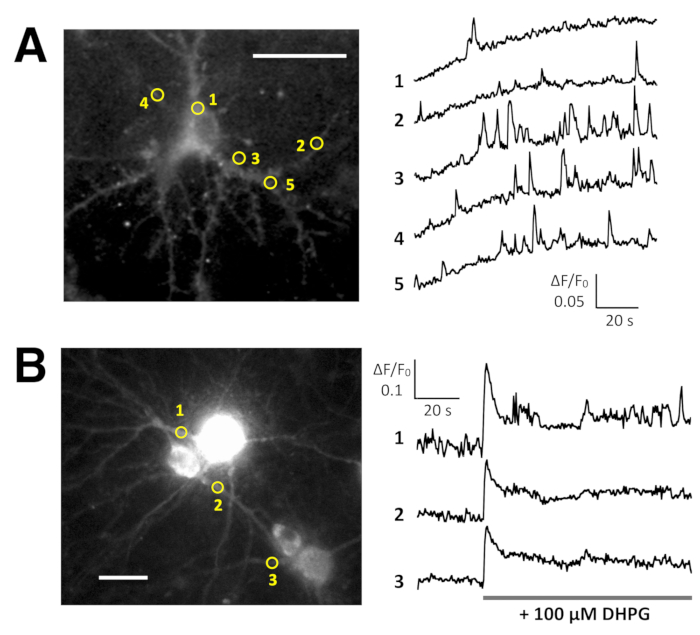
איור 5: דוגמאות של Ca2 + הדמיה בנוירונים עם מזל-GCaMP6f, השניה-GCaMP6f. (א) נציג עכברוש נוירונים בהיפוקמפוס לבטא Lck-GCaMP6f ב- 10 DIV (משמאל) וחלקות מציג הפעם קורסים של ΔF/F0 נמדד על ROIs (מעגלים צהובים) כבר ציינו כי בתמונה (מימין). המספרים מסלול הזמן תואמים למספרים רועי בתמונה. שימו לב כי התבנית הטמפורלי של Ca2 + העלאת שונה בין האזורים השונים של ריבית. הסחף בסיסית מרמזת על עליית Ca2 + ברמה הגלובלית בנוירונים הזה. (B) דוגמה של עכבר בוגר נוירונים בהיפוקמפוס (DIV 30) נגוע השניה-GCaMP6f ביטוי AAV וקטורים (משמאל). הזמן קורס עלילת של ΔF/F0 נמדד מציגה את Ca2 + בתגובה 100 מיקרומטר (RS) - 3.5 - dihydroxyphenylglycine (DHPG) להחיל על התזמון המוצגות על-ידי השורה האפורה. עיגולים צהובים מראים את המיקום של ROIs איפה מסלול הזמן הושג. התמונות היו רכשה 2 הרץ עם מצלמה מקורר-CCD (לוח א') או מצלמת EM-CCD (לוח ב') וניתח עם TI עבודה, שעליו מונחים. סרגל קנה מידה = 20 מיקרומטר (תמונה מיקרוסקופית). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
וידאו 1: דוגמה של הדמיה סימולטני של Lck-RCaMP2, השניה-GCaMP6f בתאים הלה. הקלטה נציג רכשה ב-10 הרץ, המוצג באיור3. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.

וידאו 2: ספונטני Ca2 + ארעי שנצפתה ב- Lck-RCaMP2 אסטרוציט hippocampal. נציג הקלטה רכשה 2 הרץ (איור 4A), נרשמו באותו שדה הראייה כמו וידאו 3. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 3: ספונטני Ca2 + ארעי שנמדדו השניה-GCaMP6f ב אסטרוציט hippocampal. הקלטה נציג רכשה 2 הרץ (איור 4A), בתוך שדה הראייה אותו כ- 2 הסרטונים. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 4: Ca ספונטנית2 + ארעי שנצפתה ב- Lck-RCaMP2 אסטרוציט בקליפת המוח נציג הקלטה רכשה 2 הרץ (איור 4B), נרשמו באותו שדה הראייה כמו וידאו 5. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 5: ספונטני Ca2 + ארעי שנמדדו השניה-GCaMP6f ב אסטרוציט קורטיקלית. הקלטה נציג רכשה 2 הרץ (איור 4B), בתוך שדה הראייה אותו כ- 4 וידאו. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 6: דוגמה Ca2 + הדמיה של נוירון בהיפוקמפוס עכברוש (DIV 10) מאת מזל-GCaMP6f. דוגמה של Ca עצביים2 + מאותת להקליט 2 הרץ (איור 5A). סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 7: Ca2 + שחרור העכבר בהיפוקמפוס נוירון (DIV 30) המבטאת השניה-GCaMP6f. דוגמה של Ca2 + אותות עצביים טלקוה העכבר נוירון בהיפוקמפוס נגוע השניה-GCaMP6f ביטוי AAV וקטורים (איור 5B). הנוירון זורז עם 100 dihydroxyphenylglycine מיקרומטר (DHPG) חלה בגיל 30 s כדי לעורר Ca2 + השחרור מחדר המיון. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
Discussion
מגוון ביולוגי פלטי מבוצעים על ידי Ca2 + אותות. Ca2 + הוא שליח איתות תאיים רב-תכליתי. פענוח Ca2 + אותות כדי לעורר את תפוקות ספציפיים כבר שאלה ביולוגית בסיסית, Ca2 + הדימות לתאר את המגוון של Ca2 + אותות נדרשים. פרוטוקול מפורט כיום מאפשרת הגילוי של Ca2 + אותות ברורים קרום פלזמה ואר (איור 3 ו- 4 באיור), רשות מקומית2 + microdomains בתוך תא (איור 4 , איור 5). זה תורם המתארת את המגוון של Ca2 + אותות תאיים. הפתרון הזמני של Ca2 + מאותת היה שיפור גם על ידי מיקוד GECIs קרום פלזמה, ER, כי זה יכול למנוע את השפעת דיפוזיה תלת מימדי של Ca2 + , GECIs את עצמם, ויש לו את היכולת לזהות רגע של Ca2 + זרם או Ca2 + שחרור, אשר מתרחשת על הקרום.
הפרוטוקול יש מספר מגבלות. למשתמשים יש לזכור כי האותות שזוהו הן הסיכום של "רגע של Ca2 + זרם או שחרור" ומתפזרת "Ca2 + החוצה מן המקור2 + Ca מקורי", במיוחד עבור Ca גדולים2 + אותות. לדוגמה, למרות שלו גירוי בתאי הלה מעורר Ca2 + שחרור מחדר המיון, רשות האישורים הנובעת שלו2 + אותות מזוהים לא רק על ידי מיון, ממוקדות השניה-GCaMP6f, אלא גם על ידי פלזמה-ממברנה-ממוקד Lck-RCaMP2 (איור 3). מגבלה נוספת היא כי ייתכן קמע תבנית התנועה של Ca2 + אותות לא ייתכן ה דטרמיננטה היחידה של הפלט של Ca2 + אותות. חלוקת אפקטור במורד הזרם חלבונים (כגון Ca2 +-kinases תלויים ו phosphatases) יכול להיות גם קביעת פקטור2. לפענח לגמרי את Ca2 + אותות תאיים, ניתוח התנהגות אנזים במורד הזרם, אשר אינו מכוסה ב פרוטוקול זה, הוא הכרחי.
אחד ההיבטים הקריטיים ביותר עבור Ca מוצלחת2 + הדמיה הוא הרכישה וההתקנה תמונת הדמיה תנאים, כמו גם לגבי לימודי הדמיה לחיות אחרות. בעבר הראינו כי Ca2 + תגובות בתא הן תלויות במידה רבה על משך ועוצמת של עירור ועל תנאי רכישת התמונה, כולל חשיפה הזמן ורכישת תדירות16. עירור תאורה כוח הוא הגורם הקריטי ביותר, זה יכול לגרום רעילות אור ו- photobleaching של GECIs. צריך להיות מוטבת התנאים הקלטה של זמן החשיפה, הקלטה תדר, עוצמת האור עירור ומשך של הקלטה לפי מטרת הניסוי. מומלץ להפחית את זמן החשיפה ואת עוצמת האור עירור ככל האפשר להימנע photobleaching, phototoxicity אל התא. תדירות הקלטה ושל משך ההקלטה צריך להספיק לסקר את Ca2 + העלאת הריבית אבל יש להשאירו נמוך ככל האפשר להימנע גם photobleaching ו- phototoxicity. אנו ממליצים קביעת תדירות הקלטה ומשך קודם ומיטוב עוצמת האור וזמן החשיפה כך photobleaching של GECIs ממוזער. גורם חשוב נוסף הוא רמת הביטוי GECIs. GECIs יש Ca2 +-אגירה אפקט כפי שהם Ca2 +-מחייב חלבונים. לכן, ביטוי של GECIs יוצרת חציצה של Ca2 +, אשר הכרחי מבחינה פיזיולוגית עבור התאים. כמות GECI הביטוי צריך להיות ממוזער כדי להימנע הדמיה התאים לבטא כמויות גבוהות של GECIs.
לסיכום, ניתוח Ca2 + אותות ברזולוציה subcellular הוא אחד הצעדים החשובים ביותר עבור פענוח סי אי2 + אותות תאיים הקובעות את התופעה הביולוגית של פלט. פרוטוקול זה מספק שיטה חדשה עבור ניתוח Ca2 + אותות כדי לתאר את הגיוון בין האותות האלה. עד מהרה, בטכניקה זו הוא מוגבל עבור ניסויים במבחנה. עם זאת, מזל-GCaMP6f נמצא כבר בשימוש עבור Ca2 + הדמיה ויוו עכברים17, השניה-GCaMP6f אושרה לפקח Ca2 + אותות ויוו בנוירונים מנוע וי ב- C. elegans7. לכן, מיקוד GECIs בתוך התא subcellular יש פוטנציאל להיות מורחבת ויוו הדמיה בעתיד, ובכך ולאפשר Ca2 + לנתיחה ויוו.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכת על ידי המענקים הבאים: יפן ומדעי הטכנולוגיה סוכנות (JST) / Precursory מחקר עבור עובריים מדע, טכנולוגיה (אוטם) (JPMJPR15F8, יפן); החברה יפן לקידום המדע (JSPS) / מעניק סיוע למחקר מדעי (KAKENHI) (JP18H05414, JP17H05710, JP16K07316), טקדה קרן. המחברים תודה Haruhiko Bito (אוניברסיטת טוקיו) על מתן RCaMP2 ו ארתור J.Y. הואנג, תומאס מקיו (RIKEN CBS) למתן AAV וקטורים ולקבלת הוראות לגבי AAV הכנה. המחברים רוצה גם להודות עורכים-יומן של דמיינו הניסויים על עזרתם עם צילום וידאו ועריכה.
Materials
| Name | Company | Catalog Number | Comments |
| (RS)-3,5-Dihydroxyphenylglycine (DHPG) | Tocris | #0342 | |
| 0.5% DNase I stock solution | Sigma-Aldrich | #11284932001 | Prepare 0.5% DNase I (w/v) in Hanks' Balanced Salt Solution supplemented with 120 mM MgSO4. Prepare 160 µL aliquots and store at -30 °C. |
| 0.5% Trypsin-EDTA solution | Thermo Fisher Scientific | #25300054 | |
| 100 mM L-glutamine (×100 stock) | Thermo Fisher Scientific | #25030081 | Preparing small aliquots of 250-750 µL and store at -30 °C. |
| 100 mM Sodium pyruvate (×100 stock) | Thermo Fisher Scientific | #11360070 | Aliquots (10 mL) can be stored at -20 °C. After thawing, the solution can be maintained at 4 °C for 2 months. |
| 12-Well multiwell culture plates with low-evaporation lid | Falcon | #353043 | Low-evaporation lid is critical for culturing neuron-glia mixed culture. For cell line cells, alternative culture dishes can be used. |
| 18 mm diameter circular coverslips | Karl Hecht "Assistent" | #41001118 | Thickness 1, 18 mm diameter circular coverslips; alternative coverslips can be used. |
| 1 M HEPES | Thermo Fisher Scientific | #15630080 | pH 7.2-7.6 |
| 2.5% Trypsin stock solution (×20 stock) | Sigma-Aldrich | #T4674 | Prepare 150 µL aliquot and store at -30 °C. |
| 50% Poly(ethyleneimine) (PEI) solution | Sigma-Aldrich | #P3143 | Prepare 2% (V/V) PEI stock solution (×50) with distilled water sterilized by filtration. Store stock solution at -30 °C after preparing small aliquots of 250-750 µL. Prepare 0.04% PEI solution with distilled water on the day of coverslip coating. |
| 70% Ethanol | Kept in a spray bottle to be used for surface disinfection. | ||
| Adeno-associated virus (AAV) for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under the direction of the EF1a promoter | AAV can be prepared using AAV Helper Free System (Agilent Technologies) and HEK293 cells, or alternative methods. pAAV.EF1a.Lck-GCaMP6f, pAAV.EF1a.Lck-RCaMP2, and pAAV.EF1a.OER-GCaMP6f are available upon request. | ||
| B-27 supplement (×50 stock) | Thermo Fisher Scientific | #17504044 | This can be replaced by B-27 plus supplement (Thermo Fisher Scientific; #A3582801) or MACS NeuroBrew-21 (Miltenyi Biotec, Bergisch Gladbach, Germany; #130-093-566). |
| B57BL/6 | Japan SLC, Inc. | ||
| Camera for microscopic image recording | The following cameras were available for use: cooled-CCD camera (e.g., Hamamatsu Photonics, OECA-ER), EM-CCD camera (e.g., Hamamatsu Photonics, ImagEM; Andor, iXon) or CMOS camera (e.g., Hamamatsu Photonics ORCA-Flash4.0) | ||
| Cell freezing container | Sarstedt K.K. | #95.64.253 | Alternative cell freezing container can be used. |
| Cell strainer | Falcon | #352350 | |
| CO2 incubator | Maintain at 37 °C, 5% CO2. | ||
| Cryogenic tube | Corning | #430661 | Alternative cryogenic tubes can be used. |
| Cryopreservation medium | Zenoaq | "CELLBANKER1" | |
| Culture medium (for HeLa cells) | Dulbecco's modified Eagle's medium (DMEM) supplemented with 10% heat-inactivated fetal bovine serum, and penicillin-streptomycin solution (final concentration: Penicillin 100 U/mL and Streptomycin 100 µg/mL) | ||
| Dissection medium | One milliliter of 1 M HEPES (final concentration 20 mM) to 49 mL DMEM | ||
| DMEM | Nacalai | #08456-65 | Alternative DMEM can be used. |
| DMEM | Nacalai | #08456-65 | Low glucose |
| DNA transfection reagent | Sigma-Aldrich | #6366244001 | "X-tremegene HP DNA transfection reagent" Alternative transfection reagents can be used. |
| Glass jar with a lid | 500 mL jar (for mouse) or 1,500 mL jar (for rat) to anesthetize the animal | ||
| HBSS | Thermo Fisher Scientific | #14170161 | HBSS free of calcium and magnesium |
| Heat inactivated bovine serum | Thermo Fisher Scientific | #10100147 | |
| HeLa cells | RIKEN BioResource Center | #RCB0007 | |
| Histamine | Sigma-Aldrich | #H7125 | |
| Image analysis software | Such as Metamorph (Molecular Devices), ImageJ (NIH), and TI Workbench14 (custom made) | ||
| Image splitting optics | Hamamatsu Photonics | #A12801-01 | W-view GEMINI |
| Image splitting optics dichroic mirror | Semrock | #FF560-FDi01-25×36 | For separation of green fluorescent protein/red fluorescent protein (GFP/RFP) signal |
| Image splitting optics emission filters | Semrock | #FF01-512/25-25, #FF01-630/92-25 | For emission of GFP/RFP signal, respectively |
| Imaging medium and buffer | Use optimal medium or buffer for the experiment. When medium is used, medium without phenol red is desirable to reduce background fluorescence. Add 20 mM HEPES to maintain pH outside of CO2 incubator. | ||
| Incubation saline | Add 1 mL of 1 M HEPES (20 mM) to 49 mL HBSS | ||
| Inverted fluorescence microscope | Such as IX73 (Olympus) or Eclipse TI (Nikon Instech) | ||
| Isoflurane | Pfizer | Used for anesthesia | |
| Maintenance medium (for 4 × 12 well dishes) | 48.5 mL Neurobasal-A medium supplemented with 1 mL B-27, 500 µL of L-glutamine stock and 25 µL Penicillin-Streptomycin solution. | ||
| Maintenance medium for frozen cortical cells (for 1 × 12 well dishes) | 12.2 mL Neurobasal plus medium supplemented with 250 µL B-27, 125 µL of L-glutamine stock and 6.2 µL Penicillin-Streptomycin solution. | ||
| MEM (Minimum Essential Medium) | Thermo Fisher Scientific | #11090-081 | |
| Microscope filter set for GCaMP6f imaging | Appropriate filter for GFP (excitation, 480 ± 10 nm; emission, 530 ± 20 nm) | ||
| Microscope filter set for RCaMP2 imaging | Appropriate filter for RFP (excitation, 535 ± 50 nm; emission, 590 nm long pass) | ||
| Microscope filter sets for double imaging of RCaMP2 and GCaMP6f | Semrock | #FF01-468/553-25, #FF493/574-FDi01-25×36, #FF01-512/630-25 | Dual excitation filter, Dual dichroic mirror, and emission filter for GFP/RFP imaging. |
| Microscope heating system | A heating system to maintain cells at 37 °C during the imaging. To avoid drift caused by thermal expansion, heating systems covering the entire microscope itself (e.g., Tokai Hit, Thermobox) are recommended. | ||
| Microscope light source for excitation | Mercury lamp (100 W), xenon lamp (75 W), Light-emitting diode (LED) illumination system (e.g., CoolLED Ltd., precisExcite; Thorlabs Inc., 4-Wavelength LED Source; Lumencor, SPECTRA X light engine). In case of mercury lump and xenon lamp, use ND filter to reduce the excitation intensity. | ||
| Microscope objective lens | Plan-Apochromat oil immersion objective with numerical aperture higher than 1.3 is highly recommended for the recording of spontaneous Ca2+ activity in neurons and astrocytes. | ||
| Neurobasal plus medium | Thermo Fisher Scientific | #A3582901 | |
| Neurobasal-A Medium | Thermo Fisher Scientific | #10888022 | Neurobasal plus medium (Thermo Fisher, A3582901) can be used instead of Neurobasal-A medium. |
| PBS(-): Phosphate-buffered saline free of Ca2+ and Mg2+ | Fujifilm Wako Pure Chemical Cooperation | #164-23551 | The absence of Ca2+ and Mg2+ is critical not to inhibit the trypsin activity. An alternative to PBS(-) can be used. |
| PC and image acquisition software | Such as Metamorph (Molecular Devices); Micromanager; TI Workbench14. | ||
| Penicillin-Streptomycin solution | Thermo Fisher Scientific | #15140122 | Penicillin 10,000 U/mL and Streptomycin 10,000 µg/mL |
| Plasmid for Lck-GCaMP6f, Lck-RCaMP2, and OER-RCaMP2 expression under cytomegalovirus promoter 7-9 | Available upon request | ||
| Plating medium (for 4 × 12 well dishes) | 48 mL MEM supplemented with 1 mL B-27 supplement, 500 µL L-glutamine stock (final concentration: 2 mM), 500 µL of sodium pyruvate stock (1 mM) and 25 µL Penicillin-Streptomycin solution (penicillin 5 U/mL, streptomycin 5 µg/mL). This concentration of Penicillin-Streptomycin, which is 1/20 of the concentration recommended by the manufacturer, is critical for neuronal survival. | ||
| Recording chamber | Elveflow | Ludin Chamber | This recording chamber is for 18 mm diameter round coverslips. |
| Reduced serum media | Thermo Fisher | #11058021 | Opti-MEM |
| Stereomicroscope | Used to dissect hippocampi. Olympus SZ60 or equivalent stereomicroscopes are available. | ||
| Surgical instruments | Standard dissecting scissors to cut the abdomen of a mouse or a rat, tweezers to pinch the uterus, delicate dissecting scissors to cut the uterus and the head of embryo, ring forceps to pinch the embryos, 13 cm curved Semken forceps (Fine Science Tools #11009-13) to extract brains, 3 forceps with fine tips (Dumont Inox #5) | ||
| Transfection reagent for neuron | Thermo Fisher Scientific | #L3000008 | "Lipofectamine 3000" reagent. It is composed of the the "supplement (P3000)" that should be mixed with plasmid DNA in the step 2.2.3, and the "transfection reagent (lipofectamine 3000)" used in the step 2.2.4. |
| Trypan blue (0.4%) | Thermo Fisher Scientific | #15250061 | |
| Wash medium for frozen cortical cells | 25 mL DMEM, supplemented with 250 µL heat-inactivated fetal bovine serum + 12.5 µL Penicillin Streptomycin. | ||
| Wistar rats | Japan SLC, Inc | Pregnant rats (E18) |
References
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Bagur, R., Hajnoczky, G. Intracellular Ca(2+) Sensing: Its Role in Calcium Homeostasis and Signaling. Molecular Cell. 66 (6), 780-788 (2017).
- Bannai, H., et al. Bidirectional Control of Synaptic GABAAR Clustering by Glutamate and Calcium. Cell Reports. 13 (12), 2768-2780 (2015).
- Tojima, T., Hines, J. H., Henley, J. R., Kamiguchi, H. Second messengers and membrane trafficking direct and organize growth cone steering. Nature Reviews Neuroscience. 12 (4), 191-203 (2011).
- Shigetomi, E., Kracun, S., Sofroniew, M. V., Khakh, B. S. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes. Nature Neuroscience. 13 (6), 759-766 (2010).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Niwa, F., et al. Dissection of local Ca(2+) signals inside cytosol by ER-targeted Ca(2+) indicator. Biochemical and Biophysical Research Communications. 479 (1), 67-73 (2016).
- Vervliet, T., et al. Basal ryanodine receptor activity suppresses autophagic flux. Biochemical Pharmacology. 132, 133-142 (2017).
- Sakuragi, S., Niwa, F., Oda, Y., Mikoshiba, K., Bannai, H. Astroglial Ca2+ signaling is generated by the coordination of IP3R and store-operated Ca2+ channels. Biochemical and Biophysical Research Communications. 486 (4), 879-885 (2017).
- Inoue, M., et al. Rational design of a high-affinity, fast, red calcium indicator R-CaMP2. Nature Methods. 12 (1), 64-70 (2015).
- Quasthoff, K., et al. Freshly frozen E18 rat cortical cells can generate functional neural networks after standard cryopreservation and thawing procedures. Cytotechnology. 67 (3), 419-426 (2015).
- Boehringer, R., et al. Chronic Loss of CA2 Transmission Leads to Hippocampal Hyperexcitability. Neuron. 94 (3), 642-655 (2017).
- Arizono, M., et al. Receptor-selective diffusion barrier enhances sensitivity of astrocytic processes to metabotropic glutamate receptor stimulation. Science Signaling. 5 (218), ra27 (2012).
- Kanemaru, K., et al. In vivo visualization of subtle, transient, and local activity of astrocytes using an ultrasensitive Ca(2+) indicator. Cell Reports. 8 (1), 311-318 (2014).
- Inoue, T. TI Workbench, an integrated software package for electrophysiology and imaging. Microscopy (Oxford, UK). 67 (3), 129-143 (2018).
- Miyamoto, A., Bannai, H., Michikawa, T., Mikoshiba, K. Optimal microscopic systems for long-term imaging of intracellular calcium using a ratiometric genetically-encoded calcium indicator. Biochemical and Biophysical Research Communications. 434 (2), 252-257 (2013).
- Srinivasan, R., et al. New Transgenic Mouse Lines for Selectively Targeting Astrocytes and Studying Calcium Signals in Astrocyte Processes In Situ and In Vivo. Neuron. 92 (6), 1181-1195 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved