Method Article
חוקרים למרכזי נבטי Autoreactive בודדים על-ידי Photoactivation במודל של Chimeric מעורבת של מחלת חיסון עצמי
In This Article
Summary
פרוטוקול זה מתאר את הדור של מעורבות מח עצם מאתר כימרות עם ספונטנית למרכזי נבטי אוטואימונית, באיזה autoreactive לימפוציטים לשאת photoactivatable חלבון פלואורסצנטי ירוק (GFP-הרשות) כתב. פעולה זו מספקת את היכולת לקשר מיקום סלולארי ברקמות עם ניתוחים פונקציונליים המולקולריים במורד הזרם.
Abstract
מחלות אוטואימוניות מציגים נטל בריאותיים משמעותיים. שאלות בסיסיות לגבי פיתוח, ההתקדמות של מחלת חיסון עצמי נותרו ללא מענה. דרישה אחת על החידושים ההבנה שלנו של מנגנוני המחלה הבסיסית, דינמיקה סלולר היא המושבים מדויקת של המיקום microanatomical של קבוצות משנה תא עם ניתוחים מולקולריים או פונקציונליים במורד הזרם; יעד באופן מסורתי קשים להשגה. הפיתוח של fluorophores הביולוגית יציבה photoactivatable ושל השתלבותם כתב זנים אפשרה לאחרונה תיוג microanatomical מדויק ומעקב של קבוצות משנה הסלולר במודלים מאתר. כאן, אנו מתארים איך היכולת לנתח autoreactive לימפוציטים ממרכזי נבטי יחיד עשוי לעזור כדי לספק תובנות לגבי הרומן מחלת חיסון עצמי, באמצעות השילוב של מודל chimeric הרומן של מחלת חיסון עצמי עם עיתונאי photoactivatable כדוגמה . נדגים שהליך ליצירת מעורבב כימרות עם autoreactive ספונטנית למרכזי נבטי מאוכלס על ידי לימפוציטים נושא כתב חלבון פלואורסצנטי ירוק photoactivatable. באמצעות אסטרטגיות תיוג ויוו, למרכזי נבטי יחיד, ניתן לאבחן רקמות הלימפה explanted ו photoactivated המרכיבים הסלולר שלהם על ידי מיקרוסקופ שני הפוטונים. Photoactivated לימפוציטים ממרכזי נבטי בודדת ואז ניתן לנתח או מיון זרימה cytometrically, תאים בודדים או בתפזורת, עלולים להיות נתונים ניתוחים פונקציונליים המולקולריים במורד הזרם נוספים. גישה זו ניתן להחיל ישירות לספק תובנות מחודשת בתחום מחלת חיסון עצמי, אבל ההליך ליצירת כימרות מח העצם ואת ההליך photoactivation עלול למצוא בנוסף יישום נרחב במחקרים של מחלות זיהומיות, גרורות הגידול.
Introduction
השכיחות של מחלות אוטואימוניות עלה במהירות בעשורים האחרונים, במיוחד בחברות מערביות. . היום, מחלות אוטואימוניות הדרגות השלישית על הרשימה של הסיבות הנפוצות ביותר של התחלואה והתמותה העולם המערבי1 שאלות בסיסיות לגבי פיתוח, ההתקדמות של מחלת חיסון עצמי נותרו ללא מענה. דרישה אחת על החידושים ההבנה שלנו של מנגנוני המחלה הבסיסית, דינמיקה סלולר היא המושבים מדויקת של המיקום microanatomical של קבוצות משנה תא עם ניתוחים מולקולריים או פונקציונליים במורד הזרם. בעשור האחרון, אפשרה הפיתוח של מספר יציב photoconvertible, photoactivatable או photoswitchable fluorophores ביולוגי, השתלבותם כתב זנים תיוג microanatomical מדויק ומעקב של הסלולרי קבוצות משנה במודלים מאתר.
קאךה, חלבון פלואורסצנטי photoconvertible שמקורם אלמוג אבן, עובר photoconversion בלתי הפיך מפני קרינה פלואורסצנטית ירוק כדי פלואורסצנטי אדום עם חשיפה ל- בהיר, סגול או סגול2. בתחילה מועסק לעקוב את התנהגות דינמית של תאים בודדים בפיתוח organotypic המוח פרוסות3, דור קאךה טוק-in העכבר לאחר מכן מותר ניטור ויוו הסלולר התנועה ומערכת היה מוחל על ניתוחים של נדידת תאים חיסוניים וממנה הלימפה4. גישה זו הייתה לאחר מכן מעודן עם כתב הדור השני5. כתבת דומה הוא Dendra6, ששימש לאחרונה כדי לעקוב אחר גרורות הצומת לימפה vivo7.
החלבון photoactivatable הראשון שפותח היה חלבון פלואורסצנטי ירוק (GFP) מתוכנן עם מוטציה נקודה בודדת (T203H), המוביל ספיגת נמוכה מאוד באזור גל ועד 450-550 ננומטר8. לאחר photoactivation על ידי אור סגול, זה חלבון פלואורסצנטי ירוק photoactivatable (PA-GFP) מתגים המקסימאלית הקליטה שלה מ- 400 ~ ל ~ 500 ננומטר, מניב עוצמה 100-fold משוער להגדיל כשהוא מתרגש עם אורך גל של 488 ננומטר. הדור של העכברים הטרנסגניים בו כל התאים hematopoietic אקספרס הרשות הפלסטינית-GFP מותר, בפעם הראשונה, ניתוחים מעמיקים של תא B בחירה באזורים כהים ובהירים שהוגדרו מבחינה אנטומית של מרכז נבטי9.
בעוד photoactivation הוא המרה הפיכה ממצב בלתי-פלורסנט למצב פלורסנט, photoconversion היא מעבר לכיוון אחד מאורך גל אחד למשנהו, חלבונים photoswitchable מסוגלים בין שני התנאים10 . תפקידו האחרון היה רתום לאחרונה להנדס שליטה אופטית של חלבון פעילות11.
ניצול הכתב הרשות הפלסטינית-GFP, אנחנו לאחרונה מאופיין repertoires תא B את המרכזים נבטי יחיד במודל של הרומן של מחלת חיסון עצמי, כמו לופוס ספונטנית12. מודל זה מבוסס על כימרות מעורב עם מח עצם 1 חלק מחסה autoreactive תא B קולטן טוק-in של ירידה לפרטים על מתחמי ribonuclear-חלבון (13,564Igi14) בשילוב עם מח עצם 2 חלקים מכל הרצוי התורם. כ 6 שבועות פוסט שיחזור, תנאים homeostatic מושגות באיזה autoreactive ספונטנית למרכזי נבטי נוכחים הטחול ואת בלוטות הלימפה עורית. ראוי לציין, מרכז נבטי האוכלוסייה תא B נמצא באופן כמעט בלעדי (~ 95%) מורכב של תאים שמקורם תא הלא-564Igi, אלו תאים B פראי-סוג-derived הפכו autoreactive. לפיכך, המודל מאפשר גישה 'מסוג הכנס-הפעל' ניתוחים של תאים B מרכז נבטי autoreactive שימוש transgenes שונים, טוק-outs, כתבים. כאן, אנו מתארים את ההליך ליצירת כימרות מעורב עם מרכזי נבטי autoreactive ספונטנית מאוכלס על ידי לימפוציטים נושא הכתב הרשות הפלסטינית-GFP. באמצעות אסטרטגיות תיוג ויוו, למרכזי נבטי יחיד, ניתן לאבחן רקמות הלימפה explanted ו photoactivated המרכיבים הסלולר שלהם באמצעות מיקרוסקופ שני הפוטונים. Photoactivated לימפוציטים ממרכזי נבטי יחיד יכול לאחר מכן נותחו על ידי cytometry זרימה או ממוין לפי תא לפעיל על-fluorochrome מיון (FACS), נתון ניתוחים פונקציונליים המולקולריים במורד הזרם נוספים. ניתן להחיל את היכולת לנתח autoreactive לימפוציטים ממרכזי נבטי יחיד ישירות לספק תובנות מחודשת בתחום מחלת חיסון עצמי, אבל טכניקות וגישות שתוארו ייתכן בנוסף לאתר היישומים הרלוונטיים בלימודי מחלות זיהומיות, גרורות הגידול.
Protocol
כל שימוש בבעלי חיים תאמו הנחיות הקהילה האירופית, אושרה על ידי מחקר חיה דנית Inspectorate (2017-15-0201-01348).
1. העכבר כללי גידול והכנת buffers וכלים
- עכבר מצוי קווים בתנאים (SPF) חינם פתוגן מסוים, עם ניטור תקופתי של מצב תקינות בהתאם לקווים מנחים סטנדרטיים.
- אופציונלי: לוודא העדר ספונטנית למרכזי נבטי בעכברים תמים עקב זיהומים adventitious ללא פיקוח. זה יכול להיעשות גם על ידי מיקרוסקופ immunofluorescence (נוכחות של מבנים מרכז נבטי) או לזרום cytometry (תדירות של מרכז נבטי B תאים) כמו שתואר לעיל12.
הערה: גם נקבות או זכרים יכול לשמש. באופן כללי, זה אידיאלי כדי סקס התאמה תורמים ומקבלים, כמו חוסר התאמה של סקס יכול תיאורטית להוביל alloreactivity לכיוון הגברי Y-אנטיגן על-ידי נמענים הנשי/תורמים15. - שימוש CD45.1 נמענים (B6. SJL -Ptprc Pepcb/BoyJ)-בסביבות גיל 6-10 שבועות. השתמש 564Igi (B6. Cg-Ightm1 Tik (Igh564)Igktm1 Tik (Igk564)/J), הרשות הפלסטינית-GFP (תורמים B6.Cg-Tg(UBC-PA-GFP)1Mnz/J) רוב בגיל 6-12 שבועות.
- סטריליזציה של כלי כירורגי (מספריים בסדר ישר, מלקחיים דומונט #5 ו- #7) על ידי autoclaving אותם בהתאם להנחיות עיקור שגרתית.
- הכנת 500 מ"ל של מאגר מח העצם (מוניטור) המכיל באגירה פוספט תמיסת מלח (PBS), 2% סרום שור עוברית (FBS), חומצה ethylenediaminetetraacetic 1 מ מ (EDTA) ב- pH 7.4. כדי להכין מאגר מוניטור, להוסיף 10 מ של חום-לא פעיל (1 שעה באמבט מים 56 ° C כדי להשבית את המשלים) FBS ו 1.25 מ של 400 מ EDTA פתרון (מותאם pH 7.4) עד 500 מ"ל של PBS, pH 7.4 ולערבב היטב. לסנן את המאגר באמצעות בקבוקון מסנן 0.2 µm.
- הכן 10 מ"ל של תאי הדם האדומים (RBC) פירוק מאגר (155 מ מ NH4קלרנית, 12 מ מ NaHCO3, 0.1 מ מ EDTA) על ידי דילול 1 מ"ל של מניה 10 x 10 מ של הנפח הכולל עם ריאגנט כיתה מים. להכין 50 מ של PBS עם 5 מ מ EDTA, pH 7.4.
2. הקמת כימרות מעורבות מח עצם
- הקרנה של נמענים (יום 0)
- למקם את CD45.1 מח שהנמענים במיכל הקרנה המתאים, להאיר עם 1,100 Rad ב בעוצמה גמא.
הערה: הקרנה חלופית מקורות ניתן להשתמש. ללא קשר למקור, המינון/התיזמון חייב להיות מותאם להניב אפקט מקסימלי myeloablative עם נזק מינימלי לרקמות נלווה לבעלי. - מניחים על המים לאנטיביוטיקה ad libitum (1 מ ג של sulfadiazin ו- 0.2 מ ג של ילדים מתחת לגיל/mL שתיית מים).
- למקם את CD45.1 מח שהנמענים במיכל הקרנה המתאים, להאיר עם 1,100 Rad ב בעוצמה גמא.
- מיצוי של עצמות (יום 1)
- עזים ומתנגד של תורמי מח עצם 564Igi על ידי זרימה רציפה של 4% איזופלוריין באוויר, המתת חסד מאת נקע בצוואר הרחם. לרסס את התורמים עם אתנול ומניחים אותם על רפידות כירורגי סטרילי בשכונה זרימה. להמשיך לעבוד שמירה על תנאים סטריליים, באמצעות מאגרי סטרילי וציוד.
- כדי לחלץ את עצם הירך ואת השוקה, תחילה אעשה חתך מסביב לקרסול, להאריך כלפי מעלה כל הדרך עד הירך באמצעות מספריים בסדר ישר. בעזרת מלקחיים כבדים או האגודל, האצבע, משוך את העור, את הרגל לכיוון הגוף. באופן דומה למשוך את העור למטה את כף הרגל.
- תקפוץ החוצה המפרקים בברך ובקרסול תופס את הרגל בירך, משיכת ברגל בכוח. המשך כדי לשבור את הקרסול משותפת למשוך ברגל לכיוון הגוף תוך לאחוז בשוקיים, ובכך מפשיטים את הגידים והשרירים את עצם השוקה.
- אשבור את הברך משותפת כדי לשחרר את השוקה, בדומה למשוך זה כלפי הגוף תוך מחזיק עצם הירך, ובכך מפשיטים הגידים והשרירים את עצם הירך. אעשה חתך על מפרק הירך, לחתוך את הגידים, לאחר מכן להוציא עצם הירך מהשקע היפ. חזור על שלבים 2.2.2 – 2.2.4 על הצד contralateral.
- לנקות את העצמות בקפידה על ידי שפשוף אותם עם מגבת נייר גס על מנת להסיר כל הנותרים משרירים ורקמות. ואז לשטוף אותם במאגר מוניטור כקרח לפני סוף סוף העברתן למאגר מוניטור קר טריים על קרח באמצעות זוג מלקחיים דומונט #7. חזור על צעד 2.2 התורמים הרשות הפלסטינית-GFP.
הערה: מספר תאי מח עצם מתורם יחיד משתנה לפי גיל, מין. סולם מספר התורמים לפי היחס הרצוי מח עצם קלט ומספרים, את מספר הנמענים הרצויים. אם תורמים נדירים, הגפיים הקבלה יכול להיות כלולות עבור שאיבת מח עצם. זה בדרך כלל התשואות של 1/3 נוסף כדי ½ של התאים המתקבל הגפיים האחוריות. בדרך כלל, בכל מקום מתאי 50 עד 200 מיליון ניתן לשחזר לכל התורמים, בהתאם לגיל, מין, רקע אם רק האחוריות או הינד והן הגפיים הקבלה הינם כלולים.
- חילוץ תאי מח עצם
- הכן המרגמה על ידי שטיפה במאגר מוניטור קר כקרח. מסננים את המאגר יש לשטוף ולהשתמש לקונטרולר פיפטה חשמלי עם פיפטה סרולוגית 10 מ ל להוסיף 10 מ ל טריים קפואים מוניטור מאגר.
- להעביר את העצמות התורמים 564Igi המליטה באמצעות זוג מלקחיים דומונט #7 ולהשתמש איחדו את כדי למחוץ, לטחון את העצמות כדי לשחרר את מח העצם. וארוקן את תמצית מח עצם עם פיפטה סרולוגית 10 מ ל, להעביר את זה דרך מסננת תא מיקרומטר 70 לתוך צינור 50 מ על קרח.
- להוסיף נוספים של 10 מ"ל טריים קפואים מוניטור מאגר המליטה וחזור כדי להבטיח התאוששות מלאה של תאים. הסרת עצם חומר המליטה עם מגבת נייר, למחוק כראוי, ולשטוף המליטה בזהירות עם 70% אתנול, ואחריו מאגר מוניטור. חזור על שלב 2.3 עבור הקבוצה תורם מח עצם הרשות הפלסטינית-GFP.
- ספירת תאים במח העצם
- שימוש של micropipette, מקום droplet המכיל 40 µL של RBC מאגר פירוק על חתיכת פלסטיק פרפין הסרט. היפוך הצינור מח עצם 564Igi כמה פעמים, להוציא µL 10 aliquot משתמש של micropipette. ערבב את זה עם µL 40 של RBC פירוק מאגר ירידה.
- לאחר מכן להוסיף 50 µL של Trypan blue (0.4% ב תמיסה מימית) המסירה. מיד לטעון µL 10 של המיקס המתקבל Burker-הטורקים hemocytometer, ספירה מתחת למיקרוסקופ. לחשב את מספר התאים לכל מל ', באמצעות ה-10 x פקטור הכולל דילול. לאשר את הכדאיות תא נאותה > 90%. חזור על שלב 2.4 עבור הקבוצה תורם מח עצם הרשות הפלסטינית-GFP.
- הכנת המתלים התורם
- בהתבסס על הסעיפים מתקבל שלב 2.4, את מספר הנמענים הרצויים, לחשב את עוצמת הקול של תורם מח עצם מכל הקבוצות התורם שני להיות מעורב בצינור מיקס התורם.
הערה: לדוגמה, הגדרת קבוצה אחת של 1:2 564Igi:PA מעורב-GFP כימרות המושתלים CD45.1 6: כל נמען דורש 20 x 10 תורם6 תאים סה ' כ, 564Igi חלק 1 ו- 2 חלקים הרשות הפלסטינית-GFP. לכן, זה מחייב 6 x 1/3 x 20 x 106 = תאי התורם 564Igi 40 x 106 ו- 6 x 2/3 x 20 x 106 = 80 x 106 הרשות הפלסטינית-GFP תורם תאי. - מערבבים את כמויות מתאימות של הרשות הפלסטינית-GFP, 564lgi תורם מח צינור חרוטי 50 מ. Centrifuge את התערובת מח עצם 200 x g ו- 4 מעלות צלזיוס למשך 10 דקות באמצעות רוטור דלי מתנדנדים.
- Decant את תגובת שיקוע, resuspend את התאים במאגר מוניטור כקרח-צפיפות של תאי8 עונה 1 פרק 10 מ"ל. העברת צינור microcentrifuge precooled 1.5 mL על קרח.
- בהתבסס על הסעיפים מתקבל שלב 2.4, את מספר הנמענים הרצויים, לחשב את עוצמת הקול של תורם מח עצם מכל הקבוצות התורם שני להיות מעורב בצינור מיקס התורם.
- לשחזר נמענים מח עצם עם תורם מח עצם
- עזים ומתנגד נמענים באמצעות אינדוקציה עם זרימה רציפה של 4% איזופלוריין באוויר, ואחריו תחזוקה ב- 3.75%. לאמת המטוס נאותה של הרדמה על ידי היעדר רפלקס הבוהן-קורט.
- קפיצי בקפידה את הצינור המכיל תערובת מח עצם על מנת להבטיח resuspension נאותה של תאים במח העצם, ולאחר מכן µL 200 וביופסיה של מח העצם מיקס (~ 20 x 106 תאים), ב- mL 0.3, 30 מד מזרק אינסולין.
- במקום המטופל על צידה, למתוח בעדינות את העור מעל ומתחת לעין מעט ' פופ את העין ", ולהוסיף בעדינות את קצה המזרק בזווית של 30 מעלות לתוך החלק הקדמי של ארובת העין, מקפיד להימנע העין ואת הרקמה הסובבת. כאשר קצה המחט מורגשת לגעת העצם קו תחתון ארובת העין, לסגת מעט (~0.5 מ מ), לאט לאט להחדיר את מח העצם של התורם באמצעות לחץ אחיד.
הערה: צריך להיות אין דימום, אין דליפה של נוזל וכדי לא בולטות מאוד מינורי של העין בעת ההזרקה. - להחזיר את העכבר לכלוב עם ad libitum מים אנטיביוטי וודא ההתאוששות מיידית. חזור על שלב 2.6 עבור כל נמען.
הערה: הזרקת וריד הזנב יכול לשמש במקום הזרקת retroorbital עם תוצאות דומות, בידיים שלנו זאת, איטית במידה ניכרת, אשר עשוי להיות דאגה בעת עבודה עם קבוצות גדולות של הנמענים. שחזור של מרדימים בעלי חיים ישירות על מצעים בקוטר קטן יש להימנע ככל. היא מהווה סיכון והשאיפה חנק
- הסרת לאנטיביוטיקה מים (14 יום)
- להסיר cage(s) המים לאנטיביוטיקה ולהחליף עם מים מתוקים לשתיה רגיל.
3. בדיקת שיחזור מוצלחת ואימות המתאים מידת chimerism (שבוע 6)
-
Retroorbital דימום של כימרות ופקדים
- להכין צינורות איסוף דם על-ידי labelling 1.5 mL microcentrifuge צינורות לפי האוזן הנמען תג מספרי והוספת µL 50 ל- PBS המכיל 5 מ מ EDTA.
הערה: כוללים את הפקדים המתאימים עבור הרשות הפלסטינית-GFP, CD45.1, CD45.2 ו- 9D 11 (idiotype). ניתן לבצע זאת על-ידי הכללת 1 הרשות הפלסטינית-GFP + עכבר, עכבר CD45.1 1, 1 B6 עכבר ועכבר 1 564Igi. - עזים ומתנגד עכברים ואמת המטוס נאותה של הרדמה כמו שלב 2.6.1. מקם את כמירה על צידה, למתוח בעדינות את העור מעל ומתחת לעין מעט ' פופ העין החוצה '.
- הכנס בעדינות עטופים BoPET heparinized קפילר (60 נפח פנימי µL) בזווית של 40° לתוך החלק הקדמי של ארובת העין, טיפול כדי למנוע נזק העין ואת הרקמה הסובבת. טוויסט/סובב בעדינות הצינורית עד שיתחיל למלא עם דם.
- לאפשר את הדם למלא את הצינורית פסיבי מאת נימיות, עד מלא כמעט לחלוטין, ואז תמשוך את הצינור ולמקם אותו לתוך הצינורית אוסף עם תוויות ברורות מראש המתאים, בזמן בו זמנית מיד מרגיע האחיזה סביב העין כדי לאפשר לעין להתיישב חזרה למקומה. דימום להפסיק מיד.
- להבטיח צינור קפילרי התרוקן לתוך הצינור אוסף וזורקים אותו במיכל החדים. סגור את הצינור, היפוך שלוש פעמים כדי לוודא ערבוב מוחלט עם EDTA/PBS.
- להחזיר את העכבר על הכלוב ואמת ההתאוששות מיידית. חזור על צעד 3.1 כל עכבר ניסיוני, הפקדים המתאימים.
הערה: קח זהירות בעת שימוש הניקוב וריד נקראות גם שיטה זו עלולה להוות סיכון גדול יותר עבור זיהום adventitious אצל הנמענים לקרינה לפני אלה הם לגמרי מחדש. יתר על כן, מניסיוננו, אנו מוצאים כי נפח הדם שנאספו, כמות הדם איבדו בשל דימום יתר הוא משתנה נוסף. שניהם מן השיקולים הללו חשובים, כמו מח העצם כימרות רגישים בשלב שיחזור, לפני מח העצם החדש הוא מלא engrafted hematopoiesis חידש את רמות נורמליות.
- להכין צינורות איסוף דם על-ידי labelling 1.5 mL microcentrifuge צינורות לפי האוזן הנמען תג מספרי והוספת µL 50 ל- PBS המכיל 5 מ מ EDTA.
-
טיהור דם היקפיים תאי תא (PBMC)
- לאחר השלמת איסוף דם, לזמן קצר (10 s) centrifuge הצינורות במהירות נמוכה (< 200 x גר') לאסוף את מדולל התייצב דם בחלק התחתון של הצינורות.
- ממלאים מזרק 10 מ"ל לימפוציט ההפרדה בינונית וחבר של מחט 18 גרם. את המחט לחלק התחתון של הצינור הראשון, underlayer את דגימת הדם עם 1 מ"ל של לימפוציטים הפרדה בינוני. לשלוף את המחט ובזהירות לנגב את זה עם מגבת נייר כדי למנוע זיהום צולב של הדוגמה הבאה.
- המשך דרך כל הדגימות ולאחר מכן צנטריפוגה במשך 25 דקות ב 800 x g, בטמפרטורת החדר, ומפרידה דלי מתנדנד, עם הבלמים מוגדר נמוך/כיבוי.
- הכנת סט של mL 1.5 בהתאמה שכותרתו צינורות microcentrifuge המכיל 1 מ"ל כקרח מאגר מוניטור, כל.
- בעקבות צנטריפוגה, עבור כל דגימה, הזן את השכבה העליונה (פלזמה) עם micropipette 200 µL, וארוקן את שכבת תאי תאים (MNC) מעל הממשק. העבר את התאים הצינור בהתאמה שכותרתו המכיל 1 מ"ל מוניטור המאגר. סגור את המכסה, היפוך לערבב. למחוק את הצינור המכילות בינוני לימפוציט ההפרדה.
- המשך דרך כל הדגימות, ואז צנטריפוגה ב x 200 גרם במשך 5 דקות, 4 ° C ברוטור דלי מתנדנדים. האחות למחוק את תגובת שיקוע ו resuspend בגדר ב 200 µL מאגר מוניטור קר כקרח. הדגימות מוכנים עכשיו מכתים נוגדן וניתוח cytometric זרימה.
-
צביעת להערכה cytometric זרימה
הערה: הציע לוח: CD45.1-FITC, B220-PerCP-Cy5.5, 9-ד' 11-A568, CD45.2-APC. הרשות הפלסטינית-GFP מופעל ללא מזוהה בתעלה השקט כתום (או שווה ערך). אין צבע הכדאיות נדרש כמו ההפרדה לימפוציט מקבל להיפטר של תאים מתים.- שימוש של micropipette, להוסיף 100 µL תא השעיה לכל טוב עבור כל דגימה כמירה ושליטה, צלחת 96-ובכן.
- עבור הדגימות הלא-הרשות הפלסטינית-GFP שליטה 3, מאגר של µL 100 הנותרים של כל דגימה (סה כ 300 µL). הוסף µL 50 החומר הזה עבור בקרת מוכתם יחיד בארות ובקרה וללא רבב. עבור הפקד שהוכתמו יחיד הרשות הפלסטינית-GFP בנוסף להוסיף 50 µL מדגם הרשות הפלסטינית-GFP וללא רבב.
- כל טוב, להוסיף 100 µL מאגר (מוכתם), יחיד נוגדנים (פקדי פיצוי שהוכתמו יחיד, למעט שליטה פיצוי הרשות הפלסטינית-GFP) או ערבוב נוגדנים (דוגמאות). דגירה על קרח במשך 20 דקות.
- צנטריפוגה ב x 200 גרם ל-5 דקות-4 מעלות צלזיוס. קפיצי את המאגר. להוסיף 200 µL מוניטור מאגר מכל קידוח, צנטריפוגה שוב לשטוף. קפיצי את המאגר, resuspend בתאים מכל קידוח ב 200 µL מוניטור המאגר. הדגימות. אתה מוכן לניתוח על cytometer זרימה (איור 1).
הערה: ניתן לנתח מרכז נבטי תגובות ב כימרות בכל נקודה מ- 6 שבועות ואילך.
4. אין ויוו תיוג של אזור שוליים/subcapsular הסינוס לסייע זיהוי של יחיד למרכזי נבטי
הערה: פרוטוקול נוכח הוכח לו טביעות רגל/למשכן (popliteal קשריות לימפה), זריקות תוך ורידית (עירוי, טחול), אך יכולים להיות מגוונים על פי אתר היעד.
-
הזרקה דו צדדיים לו טביעות רגל של הצומת לימפה popliteal תיוג
- עזים ומתנגד העכברים כמו שלב 2.6.1.
- צינור microcentrifuge 1.5 mL, למהול 2 µL של עכברוש התווית על-ידי PE העכבר נגד נוגדן CD169 ב 18 µL ל- PBS, pH 7.4. במקום שתי טיפות 10 µL כל תערובת על פיסת פלסטיק פרפין סרט צילום. מחוק לגמרי לכל droplet באמצעות מזרק אינסולין 0.3 mL עם מחט מד 30.
- להזריק את µL 10 של תיוג לערבב גם לו טביעות רגל (להיכנס עם המחט בזווית של 5-10 מעלות בחלק המרכזי של לו טביעות רגל, מקורב מההתחלה של האצבעות, והכנס את המחט בערך באמצע הדרך לכיוון העקב) או למשכן (הזן עם המחט ב 5 - 10 ° זווית בדיוק מעל העקב ולהוסיף על חצי אורכו לאורך הציר של גיד אכילס לכיוון לכיוון הברך של). העכברים לשוב הכלובים ולהמתין כ- 15 דקות לפני שתמשיך עם שלב 5.
-
הזרקה תוך ורידי של הטחול תיוג
- עזים ומתנגד העכברים כמו נקודת 2.6.1.
- צינור microcentrifuge 1.5 mL, לדלל 10 µL של עכברוש התווית על-ידי PE אנטי-העכבר נוגדן CD169 ב µL 90 ל- PBS. וארוקן את התערובת בעזרת מזרק אינסולין 0.3 mL.
- לבצע הזרקת עירוי retroorbital לפי שלב 2.6. העכברים לשוב הכלובים ולהמתין כ- 15 דקות לפני שתמשיך עם שלב 5.
הערה: כחלופה איזופלוריין, זריקת הרדמה כגון קטמין/חריגות השירותים הווטרינריים mix ניתן להשתמש; עם זאת, זה בדרך כלל מוביל פעמים התאוששות איטית יותר. מאז ניקוז לימפטי מושפע בדרך כלל על ידי תנועת השרירים השלד, זה צפוי להוביל זמן ניקוז איטי יותר.
5. explanting הטחול ובלוטות הלימפה והכנת photoactivation
-
הכנת דו-צידית הדמיה ו- photoactivation תא
- להסיר את הבוכנה מזרק 20 מ"ל, הגב עומס זה עם ואקום גריז על ידי החדרת הזרבובית של שפופרת של גריז ואקום לתוך זה. לאחר מכן להסיר את הבוכנה של מזרק 5 מ ל והשתמש המזרק 20 מ"ל על הגב-עומס זה עם גריז ואקום.
- השתמש במזרק ואקום-גריז שנטען מ ל כדי להכין, הדמיה ו photoactivation קאמרית על ידי הצבת coverslip מרובע על גבי משטח עקיבה לאורך קצות coverslip עם גריז ואקום (בערך 1-2 מ מ מהשוליים).
הערה: לטפל כדי למנוע זיהום גריז ואקום של כל המשטחים לאחר מכן במגע עם עדשת המיקרוסקופ, כמו microdroplets של emulsified במים טבילה ואקום גריז יכול לזהם את העדשה. - למלא תא ואקום גריז כיסוי-slip באמצעות מאגר מוניטור כקרח ומניחים על משטח שטוח קר.
-
קציר הלימפה והטחול
- המתת חסד אין ויוו הנקרא chimeric העכבר כדי להיות מנותח לפי שלב 2.2.1. לרסס את הגופה עם 70% אתנול.
- כדי לגשת הצומת לימפה popliteal, להשתמש במספריים ישר בסדר לעשות חתך בעור מתחת לבור הברך, להרחיב את החתך כלפי מעלה לאורך הקו-שריר הירך כמעט עד מפרק הירך. שימוש דומונט #5 או #7 מלקחיים, למשוך כל המשק חשופות של העור כלפי חוץ, כדי לחשוף את רקמות הפוסות popliteal (איור 2 א).
- באמצעות זוג מלקחיים דומונט #5, בזהירות להזין את הפוסות popliteal רק המדיאלי לוריד popliteal ומנתחים לפתוח את השומן על ידי הוספת, פתיחה וסגירה של המלקחיים לאורך הציר של הרגל, על מנת לחשוף את הצומת לימפה popliteal המשמש כבסיס.
- פופ הצומת לימפה מחוץ הפוסות ידי התכווצות של שריר הארבע ראשי מהצד הקדמי proximal ועד לברך באמצעות האגודל והאצבע המורה (איור 2B). תפוס הצומת לימפה מלמטה עם המלקחיים לשחרר אותו מן הרקמה שמסביב (איור 2C) ולמקם אותו ואז בבית הבליעה גריז ואקום מוכן בשלב 5.1.
- חזור על שלבים 5.2.2 – 5.2.4 על הצד contralateral. יכול להיות מצויד לימפה מרובות בתוך תא בודד אם רצונך בכך.
- סוף סוף לסגור את התא על ידי מיקום של coverslip השני על גבי השפה גריז ואקום והקשה בעדינות למטה, מקפיד הבלטת כל בועות האוויר.
הערה: חלק מן המאגר עשוי להידחף גם כן, אבל המשחה ואקום צריך טופס חותם צר, מניעת דליפה של נוזל (איור דו-ממדי). בלוטות הלימפה נמצאים כעת תא הדמיה דו-צידית. - כדי לגשת הטחול, בעזרת זוג מספריים ישר בסדר הפוך חתך דרך דופן הבטן בצד שמאל של העכבר, מקורב המדיאלי לקו הקדמי, מתחת בית החזה, להאריכו מסביב לגוף האחורית. הטיפ של הטחול צריך להיות גלוי (איור 3 א).
- משוך החוצה את הטחול עם זוג מלקחיים דומונט #7 וחותכים את ההדבקויות בצד התחתון לשחרר אותו. השתמש זוג מספריים בסדר ישר לחתוך פרוסות עבה, חתך, ~ 2 מ מ.
- מניחים הפרוסה בבית הבליעה גריז ואקום מוכן בשלב 5.1. יכול להיות מצויד פרוסות הטחול מרובות בתוך תא בודד אם רצונך בכך.
- סוף סוף לסגור את התא על ידי מיקום של coverslip השני על גבי השפה גריז ואקום והקשה בעדינות למטה, מקפיד הבלטת כל בועות האוויר. לשמור את כל תאי הדמיה על קרח בכל עת, למעט במהלך דימות ו photoactivation.
הערה: חלק מן המאגר עשוי להידחף גם כן, אבל המשחה ואקום צריך טופס חותם צר, מניעת דליפה של נוזל. הפרוסות טחול נמצאים כעת תא הדמיה דו-צידית (איור 3B).
6. Photoactivation
-
זיהוי למרכזי נבטי יחיד
הערה: פרוטוקול זה מתואר על הטחול, אבל הוא לגמרי מקביל של בלוטות הלימפה.- המקום לחדר ההדמיה על הבמה מיקרוסקופ. באמצעות פיפטה העברה פלסטיק של 3.5 מ ל, מקום טיפה של מים מזוקקים על גבי coverslip העליון ולהוריד המטרה עד נקודת המגע. פוקוס על הרקמה באמצעות האור המשודר.
- לעבור עירור שני הפוטונים ומצב כהה, ובהתאמה הלייזר 940 ננומטר.
הערה: עם ערכות הסינון המתאימה, הגל הזה מתיר עירור וזיהוי של הדור השני הרמוניות המכילות קולגן מבנים הקשורים כלי מרכזי אלמנטים מבניים, כמו גם את CD169-PE מוזרק בשלב 4.2, אשר מזהה האזור שולית. עם זאת, עירור nm 940 עושה לא photoactivate הרשות הפלסטינית-GFP. - בתרגום לבן-ספרות זולה באזורים פרטניים (מוגבל על-ידי CD169-PE מכתים) סמוך לפני השטח של הרקמה וזהה periarteriolar הלימפה נדן (חברים, אזור תא T) על ידי הדור השני הרמוניות המשויך את arteriole המרכזית. באזור בין החברים את האזור שולית, מראה כי הנוכחות של מאוד autofluorescent, הופעל tingible גוף מקרופאגים (האות autofluorescent חזק כל הערוצים, מראה כמו בועה עם וקואלות כהה) (איור 4A).
הערה: אם יש צורך, עקב כיוון בלתי רצויות של הרקמה, ניתן להפוך את החדר הדמיה, ניתן לבצע הדמיה מהכיוון השני. - בהתבסס על המחפשים שזוהו בשלב 6.1.3., לצייר אזור עניין זיהוי אזור מרכז נבטי יחיד. להגדיר את Z-ערימה של סביב 100-150 עומק מיקרומטר, החל מהשטח של הרקמה, ושימוש גודל צעד של מיקרומטר ~ 3.
- לעבור 830 גל עירור ננומטר. כבה או דים סאם כל הערוצים למניעת נזקי גלאי (כמו לייזר כוח ו פלט קרינה פלואורסצנטית הוא בדרך כלל גבוה באופן משמעותי ובאורך הגל הזה), ולאחר מכן 'תמונה' הערימה.
הערה: הגדרות ספציפיות, כגון לייזר פיקסל והכוח להתעכב זמן, תלוי לעומק הרקמה, הרקמה ספציפיים השתמשו ו מערכת ההדמייה. כל יישום חייב להיות ממוטבים עבור מערכת הדמיה ספציפית בשימוש. אמנם זה חיוני כדי לקבל photoactivation יעיל לאורך כל הערימה, להקפיד שלא נזקי התאים. - לחזור 940 nm עירור אורך הגל ולפתוח ערוצים. יסרוק המחסנית כדי לאשר photoactivation יעיל לאורך (איור 4B) היעדר נזקי (האות פא-GFP ' מאטום לשקוף ', שאינו מוגבל תא, כתמים כהים או גבוהה מעלות autofluorescence באזור photoactivated).
- המשך photoactivate לכל רקמות הרלוונטיים בבית הבליעה הדמיה, ואז מיד להחזיר אותה ice עד עיבוד נוסף. להמשיך עם photoactivation של צ'יימברס הדמיה נוספים.
הערה: רקמת explanting, הרכבה, במיוחד photoactivation הם תהליכים גוזלת זמן, אבל סה כ, סיבוב סביב הזמן צריך להיות מוגבל ל 4-6 שעות, כדי למנוע ירידה דרמטית תא הכדאיות.
7. שחזור וניתוח של תאים photoactivated
-
מיצוי של לימפוציטים מ הלימפה והטחול
- עבור כל דגימה photoactivated, הכן צינור microcentrifuge של mL 1.5 בהתאם שכותרתו המכיל 500 µL מוניטור מאגר על קרח. כוללים דגימות פקד ללא-הרשות הפלסטינית-GFP ועכבר שלא הופעל הרשות הפלסטינית-GFP. זה יכול להתבצע על ידי כולל פקד B6 אחד אחד הרשות הפלסטינית-GFP שליטה בעכבר.
- הסר בזהירות את תלוש כיסוי עליון מן החדר הדמיה, מקפיד לשמור על המיקום של הדגימות (אם מספר דוגמאות קיימות בתוך תא בודד), ולמקם כל מדגם לתוך הצינור שלה מדגם בהתאמה.
- שימוש של מהמגן המרוסקים, לסחוט את הרקמה ולסובב איחדו בצינור כדי לשחרר לימפוציטים. שימוש של micropipette, וארוקן את lysate, לסנן דרך מסננת תא מיקרומטר 70 לתוך צינור microcentrifuge mL 1.5 טריים, טרום מקורר. לקבלת דוגמאות הצומת לימפה, דלג לשלב 7.1.5.
- לקבלת דוגמאות הטחול, צנטריפוגה ב x 200 גרם במשך 5 דקות ב 4 ° C ברוטור דלי מתנדנדים. למחוק את תגובת שיקוע, resuspend בגדר ב- µL 200 RBC פירוק המאגר. תקופת דגירה של 5 דקות בטמפרטורת החדר, ולאחר מכן להוסיף µL 800 מאגר מוניטור כקרח והמשך לשלב 7.1.5.
- צנטריפוגה ב x 200 גרם במשך 5 דקות ב 4 ° C ברוטור דלי מתנדנדים. למחוק את תגובת שיקוע, resuspend ב µL 200 מאגר מוניטור קר כקרח. הדגימות מוכנים עכשיו מכתים להערכה cytometric זרימה ומיון, אם רצונך בכך.
-
צביעת להערכה cytometric זרימה
הערה: הציע לוח: CD169-PE, B220-PerCP-Cy5.5, 9-ד' 11-A647, CD38-PE-Cy7, הכדאיות צבע ניתן לתיקון Efluor-780, GL7-פסיפיק בלו. הרשות הפלסטינית-GFP מופעל ללא מזוהה בתעלה השקט כתום (או שווה ערך). Photoactivated הרשות הפלסטינית-GFP מזוהה בערוץ ה-GFP. כל שותף מטוהרים מקרופאגים (אשר או אולי לא היה ויוו המסומנת CD169-PE) יכול ייכללו על ידי צביעת עם CD169-PE באמצעות זה כמו שער ה-dump.- שימוש של micropipette, להוסיף 100 µL תא השעיה לכל טוב עבור כל דגימה כמירה ושליטה, צלחת 96-ובכן.
- הדגימות שליטה B6, הוסיפו 50 µL החומר הזה עבור בקרת מוכתם יחיד בארות ובקרה וללא רבב. עבור הפקד שלא הופעל שהוכתמו יחיד הרשות הפלסטינית-GFP בנוסף להוסיף 50 µL מדגם הרשות הפלסטינית-GFP שלא הופעל וללא רבב. לבקרת מופעל הרשות הפלסטינית-GFP שהוכתמו יחיד, מאגר החומרים הנותרים עבור כל הדגימות photoactivated.
- לכל אחד טוב, להוסיף 100 µL מאגר (מוכתם ושולט פיצוי הרשות הפלסטינית-GFP), יחיד נוגדנים (פקדי פיצוי שהוכתמו יחיד) או ערבוב נוגדנים (photoactivated דגימות). דגירה על קרח במשך 20 דקות.
- צנטריפוגה ב x 200 גרם 5 דקות ב 4 º C. קפיצי את המאגר. להוסיף 200 µL מוניטור מאגר מכל קידוח, צנטריפוגה שוב לשטוף. קפיצי את המאגר, resuspend בתאים מכל קידוח ב 200 µL מוניטור המאגר. הדגימות. אתה מוכן לניתוח זרימת cytometer או סדרן (נציג תוצאות באיור5).
תוצאות
דור של מעורבות מח עצם כימרות
בפרוטוקול הנוכחי robustly משיגה כימרות מח עצם מעורב עם chimerism כמעט מוחלטת בתא B cell כמוצג בתוצאה נציג באיור 1 (עבור מובהקות סטטיסטית נא להפנות ל- 12). המספרים תא B מנורמל מגלה serotyping ב 6 שבועות פוסט הכינון (איור 1 א'), עם תדירות נמוכה של 9D 11 (idiotype) חיובי בתאי B מחזורי הנובע תא 564Igi (איור 1B). בתוך השער לימפוציט הכולל, יש תדר נמוך של הנמען-derived תאים שיורית, ~ 6% CD45.1 (Q1), המציינת את תואר הכללית של chimerism ~ 94% (איור 1C). בתוך התורם תא (CD45.1.-, רבעון 4 + Q3) היחס בין 564Igi (ש4) אל הרשות הפלסטינית-GFP (Q3) נמצא במרחק של-23% עד 77%. זה מעט נמוך יותר קלט 33% 66% יחס מוסבר על ידי הבחירה שלילי כבד של תאים B נגזר מן ה תא 564Igi 12. כפי שניתן לראות באיור 1D, יש chimerism כמעט מלאה בתא B cell (99.9% CD45.1-), הדומיננטיות של תאי B הנגזרות מח עצם של הרשות הפלסטינית-GFP (Q3), אשר היא תוצאה של הבחירה שלילי כבד תאי B נגזר 564Igi.
הקציר של רקמות, עיבוד והערכה cytometric זרימה
איור 2 ו- 3 איור להדגים נהלי, התוצאות של explanting מבודדים טרי הלימפה ופרוסות הטחול. איור 4 מציג תוצאה נציג עבור תיוג ויוו ו- photoactivation של אזור מרכז נבטי יחיד פרוסה טחול explanted. כפי שניתן לראות (איור 4A), תיוג ויוו עם CD169-PE robustly. רשום את אזור שוליים (אדום, שצוין על-ידי "MZ"). האות השנייה הרמוניות בולטת של אלמנטים מבניים המכילות קולגן וכלי מרכזי (כחול), כולל את arteriole המרכזית של periarteriolar הלימפה נדן (PALS). מאוד autofluorescent, המקרופאגים tingible הגוף מופעל משויכות פעילות מרכז נבטי (חץ). יחדיו, זיהוי אזור שולית, חברים ו מקרופאגים tingible הגוף, מאפשר זיהוי של אזור בעל עניין אשר סביר להניח מכיל מרכז נבטי יחיד. האזור של עניין הוא photoactivated כמופיע באיור 4B. כפי שמתואר, photoactivation הוא מדויק microanatomically9, מניב אזור מוגדר של הפעלה. התוצאות שהוצגו בנוסף לשמש אסמכתה צפיפות גבוהה של הרשות הפלסטינית-GFP + לימפוציטים כימרות משוקם, נוכחות של מרכזי נבטי ספונטנית. במורד הזרם cytometric הערכה נוספת מאשר מספרים תא תא B מנורמל (איור 5D), אוכלוסיה מרכז נבטי ספונטנית (איור 5E), הנוכחות של תת-קבוצה של תאי B מרכז נבטי אשר היו photoactivated (דמות 5F).
כך, הפרוטוקול הנוכחי מציג שיטה חזקה לדור של מעורבות מח עצם כימרות עם autoreactive ספונטנית למרכזי נבטי, אשר מורכבים בעיקר של תאי B נגזר פראי-סוג נושא כתב photoactivatable. זה בתורו מאפשר ניתוח במורד הזרם של מרכזי בודדות נבטי (גרפי סקירה ב איור 6).
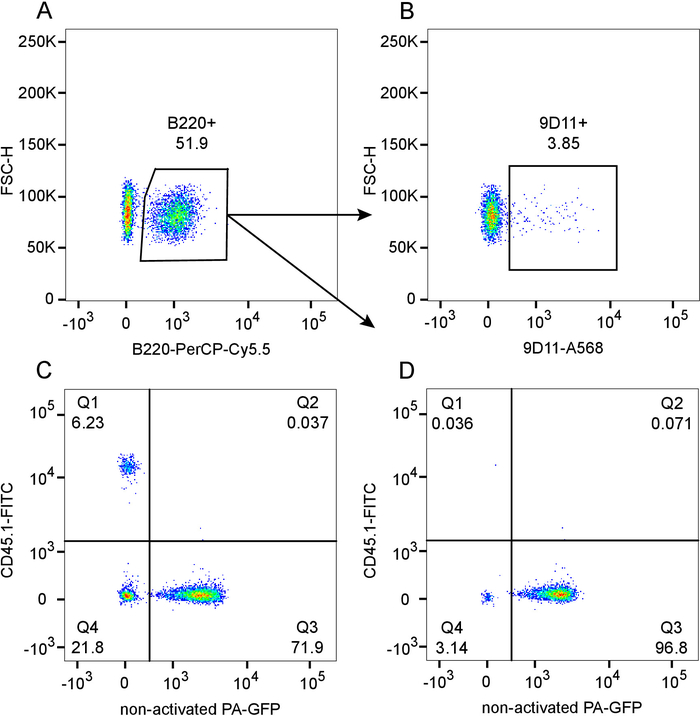
איור 1: זורם cytometric הערכה של מידת chimerism בדם של 564Igi (CD45.1.-, הרשות הפלסטינית - GFP-): הרשות הפלסטינית-GFP (CD45.1-, הרשות הפלסטינית-GFP +) מעורב כימרות בתוך אולם לקרינה CD45.1 נמענים (CD45.1. +, הרשות הפלסטינית - GFP-), 6 שבועות פוסט הכינון. מגרש A) מציג gating של תאים B220 + B, פיקוח מראש על גופיה לימפוציטים. Subgate B) מן מגרש A, מראה 9D 11 + (idiotype) תדירות בתוך האוכלוסייה תא B. C) העלילה של הרשות הפלסטינית-GFP לעומת CD45.1, פיקוח מראש על גופיה לימפוציטים. D) העלילה של הרשות הפלסטינית-GFP לעומת CD45.1 ב subgate תא B מן מגרש א אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
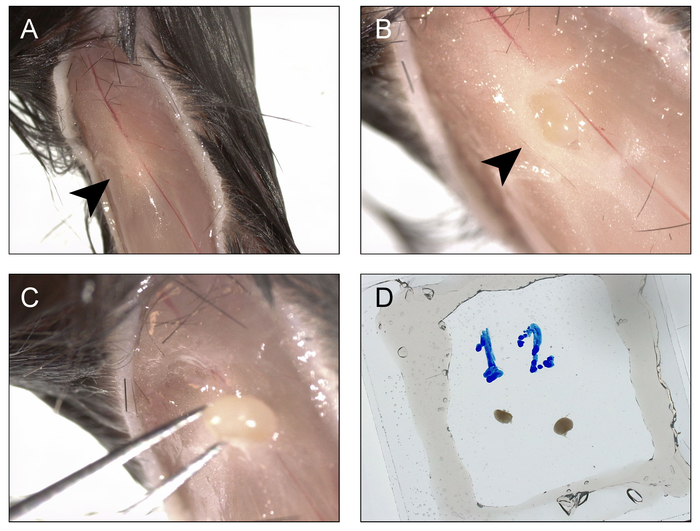
איור 2: נוהל קציר והרכבה popliteal בלוטות הלימפה עבור הדמיה ו- photoactivation. A) חתך הוא עשה מתחת לברך מורחב עד מפרק הירך ואת הקצוות הם נסוגים בצדדים, כדי לחשוף את הפוסות popliteal (חץ). B) fatpad שמעליה נפתח והוא הצומת לימפה popliteal חשוף (חץ). C) הצומת לימפה popliteal מאוחזר הפוסות. D) התהליך חוזר על עצמו עבור הצד contralateral, שני הענפים מותקנים בתוך תא coverslip/ואקום-גריז דו-צדדיים מלאים מאגר מוניטור. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
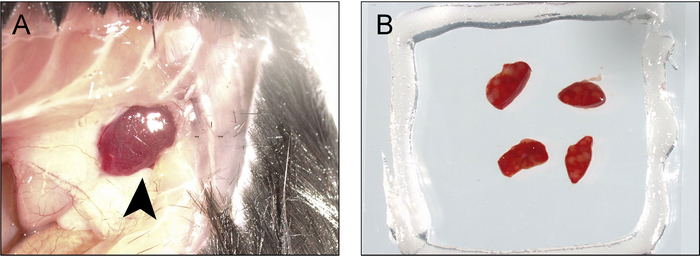
איור 3: נוהל קציר והרכבה הטחול עבור הדמיה ו- photoactivation. ) חתך הוא עשה על הקו הקדמי המדיאלי מתחת קשת הצלעות המורחבת סביב לגוף האחורית ואת הקצוות הם נסוגים לחשוף את קצה הטחול (חץ). B) הטחול מההצעה, טוחנות, לחתוך לפרוסות (1-2 מ מ עובי), אשר מותקנים בתוך תא coverslip/ואקום-גריז דו-צדדיים מלאים מאגר מוניטור. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
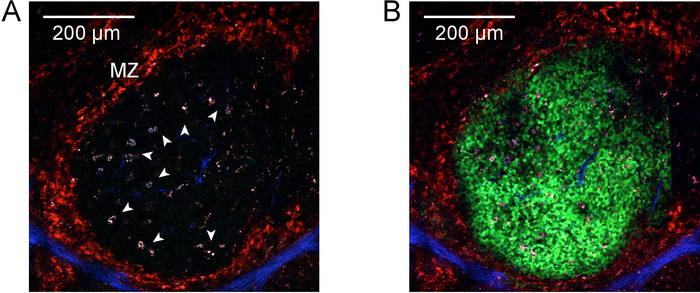
איור 4: Photoactivation. A) שני הפוטונים micrograph של מרכז נבטי הטחול לפני photoactivation. תיוג in vivo עם אנטי-CD169-PE בוצעה לפני הקטיף של הטחול לסמן את אזור שוליים (אדום, שצוין על-ידי "MZ"). לצלילים ההרמוניים השנייה אות ניכר בתוך מבנים המכילים קולגן המשויך בעור וכלי מרכזי (כחול). ראשי חץ זהה מאוד autofluorescent, המקרופאגים tingible הגוף מופעל הקשורים עם פעילות מרכז נבטי. הדמיה בוצעה ב- 940 עירור ננומטר. סרגל קנה מידה בפינה השמאלית העליונה מציין 200 מיקרומטר. B) עבור A, אבל אחרי photoactivation-830 ננומטר. תאים Photoactivated הם עכשיו גלוי (ירוק) באזור מוגדר עניין מוגבל על ידי אזור שולי המקיף את המקרופאגים tingible הגוף שזוהו בעבר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
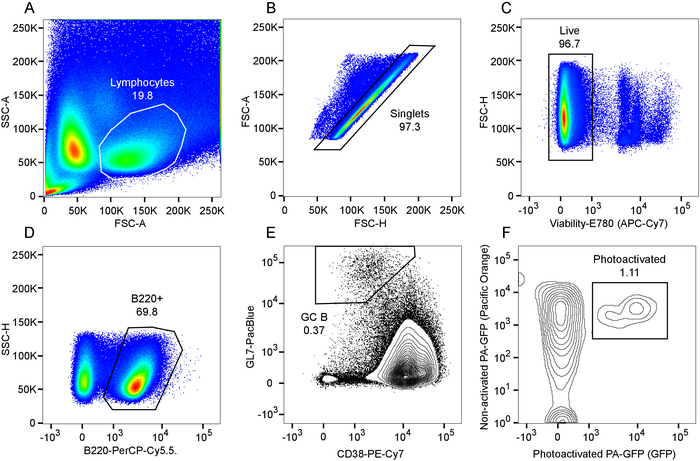
איור 5: לזרום ניתוח cytometric של תאי B מרכז נבטי photoactivated. A) חלקת קדימה לעומת השער הצדדי פיזור של לימפוציטים. B) חלקת אזור פיזור קדימה כפונקציה של גובה פיזור קדימה בתוך שער לימפוציט, ואת השער גופיה וכתוצאה מכך. הכדאיות C) לצבוע את אי-הכללה של מגרש בתוך גופיה שער, שער תא חי שנוצר. Gating D) של תאים B220 + B. Gating E) של מרכז נבטי B תאים, זוהה CD38lo GL7hi תאים בתוך השער B220 +. Gating F) של תאים photoactivated בתוך האוכלוסייה תא GC B, המזוהה כהמשנה של תאים שותף לבטא שלא הופעל photoactivated הרשות הפלסטינית-GFP. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
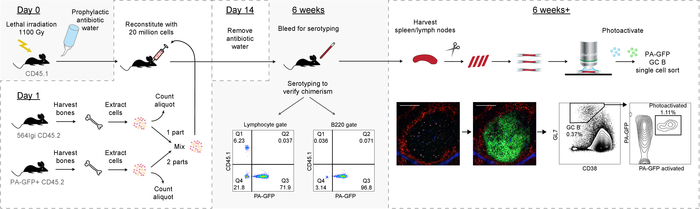
איור 6: סקירה גרפית של הפרוטוקול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
מספר רב של מודלים מאתר של מחלת חיסון עצמי הינם זמינים, שרבים מהם להציג עם מרכזי נבטי ספונטנית16. עם זאת, רבים של הדגמים זמינים הנמל במתחם רקע גנטי או מוטציות בגן הרגולטורים המרכזי של לימפוציטים התפשטות או הפעלה, והוציאם מתאים גרוע כדי intercrossing עם קווים כתב מחקרים על התנהגות לימפוציטים נורמלית במחלת חיסון עצמי, בהתאמה. הדגם הנוכחי, להפך, מאפשר גישה 'מסוג הכנס-הפעל' ניתוחים מעמיקים של תאים פראי-סוג-derived מרכז נבטי B autoreactive תוך שימוש בכל שילוב הרצוי של transgenes, טוק-outs, כתבים, במקרה הנוכחי המיוצג על-ידי photoactivatable GFP. באמצעות אסטרטגיות תיוג ויוו, למרכזי נבטי יחיד, ניתן לאבחן רקמות הלימפה explanted ו photoactivated המרכיבים הסלולר שלהם באמצעות מיקרוסקופ שני הפוטונים. Photoactivated לימפוציטים ממרכזי נבטי בודדת ואז ניתן שנותחה או ממויינת זרימה cytometrically, תאים בודדים או בכמות גדולה. כתוצאה מכך עלולים להיות נתונים תאים אלה ניתוחים במורד הזרם נוספים מולקולרית ופונקציונליים לספק תובנות מחודשת בתחום מחלת חיסון עצמי.
ישנם כמה צעדים קריטיים עבור ביצועים מוצלחים של הליך זה. כפי שמגלה את התוצאות נציג, ההקרנות (1,100 ראד) ולהחליף תורם מח עצם שיחזור בהצלחה תא הנמען מח העצם מניב כמעט מוחלטת chimerism בתא B cell. זו נקודה חשובה, כמו תאים B הנמען-derived שיורית ייתר תת-קבוצה של האוכלוסייה מרכז נבטי 'אפל'. ללא קשר למקור המשמש הקרנה, המינון/התזמון של הקרנה יש ניתן למטב הכלבית אפקט מקסימלי myeloablative עם נזק מינימלי לרקמות משני בעלי החיים. בשביל שיחזור, עצם-התאהבות הפרוטוקול לבין שיחזור עם תאי התורם סה כ-20 מיליון נמצאה להניב robustly שיחזור גבוהה מעלות. עובד וסטרילי, קר/על קרח על החילוץ מח עצם מבטיחה גבוהה הכדאיות של התורם מח. כדי להגיע התורם הרצוי מח עצם יחסי, זה חיוני כדי לנקוט זהירות רבה בעת ספירת aliquots של התאים, הספירה עצמה וגם כשהוא מוציא את subsample של מח העצם עבור ספירה. ערבוב, שיתוף pelleting מועך את התורם, במקום צריך שתוציאו, resuspending בנפרד, ואז ערבוב, מגישה כדי למנוע כל הטיה של התורם יחסי בעקבות ספירת תאים.
הדור כמירה מעורבות מח עצם של הפרוטוקול יכולה לעמוד לבד, והוא מאפשר יצירה של כימרות עם מרכזי נבטי autoreactive עם הכתב הרצויה, transgene או הנוק-אאוט. עם זאת, מגבלה אחת לכך היא הצורך להשתמש histocompatible תורמים. המתח 564Igi היא על רקע congenic C57Bl/6J, כתוצאה מכך, את donor(s) אחרים, הנמענים צריך רקע congenic של H-2b (או לחלופין, המתח 564Igi צריך להיות backcrossed ועד המתח הרצוי של פנוטיפ אוטואימוניות נבדק על רקע חדש.) ההליך הקרנה נוטה לטובת הסביבה tolerogenic17, אי-התאמות באנטיגנים histocompatibility משניות מסוימות עשויים להיות נסבל. עם זאת, ההיבט הזה ביסודיות להתייחס, במיוחד אם ערבוב תורמים זכר ונקבה ו/או נמענים, בשל פוטנציאל תגובתיות נקבה עם זכר מוגבלת Y-אנטיגנים.
באופן דומה, ההיבט photoactivation של הפרוטוקול יכולה לעמוד לבד, והוא עשוי לשמש בהקשרים שונים רבים. עם זאת, הכתב הרשות הפלסטינית-GFP זמינה כיום רק עם promotor UBC, אשר פעילים כל התאים השושלת hematopoietic, אבל לא בתוך תאי סטרומה. כאמור במבוא, photoactivatable, photoswitchable או photoconvertible כתב זנים אחרים הינם זמינים, יכול להיות מוחלף עבור הרשות הפלסטינית-GFP, עם התאמה המתאימה של תנאי הניסוי.
חשוב להימנע photoactivation מכוונת של אזורים בלתי רצויות, על ידי שמירה על הלייזר מעל 900 ננומטר כאשר הדמיה, וגם אורך גל זה לא photoactivate הרשות הפלסטינית-GFP. עבור photoactivation עצמה, הגדרות ספציפיות, כגון לייזר פיקסל והכוח להתעכב זמן, יהיה תלוי לעומק הרקמה, הרקמה ספציפיים השתמשו ו מערכת ההדמייה ולאחר כל יישום חייב להיות ממוטבים עבור מערכת הדמיה ספציפית בשימוש. להקפיד שלא נזקי התאים, אבל זה חיוני כדי לקבל photoactivation יעיל לאורך כל הערימה, כדי לקבל ייצוג מספיק תאים מופעל עבור ניתוחים במורד הזרם באותו זמן. מרכז נבטי B תאים בדרך כלל מהווים מקום מ- 0.5% ל ~ 2% של הצומת לימפה של הטחול או עורית-B תאים, כפי שניתן לראות את התוצאות נציג (איור 5), photoactivated מרכז נבטי יחידה B תאים עשוי לפצות ~ 1% מכלל אוכלוסייה נוכח פרוסה הטחול יחיד. לפיכך, ניתוח מוצלח או מיון של מספר משמעותי של תאים דורש עיבוד מספר גדול של אירועים.
Disclosures
המחברים אין לחשוף.
Acknowledgements
SE Degn הוא בחור Lundbeckfonden, עמית קרלסברג קרן. עבודה זו באופן חלקי בנוסף נתמך על ידי מענק הביו-רפואית NNF (SE Degn).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody, 9D11-A568 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Biotium 92255 | |
| Antibody, 9D11-A647 | In-house generated | 9D11 hybridoma, kindly provided by MC Carroll, labeled with kit: Nordic Biosite ABD-1031 | |
| Antibody, FITC anti-mouse CD45.1 | Biolegend | 110705 | |
| Antibody, Pacific Blue anti-mouse/human GL7 Antigen (T and B cell Activation Marker) | Biolegend | 144613 | |
| Antibody, PE anti-mouse CD169 (Siglec-1) | Biolegend | 142403 | |
| Antibody, PE/Cy7 anti-mouse CD38 | Biolegend | 102717 | |
| Antibody, PerCP/Cy5.5 anti-mouse/human CD45R/B220 | Biolegend | 103235 | |
| Capillary tube, Mylar-wrapped, heparinized | Fisher Scientific | 211766 | |
| Cell strainer, 70 µm | Falcon | 352350 | |
| Conical tubes, 50 mL | Falcon | 352235 | |
| Cover slip, square, 22x22 mm, 0.13-0.17 mm | Thermo Fisher Scientific | 22X22-1 | |
| EDTA | Merck | 1,084,180,250 | |
| Ethanol, 70% | VWR | 8301.360 | |
| Fetal bovine serum | Life Technologies | 10270106 | |
| Flow cytometer, FACS Canto II | BD Biosciences | 338962 | |
| Flow cytometer, LSRFortessa SORP | BD Biosciences | - | Special order product with 4 lasers (405 nm, 488 nm, 561 nm and 640 nm) |
| Grease, high vacuum, Dow Corning | VWR | DOWC1597418 | |
| Hemocytometer, Burker-Türk | VWR | 630-1544 | |
| Isoflurane, IsoFlo vet. | Orion Pharma | 9658 | |
| Lymphocyte separation medium (Lympholyte-M Cell Separation Media) | Cedarlane | CL5035 | |
| Microcentrifuge tube, 1.5 mL (Eppendorf) | Sarstedt | 72.690.550 | |
| Microscope, Two-photon | Prairie Technologies (now Bruker) | - | Special order Ultima In Vivo Two Photon Microscope |
| Mortar w. lip, unglazed, 75 ml | VWR | 410-0110 | |
| NaHCO3 | Merck | 1063290500 | |
| Needle, 18 gauge | BD Medical | 304622 | |
| NH4Cl | VWR | 87,769,290 | |
| PBS | Sigma | d8537 | |
| Pestle homogenizer | VWR | 47747-358 | |
| Pestle, unglazed, 175 mm | VWR | 410-0122 | |
| Pipette, Serological, 10 ml | VWR | 612-3700 | |
| Pipette, transfer, plastic | Sarstedt | 861,172,001 | |
| Plastic paraffin film (Parafilm M) | Bemis | PM996 | |
| Plate, 96-well | Falcon | 353910 | |
| Surgical forceps, Student Dumont #5 Forceps | FST - Fine Science Tools | 91150-20 | |
| Surgical forceps, Student Dumont #7 Forceps | FST - Fine Science Tools | 91197-00 | |
| Surgical scissors, Student Fine Scissors, Straight | FST - Fine Science Tools | 91460-11 | |
| Syringe, 10 mL | Terumo | SS-10ES1 | |
| Syringe, 20 mL | Terumo | SS-20ES1 | |
| Syringe, 5 mL | Terumo | SS-05S1 | |
| Syringe, Insulin, 0.3 cc | BD Medical | 324827 | |
| Tribrissen vet. 24% inj., containing 200 mg sulfadiazin and 40 mg trimethoprim/ml | MSD Animal health | 431577 | |
| Trypan blue solution, 0.4% | VWR | K940-100ML | |
| Viability dye, eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific | 65-0865-14 |
References
- Lerner, A., Jeremias, P., Matthias, T. The World Incidence and Prevalence of Autoimmune Diseases is Increasing. International Journal of Celiac Disease. 3 (4), 151-155 (2015).
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12651-12656 (2002).
- Mutoh, T., Miyata, T., Kashiwagi, S., Miyawaki, A., Ogawa, M. Dynamic behavior of individual cells in developing organotypic brain slices revealed by the photoconvertable protein Kaede. Experimental neurology. 200 (2), 430-437 (2006).
- Tomura, M., et al. Monitoring cellular movement in vivo with photoconvertible fluorescence protein “Kaede” transgenic mice. Proceedings of the National Academy of Sciences. 105 (31), 10871-10876 (2008).
- Tomura, M., et al. Tracking and quantification of dendritic cell migration and antigen trafficking between the skin and lymph nodes. Scientific Reports. 4, 6030 (2014).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature biotechnology. 24 (4), 461-465 (2006).
- Pereira, E. R., et al. Lymph node metastases can invade local blood vessels, exit the node, and colonize distant organs in mice. Science (New York, NY). 359 (6382), 1403-1407 (2018).
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science (New York, NY). 297 (5588), 1873-1877 (2002).
- Victora, G. D., et al. Germinal center dynamics revealed by multiphoton microscopy with a photoactivatable fluorescent reporter. Cell. 143 (4), 592-605 (2010).
- Habuchi, S., et al. Reversible single-molecule photoswitching in the GFP-like fluorescent protein Dronpa. Proceedings of the National Academy of Sciences of the United States of America. 102 (27), 9511-9516 (2005).
- Zhou, X. X., Chung, H. K., Lam, A. J., Lin, M. Z. Optical control of protein activity by fluorescent protein domains. Science (New York, NY). 338 (6108), 810-814 (2012).
- Degn, S. E., et al. Clonal Evolution of Autoreactive Germinal Centers. Cell. 170 (5), 913-926 (2017).
- Berland, R., et al. Toll-like receptor 7-dependent loss of B cell tolerance in pathogenic autoantibody knockin mice. Immunity. 25 (3), 429-440 (2006).
- Chatterjee, P., et al. Complement C4 maintains peripheral B-cell tolerance in a myeloid cell dependent manner. European journal of immunology. 43 (9), 2441-2450 (2013).
- Toubai, T., et al. Induction of acute GVHD by sex-mismatched H-Y antigens in the absence of functional radiosensitive host hematopoietic-derived antigen-presenting cells. Blood. 119 (16), 3844-3853 (2012).
- Luzina, I. G., et al. Spontaneous formation of germinal centers in autoimmune mice. Journal of leukocyte biology. 70 (4), 578-584 (2001).
- Sachs, D. H., Kawai, T., Sykes, M. Induction of tolerance through mixed chimerism. Cold Spring Harbor perspectives in medicine. 4 (1), a015529 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved