Method Article
מפשיר Culturing, Cryopreserving שורות תאים דרוזופילה
In This Article
Summary
שורות תאים דרוזופילה הם ריאגנטים חשוב למחקר בסיסי והן ביו. מאמר זה מספק פרוטוקולים מפשיר, subculturing של הקפאה קריוגנית של שורות תאים דרוזופילה נפוץ כדי לסייע לחוקרים שילוב השימוש האלה ריאגנטים במחקר שלהם.
Abstract
כיום יש מעל 160 ברורים דרוזופילה שורות תאים מופץ על ידי מרכז משאבים גנומיקה דרוזופילה (DGRC). עם הגנום הנדסה, מספר שורות תאים הרומן צפוי לגדול. DGRC שואפת להכיר חוקרים באמצעות שורות תאים דרוזופילה ככלי ניסיוני משלימים ולנסוע שלהם למחקר ופיתוח. נהלי עבודה עם מגוון רחב של שורות תאים דרוזופילה בעלי מאפיינים ברורים הינם מסופקים, לרבות פרוטוקולים עבור מפשיר culturing, cryopreserving שורות תאים. חשוב לציין, פרסום זה מדגים את שיטות עבודה מומלצות שבהן נדרש לעבוד עם דרוזופילה שורות תאים כדי למזער את הסיכון של מציג מיקרואורגניזמים adventitious או שורות תאים אחרים. החוקרים להכיר נהלים אלה יוכלו להתעמק היישומים רבים להשתמש בתאים דרוזופילה תרבותי כולל ביוכימיה, ביולוגיה של התא, גנומיקה תפקודית.
Introduction
השימוש דרוזופילה תרבותי תאים משלים ויוו לטוס ניתוח גנטי, משמש ככלי חקירה ראשית למיעון רבות השאלות הביולוגיות הבסיסיות1,2,3. שורות תאים דרוזופילה מציעים ייחודי הומוגנית אוכלוסיות של תאי ממקורות שונים רקמה עם רקע גנטי מובהק. שורות תאים מתאימים עבור יישומים רבים כולל ביטוי גנים הטרנסגניים, גנומיקה, transcriptomics, פרוטאומיקס, גליקומיקס, תפוקה גבוהה RNA הפרעה (RNAi) המסכים, ביולוגיה של התא, מיקרוסקופ. חשוב, השימוש של תרבית תאים דרוזופילה מקלה על אפיון התגובות זמני מיידי לגירויים ידוע. יתר על כן, תרבית תאים דרוזופילה הוא נוטה הגנום CRISPR-Cas9 עריכה, ולכן קל יחסית ליצור שורות תאים חדשים עם הגנום ספציפי שינויים4,5,6, 7.
מרכז משאבים גנומיקה דרוזופילה (DGRC) משמש מרכז מאגר והפצה עבור שורות תאים דרוזופילה . אחת המטרות של DGRC היא לסייע חברי קהילת המחקר באמצעות משאבי התרבות התא דרוזופילה . מאמר זה מציג פקודות בסיסיות לטיפול של שורות תאים דרוזופילה . תתנחם מהמשאבים הקיימים כדי לסייע לחוקרים להיות נוח עם טיפול תרביות תאים דרוזופילה ולהשיג רמת העצמאות שלהם ניסויים1,2,8,9 ,10.
הקווים תא דרוזופילה הנפוצות ביותר הם: שניידר קווים מספר11, Kc16712, דיסק דמותי מיצובישי/מיאקי ואת מערכת העצבים המרכזית (CNS) קווים13,14, מילנר מעבדה דיסק דמותי קווים 15,16,תא השחלות למבוגרים קווים17, ו Ras קווים18 (טבלה 1). השורות שניידר ו- Kc167 הם שורות תאים לכל מטרה כללית לשימוש בביוכימיה, ביטוי גנים הטרנסגניים רקומביננטי, ומסכי גנטי הפוכה. הקווים מעבדה (ML) מיצובישי/מיאקי נגזר דיסקים דמותי זחל או במערכת העצבים המרכזית (CNS), הם היו שימושיים עבור מחקרים בנושא neurosecretion, תקנה שעתוק RNA עיבוד. הקווים דיסק מילנר (CME) היה חשוב ללמוד מעבר אותות. הקווים תא המדרשה/OSS נגזר מוטציה השחלות למבוגרים נותרו ריאגנטים חשוב לחקור את ההשפעה ללא קידוד של הביולוגיה RNA קטנים תא הנבט תחזוקה ובידול17,19. לבסוף, הקווים ראס הם ייחודיים, כי אלה שורות תאים שמקורם עוברי ectopically לבטא את אונקוגן Ras. הם כוללים את החתימה תעתיק של תאי שריר קודמן, מבטא שמריהו פעיל מכונות20. סקירת מאמרים ופרקים לכסות את היישומים שורות אלה תא פופולרי עם יותר פרטים2,3,9.
כל שורות תאים אלה יכולים להיות subcultured, קפוא. יש דרישות שונות קלה, אבל חשוב על איך כל שורה תא ומשופרת לקראת הקפאה קריוגנית. לדוגמה, שורות תאים נפרדים לדרוש מדיה שונים ותוספי מזון (טבלה 1). הקווים משתנים גם במאפייני השטח הדבקות, מורפולוגיות (איור 1 ו- 2 איור), גנוטיפ, זמן ההכפלה (טבלה 2). אנו מציגים פרוטוקולים בסיסיים, להדגיש את ההבדלים ייחודי לטיפול הקווים השונים דרוזופילה בשימוש נרחב תא.
Protocol
1. מפשיר, החייאת שורות תאים קפוא דרוזופילה
- לחטא את מכסה המנוע על ידי מנגב משטח העבודה עם 70% אתנול. לוותר על 5 מ של המדיום המתאים (טבלה 1) לתוך 25 ס מ2 T-הבקבוק (T-25).
- הסר את cryovial/האמפולה נוזלי N2 או קרח יבש. לנגב את cryovial עם 70% אתנול, בזהירות לשחרר, פתחי את האמפולה.
- באמצעות פיפטה של פסטר, לסגת 1 מ"ל של מדיה בטמפרטורת החדר (RT) הבקבוק T-25. לאט לאט להוסיף התקשורת cryovial ומערבבים בעדינות כדי להפשיר את התאים קפוא, המבטיח כי התליה תא גלישה לא.
- להעביר את כל נפח התא המופשרים ההשעיה מ האמפולה לתוך הבקבוק T-25. חזור על מנת להבטיח שהתליה תא הועבר לחלוטין.
- הכנס את הבקבוקון חממה 25 ° C, המאפשר את התאים כדי ליישב וציות לפחות 2 ח' לבחון את התאים במיקרוסקופ כדי להבטיח כי רוב התאים התיישבו על המשטח גדל והולך. בעדינות להסיר מדיה ישן ותחליף 5 מ של מדיה חדשה. להחזיר את הבקבוק לתוך החממה.
- למחרת, בעדינות מסיר את המדיה הישנה ולהחליף עם 5 מ של מדיה חדשה. להחזיר את התרבות החממה.
2. מפשיר, החייאת קפוא דרוזופילה שורות תאים (חלופה)
- בשכונה סטרילי, להפשיר את התאים על ידי resuspending בגדר קפוא עם 1 מ"ל של RT מדיה. העברת כל התליה תא המופשרים לתוך צינור חרוטי 15 מ"ל.
- גלולה התאים על ידי צנטריפוגה-1,000 x g עבור 5 דק. להשליך את תגובת שיקוע, resuspend בגדר תא ב 5 מ של מדיה חדשה.
- להעביר את כל נפח התא ההשעיה לתוך בקבוקון T-25, דגירה התרבות ב 25 º C.
- 1 עד 2 h מאוחר יותר, לבחון את התאים במיקרוסקופ כדי להבטיח כי רוב התאים התיישבו על המשטח גדל והולך. למחרת, החלף את המדיה הישנה 5 מ של מדיה טריים וחוזרים התרבות החממה.
3. subculturing תאים חסיד למחצה גדלו ב 100 מ מ תרבות צלחות
- לחטא את מכסה המנוע על ידי מנגב עם 70% אתנול. להכניס את החומרים סטרילי עבור subculturing בכיפה, כולל מדיה בקבוקים, פיפטות, סיוע פיפטה של תרבות צלחות.
- בחן את המורפולוגיה זרימה של התרבות תחת מיקרוסקופ. חפש סימנים ברורים של מציג microorganismal בתרבות. לקבוע האם התאים הם מוכנים להיות passaged, בהתבסס על מאפייני התרבות: תא צפיפות ולהכפיל את הזמן, כולל הפעם האחרונה שהם היו subcultured.
- אם התרבות מופיע מאוד confluent (איור 1), לקבוע את צפיפות התאים. בשכונה סטרילי, לסלק תאים מפני השטח גדל על-ידי pipetting עד 10 מ"ל של המדיום מהצלחת מחלק זה על התאים. חזור על מספר פעמים, הבטחת לא ליצירת קצף, עד המשטח גדל הופך ברור. לקבוע את צפיפות התאים באמצעות hemocytometer או מונה הניתן חלקיקים אוטומטי (סעיף 5, איור 3). תת-תרבות התאים אם צפיפות התאים היא בין 5 x 106 עונה 1 פרק 107 תאים/מ ל....
הערה: האם לא תת-תרבות דרוזופילה תא קווי צפיפות תא מתחת עונה 1 פרק 106 תאים/מ ל.... -
לדלל התליה תא בהתאם באמצעות בינוני המתאים של ריכוז זריעה הסופי לפחות 1 x 106 תאים/מ ל....
- השגרה passaging ותחזוקה, להוסיף אמצעי אחסון המתאים של השעיה תא נפח שנקבע מראש במדיום צלחת תרבות חדשה כדי להשיג צפיפות תא זריעה הרצוי.
- עבור שינוי קנה מידה את תרבות, להעביר כל התליה תא לתוך בקבוקון גדולים. לדלל התליה תא לצפיפות הרצויה תא עם אמצעי אחסון המתאים של המדיום. להפיץ נפחים שווים של התליה תא מדולל על לוחיות הרישוי. שיטה זו ממזערת את הווריאציות בצפיפות תא בין לוחות.
- מכסה, תווית הצלחות עם התיבות המפעיל, תאריך, פיצול יחס, צפיפות תא זריעה, מזהה קו תא, מדיה, מעבר מספר ותוספות בכל מדיה כגון אנטיביוטיקה.
- מקם את הצלחות לתוך מיכל פלסטיק וחוזרים תיבת החממה.
הערה: בטבלה 3 רשימות כלי תרבות הנפוץ עבור culturing שורות תאים דרוזופילה ואמצעי האחסון המשויך את העבודה.
4. מוציאים תאים חסיד גדלו ב 100 מ מ תרבות צלחות
- העברת כל המדיום מהצלחת אל בקבוק חדש סטרילי. לשמור את המדיום.
- לשטוף תאים על-ידי הוספת לאט 1 מ"ל של 0.05% טריפסין-EDTA לצלחת. מערבולת בעדינות כדי להבטיח שהפתרון טריפסין מכסה את פני השטח כולו צמיחה. לבטל את הפתרון טריפסין.
- בעדינות מוסיפים 1 מ"ל של 0.05% טריפסין-EDTA לצלחת. דגירה את הצלחת 25 ° c בין מין 3−10 בזמן ניטור עבור סימנים גלויים של ניתוק שכבה תאים הזזה את המשטח גדל.
- להוסיף 9 מ של המדיום ששמרת הצלחת לעצור את פעילות טריפסין. מערבבים התליה תא מביצועם תא גושים. לאחר כבר הוציא את כל התאים, המשטח גדל יהיה ברור.
הערה: השימוש של אנזימי עיכול כמו טריפסין מסייעת passaging שורות תאים חסיד חריפה. טריפסין הוא תערובת של פרוטאזות לעיתים קרובות נגזר מן הלבלב חזירי והוא זמין מסחרית דרגות שונות של טוהר.
5. תא ידנית סופר שימוש בתא נויבאואר ספירת שקופיות
- הכן את השקופית hemocytometer ואת coverslip על ידי ניגוב המשטח עם אלכוהול 70%.
- לערבב התליה תא, לוותר על µL 15 של התליה תא אל קצה hemocytometer (איור 3 א) למלא את התא הראשון של hemocytometer מחורץ. למלא את התא השני של hemocytometer. התליה תא יצוייר לתוך החדר ספירה מאת נימיות.
- באמצעות 10 x מיקרוסקופ אובייקטיבי, לספור את התאים בתוך אזור2 1 מ"מ באמצע הרשת מאוגד על ידי קווים מקבילים (איור 3C,יח). כדי להימנע ספירת כפולים, לספור את התאים כיסוי החלק העליון והחלק השמאלי גבולות, אבל לא התאים לחצות את הגבולות הימני והתחתון של הריבועים2 מיקרומטר 200. נחשב בין תאים 100−200. חזור על הרוזן עם החדר השני.
- חשב את הממוצע של שני סעיפים ולקבוע את צפיפות התאים לפי הנוסחה הבאה: תא צפיפות (תאים/mL) = ספירת התאים הממוצע (n1 + n2/2) x 104.
הערה: תא הכדאיות מבוטא כאחוז מתוך התאים קיימא הכולל תאים. כדי לקבוע את הכדאיות תא, לערבב התליה תא עם אמצעי אחסון שווה של trypan blue (0.4%) פתרון לפני ספירת תאים ידנית או אוטומטית. תאים חיים לא תרימו את צבען, ואילו תאים מתים מוכתם כחול.
6. הקפאה קריוגנית של שורות תאים דרוזופילה
- בדוק את התרבות מורפולוגיה בריא, צמיחה של היעדר זיהום. הקציר התרבויות מן אמצע לשלב מאוחר-יומן צמיחה (שלב 3.3, או סעיף 4). קווים רבים דרוזופילה התא, הוא בערך בין 4 x 106 תאים למ"ל 8 x 106 תאים/מ ל....
- להעביר את המתלים התא כולו לתוך צינור חרוטי 15 מ"ל או 50 מ. לאסוף את התאים על ידי צנטריפוגה ב x 1000 g למשך 5 דקות וזורקים את תגובת שיקוע.
- Resuspend בגדר תא באמצעי אחסון בינוני קפוא (טבלה 4) כי תגרום צפיפות תא הסופי לפחות 4 x 107 תאים/מ ל....
- להוסיף dropwise את הכמות המתאימה של cryoprotectant דימתיל סולפוקסיד (דימתיל סולפוקסיד) לתוך התליה תא כזה ריכוז דימתיל סולפוקסיד הסופי הוא 10%. מערבבים בעדינות התליה תא.
- בזהירות לוותר על 0.5 מ"ל של התליה תא לתוך aliquots של cryovials שכותרתו מראש (~ 2 x 107 תאים/מבחנה). מניחים את ampules לתוך מיכל המקפיא מלא אלכוהול איזופרופיל (איור 4A). העברת המכולה מקפיא בפריזר-80 ° C בלילה כדי לאפשר את הטמפרטורה של cryovials לרדת לאט לאט (-1 ° C/דקה) כדי הטמפרטורה למקפיא.
- להוציא את cryovials קפואים, במהירות לצרף אותם שיחי (איור 4B). הכנס את שיחי המכיל cryovials לתוך מיכל (איור 4C). לחלופין, מקום cryovials קפוא בתוך קופסא מקפיא טרום מקורר (איור 4D). חנות קפוא cryovials בשלב הנוזלי של N2 מקפיאים (איור 4E,F).
הערה: בעת שימוש מקפיא מדיה המכילה דימתיל סולפוקסיד, באיחור של עד 30 דקות ב- RT אינה מזיקה לתאים.
תוצאות
חשוב להפשיר תאים דרוזופילה קפואות במהירות, תרבות אותם ב צפיפות תא המביאה את התרבות בחזרה לתוך שלב הצמיחה. אם נהלי והפשרה של הקפאה קריוגנית הם דבקו, צפיפות התאים בתוך הבקבוק T-25 תהיה שווה לפחות 4 x 106 תאים/מ ל.... 1-2 שעות לאחר מפשיר, רוב שורות תאים דרוזופילה יתחיל לצרף אל פני השטח גדל והולך. הנסיבות שבהן רוב התאים לא צירפו על המשטח גדל תוך שעתיים מרגע מפשיר, מומלץ דגירה התאים בלילה לפני שינוי בתקשורת.
המטרה של subculturing היא לשמור תאים בריאים מעריכי היומן-בשלב של עקומת גדילה. הקריטריונים subculturing תלויות גלויות היעדר זיהום microorganismal, צפיפות התאים, ואת הצורך לקבוע לוח זמנים תחזוקה שוטפת. חשוב להעריך את הבריאות של התאים תחילה ולקבוע העדר של מזהמים adventitious להקפאה. רוב מזהמים חיידקים ופטריות קלים לזיהוי על-ידי רדיוגרפיה. תרבויות מזוהמים יכול להיות מזוהה על ידי עלייה ב- media עכירות. תחת המיקרוסקופ, מזהמים עשוי להופיע כ מוטות חיידקי, cocci, הנצה תאי שמרים או מחרוזת דמוי הפטריה. מקורות אחרים של זיהום כגון mycoplasma הלא-cytopathic לא ניתן לאתרם באופן חזותי, יכול להיבדק באופן קבוע על ידי מבחני מבוססי ה-PCR21.
המפגש של שורת תאים יכול להיקבע באופן חזותי (איור 1). שורות תאים גדל מהר להגיע למפגש מוקדם, צריך להיות passaged באופן קבוע. קווים אלה הם subcultured עד פעמיים בשבוע. לעומת זאת, תאי גידול איטי הם passaged לפחות פעם אחת לשבועיים או יותר. עם זאת, התאים צריך להאכיל מדיה חדשה כל שבוע. זה כדי למנוע תשישות מדיה וכדי לדלל מטבולית הפסולת מהתאים. שורות תאים נגזר משתנה רקמות מקורות נבדלים שלהם מורפולוגיה (איור 2), מאפייני הדבקות, מדיה דרישות (טבלה 1) ולהכפיל את הזמן (טבלה 2). טבלה 5, טבלה 6, טבלה מס ' 7ו- 8 הטבלה ברשימת המתכונים עבור התקשורת השונים של תרבות תא דרוזופילה .
תא ספירת מבטיחה צפיפות זריעה מדויקת שגרתי צפוי עבור subculturing. לניסויים כמותית, ספירת תאים הוא חיוני. תאים נספרים גם על-ידי שימוש של hemocytometer (איור 3 א) או מונה הניתן חלקיקים אוטומטיות (איור 3B). אם משתמש של מונה אוטומטי, בצע הוראות היצרן. ספירת התאים באופן ידני באמצעות hemocytometer היא חסכונית וקלה. מספר התאים בסוגריים את רשתות נויבאואר האמצעי נספרים, צפיפות תא מחושב; לדוגמה, n = 214 תאים, וכתוצאה מכך צפיפות התאים של 2.14 x6 10 תאים/mL (דמות תלת-ממד).
תא השעיה של שתי צלחות 100 מ מ, המכיל כל 10 מ"ל של התא השעיה-4 x 106 תאים למ"ל נאספים וכוח resuspended ב 2 מ"ל להקפאת מדיה כדי להשיג צפיפות של 4 x 107 תאים/מ ל.... כל cryovial קפוא עם 0.5 מ"ל של השעיה התא מכיל 2 x 107 תאים. התוצאה תהיה תרבות עם 4 x 106 תאים למ"ל כאשר הקרת לפי הפרוטוקול, סעיף 1.
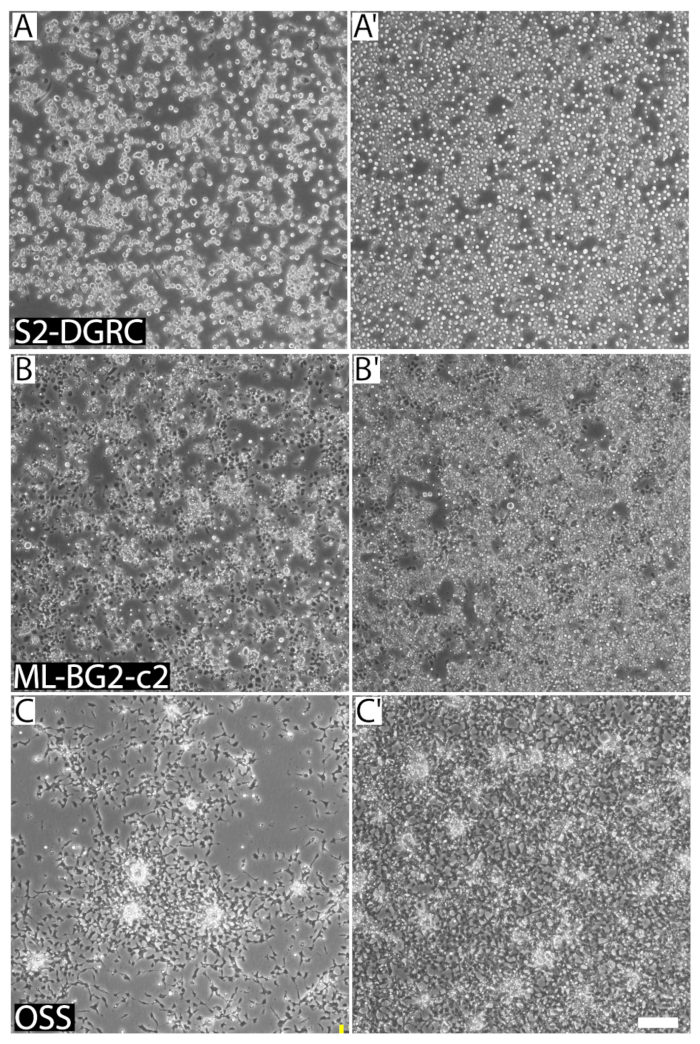
איור 1 : להחליפן בתמונות של שלושה ייחודי דרוזופילה תא קווי צפיפויות שונות הנהרות ותא. (א) S2-DGRC תרבות-עונה 1 פרק 106 תאים למ"ל. (A') תרבות S2-DGRC-4.5 x 106 תאים למ"ל. (B) ML-BG2-c2 תרבות-עונה 2 פרק 106 תאים למ"ל. (ב') תרבות ML-BG2-c2-8 x 106 תאים למ"ל שבו תאים לערום, צבירה כמו מוקדים. (ג) OSS תרבות-עונה 1 פרק 106 תאים למ"ל. (סי ') OSS תרבות-4 x 106 תאים/מ ל.... תאים ההשעיה נלכדים לא על אותו מישור מוקד. סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
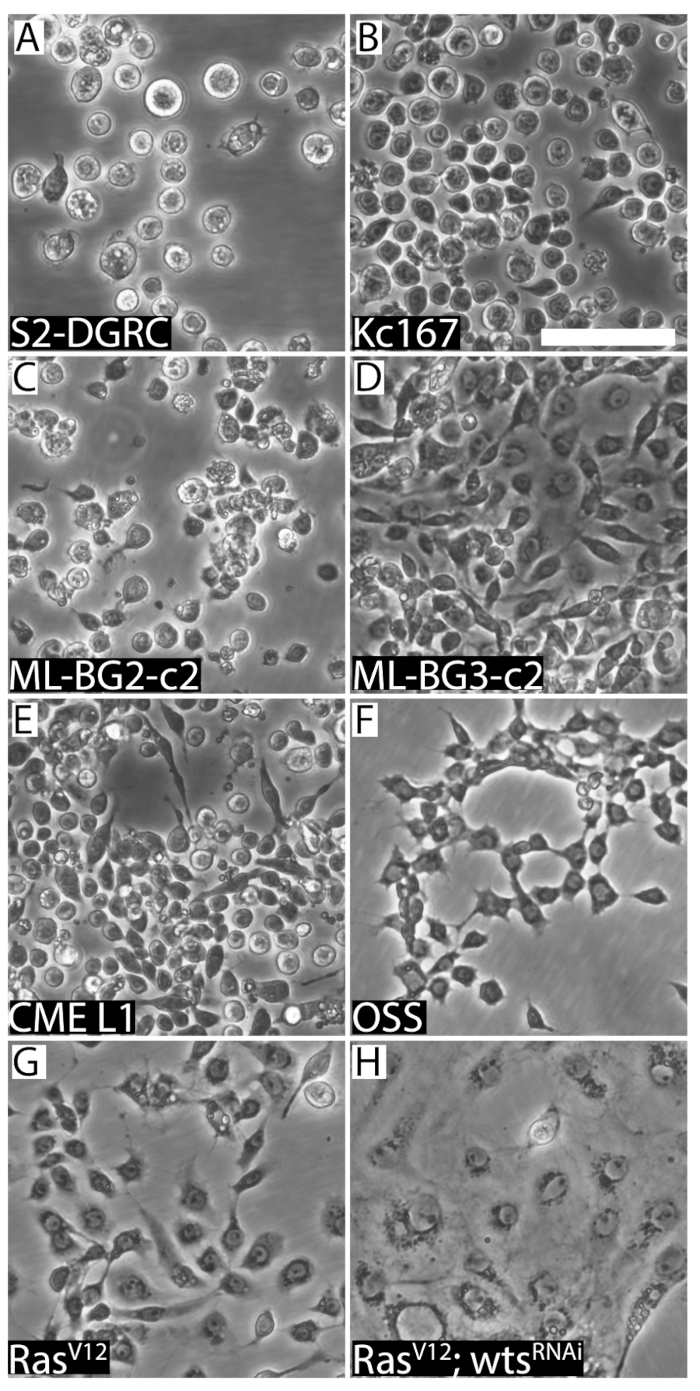
איור 2 : להחליפן בתמונות של הקווים שמונה דרוזופילה ברורים תא. (א) סיבוב העובר-derived S2-DGRC. (B) סיבוב העובר נגזר Kc167. (ג) סביב זחל CNS-derived ML-BG2-c2. (ד) סיבוב זחל בצורת כישור ML-BG3-c2. (E) CME L1, קו תא נגזר מן הדיסקים דמותי הרגל זחל, קטן ויש לו סיבוב/דמוי מורפולוגיה. OSS (F), קו תא הנגזרות שחלות למבוגרים, מציג מורפולוגיה בצורת כישור. (G) שורת התאים בצורת כישור ראסV12 לבטא מופעל Ras. (H) ראסV12; wtsRNAi (WRR1), קו תא לבטא מופעל Ras ו- RNA גדילי כפול מיקוד משתיק קול הגידול יבלות (wts), הצגת מאפייני האפיתל. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
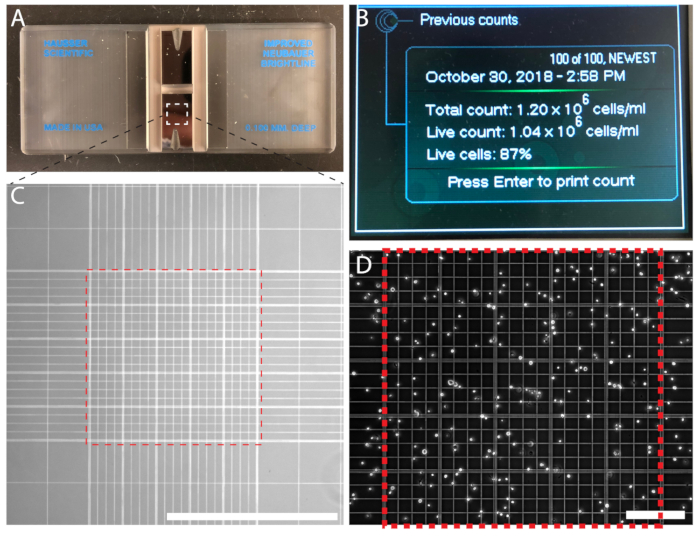
איור 3 : תא צפיפות ניתן לספור באופן ידני באמצעות hemocytometer או באופן אוטומטי באמצעות מונה חלקיקים אוטומטיות הניתן. (א) א hemocytometer עם שני תאים. (B) מונה הניתן תא אוטומטית הצגת הפלט של ספירת תאים. (ג) התא נויבאואר משופרת ספירת רשת צפו תחת מטרה 10 x. ספירת תאים על-ידי 0.1 מ מ3 מרכזי ברשת (ריבוע מקווקו אדום). (ד) לרשת המרכזית ב hemocytometer מלא תאים עבור ספירה. סרגל קנה מידה = 1 מ מ (ג); 0.2 מ מ (עומק). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : ציוד הקפאה קריוגנית. (א) A הקפאה מיכל חנויות ampules בתנוחה זקופה על הקפאה איטית. (B) A מקל מתכת להחזקת ampules קפוא. (ג) A מיכל מחזיק מקלות הליכה. (ד) A מקפיא קופסת פלסטיק (cryobox). (E) A מיכל מחזיקה מספר שיחי מוכנס לתוך מיכל אחסון של2 נוזל N. מיכל אחסון של2 (F) N נוזלי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| תא המתח | מדיה | הדבקות | טריפסין |
| קווים שניידר | M3 + BPYE + 10% עגל עוברית סרום (FCS), pH 6.6 | מחסידי למחצה | לא |
| (S2R +, S2-DRSC, S2-DGRC, Sg4) 11 | |||
| של שניידר מדיה+ + 10% FCS | |||
| Kc קווים (Kc167, Kc7E10)21,22 | M3 + BPYE + 5% FCS, pH 6.6 | מחסידי למחצה | לא |
| Hyclone-CCM3, pH 6.2 | |||
| CNS קווים (ML-קווים)13,14 של דיסק דמותי | M3 + BPYE + 10% FCS, pH 6.6 | מחסידי למחצה | לא |
| אינסולין µg 10/mL | |||
| דיסק דמותי מילנר קווים (CME-קווים)15 | M3 + 2% FCS | מחסידי למחצה | לא |
| µg 5/mL אינסולין | |||
| 2.5% תמצית לעוף | |||
| המדרשה/OSS16 | M3 + 10% FCS, pH 6.8 | חסיד | * |
| אינסולין µg 10/mL | |||
| 1 מ"ג/מ"ל C5H8יודע4 | |||
| 0.5 מ"ג/מ"ל KHCO3 | |||
| גלוטתיון 0.6 מ"ג/מ"ל | |||
| תמצית לעוף 10% | |||
| ראסV12 קווים18 | M3 + BPYE + 10% FCS, pH 6.6 | חסיד | כן |
טבלה 1: מאפיינים ודרישות מדיה שונים דרוזופילה תא קווים. מבודד שונים של חסיד למחצה קווי שניידר כולל S2R + מרכז הקרנה RNAi S2-דרוזופילה (DRSC), מרכז משאבים גנומיקה S2-דרוזופילה (DGRC), Sg4 הם קווים תא נפוץ אשר להתרבות robustly כאשר תרבותי בתקשורת M3 + Bactopetone תמצית שמרים (BPYE) בתוספת 10% עגל עוברית סרום (FCS). לחלופין, המדיה של שניידר (pH 6.7-6.8) משמשת לעתים קרובות במקום M3 + BPYE. הקווים Kc להתרבות או M3 + BPYE (5% FCS) או ללא סרום CCM3 מדיה. הדיסק דמותי ML ואת מערכת העצבים המרכזית (CNS) קווים לדרוש תוספת אינסולין התפשטות. הקווים דיסק דמותי מילנר דורשים אינסולין ולעוף לחלץ תוספי. שורות תאים חסיד המדרשה/OSS דורשים אינסולין, ריכוז גבוה יותר של תמצית לעוף, כמו גם גלוטתיון לצמיחה. קווים ראסV12 חסיד לגדול גם ב M3 + BPYE (10% FCS). טריפסין משמש מכך שורות תאים חסיד מפני השטח צמיחה.
| תא קו (במניה #) | גן # מושגים בסיסיים | הכפלת זמן (h) * | רקמת המקור |
| S2R + (150) | OreR | 39 | עוברי מאוחר |
| S2-DGRC (6) | OreR | 23 | עוברי מאוחר |
| S2-DRSC (181) | OreR | 46 | עוברי מאוחר |
| Kc167 (1) | e/se | 22 | 6−12 עוברי h |
| ML-BG2-c2 (53) | y v נ מל | 48 | 3rd לחלל CNS זחל |
| ML-BG3-c2 (68) | y v נ מל | 104 | 3rd לחלל CNS זחל |
| ML-DmD8 (92) | y v נ מל | 66 | 3rd לחלל כנף זחל דיסק |
| CME W1 Cl.8+ (151) | OreR | 46 | 3rd לחלל כנף זחל דיסק |
| CME L1 (156) | OreR | 47 | 3rd לחלל הרגל זחל דיסק |
| OSS (190) | bamD86 | 45 | השחלות מוטציה למבוגרים בום |
| ראסV12 קווים | UAS-GFP; P(UAS-Ras85D.V12) / P (Act5C-GAL4) 17bFO1 | 41−65 | העובר |
בטבלה 2: גנוטיפ, הכפלת זמן, ומקורות רקמות של נרחב בשימוש דרוזופילה תא קווים. גנוטיפ רקמות, המקור, האוכלוסייה הכפלת זמן של שורות תאים נפוץ מוצגים. הכפלת זמן מבוסס על צמיחה של המדיה המומלץ ב 25 º C.
| תרבות כלי | נפח של מדיה (mL) |
| 12.5 ס מ2 T-הבקבוק... | 2.5 |
| 25 ס מ2 T-הבקבוק... | 5 |
| 75 ס מ2 T-הבקבוק... | 15 |
| צלחת 35 מ מ | 1 |
| צלחת 60 מ מ | 4 |
| צלחת 100 מ מ | 10 |
| 384-ובכן צלחת * | 0.04/טוב |
| צלחת 96-ובכן * | 0.1/טוב |
| 48. ובכן צלחת * | 0.3/טוב |
| צלחת 24-ובכן * | 0.5/טוב |
| 12. ובכן צלחת | 1.0/טוב |
| לוח 6-ובכן | 2.0/טוב |
טבלה 3: תרבות כלי ואמצעי אחסון מדיה המומלצים של. תרבות כלי בגדלים שונים זמינים עבור culturing תאים דרוזופילה . אמצעי האחסון המדיה המתאימה (mL) מומלץ עבור כל כלי. חותם רב טוב צלחות המכיל פחות מ- 0.5 מ ל תא הבולם עם פרפין סרט כדי לצמצם את אובדן מדיה עקב התאדות.
| נפח | |
| M3 + BPYE, pH 6.6 | 70 מ |
| מחממים FCS לא מופעל | 20 מ |
| דימתיל סולפוקסיד מסוננים עקר * | 10 מ |
בטבלה 4: מתכון להכנת 100 מ של הקפאה בינוני (M3 + BPYE, FCS 20%, 10% דימתיל סולפוקסיד). להכין מדיה מקפיא כנדרש ולהימנע אחסון מדיה קפוא המכיל דימתיל סולפוקסיד לתקופה ממושכת.
| M3 + BPYE בינוני | כמות |
| שילדס ושר של M323 | בקבוק 1 |
| KHCO3 | 0.5 ג'י |
| תמצית שמרים בחר | 1.0 g |
| Bactopeptone | 2.5 g |
| מים מטוהרים סטרילי | 1000 מ |
טבלה 5: מתכון להכנת 1 ליטר של M3 + BPYE תרביות רקמה בינונית. להתאים את ה-pH ל 6.6. לחטא על-ידי העברת המדיום דרך מסנן 0.22 מיקרומטר.
| בינוני M3 הבסיס עבור המדרשה/OSS תא קו | כמות |
| שילדס ושר M3 | בקבוק 1 |
| KHCO3 | 0.5 ג'י |
| C5H8יודע4 | 1.0 g |
| מים מטוהרים סטרילי | 1,000 מ |
טבלה 6: מתכון 1 ליטר של המדרשה/OSS M3 בסיס בינונית. להתאים את ה-pH ל 6.8. לחטא על-ידי העברת המדיום דרך מסנן 0.22 מיקרומטר.
| Hyclone-CCM3 | כמות |
| אבקת CCM3 | 28.6 g |
| NaHCO3 | 0.35 g |
| 10 N NaOH | 2.5 מ |
| CaCl2 | 0.5 ג'י |
| מים מטוהרים סטרילי | 1,000 מ |
טבלה 7: מתכון 1 ליטר של Hyclone-CCM3 רקמות תרבות בינונית. להתאים את ה-pH ל 6.2. לחטא על-ידי העברת המדיום דרך מסנן 0.22 מיקרומטר.
| M3 + BPYE + 10% FCS | מיאקי דיסק והמדיום קווים CNS | מילנר דיסק קווים בינוני | המדרשה/OSS שלם בינוני | |
| M3 + BPYE, pH 6.6 | 90 מ | 90 מ | - | - |
| החום לא פעיל FCS * | 10 מ | 10 מ | 2 מ | 10 מ |
| אינסולין (10 mg/mL) | - | 100 ΜL | 50 ΜL | 100 ΜL |
| תמצית לעוף | - | - | 2.5 מ | 10 מ |
| גלוטתיון (60 מ"ג/מ"ל) | - | - | 1 מ"ל | |
| M3, pH 6.6 | - | - | 97.5 mL | - |
| המדרשה/OSS M3, pH 6.8 | - | - | 79 mL |
טבלה 8: מתכון להכנת 100 מ של קומון שונים דרוזופילה מדיה התרבות התא. דגירה FCS ב 56 ° C עבור 1 h ומנערים כל חמש דקות עד חום-בטל חלבוני המשלים.
Discussion
תרביות תאים דרוזופילה הם ראשי ריאגנטים עבור מסכי מבוססת תא תפוקה גבוהה. השימוש שלהם גם משלים ויוו מחקר גנטי על ידי מתן אוכלוסיה הומוגנית של תאים מתאים ביוכימיה, מהירה בדיקה של בונה הטרנסגניים לפני הזרקת לתוך זבובים, ביולוגיה של התא, מיקרוסקופיה ולאחרונה תאים סומטיים גנטי מניפולציות על ידי הגנום עריכה1,2,3,8,9,10.
הכדאיות ושחזור של תאים דרוזופילה הקפוא רגיש לתנודות קיצוני אפילו בטמפרטורות נמוכות. DGRC מאחסן שורות תאים קפואה בשלב הנוזלי של N2 (-196 מעלות צלזיוס), מסיע אותם בתוך קרח יבש (78.5 º C). Ampules קפואים שהעביר בתוך קרח יבש כדאי לא יועבר חזרה לתוך נוזל N2 או מקפיא-80 ° C עבור אחסון. במקום זאת, התאים קפוא צריך להיות הקרת, reseeded-צפיפות גבוהה תא בהקדם האפשרי עם ההגעה (פרוטוקול בסעיף 1) ותרבותית למטרות המיועד שלהם (פרוטוקול בסעיף 3). אם הקווים תאים שאינם מנוצלים באופן מיידי לניסויים, התא קווים צריך להיות cryopreserved (פרוטוקול סעיף 6) עד שיהיו מוכנים לשימוש.
שורות תאים מסוימים, כגון השורות ML-BG2-c2 וראס צריך כמה ימים כדי להתאושש מן ההשפעות של קמה לתחייה מהמדינה cryopreserved. כמות משמעותית של פסולת הסלולר מלווה את שורות תאים אלו הימים הראשונים לאחר מפשיר. נותר ללא הפרעה, התאים לשחזר, להתרבות. הרבה שורות תאים דרוזופילה -DGRC הותאמו לגדול M3 מבוסס מדיה22. עבור שורות תאים כי הם איטיים להתאושש מן ההשפעות של מפשיר, בשימוש במדיה ממוזגים עשויה להיות שימושית. סביר ממוזגים המדיה להכיל גורמי גדילה מופרש על ידי תאי לתוך המדיה אשר עשויים לעודד את השחזור ואת התפשטות התאים לאחר מפשיר.
שורות תאים בדרך כלל לעקוב אחר עקומת גדילה סטריאוטיפי המורכב שלב ההשהיה, שלב מעריכית, מישור שלב, שלב ההתדרדרות. שורות רבות של תאים דרוזופילה להתרבות היומן-בשלב של צמיחה, כאשר הם מתורבתים-צפיפות בין עונה 1 פרק 106 עונה 1 פרק 107 תאים למ"ל על 25 מעלות צלזיוס. זה חיוני כי שורות תאים הם passaged כך הם תמיד שלב הגידול המעריכי.
המפגש של תרבות, המבוטא באחוזים, מתאר את הצמיחה פני השטח מכוסה על ידי התאים. תא זרימה עבור קו תא תלוי תא הצורה והגודל שלה. שורות תאים נפרדים יש מורפולוגיות שונות ומאפייני הדבקות. כתוצאה מכך, ייתכן שורות תאים שונים-כ דומה למפגש צפיפות התאים מאוד ברורים (איור 1). תרבות זרימה לא יכול להיות אינדיקטור אידיאלי עבור passaging תרביות תאים דרוזופילה מכיוון שורות תאים דרוזופילה ממשיכים להתרבות גם על ידי ללגוז האחד על השני מוקדים או ההשעיה אפילו לאחר השטח צמיחה מכוסה (איור 1). עם זאת, משתמשים מנוסים עם שורות תאים מסוים עשוי לעתים קרובות להשתמש הנהרות כמדריך חזותי מהירה עבור כאשר תת-תרבות.
אמנם זה אפשרי לגדול דרוזופילה קווים ב RT הסביבה בין 19−25 ° C, לא מומלץ בגלל תנודות טמפרטורת הסביבה משפיעה על קצב התפשטות. השימוש של חממה ייעודית-25 ° C מומלץ. החממה של תרביות תאים דרוזופילה אינו צריך להקל על חילופי גז CO2 כי דרוזופילה תא תרבות המדיה אל תשתמש CO2 לאכסון. הלחות בתוך החממה עבור culturing שורות תאים הוא גורם חשוב לא להתעלם כאשר culturing בתאים צלחות. בהתאם לסוג על החממה ועל סביבת העבודה, ייתכן צורך למקם גביע במים סטריליים בתוך החממה. כדי למזער את המדיה אידוי, להשתמש T-הבקבוק סגור או לאחסן תרבות צלחות במיכל פלסטיק אטומה בחוזקה ואילו בתוך החממה.
חשוב לפיתוח זמנים עבור subculturing שורות תאים דרוזופילה . כדי להעריך צמיחה קצב וצג בעקביות, זה נוח תת-תרבות יחס אפילו גיאומטריים (פיצול יחס 1:2, 1:4, 1:8). לדוגמה, ניתן לפצל צלחת confluent 10 מ"ל של תאים Kc167-8 x 106 תאים למ"ל ביחס 1:8 כדי להשיג צפיפות זריעה של עונה 1 פרק 106 תאים/mL (מ 1.25 ל השעיה תא מדולל 8.75 מ של מדיה טריים). ב- 72 h, Kc167 תרבויות צפויים להתרבות על צפיפות של תאים6 8 x 10/mL, בהתחשב שלה זמן ההכפלה של 24 שעות. היחס פיצול ולכן נקבע כדי להקל על תת-תרבות נוח שיגרה של עד פעמיים בשבוע, המבטיח כי התאים תמיד מתורבתים בשלב שלהם יומן מעריכית של צמיחה. דבר זה מאפשר זמנים קבוע subculturing את התאים כך הוא זמן זרימה לא קצר מדי ולא יותר מדי זמן. אם הזמן למפגש קצר מדי, התאים הם subcultured-צפיפות התא התחתון (יחס פיצול גבוה יותר). באופן דומה, אם הזמן להגיע למפגש ארוך מדי, התאים הם subcultured-צפיפות תא גבוהה יותר (יחס הפיצול נמוכה יותר). חשוב לציין כי רוב שורות תאים דרוזופילה רגישים מאוד צפיפות התאים נמוך (< עונה 1 פרק 105 תאים למ"ל), אילו תאים בקושי להתרבות ואת עלולה למות בסופו של דבר.
דרוזופילה שורות תאים משתנים מאפייני צמיחה מורפולוגיה. כתוצאה מכך, ייתכן שורות תאים עם מאפיינים ברורים להיות מטופלים באופן שונה. רוב דרוזופילה פתוחים למחצה חסיד. צפיפות התאים נמוך יותר, הם דבקים חזקים השטח צמיחה, התרבות הופך confluent, התאים הופכים פחות חסיד ולנתק בקלות. זה שינוי הדרגתי תא הדבקות מקלה על subculturing קל של שורות תאים דרוזופילה הנפוצה ביותר (שניידר, Kc קווים, דיסק דמותי וקווים CNS) שכן היא מאפשרת את המפעיל פשוט לוותר על מדיה מעל טפט תא לנתק אותם מפני השטח גדילה כאשר התרבות היא צפופה. לקווים שאינם מחסידי משטח כגון נבט הנשי-קו גזע/השחלות נדן סומאטית (המדרשה/OSS) וקווים ראס, זה חיוני כדי דגירה התאים טריפסין למשך זמן קצר לסייע ניתוק התאים מפני השטח צמיחה.
תוספות מדיה עבור רוב שורות תאים דרוזופילה כוללות עגל עוברית סרום (FCS). אינסולין ולחלץ לטוס למבוגרים (את פליקס) נדרשים עבור כמה שורות ספציפיות. את פליקס מכילה רכיבים לא מוגדר חיוני לצמיחה של שורות ספציפיות דיסק דמותי זחל והן לקווי תא השחלות למבוגרים. מכין DGRC, ואת עושה את פליקס למבוגרים זמין נגזר בן שבוע זבובים אורגון-R-modENCODE (RRID: BDSC_25211) ב aliquots 2.5 מ ל ו- 10 מ"ל. DGRC מספק גם הנחיות בקנה מידה קטן את פליקס הכנה באתר האינטרנט שלה < https://dgrc.bio.indiana.edu/include/file/additions_to_medium.pdf>. הכנה את פליקס, עם זאת, הוא זמן רב ואינה דורשת כמות גדולה של הזבוב הבוגר.
הקפאה קריוגנית של שורות תאים דרוזופילה שומר ריאגנטים עבור שמירה על שורות תאים וזמן לא נעשה בו שימוש מיידי. הקפאה קריוגנית מושגת על ידי לאט להקפיא את התאים (-1 ° C/דקה)-80 מעלות במדיום המכיל דימתיל סולפוקסיד, סוכן cryoprotective. השלב קירור איטי הוא קריטי עבור הקפאה קריוגנית מוצלחת. במקפיא-80 ° C, האמפולה של תאים מצטנן בקצב של-1 ° C/min כאשר הם ממוקמים בתוך מיכל המקפיא מלא אלכוהול איזופרופיל החל בטמפרטורת החדר 25 ° C, זה יקח עד 2 שעות על הטמפרטורה ב ampules כדי להגיע-80 מעלות צלזיוס. מומלץ להשאיר את ampules כדי להקפיא למשך הלילה.
Ampules קפואים ואז שתתאפשר במהירות לתוך השלב הנוזלי של חנקן עבור אחסון ממושך. בטמפרטורת החדר, cryovial לחמם במהירות כ 10 ° C/דקה, הכדאיות ייחשף ב מעל-50 ° C23. כדי למנוע ההעברה מהירה, לטפל ampules בקבוצות קטנות כדי למזער את החשיפה טמפרטורת הסביבה. לחלופין, במקום את cryovials קפוא על קרח יבש בעת הכנת להעברת שלהם לנוזל N2- אם חנקן נוזלי אינה זמינה, התאים ניתן לאחסן במקפיא-80 ° C, אך עם סיכון של הידרדרות משמעותית לאורך זמן.
תא צפיפות הוא קריטי עבור הקפאה קריוגנית מוצלחת ואת התחייה עוקבות של שורות תאים. באופן כללי, התא החדש קווים אמורים לקפוא ליצירת הראשונית להקפיא (1−3 ampules), ברגע עודף של תאים הופכת לזמינה. ברגע שורת התאים יש כבר תרבותי נוסף stably, מלאי קפוא של 10−20 ampules צריך להיווצר. מלאי זה הוא להפשיר ואז לבדוק את תא ההקפאה שלאחר השחזור ואת הכדאיות, לאחר מכן זה הופץ עבור experimentations או כדי להחליף את המניה כאשר המספר של ampules מניות קפוא יורד מתחת חמש. לבסוף, חשוב לאמת כי התאים המופשרים לשמר את המאפיינים של המניות הורים כמו שורות תאים ידועים להתפתח3,24.
לסיכום, מאמר זה מציג פריימר לעבודה עם תרביות תאים דרוזופילה על-ידי מתן המידע הבסיסי על שונים קווים, שיטות עבודה מומלצות, audiovisual פרוטוקולים לטיפול הבסיסי של שורות תאים דרוזופילה . משאב נגיש זה נועד להקל בצורה חלקה המבוא לעבודה עם תאים בתרבית דרוזופילה וכדי להשלים את המדריכים הקיימים הדרכה בכל מעבדה למחקר.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים מכוני הבריאות הלאומיים (פרס NIH P40OD010949) וקהילת המחקר על ניצול המשאבים השונים של DNA/וקטורים/תא melanogaster ד מספר פעמים ב DGRC.
Materials
| Name | Company | Catalog Number | Comments |
| 100 mm tissue culture plates | Corning | 430167 | Subculturing |
| 25 cm2 T-flask | Corning | 430168 | Subculturing |
| 35HC Liquid Nitrogen Storage Tank | Taylor-Wharton | 35HCB-11M | Cryopreservation |
| Automated Cell counter | BIO-RAD | TC20 | Counting |
| Bactopeptone | BD BioSciences | 211677 | Medium additions |
| Counting Slides | BIO-RAD | 145-0011 | Counting |
| Cryovial 1 mL | Greiner | 123263 | Cryopreservation |
| DMSO | Sigma Aldrich | D5879 | Cryopreservation |
| Freezing Box | Nalgene | 5029-0909 | Cryopreservation |
| Freezing Container | Fisher Scientific | 15-350-50 | Cryopreservation |
| Hematocytometer | Fisher Scientific | #0267110 | Counting |
| Human Insulin | Millipore Sigma | I9278 | Medium additions |
| Hyclone CCM3 media | GE Healthcare Life Sciences | SH30061.03 | Medium |
| Hyclone Fetal Bovine Serum | GE Healthcare Life Sciences | SH30070.03 | Medium additions |
| L-Glutamic acid potassium salt monohydrate | Millipore Sigma | G1149 | Medium additions |
| L-Glutathione reduced | Millipore Sigma | G6013 | Medium additions |
| Potassium Bicarbonate | Millipore Sigma | 237205 | Medium additions |
| Select Yeast Extract | Millipore Sigma | Y1000 | Medium additions |
| Shields and Sang's M3 Insect medium | Millipore Sigma | S8398 | Medium |
| Trpsin-EDTA (0.05 %), phenol red | ThermoFisher Scientific | 25300054 | Subculturing |
| Trypan Blue (0.4%) | BIO-RAD | 145-0013 | Counting |
References
- Baum, B., Cherbas, L., Dahmann, C. Drosophila: Methods and Protocols. Methods in Molecular Biology. 420, 391-424 (2008).
- Cherbas, L., Gong, L. Cell lines. Methods. 68 (1), 74-81 (2014).
- Luhur, A., Klueg, K. M., Zelhof, A. C. Generating and working with Drosophila cell cultures: Current challenges and opportunities. Wiley Interdisciplinary Reviews: Developmental Biology. , e339 (2018).
- Franz, A., Brunner, E., Basler, K. Generation of genome-modified Drosophila cell lines using SwAP. Fly (Austin). 11 (4), 303-311 (2017).
- Housden, B. E., et al. Identification of potential drug targets for tuberous sclerosis complex by synthetic screens combining CRISPR-based knockouts with RNAi. Science Signaling. 8 (393), r9 (2015).
- Kunzelmann, S., Bottcher, R., Schmidts, I., Forstemann, K. A Comprehensive Toolbox for Genome Editing in Cultured Drosophila melanogaster Cells. G3 (Bethesda). 6 (6), 1777-1785 (2016).
- Ishizu, H., Sumiyoshi, T., Siomi, M. C. Use of the CRISPR-Cas9 system for genome editing in cultured Drosophila ovarian somatic cells. Methods. 126, 186-192 (2017).
- Echalier, G. . Drosophila Cells in Culture. , (1997).
- Echalier, G., Perrimon, N., Mohr, S. . Drosophila cells in culture. 2nd edition. , (2017).
- Cherbas, L., Cherbas, P., Roberts, D. B. . Drosophila: A practical approach. 10, 319-346 (1998).
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. Journal of Embryollgy and Experimental Morphology. 27 (2), 353-365 (1972).
- Echalier, G., Ohanessian, A. Isolement, en cultures in vitro, de lignees cellulaires diploides de Drosophila melanogaster. Comptes rendus de l'Académie des Sciences. 268, 1771-1773 (1969).
- Ui, K., et al. Newly established cell lines from Drosophila larval CNS express neural specific characteristics. In Vitro Cellular & Developmental Biology − Animal. 30A (4), 209-216 (1994).
- Ui, K., Ueda, R., Miyake, T. Cell lines from imaginal discs of Drosophila melanogaster. In Vitro Cellular & Developmental Biology. 23 (10), 707-711 (1987).
- Currie, D. A., Milner, M. J., Evans, C. W. The growth and differentiation in vitro of leg and wing imaginal disc cells from Drosophila melanogaster. Development. 102, 805-814 (1988).
- Niki, Y., Yamaguchi, T., Mahowald, A. P. Establishment of stable cell lines of Drosophila germ-line stem cells. Proceedings of the National Academy of Sciences of the United States of America. 103 (44), 16325-16330 (2006).
- Saito, K., et al. A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature. 461 (7268), 1296-1299 (2009).
- Simcox, A., et al. Efficient genetic method for establishing Drosophila cell lines unlocks the potential to create lines of specific genotypes. PLoS Genetics. 4 (8), e1000142 (2008).
- Sumiyoshi, T., et al. Loss of l(3)mbt leads to acquisition of the ping-pong cycle in Drosophila ovarian somatic cells. Genes & Development. 30 (14), 1617-1622 (2016).
- Dequeant, M. L., et al. Discovery of progenitor cell signatures by time-series synexpression analysis during Drosophila embryonic cell immortalization. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 12974-12979 (2015).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Shields, G., Sang, J. H. Improved medium for culture of Drosophila embryonic cells. Drosophila Information Service. 52, 161 (1977).
- Freshney, R. I., Capes-Davis, A., Gregory, C., Przyborski, S. . Culture of animal cells : a manual of basic technique and specialized applications. Seventh edition. edn. , (2016).
- Lee, H., et al. DNA copy number evolution in Drosophila cell lines. Genome Biology. 15 (8), R70 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved