A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפונקציונליזציה של מיקרוסקופ כוח אטומי מנופים עם תאים חד-טי או חלקיק יחיד לספקטרוסקופיית של כוח בודד אימונולוגיים
In This Article
Summary
אנו מציגים פרוטוקול לפונקציונליזציה של מיקרוסקופ כוח אטומי (AFM) התלויה מנופים עם תא T יחיד וחלקיק חרוז למחקרים אימונולוגיים. הליכים לחקור בודד זוג תא תא דנדריטי כריכה על ידי AFM ולפקח על התגובה התאית בזמן אמת של מקרופאגים לחלקיק אחיד אחד על ידי AFM עם הדמיה פלואורסצנטית מוצגים.
Abstract
מיקרוסקופ כוח אטומי (AFM-SCFS) הוא כלי רב עוצמה ללימוד תכונות ביופיזיקלי של תאים חיים. טכניקה זו מאפשרת הידברות בדיקה ודינמיקה על קרום התא חי, כולל אלה בין תאים, קולטן וליגטים, לצד וריאציות רבות אחרות. זה גם עובד כמנגנון לספק גירוי פיסי או ביוכימיים על תאים בודדים בצורה מבוקרת spatioזמניות, ובכך לאפשר הפעלה תא ספציפית ואירועים סלולריים הבאים להיות מנוטרים בזמן אמת בשילוב עם לחיות תא הדמיה פלואורסצנטית. הצעד העיקרי במידות ה-AFM-SCFS הוא הפונקציונליזציה של ה-AFM-זיז, או במילים אחרות, ומצרף נושא מעניין לזיז. כאן, אנו מציגים שיטות כדי לשנות את מנוף AFM עם תא T אחד ו פוליסטירן בודד חרוז בהתאמה למחקרים אימונולוגיים. הראשון כרוך דבק ביולוגי תואם זוגות תאים T יחיד לקצה של זיז שטוח בפתרון, בעוד האחרון מסתמך על דבק אפוקסי על הדבקה אחת חרוז בסביבה האוויר. שני יישומים אימונולוגיים הקשורים לכל שינוי שלוחה מסופקים גם כן. השיטות המתוארות כאן יכולות להתאים בקלות לסוגי תאים שונים ולחלקיקים מוצקים.
Introduction
מיקרוסקופ כוח אטומי (afm), כלי רב-תכליתי, מצא יישומים רבים במחקר ביולוגיה תא1,2,3,4,5. מלבד יכולת הדימות שלה ברזולוציה גבוהה, התכונה הטבעית בודק כוח מאפשר ביופיזיקלי מאפיינים של תאים חיים להיחקר ישירות באתרו בתא יחיד ברמה6,7. אלה כוללים את מרכיבי הרוח של מבנים subcellular או אפילו תאים שלמים8,9,10,11,12, מסוימים מחייב ליגפני/קולטן החוזקות ב רמת מולקולה בודדת על פני השטח של התא13, וכוחות הדבקה בין זוגות בודדים של חלקיקים מוצקים ותאים או בין שני תאים1,2,14,15. שני האחרונים מסווגים בדרך כלל כספקטרוסקופיית כוח בודד (SCFS)16. בשל מנוף התלויה זמין עם קבוע באביב שונים, טווח הכוח נגיש AFM הוא רחב למדי מכמה piconewtons (pN) כדי מיקרוונטונים (μN), אשר מכסה כראוי את כל מגוון של אירועים סלולריים מעורבים כוחות מכמה עשרות של pN, כגון כריכת מולקולה בודדת מבוססת-קולטן, ל-nN, כגון אירועים סלולריים phagocytic15. זה טווח כוח דינאמי גדול עושה יתרון AFM על טכניקות אחרות כוח לחטט כגון מלקחיים אופטיים/מגנטיים ו biomembrane כוח בדיקה, כפי שהם מתאימים יותר מדידות כוח חלש, עם כוח בדרך כלל פחות מ 200 pN17 , 18. בנוסף, afm יכול לתפקד כמו מניפולטור בדיוק גבוהה כדי לספק גירויים שונים על תאים בודדים באופן מוגדר בצורה מוגדרת4,19. הדבר רצוי עבור לימודי הפעלה בזמן אמת של תא יחיד. בשילוב עם הדמיה לחיות בתאים הפלואורסצנטית, את התגובה התאית הבאה לגירוי מסוים ניתן לנטר בו, ובכך לבצע SCFS מבוססי מאוד חזק כמו דימות אופטי מתן כלי מעשי לחקור איתות סלולרי. למשל, AFM שימש כדי לקבוע את הזנים הדרושים כדי לעורר ארעיות סידן באוסטאואורך20. בעבודה זו, מעבר סידן מסומנים פלואורומטרים באמצעות הדמיה מטימטרי סידן לאחר היישום של כוחות מותאמים לשפות אחרות על האוסטאופיה מתורבת עם טיפ AFM. לאחרונה, afm הועסק מתיחה סיבים קולגן על אשר תאים stellate הכבד (hsc) גדלו ואת זה מכונאי הפעלה hsc ההפעלה היתה בזמן אמת מפוקח על ידי פלורסנט Src ביוסנסור, אשר זירחון כפי שמיוצג על ידי האינטנסיביות הפלואורסצנטית של ביוסנסור מתואם עם hsc הפעלה3.
בניסויי SCFS מבוססי AFM, הפונקציונליזציה הנכונה של מנופים של AFM התלויה הוא צעד מפתח לקראת מדידות מוצלחות. מאז אינטרס המחקר שלנו מתמקד הפעלה של תאים חיסוניים, אנחנו באופן שגרתי מנופים התלויים עם חומר חלקיקי כגון חלקיקים מוצק אחד שיכול להפעיל phagocyציטוזה ו/או תגובות החיסון חזק4,14 , 15 ותאי T בודדים שיכולים ליצור סינפסה החיסונית עם הצגת התאים אנטיגן, כגון תאים דנדריטים המופעל (DC)2. חלקיקים מוצקים בודדים מצמידים בדרך כלל לזיז באמצעות דבק אפוקסי בסביבה האוויר, ואילו תאים T בודדים, בשל האופי שלהם שאינם דבקים, הם פונקציונל באמצעות דבק ביולוגי בפתרון. כאן, אנו מתארים את השיטות לבצע שני סוגים אלה של שינוי זיז ולתת שני יישומים משויכים גם. האפליקציה הראשונה היא לחקור אינטראקציות T cell/DC עם AFM-SCFS כדי להבין את המנגנון המדכא של תאי T הרגולציה מנקודת המבט של מכניקת התא. השני כולל שילוב של AFM עם הדמיה לחיות בתאים פלואורסצנט כדי לפקח על התגובה התאית של מקרופאג כדי חלקיק מוצק בזמן אמת כדי לחשוף את המנגנון המולקולרי של הקולטן פוספולידיליליניום 4, 5-ביספושוונאים (PIP2)- . מוסין מתווכת הפייגוציטוזה מטרת פרוטוקול זה היא לספק מסגרת התייחסות לחוקרים מעוניינים לעצב וליישם הגדרות הניסוי שלהם עם מבוססי AFM ניתוח תא בודד עבור מחקר אימונולוגיים.
Protocol
פרוטוקול ניסוי העכבר עוקב אחר ההנחיות לטיפול בבעלי חיים של אוניברסיטת טסינחואה
1. פונקציונליזציה של זיז עם תאי T בודדים
- בתאי הטחול של העכבר הכנה
- להקריב את העכבר (8-16 שבועות של גיל (או סקס); למשל, C57BL/6 זן) באמצעות פחמן דו חמצני, ואחריו פריקה צוואר הרחם.
- לנקות את העכבר עם 75% אתנול ולעשות חתך העור באמצע קו ואחריו כריתת טחול.
- הומוגון לסדר את הטחול ב 4 מ ל של PBS המכיל 2% סרום של שור עוברי (fbs) באמצעות שקופיות זכוכית ולהסיר אגרגטים ופסולת על ידי העברת ההשעיה התא דרך מסננת ניילון 70 יקרומטר שינוי.
- צנטריפוגה את ההשעיה התא ב 500 x g עבור 5 דקות, להיפטר supernatant ולהשעות את התאים 2 מ ל של מאגר הפירוק של תא דם אדום (מאוזנת בטמפרטורת החדר) עבור 5 דקות. לסיים את תגובת הליזה על ידי הוספת 8 מ ל של פתרון PBS.
- צנטריפוגה את ההשעיה התא ב 500 x g עבור 5 דקות להשעות את התאים בצפיפות של 1 x 108 תאים/mL ב-PBS המכיל 2% Fbs ו 1 מ"מ Edta (מתויג כמו פתרון a), בדרך כלל 0.25-2 mL בהתאם לצפיפות התא. העבר את התאים המושהים ל-5 מ ל (12 x 75 מ"מ) פוליסטירן בצינור התחתון.
- הכנה לעכבר CD4 + T
- הוסף 50 μL/mL סרום עכברוש (ראה טבלת חומרים) ו 50 μl/ml CD4 + בידוד תא T קוקטייל (ראה טבלת חומרים) למדגם התא שהתקבל משלב 1.1.5. מערבבים ו דגירה עבור 10 דקות בטמפרטורת החדר.
- וורטקס המניות streptavidin מצופה חלקיקים מגנטיים (ראה טבלת חומרים) עבור 30 s או עד החלקיקים מופיעים באופן שווה התפזרו.
- ה75 וסף חלקיקים מגנטיים streptavidin מצופים ב-μL/mL לדגימת התא. מערבבים ו דגירה עבור 2.5 דקות בטמפרטורת החדר.
- הוסף פתרון A כדי למעלה את דגימת התא כדי 2.5 mL ולערבב על ידי ליטוף בעדינות למעלה ולמטה עבור 2-3 פעמים.
- מניחים את השפופרת לדוגמה (ללא מכסה) לתוך המגנט (ראה טבלת חומרים) ו דגירה עבור 5 דקות בטמפרטורת החדר. שופכים בזהירות את התא המועשר הבולם לתוך חדש 5 מ ל פוליסטירן מוקצף עגול התחתון.
- צנטריפוגה את ההשעיה התא ב 500 x g עבור 5 דקות. למחוק את supernatant ולהשעות מחדש את התאים T מועשר ב 500 μl של פתרון A.
הערה: התאים CD4 + T המועשר מכילים הן תאי T רגילים ורגולליים.
- תאי T רגולט הפרדה מתאי T רגילים
- הוסף 25 μL של חוסם FcR (ראה טבלת חומרים) לדגימת תא T המועשר שהושגה משלב 1.2.6. מערבבים ו דגירה עבור 5 דקות בטמפרטורת החדר.
- הוסף 25 μL של קוקטייל בחירה חיובית של תא T (ראה טבלת חומרים) לדגימת התא t. מערבבים ו דגירה עבור 10 דקות בטמפרטורת החדר.
- הוסף 10 μL של קוקטייל בחירת PE (ראה טבלת חומרים) לדגימת התא T. מערבבים ו דגירה עבור 5 דקות בטמפרטורת החדר.
- וורטקס המניה מצופה החלקיקים המגנטיים של המניות (ראה טבלת חומרים) עבור 30 s או עד החלקיקים מופיעים באופן שווה התפזרו.
- הוסף 10 μL של חלקיקים מגנטיים מצופים דקטרן לדגימת התא T. מערבבים ו דגירה עבור 5 דקות בטמפרטורת החדר.
- הוסף את הפתרון A כדי למעלה את דגימת התא T ל 2.5 mL ולערבב על ידי בעדינות ללטף למעלה ולמטה עבור 2-3 פעמים.
- מניחים את השפופרת לדוגמה תא T (ללא מכסה) לתוך מגנט ו דגירה עבור 5 דקות בטמפרטורת החדר. שופכים בזהירות את הסופרנטאנט לשפופרת חדשה.
הערה: supernatant מכיל את התאים המועשר קונבנציונאלי CD4 + T. - צנטריפוגה את התאים CD4 + T קונבנציונאלי מועשר ב 500 x g עבור 5 דקות. להיפטר supernatant ולהשעות את התאים ב 4 מ ל של RPMI1640 המכיל 10% fbs, 0.05 mM β-Mercaptoethanol, 0.01 M hepes ו 1% פניצילין/סטרפטומיצין (שכותרתו כבינונית B).
- הסר את הצינור שבו תאי T הרגולציה מועשרים מן המגנט. הוסף 2.5 mL של פתרון A אל הצינור ולערבב על ידי בעדינות ליטוף למעלה ולמטה עבור 2-3 פעמים. לשים את הצינור בחזרה לתוך המגנט, דגירה עבור 5 דקות, ולאחר מכן בזהירות לשפוך ולמחוק את supernatant. חזור על שלב זה עוד שלוש פעמים.
- השהה מחדש את תאי T הרגולטורים המועשר ב-2 מ ל של בינונית B.
- שניהם מטוהרים בתאי T קונבנציונאלי ותאי T הרגולציה עם 100 U/mL היל-2 לילה או לפחות 4 h ב 37 ° c בחממה מחולל לחות עם 5% CO2 לפני שנעשה שימוש לפונקציונליזציה זיז.
- הכנה לתאים דנדריטים
- הכנת פתרון פיראניה, תערובת של 30% H2O2 (30%) ו 70% H2כל כך4 (conc) (v/v). לאט לשפוך 3 מ ל של H2O2 לתוך 7 מ ל של h2כל כך4 תחת ערבוב וקירור קבוע.
התראה: הפתרון פיראניה הוא מאוד מאכל, והוא יכול לצרוב ולהשמיד רקמות הגוף. לכן, בטוח יותר להשתמש בתמיסה פיראנה תחת ברדס וללבוש ציוד בטיחות מתאים, כמו התערובת יהיה להתיז סביב הגביע. לנטרל את הפתרון עם NaOH ל-pH 7 לאחר השימוש. - לטבול את שמיכות זכוכית של קוטר 24 מ"מ לתוך הפתרון פיראניה עבור 30 דקות ולשטוף ביסודיות לאחר מכן עם המים באולטרטהורים סטרילי.
- טובלים זוג מלקחיים מחודדים ב-75% אתנול במשך 30 דקות לחיטוי קר.
- הציגו את שמיכות הזכוכית הנקוות לצלחת התרבות בעלת 6 היטב על ידי הפינצטה.
- להטות את הצלחת 6 ס מ לתרבות פלסטיק שבה DC 2.4 תאים היו טרום תרבותית עם 4 מ ל של בינונית B ומכה את כל המדיום. הוסף 2 mL של PBS לתוך צלחת התרבות כדי לשטוף DC 2.4 תאים ולמחוק PBS. חזור על צעד שטיפה זה פעמיים נוספות.
- הוסף 1 מ ל של 0.25% טריפסין EDTA לצלחת התרבות עבור 2 דקות. הוסף 1 מ ל של בינונית B כדי תבשיל זה כדי לסיים את תגובת העיכול האנזים. העבר את השעיית התא המתעכל לשפופרת של 15 מ ל.
- צנטריפוגה את השעיית התא ב 500 x g עבור 5 דקות ו-dc השעיה מחדש 2.4 תאים בצפיפות של 2 x 105 תאים/mL במדיום B.
- זרעי DC 2.4 תאים על שמיכות זכוכית הכין בשלב 1.4.4 ו-דגירה את התאים לילה בחדר מחולל לחות ב 37 ° c עם 5% CO2.
הערה: כדי למדוד כוחות האינטראקציה בין שני תאים בודדים, ריכוז נמוך יחסית של DC 2.4 תאים (כלומר, < 10% שליטה) הוא הכרחי כדי להיות מרווח הולם בין תאים.
- הכנת פתרון פיראניה, תערובת של 30% H2O2 (30%) ו 70% H2כל כך4 (conc) (v/v). לאט לשפוך 3 מ ל של H2O2 לתוך 7 מ ל של h2כל כך4 תחת ערבוב וקירור קבוע.
- הכנת שלוחה AFM
הערה: מנופים שמתאימים לניסויים באמצעות ספקטרוסקופיית בודד, הם אלה עם קבועי מעיין נמוכים, בדרך כלל בטווח של 0.01-0.06 N/m. כאן, מנופים רכים התלויה פחות עבור תאים בודדים ופונקציונליות חלקיקים בודדים אחיד.- נקו את המנופים על ידי טיפול פיראניה או פלזמה או UV-אוזון.
- הר את הזיז הנקי לראש סריקת AFM.
- הכן תא מדגם נקי מלא מים טהורים לכייל את הזיז בתמיסה המים על ידי הפעלת עקומת כוח על מצע הזכוכית כדי לקבל את הרגישות (השיפוע של התאמה ליניארית על החלק הדוחה של העקומה מתקרב) ולאחר מכן הקלטת ספקטרום רעש תרמי כדי לחלץ את קבוע האביב בהתאם למדריך ההוראה של AFM.
- הסר את ראש סריקת AFM מהפתרון, לשטוף את הזיז רכוב עם כמה טיפות של אתנול טהור, ולשמור את הזיז יבש על הראש סריקה.
- חיבור תאי T בודדים לזיז
- מחממים את מארז התאים החיים עם 5% CO2 ב 37 ° c.
- הר שמיכות זכוכית עם DC 2.4 תאים גדל על זה משלב 1.4.8 הרכבת למדגם קאמרית, להוסיף 600 μL של בינונית B לחדר מיד, ולאחר מכן לשים את ההרכבה על הבמה AFM לדוגמה.
- הוסף CD4 להוסיף לחדר הדגימה את התאים הרגילים או הרגולטורים של היל -2.
הערה: נפח הדגימה הכולל לא יעלה על 1 מ ל. - המתן עד תאי CD4 + T שנוספו מיושבים במלואם בתחתית הכיסויים.
הערה: בועות אוויר יגרום הפרעה גדולה לניסוי, ולכן, מומלץ להימנע כל בועות אוויר בשלב 1.6.2 ו 1.6.3. - הוסף טיפה של 2 μl של דבק ביולוגי על הקצה של הזיז רכוב עם פיפטה כפי שמוצג באיור 1 ולאחר מכן למקם את ראש הסריקה על הבמה לדוגמה במהירות, ובכך לאפשר את הזיז מצופה עם דבק תואם ביולוגי לטבול ב פתרון.
התראה: אין לגעת בבלוק הזכוכית או בזיז עם קצה הפיפטה. מכיוון שדבק ביולוגי המשמש כאן הוא נוטה חמצון באוויר, שלב זה צריך להיעשות מהר ככל האפשר. - אתר תא T בריא מתחת לקצה של הזיז מתחת למיקרוסקופ על ידי הזזת שלב המדגם ולאחר מכן להתאים בעדינות את המיקום על ידי הזזת ראש הסריקה.
הערה: תא CD4 + T בריא בדרך כלל כולל גודל גדול יחסית, קצוות חלקים וtransmissive אופטית בדימות השדה הבהיר. - הנמך את הזיז באופן ידני עם גודל השלב החל מ-50 יקרומטר ולאחר מכן ל-10, 5, 2 ו-0.5 יקרומטר בהדרגה על-ידי שליטה על מנועי stepper. להחזיק את המיקום של מנועי stepper ולהתאים את המיקום של הראש סריקה ליישור טוב יותר בין קצה הזיז ואת התא, פעם הזיז הופך קשר המשרד עם תא T היעד כפי שצוין על ידי עקירה קטנה של קרן הלייזר מיקום בגלאי התמונות התואם לטווח הכוח האופייני של 0.5-1.5 nN.
הערה: ניתן לבצע שלב זה גם על-ידי הפעלת מידה יחידה בודדת שבה נקודת ההגדרה (הכוח המוחל על התא) וזמן יצירת הקשר יכולים להיות מוגדרים היטב בתוכנה. עם זאת, בשל האופי הלא דביק של תאים T, הגישה הידנית מספק גמישות רבה יותר בשליטה מכוון, מיצוב, זמן יצירת קשר מאשר האוטומטי מתקרב וזה עובד באופן אמין עבור הדבקה תא T. ניסויים בעתיד צריכים לנסות הן את המדריך והן אוטומטית מתקרבים לגלות מה עובד טוב יותר עבור מערכות העניין שלהם. - למשוך את הזיז אחרי 30 של מגע.
הערה: אם התא נע עם הזיז, הקובץ המצורף מצליח. אם לא, חזור על שלב 1.6.6 אך על תא T אחר. הדבק התואם ביותר. מתחמוצת בקלות שלב 1.6.5-1.6.7 צריך להסתיים בתוך 5 דקות. בנוסף, אם אותו הזיז נכשל שלוש פעמים על הקובץ המצורף לתא T, יש להשתמש בזיז חדש, וההליך המצורף צריך להתחיל שוב משלב 1.5.2.
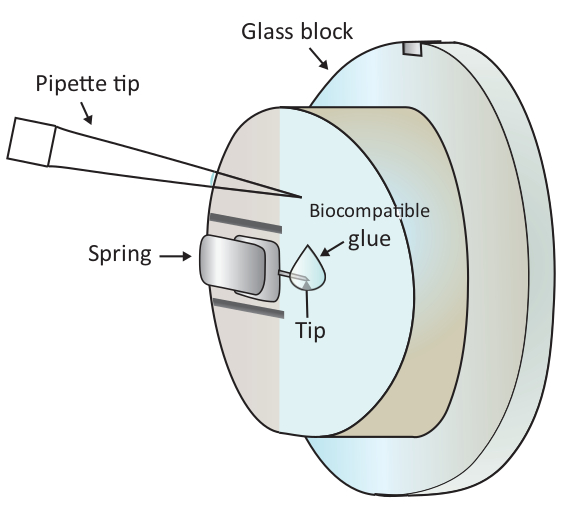
איור 1: ייצוג סכמטי של הוספת טיפה קטנה של דבק ביולוגי על הזיז הנטען. הזיז הוא רכוב באמצעות קפיץ לחסום את מחזיק הזכוכית המותקן בראש סריקת AFM (לא מצויר כאן). כאשר ראש הסריקה עומד על משטח מפולס, הזיז מונחה אנכית כמוצג בציור. ניתן להוסיף לקצה הזיז באמצעות מיקרו-פיפטה על שני הדבק התואם ל-μL. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- כפיית ספקטרוסקופיה של תא T בודד/תא הדנדריטי אינטראקציה
הערה: כדי לבדוק אינטראקציות תא/תאים, afm עם טווח Z גדול יותר מאשר 10-15 יקרומטר קונבנציונאלי נדרש כדי להפריד באופן מלא את שני התאים. AFM משמש כאן יש Z-טווח של 100 μm, אשר מספיק כדי להפריד תא T מתא הדנדריטים לאחר מגע תא/תא.- הצב את התא T המצורף מעל לתא DC 2.4 נפרד על-ידי הזזת השלב לדוגמה ו/או ראש הסריקה (ראה איור 2).
- הגדר פרמטרים נכונים והפעל ספקטרוסקופיית כוח.
הערה: הגדרות המפתח הבאות משמשות בדרך כלל: Setpoint 0.5 nN, אורך מושך 50 μm, תנועת Z מהירות קבועה, הרחבת מהירות 5 μm/s, צור קשר זמן 10, כוח קבוע של מצב עיכוב. עבור כל זוג T-DC, 20 חוזר של עקומות כוח נאספים ומינימום של 14 עקומות כוח משמשות לניתוח נוסף. - הר שלוחה חדשה ומנוקה, כיול אותו במים טהורים כמו בשלב 1.5.3, וחזור לדגימת תאים T-DC כדי לחזור על שלב 1.6 ו 1.7 עבור זוג T-DC אחר. בדיקה לפחות 5 זוגות לכל תנאי.
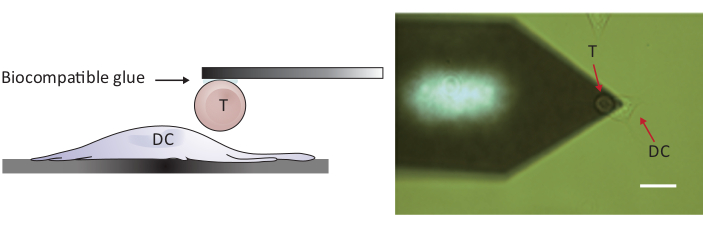
איור 2: קביעת התצורה הניסיונית של בדיקת כוח בין תא T יחיד לבין DC. (א) רישום סכמטי של התצורה הניסיונית שבה תא T המחובר לזיז מובא ל-DC שגדל על המצע לחיטוט בכוח. (ב) תמונת שדה בהירה של שלוחה בעלת פונקציונליות תא T ו-DC. סרגל בקנה מידה, 20 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. פונקציונליזציה לזיז עם חרוזי קלקר בודדים
- הכנה לחרוזים בודדים
- לדלל את השעיית המניה של 6 יקרומטר פוליסטירן חרוזים ב 100% אתנול.
הערה: הריכוז של פתרון חרוזים מדולל צריך להיות נמוך מספיק כך שכאשר הוסיף משטח שמיכות זכוכית, חרוזים בודדים מופרדים היטב ללא אשכולות משמעותיים לאחר אידוי הממס. - נקה את שמיכות זכוכית בקוטר 24 מ"מ עם אתנול ולהסיר כל אבק על ידי N2 האוויר זרימת.
- הר את שמיכות זכוכית מנוקה להרכבה קאמרית לדוגמה ולשים את ההרכבה על המיקרוסקופ.
- שים טיפה של פתרון חרוזים מדולל בצד שמאל אבל קרוב למרכז של coverslip (ראה איור 3) ולבדוק את המרווח בין החרוזים לאחר אידוי הממס בשדה בהיר תחת המיקרוסקופ עם מטרה 20x. המשך לשלב הבא אם החרוזים בודדים מופרדים היטב.
- לטבול טיפ מיקרופיפטה או קיסם לתוך דבק אפוקסי מעורב היטב ולאחר מכן להעביר כמות קטנה של דבק כזה לשלושה כתמים נפרדים עם נגיעות עדינות רצופים בצד ימין אבל קרוב למרכז של הcoverslip.
הערה: שלושת נקודות הדבק צריכות להיות מיושרות אנכית (ראו איור 3). הנקודה האחרונה עם הכמות הקטנה ביותר של הדבק תהיה בשימוש מאוחר יותר.
- לדלל את השעיית המניה של 6 יקרומטר פוליסטירן חרוזים ב 100% אתנול.
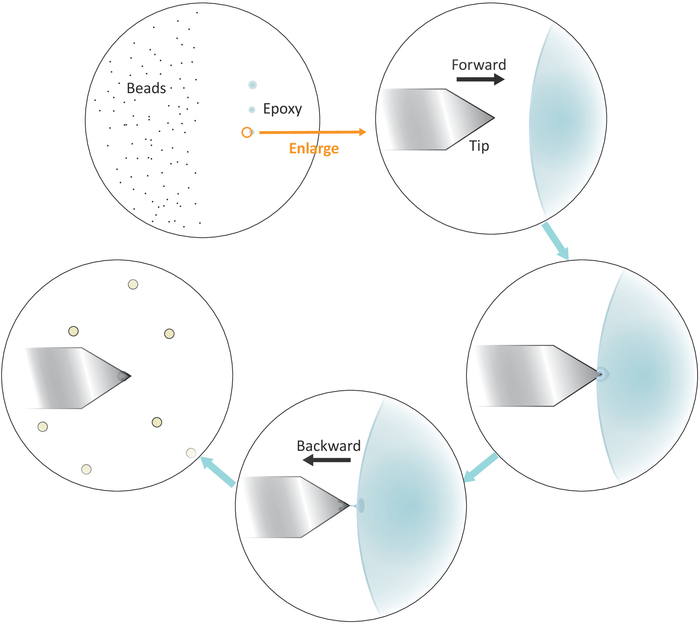
איור 3: ייצוג סכמטי של זרימת עבודה לפונקציונליזציה של חרוזים בודדים על הזיז. מופרדים היטב מיקרון בגודל חרוזים מוכנים בצד שמאל של המצע וכמות זעירה של דבק אפוקסי מועברים על הצד הימני של המצע דרך 3 נגיעות עדינות רצופות, וכתוצאה מכך 3 כתמי דבק. רק המקום האחרון עם הסכום הנמוך ביותר של הדבק (מצוין על ידי מעגל) משמש כדי לשים את קצה מאוד של הזיז. להתקרב הזיז לתוך הדבק משמאל ולאחר מכן להזיז את הזיז אחורה ברגע שהוא שקוע לתוך הדבק כדי להגביל את הדבק בקצה מאוד של הזיז. להביא את חרוז היעד מתחת הזיז וליישר אותם כראוי לפני ביצוע מגע החברה (בדרך כלל 2-5 nN) עבור הדבקה חרוז. כאשר החרוז הוא מתפקד בהצלחה על הזיז, שלוחה חדשה יכולה להיות מותקן כדי להתחיל מחזור הפונקציונליזציה החדש. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הכנת שלוחה AFM
- טעינת שלוחה שנוקה פחות מקצה לראש סריקת AFM.
- כיול הזיז הזה באוויר עם משטח נקי כדי לקבל את קבוע האביב.
- חיבור חרוזים בודדים אל הזיז
- הצב את קצה הזיז מעל הגבול השמאלי של הכתם האחרון של דבק האפוקסי כמוצג באיור 3.
- הביאו את הזיז הקרוב לדבק לאט על ידי הנמכת מנועי הפסיעה עם גודל השלבים הקטנים.
- משוך את הזיז הרחק במהירות מן הדבק באמצעות הזזת ראש סריקת AFM לאחור (משמאל) באופן ידני פעם הקצה הוא שקוע בדבק.
הערה: ודא כי רק כמות קטנה של הדבק מדבקת בקצה הקצה. אם יש דבק מופרז על הקצה, אפשר להקטין את כמות הדבק על ידי נגיעה ואחריו על ידי הזזת הקצה על משטח ריק. - הזז את קצה הזיז על גבי חרוז יחיד מבודד היטב.
- לגשת הזיז לחרוז אחד לאט ולעשות קשר עם החברה עם חרוז (כפי שמצוין על ידי העקירה של מיקום קרן לייזר בגלאי המתאים לטווח כוח אופייני של 2-5 nN) עבור 10 במהלכו במהלכה התאמה קנס של ה מיקום ה-ip באופן מיותר מקרוב תסייע לאתר בצורה טובה יותר את החרוז בקצה מאוד של הקצה. משכי את הקצה בסוף איש הקשר.
הערה: היעלמותו של החרוז מתוך המישור המקורי מעיד על אירוע חסיד מוצלח. - Demount שונה חרוז בזהירות ולאחסן אותו בתיבת זיז לילה עבור מיצוק מלא של הדבק.
- הדמיה פלואורסצנטית של התגובה התאית של מקרופאג לחרוז אחד שנמסר על ידי AFM.
הערה: הדמיה פלואורסצנטית בוצעה על מיקרוסקופ מתוצרת בית מסוג כולל השתקפות פנימית במיקרוסקופ מבוסס על דוכן מיקרוסקופ מסחרי. מערכת הדמיה זו מצוידת 4 מקורות לייזר (405 nm, 488 nm, 561 nm, 647 nm), מציג מפצל לאיתור שני צבעים, ו אלקטרון הכפלת חיוב מצמידים המכשיר (EMCCD) עבור הדמיה שטח רחב.- לגדול 264.7 תאים גולמיים על שמיכות זכוכית ב 37 ° c ב 5% CO2 מחולל תא.
- Transfect Moesin אסין-EGFP ו-PLCδ-PH-mCherry לתאי 264.7 גולמיים באמצעות ערכת החצייה (ראה טבלת חומרים) לפי פרוטוקול של היצרן כדי להמחיש באופן מוסין ופוספרידיםליניטול 4, 5-ביספוםשנאה (PIP2) מולקולות בהתאמה.
הערה: מוסין כולל מוטיב ITAM שיכול להפעיל את Syk, שחקן מפתח בפייגוציטוזה. PIP2 ידוע לגייס מוסין לקרום התא. - לשים את שמיכות זכוכית עם תאים על הרכבה קאמרית מדגם והר ההרכבה על הבמה AFM לדוגמה.
- הר השונה חרוז לראש סריקת AFM.
- הפעל עקומת כוח באזור ריק וכבה את הכוח עם הרגישות מעקומה זו ואת קבוע האביב שנמדד בשלב 2.2.2.
- מצא תא מבודד היטב עם עוצמות של כוונות זריחה בשתי הירוקות (Moesin-EGFP) ואדום (PLCδ-PH-mCherry) ערוצים עם 488/561 ננומטר הפעלות.
- מסירת בעירום 6 יקרומטר פוליסטירן בחרוזים עם afm למשטח התא עם 1 nN כוח קבוע ו 500 s זמן יצירת קשר.
- הקלטת סדרה של תמונה פלואורסצנטית של התא במגע עם חרוז לניתוח (בדרך כלל 10 מסגרות/s).
הערה: כדי להקטין את photobleaching לבנת של fluorophores, כוח עירור נמוך יחסית צריך לשמש לחיפוש בתאי העניין. בנוסף, תרמית עירור לסירוגין יכול להיות מועסק כדי להאריך את עקבות הזמן של הזריחה אם הדינמיקה של תגובות התא הוא בסרגל זמן איטי.
תוצאות
איור 4A מציג עקומות מרחק כוח אופייני מתוך האינטראקציה הbinding בין תא בודד-T לבין SINGLE-DC במחזור אחד של מחזור גישה. העקומה האדומה הקלה היא עקומת ההרחבה והאדום הכהה הוא עקומת הנסיגה. כיוון שעקומת ההארכה משמשת בדרך כלל לכניסות או לניתוחי קשיחות, כאן רק עקומת הנסיגה...
Discussion
AFM מבוססי תא בודד ספקטרוסקופיית התפתח להיות כלי רב עוצמה כדי לטפל במאפיינים הביופיסיים של תאים חיים. עבור יישומים אלה, הזיז צריך להיות מתפקד כראוי על מנת לחקור אינטראקציות או מאפיינים ספציפיים על תאי העניין. כאן, השיטות לצימוד תא T יחיד וחרוז מיקרון בגודל יחיד לזיז הפחות-טיפ מתוארים בהתאמה....
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי הקרן הלאומית למדעי הטבע של סין התוכנית הכללית (31370878), תוכנית מפתח המדינה (31630023) ותוכנית קבוצת מחקר חדשנית (81621002).
Materials
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
References
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved