Method Article
המושרה באור Adsorption מולקולרית של חלבונים באמצעות מערכת פרימו עבור מיקרו הפנינג כדי ללמוד התגובות לתא מטריצות חלבונים מטריקס
* These authors contributed equally
In This Article
Summary
המטרה הכללית שלנו היא להבין כיצד תאים התחושה מסחטות רמזים כי להוביל צמיחה סיבי מכוון. כאן, אנו מתארים את המתודולוגיה של adsorption מולקולרית המושרה אור של חלבונים, משמש כדי לייצר מיקרו דפוסים מוגדרים של מטריקס רכיבים מטריצות על מנת ללמוד אירועים ספציפיים השולטים אקסון הצמיחה ואת מציאת.
Abstract
תאים חשים מגוון של רמזים לחילוץ, כולל הקומפוזיציה והגיאומטריה של מטריצה החילוץ, אשר מסונתז ושופצה על ידי התאים עצמם. כאן, אנו מציגים את השיטה של Adsorption מולקולרית אור המושרה של חלבונים (LIMAP) באמצעות מערכת פרימו כטכניקת הפנינג כדי לייצר מטריצה מיקרו בדוגמת מטריקס (ECM) מצעים באמצעות יחיד או שילוב של חלבונים. השיטה מאפשרת הדפסת תבניות ECM ברזולוציה של מיקרון עם מצוינות מעולה. אנו מספקים פרוטוקול צעד-אחר-צעד ומדגימים כיצד ניתן ליישם זאת כדי ללמוד את תהליכי האיתור העצבי. LIMAP יש יתרונות משמעותיים על פני שיטות הדפסה מיקרו הקיים במונחים של קלות הדפוס יותר מרכיב אחד ואת היכולת ליצור דפוס עם כל גאומטריה או הדרגתי. הפרוטוקול יכול בקלות להיות מותאם ללמוד את התרומה של כמעט כל רכיב כימי כלפי הגורל התא התנהגות התא. לבסוף, אנו דנים בסוגיות נפוצות שיכולות להיווצר וכיצד ניתן להימנע מכך.
Introduction
בשנים האחרונות, המדע הביולוגי עשה יותר ויותר שימוש בהתקדמות שמספקת מדעי החומרים. דוגמה אחת בולטת היא המיקרו-מכשיר של מצעים, אשר ניתן להשתמש בהם כדי ללמוד תגובות סלולריות כגון הפצת תאים1,2, בידול3,4,מיכל 5,6, הגירת תאים7,8,9והפקודה הפתובה10,11. יש מספר טכניקות זמין המאפשרים את המיקרו-דפוס של מצעים, כגון פוטופוטון ההתרגשות רב-פוטכימיה12, AFM לטבול-עט ננוגרפיה13, סיכה והדפסה ישירה של הזרקת דיו14, הדפס קרן אלקטרונים15או מיקרופלואידיקה16. עם זאת, שתי טכניקות שבהן נעשה שימוש נרחב בשדה הביולוגי הן הדפסת מיקרומגע17,18,19או בעזרת מברק בעזרת לייזר3(איור 1). הדפוס בסיוע לייזר נחשב לספק תוצאות אמינות יותר במונחים של חלבון ו-יתד יציבות וכליאה התא על דפוסי, לעומת הדפסה microcontact20. גישה חדשנית יותר עבור מיקרו-הפנינג תיאר כאן הוא השימוש בספיחה מולקולרית המושרה של חלבונים21(LIMAP,איור 1 D) באמצעות מערכת זמינה מסחרית (פרימו,רשימת חומרים). לכל אחת מהשיטות יש יתרונות ומגבלות המתוארים להלן בקצרה. הדפסת מיקרומגע משתמשת בתבניות PDMS (בולים) עם מיקרו-תכונות הרצוי הנוצרות ממאסטרים ליטוגרף. בולים מודתמים עם חלבון נבחר אשר מועבר אז (חותמת) על מצע התרבות התא18(איור 1 קצת). מניקור באמצעות לייזר משתמש באור אולטרא סגול לקליב סרט אנטי-כסות22,23,24,25, חשיפת אזורים העשויים לאחר מכן להיות מצופים בחלבון הריבית (איור 1 B). בעוד שהרזולוציה הושגה עם גישות צילום, היא בטווח מיקרון25,26, רוב השיטות הללו דורשות מסכת צילום, במגע עם המדגם, או ממוקם במישור האובייקט של מטרת המיקרוסקופ23,27,28. הדרישות של מסיכות בהדפסה הן במיקרו-מגע והן בדפוס הצילום יכולות להיות מגבלה; מסיכות ספציפיות נדרשות עבור כל תבנית וגודל גיאומטריים, אשר עשוי להיות יקר וארוך זמן להפקת. בניגוד לטכניקות אלה, LIMAP אינו דורש מסכה (איור 1 D). שימוש במערכת פרימו עבור LIMAP יכול להיות אינטנסיבי בהתחלה, כי זה דורש רכישת ציוד. עם זאת, תוכנת קוד פתוח משמש לעיצוב דפוסים של כל הגיאומטריה הרצויה, מתן הרבה יותר חופש והתרת ניסויים מורכבים יותר כולל שימוש במעברי הצבע של ריכוז חלבונים. לייזר פרימו הוא נשלט ומכוון על ידי מכשיר micromirror הנשלט באופן דיגיטלי (DMD) כדי ליצור דפוסים בכל מספר של גיאומטריות מוגדרות על-ידי המשתמש. LIMAP דורש משטח התרבות להיות מצופה במולקולות המונעות מצורף לתא. פוליאתילן גליקול (יתד) הוא הנפוץ ביותר כגון "התרופה" מגיב; זה יוצר סרט צפוף נגד דבקים על משטח הזכוכית או הפלסטיק29. לאחר מכן, מאתחל תמונה מתווסף המאפשר את הסרט יתד להיות מוסר עם דיוק גבוה באמצעות מנגנון המספריים לצילום30על ידי חשיפה מקומית לאור UV תחת השליטה של DMD. אלה אזורים ללא יתד יכול להיות מצופה חלבונים כי ספוח לפני השטח חרוט לייזר, יצירת דפוס מיקרו. על ידי שינוי כוח הלייזר, כמויות שונות של יתד ניתן להסיר מן המשטח המאפשר למשתמש ליצור מעברי צבע חלבון. הסרת פג ואת ההליך ציפוי יכול לחזור ליצור דפוסים עם שניים או יותר חלבונים ברורים באותו מיקרו-באר21. מיקרו דפוסי שנוצר לספק משטחי דבק עבור תאים, המאפשר לימוד של התנהגות התא. במחקרים שלנו, אנו משתמשים מיקרו-העמקה כדי ללמוד neurite או אקסון החיפוש של קו התאים העצבי (CAD (כתיב) תאים הבדיל31) או החולדה הראשית השורש גנגליון (DRG) נוירונים, בהתאמה. כאן, אנו מתווה פרוטוקול צעד-אחר-צעד עבור LIMAP (איור 2) באמצעות מערכת פרימו הזמינה באופן מסחרי וליווי תוכנת לאונרדו. אנו מדגימים כיצד ניתן להשתמש בו ליצירת דפוסים בעלי גיאומטריות מוגדרות ומספר חלבונים, שבהם אנו משתמשים כדי ללמוד את מציאת הדגם. אנו דנים בסוגיות נפוצות שיכולות להיווצר וכיצד ניתן להימנע מכך.
Protocol
1. עיצוב תבניות דוגמת מילוי
הערה: תבניות להרטוט נוצרות עם תוכנת ציור דיגיטלי (טבלת חומרים). רישום ברמות אפורות שונות יקבע עוצמות לייזר. שימוש בתוכנה לעיצוב תבניות תבנית מאפשר יצירה מהירה של תבניות עם גיאומטריה רצויה ומעברי צבע (איור 3).
- צייר באופן דיגיטלי את תבנית התבנית הרצויה באמצעות תוכנת ציור. בחר גודל התמונה של 1824 פיקסלים אורך ו 1140 הרוחב פיקסלים (אשר במחקר זה מתאים 415 יקרומטר אורך and 260 יקרומטר רוחב). שמור את תבנית התבנית כקובץ Tiff של 8 סיביות.
הערה: פרוטוקול צעד-אחר-צעד להפקת תבניות זמין על פי בקשה למותג המסחרי את הציוד המיקרוקול (טבלת חומרים).
2. ניקוי פלזמה
הערה: התוצאות האופטימליות דורשות ניקוי פלזמה של המשטחים לפני הפרינינג, אשר יסיר את כל החומר האורגני ויפעיל את המשטח. במקרה הנוכחי, אוויר סביבתי מספיק עבור הפעלת פני השטח. מנקה פלזמה (טבלה של חומרים) שימש עם לחץ התהליך של 1000-1300 mTorr וכוח של 29.6 W עבור 1-5 דקות.
- השימוש בתחתית הזכוכית מאכל/es עם 20 מ"מ בגודל הפנימי ועובי זכוכית של 0.16-0.19 mm. לבדיקת תנאים מרובים, להשתמש בצלחת 6-היטב זכוכית בתחתית. אחרת, השתמש בצלחת אחת בתחתית הזכוכית (טבלת חומרים).
הערה: פרוטוקול שלב אחר שלב לניקוי פלזמה זמין על פי בקשה למותג המסחרי את ציוד הניקוי הפלזמה (לוח חומרים).
3. פסיבציה
הערה: שלב זה יוצר סרט אנטי-כסות המונע ספיחה של חלבונים למשטח הזכוכית. פג מציעה עמידות גבוהה לספיחה חלבון29 כסוכן מנוגד. LIMAP משתמשת ביוזם צילום כדי להסיר את פג באופן מקומי באמצעות תמונות UV. חלבון/s של עניין אז ספוח אלה משטחים ללא יתד21, יצירת מיקרו דפוסים.
- פסיבציה עם PLL-יתד
- בתנאים סטריליים, חותכים את הסטנסילים של PDMS (ראה איור 4א, ב וטבלה של חומרים) כדי להבטיח שהם מתאימים בתחתית הזכוכית הפנימית היטב, ולהסיר את הסתימות מיקרו היטב הפנימי עם מלקחיים סטרילי. מקל סטנסילים על הזכוכית היטב באמצעות מלקחיים.
- ודא כי הסטנסילים מקל היטב על הזכוכית, מניעת היווצרות בועות אוויר שיכול לגרום דליפות במהלך תהליך פסיבציה.
הערה: הסטנסילים pdms יכול גם להיות מפוברק בתוך הבית באמצעות פרוטוקולים שפורסמו18,32. - הכינו את התמיסה PLL-יתד (טבלת חומרים, 0.1 Mg/mL) בתמיסת מלח מאגור פוספט (PBS). הוסף 20 μL של פתרון PLL-יתד לכל מיקרו-היטב ו דגירה בטמפרטורת החדר, עבור 1 h.
- הסרת 15 μL של PLL-יתד מן המיקרו-בארות ולשטוף אותם חמש פעמים עם 20 μL של PBS (טבלת חומרים) מבלי לאפשר להם להתייבש.
הערה: תמיד לעזוב כ 5 μL של PBS בין שוטף. בהתחשב בנפח הקטן שלהם, המיקרו-בארות רגישים במיוחד לייבוש. ייבוש יביא מיקרו דפוסים של איכות ירודה. - או לשמור את הצלחת התרבות ב-PBS (3 מ ל) ב 4 ° צ' עד 3 ימים או להמשיך עם השלב הבא (שלב 3.1.5).
- הסרת 18 μL של PBS ממיקרו-באר יחיד (לדוגמה, השמאלית העליונה מיקרו-טוב, ראה איור 4D), להוסיף 5 μl של צילום יוזם (plpp, טבלה של חומרים) ולהשאיר 20 μl של PBS במיקרו בארות הנותרים. זה מיקרו היטב עם PLPP ישמש כדי ליצור דפוס התייחסות (ראה איור 4ד, E) במהלך שלב כיול המערכת (שלב 4). לשמור על PLPP מוגן מפני אור.
- פסיבציה עם שימור ארוך של יתד-SVA
הערה: כדי ליצור את המשטח נגד הדבקה אחד יכול להשתמש: 1) יתד מקושר ל פולי-L-ליזין (PLL-יתד, שלב 3.1) או 2) יתד-סוסיטה N-הידרוקסינימיד (יתד-SVA). ההחלטה לבחור אחת מהאפשרויות הפסיבציה תלויה באפשרויות האחסון (ראה שלב 10). מנות תרבות מודבלות עם יתד-SVA דורשים כמות כפולה של פסיבציה ו פוטוatning זמן.- הכן סטנסילים כמתואר בשלב 3.1.1.
- הוסף 20 μL של 0.01% פולי-L-ליזין (PLL, טבלה של חומרים) לכל מיקרו-היטב ו דגירה בטמפרטורת החדר עבור 30 דקות כדי pre-מעיל עם pll.
- הסרת 15 μL של PLL מתוך מיקרו בארות ולשטוף אותם שלוש פעמים עם 20 μL של מאגר HEPES 1 M (טבלת חומרים) מבלי לאפשר לבארות להתייבש.
הערה: תמיד להשאיר כ 5 μL של HEPES או PBS בין שוטף. בהתחשב בנפח הקטן שלהם, המיקרו-בארות רגישים במיוחד לייבוש. ייבוש יביא מיקרו דפוסים של איכות ירודה. - הכן את פתרון יתד-SVA. יתד-SVA פתרון (50 mg/mL ב HEPES מאגר 1M) צריך להיות מוכן טרי בכל פעם לפני השימוש. הכינו 20 μL של יתד-SVA לכל מיקרו-באר.
- מאגר HEPES חייב להיות pH בין 8-8.5. בדיקת HEPES pH לפני הכנת הפתרון יתד-SVA עם נייר pH. שוקלים יתד-SVA בצינור צנטריפוגה באמצעות סולם דיוק. הוסף מאגר HEPES ו מערבולת 30 s עד התפרקה. יתד-SVA הוא התפרקה לחלוטין כאשר הפתרון הוא שקוף.
הערה: SVA הוא אסתר המאפשרת קשירה של פג אל PLL מצופה בעבר. לאחר מאגר HEPES מתווסף ל-יתד-SVA, SVA יש מחצית חיים של 15 דקות ויש להשתמש בו מיד. - הוסף 20 μL של הפתרון יתד-SVA לכל מיקרו-היטב ומארג בטמפרטורת החדר, עבור 1 h. הסר 15 μL של יתד-SVA מתוך מיקרו בארות ולשטוף חמש פעמים עם 20 μL של PBS (טבלת חומרים) מבלי לתת לבארות להתייבש.
- הכינו את קערת התרבות לאחסון לטווח ארוך (עד 1 חודש, ראה שלב 10.2) או המשך לשלב הבא (שלב 3.2.8).
- הסרת 18 μL של PBS ממיקרו-באר יחיד (לדוגמה, השמאלית העליונה מיקרו-טוב, ראה איור 4D), להוסיף 5 ΜL של Plpp (טבלת חומרים) ולעזוב 20 μl של PBS במיקרו בארות הנותרים. זה מיקרו היטב ישמש כדי ליצור דפוס התייחסות (ראה Fi יקח 4d, E). ודא כי PLPP הוא הומוגנית על פני השטח כולו של מיקרו-באר. לשמור על PLPP מוגן מפני אור.
4. כיול מערכת
הערה: בשלבים אלה, מוקד הלייזר יותאם לסוג מסוים של כלי תרבות (שלב 4.1). דפוס התייחסות ייווצר רק אחד מיקרו-באר (שלב 4.2) ואחריו דגירה עם פתרון חלבון (שלב 4.3) כדי להבטיח את תנאי המיקוד האופטימלי של הלייזר (שלב 4.4), הכרחי כדי לקבל דפוסים חדים ומוגדרים.
- כיול לייזר
הערה: במהלך תהליך הכיול, תמונת לייזר של כיול תועלה על פני משטח זכוכית מסומן (כיול היטב, מסומן בסימון פלורסנט, איור 4ג), שצריך להניחה בפוקוס על ה מיקרוסקופ.- השתמש בסימון פלורסנט (טבלת חומרים) כדי לסמן היטב זכוכית פנימית ריקה.
הערה: לכיול היטב חייב להיות עובי זכוכית זהה (0.16-0.19 mm) כמו תבשיל התרבות שעליה מיקרו תבניות ייווצרו. אם הצלחת 6-היטב זכוכית בשימוש, ניתן להשתמש בבאר ריקה לכיול ויש לסמן עם עט פלורסנט בתנאים סטריליים. - , הפעל את המיקרוסקופ. הבמה והמחשב הפעל את ציוד ה-פרימו המיקרו-מיקרו, פתח את תוכנת מיקרו-מנג ותוכנה לאונרדו. תוכנת לאונרדו מופעלת באמצעות מיקרו-מנהל תחת תוספים. בדוק את המותגים/קטלוג מספרים של ציוד ותוכנה ברשימת חומרים.
- בתפריט ההתחלתי של לאונרדו, בחר באפשרות כיול. בדוק שקוביית הסינון הייעודית של פרימו נמצאת במיקום הנכון (נתיב אופטי) בצריח המסנן; בחר את המטרה 20X (0.75 DIC S תוכנית Fluor, לא טבעת שלב) הן על המיקרוסקופ ועל תוכנת לאונרדו.
הערה: פרוטוקול זה מותאם לגרסה 4.4 של לאונרדו. ייתכן שהפרוטוקול יצטרך להתאים לגירסאות אחרות. - הצב את הכיול המסומן בעבר היטב (איור 4ג) מעל המטרה. בחר נתיב מצלמה. להתאים את המוקד האובייקטיבי עד הקרנת הלייזר של שני הלוגו פרימו ואת קו התגים לטפל התאים שלך נמצאים בפוקוס.
- השאירו זמן חשיפה של מצלמת ברירת מחדל ב-25 ms. כוונן את עוצמת הלייזר כדי לראות את האות I מהטלה הלוגו הפרימו בצבע אפור ושאר האותיות בלבן.
- הקלט את מיקום Z של המישור המוקד, (גובה המטרה למדגם) התייחס מאוחר יותר ל-Z-מיקום הכיול. זה יהיה קירוב למוקד האופטימלי שהושג לאחר התייחסות הדור דפוס (ראה שלב 4.2-4.4).
- השתמש בסימון פלורסנט (טבלת חומרים) כדי לסמן היטב זכוכית פנימית ריקה.
- תבנית אסמכתא
- מיקום צלחת התרבות עם מיקרו-גם המכיל את התמונה יוזם (דפוס התייחסות מיקרו-טוב, איור 4ד) מעל המטרה ולבחור דפוס עכשיו בתוכנה לאונרדו.
- המחש את קצה המיקרו-באר עם אור משודר דרך המצלמה ובחר בסמל הROI מהתפריט הימני. הגדר את קוטר המעגל roi כדי 4000 יקרומטר וליישר את הקצה של ההחזר הדיגיטלי עם קצה של המיקרו-באר הנוכחי.
- ודא שיש חפיפה מדויקת בין ההחזר הדיגיטלי למיקרו-באר הנוכחי על-ידי הזזת השלב סביב הקצוות של המיקרו-באר. תנוחת ההחזר תהיה משולב לתנועות הבמה.
- בחר לנעול בתוכנת לאונרדו כדי לנעול את ההחזר במיקום הרצוי. . כבה את האור המשודר
- בחר פרימו כדי להעלות את תבנית התבנית הרצויה, שתהיה מוקרנת על ה-ROI כיחידת עיצוב (ראה איור 5). תבניות יופיעו ברשימה נפתחת הנקראת פעולות ומוצגות בתפריט פעולות בתוכנה.
הערה: יש לתכנן תבניות תבנית בעבר (ראה שלב 1) ולשמור כקובץ Tiff של 8 סיביות לפני טעינת התבנית בתוכנה. - נדרשת תבנית קטנה בלבד עבור תבנית הייחוס; לדוגמה, 3 שורות, עמודה אחת (ראה איור 4E ואיור 5ב). בתפריט השכפול , הגדר את המספר הרצוי של עמודות ושורות (שורות בתוכנת לאונרדו). לחץ על ' רענן ' כדי לצפות בתצוגה מקדימה דיגיטלית של עיצוב דוגמת המילוי.
- הגדר את מינון הלייזר בתפריט השכפול . מינון לייזר אופטימלי בהגדרה זו באמצעות PLL-יתד הוא 1390 mJ/mm2.
הערה: כוח לייזר יכול להשתנות בין 5-7.5 mW/mm2. במקרה זה, זה 7.5 mW/mm2, אשר לוקח כ 30 s כדי תבנית כל יחידת עיצוב, באמצעות מינון לייזר של 1390 mJ/mm2. מינונים גבוהים יותר של לייזר עשוי להידרש אם משטח צלחת התרבות הוא פסיב עם יתד-SVA (כמות לייזר כפולה בהשוואה ל PLL-יתד). . צריך לבדוק את זה מראש - נווטו לאזור היקפי של המיקרו-באר, (לדוגמה, חלק עליון) הרחק מהאזור העיקרי של העניין ליצירת תבניות (אזור מרכזי) של המיקרו-באר (ראו איור 4E) ובחרו ' נעל'. המתן עד להצגת התבנית.
- כוונן את המוקד אל מיקום Z של הכיול (ראה שלב 4.1.6).
הערה: מומלץ לבצע שלב נוסף של כיול מערכת אם משתמש אחר משתמש במיקרוסקופ זהה בין סיבובים photopatterning. - בחר את סמל ההפעלה כדי להתחיל בהצגה. ודא שהלייזר מופעל בתוכנה. המתן עד לסיום תהליך הגימור. משך התצוגה יוצג בחלונית ' זמן משוער '. בגרסת התוכנה של לאונרדו 4.4 הדמיה מסתיימת כאשר כל הפעולות מופיעות כחולות בתפריט החזותי.
- דגירה של חלבון בדפוס התייחסות
- תחת תנאים סטריליים, לשטוף את תבנית הייחוס מיקרו-טוב שלוש פעמים עם 20 μL של PBS כדי להסיר את PLPP.
- הוסף 20 μL של חלבון ECM מתויג בצורה פלואורומטר (10 μg/mL למינציה, פילברון או פיברינוגן ב-PBS, ראה טבלת חומרים וצעד 6) לתבנית ההתייחסות מיקרו-באר. דגירה בטמפרטורת החדר עבור 10-20 דקות (בהתאם לחלבון) מוגן מפני אור (לעטוף את הצלחת ברדיד אלומיניום).
- לאחר דגירה, להסיר 18 μL של פתרון חלבון ולשטוף שלוש פעמים עם 20 μL של PBS; לשמור על מיקרו בארות שאינם משמשים כדי ליצור דפוס התייחסות (ראה איור 4ד, E) ב 20 μl של PBS.
- הדמיה והגדרה של מוקד לייזר אופטימלי
- להמחיש את דפוס ההתייחסות באמצעות מיקרוסקופ אפידלנטית, המטרה 20X ותוכנה מתאימה (לבדוק את התוכנה בשימוש במחקר זה בטבלה של חומרים). תבנית ההתייחסות צריכה להיות גלויה באזור ההיקפי (לדוגמה, אזור הבאר העליון), שבו נוצרה תבנית ההפניה (ראה איור 4E).
- כוונן את המיקוד בקצות התבנית דרך נתיב המצלמה. הקלט את מיקום Z בהתאם למיקוד הטוב ביותר בתבנית ההפניה. מיקום Z מותאם זה יהיה מוקד הלייזר האופטימלי המשמש לצורך המשך הפעולה הבאה.
5. הגדרת תוכנה ופוטוטרנינג
הערה: לאחר כיול המערכת הושג (שלב 4), המשתמש יעלה את תבניות התבנית הרצויות (תצורת תבנית, איור 5) עבור photopatterning, עם אפשרות ליצור דפוסים עבור חלבונים אחד או מספר מרובים בכל מיקרו-טוב. תהליך מיקרו-הדנינג כרוך בתהליכי דגירה ושלבי אינקובציה של חלבונים (ראה איור 2).
- תחת תנאים סטריליים, להסיר 18 μL של PBS מכל מיקרו בארות ולהוסיף 5 μL של PLPP לכל מיקרו-באר. ודא כי PLPP הוא הומוגנית על פני השטח כולו של מיקרו-בארות.
- מקמו את קערת התרבות עם תבנית ההתייחסות מיקרו-טוב (איור 4D, E) מעל המטרה ולבחור דפוס עכשיו בתוכנה לאונרדו.
- המחש את המיקרו-באר עם אור משודר דרך נתיב המצלמה ובחר בסמל הROI. להגדיר את קוטר ההחזר של התשואה כדי 4,000 יקרומטר וחופפים את הקצה של ההחזר הדיגיטלי לקצה של מיקרו-באר הנוכחי. בחר נעילה.
הערה: הצורה והקוטר של ה-ROI תלויים בעיצוב ובגודל של סטנסיל PDMS הנמצא בשימוש. לדוגמה, אם באמצעות 5,000 x 5,000 יקרומטר pdms בריבוע סטנסילים, להשתמש 5,000 x 5,000 יקרומטר בריבוע ROI. - חזור על השלב החופף (שלב 5.3) עבור כל מיקרו-באר של המנה. עם סיום הביצוע, כבה את האור המשודר.
- נווט אל מרכז תבנית הייחוס מיקרו-טוב, הרחק מאזור תבנית הייחוס, ובחר פרימו כדי להעלות את תבנית התבנית הרצויה, אשר תהיה מוקרנת על ROI כיחידת עיצוב (ראה איור 5). תבניות יופיעו ברשימה נפתחת הנקראת פעולות ומוצגות בתפריט פעולות בתוכנה.
הערה: תבניות תבנית צריכות להיות מתוכננות לפני הניסוי ונשמרות כקובץ Tiff של 8 סיביות לפני טעינת התבנית בתוכנה. - על מנת ליצור תבנית לאורך כל המיקרו-באר, יש לשכפל את יחידת העיצוב. יחידת עיצוב מכסה סביב 0.1 מ"מ2 של אזור מיקרו-באר. בתפריט השכפול , הגדר את המספר הרצוי של עמודות ושורות (קווים בתוכנה) (ראה איור 5).
- כדי ליצור תבנית רציפה, התאם את הריווח בין עמודות וקווים; במחקר זה, דפוסים של פסים רציפים מתקבלים באמצעות-20 עד-35 יקרומטר מרווח (מרווח שלילי) בין עמודות. ריווח שלילי זה יוצר חפיפה בין יחידות עיצוב (איור 5ב, ג).
- הגדר את מינון הלייזר בתפריט השכפול . מינון לייזר אופטימלי בהגדרה זו באמצעות PLL-יתד הוא 1390 mJ/mm2. משך התצוגה יוצג בלוח הזמן המשוער .
הערה: במקרה זה כוח לייזר הוא 7.5 mW/mm2, נטילת כ 30 s לתבנית כל יחידת עיצוב, באמצעות מנה של 1390 mJ/mm2. לדוגמה, יחידת עיצוב (0.1 mm2) משוכפל ב 4 עמודות ו 4 שורות (סביב 1.6 mm2), ייקח 8 דקות להיות בדוגמת. מינונים גבוהים יותר של לייזר עשוי להידרש אם משטח צלחת התרבות הוא פסיב עם יתד-SVA (כמות לייזר כפולה בהשוואה ל PLL-יתד). - בחר באפשרות ' נעל ' והמתן עד שהתבנית מוצגת כמעט.
- כדי לעדכן את הפרמטרים של תבנית, לחץ על הפעולההקשורה ולאחר מכן בטל את נעילת ועדכן את הפרמטרים. בחר באפשרות Lock שוב לאחר השלמת עדכון התבנית.
- הדפוס של חלבונים מרובים באותו מיקרו היטב (סיבובים מיקרו המטחים רציפים) דורש יישור מדויק של דפוסי. כדי להשיג יישור כזה, להעלות את כל ערכות של תבניות הרצוי בו (דפוסים של סיבובים photopatterning הראשון והשני).
- הגדר את פרמטרי השכפול והמינון של תבניות התבנית. לאחר הגדרת הפרמטרים, תבניות יופיעו כפעולות ברשימת הפעולות . שמור תצורת תבנית זו כקובץ בתוכנה (ראה איור 5ד).
- ברשימה פעולות , בחר רק את הפעולות הספציפיות שיהיו בתבנית במהלך הסיבוב הראשון ובטל את הבחירה בפעולות שיהיו בתבנית במהלך הסיבוב השני (ראה איור 5ד).
- נווט לאזור שבו תבנית ההפניה הופקה בשלב 4.2 (לדוגמה, האזור העליון של תבנית ההפניה מיקרו-טוב, ראה איור 4E). כוונן את המוקד למיקום Z האופטימלי (מתקבל בשלב 4.4).
הערה: מומלץ מאוד לבחור מערכת המיקוד המושלמת על המיקרוסקופ שנעשה בו שימוש (אם זמין), אשר מבטיח כי מיקום Z האופטימלי עבור המרכז יהיה נשמר בכל תהליך photopatterning כולו. - בחר את סמל ההפעלה כדי להתחיל בהצגה. משך התצוגה יוצג בחלונית ' זמן משוער '. בגרסת התוכנה של לאונרדו 4.4 הדמיה מסתיימת כאשר כל הפעולות מופיעות כחולות בתפריט החזותי .
6. דגירה של חלבון
הערה: מיקרו-בארות מודוגות עם חלבונים ECM (רצוי מתויג באמצעות פלואורוסקופים). אלה יהיה רק לאגד את האזורים שבהם פג היה ביקע באמצעות תהליך photopatterning המתואר בשלב 5. כל טוב מכיל סטנסיל PDMS עם 4 מיקרו-בארות, אשר יאפשרו בדיקה 4 מצבים שונים בו זמנית, למשל, דגירה של חלבון שונה בכל מיקרו-באר (ראה איור 4ד).
- השתמש בחלבונים בעלי תוויות פלואורוסקופים (לדוגמה, למינציה, fibronectin או פיברינוגן מצופף אדום או ירוק fluorophores) על מנת להמחיש את דפוסי מיקרו (ראה שלב 6.7 ו 9.4). לחילופין, חלבונים ללא תווית נספחת יכול להיות דמיינו בשלבים מאוחרים יותר באמצעות immunofluorescence.
הערה: חלבונים ECM (לדוגמה, fibronectin) ניתן לתייג באמצעות פרוטוקולים קיימים33 ו מסחרית זמינים ערכות תיוג הקרינה (כלומר, אלקסה 488 ערכת תיוג), או לרכוש בקלות בתווית (למשל, במצועית fiברינוגן-488 או הפלורסנט הלמינציה-אדום, ראו טבלת חומרים). - בתנאים סטריליים, להכין את הריכוז הרצוי של חלבונים ECM (10 μg/mL למינציה, fibronectin או פיברינוגן ב-PBS, ראה לוח חומרים וצעד 4.3).
הערה: פלואור מתויג חלבונים ECM הם רגישים באור, צריך להיות מוגן מפני אור (צלחת לעטוף ברדיד אלומיניום) ויש לשמור על קרח בכל עת. - בתנאים סטריליים, לשטוף את מיקרו בארות שלוש פעמים עם 20 μL של PBS כדי להסיר את PLPP.
- הסרת 18 μL של PBS מכל מיקרו-בארות ולהוסיף 20 μL של פתרון חלבון ECM לכל מיקרו-באר. דגירה בטמפרטורת החדר, עבור 20-30 דקות ולהגן מפני אור.
הערה: שעות דגירה של ציפויים אופטימליים עשויות להשתנות בהתאם לסוג ולריכוז החלבונים. - לאחר הדגירה, להסיר 15 μL של פתרון חלבון ECM ולשטוף את מיקרו בארות שלוש פעמים עם 20 μL של PBS.
הערה: תמיד לעזוב כ 5 μL של PBS בין שוטף. - אם מדובר רק בחלבון אחד (סיבוב אחד של מיקרו-מיקרונג), המשך לאחסון המנה התרבותית (שלב 10) או לציפוי תאים (שלב 11, וראה איור 2). אם ביצוע סיבוב שני של מיקרו-מחשב עם חלבון שונה באותו מיקרו-באר, להמשיך או לאחסון של צלחת התרבות (שלב 10) או כדי לחסום אתרי איגוד מסוימים (שלב 7, ולראות איור 2).
- שלב בקרת איכות אופציונלי: הדמיה ודפוסים מודפסים של תמונה באמצעות מיקרוסקופ אפיצילי לפני התאים הציפוי. בחרו ערוצי פלורסנט מתאימים והתאימו את זמני החשיפה בהתאם.
הערה: כדי להשוות את עוצמת הקרינה הפלואורסצנטית של דפוסים בין ניסויים, חיוני להשתמש באותם זמנים חשיפה עבור חלבונים זהים.
7. חסימת אתרי קשירה לא ספציפיים (רק עבור תבניות חלבון מרובות)
הערה: מיקרו-המטנג עם מספר חלבונים באותו מיקרו-היטב כרוך שלבים רציפים (ראה איור 2). סוכן חוסם (PLL-יתד או BSA) מתווסף מיקרו בארות כדי למנוע מחייב צולבות, אשר מתרחשת כאשר חלבון מודלת השני (שלב 9) נקשר חלבון מודמת הראשון (שלב 6), ובכך הימנעות תערובת של חלבונים בתוך דפוסי.
- תחת תנאים סטריליים, להוסיף 20 μL של PLL-יתד (0.1 mg/mL ב-PBS) או BSA (1% BSA ב-PBS) כצעד חוסם כדי למנוע מחייב צולב.
הערה: חסימת היעילות עשויה להשתנות בהתאם לאופי החלבונים הנמצאים בשימוש ולזיקה שביניהם. מומלץ לבדוק הן PLL-יתד ו-BSA כסוכני חסימת מראש (איור 10D-I). - הסוכן החוסם של הגנה בטמפרטורת החדר במשך 1 h ולהגן מפני אור. הסרת 15 μL של סוכן חוסם ולשטוף את כל מיקרו בארות שלוש פעמים עם 20 μL של PBS. תמיד להשאיר כ 5 μL של PBS בין שוטף.
- הסרת 18 μL של PBS מכל מיקרו בארות ולהוסיף 5 μL של PLPP לכל מיקרו-באר, להבטיח כי PLPP הוא הומוגנית על פני השטח כולו של מיקרו בארות.
8. סיבוב שני של פוטואטנינג (רק עבור דפוסי חלבון מרובים)
הערה: לאחר סיבוב הראשון של photopatterning והדגירה של חלבון, מיקרו דפוס נוצרת. בסיבוב השני של photopatterning, התבנית עבור החלבון השני ייווצר באותו מיקרו-באר (ראה איור 2C ואיור 5ד). בתוכנה, בחר את תבניות התבנית הנכונות (פעולות), שיהיו מקושטות במהלך סיבוב זה (ראה איור 5ד).
- נווטו למיקרו-באר הראשון (איור 4ד). ודא חפיפה מתאימה בין ההחזר הדיגיטלי למיקרו-באר.
- טען את תצורת התבנית שנשמרה בעבר (שלב 5.12) ובחר את הפעולות שיהיו בתבנית במהלך הסיבוב השני של הפוטואטנינג (בטלו את הבחירה בפעולות מסיבוב ראשון, ראה איור 5ד).
- בחר את סמל ההפעלה כדי להתחיל בהצגה. ודא שהלייזר מופעל בתוכנה.
9. הסיבוב השני של דגירה החלבון (רק עבור דפוסי חלבון מרובים)
הערה: בחלק זה של הפרוטוקול, חלבון בעלי תווית שכותרתו/s יהיה מודחים על מנת התרבות לאחר הסיבוב השני של photopatterning.
- תחת תנאים סטריליים, לשטוף את מיקרו היטב שלוש פעמים עם 20 μL של PBS כדי להסיר את PLPP. הסר 18 μL של PBS ולהוסיף 20 μL של פתרון חלבון ECM לכל מיקרו-באר. דגירה בטמפרטורת החדר עבור 20-30 דקות ולהגן מפני אור.
הערה: שעות דגירה של ציפויים אופטימליים עשויות להשתנות בהתאם לסוג ולריכוז החלבונים. - לאחר הדגירה, להסיר 15 μL של פתרון חלבון ECM ולשטוף את מיקרו בארות שלוש פעמים עם 20 μL של PBS. תמיד להשאיר כ 5 μL של PBS בין שוטף.
- המשך לאחסון של כלי תרבות (שלב 10) או לציפוי תא (שלב 11 וראה איור 2).
- שלב בקרת איכות אופציונלי: שימוש במיקרוסקופ אפיציאני, הדמיה ודפוסים מודפסים בתמונה לפני התאים הציפוי. בחרו ערוצי פלורסנט מתאימים והתאימו את זמן החשיפה.
הערה: כדי להשוות את עוצמת הקרינה הפלואורסצנטית של דפוסים בין ניסויים, חיוני להשתמש באותם זמנים חשיפה עבור חלבונים זהים.
10. אחסנה של מיקרו דפוסים
הערה: ניתן לאחסן מיקרו-תבניות עם חלבונים מבוססי האדסורמיטה בשלבים שונים של הפרוטוקול (ראה איור 2). אם מיקרו-דפוס עם חלבונים מרובים, מיקרו דפוסים ניתן לאחסן לאחר הסיבוב הראשון של המיקרו-מיקרו או לאחר שני סיבובים רציפים של מיקרו הדפוס הושלמו (ראה איור 2ב).
- כאשר פסיב עם PLL-יתד, לאחסן את מיקרו דפוסי ב-PBS (3 מ ל) ב-4 ° c עד 3 ימים.
- אם צלחת התרבות היה פסיב עם יתד-SVA, מיקרו דפוסים ניתן לאחסן עד 1 חודש. על מנת לעשות זאת, לשטוף מיקרו דפוסי אינטנסיבי עם מים כפולים מזוקקים מזוקק ויבש עם אקדח אוויר סטרילי של ארגון או חנקן, למרות אוויר נורמלי יכול לשמש גם. לאחר ייבוש, מיקרו דפוסי ניתן לאחסן ב 4 ° צ' עד 1 חודש (צוות התמיכה של מערכת פרימו, תקשורת אישית).
11. ציפוי תאים
הערה: במהלך השלבים הבאים, התאים יהיו מצופים בתבשיל התרבות המוכן בדוגמת מיקרו. במחקרים אלה, קו התאים העצבי (תאי CAD) משמש31. עם זאת, ניתן לכוונן פרוטוקול זה כדי ללמוד סוגי תאים אחרים של העניין (התאמת פרוטוקול ציפוי התא כנדרש).
- להבדיל תאים CAD עבור 48 h באמצעות בידול בינוני (DMEM שיושלם עם 1% גלוטמין, ללא סרום, עם 1% עט/דלקת, ראה טבלה של חומרים).
- צלחת 1 מ ל של בינוני עם תאים בתוך הזכוכית הפנימית היטב, כיסוי כל מיקרו בארות ומקום את הצלחת התרבות ב 37 ° c, 5% שיתוף חממה2 .
תוצאות
בעקבות הפרוטוקול הנ ל תוצאות משטחים בדוגמת מיקרו, מצופה חלבון ECM/s של עניין. אנחנו משתמשים בדפוסים האלה. כדי לעקוב אחרי החיפוש העצבי
תבניות שנוצרו אמורות להיות ייצוג מדויק של התבנית. דוגמה מוצגת באיור 6 כאשר תבנית תבנית דיגיטלית (איור 6a) המייצגת יחידת עיצוב אחת (איור 5B), הביאה למיקרו-תבניות מוגדרות, החל מ -20 עד 2 יקרומטר רוחב, מצופה בתווית פיברינוגן (איור 6ב). באמצעות imagej, מדידות אינטנסיביות הזריחה הושגו הן אנכית (איור 6ג) ואופקית (איור 6E) לאורך הפס ומאזור הרקע המקביל 15 יקרומטר מעל כל פס. מדידות הרקע המופלו ממידות התבנית עבור כל רוחב פסים.
מגבלה אחת של המערכת היא כי אפקט הקצה ניתן לצפות (איור 6B, פס עליון) בעת הדפסה תכונות ≥ 20 μm, עם אות בעוצמה גבוהה יותר בקצוות דפוס בהשוואה למרכז (איור 6D, השיא הראשון של פרופיל עוצמת פלורסנט). בניסויים שלנו מגבלת הרזולוציה היה כ 2 μm; ברוחב זה הבחנו בירידה משמעותית (על-ידי כ-50%) בעוצמת הקרינה הפיבריעית בהשוואה לעוצמת הפסים הרחבים (איור 6F, G). הפרנינג באמצעות מערכת פרימו והפרוטוקול המתואר כאן הפיק דפוסים, עם סטיית התקן הגבוהה ביותר של עוצמת פלורסנט ממוצע נמדד עבור 2 יקרומטר רוחב מארבע יחידות עיצוב משוכפל בודדים (איור 6 G). וריאציה בתוך הפסים בדוגמאות נמצאה גם היא נמוכה; מקדם וריאציה נע בין 3 אל 10%, עם 20 יקרומטר ו 2 יקרומטר פסים בעל וריאציה פנימית הגדול ביותר. הדבר עשוי להיות תוצאה של אפקט הקצה ומגבלת הרזולוציה של המערכת, בהתאמה. שים לב כי עבור מדידות אלה רק מדדנו את העוצמה במרכז הפסים, כדי למנוע את התאורה האחידה כתוצאה מהמטרה המשמשת לרכישת תמונות אלה (רשת כהות, איור 6E).
ניסויים מסוימים עשויים לכלול שאלות הדורשות ריכוזי חלבון מוגדרים, אשר ניתן להשיג בשתי דרכים: 1) שינוי ריכוז החלבון (איור 7א, ב). דגירה עם ריכוזים שונים של למינציה, התוצאות בעוצמות שונות של כוונת הזריחה, הגדלת עם ריכוזי חלבון גבוהים יותר (איור 7ב). 2) מינון לייזר המשמש לקליב הסרט נגד דבקים (יתד) יכול להיות מגוון. מינונים גבוהים יותר של לייזר תסיר את הסרט מנוגד במידה רבה יותר, יצירת אתרים מחייבים יותר עבור חלבונים של עניין (איור 7ג, ד) וכתוצאה מכך שונות העוצמות הזריחה שונים, הגדלת עם לייזר גבוה יותר מנות (איור 7ד).
שינוי המינון לייזר מאפשר את הדור של מעברי החלבון בתוך אותה תבנית. הדבר מוצג באיור 8A, כאשר תבנית מעבר צבע תוכננה באמצעות רמות שונות של גוני אפור, משחור (ללא כוח לייזר) ללבן (כוח לייזר מרבי).
עוצמת לייזר היא פרופורציונלית לרמת הסולם האפור של התבנית (החל מ -0 עד 255 בתמונה של 8 סיביות), יצירת מעברי צבע של תאורה UV. המדידה של פרופיל העוצמה הפלואורסצנטית לאורך הפס ההדרגתי היא לינארית בתבנית התבנית (איור 8ב) ובתבנית מעבר הצבע שנוצרה (איור 8C, D). הדבר משתנה בין כל פסים במעבר הצבע בתוך תבנית זהה ומעבר צבע (איור 8B, D). דור של מעברי צבע כאלה הוא מאוד שימושי ומסייע לחקות בסביבות vivo שבו תאים לעתים קרובות להגיב מעברי צבע של חלבונים אקטיביים34,35,36,37.
תאים לחוש שינוי סביבות החילוץ אבל בחני אומר כי לאפשר את המחקר של התנהגות התא כאשר התאים מפגש שינויים כאלה מוגבלים. LIMAP ניתן להשתמש מיקרו-דפוס עם חלבונים מרובים באותו מיקרו-באר. דוגמאות מוצגות באיור 9 שבו נוצרו דפוסים מוצלבות עם פסים של פיברוטין (אופקי) ולמינציה (אנכית). בעת יצירת דפוסים עם מספר חלבונים, חשוב להשתמש בצעד החוסם בין הדגירה הראשונה והשנייה של החלבון, כדי למנוע כריכה מקושרת של חלבונים (ראה שלב 7). היעילות החוסמת עשויה להשתנות בהתאם למאפיינים הביוכימיים של החלבונים המשמשים לציפוי ואנו מייעצים בדיקת מאגרי חסימה מספר כולל PLL-יתד (0.1 mg/mL) ו-BSA (1%). כדי להעריך את האפקט הזה מחייב צלב, ביצעת מדידות אינטנסיביות הקרינה באמצעות ImageJ (איור 9) ואנו הראו כי מחייב החוצה ניתן לצמצם באופן דרמטי, באמצעות מאגר pll-יתד (0.1 Mg/mL) עבור fibronectin ולמינציה רוחב דפוסים (איור 9ד, ח).
הצלבים שנוצר שימשו עבור בחני הסלולר בתאי CAD (איור 10A, B) או השורש החולדה גנגליון (drg) נוירונים (איור 10ג). Neurites שלהם (CAD) ו אקסונים (drg) גדלים לאורך קווים שונים. תאי CAD משמשים כמודל עצבי מאז הם מראים אינטגרציה דומה בפרופיל הביטוי לעומת הנוירונים העיקריים והם עדיין מציגים גביעי צמיחה עשיר actin לאחר 48 h בתרבות (איור 10B), מה שהופך אותם מתאים לחיפוש חקרים.
על מנת לחקור את ההשפעות ציטוטוקסיים אפשרי של מיקרו דפוסי שנוצר לקראת הנוירונים הראשי, הנוירונים DRG היו מבודדים ומתורבתים על מיקרו דפוסי בעקבות פרוטוקול שפורסם בעבר38. התוצאות להפגין כי הנוירונים העיקריים לסבול את הסביבה מיקרו דפוסי (איור 10ג). אנחנו כרגע לומדים כיצד מגוון של חלבונים ecm השפעה סיבי (neurite) מגלה. ההוכחה הראשונית של מושגים שנמצאו בתאי CAD יהיה נחקר נוספת באמצעות DRG נוירונים. כדי לאמת את האיכות של מיקרו דפוסים שנוצרו, רצוי דפוסי התמונה על ידי מיקרוסקופ פלואורסצנטית כדי להבטיח את הקצוות דפוס מוגדרים היטב לפני שתמשיך ציפוי התא. במהלך תהליך הדימות, חשוב להבטיח את ההתאמה האופטית בין המיקרוסקופ למצלמה כדי להימנע מאפקט הכהות ההיקפי (רשת כהות) המשפיעה על הניתוח האחורי והפרשנות של הנתונים. בנוסף, ניתן לרכוש תמונה של אזור נטול תבנית באמצעות אותן שעות חשיפה שישמשו לתמונות התבניות ולהפחתת תמונה זו מתמונת התבנית.
לסיכום, באיכות טובה מיקרו דפוס הדור, מומלץ להעריך את ריכוז החלבון (איור 7A, B), מינונים לייזר (איור 7ג, D), רמות הרקע חלבון (איור 6E, F, H) ו- שלב חסימה יעיל (איור 9) בעת שימוש במספר חלבונים. בהחלט, את האיכות של מיקרו דפוסי שנוצר עם LIMAP הוא חיוני כדי לקבל נתונים אמינים ומופקים מן assays הסלולר.

איור 1: ערכה של טכניקות מיקרו-מדפסות: הדפסה באמצעות מיקרומגע ומכונת דפוס בסיוע לייזר. (A) הדפסה מיקרומגע משתמשת בתבנית בסיס ליטוגרף עם מיקרו-תכונות מוגדרות כדי ליצור חותמת pdms אשר מודוללת עם חלבון הריבית. חלבון זה מועבר לאחר מכן (מוטבע) על משטח זכוכית, יצירת מיקרו דפוסי חלבון. (ב) שיטות מסוימות לייזר בסיוע כוללות פוטוטרנינג ומיישר לייזר ישיר. (ג) רוב הגישות photopatterning להשתמש במקור אור UV ו פושאל (או במגע עם משטח המצע או במישור המוקד של המטרה) עם גיאומטריות הרצוי על מנת לדבוק משטח יתד מנוגד בתנוחות ספציפיות, יצירת תבנית מוגדרת. השלב הבא הדגירה החלבון התוצאות הספיחה חלבונים רק לאזורים לייזר ביקע. (ד) limap היא טכניקה פוטואטטרנינג אשר אינו מחייב הפושאול במגע עם המצע (כלומר, גישה maskless ללא מגע). LIMAP משתמשת ביוזם תמונה, אשר מופעל על ידי מינונים נמוכים של לייזר, השארת אזורים חשופים באור של פג. פעולה זו יוצרת אתרים מצורפים עבור ספיחה של חלבונים רציפים. (ה) לייזר ישירה ה, משתמשת אור אנרגיה גבוהה כדי לחרוט ישירות את הסרט יתד, המאפשר כריכת חלבון באזורים החרוטים האלה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
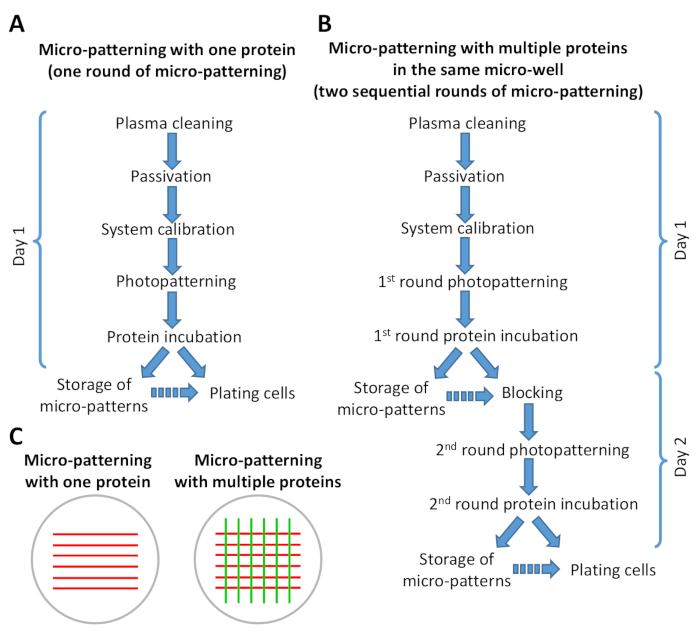
איור 2: ערכה המציגה סיכום של השלבים בפרוטוקול המיקרו-מפענח. (A) מיקרו-המטנג עם חלבון אחד כרוך רק סיבוב אחד של מיקרו-המטנג (photopatterning וחלבון הדגירה) והוא יכול להתבצע תחת 8 h. (ב) מיקרו-המטנג עם חלבונים מרובים דורש שני סיבובים רציפים של מיקרו הדפוס יכול להסתיים ב 1-2 ימים, בהתאם למספר דפוסי מיקרו להיות מוכנים. ניתן לעבור את גירסת B של הפרוטוקול ביום אחד של עבודה. חיצים מתמשכים מציינים זרימה ישירה של שלבים בפרוטוקול. חצים שאינם רציפים מציינים שקיים פער זמן משמעותי בין צעד אחד לבין השני (ראה שלב 6.6 ו-9.3). (ג) השקפה סכמטית של דוגמאות לדוגמה שהתקבלו לאחר סיבוב אחד של מיקרו-מיקרונינג (פסים אדומים) או שני סיבובים רציפים של מיקרו-מיקרונינג (פסים אדומים וירוקים). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: הדור של תבנית תבנית הוא רב-תכליתי עם LIMAP. (א, ב) דוגמאות לתבניות דוגמת מילוי שעוצבו באמצעות ImageJ (הצלב, האותיות B). צורות שצוירו בלבן הוקרינו בכוח לייזר מקסימלי וצורות שצוירו בשחור לא הוקרן. (ג, ד) מיקרו דפוסי השיג עם limap מתוך תבניות לאחר דגירה עם 10 μg/mL פיברינוגן (ירוק). (ג) crossbows הם 50 יקרומטר רוחב ו 50 יקרומטר גובה רווחים על ידי 75 יקרומטר אופקית ו 50 יקרומטר אנכית. (ד) אותיות הם 80 יקרומטר רוחב ו85 יקרומטר גובה. סרגל משנה C ו-D מייצג 50 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: חומרים חיוניים לפרוטוקול LIMAP. (א) סטנסילים המשמשים בפרוטוקול זה הם 20 מ"מ קוטר, דק בצורת מעגלי pdms (250 יקרומטר עובי) המכיל 4 בארות מיקרו (4 מ"מ קוטר כל אחד). אמצעי האחסון המשמשים את טווח מיקרו בארות מ 5 כדי 20 μL, באופן משמעותי להפחית את כמות של ריאגנטים וחלבונים הדרושים עבור כל ניסוי. (ב) 6 טוב זכוכית בתחתית התבשיל שבו סטנסילים כבר ממוקמים בכל טוב. מיקרו-ולס מכילים 20 μL של PBS כדי להפוך אותם לגלויים. (ג) צלחת כיול שבה הזכוכית הפנימית הייתה מסומנת בסימון ירוק, שישמש לכיול מוקד הלייזר. (ד) השקפה סכמטית של העליון שמאל היטב ממנה 6-היטב זכוכית תחתית ב-B (מחולקת עם עיגול אדום מקווקו). בתחתית הזכוכית הפנימית היטב מיוצגת בלבן והסטנסיל מוצג באפור. הסטנסיל מכיל 4 מיקרו בארות (ממוספרים 1-4), עבור בדיקות של 4 מצבים ניסיוניים שונים (למשל, ריכוזי חלבון שונים, תבנית גיאומטריות, שילובים של חלבונים, וכו '). הכוכבית מייצגת את המיקרו-היטב המכיל את תבנית הייחוס. (ה) תצוגה סכמטית של מיקרו-טוב שבו תבנית הפניה נוצרה בחלק העליון (חץ עם ראש חץ מלא). תבנית התייחסות זו נדרשת כדי לקבל את מוקד הלייזר האופטימלי לדפוס (ראה שלב 4). חץ עם ראש חץ ריק מציין את האזור המרכזי של המיקרו-באר, שישמש לצורך מימוש אחר כיול המערכת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
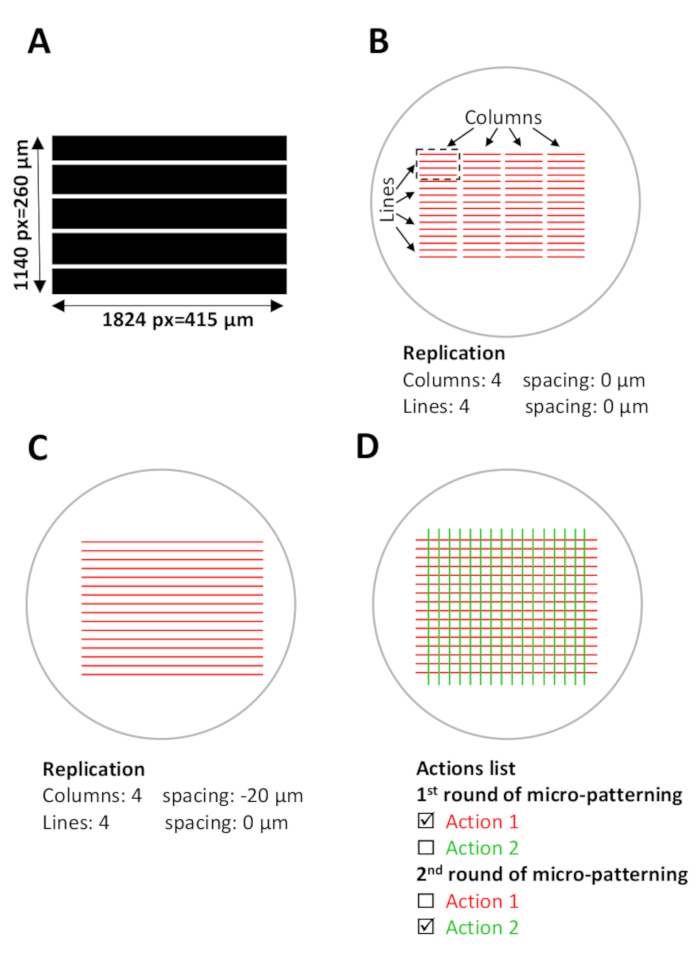
איור 5: הגדרת תוכנה עבור מיקרו-מחשב. (A) תבנית תבנית עם פסים מקבילים המעוצבים באמצעות imagej ונשמרים כקובץ Tiff של 8 סיביות. (B-D) תצוגה סכימטית של ROIs דיגיטלי (אזורי עניין) אשר חופפים עם מיקרו בארות הנוכחי שבו מיקרו דפוסים ייווצרו. (ב) תבנית דפוס לשמש (אורך 1824 פיקסל = 415 μm, רוחב 1140 פיקסל = 260 μm) נבחר על לאונרדו והוא מוקרן על ROI כיחידת עיצוב (פסים אדומים במלבן שחור מקווקו), אשר יכסה כ 0.1 מ"מ2 של ה אזור מיקרו-באר. יחידת העיצוב משוכפלת ב-4 עמודות ו-4 שורות בתפריט השכפול (תצורת תבנית), יצירת תבנית לרוחב המיקרו-באר. שים לב למרווח בין העמודות. (ג) כדי לתבנית פסים רציפים, יש לכוונן את המרווח בין העמודות. במקרה זה, כדי להשיג חפיפה בין יחידות עיצוב הריווח בין העמודות מוגדר בתפריט השכפול כמרווח שלילי,-20 μm. (ד) כדי לעצב מספר חלבונים באותו מיקרו-באר, יישור מדויק של הדפוסים הוא נדרש. במהלך שלב הגדרת התוכנה (שלב 5), העלה את כל תבניות התבנית הרצויות בו זמנית. ברשימה פעולות , בחר רק את הפעולות הספציפיות שיהיו בדוגמת מילוי בכל סיבוב ובטלו את הבחירה בשאר הפעולות (שלב 5.12, 5.13 ו-8.2). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
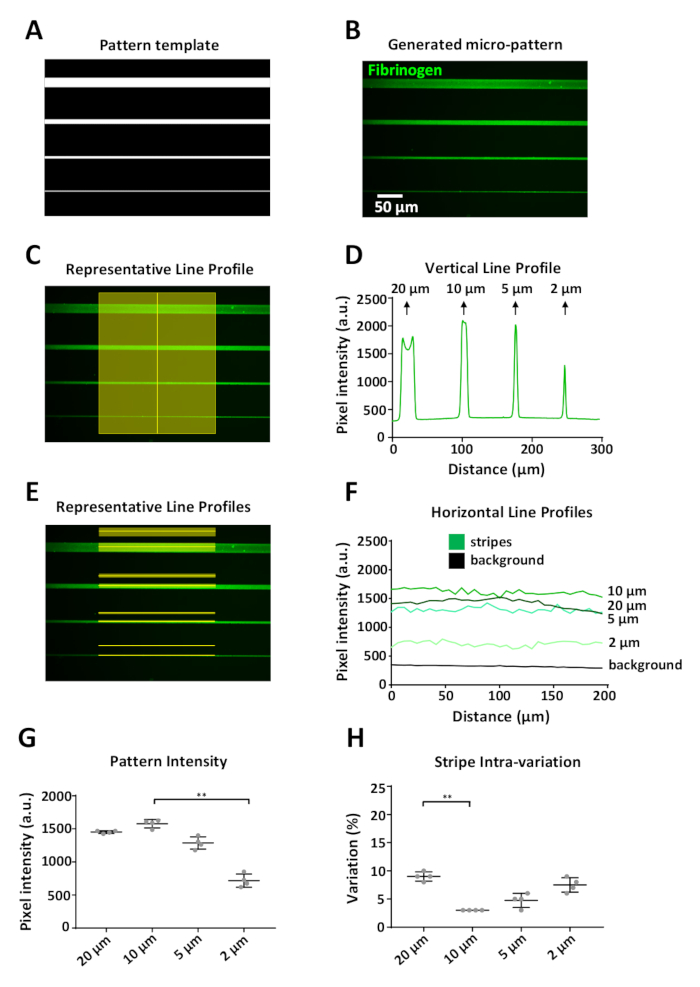
איור 6: ניתוח השתנות תבנית באמצעות LIMAP. (א) תבנית תבניתשתוכננהעם imagej המשמשת לדפוס מיקרו ארבעה פסים ברוחב משתנה (20, 10, 5, 2 μm, מלמעלה למטה). (ב) מיקרו-דפוס שהושג לאחר דגירה עם 10 μg/mL של התווית בתוך fluorescently (ירוק). (ג) מדידות אינטנסיביות לאורך קו אנכי חוצה את הפסים של דפוס מיקרו. (ד) פרופיל בעוצמה פלואורסצנטית אנכית שהושג ממדידה ב (ג). שים לב כי ברוחב גדול יותר (20 μm) יש וריאציה בפרופיל האנכי הנגרמת על ידי הצטברות של חלבון בקצות הפס, וכתוצאה מכך שתי פסגות בעצימות ברורה בעוצמה (אפקט הקצה). אפקט זה נראה רק רוחב פס ≥ 20 μm. (E) מדידות אינטנסיביות לאורך הקווים האופקיים מתוארים (זריחה ורקע). (F) פרופילים אופקיים בעלי עוצמה פלואורסצנטית שהתקבלו ממדידות ב (E). (ז) גרף המציג את העוצמה הממוצע עבור כל רוחב פסים, הנמדד מארבע יחידות עיצוב משוכפלות בודדות (וריאציה בין תבניות). הערה ספיחה חלבון מופחתת על דפוסי של 2 יקרומטר פס רוחב. (ח) הווריאציה בתוך הפסים בדוגמאות (מקדם הווריאציה) הייתה נמוכה עבור כל רוחב הפס, החל מ-3 עד 10%. נתונים ב-G ו-H הראו כממוצע ± SD. ניתוח סטטיסטי בסול ו-H בוצע באמצעות מבחן ANOVA (קרוקאל-ווליס) בכיוון אחד עם השוואות מרובות. ערך P הוא < 0.001 עבור * * משמעות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
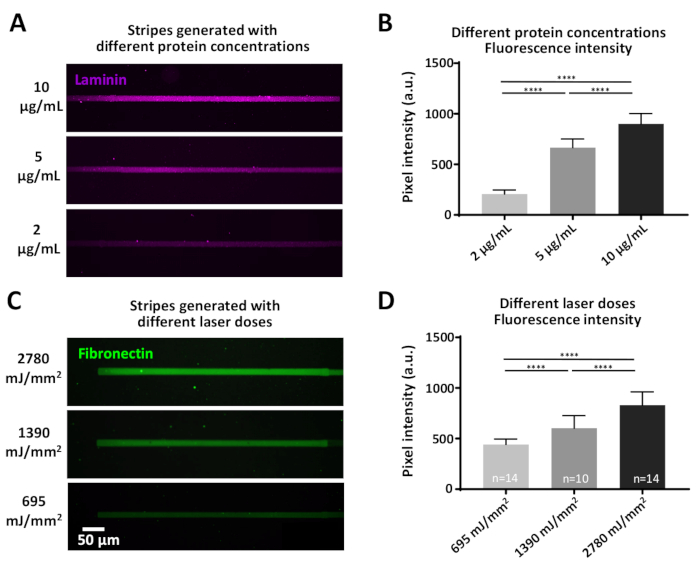
איור 7: ההשפעה של וריאציות על כוח לייזר וריכוז חלבון עבור יעילות ספיחה חלבון. (א) משטח PLL-יתד היה לייזר-ביקע עם מינון לייזר קבוע (1390 mJ/mm2) ו מודבטים עם ריכוזים המצוין של התווית fluorescently (מגנטה). (ב) כימות העוצמה הפלואורסצנטית של הפסים הלמינציה ב (א). (ג) שונה לייזר שצוין מינונים הוחלו ואחריו הדגירה עם הריכוז זהה (10 μg/mL) של התווית של התוויות בצבע (ירוק). (ד) קוונפיקציה של עוצמת הזריחה של פסים fibronectin ב (ג) מראה כי מינונים לייזר גבוה יותר לתאם רמות גבוהות יותר של חלבון נספחת. כל המדידות הן רקע מופחתים. מספרים לדוגמה מצוינים בתחתית העמודות; הנתונים מוצגים כממוצע ± SEM. ניתוח סטטיסטי בוצע באמצעות מבחן מאן-ויטני לא פרמטרית עם חישוב דו-זנבי. ערך P הוא < 0.0001 עבור משמעות * * * *. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
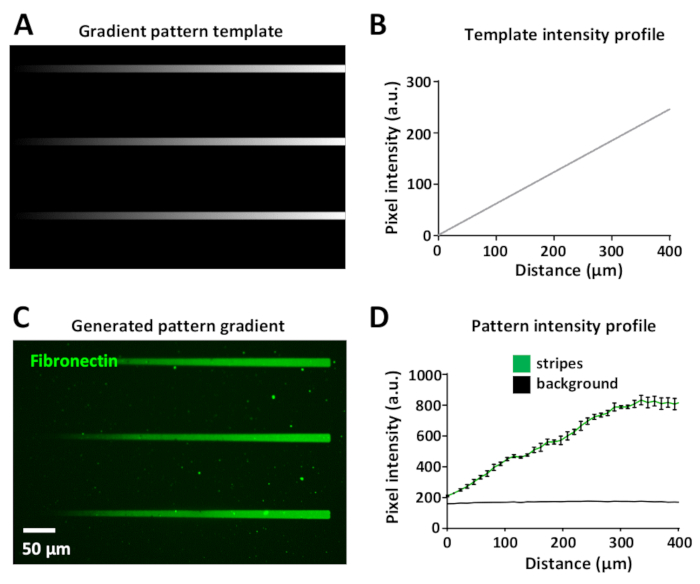
איור 8: הדור של ריכוז חלבון הדרגתי בתוך דפוס מיקרו. (A) תבנית תבנית מעבר צבע בקנה מידה אפור. (ב) פרופיל בעוצמה פלואורסצנטית נמדד מ (א). (ג) תבנית שהושג עם limap מתבנית דפוס ב (א) לאחר הדגירה עם 10 μg/mL של התווית של התוויות בצבע (ירוק). (ד) פרופיל העוצמה הפלואורסצנטית של n = 3 פסים ורקע המיוצגים כממוצע ± SEM, המציג את העלייה הליניארית בעוצמת הצבע של החלבון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
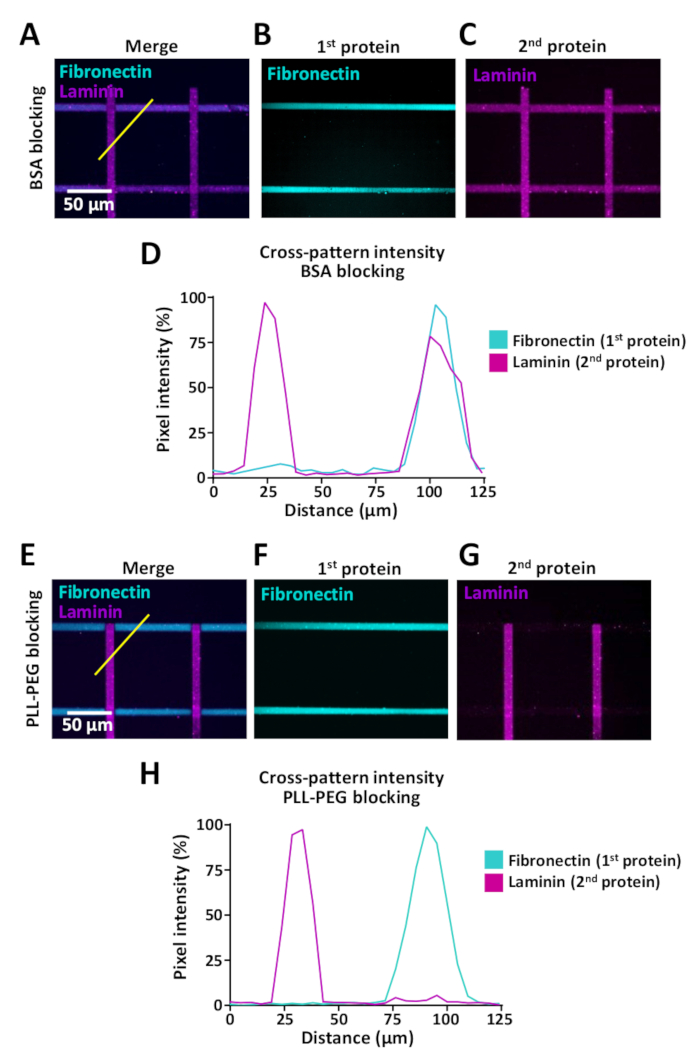
איור 9: האפקט הצולב מחייב בעת הבנת מספר חלבונים ברצף. (A-C, E-G) מדגמים עם פסים 10 יקרומטר של התווית של משקפיים (ציאן, אופקי) ומתויג בצורה מלעית (מגנטה, אנכי). (א-ג) דגימות שטופלו במאגר חסימת BSA. (E-F) דגימות שטופלו באמצעות PLL-יתד לחסימת אתרי איגוד לא ספציפיים (שלב 7). (א, ה) ערוצי פלואורסצנטית ממוזגים המציגים הן פירובטין ולמינציה. (ב, ו) התמונה מראה הפיברוטין בלבד. (ג, ג) תמונה המציגה מלמינציה בלבד. עבור C, שים לב לנוכחות של הלמינציה גם על פס הזזה אופקי של הפסים החיוביים הנובע מחסימה לא יעילה של אתרי קשירה פנויים עם BSA. עבור G, שים לב כי חסימת עם PLL-יתד מונע קשירה יעילה של למינציה לפסים fibronectin. (ד, ח) פרופילים של עוצמה פלואורסצנטית שהתקבלו ממדידות מצוינות (קו צהוב אלכסוני) ב A ו-E, בהתאמה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
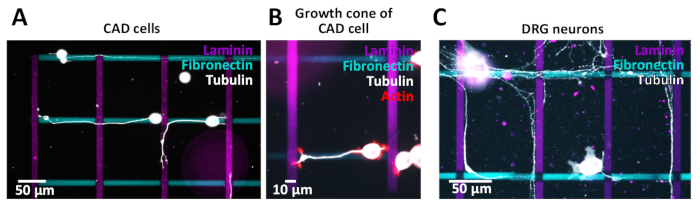
איור 10: דפוסי הצלב כדי לחקור neurite/axon pathfinding. (א-ג) מדגמים עם פסים 10 יקרומטר של התווית של משקפיים (ציאן, אופקי) ומתויג בצורה מלעית (מגנטה, אנכי). (א, ב) תמונות פלורסנט של תאים CAD עם neurites גדל לאורך דפוסי מיקרו. כדי להמחיש neurites, תאים היו מתורבתים עבור 48 h, קבוע עם 4% בלהוב ומוכתם עבור טובולין (A) או טובולין ו אקטין (ב). (ג) חולדה השורש גנגליון (drg) נוירונים עם אקסונים גדל לאורך דפוסי מיקרו. כדי להמחיש axons, הנוירונים DRG היו מתורבתים עבור 72 h, קבוע עם 4% כדור לדור הטובולין ומוכתם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
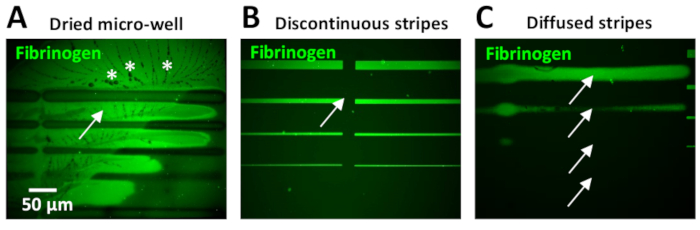
איור 11: דוגמאות לתוצאות שליליות נפוצות שהתקבלו בעת יצירת מיקרו-תבניות עם LIMAP. (א-ג) משנה אופטימלית בדוגמת פסים של 10 μg/mL מתויג באופן מסומן פיברינוגן (ירוק) המתקבל בנסיבות שונות. (א) המיקרו-באר התייבש במהלך דור דפוס. שימו לב לרמות הגבוהות של הזריחה ברקע (חץ) ונוכחות של גבישי PBS (כוכביות). (ב) התפרים בין הפסים לא הותאמו כראוי במהלך הגדרת התוכנה והתוצאה היא פסים לא רציפים עם פערים (חץ) בין יחידות עיצוב (ראה שלב 3.4.7). (ג) המוקד לייזר היה תת אופטימלית גורם פסים מתפזרת (חיצים) אשר אינם מייצגים את רוחב הפס בפועל של תבנית התבנית, אשר אמור להיות 20, 10, 5, 2 יקרומטר מלמעלה למטה, כמו ב (ב). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
LIMAP (פרימו) מיקרו-מחשב יתרונות והשוואה עם הדפסת מיקרומגע
בעוד הדפסה microcontact היא אולי השיטה הנפוצה ביותר בשימוש במיקרו-מיקרונינג בשדה הביולוגי39, נראה שיש מספר גדל והולך של חוקרים באמצעות limap טכנולוגיה40,41,42 ,43,44. כאן, הצגנו פרוטוקול באמצעות פרימו, מערכת זמינה מסחרית עבור LIMAP. בהמשך אנו דנים בקצרה על יתרונות פוטנציאליים ומגבלות של הדפסת מיקרואיש קשר ו-LIMAP צילום-מניפולציה.
הדפסה microcontact מחייב מאסטרים ליטוגרף המיוצר על ידי ציפוי ספין מסכת צילום (בדרך כלל SU-8) על זכוכית או סיליקון וופל, אשר לאחר מכן לייזר חרוט עם מיקרו תכונות הרצוי. מאסטרים אלה משמשים כתבניות כדי ליצורמ45בחותמת pdms. החותמת היא מודלת עם חלבון שנבחר כי adsorbs זה, והוא מועבר לאחר מכן (חותמת) על הצלחת תרבות התא. תהליך הספיחה של החלבון לחותמת PDMS תלוי בריכוז חלבונים, מאגר וזמן דגירה. פרמטרים אלה צריכים להיבדק מראש לקבלת תוצאות מיטביות46.
מאסטרים יכולים לשמש במספר משמעותי של ניסויים, שנמשך חודשים או אפילו שנים, אם נשמר כראוי. עם זאת, גורם מגביל של טכנולוגיה זו הוא הצורך לעצב מחדש מאסטרים חדשים של ליטוגרף עבור כל שינוי רצוי. שינויים בעיצובים ניסיוניים עשויים לגרום לייצור זמן רב של מאסטרים חדשים (עד מספר שבועות) ובכך לעכב ניסויים. לעומת זאת, לימפה פוטואטנינג אינו דורש מאסטר פיזי; היא משתמשת בתבניות דפוס שנוצר על ידי תוכנות שניתן להשתמש בהן כדי להתאים בגמישות הרצוי של מיקרו דפוסים כדי לשנות שאלות מחקר. LIMAP ניתן להשתמש גם כדי ליצור מעברי חלבון בתוך אותו מיקרו דפוס (איור 8), אשר קשה יותר להשיג באופן הניתן לשימוש באמצעות microcontact הדפסה47.
יתר על כן, הרזולוציה מיקרו דפוס השיגה עם limap, במקרה שלנו, הוא 2 יקרומטר (איור 6ב).
התקרבות לרזולוציה זו הגדילה את השונות הפנימית והבין-לדפוס. הפקת דפוסים סביב או מעל 10 יקרומטר רוחב היה מאוד מיותר (איור 6G, H). להיפך, עם הדפסה microcontact קשה לקבל בעקביות החלטות מתחת 10 יקרומטר והוא נפוץ למצוא חפצי אמנות בעת הטבעת תכונות קטנות (נתונים לא מוצגים).
הראינו כי LIMAP ניתן להשתמש מיקרו דפוס חלבונים מרובים (איור 9) בתוך אותו מיקרו-באר, המאפשר רמות נוספות של מורכבות להתווסף ניסויים. למרות שזה יכול להיות מושגת עם הדפסה microcontact, יישור חלבונים שונים עם רמה גבוהה של דיוק יכול להיות מבחינה טכנית תובענית למדי. בעוד מפרט חלבונים מרובים באמצעות LIMAP נראה ישר קדימה, חשוב לציין כי הכלאה של חלבונים באמצעות הליכי ציפוי רציפים ניתן לצמצם באמצעות חוסם ריאגנטים אך לא לחלוטין סולק (איור 9).
לגבי העלות של הטכניקה אחת או אחרת, LIMAP כפי שמתואר כאן דורש רכישה של ציוד מיקרו הרנינג (פרימו) כי ניתן להתקין על מיקרוסקופים פלואורסצנטית שונים ודורש שלב ממונע. למרות שהשקעה זו עולה בתחילה באופן אינטנסיבי, אין רכישות נוספות מלבד פריטים מתכלים (סטנסילים, פג ו-PLPP) בטווח הארוך המשויך LIMAP. לחילופין, הסטנסילים של pdms יכולים להיות מיוצרים גם במעבדה על ידי הניסויים האחרים שפורסמו בעקבות הפרוטוקולים המתפרסמים18,32. העלויות הגדולות ביותר עבור הדפסה של microcontact עשויות להיות משויכות לייצור מאסטרים חדשים, שיכולים להיות משמעותיים אם הניסויים דורשים דפוסים חדשים.
חיסרון אחד של LIMAP היא גישת תפוקה נמוכה יחסית של טכניקה זו. הדפסת מיקרו-מגע יכולה להפיק מספר רב של מיקרו-תבניות במהירות וביעילות בשלב הטבעה סימולטני, בהשוואה למיקרו-מיקרו הלייזר הנדרש עם LIMAP. לדוגמה, ניתן לייצר 6 כיסוי זכוכית מוטבע בתוך כ 2 h עם הדפסה microcontact באמצעות בולים PDMS (למעט הכנה בחותמת); מפענח אזור דומה (6-היטב צלחת) עם LIMAP ייקח כ 4 שעות, למעט ההליך של פסיבציה פני השטח (בהתחשב בתצורה של תבנית דפוס המתואר בשלב 5.12 ולראות איור 5ב).
מקדם הגבלת קצב נוסף של טכנולוגיית LIMAP היא זמן התאורה הארוך הנדרש עבור המעצבים אזורים גדולים (30 s לכל יחידת עיצוב עם 7.5 mW/mm2 לייזר). במקרים אלה, הדפסה של מיקרואנשי קשר עשויה להיות אפשרות מועדפת. חדש זמין ליוזם תמונה (ג'ל PLPP, טבלה של חומרים) צריך במידה ניכרת להפחית את הזמן שנלקח הדפוס, המאפשר את הדור של מאות מיקרו-דפוסים באזורים גדולים (עד 8 מ"מ2) בתוך דקות ספורות.
גורם חשוב נוסף לקחת בחשבון כאשר משטחי מיקרו לתרבות התאים הוא הופך את הצורה החוזרת של דפוסי מיקרו בקרב ניסויים שונים חוזר, בהשוואה לשונות שהתקבלו עם הדפסה microcontact. לדוגמה, הגרפים המוצגים באיור 7ב, D מייצגים נתונים של שלושה מזהים חוזרים ניסיוניים בעלי תוצאות דומות מאוד (נתונים לא מוצגים). בהתבסס על הניסיון שלנו הפרסומים הקודמים, רמה זו של התוכסות קשה להשיג עם microcontact הדפסה48,49,50,51,52.
בניגוד לטכניקות צילום אחרות הדורשות כימיה ייעודית למהנדס חומרים רגישים לאור או שימוש בתמונות רגישות, שבדרך כלל אינן תואמות באופן ביולוגי3, המרכיב הרגיש לאור של limap (plpp ) הוא ביולוגי תואם ונסבל היטב על ידי תאים21; בידינו לא חווינו כל הרעילות ציטובית על פני מגוון של תאים, כולל CAD, הנוירונים DRG (איור 10), פיברותקיעות, תאים אפיתל, ותאי מלנומה (נתונים לא מוצגים). יתרון נוסף של LIMAP באמצעות פרימו בהשוואה לטכניקות צילום אחרות של התמונה היא כי לא מפובקש נדרש. בדומה הדפסה microcontact, פושאול חדש צריך להיות מעוצב ומיוצר עבור כל דפוס רצוי.
כל המגבלות שהוזכרו לעיל עבור הדפסה מיקרו-מגע, עיין בגישה הידנית של הטכניקה. עם זאת, ניתן לשפר את התפוקה ואת השגות של הדפסה מיקרומגע באמצעות מכשיר אוטומטי עם עומס בולים ובקרת לחץ53.
שלבים מרכזיים של הפרוטוקול ופתרון הבעיות עבור LIMAP באמצעות פרימו
אחת הבעיות הנפוצות ביותר שנמצאו במהלך פרוטוקול זה היא שיש רמות גבוהות של הרקע בתוך מיקרו דפוסים. זה יכול להיות בגלל ייבוש מתוך מיקרו בארות אשר לעיתים קרובות מתרחשת בשל הנפח הקטן שלהם. כאשר הדבר מתרחש, קריסטלים של PBS מופיעים לעיתים קרובות סביב דפוסי ECM (איור 11א).
שלבי הכביסה לא מספיקים או לא יעילים לאחר דגירה של חלבון יכול גם לגרום לרמות גבוהות של זריחה ברקע. זה יכול להיות נצפתה במיוחד על ידי שימוש בריכוזי חלבון של 10 μg/mL (איור 11ב) או גבוה יותר. עודף חלבון ברקע יכול להיות מופחת על ידי כולל שטיפת כביסה נוספת עם PBS.
הנוכחות של רקע חלבון צריך להיות נמדד ומאופיין בכל ניסוי, חישוב עוצמת הזריחה ברקע (איור 6E) והפחתת זה מן העוצמה מיקרו דפוסי (איור 6F-H ואיור 7ב, ד). רקע חלבון גבוה עלול להשפיע על הקובץ המצורף ולבלוב של תאי CAD, להתפשר על הפרשנות של תוצאות.
הפערים בין יחידות העיצוב היא בעיה נפוצה כאשר למשתמשים יש ניסיון מוגבל (איור 11ב'), המתרחשת כתוצאה מחפיפה לא מספקת בין תבניות. ניתן לכוונן שני פרמטרים בתוכנת לאונרדו כדי להתגבר על זה: 1) מרווח שלילי בין העמודות עשוי להידרש, בהתאם לעיצוב התבנית (שלב 5.7 וראה איור 5ב, ג). לחלופין, 2) השתמש באפשרות מעבר הצבע בתפריט מומחה כדי לתפור את העמודות. בדיקה מהירה כדי לקבוע את פרמטרי הריווח האופטימלי ניתן לבצע באמצעות דבק UV (טבלת חומרים). טיפה קטנה של דבק זה מוחל על שקופית זכוכית, אשר מכוסה לאחר מכן עם שמיכות זכוכית, עשיית סרט. דבק UV מוטבע הוא photopatterned עם תבנית דפוס של עניין באמצעות מינון לייזר נמוך (30 mJ/mm2). את האזורים החשופים של הדבק המוטבע ניתן לרפא ולהפוך לגלויים במיקרוסקופ שדה בהיר. תוצאות הבדיקה מדמיינו להעריך את המרווח המתקבל בתבנית. בניסויים העצביים שלנו, פער בין פסים עלול להשפיע לרעה על התנהגות התא, ולייצר וריאציות בדינמיקה של גדילה (מהירות מופחתת או נטישה של הנתיב).
בעדכון האחרון של התוכנה לאונרדו (בזמן הפרסום, לאונרדו 4.11), ניתן לטעון בעבר מתוכנן תבניות תבנית גדולה יותר המכסה שטח גדול הרבה יותר (עד 8 מ"מ2 באמצעות המטרה 20x) של משטח מיקרו-באר לעומת 0.1 mm הנוכחי2 לכל יחידת עיצוב, ביטול הצורך לתפור יחד את יחידות עיצוב קטן יותר. קצוות לא מוגדרים עלולים לנבוע מחוסר התאמה של מיקוד לייזר במהלך יצירת תבניות (איור 11ג). לכן חיוני לכייל את הלייזר ולבצע שלבי דפוס התייחסות (ראה שלב 4) לפני הדפוס. פסים מוגדרים לקוי התוצאה של וריאציות ברוחב פס, מה שהופך את הקורלציה בין דינמיקת הצמיחה אקסון ורוחב פסים קשה. Axons גם נוטים לנטוש פסים כי יש קצוות מתפזרת. בנוסף, השונות בקצוות ניתן למצוא גם בעת הדפסת פסים של 10-20 יקרומטר רוחב או גבוה יותר, וכתוצאה מכך תוכן חלבון גבוה יותר בקצוות בהשוואה לאזורים המרכזיים של התבנית (איור 6B, D). אפקט קצה זה מופק על-ידי דיפוזיה שאינה אחידה של יוזם התמונה במהלך תהליך פוטואטטרנינג. תגובת התמונות היא תלוית חמצן, אשר מפזרת יותר בקצוות. אפקט קצה זה יכול להיות ממוזער הומוגניזציה צילום-יוזם עם פיפטה ב מיקרו-גם במהלך התהליך photopatterning. יתר על כן, תמונה חדשה ממוסחר מחדש (ג'ל PLPP), יכול גם להפחית את אפקט הקצה (צוות התמיכה של מערכת פרימו, תקשורת אישית).
מיקרו-הדפסה של יותר מחלבון אחד יכול לגרום החוצה מחייב (איור 9א-ד). ניתן למזער זאת על-ידי הגברת היעילות החוסמת המשמשת לתפוס אתרי קשירה לא ספציפיים בין הצעדים הדגירה של שני החלבונים השונים. מחייב החוצה של חלבונים יכול לperturb בלתי מנוצח של תוצאות ניסיוני עלול להוביל וטעה של נתונים, מאז קשה לקבוע את התרומה של כל חלבון כדי הדינמיקה הצמיחה אקסון והתנהגויות תאים אחרים.
מסקנה
אנו מקווים כי הפרוטוקול שסופקו באמצעות LIMAP מקלה על הדור של מיקרו תבניות חלבון באמצעות מערכת פרימו. בעוד הפרוטוקול שלנו מתמקד כיצד לייצר באופן אמין מיקרו דפוסים ב-2D משטחי זכוכית, אחרים הראו כי ניתן להשתמש LIMAP עבור מיקרו דפוס של מצעים רכים54, ומשטחים מובנים מיקרו עבור תרבויות תלת-ממד42. אלה מיקרו דפוסי יכול להיות כלי רב-תכליתי כדי ללמוד תגובות הסלולר שינויים במיקרו-סביבה שלהם.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי BBSRC, EPSRC, MRC וברוכים האמינים. המעבדה הרדיו אזרחי מהווה חלק ממרכז יחסי האמון של מחקר התאים, אוניברסיטת מנצ, הנתמכת על-ידי מימון הליבה מיחסי האמון (גרנט מספר 088785/Z/09/Z). המחברים מבקשים להכיר במימון המסופק על ידי המועצה למחקר ביוטכנולוגיה ומדעי ביולוגי (BBSRC) ל-C.M., K.J. (BB/M020630/1) ו-הוראות (BB/P000681/1) ועל ידי המועצה למחקר פיסי ומדעי הנדסי (EPSRC) ורפואי מועצת המחקר (MRC) מרכז להכשרה לדוקטורט ברפואת משובי לA.K. (EP/L014904/1). המחברים מודים לAlvéole על התכתובת שלהם ועל צוות התמיכה שלהם אחרי המכירה. המחברים מודים לפיטר מרץ ורוג כרי דשא ממתקן Bioimaging, אוניברסיטת מנצ על עזרתם עם המיקרוסקופיה. מיקרוסקופ מתקן Bioimaging המשמשים במחקר זה נרכשו עם מענקים של BBSRC, ברוכים האמינים ואוניברסיטת מנצ הקרן האסטרטגית.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa 488 protein labeling kit | Invitrogen | A10235 | Working concentration: N.A. |
| Alexa 647 protein labeling kit | Invitrogen | A20173 | Working concentration: N.A. |
| CAD cells | ECACC | 8100805 | Working concentration: N.A. |
| Conjugated fibrinogen-488 | Molecular Probes | F13191 | Working concentration: 10 μg/ml |
| DMEM culture medium | Gibco | 11320033 | Working concentration: N.A. |
| Epifluorescence Microscope** | Nikon | Eclipse Ti inverted | Working concentration: N.A. |
| Fibronectin | Sigma | F4759 | Working concentration: 10 μg/ml (after labelling with Alexa 488 protein labeling kit, see above) (diluted in PBS) |
| Fiji-Image J | www.imagej.nih.gov | Version 2.0.0-rc-54/1.51f | Working concentration: N.A. |
| Fluorescent highlighter | Stabilo | Stabilo Boss Original | Working concentration: N.A. |
| HEPES | Gibco | 15630080 | Working concentration: 1M |
| Inkscape software | Inkscape | Check last update | Working concentration: N.A. |
| Laminin-red fluorescent rhodamine | Cytoskeleton, Inc. | LMN01 | Working concentration: 10 μg/ml (diluted in PBS) |
| Leonardo software | Alvéole | version 4.11 | Working concentration: N.A. |
| L-Glutamine | Sigma | G7513 | Working concentration: 1% |
| Micro-manager software | Open imaging | Check last update | Working concentration: N.A. |
| Motorized x/y stage | PRIOR Scientific | Proscan II | Working concentration: N.A. |
| NIS Elements Software | Nikon | NIS Elements AR 4.60.00 64-bit (With Nikon jobs) | Working concentration: N.A. |
| PBS (without Ca2+, Mg2+) | Sigma | D8537 | Working concentration: 1X |
| PDMS Stencils | Alvéole | visit www.alveolelab.com | Working concentration: N.A. |
| PEG-SVA | Laysan bio, Inc. | MPEG-SVA-5000-1g | Working concentration: 50 mg/ml |
| Phalloidin 405 | Abcam | ab176752 | Working concentration: 1:1000 |
| Photo-initiator (PLPP) | Alvéole | Classic PLPP | Working concentration: 14.5 mg/ml |
| Photo-initiator (PLPP gel) | Alvéole | PLPP gel | Working concentration: 4.76% diluted in ethanol |
| Plasma cleaner | Harrick Plasma | PDC-32G (115V) | PDC-32G-2 (230V) | Working concentration: N.A. |
| PLL-PEG | SuSoS (also distributed by Alvéole) | www.alveolelab.com | Working concentration: 0.1 mg/ml (diluted in PBS) |
| Poly-L-Lysine | Sigma | P4707 | Working concentration: 0.01% |
| Primo equipment | Alvéole | www.alveolelab.com | Working concentration: N.A. |
| Pen/Strep | Thermo Fisher | 15140122 | Working concentration: 1% |
| Tubulin anti-alpha antibody | Abcam | DM1A | Working concentration: 1:1000 CAD cells |
| Tubulin anti-beta 3 antibody | Sigma | T8660 | Working concentration: 1:500 DRG neurons |
| UV adhesive | Norland Products | NOA81 | Working concentration: N.A. |
| 1 well glass bottom dish | Cellvis | D35-20-1.5-N | Working concentration: N.A. |
| 6 well glass bottom dish | Cellvis | P06-20-1.5-N | Working concentration: N.A. |
| 20x objective** | Nikon | no phase ring (check updated catalogue) | Working concentration: N.A. **Epifluorescence microscope: images were acquired and patterns were generated on an Eclipse Ti inverted microscope (Nikon), coupled to PRIMO micro-patterning equipment (Alvéole), using a 20x objective (0.75 S Plan Fluor (nophasering, Nikon). Nikon specific filter sets for GFP, mCherry and Cy5 were used and fluorescent light source was LED (Lumencor) although other fluorescence sources and filter sets can be used. The microscope has an automated x/y stage (PRIOR Scientific) for the printing of multi-field patterning and Nikon Perfect Focus to prevent focus drift. The images were collected using a Retiga R6 (Q-Imaging) camera. |
References
- Alamdari, O. G., Seyedjafari, E., Soleimani, M., Ghaemi, N. Micropatterning of ECM Proteins on Glass Substrates to Regulate Cell Attachment and Proliferation. Avicenna Journal of Medical Biotechnology. 5 (4), 234-240 (2013).
- Sunami, H., Yokota, I., Igarashi, Y. Influence of the pattern size of micropatterned scaffolds on cell morphology, proliferation, migration and F-actin expression. Biomaterials Science. 2 (3), 399-409 (2014).
- Thery, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123 (Pt 24), 4201-4213 (2010).
- Marino, A., et al. Two-photon polymerization of sub-micrometric patterned surfaces: investigation of cell-substrate interactions and improved differentiation of neuron-like cells. ACS Applied Materials & Interfaces. 5 (24), 13012-13021 (2013).
- Joo, S., et al. Effects of ECM protein micropatterns on the migration and differentiation of adult neural stem cells. Scientific Reports. 5, (2015).
- Morgani, S. M., Metzger, J. J., Nichols, J., Siggia, E. D., Hadjantonakis, A. K. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning. Elife. 7, (2018).
- Javaherian, S., O'Donnell, K. A., McGuigan, A. P. A Fast and Accessible Methodology for Micro-Patterning Cells on Standard Culture Substrates Using Parafilm (TM) Inserts. Plos One. 6 (6), (2011).
- Smirnov, M. S., Cabral, K. A., Geller, H. M., Urbach, J. S. The effects of confinement on neuronal growth cone morphology and velocity. Biomaterials. 35 (25), 6750-6757 (2014).
- Albert, P. J., Schwarz, U. S. Dynamics of Cell Ensembles on Adhesive Micropatterns: Bridging the Gap between Single Cell Spreading and Collective Cell Migration. PLOS Computational Biology. 12 (4), (2016).
- Evans, A. R., et al. Laminin and fibronectin modulate inner ear spiral ganglion neurite outgrowth in an in vitro alternate choice assay. Developmental Neurobiology. 67 (13), 1721-1730 (2007).
- Nichol, R. H., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of Axons by Local Coupling of Retrograde Flow to Point Contact Adhesions. Journal of Neuroscience. 36 (7), 2267-2282 (2016).
- Burdick, J. A., Khademhosseini, A., Langer, R. Fabrication of gradient hydrogels using a microfluidics/photopolymerization process. Langmuir. 20 (13), 5153-5156 (2004).
- Schwartz, P. V. Molecular transport from an atomic force microscope tip: A comparative study of dip-pen nanolithography. Langmuir. 18 (10), 4041-4046 (2002).
- Barbulovic-Nad, I., et al. Bio-microarray fabrication techniques--a review. Critical Reviews in Biotechnology. 26 (4), 237-259 (2006).
- Shafagh, R. Z., Vastesson, A., Guo, W. J., van der Wijngaart, W., Haraldsson, T. E-Beam Nanostructuring and Direct Click Biofunctionalization of Thiol-Ene Resist. Acs Nano. 12 (10), 9940-9946 (2018).
- Kobayashi, J., Yamato, M., Itoga, K., Kikuchi, A., Okano, T. Preparation of microfluidic devices using micropatterning of a photosensitive material by a maskless, liquid-crystal-display projection method. Advanced Materials. 16 (22), (2004).
- Bernard, A., et al. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- Ruiz, S. A., Chen, C. S. Microcontact printing: A tool to pattern. Soft Matter. 3 (2), 168-177 (2007).
- Qin, D., Xia, Y., Whitesides, G. M. Soft lithography for micro- and nanoscale patterning. Nature Protocols. 5 (3), 491-502 (2010).
- Fink, J., et al. Comparative study and improvement of current cell micro-patterning techniques. Lab Chip. 7 (6), 672-680 (2007).
- Strale, P. O., et al. Multiprotein Printing by Light-Induced Molecular Adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Belisle, J. M., Correia, J. P., Wiseman, P. W., Kennedy, T. E., Costantino, S. Patterning protein concentration using laser-assisted adsorption by photobleaching, LAPAP. Lab Chip. 8 (12), 2164-2167 (2008).
- Belisle, J. M., Kunik, D., Costantino, S. Rapid multicomponent optical protein patterning. Lab Chip. 9 (24), 3580-3585 (2009).
- Heinz, W. F., Hoh, M., Hoh, J. H. Laser inactivation protein patterning of cell culture microenvironments. Lab Chip. 11 (19), 3336-3346 (2011).
- Azioune, A., Carpi, N., Tseng, Q., Thery, M., Piel, M. Protein Micropatterns: A Direct Printing Protocol Using Deep UVs. Microtubules: In Vivo. 97, 133-146 (2010).
- Vignaud, T., Ennomani, H., Thery, M. Polyacrylamide hydrogel micropatterning. Methods in Cell Biology. 120, 93-116 (2014).
- Waldbaur, A., Waterkotte, B., Schmitz, K., Rapp, B. E. Maskless projection lithography for the fast and flexible generation of grayscale protein patterns. Small. 8 (10), 1570-1578 (2012).
- Kang, J., Choi, J. C., Kim, M., Jung, H. R., Doh, J. Photopatterning with a printed transparency mask and a protein-friendly photoresist. Methods in Cell Biology. 119, 55-72 (2014).
- Falconnet, D., Csucs, G., Grandin, H. M., Textor, M. Surface engineering approaches to micropattern surfaces for cell-based assays. Biomaterials. 27 (16), 3044-3063 (2006).
- Morlat, S., Gardette, J. L. Phototransformation of water-soluble polymers. Part II: photooxidation of poly(ethylene oxide) in aqueous solution. Polymer. 44 (26), 7891-7897 (2003).
- Qi, Y., Wang, J. K., McMillian, M., Chikaraishi, D. M. Characterization of a CNS cell line, CAD, in which morphological differentiation is initiated by serum deprivation. Journal of Neuroscience. 17 (4), 1217-1225 (1997).
- Shrirao, A. B., et al. A Versatile Method of Patterning Proteins and Cells. Journal of Visualized Experiments. (120), (2017).
- Pankov, R., Momchilova, A. Fluorescent labeling techniques for investigation of fibronectin fibrillogenesis (labeling fibronectin fibrillogenesis). Methods in Molecular Biology. 522, 261-274 (2009).
- Dertinger, S. K., Jiang, X., Li, Z., Murthy, V. N., Whitesides, G. M. Gradients of substrate-bound laminin orient axonal specification of neurons. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12542-12547 (2002).
- Chelli, B., et al. Neural cell alignment by patterning gradients of the extracellular matrix protein laminin. Interface Focus. 4 (1), (2014).
- Tang, Y., Qiu, Q. F., Zhang, F. L., Xie, M., Huang, W. H. Quantifying orientational regeneration of injured neurons by natural product concentration gradients in a 3D microfluidic device. Lab Chip. 18 (6), 971-978 (2018).
- Srinivasan, P., Zervantonakis, I. K., Kothapalli, C. R. Synergistic effects of 3D ECM and chemogradients on neurite outgrowth and guidance: a simple modeling and microfluidic framework. PLoS One. 9 (6), (2014).
- de Luca, A. C., Faroni, A., Reid, A. J. Dorsal root ganglia neurons and differentiated adipose-derived stem cells: an in vitro co-culture model to study peripheral nerve regeneration. Journal of Visualized Experiments. (96), (2015).
- Khadpekar, A. J., Khan, M., Sose, A., Majumder, A. Low Cost and Lithography-free Stamp fabrication for Microcontact Printing. Scientific Reports. 9 (1), (2019).
- Delepine, C., et al. Altered microtubule dynamics and vesicular transport in mouse and human MeCP2-deficient astrocytes. Human Molecular Genetics. 25 (1), 146-157 (2016).
- Decock, J., Schlenk, M., Salmon, J. B. In situ photo-patterning of pressure-resistant hydrogel membranes with controlled permeabilities in PEGDA microfluidic channels. Lab Chip. 18 (7), 1075-1083 (2018).
- Stoecklin, C., et al. A New Approach to Design Artificial 3D Microniches with Combined Chemical, Topographical, and Rheological Cues. Advanced Biosystems. 2 (7), (2018).
- Toraille, L., et al. Optical Magnetometry of Single Biocompatible Micromagnets for Quantitative Magnetogenetic and Magnetomechanical Assays. Nano Letters. , (2018).
- Theodoly, O., et al. Live nanoscopic to mesoscopic topography reconstruction with an optical microscope for chemical and biological samples. PLoS One. 13 (12), (2018).
- Ermis, M., Antmen, E., Hasirci, V. Micro and Nanofabrication methods to control cell-substrate interactions and cell behavior: A review from the tissue engineering perspective. Bioactive Materials. 3 (3), 355-369 (2018).
- von Philipsborn, A. C., et al. Microcontact printing of axon guidance molecules for generation of graded patterns. Nature Protocols. 1 (3), 1322-1328 (2006).
- Ricoult, S. G., Kennedy, T. E., Juncker, D. Substrate-bound protein gradients to study haptotaxis. Frontiers in Bioengineering and Biotechnology. 3, (2015).
- Bietsch, A., Michel, B. Conformal contact and pattern stability of stamps used for soft lithography. Journal of Applied Physics. 88 (7), 4310-4318 (2000).
- Hui, C. Y., Jagota, A., Lin, Y. Y., Kramer, E. J. Constraints on microcontact printing imposed by stamp deformation. Langmuir. 18 (4), 1394-1407 (2002).
- Sharp, K. G., Blackman, G. S., Glassmaker, N. J., Jagota, A., Hui, C. Y. Effect of stamp deformation on the quality of microcontact printing: theory and experiment. Langmuir. 20 (15), 6430-6438 (2004).
- Delamarche, E., Schmid, H., Michel, B., Biebuyck, H. Stability of molded polydimethylsiloxane microstructures. Advanced Materials. 9 (9), 741-746 (1997).
- Perl, A., Reinhoudt, D. N., Huskens, J. Microcontact Printing: Limitations and Achievements. Advanced Materials. 21 (22), 2257-2268 (2009).
- Chakra, E. B., Hannes, B., Dilosquer, G., Mansfield, C. D., Cabrera, M. A new instrument for automated microcontact printing with stamp load adjustment. Review of Scientific Instruments. 79 (6), (2008).
- Pasturel, A., Strale, P., Studer, V. Tailoring 3D cell culture templates with common hydrogels. bioRxiv. , (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved