Method Article
שימוש של תהודה מגנטית הדמיה נתונים ביופסיה כדי להנחות הליכי דגימה עבור סרטן הערמונית ביאובאנקינג
In This Article
Summary
שיטה זו כוללת ניצול של נתוני אבחון קליני עבור חולי סרטן הערמונית על מנת להנחות את הליכי הדגימה, כאשר רקמת biobanking בעקבות כריתת רדיקלים קיצוניים. זה מתגבר על בעיות עם שיטות שפורסמו בעבר סביב יעילות וזמינות של רקמות טריות עבור מגוון רחב יותר של יישומי במטה.
Abstract
השיטות הקודמות רקמת הערמונית biobanking, בעקבות כריתת רדיקלים קיצוניים, בדרך כלל מעורב דגימה אקראית. כדי להגביר את היעילות, ולאפשר מגוון רחב יותר של יישומים במורד הזרם, פותחה שיטה ממוקדת יותר של דגימת רקמת הערמונית. כאן אנו משתמשים שני דימות תהודה מגנטית (MRI) ונתוני ביופסיה כדי למקד אזורים ספציפיים של האיבר לדיגום. השיטה כוללת שימוש במכשיר הערמונית שפורסם בעבר, אשר מסיר פרוסה רוחבי 5 מ"מ מאזור מוגדר מראש של הערמונית, ואחריו הסרת 6 מ"מ פונץ ביופסיות מאזורים קבועים מראש של פרוסה זו. דגימות אלה ניתן לאחסן קפוא או קבוע עבור biobanking מטרות, או בשימוש טרי מיד עם 70% ביטחון של תוכן הגידול, לעומת 10% ביטחון מהגישה דגימה אקראית. זה מאפשר את השימוש של כל טכניקות סטנדרטיות במורד הזרם כגון גנומיקה, פרוטאוומיקס או עבודה היסטולוגית, אבל גם עבודה הדורשת רקמה טרייה כגון הדמיית רקמה חיה או תרבות vivo ex.
Introduction
גישה לרקמת סרטן הערמונית באיכות גבוהה האדם היא דרישה מפתח לנהיגה במחקר אפקטיבי בתחום. ישנן מספר שיטות קיימות לדוגמה רקמת הערמונית לאחר ניתוח רדיקלי למחקר. בדרך כלל אלה כרוכות באמצעות ביופסיות אגרוף לקחת דגימות אקראיות מתוך פרוסה טרייה, קפואה או קבועה של רקמת הערמונית, ו כפוף מאשרת אם הגידול קיים בכל מדגם על ידי המטאוקסילין & אאוזין (H & E) כפי שמוערך על ידי ,מדבר2,3,4,5 סקירה שנערכה לאחרונה הפכה סקירה של שיטות קיימות אלה6. שיטות אלה שימושיות עבור יישומים מסוימים במורד הזרם, שבו רקמות ניתן לאחסן והעריכו עבור תוכן הגידול במועד מאוחר יותר, כגון בקנה מידה גדול מנתח גנומית כמו סרטן הגנום הבינלאומי (ICGC) וסרטן הגנום אטלס (TCGA) 4,7. עם זאת, ניתן לשפר שיטות אלה אם היינו להשתמש בדימות תהודה מגנטית (MRI) ו/או נתונים ביופסיה כדי למקד את האזורים הספציפיים של הערמונית לדיגום. זה ישפר את המתודולוגיה בשתי דרכים; ראשית, על ידי הפחתת מספר דגימות רקמות שנאספו, הגדלת יעילות והפחתת הלחץ על מחלקות פתולוגיה ועלות אחסון, ושנית, על ידי מתן אפשרות רקמות טריות לשמש מיד ללא צורך באישור מיידי של תוכן הגידול, עבור מדינה חדשה של האמנות במורד טכנולוגיות כגון הדמיה רקמה חיה, הדור אורגנואיד או תרבות vivo ex. הצורך מחקר זה הוביל את הפיתוח של העם (דגימות הערמונית החולה למחקר) שיטה, ואת התוצאות של 84 הראשונים המקרים biobanked קוטע באמצעות אנשים פורסמו לאחרונה8. וריאציה של שיטה זו גם פורסמה עם תלת מימדי (3d) מנגנון הפריסה מודפס ועובש ספציפי לחולה, כדי להקל על vivo MRI ex על לפני ושלאחר קיבוע רקמות9,10.
Protocol
הפרוטוקול מתייחס להנחיות המקומיות ומאושר על ידי ועדת האתיקה של מחקר UCL/UCLC YH/0311).
הערה: כאשר שיטה זו כרוכה בדגימת רקמה אנושית, כל ההליכים המקומיים לגבי אתיקה והסכמה חייבים להיות מראש בתחילת הפרוטוקול. מקרי הניתוח הרדיקלי ניתן לכלול אם שני הנתונים MRI ו ביופסיה זמינים מראש של ניתוח, עם קוטר הגידול ≥ 5 מ"מ. המקרים צריך להיות נשלל אם הנגע המדד אינו מוגדר היטב, כלומר, רק שינויים מפוזר גלויים על ידי MRI.
1. מנגנון לחלוקת הערמונית
- לרכוש את מנגנון הערמונית (לוח חומרים). לחלופין, הדפס נקודת אחיזה ללהב באמצעות מדפסת תלת-ממד כאשר פורסמה בעבר10.
הערה: המכשיר ולהבי חד פעמיות המשמשים כאן נרכשו תחת הסכם העברת חומר מן המכון לחקר הסרטן, לונדון, בריטניה.
2. מיקוד הגידול
- סקירת הערות קליניות כדי לזהות את הנגע המדד כפי שצוין על ידי ביופסיה אבחון, למשל, האחורי השמאלי.
- סקירת תמונות MRI כדי למדוד את המיקום של הגידול לעיל.
- מצא את הרצף שבו הגידול הוא הנראה ביותר במישור צירית, למשל, T2-משוקלל.
- גלול בתמונות צירית כדי למצוא את התמונה שבה הגידול הוא הגדול ביותר והדפס תמונה לצורך התייחסות.
- בתמונה המקבילה המתאימה, למדוד את המרחק מהבסיס של הערמונית לתנוחת צירית נבחר, ואת אורך מלא של הערמונית מן הפיסגה לבסיס (mm), ולהדפיס עבור התייחסות.
3. אוסף של pProstate
- בדוק הערות המטופל כדי להבטיח הסכמה מושכלת מידע התקבל עבור הליך זה וכל יישומי מחקר מטה.
- לאחר כריתת הערמונית רדיקלי, לאסוף את הפרוסטטה בסיר יבש. ודא לא פורמלין או קבע אחרת נוספה הערמונית.
- העברה למיקום סטרילי ומתאים לדיגום, לדוגמא, כיסוי למינארי במעבדת פתולוגיה.
- המשך לדיגום בהקדם האפשרי אם יש צורך ברקמה טרייה.
הערה: עבור יישומים מסוימים (למשל, הערכה של DNA אשר לא צריך לבזות מהר כמו RNA), זה עשוי להיות מתאים להכניס למקרר את הדגימה ולקחת דגימות למחרת.
4. הכנה לדגימה
- הכינו מנגנון זרימה למינארי ומכשיר לחיתוך הערמונית על פי נוהלי טיהור מקומיים, תוך שימוש בטכניקה סטרילית. כאן, ריסוס 70% אתנול ולנגב על פני כל המשטחים. השתמש במחטים ומחטים. חד-שימוש סטריליים השתמש בלהבים מבצעה עד שלוש פעמים; לשטוף לאחר כל שימוש במי סבון חם, ואז לרסס ולנגב עם 70% אתנול.
- שוקלים את הערמונית (g) באמצעות קנה מידה סטנדרטי.
- . דיו על הערמונית צבעו את הצד השמאלי בדיו כחול ומצד ימין עם דיו שחור. כסו את הקפסולה המלאה ואת שלפוחית הזרע עם דיו כדי לציין מאוחר יותר את השוליים הכירורגית.
הערה: הליכי סימון בדיו עשויים להשתנות באופן מקומי וניתן לשנותם בהתאם.
5. פרוסות בלוטת הערמונית
- הכנס את מנגנון הפריסה על ידי החדרת הקירות ניצב לבסיס המעמד (איור 1א).
- מניחים את הערמונית כך שהבסיס והקודקוד ניצבים מול קירות הפנים, כאשר הצד האחורי למטה והקדמי למעלה. מניחים סיכות זהב סביב הערמונית. דחוף פנימה הערמונית מעט במידת הצורך כדי לקבל התאמה חמימה, אשר יתמוך הערמונית במהלך חיתוך.
- מדידת אורך הערמונית מהבסיס לפיסגה, באמצעות סרגל, ולהשוות עם אורך הערמונית כפי שנמדד על ידי MRI. אם הערמונית התכווץ, להחיל תיקון אד הוק על המרחק הצפוי מהבסיס לפלח רוחבי היעד. לדוגמה, אם אורכו המלא של הערמונית בתמונת ה-MRI הוא 50 מ"מ, אך כאשר נמדד עם סרגל בנקודה זו הוא התכווץ ל 45 מ"מ, להקטין את מיקום החיתוך הצפוי ב -10%.
- מדידה מהבסיס לפרוסה הרוחבי הרצויה. בחר את הסיכה שיושבת הקרובה ביותר למדידה זו כדי לחתוך מסביב.
- לבישת כפפות הדואר האלקטרוני כדי למנוע פציעה, להחזיק לחתוך את המכשיר (איור 1B), במקום להבים משני צדי הפין המזוהה ולהשתמש מרווח כדי לשמור על להבים 5 מ"מ בנפרד. קחו את הפרוסה באיטיות ובחוזקה הזזת הלהבים כלפי מטה, קדימה ואחורה במשיחות ארוכות (איור 1ג). ודא שפרוסה מלאה הופרזה לפני הפרדת המנגנון.
- להסיר קירות וסיכות ובזהירות לקחת את הפרוסה אל סדין סטרילי של לוח שעם באמצעות כפפות.
6. דגימת רקמה
- בדקו חזותית את הפרוסה הרוחבי והשוו עם תמונת ה-MRI הצירית. במקרים מסוימים, אזור הגידול עשוי להיראות חיוור יותר מאשר הרקמה הסובבת.
- משוך את הפרוסה הרוחבי בעדינות. במקרים מסוימים, הגידול עשוי להרגיש תקיף יותר מאשר הרקמה הסובבת.
- באמצעות תמונת ה-MRI הצירית כמדריך, בחר אזור אחד או יותר לדגימה.
-
לקחת אגרופים ביופסיה של האזור הרצוי של רקמות.
- באמצעות אגרוף 6 מ"מ, לדחוף למטה על האזור הרצוי של רקמות.
- סובבו את הניקוב הרקמות על הנקודה ולמטה כנגד הפקק כדי להבטיח הפרדה מלאה ולהשתמש באזמל חד כדי להפריד במידת הצורך.
- להסיר את האגרוף ואת המקום צינורות/תבניות לפי הצורך על ידי הוצאת באמצעות הבוכנה.
- חזור על הגידול ודגימות שפירים כנדרש, עם אגרופים נפרדים ביופסיה סטרילית. דיו על החורים שבהם. האגרופים נלקחו באדום
- שים לב למיקום של כל אגרוף יחד עם המשקל של הערמונית וכל התצפיות על צבע רקמה/מוצקות.
7. הגשת הערמונית לאבחון מקומי
- הצמד את הערמונית לשעם מחטים סטרילי לשימוש יחיד לפני קיבעון על מנת למנוע הצטמקות רקמות ועיוות, אשר יכול לשנות את המראה של השוליים הכירורגית.
- בעקבות הצמדה לשעם, לשלוח את הערמונית למחלקה histopathology עבור אבחון קליני סטנדרטי.
8. טיהור מכשירים
- השמט את כל הציוד החד בנחלים ומיכלי השרפ הרפואיים המיועדים לשימוש מקומי.
- טהרים מנגנון הזרימה הבינארי ומנגנוני הערמונית בהתאם להערכות הסיכון המקומיות המתאימות לרקמה האנושית (למשל, בריסוס עם 70% אטוח וניגוב).
תוצאות
רקמת הערמונית טרי שנדגמו באמצעות שיטת העם ניתן להשתמש עבור מגוון של טכניקות במורד הזרם, כולל רצף גנומית ותרבות vivo ex. 59 המקרים הראשונים שנדגמו בשיטה זו פורסמו בעבר בהשוואה לגירסה קודמת של השיטה, יחד עם נתוני הזרם הראשוניים8. הזמן החל תחילה לחתוך את הערמונית כדי להקפיא/תיקון ביופסיות אגרוף כאן היה כ 1 דקות, אשר נשמר למינימום כדי למנוע השפלה של RNA. זמן מהסרת הערמונית כדי לחתוך הערמונית צריך גם להישמר למינימום, למרות כאן זה לקח כ 20 דקות בשל התיאטרון שלנו מעבדות פתולוגיה להיות במיקומים שונים.
בהתאם ליישום במורד הזרם, בדרך כלל לפחות שתי דגימות נלקחים: אחד מאזור של רקמת הגידול צפוי ואחד מאזור של רקמה שפיר צפוי. המדד העיקרי של ההצלחה עבור שיטת הדגימה עצמה היא להעריך את תוכן הגידול במדגם נתון.
עבור כניסה לתוך הפרויקט 100,000 גנום, H & E ויטראז מקטע חייב להיות מוערך על ידי הפתולוג, והמדגם חייב להכיל לפחות 40% תאים סרטניים. דוגמאות המכילות פחות מ-40% הגידול עדיין עשויות להיכלל בפרוייקט אם הן מאקרו בהצלחה. מתוך 92 המקרים הראשונים שנדגמו באופן זה, 64% הכיל לפחות 40% הגידול הוגשו לפרויקט הגנום ה100,000 ללא מאקרוקרע. ה-DNA הופק והיה מספיק תשואה ואיכות בכל המקרים (שולחן 1). קבוצת משנה ראשונית של 59 מדגמים אלה פורסמה בעבר בהשוואה לשיטה מוקדמת יותר של8.
עבור תרבות vivo ex, גידול בהתאמה ורקמות שפיר חייב להיות באיכות מספקת לעמוד 72 h תרבות ללא השפלה משמעותית. דגימות רקמות מרובות מסכום כולל של שלושה חולים היו מתורבתים בהצלחה8.
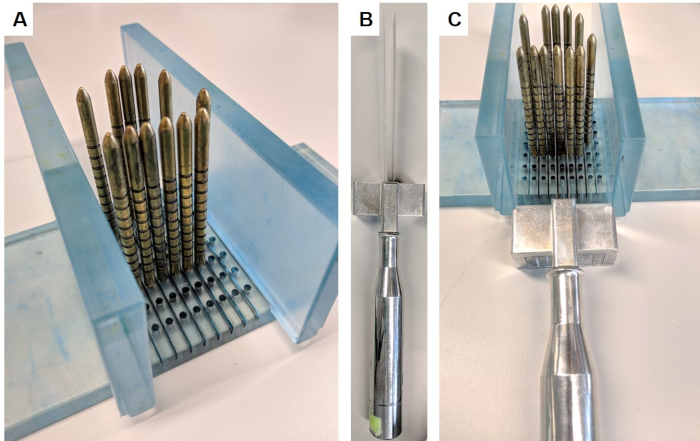
איור 1: מנגנון לחלוקת הערמונית. מנגנון זה הושג תחת הסכם העברת חומר מהמכון לחקר הסרטן. (א) הקירות מוכנסים בניצב לבסיס, וסיכות זהב מוכנסים לבסיס המקיף את הערמונית (הערמונית לא בתמונה). (ב) הלהבים המקבילים הניתנים להחלפה מוכנסים לידית הלהב. (ג) הלהבים עוברים בין סיכות זהב כדי לחתוך קטע 5 מ"מ של הערמונית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| n (%) | |
| מכה (> 40% הגידול) | 59% (64%) |
| כניסות חלקיות (5-30% הגידול) | 6 (7%) |
| מיס (0% גידול) | 27 (29%) |
| כולל | 92% (100%) |
טבלה 1: שיעור הפגיעה בגידול. שיעור הפגיעה בגידול נקבע על ידי הפתולוג יועץ המתמחה בסרטן הערמונית, בעקבות סקירה של הרקמה הצבעונית של H & E. תאים סרטניים תוכן של > 40% נקבע להיות מתאים להכללה ב-100,000 Genomes פרוייקט, כמו לכל הנחיות גנומיקה אנגליה.
Discussion
צעדים קריטיים בתוך פרוטוקול זה כוללים זיהוי של אזור הגידול לדיגום, מדידה של הערמונית, ודגימת רקמות. ראשית, מדידה של ה-MRI כדי לזהות את האזור הנכון של הדגימה הוא המפתח. אנו מדגימים שיטה זו בווידאו הנלווה; עם זאת, אנו ממליצים גם על המאשרת מדידות ברדיולוג בערכאה הראשונה. ברור הערות קליניות אשר מצביעים על החוקר לכיוון השטח של תמונות ה-MRI המכיל את הנגע המדד הם אידיאליים. שנית, מדידה של הערמונית צריך להתבצע בזהירות, להבטיח כי השליט מוחזק בזווית כדי למדוד את האורך המלא מהבסיס לקודקוד, במקביל הקדמי של הערמונית. שלישית, אזורי הגידול יש לאשר לפני הדגימה על ידי בדיקה חזותית את פרוסת הרקמה ביחס לתמונת ה-MRI המקורי, palpating הרקמה (במקרים מסוימים אזור הגידול יכול להרגיש צפוף יותר), ויזואלית להעריך את הצבע של הרקמה (כמה מקרים הגידול ייראה חיוור יותר מאשר הרקמה השפיר הסביבה).
פרוטוקול זה בוצע במלואו ב UCL/UCLH על ידי חוקרים שאינם קליניים קלינית, ברנש פתולוגיה, לפתולוגיה יועצים, וטכנאים מחקר. בניסיון שלנו ניתן ללמוד את כל הצעדים של הפרוטוקול בפחות מעשרה מקרים ללא קשר לרקע הטכני. עם זאת, אנו ממליצים על הדרכה מרדיולוג לגבי מדידת MRI והדרכה של הפתולוג לגבי חיתוך במקרה הראשון. ניתן לשנות את הפרוטוקול באמצעות נקודת אחיזה לחיתוך מודפס תלת-ממדי, כפי שפורסמה בעבר10.
מגבלות פוטנציאליות של הטכניקה כוללות את הסיכון לסכל את האבחנה. חיתוך הערמונית הוא צעד מפתח, אשר יכול לעכב את הדירוג או שיעורי שוליים חיוביים אם נעשה באופן שגוי. . יש כאן שני בעיות פוטנציאליות ראשית, אם כל הנגע המדד מוסר ומשמש ניסויים רקמות טרי מיד, אבחון קליני שגרתי לא יבוצע עבור הנגע הזה והחולה עשוי להיות מאובחן בטעות כבעל סרטן בכיתה נמוכה. כדי למנוע זאת, החוקר צריך לדון בתוכנית הדגימה עם הפתולוג יועץ אשר באופן שגרתי לסקור את המקרה, לפני הדגימה, ולהסכים על מספר, ומיקום, של דגימות להילקח. גידולים קטנים ניתן לכלול באופן מקומי מסיבה זו. שנית, אם קפסולת הערמונית אינה מוצמדת כראוי ללוח שעם לפני קיבעון, זה יכול לאפשר את הרקמה הפנימית לבליטה החוצה במהלך הקיבעון, שינוי השוליים כירורגי. זה יכול להוביל שוליים חיוביים שווא, שבו הגידול הנותרים נראה לשכון הקפסולה גרידא בשל העיוות רקמות.
המשמעות של טכניקה זו ביחס לשיטות הקיימות טמונה בעיקר עם מיקוד הגידול. מגוון של שיטות לדגימה של דגימות קיצוניות של ניתוח רדיקלים פורסמו עד היום; עם זאת, כל אלה להסתמך על גישה דגימה מלאה או אקראית חלקית1,2,3,4,5,6,7. השימוש בביופסיה ובנתונים MRI מסוימים כאן יש יעילות משופרת, המאפשר דגימה מופחתת עם ביטחון מוגבר של קבלת רקמת הגידול8.
יישומים עתידיים של שיטה זו מאפשרים אימוץ של מגוון רחב יותר של טכניקות במורד הזרם מאשר עם שיטות דגימה קודמות. לדוגמה, הזמינות של רקמה טרייה כי יש סבירות גבוהה להיות גידול פירושו כי יקר יותר/או עבודה אינטנסיבית רקמות טריות יכול להיות מנוצל, כמו דגימות רבות אינן נדרשות כדי להבטיח נוכחות של גידול. זה יכול לכלול ואינו מוגבל, לשעבר תרבות vivo, MRI vivo ex, הדמיה מתקדמת ו transcript.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים רוצים להכיר סרטן הערמונית בריטניה עבור מימון SH תחת סרטן הערמונית מרכז בבריטניה של מצוינות ומלגת פרס הנסיעה (TLD-PF16-004) ו-HP תחת חדשנות (PG14-018-TR2). עבודה זו נתמכת על ידי חוקרים במכון הלאומי לחקר הבריאות באוניברסיטת מכללת בלונדון בתי חולים מחקר ביורפואי מרכז.
Materials
| Name | Company | Catalog Number | Comments |
| 6 mm biopsy punch | Fisher Scientific | 13404607 | Disposable biopsy punches for removing 6 mm tissue samples |
| Black Ink | Leica Biosystems | 3801753 | Tissue marking & margin dye |
| Blue Ink | Leica Biosystems | 3801751 | Tissue marking & margin dye |
| Chainmail hand glove | Arco | 1456803 | Chainmail gloves to protect hand during slicing |
| Cork board | Fisher Scientific | 12396447 | Cork board for pinning prostate to following sampling procedure |
| Needles | SLS (Scientific Laboratory supplies) | SYR6112 | Sterile needles to use to pin tissue to cork board following sampling |
| Prostate slicing aparatus | Insitute of Cancer Research, London | NA - must be obtained under MTA | A kit containing the slicer handle, blades, spacer, base, walls and pins |
References
- Sooriakumaran, P., Henderson, A., Denham, P., Langley, S. E. A novel method of obtaining prostate tissue for gene expression profiling. International Journal of Surgical Pathology. 17 (3), 238-243 (2009).
- Jhavar, S. G., et al. Processing of radical prostatectomy specimens for correlation of data from histopathological, molecular biological, and radiological studies: a new whole organ technique. Journal of Clinical Pathology. 58 (5), 504-508 (2005).
- Wheeler, T. M., Lebovitz, R. M. Fresh tissue harvest for research from prostatectomy specimens. The Prostate. 25 (5), 274-279 (1994).
- Esgueva, R., et al. Next-generation prostate cancer biobanking: toward a processing protocol amenable for the International Cancer Genome Consortium. Diagnostic Molecular Pathology. 21 (2), 61-68 (2012).
- Dev, H., et al. Biobanking after robotic-assisted radical prostatectomy: a quality assessment of providing prostate tissue for RNA studies. Journal of Translational Medicine. 9, 121 (2011).
- Tolkach, Y., et al. Blind Biobanking of the Prostatectomy Specimen: Critical Evaluation of the Existing Techniques and Development of the New 4-Level Tissue Extraction Model With High Sampling Efficacy. The Prostate. 77 (4), 396-405 (2017).
- Warren, A. Y., et al. Method for sampling tissue for research which preserves pathological data in radical prostatectomy. The Prostate. 73 (2), 194-202 (2013).
- Heavey, S., et al. PatiEnt prOstate samPLes for rEsearch, a tissue collection pathway utilizing magnetic resonance imaging data to target tumor and benign tissue in fresh radical prostatectomy specimens. The Prostate. 79 (7), 768-777 (2019).
- Bailey, C., et al. VERDICT MRI validation in fresh and fixed prostate specimens using patient-specific moulds for histological and MR alignment. NMR in Biomedicine. 32 (5), 4073 (2019).
- Bourne, R. M., et al. Apparatus for Histological Validation of In Vivo and Ex Vivo Magnetic Resonance Imaging of the Human Prostate. Frontiers in Oncology. 7, 47 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved