Method Article
התמרה והרחבה של תאי T ראשוניים בתשעה ימים עם אחזקה של זיכרון מרכזי מושגים
In This Article
Summary
אנו מתארים פרוטוקול של 9 ימים עבור התמרה והתרחבות של דם היקפי רזוס מקוק תאים מונמוננקה שתשואות תאים עם ביטוי מעולה של הגנים של העניין במספר מספיק עבור מחקרי אינפוזיה של יעילות התא.
Abstract
חיסוני המתעוררים לטיפול במחלות זיהומיות וסרטן לעתים קרובות כרוך התמרה של אוכלוסיות סלולריות עם גנים קידוד מחלות מיקוד החלבונים. לדוגמה, כצ קולטן אנטיגן (רכב)-T תאים לטיפול בסרטן וזיהומים נגיפי כרוך התמרה של תאים T עם גנים סינתטיים קידוד מולקולות רכב. מולקולות רכב להפוך את התאים T במיוחד לזהות ולהרוג סרטן או תאים נגועים virally. תאים יכולים גם להיות מהתמרה משותפת עם גנים אחרים של עניין. לדוגמה, תאים יכולים להיות משותפים עם גנים קידוד חלבונים היעד תאים למיקומים ספציפיים. כאן, אנו מציגים פרוטוקול כדי לשנות את הדם ההיקפי העיקרי תאים מוננונקה (PBMCs) עם גנים קידוד מכונית ספציפית וירוס ו תא B זקיק מולקולה מולקולת כימוקין סוג 5 (CXCR5). הליך זה לוקח תשעה ימים ותוצאות התמרה אוכלוסיות תא T לשמור על הזיכרון המרכזי הפנוטיפ. תחזוקה של זיכרון מרכזי או פנוטיפ פחות מובחנים הוכחו לשיוך להתמדה של תאים שלאחר העירוי. יתר על כן, תאים המיוצרים עם שיטה זו להראות רמות גבוהות של יכולת הכדאיות, רמות גבוהות של ביטוי שיתוף של שני גנים התמרה, וכמויות גדולות מספיק של תאים עירוי חיסוני. פרוטוקול זה בן תשעה ימים עשוי לשמש בהרחבה עבור תא CAR-T וגישות אחרות לחיסוני תא T. השיטות המתוארות כאן מבוססות על מחקרים שהוצגו בפרסומים הקודמים שלנו.
Introduction
חיסוני הסלולר מתגלים כאמצעי חדש לטיפול במחלות כולל סרטן ומחלות זיהומיות. שיטות הטיפול החיסוני מעורבות בדרך כלל בתאים טיפוליים לבטא מולקולות ספציפיות. לדוגמה, כימאריק קולטן אנטיגן (רכב) תאים T מתוכננים לבטא מולקולה רכב כי יש תחום החילוץ כי נקשר במיוחד מולקולות על תאים חולים ומתחם איתות המפעיל את התאים החיסוניים להרוג את התא החולה. תאי T מכונית נמצאים בשימוש בהצלחה חיסוני סרטן, והיה יעיל במיוחד בטיפול B תא לוקמיה1,2,3. מכונית-T תאים גם מפותחים לטיפול בזיהומים נגיפי כגון HIV. HIV ספציפי מכוניות למקד את החלבונים המעטפה על פני השטח של תאים נגועים באופן ויראלי4. תאים אימונותרפיה יכולים גם להיות מהונדסים לבטא מולקולות ביות למקד את התאים הטיפוליים למיקומים רקמות ספציפיות. פיתחנו וקטורים כי מעביר הן מכונית ספציפית וירוס, כמו גם הלימפה זקיק מולקולה CXCR55.
שכפול נגיפי של וירוסים מסוימים, כולל וירוס הכשל החיסוני האנושי (HIV) וירוס הכשל החיסוני קופיים (סיב), מרוכז ב-B זקיקי תאים ברקמות הלימפה המשני6. ב-זקיקי התאים הם אתרים מיוחסים במקצת, בהם רמות נמוכות של וירוסים ספציפיים לאישור CTL שכפול ויראלי מתמשך7,8. מסיבות אלה, מיקוד התאים HIV/סיב ספציפי T לתוך זקיק דרך הביטוי של CXCR5 היא אסטרטגיה חיסול של מאגר הזקיקים של תאים נגועים virally9,10. באופן ספציפי, אנו מיקוד התאים הספציפיים סיב מכונית T אל זקיקי התא באמצעות CXCR5 הביטוי המשותף.
בפרוטוקול זה אנו מתארים שיטה לשנות את המכונית/CXCR5 ולהרחיב PBMCs לייצר תאים מכונית/CXCR5 T של כמויות מספיקות אינפוזיה טיפולית. תאים שעברו התמרה עם שיטות אלה לשמור על הזיכרון המרכזי הפנוטיפים. מחקרים הראו כי תאים עם פנוטיפ פחות הבדיל, כגון הזיכרון המרכזי t תאים ותאי גזע t זיכרון להתמיד יותר מאשר תאים הבדיל יותר11,12. בנוסף, פרוטוקולים רבים שנועדו לייצר תאים שהועברו מאומצים יש זמן רב יחסית בתרבות כי התוצאה בתאים שיש להם פנוטיפ הבדיל יותר והתמדה מופחתת13. יתר על כן, תאים שהועברו מאמצים עם זמני תרבות ארוכים שהצטברו בתוך הריאות במקום רקמות14הלימפה היעד ב רזוסמקוק 14,15. בשיטות שאנו מתארים ולהדגים כאן, אנו מרחיבים במהירות ולהרחיב PBMCs רזוס מקוק לייצר תאי T מתתמרים לשמור על הזיכרון המרכזי הזיכרונות.
גם תאי CD4 ו-CD8 T נכללים בגישת החיסוני שלנו. זה האוכלוסייה תא מעורב נבחר כי, בניסויים קליניים, העדר CD4 + T תאים במוצר תא CD8 + T היה מתואם עם כישלון של תאים CD8 T מעורבב כדי להמשיך 16. השיטות המתוארות כאן מתחילות בהפעלת pbmcs עם נוגדנים anti-CD3 ו anti-CD28 אשר לעורר בסיפוק את הקולטן התא T ולספק אות שיתוף מגרה כדי למנוע שבטיים anergy17,18.
לאחר ההפעלה, תאים מותמרים עם קידוד וקטורי של gammaretroviral מכונית ספציפית וירוס ואת המולקולה הלימפה CXCR5. תאי התמרה מורחבת לאחר מכן באמצעות צלחות שנועדו עבור הפצת תאים שאינם חסיד אשר יש קרום חדיר גז בבסיס. קרום זה מתיר החלפת גז בתחתית הבאר המובילה הישרדות התא משופר זמינות מזינים19. באמצעות שיטות אלה, ניתן לייצר תאים פונקציונליים מספיקים בפרק זמן של 9 ימים במחקרים vivo אינפוזיה. למרות שפרוטוקול זה מיועד לצורך התמרה והרחבה של תאי מקוק רזוס, עם שינוי קל של נוגדנים מסוג מינים ספציפיים, ניתן להשתמש בו עם תאים ממינים אחרים. שיטות אלה מבוססות על מחקרים שפורסמו בעבר9,20.
Protocol
הערה: פרוטוקול התמרה רזוס של PBMC זה מחייב שימוש בווקטור של הגמרואטנגיזציה. שימו לב כי ניתן לייצר וירוס gammaretrovirus במעבדה או מיקור חוץ לחברת הפקה נגיפית. בייצור מעבדה ניתן לבצע עם הפרוטוקול המתואר בשלב 1 והווירוס ניתן לבצע כמתואר בשלב 2. אם הנגיף מופק באתר או על-ידי חברת הפקה, יש לקבוע את משרד היחסי (יחס של הריטונים הזיהומיות לתאים בתרבות), כפי שמתואר בשלב 3, עבור כל הכנה ויראלית שנוצרה לאחרונה ותאי הריבית.
התראה: עבודה עם וקטורים וקטורים מסוג הגמאראטריליים או כלים אחרים מחייבים אמצעי זהירות נאותים כגון שימוש במעילים מעבדה ושכבות כפולות של כפפות. כל הטיפול בווירוס חייב להתרחש במכסה הביובטיאל. כל הdecontaminated צריך להיות בתמיסה של 10% אקונומיקה עבור 30 דקות. יש לdecontaminated את כל הפסולת הזיהומית הנוזלית בריכוז הסופי של 10% אקונומיקה. בלימה משנית, עם חותם המונע שחרור של אירוסולים מיקרוביולוגית, נדרש עבור צנטריפוגה
1. הפקת מניות הגממראטנגיל
- הצלחת 293T תאים לזיהום. הכנה וירוס מלא דורש 12 T75 מבחנות ב 4.5 x 106 תאים/בקבוקון ב שונה מדיום הנשר בינונית (dmem) + 10% סרום עוברי (fbs) ללא אנטיביוטיקה.
- אפשר לתאים לצמוח לילה ב 37 ° צ' לפני החצייה.
- לדלל 60 μL של הזיהום מגיב ב 1.5 mL מופחתת סרום מופחת. הכן צינורית אחת לכל בקבוקון. מודטה למשך 5 דקות ב RT.
- עבור כל בקבוקון, להכין צינור המכיל 1.5 mL של מדיה סרום מופחת ואת הפלמידים הבאים: 9.0 μg של העברת הפלסטיק המכיל את הגן (s) של עניין, 3 μg של RD114 ו 1.2 μg של VSV-G (פלמידים המעטפה), ו 3 μg של מחסום-פה/פול.
הערה: המעטפה ו-לחסום/פול גנים נחוצים עבור האריזה retroviral יעיל. עבור הייצור הרטרונגיפי שלנו, אנו מוסיפים הן את המעטפה RD114, עבור הוסיף יציבות, כמות קטנה של מעטפת VSV-G. - הוסף פלמידים מדולל (שלב 1.4) כדי מדולל בזיהום החצייה (שלב 1.3). מערבבים בעדינות. דגירה של 20 דקות בטמפרטורת החדר.
- להאכיל את התאים 5 מ ל של מדיה מלאה טרי ולהוסיף 3 מ ל של החוצה הזרע מגיב/בינוני בתערובת בקבוקון לבקבוקון ו דגירה עבור 5 – 6 h ב 37 ° c.
- הוסף 5 מ ל נוסף של בינוני טרי כדי מבחנות ו דגירה עבור 42 – 43 h ב 37 ° c.
- לאחר זמן החצייה הכולל של 48 h, לאסוף מדיה צנטריפוגה ב 1282 x g עבור 3 דקות ב 4 ° צ' כדי להסיר פסולת תא.
- הבהוב לתוך אמצעי אחסון מתאימים לשימוש עתידי, הקפאת הווירוס באמבט אתנול/קרח יבש והחנות ב-80 ° c.
2. לאחד את הווירוס Gammar, וירוס
הערה: מספר מדלל של וירוס עשוי להיות צורך להשיג titer תקף.
- צלחת 293T תאים ב 600,000 תאים/גם בצלחת 6-באר ו מודקת את הצלחות עבור 24 h ב 37 ° c.
- הסר את המדיום מן התאים והוסף את הסכום הרצוי של Dמאמ + 10% FBS ל 293T (2 mL נפח כולל של וירוס).
- להוסיף את הווירוס המתאים היטב מערבולת בעדינות לערבב. לדוגמה, הוסף 200 μL, 100 μL, 50 μL ו-25 μL בהתאמה ל-4 בארות. כלול גם היטב ללא וירוסים עבור cy, לדוגמה מדגם).
- מודטה עבור 48 h ב 37 ° c.
- טריזיסיזציה של התאים 293T על ידי הוספת 0.5 mL של טריפסין-EDTA ו הדגירה 4 דקות ב 37 ° c. הפסיקו את הטריפסין על-ידי הוספת 1.5 mL של Dמאמ + 10% FBS. ספור את התאים וקבע את הכדאיות באמצעות מונה תאים אוטומטי או הומוציטומטר.
- כדי להשתמש במונה התאים, הוסף 10 μL של תאים עד 10 μL של טרימין כחול, ערבב, טען את השקופית הקאמרית והכנס לתוך המונה. ללחוץ על כפתור "ללכוד" כדי לספור את התאים.
- לאסוף 0.5 – 1 x 106 תאים ולהעריך רמות של רכב CXCR5 ידי הזרמת cy, לראות (ראה שלב 9.5). ביטוי של CD4 או MBL יחד עם CXCR5 יזהה התמרה 293T t לבטא את המכונית ואת CXCR5. ראה נוגדנים ראקטיבית בשלב 9.5.1.
- חישוב titer נגיפי.
הערה: בחר את המדגם ברמת התמרה של 20% או פחות לחישוב titer.- השתמש בנוסחה הבאה לחישוב titer:
יחידות התמרה/mL = (מספר התאים בתרבות) (% של תאים שעברו התמרה)/נפח של וירוס שנוסף לתרבות
- השתמש בנוסחה הבאה לחישוב titer:
3. קביעת משרד המידע האופטימלי עבור הכנה ויראלית שיוצרו לאחרונה ותאי העניין
- בצע את פרוטוקול התמרה (סעיפים 4 – 9) עם PBMCs הראשי וכפולה של הכנה מגמאראטנגיזציה.
- להעריך את רמת הביטוי של הגנים של העניין על ידי הזרימה cy, (שלב 9.5).
- בחר ריכוז של וירוס המאפשר התמרה מקסימלית ללא אובדן הכדאיות של התא.
4. הכנת צלחות להפעלת תא T על ידי ציפוי וולס עם נוגדנים נגד CD3
- הכנת נוגדן CD3 נגד מקוק (FN18) על ידי דילול המניה כדי 10 μg/mL ב פוספט מאגר מלוחים (PBS).
- מדבקות 2 מ ל/ובכן ב 6-צלחות. המלון משלב בין השאר ב37 ° c עבור 2 מעלות לחילופין.
- . והנוגדנים הלא מאוגדים לשטוף בארות פעמיים עם 2 מ ל של PBS ולהשתמש מיד לוחית PBMCs.
5. עירור רזוס PBMCs עם צלחת מאוגד Anti-CD3 ו מסיסים Anti-CD28
- הפשרת רזוס PBMCs העיקרי באמבט מים בגובה 37 ° c, עם עצבנות עדינה, עד שנותר רק כמות קטנה של קרח.
- במכסה המנוע, בעדינות מנקז. תאים לתוך צינור חרוט לשטוף את המבחנה עם 1 מ ל של בינונית בסיסית ולהוסיף אותו לאט לתאים. לאחר מכן, לאט להוסיף 9 מ ל נוסף של בינונית בסיסית חמה לתאים.
הערה: ניתן לשנות שלב זה, אך לעולם לא להפשיר יותר מ-4 מבחנות בו. - צנטריפוגה ב 600 x g עבור 5 דקות ב 22 ° c כדי לצנפה את התאים. ולאחר מכן השהה מחדש את הגלולה. בכמות קטנה של מדיום גדילה בחר אמצעי אחסון כזה שריכוז התאים יעלה על 2 x 106 תאים/mL בשלב זה מאז הריכוז הסופי צריך להיות 2 x 106 תאים/mL.
- כתמים תאים עם טרי, כחול ולספור את התאים כדי לקבוע את מספר תאים קיימא.
הערה: ניתן לעשות זאת באמצעות הומוציטוטומטר סטנדרטי או מונה תאים אוטומטי. אנו משתמשים בדלפק תאים אוטומטי המציג את הכדאיות ואת מספר התאים החיים.- כדי להשתמש במונה, להוסיף 10 μL של תאים כדי 10 μL כחול, לערבב, לטעון את שקופית קאמרית ולהכניס לתוך הדלפק. ללחוץ על כפתור "ללכוד" כדי לספור את התאים.
- חשב את המספר הכולל של תאים על-ידי הכפלת ריכוז התא באמצעות נפח ולאחר מכן דלל את התאים ל-2 x 106 תאים/mL במדיום גדילה. לפני ציפוי, להוסיף anti-CD28 לריכוז הסופי של 5 μg/mL על מנת לספק אות מגירוי שיתוף הכרחי עבור הפעלת התא T.
- תאים פיפטה לתוך לוחות מצופים אנטי CD3. הוסף 3 – 6 x 106 תאים לכל טוב (המטרה הטובה היא 4 x 106 תאים ב 2 מ"ל מדיה לכל טוב) ו דגירה עבור 2 ימים ב 37 ° c ב 5% CO2.
6. הכנת לוחות מצופים בפיסמטין
הערה: PBMC ו-T תאים לבטא אינטגרציה קולטנים ויולה-4 או ויולה-5 והם מטרות טובות עבור התמרה בתיווך fibronectin.
- לפני ציפוי לוחיות, ראשית להכין fibronectin מגיב על ידי דילול זה 1:100 ב-PBS סטרילי.
- פיפטה 2 מ ל של התמיסה הסטרילית של fibronectin לתוך כל טוב של צלחת 6-היטב. לוחות סלע בעדינות עבור 2 h בטמפרטורת החדר.
הערה: בשלב זה יש להשתמש בכלים שאינם מטופלים, לוחיות התרבות של רקמת התאים או מנות שאינן מטופלות. - הסר את הפתרון fibronectin על ידי שאיפה ולאחר מכן לחסום עם 1 מ ל של סטרילי 2% סרום שור בקר (BSA, שבר V) ב-PBS. מטלטל את הצלחות בטמפרטורת החדר למשך 30 דקות.
- מטפי את פתרון BSA ולשטוף את הצלחת עם 2 מ ל של PBS. לאחר השאיפה של ה-PBS, ניתן לאטום את הלוחות המגולפות בציפוי האטום בעטיפת החותם ולאחסנו ב -4 ° c עד שבוע.
הערה: אנו בדרך כלל מכינים את הצלחות יום אחד לפני התמרה.
7. התמרה של הרזוס מופעל PBMCs
התראה: עבודה עם וקטורים ויראליות או עם PBMCs רזוס מקוק דורש ניצול של אמצעי זהירות נאותים כגון שימוש במעילים מעבדה ושכבות כפולות של כפפות. כל הטיפול בווירוס והתאים חייבים להתרחש במכסה הביובטיטיאלי. כל הdecontaminated צריך להיות בתמיסה של 10% אקונומיקה עבור 30 דקות. יש לdecontaminated את כל הפסולת הזיהומית הנוזלית בריכוז הסופי של 10% אקונומיקה. בלימה משנית עם חותם המונע שחרור של אירוסולים מיקרוביולוגית, נדרש עבור צנטריפוגה.
- הצמד את וקטור הגמרואטריקציה לציפוי היטב.
- לחמם צנטריפוגה 32 ° צ' על ידי ריצה ב 2000 x g כ 30 דקות.
- חמם גם את הסרום מדיה חופשית וצמיחה באמבט מים ב37 ° c.
- הפשרת הווירוס על הקרח או על ידי מתערבל בעדינות במבחנה באמבט מים 37 ° c עד כמות קטנה של קרח בלבד. כדי להימנע מהשפלה של ההכנה הנגיפית, אל תאפשר לתכנים להתחמם.
- דלל את הרטרו וירוס לריבוי מוגדר מראש של זיהום (מוי) במדיום ללא סרום.
הערה: עם וירוס gammar, שלנו רזוס PBMC, גילינו כי משרד ה0.5 הוא אופטימלי.- דילול לדוגמה: לחלוק 4 בארות עם וירוס ולהוסיף 1.5 x 106 תאים, (4) (1.5 x 106) (0.5) = 3 x 106 TU נדרשים. אם סיכוייו נגיפי הוא 1.1 TU/mL, לאחר מכן להשתמש 2.7 ml וירוס ב 5.3 ml מדיה עבור נפח כולל של 8 ml.
- הוסף 2 mL מדולל רטרווירוס לכל טוב של הצלחת מצופה fibronectin.
- עבור שליטה שלילית בתאי התמרה, הוסף מדיה בלבד לבארות הציפוי המצופה.
- מניחים את לוחיות בתוך מחומם מראש 32 ° c צנטריפוגה בנשאים אימונולוגיה עם כיסויים סטרילית ו צנטריפוגה ב 2000 x g עבור 2 h.
הערה: לוחות מצופים וירוס ניתן להשתמש באופן מיידי או מאוחסן, עם וירוס, ב 4 ° c ללילה. - לשימוש מיידי, מנושף את הכנת הווירוס מבארות ומוסיפים 2 מ ל של מדיום גדילה. שמור על בארות מצופי וירוסים מפני ייבוש.
- . לוחית הגירוי
- בדוק את התאים בעזרת מיקרוסקופ הפוך. התאים צריכים להיראות בריאים, כלומר הם עגולים, בהירים ושבירה אור. הם צריכים גם להראות מראה מרומז המעיד על גירוי.
- לאסוף את התאים היעד ולהעבירם לשפופרת חרוט 50 mL. לשטוף את הטוב פעם אחת עם מדיה גדילה 1 mL ולהוסיף צינור חרוט. לספור את מספר התאים החיים עם מונה התא האוטומטי כמו בשלב 5.4.
הערה: התאים הממריצים יהיו מצופפים והאפשרות הזאת עלולה לגרום לקשיים בספירת התאים באופן מדויק. - גלולה את התאים בצינורות ידי תפרידו ב 600 x g עבור 5 דקות ב 32 ° c. מריף את התקשורת מתוך הגלולה תא ולהשעות מחדש את התאים בינוני גדילה בריכוז של 1.5 x 106 תאים/mL.
- לכל וירוס מצופה היטב (מוכן בשלב 7.1) להוסיף 1 mL של הבולם הנייד עבור סך של 1.5 x 106 תאים/3 mL. שים לב כי כל טוב כבר מכיל 2 mL בינונית צמיחה. לבצע את השלבים אותם עבור תאים מדומה, אבל לוחית אותם על הבארות מצופה fibronectin אשר לא קיבל וירוס.
- צנטריפוגה את הצלחות ב 1000 x g עבור 10 דקות ב 32 ° c.
- מודטה את הצלחות עבור 48 h ב 37 ° צ' תחת 5% CO2.
8. הרחבת התאים המתמרים
- לצייר את התוכן של הבארות למעלה ולמטה עם 5 מ ל pipet כדי להשעות את התאים ולאחר מכן לעבור לשפופרת חרוט 50 mL.
- להוסיף 1 מ ל של מדיית הצמיחה לכל טוב לצייר למעלה ולמטה עם pipet העברה סטרילית להסיר תאים חסיד.
- ספירת תאים כדי לקבוע את מספר התאים והכדאיות הכוללת באמצעות מונה תאים אוטומטי כמו בשלב 5.4.
- במידת הצורך, להסיר 1 x 106 תאים עבור cy, להזרים את הביטוי הגנטי ואת הפנוטיפים. ראה שלב 9.5.1 ושולחן החומרים לנוגדנים מומלצים ולגיבוש אסטרטגיה.
- צנטריפוגה את התאים ב 600 x g עבור 10 דקות ב 25 ° c.
- מזף את המדיה ומשהה מחדש את התאים במדיית הרחבה לריכוז של 1 x 106 תאים/mL. זרעי כל גז חדיר היטב של צלחת 6-היטב עם 5 מ ל של תאים. שכבת בזהירות 25 מ ל נוספים של מדיה הרחבה לכל היותר.
הערה: אנו מוסיפים את התאים באמצעי אחסון קטן ולאחר מכן שכבות את המדיה הנותרת כך שהתאים יישארו בתחתית הבאר. - מודטה את התאים הפרעה ב 37 ° צ' ב 5% שכונתיות2 חממה עבור 4 ימים.
9. אוסף של תאים מורחבים והערכת הפנוטיפ של אוכלוסיית התאים התהתמרה
- לאסוף תאים מבארות חדירות גז על ידי הסרת והשמטת 20 mL מדיה. יש לנקוט זהירות כדי למנוע הפרעה לתאים.
הערה: אנו מרחיבים את התאים רק 4 ימים ואוספים את התאים בשלב זה. עם זאת, אם מדובר בימים נוספים של תרבות, הסר 20 מ ל של מדיה מבלי להפריע לתאים ולהחליף אותו עם 20 מ ל של מדיית הרחבה טרייה. - ללטף את שאר המדיה למעלה ולמטה כדי להוציא את התאים. התקשורת צריכה להיות מאוד מעונן אם התאים גדלו היטב.
- באמצעות pipet העברה סטרילית, לשטוף כל היטב עם מדיה 3 mL לאסוף כל התאים שיורית.
- ספור את התאים עם המונה האוטומטי או הומוציטומטר כדי לבדוק את הכדאיות ואת מספר התאים.
- לבצע זרימה cy, לנסות לקבוע התמרה גנטית ביטוי תא פניטיפים.
- בדוגמה זו, לקבוע רזוס מקוק PBMC פניטיפ באמצעות נוגדנים מופנה נגד CD4 (M-T477), שיבוט כי הוא תגובתי עם rhCD4 אנדוגני ומכונית rhCD4-MBL; נגד CD3 (SP34-2) ו CD8 (RPA-T8) אשר הכתם תאים T הכולל ותאים CD8 T בהתאמה; נגד קולטן המוות CD95 (DX2) ואת המולקולה שיתוף מגירוי CD28 (CD 28.2) אשר משמשים כדי לקבוע את הזיכרון הפנוטיפ של התאים; ונגד CXCR5 (MU5UBEE) ו MBL (3E7) כדי לזהות את CXCR5 ו CD4-MBL מכונית על התאים התמרה.
- יכולת ההערכת הכדאיות הוערך. בצבע של יכולת לתקן
- הכינו תאים לצורך זרימה של cy,.
- לפצות הורים נוגדן תערובת עבור המספר הכולל של צינורות. העלה את הנפח הכולל באמצעות PBS.
- הוסיפו את התאים להזרמת צינורות. מקום 0.5 – 1 x 106 תאים לכל צינור. כלול פקדים שליליים כגון תאים לא מוכתמים, כמו גם תאי התמרה מוכתמים.
- הוסף 2 mL של PBS לתאים, צנטריפוגה ב 400 x g עבור 5 דקות בטמפרטורת החדר (RT) ו decant.
- הוסף 100 μL של שילוב נוגדן לצינורות ו-דגירה עבור 30 דקות at RT.
- הוסף 2 mL של PBS, צנטריפוגה ב 400 x g עבור 5 דקות ב RT ו decant.
- הוסף 300 μL של 1% פאראמפורמלדהיד ו דגירה עבור 15 דקות.
- צנטריפוגה ב 400 x g עבור 5 דקות ב RT ו decant. הוסף 300 μL של PBS ו לערבב.
- על הזרם cytometer לרכוש 150,000 אירועים עבור כל מדגם.
- נתח את הנתונים באמצעות תוכנת ניתוח זרימה.
הערה: אסטרטגיית הה, שפורסמה בעבר20.- לזיהוי תאים התמרה, תאי שער על לימפוציטים, סינגטים, לחיות, CD3 +, ו MBL + CXCR5 +.
- לזיהוי אוכלוסיית הזיכרון המרכזית, תאי שער על לימפוציטים, סינגטים, לחיות CD3 +, CD8 +, CD28 + CD95 +.
- השתמש בתאים לפי הצורך. ניתן להשתמש בתאים למטרות מחוץ לתחומי הפעילות, כגון שיטת הגירה באמצעות העברה של העברת מראה של9 או בתאי מבחנה הריגה5,9. ניתן להשתמש בתאים לעירוי לבעלי חיים. לחלופין, להקפיא את כל התאים הנותרים ב 90% FBS עם 10% diמתיל סולפוקסיד (DMSO) לשימוש מאוחר יותר או ניתוח
הערה: בעוד מינון היעד עבור אינפוזיה של תאים הועברו באופן מאומצים לתוך מקוק רזוס אינו מבוסס עדיין, פורסם מחקרים העברה המאמצת בפרימטים שאינם אנושיים השתמשו 0.6 כדי 1.2 x 107 תאים/ק"ג21, 1 כדי 5 x 108 תאים/ק"ג22 ו 1.4 כדי 8 x 108 תאים/ק"ג10. עם טווח זה כמנחה, ניתן להפיק מספיק תאים לעירוי באמצעות פרוטוקול זה של 9 ימים.
תוצאות
ייצור תאים
התוצאות המוצגות בפרסום זה דומות לאלה שבעבודתנו הקודמת שפורסמה בשנת9,20. ניצול הפרוטוקול המוצג כאן, אנו מצפים לפחות 8-קיפול הרחבה של תאים בין ימים 5 ו 9 (חציון 11.1 קיפול, טווח 8.7 – 13 קיפול). חדירות גז בארות שופרה בצפיפות התחלתי של 5 x 106 תאים ואחרי 4 ימים של צמיחה, השגנו צפיפות חציון של 55.6 x 106 תאים לכל באר (טווח 43.5 – 64.8 x 106) (איור 1א). ספירת תאים עם הדרה טרילון כחול מראה כי התאים לשמור על הכדאיות גבוהה ברחבי הפרוטוקול (יום 9 החציוני 85.8%, טווח 83 – 95%) (איור 1B). אנו מוצאים בעלי חיים לשונות בעלי חיים ביכולתם של התאים להתרחב; עם זאת, עם האוכלוסייה ההתחלתית של 50-100 x 106 תאים ביום 1, השתמשנו בפרוטוקול זה כדי לייצר מספיק תאים עבור עירוי רזוס מקוק של 1 – 2 x 108 תאים/ק"ג.
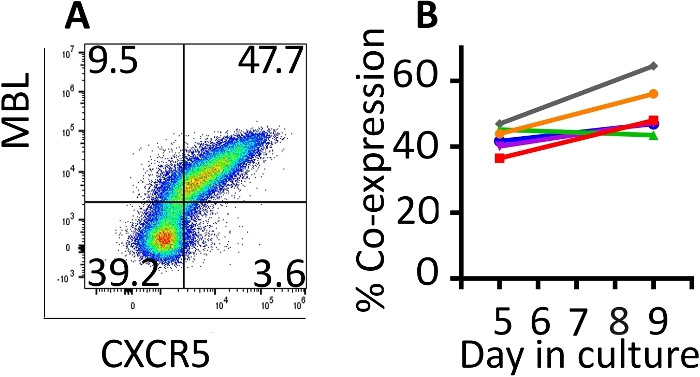
ביטוי משותף של הגנים המותמרים היה במעקב עם הזרימה cy, (איור 2א). ביטוי של המכונית וCXCR5 על פני התאים המותמרים היה יציב יחסית בין הימים 5 ו -9 של פרוטוקול זה הרחבה. ביום 5, חציון של 42.8% (טווח 36.5 – 46.9%) של התאים היו מותמרים עם CD4-MBL רכב ו CXCR5 ואילו ביום 9, הביטוי החציוני היה 47.6% (טווח 44.5 – 64.5%) בסיבוב אחד של התמרה (איור 2ב'). למרות שפרוטוקולים מסוימים מתקשרים לסיבוב נוסף של התמרה, לא ראינו תועלת במונחים של תאי התמרה מוחלטת בסיום הפרוטוקול (הנתונים אינם מוצגים).
פנוטייפ
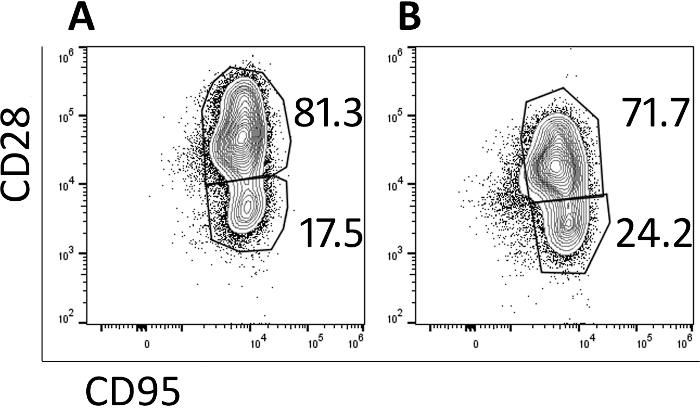
תאי התמרה נותחו על ידי מיכלי הזרימה. לפני התמרה והתרחבות, נאיבי, זיכרון מרכזי ואוכלוסיית הזיכרון של אפקטור מזוהים (הנתונים אינם מוצגים) אך האוכלוסייה התמימה אובדת באמצעות התאים, ובראשם בעיקר תאי זיכרון מרכזיים לפי יום 5 (איור 3A) ויום 9 (איור 3ב) כפי שזוהה על-ידי CD95+ CD28+ ביטוי. שימוש זה התמרה מהירה ופרוטוקול הרחבה הפיק תאים אשר בעיקר בתאי זיכרון מרכזי וכך יהיה סיכוי גבוה יותר להתרבות ולהימשך כאשר החדרת לתוך בעל חיים בדיקה.
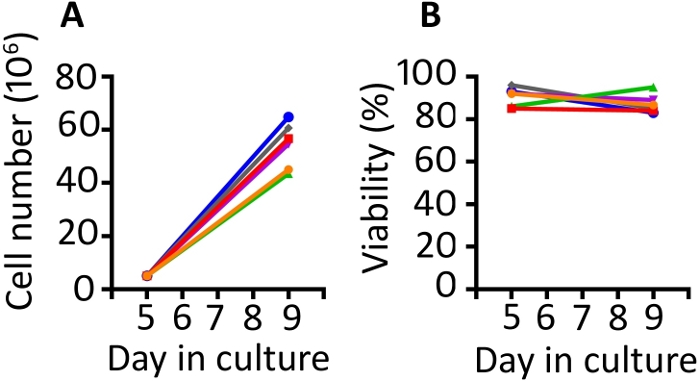
איור 1: התמרה ופרוטוקול ההרחבה מייצרת תאי התמרה שופע הנמצאים בעלי קיימא מאוד. (א) התרחבות התאים המתמרים מ -6 בעלי חיים שונים מימים 5 עד 9 בכלי קיבול הגזBויכולת הכדאיות של ה-pbmc המחלחל מ-6 בעלי חיים. הדרה של טרילון כחול באמצעות מונה תאים אוטומטי שימש לניטור מספר התאים והכדאיות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 2: פרוטוקול התמרה מפיק תאים השומרים על ביטוי משותף של שני הגנים המותמרים. (א) מגרש זרימה ייצוגית של רזוס pbmc ביום 9 של התמרה ופרוטוקול הרחבה להפגין ביטוי הן CD4-MBL המכונית ו CXCR5. (ב) ביטוי של CD4-MBL המכונית ו CXCR5 על התמרה רזוס pbmc מתוך 6 בעלי חיים שונים בימים 5 ו 9 בתרבות כפי שנמדד על-ידי cy try זרימה. גייטס הוגדרו על CD3+ תאים בשידור חי. התמרה תאים שזוהו כ-MBL+ CXCR5+. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 3: רוב התאים המיוצרים בפרוטוקול 9-יום יש מרכזי זיכרון פנוטיפ. זרם הנציג cy,לנסותחלקות של (א) יום 5 ו (ב) יום 9 מכונית/CXCR5 התמרה רזוס pbmc. גייטס הוגדרו על חיים, CD3+, CD8+ תאים. הזיכרון המרכזי הוגדר כ-CD28+ CD95+. הזיכרון של אפקטור הוגדר כ-CD28, CD95+. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר אסטרטגיית הפקה תא T לטיפול אשר מנצל וקטור gammar, כדי לשנות את רזוס מקוק PBMC המוביל לאוכלוסיית תא T המבטא רכב אנטי ויראלי, כמו גם את הזקיקים קולטן ביות, CXCR5. עם סך של 8 ימים של התרבות vivo ex הזמן, קיימא, פונקציונלי מכונית T מיוצרים בכמות שהיא בתוך טווח שפורסם10,21, 22 משמש22 לעירוי לתוך פרימטים אנושיים עבור בדיקות יעילות טרום קלינית.
ההצלחה של פרוטוקול התמרה מסתמך הן בריאים, מגורה PBMCs ועל ההכנות איכות של וירוס gammar,. כדי להשיג גירוי והתמרה מוצלחת, חיוני שטיפול נאות יילקח בהקפאה ובהובלה של PBMCs לאחר האיסוף. באופן אידיאלי, אם התאים נאספים מחוץ לאתר, הם נשלחים בחנקן נוזלי וממוקמים במהירות באחסון חנקן נוזלי לטווח ארוך. PBMCs חייב להיות פעיל באופן מיאוסטי כדי להיות מושפע בהצלחה על ידי וירוס gammar,. אחד צריך לפקח באופן חזותי עבור האשכולות של התאים לאחר גירוי עם אנטי CD3/anti-CD28. כשל בהפעלה כהלכה יגרום ליעילות נמוכה של התמרה. חשוב גם לעקוב אחר הכדאיות בתאים מגורה. הכדאיות המסכנה לאחר שלב הגירוי מובילה בדרך כלל להתמרה פחות מוצלחת. אם ההכנות וירוס מיוצרים במעבדה או מיקור חוץ, הם צריכים להיות מאוחסנים ב-80 ° c בשימוש יחיד ali, כדי למנוע הקפאת מחזורי הפשרה כי יכול לפגוע בווירוס ולפגוע התמרה יעילות. הווירוס חייב להיות מבוקר כך כמויות עקביות של וירוס ניתן להשתמש בכל ניסוי. בעת שימוש בווירוס לצורך התמרה, הפשרת הווירוס במהירות והחנות על הקרח עד הצורך. הבחירה של היזם, משפר ומעטפות חלבונים עלולים להשפיע על יעילות התמרה וביטוי של הטרנסגנים בתאי היעד. לפיכך, יש לקבוע באופן אמפירי את משרד הבית. בנוסף, השימוש במדיה המיועדת לתמוך בתאי T ובלוחות עם בארות חדירות גז להתרחבות הובילו להתרחבות מעולה של תאי התמרה. עם זאת, קיימת בעלי חיים לשונות בעלי חיים בקצב ההרחבה של התא. אנו ממליצים על מחקר ניסיון כדי לקבוע את היכולת של הכנה תא מסוים להיות התמרה והרחבה. רמות הרחבה הן עקביות בהתמרה בקנה מידה קטן וגדול.
עם השימוש בפרוטוקול זה, הופקו עד 2.5 x 109 תאים לעירוי לתוך בדיקת חיות. למרות שמצאנו את זה מיותר לשנות את הפרוטוקול בשלב זה, השימוש 6 טוב לוחות הוא מגבלה על הכנת התא בקנה מידה גדול הפרוטוקול ידרוש שינוי כדי לייצר מספר גדול יותר של תאים. דוגמאות של שינויים פוטנציאליים כוללים ביצוע התמרה של שקית התרבות מצופה fibronectin כדי להגדיל את מספר התאים המותמרים ולהשתמש בכלי קיבול גז חדיר גדול יותר לשלב ההתרחבות. למרות שעדיין לא עשינו שינויים אלה, הם מנצלים מוצרים זמינים מסחרית ושינויים אפשריים לפרוטוקול הנוכחי.
באמצעות שיטה זו, יש לנו הפיק תאי התמרה מ-PBMC מבודדים בעלי חיים נגועים, סיב בעלי חיים נגועים בעלי בעלי חיים שנדבקו סיב מטופלים עם טיפול תרופתי (אמנות). עם זאת, אנו ציינו ירידה ביעילות התמרה בתאים שטופלו באמנות20. הפחתה זו נובעת ככל הנראה בשל העיכוב של היפוך הטרנסקריפטאז ו/או שילובי התרופות. התמרה של התאים מבעלי חיים שטופלו באמנות ידרוש שינויים בפרוטוקול זה, כגון הפחתת רמות תאיים של תרופות אמנות על ידי עצירת אמנות במשך מספר ימים לפני איסוף PBMC או באמצעות וקטור חלופי אשר אינו מושפע התרופות האמנות בדרך כלל בשימוש.
חשוב כי תאים המיוצרים עבור טיפול חיסוני להיות של פנוטיפ הבדיל מינימלית, כך שהם ממשיכות post-אינפוזיה12. למרות פרוטוקולים רבים עבור העברה המאמצת של תאים דורשים פעמים תרבות ארוכה, הזמן הvivo לשעבר התרבות הקטנה כבר בקורלציה עם הפחתת בידול ושיפור בתפקוד תא T רכב13. פרק הזמן המהיר יחסית של התמרה זו ופרוטוקול הרחבה מאפשר תחזוקה של הזיכרון המרכזי הרצוי הזכרון תוך שהוא עדיין מייצר תאים מספיקים לבדיקת הפוטנציאל החיסוני שלהם20.
המטרה של אסטרטגיית הייצור עבור מוצר זה חיסוני תא T היא לייצר תאים T שיזהו תאים נגועים סיב, התנועה לאתר של שכפול נגיפי ב זקיק התא B ו יהיה להתמיד בבעלי חיים וכתוצאה מכך לטווח ארוך תרופה פונקציונלית ללא צורך בתרופות אנטי-retroviral. לתרגום מוצר חיסוני האדם, פרוטוקול זה יכול להיות שונה כדי לשנות את התאים האנושיים T באמצעות השימוש בנוגדנים ספציפיים לאדם, ציטוקינים ויישום של תקני GMP עם המטרה האולטימטיבית של הפקת תרופה פונקציונלית עבור HIV.
Disclosures
ד ר פמלה סקינר היא המייסד המשותף והקצין המדעי הראשי של מארפם פרמה.
Acknowledgements
מחקר זה היה נתמך על ידי NIH מענקים 5R01AI096966-06S1 (PS, EC, ו-EB), 1UM1AI26617 (PS, EC ו-EB), P51OD011106/P51RR000167 (ER), MN להגיע להעניק 5R01AI096966-03 (PS), 1UM1AI26617-01 (PS ו-EB), 1UM14126617 (PS ו-EC) כמו גם קרנות שסופקו על ידי חטיבת NIAID של מחקר הפנים והפנים NIH התוכנית ויראלית. Anti-CD3 ו-anti-CD28 בשימוש במחקרים אלה סופק על ידי משאב מגיב הפרימטים של NIH Nonhuman (R24 OD010976, U24 AI126683). IL-2 בשימוש במחקרים אלה סופק על ידי מאגר Preclinical של NCI. אנו מודים למשתפי הפעולה שלנו בפרוייקט CD4-mbl/CXCR5 הזה, ד ר. אליזבת ' קוניק באוניברסיטת אריזונה, ד ר. אדוארד ברגר ב niaid, NIH, ד ר. אווה G rakasz במרכז לחקר הפרימטים הלאומית של ויסקונסין וד ר ג'ף הארט וגברת פרייס הרן באוניברסיטת מינסוטה, ד ר לסלי kean בבית הספר לרפואה של הרווארד וד ר קתרין בולרד במכון ל אנחנו גם מודים ד ר סקוט McIvor באוניברסיטת מינסוטה, ד ר. כריסטופר פיטרסון בבית פרד האצ סרטן המרכז, ד ר מתיו Trivett ב-NIH, ד ר. לזניה טרביטביוט בבית החולים סיאטל ילדים, וד ר קונרד ראסל קרוז במכון לחקר הילדים על הסיוע המועיל שלהם באופטימיזציה של פרוטוקול זה אנו מכירים גם את מיס צ'י פאן וגברת ג'ומארי אלגריה-Berrocal באוניברסיטת מינסוטה לייצור מוצרים ויראליות, וגברת קים וייגראו באוניברסיטת ויסקונסין-מדיסון לבידוד רזוס מקוק.
Materials
| Name | Company | Catalog Number | Comments |
| Gammaretrovirus preparation | |||
| 0.025% Trypsin, 0.01% EDTA | Gibco | R-001-100 | |
| 293T cells | ATCC | CRL-3216 | |
| 6 well plates, treated | CytoOne | CC7682-7506 | |
| DMEM | Gibco | 10569-010 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| Lipofectamine | Invitrogen | 11668019 | transfection reagent |
| Opti-Mem | Invitrogen | 31985070 | reduced serum media |
| pBS-CMV-gagpol | Addgene | 35614 | A gift from Dr. Patrick Salmon |
| pMSGV1 containing CAR P2A CXCR5 | custom order from GenScript | ||
| RD114 | A gift from Dr. Ed Berger | ||
| T75 flasks | CytoOne | CC7682-4875 | |
| VSV-G | pMD.G | A gift from Dr. Scott McIvor | |
| T cell stimulation | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| Anti-CD28 | NHP Reagent Resource | Clone: CD28.2 | |
| Anti-macaque CD3 | NHP Reagent Resource | Clone: FN18 | |
| Phosphate buffered saline | Gibco | 14190-144 | |
| Rhesus macaque PBMC or CD8 T cells | WNPRC | Primary cells | |
| For Fibronectin coating | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| BSA (Fraction V) | HyClone | SH 30574.02 | |
| RetroNectin (1 mg/ml) | TaKaRa | T100A | |
| For T cell Expansion | |||
| G-Rex 6 Well Plate | Wilson Wolf | P/N 80240M | Plates with gas permeable wells |
| Media Components | |||
| b mercaptoethanol | Gibco | 21985-023 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| IL-2 | NCI Preclinical Repository | ||
| Penicillin/Streptomycin/Glutamine | Gibco | 10378-016 | |
| X-Vivo-15 medium | Lonza | 04-418Q | |
| Variations of Media used | |||
| Basic medium: | X-Vivo 15 medium, 10% heat-inactivated FBS, 1 x Penicillin/Streptomycin/L-Glutamine | ||
| Expansion medium: | Growth medium + 50 mM b mercaptoethanol | ||
| Growth medium: | Basic medium + 50 IU/ml IL-2 | Completion of media by addition of anti-CD28, IL-2 or b-mercaptoethanol should occur on the day of use. | |
| Cell counting | |||
| Countess cell counting chambers | Invitrogen | AMQAF1000 | |
| Countess II FL Automated Cell Counter | Invitrogen | T10282 | |
| Trypan blue, 0.4% solution | Invitrogen | T10282 | |
| Flow Cytometry | |||
| Alexa Fluor 647 Antibody Labeling Kit | Invitrogen | A20186 | for conjugation of MBL antibody |
| anti-CD28-BV605 | BD Biosciences | 562976 | |
| anti-CD3-AF700 | BD Biosciences | 557917 | |
| anti-CD4-FITC | BD Biosciences | 556615 | |
| anti-CD8-BV788 | BD Biosciences | 563824 | |
| anti-CD95-PerCP Cy5.5 | BD Biosciences | 561655 | |
| anti-CXCR5-PE | eBioscience | 12-1985-42 | |
| anti-MBL | Invitrogen | MA1-40145-S6 | |
| Flow Analysis software | FlowJo, LLC | FlowJo v10 | |
| Flow Cytometer | Beckman | CytoFlex | |
| Live/Dead Near IR | Invitrogen | L10119 | |
| Other equipment | |||
| Aerosolve canisters to contain aerosol leakage | Beckman | SX4750 | Safety equipment |
| Beckman Allegra Centrifuge | Beckman | Sterilgard e3 | |
| Cell culture incubator | Thermo Fisher | Everlast 247 | |
| Class II Laminar flow hood | Baker | Heracell Vios 160i | |
| Extra-Safe Disposable lab coat | Fisher Scientific | 359232 | Personal protective equipment |
| Microplate carriers with biocertified covers | Beckman | SX4750A | Safety equipment |
| Rocking platform | Benchmark | C10228 | |
| Swinging bucket rotor | Beckman | X13-R | |
| X-Gen Nitrile gloves | Genesee | Personal protective equipment |
References
- Klebanoff, C. A., Rosenberg, S. A., Restifo, N. P. Prospects for gene-engineered T cell immunotherapy for solid cancers. Nature Medicine. 22 (1), 26-36 (2016).
- Lim, W. A., June, C. H. The Principles of Engineering Immune Cells to Treat Cancer. Cell. 168 (4), 724-740 (2017).
- Sadelain, M., Rivière, I., Riddell, S. Therapeutic T cell engineering. Nature. 545 (7655), 423-431 (2017).
- Kuhlmann, A., Peterson, C. W. Chimeric antigen receptor T-cell approaches to HIV cure. Current Opinion in HIV and AIDS. 13 (5), 446-453 (2018).
- Ghanem, M. H., Bolivar-Wagers, S., et al. Bispecific chimeric antigen receptors targeting the CD4 binding site and high-mannose Glycans of gp120 optimized for anti-human immunodeficiency virus potency and breadth with minimal immunogenicity. Cytotherapy. 20, 407-419 (2018).
- Folkvord, J. M., Armon, C., Connick, E. Lymphoid Follicles Are Sites of Heightened Human Immunodeficiency Virus Type 1 (HIV-1) Replication and Reduced Antiretroviral Effector Mechanisms. AIDS Research and Human Retroviruses. , (2005).
- Connick, E., Mattila, T., et al. CTL Fail to Accumulate at Sites of HIV-1 Replication in Lymphoid Tissue. The Journal of Immunology. 178 (11), 6975-6983 (2007).
- Connick, E., Folkvord, J. M., et al. Compartmentalization of Simian Immunodeficiency Virus Replication within Secondary Lymphoid Tissues of Rhesus Macaques Is Linked to Disease Stage and Inversely Related to Localization of Virus-Specific CTL. The Journal of Immunology. 193 (11), 5613-5625 (2014).
- Haran, K. P., Hajduczki, A., et al. Simian immunodeficiency virus (SIV)-specific chimeric antigen receptor-T cells engineered to target B cell follicles and suppress SIV replication. Frontiers in Immunology. 9 (MAR), 1-12 (2018).
- Ayala, V. I., Deleage, C., et al. CXCR5-Dependent Entry of CD8 T Cells into Rhesus Macaque B-Cell Follicles Achieved through T-Cell Engineering. Journal of Virology. 91 (11), e02507-e02516 (2017).
- Redeker, A., Arens, R. Improving adoptive T cell therapy: The particular role of T cell costimulation, cytokines, and post-transfer vaccination. Frontiers in Immunology. 7 (SEP), 1-17 (2016).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting Through Subsets. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Ghassemi, S., Nunez-Cruz, S., et al. Reducing Ex Vivo Culture Improves the Antileukemic Activity of Chimeric Antigen Receptor (CAR) T Cells. Cancer Immunology Research. 6 (9), 1100-1109 (2018).
- Minang, J. T., Trivett, M. T., Bolton, D. L., Trubey, C. M., Estes, J. D., Li, Y., et al. Efficacy of Adoptively Transferred Central and Effector Memory-Derived Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones in Rhesus Macaques during Acute Infection. The Journal of Immunology. 184 (1), 315-326 (2010).
- Bolton, D. L., Minang, J. T., et al. Trafficking, persistence, and activation state of adoptively transferred allogeneic and autologous Simian Immunodeficiency Virus-specific CD8(+) T cell clones during acute and chronic infection of rhesus macaques. Journal of immunology (Baltimore, Md. : 1950). 184 (1), 303-314 (2010).
- Patel, S., Jones, R. B., Nixon, D. F., Bollard, C. M. T-cell therapies for HIV : Preclinical successes and current clinical strategies. Cytotherapy. 18 (8), 931-942 (2019).
- Chambers, C. A., Allison, J. P. Costimulatory regulation of T cell function. Current Opinion in Cell Biology. 11 (2), 203-210 (1999).
- Schwartz, R. H. A cell culture model for T lymphocyte clonal anergy. Science. 248 (4961), 1349-1356 (1990).
- Bajgain, P., Mucharla, R., et al. Optimizing the production of suspension cells using the G-Rex M series. Molecular Therapy - Methods and Clinical Development. 1, 14015(2014).
- Pampusch, M. S., Haran, K. P., et al. Rapid transduction and expansion of transduced T cells with maintenance of central memory populations. Molecular Therapy - Methods and Clinical Development. 16, 1-10 (2019).
- Taraseviciute, A., Tkachev, V., et al. Chimeric antigen receptor T cell-mediated neurotoxicity in nonhuman primates. Cancer Discovery. 8 (6), 750-763 (2018).
- Berger, C., Sommermeyer, D., et al. Safety of targeting ROR1 in primates with chimeric antigen receptor-modified T cells. Cancer Immunology Research. 3 (2), 206-216 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved