Method Article
Immunoprecipitation ללא תווית של זרימת עבודה בהיקפים גדולים של החברה ליצירת פרופיל רב-ממדי של Interactome גרעינית
In This Article
Summary
מתוארים היא זרימת עבודה פרוטאומניקה לזיהוי שותפים אינטראקציה חלבונים מתוך שבר גרעיני subcellular באמצעות העשרת זיקה חיסונית של חלבון נתון של ריבית ותוויות המסה חינם התווית. זרימת העבודה כוללת שבירה תת-תאית, immunoprecipitation, סינון הכנה לדוגמה, ניקוי לא מקוון, ספקטרומטר מסה וצינור ביואינפורמטיקה במורד הזרם.
Abstract
הספקטרום של טיהור חיסוני המסה (IP-MS) התפתחה כשיטה כמותית איתנה לזיהוי אינטראקציות חלבונים-חלבון. פרסום זה מציג את זרימת העבודה מלאה פרוטאומניקס המיועד לזיהוי האינטראקציות חלבון-חלבון נמוכה מהגרעין שניתן גם להחיל על תאים אחרים subcellular. זרימת עבודה זו כוללת שבירה תת-תאית, immunoprecipitation, הכנה לדוגמה, ניקוי לא מקוון, ספקטרומטר המסה ללא תווית בודדת, ו-במורד ניתוח חישובים והדמיית נתונים. הפרוטוקול שלנו הוא אופטימיזציה לזיהוי ממדר, שפע האינטראקציות נמוכה, כי הם קשים לזהות מפני התאים השלם (למשל, שעתוק מקדם אינטראקציות בגרעין) על ידי immunoprecipitation של חלבונים אנדוגניים מ תאי משנה בעלי משבר תאי. צינור ההכנה לדוגמה המתואר כאן מספק הוראות מפורטות להכנת התמצית הגרעינית של תא הלה, טיהור הזיקה של חלבון פיתיון אנדוגני, וניתוח ספקטרומטר מסה כמותי. אנו דנים גם בשיקולים מתודולוגיים לביצוע הimmunoprecipitation בקנה מידה גדול בניסויים ביצירת פרופילים בעלי מערכת המבוססת על ספקטרומטר המסה, ומספקים קווים מנחים להערכת איכות הנתונים כדי להבחין בין חלבון אמיתי וחיובי אינטראקציות מאינטראקציות שאינן ספציפיות. גישה זו מוכחת כאן על ידי חקירת interactome גרעינית של CMGC קינאז, DYRK1A, חלבון שפע נמוך קינאז עם אינטראקציות מוגדרות גרוע בתוך הגרעין.
Introduction
הפרוטדום האנושי מציג גיוון מבניים וביוכימיים רחב באמצעות היווצרות של מתחמי מולטיתת יציבים ואינטראקציות של חלבונים בחלבון ארעי. לכן, הזיהוי של שותפים אינטראקציה עבור חלבון של עניין נדרש בדרך כלל בחקירות כדי לפענח מנגנון מולקולרי. ההתקדמות האחרונה בפרוטוקולי טיהור הזיקה והופעתו של מכשור מהיר לסריקה מהירה ברזולוציה גבוהה הפעילה מיפוי קל של נופים של החלבון בניסוי חד משוחדת.
הפרוטוקולים לאינטראקציה עם חלבונים מעסיקים בדרך כלל מערכות ביטוי חוץ רחמי עם בונה היתוך מתויג באמצעות זיקה לזיהוי אינטראקציות חלבונים מבלי לדרוש נוגדנים באיכות גבוהה הכרת חלבון של ריבית1,2. עם זאת, בשיטות המבוססות על תגים בעלי מספר חסרונות. אינטראקציות פיזיות עם האפירופה עלולות לגרום לגילוי חלבונים שאינם ספציפיים לגוף3. בנוסף, היתוך של אלה התגים האפיטוניים ל-N-או C-מסוף של חלבון עלולים לחסום אינטראקציות חלבון-חלבון מקוריות, או לשבש את קיפול החלבון כדי לקדם את הקונמציות שאינן פיזיולוגיות4. יתר על כן, מערכות ביטוי חוץ רחמי בדרך כלל לבטא את החלבון פיתיון בריכוזים supraפיסיולוגיים, אשר יכול לגרום לזיהוי של אינטראקציות החלבון העובדתי, במיוחד עבור גנים מינון רגיש5. כדי לעקוף בעיות אלה, חלבון פיתיון האנדוגניים יכול להיות immunoprecipitated יחד עם משויכים החלבונים טרף הקשר, בהנחה זמינות של נוגדן באיכות גבוהה המכיר את חלבון יליד.
בתנאי כאן היא זרימת עבודה פרוטאומניקס אינטראקציה לזיהוי interactome גרעינית של חלבון אנדוסוגני באמצעות החלבון CMGC קינאז DYRK1A כדוגמה. הפרעה של מספר העתק DYRK1A, רמת הפעילות, או ביטוי יכול לגרום לנכות אינטלקטואלית חמורה בבני אדם, ו מתחלקים עובריים בעכברים6,7,8,9. DYRK1A מציג בתקנה דינמית של מכשירים מיוחדים10, ואינטראקציות חלבונים ממדר11,12, הדורשות גישות המסוגלת לזהות שותפים האינטראקציה שפע נמוך ספציפיים לתאי subcellular שונים.
פרוטוקול זה מעסיק שבירה תאית של תאי החלה של האדם לתוך שברים ציטומיים, immunoprecipitation, הכנה לדוגמא לספקטרומטר מסה, וסקירה של צינור ביולוגי להערכת איכות הנתונים והצגת תוצאות, עם הסקריפטים R הניתנים לניתוח והדמיה (איור 1). התוכנה פרוטאומניקס חבילות המשמשות בזרימת עבודה זו הם כולם זמינים באופן חופשי להורדה או ניתן לגשת דרך ממשק אינטרנט. לקבלת מידע נוסף על שיטות תוכנה וחישוביות, לימוד מעמיק והדרכה זמינים בקישורים המסופקים.
Protocol
הערה: כל קומפוזיציות המאגרים ותערובות הפרוטאז מתוארות בטבלה 1.
1. הכנת תאים
הערה: חומר התחלתי של 1-10 mg ליפוסט גרעיני לכל שכפול רצוי עבור הגישה הimmunoprecipitation המסה הזאת (IP-MS). כמויות התאים יינתן עבור 1 מ"ג של immunoprecipitations גרעינית ב טרילקאט בתוספת שולטת שלישיה.
- אם נעשה שימוש בקו התאים החסיד, הגדל את התאים עד 90% ב-3 x 15 ס"מ מנות לכל שכפול לפני הקציר.
הערה: מומלץ לבצע מינימום של שלושה immunoprecipitations שכפול לתנאי פיתיון ושליטה. פרוטוקול זה יניח את השימוש בפקדים ' חרוזים בלבד ', השולטים באינטראקציות שופעת שאינן ספציפיות עם החרוזים, החל מסעיף 4. סוגים אחרים של פקדים עשויים להיות שימושיים. אלה מתוארים לעומק בסעיף הדיונים.- לשטוף לוחות 2x עם מלוחים באגירה פוספט (PBS) ו טריזילזציה בתאי באמצעות 3 מ ל של 0.25% טריפסין לצלחת 15 ס מ. לסובב את התאים ב 1,200 x g עבור 5 דקות ו decant הטריפסין.
- עבור תאים ההשעיה, לצמוח בקנה מידה דומה/צפיפות כדי להשיג 70 ל 80 מ ג של חלבון מוחלט.
- בתאי גלולה ב 1,200 x g ו-4 ° צ' עבור 5 דקות. decant התקשורת בקפידה.
הערה: ניתן לשלב כדוריות במהלך שלב זה כדי לאפשר עיבוד יעיל באמצעות שבירה משנית בקנה מידה גדול המתואר בסעיף 2.
- בתאי גלולה ב 1,200 x g ו-4 ° צ' עבור 5 דקות. decant התקשורת בקפידה.
- שטוף את הגלולה 2x עם PBS + 5 מ"מ MgCl2 בתוספת מעכבי פרוטאז (מעכבי) ו פוספספטאז (phis) (ראה שולחן 1).
הערה: כדורי תא עלולים להיות קפואים בחנקן נוזלי ומאוחסנים ב-80 ° c עד שהוא מוכן לשבר.
2. הכנת תמצית גרעינית
הערה: יש להוסיף מעכבי פרוטאז ופוספספטאז למאגרי השבר בתוך 30 דקות של שימוש.
- אם קפוא, להפשיר את כדורי התא עבור 15 דקות בנפח של גלולה 1 x של מאגר קר A + פיס/PhIs. מניחים את הגלולה על מתלה ב -4 ° c כדי לסייע בהשעיה בזמן הפשרה. אחרת, להשעות מחדש את הגלולה תא משלב 1.3 לתוך מאגר נפח 1 x גלולה לאחסון A +.
- גלולה ב 2,000 x g ו-4 ° צ' עבור 10 דקות. decant. המאגר
- להשעות את התאים עם 5x את הנפח של התא ארוז עם מאגר A ו-דגירה על הקרח 20 דקות.
- גלולה ב 2,000 x g ו-4 ° צ' עבור 10 דקות. decant המאגר ולהשעות מחדש עם 2x מקורי ארוז נפח תא מאגר a + פיס/phis ו-דאונס ~ 7x עם "A"/משוחרר.
- צנטריפוגה את הליפוסט במשך 10 דקות ב 2,000 x ו 4 ° c.
- . והקפאת מבזק עם חנקן נוזלי אחסן את הליפוסט ב-80 ° c. הסופרנטאנט משלב זה הוא השבר התת הציטותאי.
הערה: ניתן לשמור את הגלולה הגרעינית במהלך שלב זה על ידי הקפאת פלאש עם חנקן נוזלי ואחסון ב-80 ° c - השהה מחדש את הגלולה עם כמות גלולה 0.9 x של מאגר B + פיס/PhIs ולערבב על הנוטור עבור 5 דקות ב 4 ° c.
- , כדי לסדר את הגרעינים. "
- ערבב את הליפוסט הגרעיני במשך 30 דקות ב -4 ° c, כך שהוא הומוגנית.
- צנטריפוגה את הליפוסט הגרעיני במשך 30 דקות ב 21,000 x g ב 4 ° c. ולשמור כתמצית חלבון. גרעיני מסיס
הערה: הטיפול Nuclease של הגלולה הגרעינית וכתוצאה מכך מאפשר שחזור של שבר חלבון כרומטין הקשורים. - Dialyze החילוץ הגרעיני מסיס נגד מאגר C + הפיס 3 h ב 4 ° c.
- חותכים את האורך המתאים של 24 מ"מ ברוחב צינור דיאליזה עם משקל מולקולרי של 8 kDa לחתוך את. מלחציים בצד אחד של הצינורות ומעמיסים בתוך הצינור. לאחר טעינת הליפוסט, להדק את הקצה השני ולטבול במיכל זכוכית נקייה המכילה מאגר C + פיס.
- צנטריפוגה את התמצית הגרעינית הדיליגית/נוקלאואופלזיה ב 21,000 x g ב -4 ° c עבור 30 דקות. aliquot 3x 20 כמויות μl של תמצית גרעינית עבור אימות השבר על ידי הכתם המערבי. התמצית הגרעינית המשמש ניתוח IP-MS יכול להיות מצוטט ו פלאש קפוא בחנקן נוזלי ומאוחסן ב-80 ° c, במידת הצורך.
3. אימות משבר הסלולר
- כדי לקבוע את ריכוז החלבון. של הליפוסט הגרעיני . מספק רגישות מספקת ליישום הזרם
- לטעון 20 μg של שני ציטוסולורק ושברים גרעיניים על SDS-דף ג'ל לניתוח כתמי אבן מערבית כפי שתוארה בעבר13. דלג על נתיבים בעת טעינה כדי להימנע מאפיון של מדגם.
- לחקור את האבן החשופה המערבית לp84 (THOC1) כסמן גרעיני, ו-"גנד" כסמן ציטוסולג. לקבוע את מידת השבר על ידי היחס של סמן ציטוסולג בשבר גרעיני ולהיפך.
הערה: ניתן להשתמש בנוגדנים לסמנים גרעיניים וציטוסולים אחרים.
4. הImmunoprecipitation של חלבון פיתיון גרעיני אנדוגני
הערה: מומלץ להשתמש בצינוריות שמירה נמוכה מנקודה זו והלאה. זה יפחית את הכריכה הלא ספציפית לצינורות במהלך הטיפול במדגם ולהימנע אובדן מיותרים של המדגם. בנוסף, ודא ש-LCMS כיתה ח'2O משמש להכנת מאגרים עבור השלבים הנותרים.
- הכנת חלבון A/G חרוז תערובת עבור כל שכפול על ידי שילוב 12.5 μL של נפח חרוז עבור חלבון-A ו חלבון-G בצינורות מיקרוצנטריפוגה. לאחסן את המניות חרוז כמו להשתהות המכיל 20% אתנול. לקבוע את הריכוז של חרוזים בתוך להשתהות% (v/v) ו פיפטה את הנפח הדרוש באמצעות טיפ פיפטה שנחתך על הקצה כדי להבטיח כי החרוזים יכולים להזין את העצה.
- לשטוף את חלבון A/G חרוז תערובת 2x עם 300 μL של מאגר ה-IP 1. לסובב את החרוזים ב 1,500 x g ב 4 ° צ' עבור 1 דקות ו-decant מאגר.
- להכין את נוגדן חלבון A/G חרוזים: לאגד את הנוגדן לחרוזים, להוסיף 300 μL של מאגר ה-IP 1 ו-10 μg של הנוגדן הרצוי. לאפשר את תערובת חרוז/נוגדן לסלע על החוצה ב 4 ° c בלילה. עבור פקדים בלבד חרוז, לא להוסיף שום נוגדן.
הערה: סך של 10 μg של נוגדן לכל שכפול ניתן להשתמש כנקודת התחלה, אבל הסכום המדויק יהיה צורך אופטימיזציה עבור כל נוגדן בודד וקנה מידה של הליפוסט בשימוש בניסוי - הפשרת lysates גרעינית משלב 2.10 באמבט מים ו-סדרת מחלקים כרכים המתאים לתוך שמירה נמוכה צינורות מיקרוצנטריפוגה עבור 1 mg קלט חלבון לכל שכפול.
- ספין the ליפוסט ב 16,000 x g עבור 30 דקות ולהעביר את supernatant לצינור חדש.
- הוסף 1 μL של בנזיל (250 יחידות/μL) ל 1 מ ג של הגרעין הגרעיני והרוק על הנוטור ב -4 ° c עבור 10 עד 15 דקות.
- הכינו חרוזים לניקוי הליפוסט. הוסף 12.5 μL של כל חלבון A ו-חלבון G חרוזים כדי 1.5 mL שמירה נמוכה צינורות כמו בשלב 4.1. שטוף 2x עם מאגר שטיפת IP 1 + פיס והוא משנה את המאגר.
- הוסף 1 מ ג של הגרעין הגרעיני לחרוזים משלב 4.5. מודטה בזמן שהוא מטלטל על הטור בשעה 4 ° c.
- צנטריפוגה לנקות את lysates ב 1,500 x g ו 4 ° צ' עבור 1 דקות.
- בעוד lysates גרעינית הם הדגירה עם חרוזים בשלב 4.5.1, לשטוף את נוגדן חלבון A/G חרוזים 2x עם מאגר IP 1 + פיס. צנטריפוגה ב 1,500 x g ו 4 ° צ' עבור 1 דקות ו decant את המאגר.
- העבר את ה4.6.1 הגרעינית מראש משלב השלבים על-ידי הנוגדן-חלבון A/G חרוזים. מודטה בזמן שהוא מטלטל על הנדנדה ב 4 ° c עבור 4 h. צנטריפוגה בעקבות הדגירה ב 1,500 x g ו 4 ° צ' עבור 1 דקות.
- העבר את הסופרנטנט לצינורות המסומנים כזרימה דרך עבור כל שכפול.
- שטוף את נוגדן-חלבון A/G חרוזים עם 1 מ ל של מאגר IP 2 + פיס. צנטריפוגה ב 1,500 x g ו 4 ° צ' עבור 1 דקות, מאגר decant, ולחזור על סך של 3x.
- שטוף את החרוזים 2x עם 1 מ ל של מאגר IP 1 + תפרידו כמו בשלב הקודם. ודא שכל המאגר יוסר לאחר השטיפה האחרונה.
- אליוט 2x עם 20 μL של 0.1 M גליצין (pH 2.75) עבור 30 דקות כל אחד. ודא כי הצינורות הוא נדנדה במהלך הדגירה עם מאגר להתחמק. ספין ב 750 x g ו 4 ° צ' עבור 1 דקות ו פיפטה מחוץ לסופרנטנט אחרי כל 30 דקות דגירה.
הערה: בעוד השיטה הנמוכה pH גליצין מתואר כאן חומק רוב החלבונים פיתיון, כמה אינטראקציות נוגדנים-אנטיגן דורשים תנאי מאגר מחמירים יותר. - הקפאת פלאש בחנקן נוזלי ובחנות ב-80 ° c.
5. הכנה לדוגמא
הערה: אינסולין זינק לתוך הדגימות immunoprecipitation tion מסייע בהתאוששות חלבונים במהלך triכלור חומצה אצטית (TCA) משקעים ועיבוד לדוגמה, אשר חשוב עבור שפע נמוך של חלבונים פיתיון השפע.
- להפשיר את הקצב בטמפרטורת. החדר אם היא קפואה
- מניחים את הדגימות על הקרח ולהוסיף 10 μL של 1.0 mg/mL אינסולין עבור כל 100 μL של הללויה. מערבולת ולאחר מכן להוסיף באופן מיידי 10 μL של 1% נתרן המרה. מערבולת המדגם שוב ולהוסיף 30 μL של 20% TCA ואחריו מערבולת אחרונה אחת.
- דגירה את הדגימות על הקרח 20 דקות, ואז צנטריפוגה ב 21,000 x g ב 4 ° c עבור 30 דקות.
- ומוסיפים 0.5 מ ל של אצטון שהיה מקורר עד 20 ° c. מערבולת ולאחר מכן ספין ב 21,000 x g ו 4 ° צ' עבור 30 דקות. חזור על שלב זה.
- והאוויר מתייבש את הגלולה. שנשארה בתחתית הצינורית
- הכן את המדגם לספקטרומטר מסה באמצעות שיטת ההכנה לדוגמה (FASP) שהשתנתה, הממוטב להפחתת טיפול במדגם, כפי שמתואר מתחת ל-14.
- להשעות מחדש את הגלולה חלבון משלב 5.1.4 עם 30 μL של מאגר אלקיללציה של SDS (ראה טבלה 1). מודאת המדגם על בלוק חום 95 ° c עבור 5 דקות. תן לזה להתקרר בטמפרטורת החדר במשך 15 דקות לפני שקודמת לשלב הבא.
- הוסף 300 μL של הפתרון UA ו 30 μL של 100 mM TCEP לכל דוגמה. טען פתרון זה למסנן צנטריפוגלי 30k. לסובב את המסנן צנטריפוגלי ב 21,000 x g בטמפרטורת החדר עבור 10 דקות.
הערה: החלבון הפיתיון והשחקנים האחרים שלו צריכים להיות מאוגדים למסנן בשלב זה. עם זאת, הזרימה דרך עשוי להישמר, למקרה שיש בעיה עם המסנן. - לשטוף את המסנן עם 250 μL של UA ו צנטריפוגה ב 21,000 x g עבור 10 דקות. decant את הזרימה באמצעות ולחזור על סך של 3x.
- לשטוף את המסנן עם 100 μL של 100 mM טריס pH 8.5 ו צנטריפוגה ב 21,000 x g עבור 10 דקות. decant את הזרימה באמצעות וחוזר על סך של 3x.
- הוסף 3 μL של 1 μg/μL ליס ג מושעה מחדש ב 0.1 M טריס pH 8.5. מלאו את המסננים עד לסימון מ100 μL ומאפשרים לעכל במשך 1 h ב-37 ° צ' בזמן הנדנדה על הנגן.
- הוסף 1 μL של 1 μg/μL כיתה מיליטריפסין. מערבבים בעדינות ומאפשרים לטריפסין לעבור באמצעות המדגם למשך הלילה ב-37 מעלות צלזיוס בעת שהוא מתנדנד על הטור.
- צנטריפוגה ב 21,000 x g עבור 20 דקות כדי elute את הפפטיד מן המסנן.
הערה: סיבובים מרובים של צנטריפוגה עשוי להידרש כדי לשחזר את כל החומקת. אם הדבר לא נעשה, יש פוטנציאל לאובדן מדגם חמור.
- Desalt הפפטידים באמצעות סי18 ספין עמודות. בצע את הפרוטוקול שסיפק היצרן.
- השהה את הפפטיד מחדש ב-7 μL של 0.1% TFA ב-5% בלבד. Sonicate את המדגם עבור 3 דקות כדי להבטיח את הפפטידים הושעו מחדש. ספין למטה ב 14,000 x g עבור 10 דקות.
- העבר את הפפטיד מחדש לתוך בקבוקון לדוגמה המתאים כדי לטעון על כרומטוגרפיה נוזלית-ספקטרומטר מסה (LC/MS) מערכת.
6. LC/MS מערכת התאמה
הערה: בשל קנה המידה הקטן והשפע הנמוך ביותר של חלבון מדגימות מטוהרים-אהדה, חשוב שפלטפורמת ה-LC/MS פועלת ברגישות מירבית ובחוסן.
- הוסף 1 מ ל של החומצה lc/ms בכיתה 1 L של המים lc/ms בכיתה עבור השלב הנייד A, ולהוסיף 1 מ ל של lc/ms חומצה פורמית כיתה 1 L של LC/ms כיתה acetonitrile עבור שלב נייד B.
- להכין או להתקין 75 יקרומטר התמזגו-סיליקה העמודה הקפירית ארוז עם < 2 יקרומטר היפוך-שלב סי18 שרף כי הוא ≥ 250 mm אורך. התוצאות הטובות ביותר יהיו עם הזרקה ישירה של דגימות לתוך הטור.
- לטהר את מערכת אולטרה ביצועים כרומטוגרפיה נוזלית עם שלבים ניידים טריים. עם עמודה סי18 מותקן, ליצור קצב זרימה יציבה ו-electrospray עם פולט מתאים (כלומר, 20 יקרומטר id x 360 יקרומטר od משכה לקצה 10 יקרומטר). שמרו על הטור בשעה 40 עד 60 ° c.
- בדוק את ביצועי המערכת הכוללים של מערכת LC/MS על-ידי הזרקת תקן בקרת איכות מורכב, כגון 100 למעלה מ-200 מטרים של תקציר תא שלם של הלה. אליוט עם מעבר מתאים למדגם מורכב (כלומר, 2-3 שעות מעבר הדרגתי). צור ביצועי מערכת בסיסית של הזהויות הפפטיד והחלבונים.
הערה: לקבלת התוצאות הטובות ביותר, 3000 ל-5000 או יותר מזהויות החלבון מתוך 20000 35000 פפטידים ייחודיים יספקו ביצועים אופטימליים לדגימות נסיוניות. - עבור התאמה שגרתית של מערכת LC/MS, הכנס 100-200 לפני או פחות מתקן לתקציר חלבון יחיד, כגון סרום בודד (BSA). לאליוט עם הדרגתי קצר (כלומר, 20-30 דקות).
הערה: זריקות מרובות של תקציר חלבון יסייעו ליצור ביצועי מערכת LC/MS הבסיסית, ולחזור על הזרקה לאחר כל מדגם IP-MS מספק מידה של ביצועי המערכת לאורך הניסוי ומאפשר איתור של סחיפה מכשיר, אשר יכול הטיה ללא תווית הניסויים. קו בסיס של עוצמות השיא הבודדות של הבחירה וצורות השיא יודיע על ביצועי MS, LC והעמודה. - כדי להימנע מעומס יתר על הטור האנליטי, טען חלק קטן (15-30% מכלל הסכום) של דגימת ניסוי על הטור והפרד באמצעות מעבר צבע המתאים לדגימות מורכבות (כלומר, 2-3 שעות). אם מספר הזהויות של החלבונים אינו משביע רצון, טען את כל המדגם על העמודה.
- הפעל תקן חלבון יחיד בודד בין דגימות כדי לפקח על ביצועי מערכת LC/MS ו-נושא לדוגמה. ייתכן שיהיה צורך במספר תקנים כדי להפחית את נושא המדגם בהתאם לדוגמאות שלך.
7. עיבוד נתונים
- הורד את חבילת תוכנות פרוטקומקס MaxQuant שנמצאו בhttps://www.maxquant.org/.
הערה: הדבר ישמש לעיבוד קובץ הנתונים RAW MS משלב 6.6 לטבלאות נתונים של מזהי חלבון, שמות גנים וערכים כמותיים המשויכים לזיהוי אלה עבור ניתוח במורד הזרם.- בחר באפשרות ' טען ' בתוך כותרת המשנה של נתוני הקלט של הכרטיסיה נתונים גולמיים . פתח את מיקום הקובץ שבו קבצי ms raw מאוחסנים ובחר קבצים גולמיים עבור כל הפעלה של ms/ms.
- לחץ על הכרטיסייה ספציפית לקבוצה ובחר בעיכול. בתוך רשימת האנזימים בחר Lysc ולחץ על החץ הימני כדי להוסיף אנזים זה לתוך הרשימה שבה יהיה בשימוש בחיפוש. לאחר מכן, בחר בכלי וודא שסוג הכלי המתאים מופיע ברשימה הנפתחת בחלק העליון של המסך. השאר פרמטרי חיפוש ספציפיים לקבוצה אחרים בהגדרות סטנדרטיות.
- לחץ על הכרטיסיה פרמטרים כלליים ובחר רצפים. הוסף את קובץ ה-FASTA המתאים עבור הטקסונומיה שתהיה בשימוש בחיפוש זה. פפטידים לא יוקצו כראוי אם זה לא נעשה. עבור הפרוטדום האנושי, הורד את קובץ ה-FASTA מיוניפרוט ב-https://www.uniprot.org/help/human_proteome.
- בתוך הכרטיסיה פרמטרים כלליים , לחץ על כימות חלבון. בתוך ה פפטידים לקבלת כימות בתפריט הנפתח, בחר ייחודי + תער.
הערה: MaxQuant מציע כמויות חלופיות של חלבונים באמצעות קוונפיקציה מוחלטת מבוססת עוצמה (iBAQ) וכימות ללא תווית (LFQ). עם זאת, מידע אודות ספירת הפפטיד מספיק עבור ניתוח הזרם המורד בפרוטוקול זה15. - בחלק הימני התחתון של הממשק MaxQuant, בחר את מספר המעבדים שישמשו עבור החיפוש. פעולה זו תשפיע באופן ישיר על משך הזמן הנדרש להפעלה, כך שבחר במספר רב ככל האפשר עבור פעולה זו). לחץ על התחל בחלק הימני התחתון של המסך כדי להתחיל בהפעלה. בחר בכרטיסיה ביצועים בחלק העליון של המסך כדי להציג את ההתקדמות של החיפוש.
- כאשר ההפעלה הושלמה, לפתוח את הקובץ proteingroups. txt בפרסאוס, פלטפורמת חישוב פרוטאומניקס, או תוכנית גיליון אלקטרוני אחרת כדי להציג את הנתונים16.
- השתמש פרסאוס להסיר מזהמים נפוצים וכניסות כדי רצפי חלבון הפוכה. עקבו אחר התיעוד המפורט של פרסאוס ב-http://www.coxdocs.org/doku.php?id=perseus:user:use_cases:interactions.
הערה: פתיחת קובץ ה-. txt בתוכנת ניתוח (לדוגמה, Excel) מושחתת באופן אוטומטי שמות גנים מסוימים וחלבונים.
- השתמש פרסאוס להסיר מזהמים נפוצים וכניסות כדי רצפי חלבון הפוכה. עקבו אחר התיעוד המפורט של פרסאוס ב-http://www.coxdocs.org/doku.php?id=perseus:user:use_cases:interactions.
- ניתוח נתונים ניסיוניים באמצעות מאגר זיהום לטיהור אהדה (מחורבן). רשום חשבון במאגר זה http://crapome.org/ופעל לפי הערכת הלימוד בהתאם לצורך17,18.
- השתמש בזרימת העבודה ' נתח נתונים שלך ' בעמוד הבית. בחר פקדים חיצוניים המתאימים למערכת טיהור הזיקה המשמשת בניסוי אינטראקציה זה.
הערה: ניתן להשתמש בפקדים אלה כדי לחשב העשרה שינוי הקיפול השני השימושי לגילוי מזהמים נפוצים. - צור קובץ קלט מהפלט המתוכנת. txt מ-MaxQuant באמצעות פרסאוס או יישום גיליון אלקטרוני מתאים. פרטים עבור עיצוב ידני ניתן למצוא ב http://crapome.org/?q=fileformatting. לחילופין, השתמש בסקריפט R שסופק "export_CRAPomeSAINT_Input_File. R" כדי ליצור את קובץ הקלט הקדוש/מחורבן. ראה קובץ README. txt בקבצי קידוד משלימים.
- הפעל ניתוח כדי לקבוע העשרה שינוי קיפול ו-SAINT (ניתוח משמעויות של INTeractome) הסתברות עבור כל חלבון פיתיון בimmunoprecipitation. ודא כי האפשרות ' פקדי משתמש' נבחרה בתפריט הנפתח תחת fc-A, ' שולטת במצב ' או ' כל הפקדים ' נבחרו ברשימה הנפתחת fc-B ותוצאת ההסתברות נבחרה כדי ליצור הסתברות של סנט. כאשר ההפעלה הסתיימה, הצג את הפלט הזמין תחת ' תוצאות ניתוח ' יחד עם מזהה העבודה. הורד את מטריצת הנתונים מתוך ' תוצאות ניתוח ' לצורך התוויית נתונים והדמיה בעתיד.
- השתמש בזרימת העבודה ' נתח נתונים שלך ' בעמוד הבית. בחר פקדים חיצוניים המתאימים למערכת טיהור הזיקה המשמשת בניסוי אינטראקציה זה.
- התווה חלבונים כפונקציה של FC-A (IPs לעומת שולטת משתמש) וההסתברות הקדושה על-ידי ביצוע הסקריפטים של ה-R כפי שסופקו בקבצי קידוד משלימים.
הערה: קבוצה של סקריפטים R מסופקת להפקת מגרשים של FC-A vs. SAINT ו iBAQ vs. log2 (שפע חלבון), בצבע על ידי טווח הערך p מותאם מניתוח bayes אמפירית של עוצמות ללא תוויות. הפרטים של הניתוח הסטטיסטי הדיפרנציאלי וההתוויה נמצאים ב-README. txt ובסקריפט R "main_differential_analysis. R " בקבצי הקידוד המשלימים. - הערכת היכן החלבונים הידועים באינטראקציה של חלבון הפיתיון מדורגים על ידי FC-A ו-SAINT. לבצע חיתוך של FC-A > 3.00 ו-SAINT > 0.7 עבור ניסויים פיתיון אחד בטרילקאט כנקודת התחלה.
הערה: באמצעות מידע ביולוגי, יש לקבל הודעה על מבחר של תפשטחשבתי לבין שחקן "ביטחון גבוה" ושחקן "ביטחון נמוך".
8. הדמיית נתונים
הערה: ישנן תוכניות רבות שיכולות להמחיש ביעילות נתונים פרוטאומניקס (למשל, R, פרסאוס, ציטוסקייפ, STRING-DB). ניתוח הקישוריות בין להיטים בעלי ביטחון גבוה, והעשרה פונקציונלית של שחקנים אלה יכולה להיות אסטרטגיה שימושית לצורך קביעת סדרי עדיפויות עבור אימות נוסף ואפיון פונקציונלי.
- הורד ציטוסקייפ, כלי הדמיה של רשת קוד פתוח ב https://cytoscape.org/download.html19.
- הכן קובץ קלט לנתוני אינטראקציה כקובץ המופרד בטאבים המעוצב עם שלוש עמודות: פיתיון (צומת מקור), טרף (צומת יעד), סוג של אינטראקציה (סוג קצה). זה יכול להיעשות פרסאוס או כל תוכנית הגיליון האלקטרוני על בחירתך.
- בחר את הסמל ' יבא טבלה מקובץ ' לכיוון החלק העליון השמאלי של התוכנית (המיועדת על-ידי חץ כלפי מטה ומטריצה בסמל). ציטוסקייפ יאכלס אוטומטית את נתוני האינטראקציה ברשת מוכנה לעיצוב ועיצוב מותאמים אישית.
- בחר בכרטיסיה סגנון בלוח הבקרה עבור ציטוסקייפ ולחץ על הריבועים בעמודה Def כדי לכוונן את התכונה עבור הרשת כולה. בחר צמתים או קצוות ספציפיים ברשת ולאחר מכן בחר את הריבוע בתוך עמודת Byp. בתפריט הסגנון כדי לעקוף את הגדרות ברירת המחדל וכוונן אובייקטים שנבחרו בלבד. לחילופין, לחץ על התפריט הנפתח בראש תפריט הסגנון כדי להציג את תבניות הרשת המוגדרות מראש.
הערה: ניתן לשלב את הנתונים של מחרוזת-db חלבון-חלבון ברשת זו בשלב זה באופן ידני דרך קובץ הקלט או דרך כלים העשרה שונים הזמינים כתוספים בציטוסקייפ, http://apps.cytoscape.org/20. תוסף ציטוקסקייפ מומלץ לניתוח העשרה נמצא בhttp://apps.cytoscape.org/apps/cluego21. - כדי להגביר את האמון בערכת הנתונים שנוצרה בזרימת עבודה זו, בצע ניסויים הדדיים של IP-MS או IP-מערבית המכוונות לטרף חלבונים מעניינים כמו הפיתיון.
תוצאות
רוב מסת החלבון המזוהה בניסוי ה-IP-MS מורכבת מחלבונים שאינם ספציפיים. לפיכך, אחד האתגרים המרכזיים של ניסוי ה-IP-MS הוא הפרשנות שבה חלבונים הם שחקנים בעלי ביטחון גבוה לעומת שחקנים שאינם ספציפיים. כדי להדגים את הפרמטרים הקריטיים המשמשים הערכה של איכות הנתונים המחקר ניתח טריפליכאט immunoprecipitations מ 5 מ ג של החילוץ הגרעיני הלה ניצול חרוז רק שליטה. הבדיקה הפנימית הראשונה כדי להבטיח שניסוי ה-IP-MS הוא אמין אם החלבון הפיתיון מדרג כאחד החלבונים המועשרת ביותר המזוהים על-ידי שינוי הקיפול באמצעות שליטה והסתברות קדושה. במקרה זה, הפיתיון DYRK1A המדורגים בין שלושת החלבונים המועשרת על פני השליטה (איור 2A,B). במחקר interactome גרעינית של DYRK1A ניצול ארבעה נוגדנים עצמאיים, FC-A הפסקת של > 3.00 וההסתברות סנט הסתברות > 0.7 סיפק ניתוק מחמיר לזיהוי של שני שחקנים בעבר אומת22. בעת החלתם על ניסוי זה, ניתן לראות הפרדה ברורה בין השחקנים הבין-ביטחון הגבוה לבין > 95% מהחלבונים הקווריתים המזוהים כאינם ספציפיים (איור 2A,B). החלת העשרה של שינוי מתקפל וסף הסתברות מגבירה את החריפות על-ידי דרישה להגברת מזהי חלבונים באופן עקבי באמצעות שכפול ביולוגי.
בנוסף לניקוד הסטטיסטי, זרימת העבודה בניתוח "מפות" ממפה גם את האינטראקציות שדווחו בעבר על נתוני הפיתיון23. למרות שמיפוי זה יכול להיות שימושי עבור אינטראקציות מסף ביטחון גבוה ובטחון נמוך, אינטראקציות שדווחו בעבר יכולות להבקיע בצורה לא טובה על-ידי FC-A ו-SAINT, המעידים על כך שרבים מהאינטראקציות הידועות של פיתיון נתון קיימות רק בסוגי תאים ספציפיים, הקשרים או אורגלים. לדוגמה DYRK1A dataset, iref אינטראקטור חקן FC-ערכים היו נמוכים כמו 0.45, המייצגים שליטה מאוד נמוכה על העשרה (איור 2c). כדי למנוע האינפלציה של תוצאות חיוביות כוזבות, יש לבצע את הסף הסטטיסטיות באופן שקובע סדר עדיפויות לגבי הפחתת התשלילים השקרית. יצוין כי הגילוי של אינטראקציות אלה היה עצמאי שפע של חלבון (איור 2C). מספר העתק מוחלט של כל אינטראקציה iREF בתוך תאי הלה לא הראה מתאם לרמות הזיהוי של שותף אינטראקציה על-ידי IP-MS24.
ציטוסקייפ משמש כלי יעיל להמחיש שכבות מרובות של נתונים אינטראקציה19. בניסוי DYRK1A immunoprecipitation המתואר כאן, השימוש המשולב של FC-A > 3.0 ו-SAINT > 0.9 הפחיתה את הרשימה של שחקנים בעלי ביטחון גבוה כדי שישה חלבונים (איור 2D). עם זאת, בעת החלת FC-A חיתוך של > 3.0 בבידוד, שמונה חלבונים נוספים נוספו לרשת. אלה שחקנים חלבון נוספים יש קישוריות גבוהה עם האינטרקטורים כבר ברשת, מציע שהם משויכים מתחמי דומים או תפקידים פונקציונליים. למטרה זו, הוכחה מהמחרוזת-DB של אינטראקציות חלבונים-חלבון שולבו ברשת זו כמו קווים מקווקווים כחול20. בעוד שניסוי מטריפליקט זה מספק מדגם מוגבל של הרשת הDYRK1A המלאה של האינטראקציה, ניתן להשתמש בשימוש ב-baits, בשכפל ובשילוב של ערכות נתונים ציבוריות גדולות כדי להרחיב את הרשת של אינטראקציות ביטחון גבוה. הקוטופס הסטטיסטי יהיה ספציפי לכל ניסוי בודד ויהיה צורך להעריך ביסודיות.
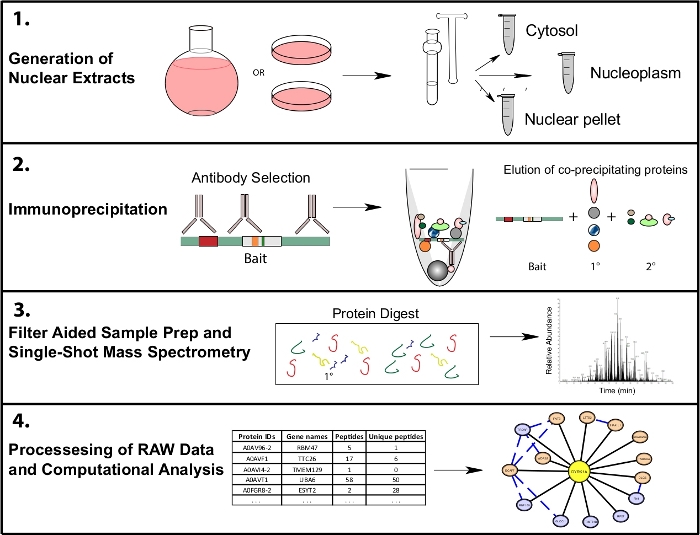
איור 1: הנציגה המייצגת את זרימת העבודה של ה-IP-MS משנה. תאים מגודלים ב 4 L עגול מבחנות התחתונה או 15 ס מ מנות התרבות רקמה וקצרו באותו זמן לשבר הסלולר. תאים מסולשים לתוך ציטוסולג, גרעיני, וכפה גרעיני, ו immunoprecipitations נעשים מ 1-10 מ ג של ליפוסט גרעיני באמצעות נוגדנים אחד או מספר לזהות את אותו פיתיון. סינון בסיוע לדוגמה (FASP) וניקוי מדגם לא מקוון מתבצעים לפני הספקטרומטר המסה היחיד שנורה. צינור חישוב במורד הזרם משמש לעיבוד נתונים לתוך מידע על אינטראקציה בין הטבלאות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
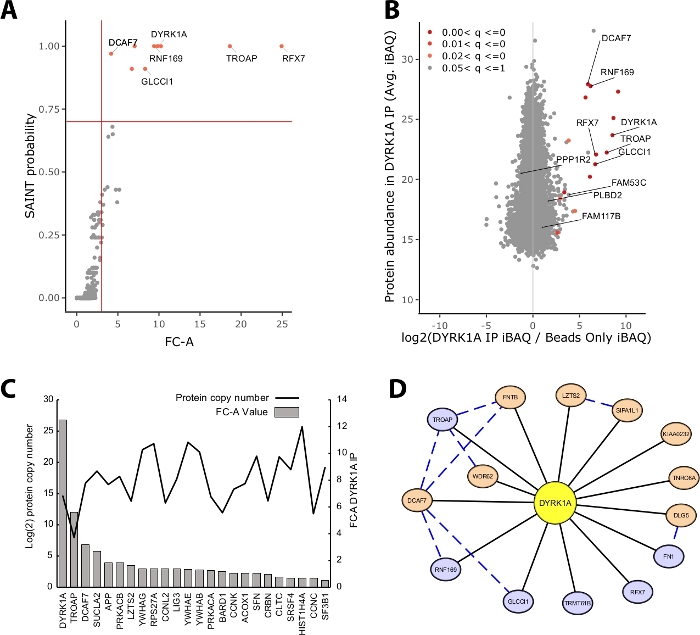
איור 2: נתוני הנציג לניסוי ה-IP-MS חד-ממדי של נוגדן אחד. (א) FC-A ו-SAINT פלט הסתברות מתוך תהליך בדיקה מיטבית לניסוי אופטימלי באמצעות נוגדן יחיד עבור קינאז DYRK1A (n = 3). בקרות חרוזים בלבד שימשו להשוואה. קווים מוצקים אדומים מייצגים להגדיר תפשטחשבתי ב-FC-A > 3.00 ו-SAINT > 0.7. (ב) הערכות שפע של חלבון מקסקואנט (iBAQ) לעומת היחס log2 של שפע חלבונים ב DYRK1A IP לשלוט, בצבע על ידי טווח הערכים p מותאם מניתוח bayes ניסיוני של עוצמות התווית חינם. (ג) מספר העותקים המשוער של החלבונים המפורטים כאינטראקציה בין חלבונים במסד הנתונים של iref23,24. (ד) ציטוסקייפ הדמיית רשת של DYRK1A הבינשחקנים. צמתים כחולים = FC-A > 3.00, סנט > 0.7. צמתי תפוז = FC-A > 3.00. קצוות שחורים = חלבונים המזוהים כשחקנים בניסוי IPMS. מקווקו כחול קצה = אינטראקציה הקדוש בין הטרף חלבון (ביטחון >. 150). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| תערובת מעכבי פרוטאז (PI) | |
| ריאגנט | ריכוז סופי |
| נתרן מטאביסולפיט | 1 ממ ' |
| בנזיל | 1 ממ ' |
| דיתיוטרטינול (DTT) | 1 ממ ' |
| פנילתסולולפוניל פלופ (PMSF) | 0.25 ממ ' |
| תערובת פוספספטאז (פי) | |
| ריאגנט | ריכוז סופי |
| מיקרוקיסטין LR | 1 μM |
| סודיום אורטודבנאט | 0.1 ממ ' |
| נתרן פלואוריד | 5 ממ ' |
| מאגרי שבירה משניים: | |
| מאגר A pH 7.9 | |
| ריאגנט | ריכוז סופי |
| מיכל ביטון | 10 ממ ' |
| MgCl2 | 1.5 ממ ' |
| אשלגן כלורי | 10 ממ ' |
| מאגר B pH 7.9 | |
| ריאגנט | ריכוז סופי |
| מיכל ביטון | 20 ממ ' |
| MgCl2 | 1.5 ממ ' |
| מיכל שלמה | 420 ממ ' |
| החומצה האמאורית (EDTA) | 0.4 ממ ' |
| גליצרול | 25% (v/v) |
| מאגר C pH 7.9 | |
| ריאגנט | ריכוז סופי |
| מיכל ביטון | 20 ממ ' |
| MgCl2 | 2 ממ ' |
| אשלגן כלורי | 100 ממ ' |
| החומצה האמאורית (EDTA) | 0.4 ממ ' |
| גליצרול | 20% (v/v) |
| מאגרי מImmunoprecipitation: | |
| מאגר ה-IP 1 | |
| ריאגנט | ריכוז סופי |
| מיכל ביטון | 20 ממ ' |
| אשלגן כלורי | 150 ממ ' |
| אדטה | 0.1 ממ ' |
| NP-40 | 0.1% (v/v) |
| גליצרול | 10% (v/v) |
| מאגר ה-IP 2 | |
| ריאגנט | ריכוז סופי |
| מיכל ביטון | 20 ממ ' |
| אשלגן כלורי | 500 ממ ' |
| אדטה | 0.1 ממ ' |
| NP-40 | 0.1% (v/v) |
| גליצרול | 10% (v/v) |
| מאגר אלקיללציה pH 8.5 | |
| ריאגנט | ריכוז סופי |
| שירותי המשך | 4% (v/v) |
| כלורואצטאמיד | 40 ממ ' |
| בעלי מארז | 10 ממ ' |
| טריס | 100 ממ ' |
| ה8.5 UA | |
| ריאגנט | ריכוז סופי |
| אוריאה | 8 מ ' |
| טריס | 0.1 מ ' |
| * השתמש בכיתות לציון H2O | |
שולחן 1: קומפוזיציות מאגר
משלים קבצי קידוד. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
זרימת העבודה של פרוטאומניקס המתוארים כאן מספקת שיטה יעילה לזיהוי מערכות חלבונים בעלי ביטחון גבוה לחלבון מעניין. גישה זו מקטינה את המורכבות לדוגמה באמצעות שבריר subcellular ומתמקדת להגדיל את האינטראקציה ההזדהות שותפים באמצעות הכנה לדוגמה חזקה, לדוגמה מנותק לנקות, ובקרת איכות מחמירים של מערכת LC-MS. ניתוח הנתונים במורד הזרם המתואר כאן מאפשר הערכה סטטיסטית פשוטה של החלבונים המזוהים באמצעות הפיתיון. עם זאת, בשל מספר גבוה של משתנים ניסיוניים (קנה מידה, קו תא, בחירת נוגדנים), כל ניסוי דורש תפשטחשבתי שונים ושיקולים לגבי הדמיית נתונים והעשרה.
שיקול העיצוב הראשון בניסוי ה-IP-MS הוא הבחירה של נוגדנים שישמשו לשימוש בחלבון של הריבית יחד עם השותפים האינטראקציה שלה. בעוד הזמינות של נוגדנים מסחריים התרחב כדי לכסות חלקים גדולים יותר של האדם במהלך העשורים האחרונים, יש עדיין חלבונים רבים שבהם ריאגנטים מוגבלים. יתר על כן, נוגדנים שאומתו עבור יישומים כגון גילוי כתמי מערביות לא יכול להיות מסוגל העשרה סלקטיבית של חלבון היעד בניסוי immunoprecipitation. לפני ביצוע הניסוי בקנה מידה גדול אינטראקציה פרוטרומאנים, הוא הציע להשלים IP מ 90% confluent 10 ס מ הצלחת, או מספר סלולרי שווה ערך, ולבדוק את חלבון היעד של עניין על ידי בלוק המערבי. אם יותר מאשר נוגדן אחד זמין עבור immunoprecipitation, זה הציע בנוסף לבחור מספר רב של נוגדנים לזהות בתוך חלקים שונים של החלבון. הכריכה של נוגדן לחלבון פיתיון יכולה לבטל את ממשק הכריכה הדרוש לשותפים באינטראקציה. בחירת אפירופה משנית לחלבון הפיתיון תגדיל את הכיסוי של פרופיל האינטראקציה המזוהה על-ידי ניסוי מבוסס ספקטרומטריה מאסיבית.
שיקול מרכזי נוסף נמצא בבחירה של השליטה המתאימה להבחנה בין אינטראקציות ביטחון גבוה לבין האינטראקציות בעלי ביטחון נמוך או יחסי גומלין לא ספציפיים מאלה המזוהים באמצעות הפיתיון. השליטה המחמירים ביותר עבור ניסוי ה-IP-MS היא להשלים את הimmunoprecipitation מתוך קו תא CRISPR KO של הפיתיון. שליטה כזו מאפשרת זיהוי וסינון של חלבונים שאינם ספציפיים הקושרים ישירות לנוגדן ולא לחלבון פיתיון. במקרים שבהם הפקת קו תא CRISPR KO של כל חלבון פיתיון אינו אפשרי, בקרת IgG-חרוז של אותו סוג איזוזה של נוגדן פיתיון ניתן להשתמש. בניסויים המעסיקים פאנל של נוגדנים המייצגים מינים מרובים, השימוש בחרוזים רק שליטה יכול להיות מתאים, אבל יגדל את הקצב של תוצאות חיוביות שווא שזוהו כמו שחקנים ביטחון גבוה.
בחירת קו התא המשמש בניסוי IP-MS תלויה במספר גורמים מרכזיים. ביטוי ולוקליזציה של חלבון תלויים במידה רבה בסוג התא. בעוד הערכות ביטוי RNA ניתן למצוא עבור רוב הגנים בקווים רבים בשימוש נפוץ, חלבון הביטוי הוא מתואם לגרוע עם ביטוי RNA וחייב להיות נחוש25. קווי תא בהם חלבון פיתיון מבוטא במספר העתק נמוך מאוד יש להימנע כדי לעקוף בעיות הקשורות לעלייה דרסטית בקנה מידה של תרבות התא שעשוי להידרש. יש לציין, עם זאת, כי הכנה לדוגמה יכולה להיות ממוטבת לאיתור חלבונים שפע נמוך מאוד. המסנן באמצעות מסנן בסיוע לדוגמה (FASP) שיטה, בעוד חסון, יכול לגרום יותר מ 50% אובדן של פפטיד במדגם. ההכנה לדוגמה המשופרת (SP3) היא שיטה יעילה ליצירת דגימות עבור ניתוח ספקטרומטר המסה הממזער את ההפסד לדוגמה26. ההתאוששות מוגברת מופעלת על-ידי שיטת SP3 של הכנה לדוגמה יכולה להיות חלופה שימושית בזרימת עבודה זו עבור כימות של חלבונים הנופלים קרוב למגבלת הזיהוי.
זו זרימת העבודה פרוטאומניקס הוחל על הרבה baits גרעיני, כולל הקינסים, E3 אוביקוויב ליגטיות, והפיגומים חברים של מתחמים multisubunit. בהנחה אימות נאות של ריאגנטים נוגדן, ביצוע מוצלח של זרימת עבודה זו תגרום לזיהוי של שותפים בעלי ביטחון גבוה לאינטראקציה גרעינית חלבון עבור חלבון של עניין.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי מענק האתגר W.M.O. ממכון לינדה Crnic עבור תסמונת דאון ועל ידי הסכם שיתופי DARPA 13-34-RTA-FP-007. אנו רוצים להודות לג קורלנד ולקירה קואזלינו על תרומתם בקריאה והערות על כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA | Thermo Fisher Scientific | 25200056 | |
| 1.5 ml low-rention microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| 4-20% Mini PROTEAN TGX Precast Protein Gels | Bio-Rad | 4561096 | |
| acetone (HPLC) | Thermo Fisher Scientific | A949SK-4 | |
| Amicon Ultra 0.5 ml 30k filter column | Millipore Sigma | UFC503096 | |
| Benzamidine | Sigma-Aldrich | 12072 | |
| benzonase | Sigma-Aldrich | E1014 | |
| Chloroacetamide | Sigma-Aldrich | C0267 | |
| Dialysis tubing closure | Caroline Biological Supply Company | 684239 | |
| DTT | Sigma-Aldrich | 10197777001 | |
| EDTA | Sigma-Aldrich | EDS | |
| GAPDH antibody | Santa Cruz Biotechnology | Sc-47724 | |
| Glycerol | Fisher Scientific | 887845 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HeLa QC tryptic digest | Pierce | 88329 | |
| HEPES | Fisher Scientific | AAJ1692630 | |
| insulin | Thermo Fisher Scientific | 12585014 | |
| iodoacetamide | Sigma-Aldrich | I1149 | |
| KONTES Dounce homogenizer 7 ml | VWR | KT885300-0007 | |
| Large Clearance pestle 7ml | VWR | KT885301-0007 | |
| Lysyl endopeptidase C | VWR | 125-05061 | |
| Magnesium Chloride | Sigma-Aldrich | 208337 | |
| Microcystin | enzo life sciences | ALX-350-012-C100 | |
| Nonidet P 40 Substitute solution | Sigma-Aldrich | 98379 | |
| p84 antibody | GeneTex | GTX70220 | |
| Phosphate Buffered Saline | |||
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23227 | |
| Pierce BSA Protein Digest, MS grade | Thermo Fisher Scientific | 88341 | LCMS QC |
| Pierce C18 spin columns | Thermo Fisher Scientific | PI-89873 | |
| Pierce Trypsin Protease, MS Grade | Thermo Fisher Scientific | 90057 | For mass spectrometry sample prep |
| PMSF | Sigma-Aldrich | P7626 | |
| Potassium Chloride | Sigma-Aldrich | P9541 | |
| Protein A Sepharose CL-4B | GE Healthcare Bio-Sciences | 17-0780-01 | |
| Protein G Sepharose 4 Fast Flow | GE Healthcare Bio-Sciences | 17-0618-01 | |
| SDS | Sigma-Aldrich | L3771 | |
| Silica emitter tip | Pico TIP | FS360-20-10 | |
| Small Clearance pestle 7ml | VWR | KT885302-0007 | |
| Sodium Chloride | Sigma-Aldrich | S3014 | |
| Sodium Fluoride | Sigma-Aldrich | 201154 | |
| Sodium metabisulfite | Sigma-Aldrich | 31448 | |
| Sodium orthovanadate | Sigma-Aldrich | S6508 | |
| Spectra/ Por 8 kDa 24 mm dialysis tubing | Thomas Scientific | 3787K17 | |
| TC Dish 150, Standard | Sarstedt | 83.3903 | Tissue culture dish for adherent cells |
| TCA | Sigma-Aldrich | T9159 | |
| TCEP | Thermo Scientific | PG82080 | |
| TFA | Thermo Fisher Scientific | 28904 | |
| Thermo Scientific Orbitrap Fusion MS | Thermo Fisher Scientific | ||
| Trizma Base | Sigma-Aldrich | T6066 | |
| Urea | Thermo Fisher Scientific | 29700 | |
| Waters ACQUITY M-Class UPLC | Waters | ||
| Waters ACQUITY UPLC M-Class Column Reversed-Phase 1.7µm Spherical Hybrid (1.7 µm, 75 µm x 250 mm) | Waters | 186007484 | nanoflow C18 column |
References
- Varjosalo, M., et al. The protein interaction landscape of the human CMGC kinase group. Cell Reports. 3, 1306-1320 (2013).
- Kimple, M. E., Brill, A. L., Pasker, R. L. Overview of Affinity Tags for Protein Purification. Current Protocols in Protein Science. 73, (2013).
- Mahmood, N., Xie, J. An endogenous 'nonspecific' protein detected by a His-tag antibody is human transcription regulator YY1. Data in Brief. 2, 52 (2015).
- Zordan, R. E., Beliveau, B. J., Trow, J. A., Craig, N. L., Cormack, B. P. Avoiding the ends: internal epitope tagging of proteins using transposon Tn7. Genetics. 200, 47-59 (2015).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10, 715-721 (2013).
- Bronicki, L. M., et al. Ten new cases further delineate the syndromic intellectual disability phenotype caused by mutations in DYRK1A. European Journal of Human Genetics. 23, 1482-1487 (2015).
- Antonarakis, S. E. Down syndrome and the complexity of genome dosage imbalance. Nature Reviews Genetics. , (2016).
- Dowjat, W. K., et al. Trisomy-driven overexpression of DYRK1A kinase in the brain of subjects with Down syndrome. Neuroscience Letters. 413, 77-81 (2007).
- Fotaki, V., et al. Dyrk1A haploinsufficiency affects viability and causes developmental delay and abnormal brain morphology in mice. Molecular and Cellular Biology. 22, 6636-6647 (2002).
- Hämmerle, B., Elizalde, C., Tejedor, F. J. The spatio-temporal and subcellular expression of the candidate Down syndrome gene Mnb/Dyrk1A in the developing mouse brain suggests distinct sequential roles in neuronal development. European Journal of Neuroscience. 27, 1061-1074 (2008).
- Funakoshi, E., et al. Overexpression of the human MNB/DYRK1A gene induces formation of multinucleate cells through overduplication of the centrosome. BMC Molecular and Cell Biology. 4, 12 (2003).
- Yu, D., Cattoglio, C., Xue, Y., Zhou, Q. A complex between DYRK1A and DCAF7 phosphorylates the C-terminal domain of RNA polymerase II to promote myogenesis. Nucleic Acids Research. , 1-14 (2019).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences of the United States of America. 76, 4350-4354 (1979).
- Wiśniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6, 359-362 (2009).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11, 2301-2319 (2016).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13, 731-740 (2016).
- Mellacheruvu, D., et al. The CRAPome: A contaminant repository for affinity purification-mass spectrometry data. Nature Methods. 10, 730-736 (2013).
- Choi, H., et al. SAINT: Probabilistic scoring of affinity purificationg-mass spectrometry data. Nature Methods. 8, 70-73 (2011).
- Shannon, P., et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Research. 13, 2498-2504 (2003).
- Szklarczyk, D., et al. The STRING database in 2017: quality-controlled protein-protein association networks, made broadly accessible. Nucleic Acids Research. 45, 362-368 (2017).
- Bindea, G., et al. ClueGO: a Cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks. Bioinformatics. 25, 1091-1093 (2009).
- Guard, S. E., et al. The nuclear interactome of DYRK1A reveals a functional role in DNA damage repair. Scientific Reports. 9, 6539 (2019).
- Razick, S., Magklaras, G., Donaldson, I. M. iRefIndex: A consolidated protein interaction database with provenance. BMC Bioinformatics. 9, 405 (2008).
- Kulak, N. A., Pichler, G., Paron, I., Nagaraj, N., Mann, M. Minimal, encapsulated proteomic-sample processing applied to copy-number estimation in eukaryotic cells. Nature Methods. 11, 319-324 (2014).
- Liu, Y., Beyer, A., Aebersold, R. On the Dependency of Cellular Protein Levels on mRNA Abundance. Cell. 165, 535-550 (2016).
- Hughes, C. S., et al. Ultrasensitive proteome analysis using paramagnetic bead technology. Molecular Systems Biology. 10, 757 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved