Method Article
הדור של הלבלב אורתוטואט גידולים ואפיון Vivo Ex של תאים הסתננות של הגידול תא T
In This Article
Summary
פרוטוקול זה מתאר את הדור כירורגי של גידולים הלבלב אורתודפית ואת העיכול המהיר של גידולים מבודדים מבודד מורטין הלבלב. לאחר העיכול, אוכלוסיות קיימא תאים החיסונית יכול לשמש ניתוח נוסף במורד הזרם, כולל לשעבר גירוי vivo של תאים T לאיתור ציטוקינים תאיים ידי הזרימה cy, try.
Abstract
במודלים vivo של סרטן הלבלב לספק כלים לא יסולא בפז לחקר הדינמיקה של המחלה, חדירה חיסונית ואסטרטגיות טיפוליות חדשות. מודל מורטין מוראו ניתן לבצע על כריות גדולות של עכברים המוסמכת בו, הוא זול יחסית ומשמר את הסביבה המיקרוגניטה רקמות. הקוונפיקציה של הסתננות תא T פעילות ציטוטוקבית בתוך גידולים אורתוטופית מספק מחוון שימושי של תגובה אנטי מוסרית.
פרוטוקול זה מתאר את המתודולוגיה עבור הדור כירורגי של גידולים הלבלב אורתודפית על ידי הזרקה של מספר נמוך של תאי הגידול syngeneic מושעה 5 μL מרתף ממברנה ישירות לתוך הלבלב. עכברים הנושאים גידולים הנושא לקחת כ 30 ימים כדי להגיע לנקודת הקצה, בו גידולים בנקודה ניתן לקצור ומעובד עבור האפיון של פעילות החדירה לתאים T הגידול. העיכול אנזימטי מהירה באמצעות הקולגן ו DNase מאפשר השעיית תא יחיד להיות מופק גידולים. הכדאיות ואת סמנים משטח התא של תאים החיסונית שחולצו מן הגידול נשמרים; לכן, זה מתאים ליישומים מרובים במורד הזרם, כולל מיון תאים בסיוע זרימה של תאים חיסוניים עבור תרבות או הפקת RNA, זרימה cy, לנסות ניתוח של אוכלוסיות תאים החיסונית. כאן, אנו מתארים את הגירוי vivo ex של אוכלוסיות תא T עבור כימות תאיים (IFNγ ו-TNFα) ופעילות Degranulation (CD107a) כמדד של הרעילות הכוללת. מעכל הגידול המלא היו מגורה עם בפורבול מסתורי אצטט ו ionomycin עבור 5 h, בנוכחות של נוגדן anti-CD107a על מנת לupregulate הייצור ציטוקינים ו degranulation. התוספת של brefeldin A ו monensin עבור הגמר 4 h בוצע כדי לחסום את התחבורה החילוץ ולמקסם את גילוי ציטוקינים. מכתים נוסף ופנים-סלולריים של תאים התבצע לאחר מכן עבור ניתוח cy, היכן שיעור IFNγ+, tnfα+ ו CD107a+ CD4+ ו CD8+ T תאים היתה בכמת.
שיטה זו מספקת בסיס התחלתי לבצע ניתוח מקיף של מיקרואקולוגיה של הגידול.
Introduction
שיטה זו פרטים, מתחילתו-to-סיום, הליך כירורגי ליצירת הלבלב אורתודפט גידולים באמצעות כמות מינימלית של חומר הסלולר ואת הדיסוציאציה המהירה הבאה של גידולים הוקמה עבור הניתוח cy, לנסות לזרום מקיף של אוכלוסיות תאים החיסונית, כולל ניתוח vivo ex של פונקציית תא T.
לבלב הלבלב אדנוקרצינומה (PDAC) הוא קרצינומה אגרסיבית עם רק 8% מהחולים ששרדו 5 שנים1. ככל פחות מ -20% מהחולים זכאים לניתוח כירורגי2, דגימות מטופלים טריים אינם נגישים בקלות למחקר ובכך במודלים vivo לספק כלים חיוניים כדי לחקור את המחלה. ישנם מודלים murine מרובים של pdac: הנושא, תת עורית, הטרנסגניים, ורידי והחולה מבע (pdac), תיאר בהרחבה כאן3. המודל האורטו-מגנטי המתואר כאן מאפשר הזרקה של תאים בתחביר PDAC לתוך הלבלב של עכברים אימונומוסמכים. ניתן לבצע זאת בקבוצות גדולות של עכברים מסוג פראי או מוטציה, ובכך מספק מודל חסכוני ועקבי להשוואת הסוכנים הטיפוליים. וחשוב מכך, המודל מספק את הסביבה קנצוני מיקרו עבור צמיחת תאים סרטניים, גרורות בידינו ואחרים4 לאתרים רלוונטיים קלינית (למשל, כבד), מה שהופך אותו רלוונטי יותר קלינית מאשר הדגמים תת עורית או כימית המושרה. אורתוטופית גידולים להציג תכונות מפתח של PDAC, כגון תגובה desmoplastic חזקה עם שפע של הפיברוולים ומטריצות מטריקס התצהיר5. המודלים הטרנסגניים של PDAC הם התקן זהב של מודל murine ואת הנפוץ ביותר הוא מודל KPC, אשר מביע מוטציה קראסG12D/+ ו Trp53R172H/+ מתחת ללבלב ספציפי pdac-1- היצור מיזם6. KPC נוספים ואחרים בדגמי vivo pdac נבדקים כאן7. עכברים KPC באופן ספונטני לפתח גידולים בלבלב עם התקדמות המחלה כי בנאמנות משכפל תכונות של האדם PDAC6. עם זאת, באשר לכל הדגמים הטרנסגניים, תוכנית הרבייה הוא יקר, התקדמות הגידול הוא משתנה ולכן דורש לעתים קרובות כורים גדולים של עכברים. PDX מודלים להשתמש בתאי הגידול נגזר החולה או חתיכות אשר גדלו לאחר מכן או אורתולמריחה או לעתים קרובות יותר תת-עורי בעכברים החיסונית. דגמי xenograft מספקים כלים שימושיים לסינון תרכובות טיפוליות ולחשבון עבור טרוגניות המטופל. עם זאת, הם אינם מספקים מיקרוסביבה חיסונית מלאה, ובכך להגביל את היישומים שלהם8,9.
הוקמה לאחר, בגידולים אורתודפית בדרך כלל לקחת בסביבות 1 חודש או יותר כדי לגדול (בהתאם לקו התא בשימוש) וטופס גידולים גדולים שניתן ליצור בקלות על-ידי אולטרסאונד או MRI כדי לעקוב אחר ההתקדמות ולקבוע את יעילות הטיפול4,5,10. עם זאת, פעם בצמיחה אקספוננציאלית, השלב האחרון של גידול הגידול יכול להיות מהיר, כך רוב הטיפול משטרי החלו יחסית מוקדם (למשל, 14 ימים)11,12. המערכת החיסונית משחק תפקיד קריטי בפיתוח הגידול, כולל PDAC, אשר מאופיין בגידול חיסוני מדכאים לחדור עם העיר היחסית של התאים T ונוכחות תכופים של תאים מיאלואידית13. נוכחות גבוהה של תאים T ב pdac לאחד פרוגנוזה טובה יותר14,15. עם זאת, כמו סוכנים בודדים, מעכבי המחסום החיסונית להקל על דיכוי חיסוני התא, כגון anti-ctla-416 ו anti-PD-L117, לא הראו תועלת קלינית בחולים pdac, סביר להניח בגלל הכולל תא T תגובתיות הוא נמוך מאוד. עם זאת, הסוכנים כי התגובות תא T הממשלה, כגון anti-CD40, יכול להתגבר על anti-PD-L1/ctla-4 התנגדות18,19 ו החיסון עם מג-שדרתי הפרשה החיסון pdac (gvax) יכול להגדיל את החיסוני של pdac גידולים20, המציין כי שיפור התגובות התא t טפסים
קריטי תגובה תא T antitumoral היא ההכרה של אנטיגנים הנגזרים מהגידול דרך קולטן T-cell (TCR) והייצור הבאים של ציטוקינים ציטוטוקסיים וגרגרים. בעוד אנטיגן תא T-זיהוי יכול להיקבע על ידי רצפי TCR, גישה זו היא יקרה זמן רב. עם זאת, כימות של קבוצות משנה של תאים החדירה הגידול מספק אינדיקציה טובה של תגובה אנטי-tumoral. בדיקה נוספת של פעילות תא T ex vivo במונחים של degranulation ייצור ציטוקין וגורמים ציטוטוקסיים אחרים מספק ניתוח פונקציונלי עמוק יותר. זה אומר שניתן לבצע על דגימות גידולים טריים ופרמטרים רבים של הפונקציה תא T ניתן למדוד במהירות על ידי הזרמת cy, לנסות.
תאים CD8+ ו CD4+ T לייצר ציטוקינים כגון IFNγ ו-tnfα כדי לספק תגובה חיסונית21. IFNɣ גורם MHCI upregulation על תאים היעד, גורם בידול וגיוס של תאים חיסוניים ואיידס מוות תאים. IFNγ הייצור על ידי CD8+ T תאים מאופיין היטב להיות חלק מתגובה antitumoral ו התואם רגרסיההגידול 22,23. Tnfα הוא עוד ציטוקינים proinflammatory המיוצר על ידי שני CD8+ ו CD4+ T תאים. היא מגבירה את ההפעלה התלויה ב-TCR ואת התפשטות תאי ה-T, ומסייעת לתגובת האנטי-טומוראלית. עם האירוסין TCR, ציטוטוקסיים CD8+ T תאים יכול לעבור degranulation שם מראש בנוי הפרשה ליזוזומים המכילים מולקולות ציטוטוקסיים משתחררים לתוך סינפולוגית החיסונית לגרום השפלה תא היעד21. מולקולות אלה כוללות ניקובים, חלבון הנקשר קרום התא היעד, ויוצרים נקבוביות כי לאחר מכן לשבש את שלמות הממברנה ולאפשר דיפוזיה21 או endocyציטוזה24 של מולקולות מתוזיות אחרות, כגון granzyme B, ישירות לתוך הציטופלסמה של תא היעד. Granzyme B הוא פרוטאז המשמש השפלה של חלבונים מרובים בתוך תא היעד, המוביל למוות תאים21. שחרורו של מולקולות כאלה דורש אקסוציטוזה של אנדוזומים אל פני השטח התא, שם סמן אנדוזוממית CD107a (הידוע גם בשם המנורה -1) הוא שולב באופן מידי לתוך קרום התא25.
המדידה של הפרשת ציטוקין על ידי תאי T מחייבת את הבידוד שלהם על-ידי מיון תאים בסיוע זרימה או הפרדה מבוססת חרוז, אשר לא ניתן לבצע בקלות על מספר רב של דגימות בו זמנית. עם זאת, מדידה של ציטוקינים תאיים אינו דורש שום צעדים טרום בידוד ניתן לבצע בקלות על מספר דגימות בבת אחת, ומאפשר גישה תפוקה גבוהה יותר. כמו ציטוקינים מופרש במהירות על ידי תאי T, רמות תאיים יכול להיות בלתי ניתן לגילוי ולכן תא T דורש גירוי כדי להגדיל את הייצור cy, הבזקין הבסיס. כדי להעריך את הייצור אנטיגן מונחה ציטוקין, אנטיגן המזוהה על ידי TCR חייב להיות מוצג לתא T על ידי APC מוכן בתוך מבחנה. במקרים שבהם האנטיגן אינו ידוע, נדרשת גישת גירוי רחבה. גירוי tcr יכול להיות מחקה באמצעות anti-CD3/28 חרוזים המספקים הן הפעלה tcr והן גירוי משני, אשר משרה ייצור ציטוקינים והתפשטות. עם זאת, חלופה חסכונית יותר היא השימוש PMA ו ionomycin, אשר ביחד להפעיל בהרחבה מסלולים איתות המובילים סינתזה ושחרור של ציטוקינים תאיים. באופן ספציפי, PMA מפעילה חלבון קינאז C (PKC) ואיקונמיצין מעלה Ca תאים2 + יונים, המוביל איתות תא מוגבר. על מנת לשמר את התוכן התאיים של ציטוקינים, גירוי זה יכול להיות משולב ביעילות עם מעכבי התחבורה חלבון brefeldin A ו monensin, אשר לחסום חלבונים ב-Golgi ובכך למנוע שחרור מסחטות. השימוש ב-PMA/ionomycin הוא שיטה מבוססת היטב לעירור תאי T ויש קשר חזק בין ציטוקינים שפורסמו ומשוטי-תאיים26. גירוי של תאים T עם PMA ו ionomycin גם מגביר את הסחר העצמי לקרום התא ולכן CD107a הופך משולב על פני השטח התא לפני ממוחזרים לתא. על ידי כלילת נוגדן anti-CD107a במהלך הגירוי, אפשר להשתמש בו כסמן של פעילות degranulation25.
שיטה זו מעכל במהירות את הגידולים כדי לספק השעיה לתא אחד. בשלב זה, אוכלוסיות בודדות יכולות להיות מוכתמות במישרין לצורך זרימה cy, או מטוהרים על-ידי שיטות במורד הזרם: מיון תאים בסיוע זרימה או הפרדת חרוזים מגנטית. הכנת השעיית תא בודד לניתוח cy, מאפשר ניתוח בתפוקה גבוהה של אוכלוסיות מרובות של תאים חיסוניים וסמנים פנוטיפ שלהם, מתן כימות מדויקת של מספר התא החיסונית והפנוטיפים.
בסופו של דבר, פרוטוקול העיכול המתואר כאן מונע הפסד של פני השטח תא ושומר על הכדאיות של התא החיסונית, המאפשר לתאי החיסון לעבור שלבי טיהור תא נוסף ותרבות כנדרש. עם זאת, שיטה זו לא נבדקה לגבי הנובעות תאים אפיתל מעיכול זה.
Protocol
אורתודהלבלב גידולים שנוצרו כפי שתוארו בעבר10 בהתאם עם בריטניה בעלי חיים במשרד הליכים מדעיים לפעול 1986 ואת ההנחיה האירופית 2010/63/האיחוד האירופי. כל העכברים עקבו בצורה מבצעית עבור סימנים של כאב או סבל, כולל אך לא מוגבל לירידה במשקל (> 15% ב 72 h או 20% בכל תקופה נתונה), piloerection, היצרות של עיניים, הילוך מוגבה, מראה מפוקח, כמו גם סימנים של זיהום הפצע כולל דימום, אדמומיות וכיבית. גידול הגידול היה במעקב על ידי מישוש, ושלטים קליניים נוספים כגון נשימה מאומצת, צהבת וגפיים קר גם בפיקוח על מנת להעריך אם הגיעו סימנים של נקודת הקצה. כל ההליכים צריכים להתבצע בתנאים סטריליים. כל הריאגנטים להשתמש לפני הזרמת cy, להזרים כתמים צריך להיות מוכן בתנאים סטרילי.
1. הכנת תאים סרטניים להזרקה
- הקליקו על ממברנה של קרום המרתף מ-20 ° c והניחו על הקרח ב -4 ° c למשך הלילה.
הערה: הריכוז הממברנה במרתף עשוי להשתנות מאצווה לאצווה; לכן, הרבה ממברנה מסוימים אצוות מרתף צריך להיבדק בvivo כדי להבטיח את האפשרות. קבוצה חדשה של קרום המרתף הוא הופכה על הקרח ב 4 ° c לילה ולאחר מכן מצוטט באמצעות משתמש מוגדר המשתמש, על הקרח, ולאחר מכן מאוחסן עוד ב-20 ° c עד הנדרש. זה ממזער את ליטוף ולהקפיא את הכנף בעת שימוש קרום המרתף.- הניחו את הערוץ PBS סטרילי ב -4 ° c ללילה כדי להתקרר.
- המקום סטרילי 200 μL ו 1000 μL הצינורות טיפים ב-20 ° c לילה כדי להתקרר.
- השימוש בתאי הגידול כי הם mycoplasma חינם, גדל לפחות 2-10 פסקאות שלאחר הפשרה ובשלב היומן של צמיחה לפני הקציר. פרוטוקול זה משתמש הנקבה murine C57BL/6 KPC-נגזר קו התא: TB32048 מסופק כמתנה נדיבה על ידי המעבדה של דוד Tuveson.
- כאשר תאים סרטניים נדרשים עבור הקציר, להסיר בינוני מן הבקבוקון ולשטוף את התאים פעמיים ב-PBS (טרום מחומם עד 37 ° c).
- הוסיפו את 2x טריפסין (מחומם מראש עד 37 ° c) לבקבוקון במשך 10 דקות ב 37 ° צ' (לבקבוקון T175, הוסיפו 5 מ ל).
- לאחר 10 דקות, להוסיף כמות שווה של בינונית מלאה (10% FBS, 1 x פניצילין, 1x סטרפטומיצין ב DMEM) לתוך הבקבוקון ואת הנתק התאים על ידי הקשה בעדינות על הבקבוקון והשעיית מחדש טוב בינונית.
- העבר את התאים לתוך צינור וצנטריפוגה עבור 5 דקות ב 300 x g וטמפרטורת החדר (RT).
- הסר את ה-supernatant והשהה מחדש את התאים במדיום מלא עבור ספירת תאים.
- התאים צנטריפוגה שוב עבור 5 דקות ב 300 x ו RT, ולהסיר את supernatant.
- השהה תאים מחדש ב-PBS מקורר כדי להשיג ריכוז של 1x106 תאים/mL.
הערה: ריכוז מניות זה מוכן להשגת ריכוז ההזרקה הסופי של 1000 תאים ב 5 μl. מצאנו הזרקה של מספר נמוך יותר של תאים בנפח הזרקה נמוכה הדליפה התא ולכן מוגברת התפתחות עם זאת, גידול הגידול עשוי להיות התלוי בקווי התא ולכן משתמשים צריכים למטב כל קו תא.
- לצד זה, מניחים ממברנה מתחת לפני המרתף מצוטט, על הקרח, אל תוך המכסה.
- היחס של הפתרון הסופי של קרום המרתף, התאים PBS ותאי הגידול ב-PBS המוכן להזרקה הוא 5:3:2. לכן ל-500 μL ליטר של קרום המרתף להוסיף 300 μL של מראש מקורר PBS באמצעות לפני מקורר 1000 μL הפיפטה.
- הוסיפו את ה-PBS ישירות לקרום הממברנה המרתף כדי למזער את הלילטף.
- לשמור את p1000 להגדיר ל-300 μL ולהשעות מחדש את קרום PBS ומרתף, וודא לשמור על הצינור על הקרח כדי לשמר את קרום המרתף במצב נוזלי.
- כאשר סיימה להוציא את כל קרום המרתף מהקצה p1000, להשאיר את הקצה בצינור כדי לאפשר כל קרום המרתף/PBS לרדת בקצה הצינורות.
- לאחר 5-10 דקות, להוציא קרום מרתף יותר מקצה p1000 בחזרה לתוך הצינור ולהשאיר את הצינור לשבת על הקרח.
- קח 200 μL של תאים סרטניים מחדש ב-PBS ולהוסיף ישירות את קרום המרתף באמצעות טרום מקורר 200 μL פיפטה טיפ.
- קח טרי p1000, מקורר מצוננים עצה, להגדיר את הפיפטה ב 300 μL ו-resuspend 30-40 פעמים. טיפ פיפטה גדול יותר, להגדיר על נפח נמוך, עדיף כמו קרום המרתף יכול לנסוע במעלה הקצה ולגעת מסנן טיפ הצינורות במהלך השעיה.
- . תאי הגידול מוכנים לזריקה לשמור על תא הגידול/קרום המרתף על הקרח במהלך הניתוח.
2. הזרקת אורתוטופית של תאי גידול
- Acclimate העכברים במתקן החי במשך 7 ימים.
- סביב 2 h לפני הניתוח, לגלח את הצד השמאלי של הבטן ובחזרה, ואז לנהל משכך כאבים מראש תת-עורי תחת העורף של הצוואר (Buprenorphine ב 50-100 μg/ק"ג).
- הכן שדה כירורגי, עם מחצלת חום להטיל את העכבר על וילונות עבור הציוד המקיף והעכבר. לחטא את כל כלי הניתוח; להכין מספיק סטים של כלים עבור כל עכבר.
- הניחו את העכבר בתוך 5% למטה עם חדר O2 עד הכרה.
- להעביר את העכבר, שוכב על גבו, על מחצלת חום ולשמור על הרדמה באמצעות מסכה, בדרך כלל בנמוכה יותר 2-3% isofלוריאן.
- אשר הרדמה עמוקה; כפי שזוהה על ידי אובדן של רפלקס הדוושה-נסיגה כאשר הרגל האחוריות הוא צבט לפקח על קצב הנשימה נשאר קבוע.
- , כסו את הגופה בכיסוי. רק החלק המגולח נחשף ודא שהעכבר מאובטח במסכת ההרדמה.
- באמצעות ניצן כותנה סטרילית, להוסיף תמיסת יוד בתנועה מעגלית על השטח מגולח: החל מהמרכז ומקיפים את הקצה. חזור על תהליך שוב עם ניצן כותנה טרי ויוד.
- השתמש אזמל לעשות חתך 1 ס מ ישירות מעל מיקום הלבלב/הטחול (הרביע השמאלי העליון). מספריים סטרילי יכול לשמש גם כדי לבצע את החתך, אם המועדף.
- משוך את העור לגזרים באמצעות מלקחיים. עם מלקחיים חדשים, לאתר את הקיר הצפק ולהשתמש במספריים לעשות עוד 1 ס מ לחתוך דרך הקיר הצפק.
- לחלץ את הלבלב, אשר עשוי לבוא עם הטחול, מן הגוף באמצעות זוג שני של מלקחיים.
- בעדינות להפוך את הבקבוקון של תאים סרטניים/קרום המרתף מספר פעמים כדי לערבב.
- הכן את מזרק זכוכית עם 5 μL המכיל 1,000 תאים סרטניים בקרום המרתף ומקום על מחצלת חום במשך כמה שניות כדי לאפשר לו להתחמם.
הערה: ההתחממות הקצרה של המזרק תאפשר לקרום המרתף להתחיל ליצור מיצוק, על מנת שיהיה קל יותר להזריק מבלי לדלוף. עם זאת, זה חייב להישמר קצר, אם נשאר זמן רב מדי קרום המרתף יהיה לחזק לחלוטין ולא להזריק. השימוש של מזרק זכוכית מאפשר נפח נמוך להיות הזריק בדיוק. - להחזיק את הלבלב בזנב כדי להאריך אותו ולהכניס את המחט ישירות למרכז הלבלב, במקביל ללבלב עצמו עם מאמץ כדי למנוע כלי דם גלויים.
הערה: למרכז הלבלב יש שטח גדול והדבר הקל ביותר להזריק. עם זאת, הראש או הזנב של הלבלב עשוי גם להיות מוזרק במפורש אם מועדף. - לאט להזריק 5 μL של קרום המרתף לתוך הלבלב ולהחזיק את המחט יציב בלבלב לפחות 30 s לאחר ההזרקה כדי לאפשר את קרום המרתף כדי לגבש ולמנוע דליפה. קרום המרתף צריך להיות גלוי כמו בועה קטנה ברורה ייווצר; עם זאת, ייתכן שהוא לא יהיה גלוי.
הערה: כמויות גדולות יותר של תאים סרטניים/קרום המרתף ניתן להזריק; עם זאת, יש לבדוק את אמצעי האחסון המדויק כדי להבטיח שהדליפה לא תתרחש. - להסיר את המחט מן הלבלב ולחכות כדי לאשר שום דימום לא אירע. בעדינות להכניס את הלבלב בחזרה לחלל הבטן, מטפלת לא לגעת בועה קרום המרתף.
- משוך את קיר הצפק יחד לבצע תפר יחיד, או שני תפרים קטוע אם יש צורך.
- משוך את שני הצדדים של החתך בעור יחד לבצע תפרים קטוע מרובים לפי הצורך או להוסיף שני קליפים כירורגיים.
- הזרקת הזרקה תת-עורית נוספת של בופרינורפין לתוך הגביל.
- להעביר את העכבר לתוך כלוב מחומם 37 ° c עבור לפחות 30 דקות לאחר הניתוח כדי לשמור על טמפרטורת הגוף לפני המעבר חזרה לכלוב טרי.
- להכין דיאט מחית זמין בכלוב, כדי להבטיח מחדש את משקל הגוף.
- לנהל מחדש כאבים שלאחר הניתוח מומלץ ולצפות מקרוב סימנים של פתיחת פצע, כאב או זיהום וירידה במשקל. אם שימוש בקליפים כירורגיים, ניתן להסירו 7-10 ימים לאחר מכן באמצעות מסיר קליפ.
- לאחר כ 14 ימים רקמת הצלקת יחלים מספיק כדי להתחיל לבתר את הבטן. הצג גודל גידול מקרוב דרך מישוש עד שעכברים מגיעים לנקודת הקצה.
- בנקודת הקצה העכבר מנקצב באמצעות פריקה צוואר הרחם ואחריו עריפת ראש. העור וחלל הצפק נפתחים באמצעות מספריים ואת הגידול לבלב באמצעות מלקחיים להחזיק את הגידול, מספריים כדי להסיר את הרקמה המקיפה.
3. העיכול של גידולים בלבלב
- מקום גידול בלבלב בגזור, גידולים באתר גרורתי, או רקמת הלבלב בריא בקרח קר PBS, ולאחסן על הקרח.
- מלקחיים להשתמש כדי להעביר את הגידול על צלחת פטרי.
- הוסף 5.0 mL של עיכול בינונית (2 מ"ג/mL קולגן, 0.025 mg/mL DNase RPMI) לתוך שפופרת של 50 mL; חנות על קרח כדי למנוע פעילות אנזים מתחיל.
הערה: פרוטוקול זה משתמש בקולגן סוג V, אשר יש פעילות של ≥ 1 יחידות/mg FALGPA מוצע ו> 125 יחידות העיכול קולגן (CDU)/mg מוצק. כאשר אתם משתמשים ב-20 ° c ומופשרים על הקרח לפני השימוש. כאשר שני הם מסיסות לחלוטין RPMI סטרילי, הם יכולים להיות מועברים באמצעות פילטר 0.2 יקרומטר כדי להסיר מזהמים. הקולגן חייב להיות מסיסות לחלוטין לפני סינון כדי למנוע אובדן של חומר. - קח מסגרת קטנה של פתרון זה כדי לכסות את הגידול על צלחת פטרי.
- השתמש אזמל סטרילי מלקחיים כדי לחתוך את הגידול לחתיכות קטנות, בערך פחות מ 3 מ"מ אורך.
- מגרדים את חתיכות הגידול לתוך הצינור בעדינות להפוך את הצינור עד כל החלקים הם שקועים בתקשורת העיכול. חנות על הקרח אם דגימות גידול אחרות צריך להיות מוכן אצווה.
- העבר אל מכשיר רועד במשך 20 דקות ב 37 ° c. ודא שכל החלקים של הגידול הם שקועים ולא תקועים לקצה הצינור. אם לרעוד הוא לא אפשרי, ואז מערבולת את המדגם כל 5 דקות כדי לסייע לעיכול.
4. הכנת השעיית תא בודד מגידול מתעכל
- מיד לאחר שלב העיכול, למקם את הצינור על הקרח כדי להאט את פעילות האנזים.
- הוסף EDTA כדי להשיג ריכוז סופי של 20 מ"מ ומערבולת בקצרה דגימה לערבב. פעולה זו תגרום להאטה של פעילות האנזים.
- פתח את הצינור ולשטוף את כל הגידול לעכל את המכסה של הצינור עם מדיום RPMI טריים.
- הכנת מסננת 70 יקרומטר (הגודל יקרומטר של המיסננת ניתן לשנות כרצונך) על הצינור 50 mL פתוח, על הקרח.
- להרטיב מראש את המסנן עם בינוני.
- השהה את התאים המועכלים ושטוף את צדי הצינור באמצעות מערך של 25 מ"ל, או גדול יותר. הפתיחה הרחבה יותר של הסטריפטה חשובה לאפשר לתקציר הסמיך לעבור בקלות.
- העבר את כל התקציר, באמצעות ה-25 מ"ל, אל המסננת.
- מחית את הגידול על גבי המסנן באמצעות מזרק 1 mL. מחית רק ישירות למעלה ולמטה כדי למזער את המתח ההטיה לתאים.
- ברציפות לשטוף את התאים דרך מסננת עם RPMI. הקפד לשטוף עם מספיק כוח כדי לדחוף את התאים.
- אם יש עדיין חומר לחית, אבל RPMI מפסיק לרוקן דרך, מסננת יהיה רווי. לכן, העבר את הדוגמה לתוך מסנן חדש והמשך.
הערה: בסופו של דבר רק רכיבי מטריצה מתכלים יישארו במסנן, כל התאים היחידים היו צריכים לעבור.
- צנטריפוגה את הצינור עבור 5 דקות ב 300 x ו 4 ° c.
- השהה מחדש בקפידה את הגלולה בRPMI השלם ועבור ישירות דרך מסנן אחר כדי להסיר כל מטריצה מסירה או גושים תאים גדולים שלא ניתן להשעות אותו מחדש.
- בשלב זה, אם לא נדרש גירוי, הכתם מיד את התאים הבודדים לצורך זרימה cy, try ניתוח ידי דילוג לשלב 6.1. לחילופין, השהה אותם מחדש בהקפאה בינונית (10% DMSO ב-FBS) ואחסן ב-80 ° c ואחריו אחסון לטווח ארוך בחנקן נוזלי.
הערה: שלב ההקפאה יכול לאפשר טיהור של תאים חיסוניים במועד מאוחר יותר; עם זאת, כימות קבוצות המשנה של תא החיסון עשוי לדרוש אופטימיזציה כדי לאשר כי מספרי התאים והפנוטיפים אינם מושפעים מתהליך ההקפאה/הפשרה. גירוי התא vivo T לשעבר מבוצע ביותר על דגימות גידולים טריים. בשלב זה המדגם יכול להיות מטוהרים עוד יותר על-ידי הסרת חרוז מבוסס תא מת להסרת או העשרה החיסון התא החיסונית אומר אם נדרש.
5. הכנת תאים עבור גירוי vivo לשעבר
- לספור את התאים כדי להשיג ריכוז של 2 x 106/100 μl בינונית מלאה (RPMI 10% fbs, 1x פניצילין ו-1x סטרפטומיצין).
הערה: המספר הגבוה של מצופה התאים הכולל מבטיח כי יהיו תאי T הולמים בתוך מדגם זה כדי לנתח. עם זאת, ניתן לשנות את המספר למעלה או למטה בהתאם לזמינות המדגם ולאופי הנדיר של קבוצות משנה של T-cell של עניין.- צלחת 100 μL של תאים בתחתית U-לוחית 96-באר.
- הוסף 100 μL של בינוני מלא המכיל 2x הכנה של PMA/איקונמיצין (כדי להשיג ריכוז סופי 0.081 μM ו 1.34 μM, בהתאמה, כפי שמומלץ על ידי היצרן).
הערה: אם מדידת הדיגרטולציות/אקסוציטוזה, כלול גם כאן מCD107a מצושל בעלי מעלה באמצעות פלואורוסקופים במדיה. יש לבצע גם דגימת בקרה שאינה מכילה CD107a. - מקום בחממה 37 ° c עם 5% CO2 עבור 1 h.
- הוסף 20 μL של הכנת 10x של brefeldin A ו monensin (כדי להשיג ריכוז סופי 1.06 μM ו 2.0 μM, בהתאמה (כפי שמומלץ על ידי היצרן) במדיה המלאה.
הערה: Brefeldin A ו monensin הם מעכבי הובלה חלבונים ובכך לחסום שחרור החילוץ של ציטוקינים, וכו ' מאפשר את הזיהוי שלהם על ידי הזרמת cy, try. אם מדידת שחרור ציטוקין לתוך הסופרנטנט על ידי אליסה או שיטות דומות – אז ניתן לדלג על שלב זה. - מניחים את הצלחת בחממה 37 ° c עם 5% CO2 עבור עוד 4 h.
6. מסחטות וכתמים תאיים על הזרמת הציטומה
- הסר את הצלחת והשהה מחדש כל טוב כדי להעביר את כל החומר לצלחת התחתית, הניח על קרח.
הערה: תאים אפיתל, מקרופאגים ותאים חסיד אחרים לא ניתן לאחזר במלואו על ידי השעיית מחדש. עם זאת, כאשר ניתוח במורד הזרם הוא רק בתאי T, זו אינה בעיה.- 6.1.1 צנטריפוגה את הצלחת עבור 5 דקות ב 300 x ו 4 ° צ' (השתמש בתנאים אלה עבור השלבים הבאים אלא אם צוין).
- הסר את הסופרנטנט על ידי העברת הלוחית למטה בתנועה חדה אחת.
- השהה מחדש ב-50 μL של צבע יכולת לתיקון, המוכן ב-PBS קר קרח. בעת השעיית מחדש, הגדר את הפיפטה לאמצעי אחסון נמוך יותר כדי להימנע מביצוע בועות.
- דגירה של 20 דקות ב 4 ° c, בחשיכה.
- לשטוף את הצעד: להוסיף 100 μL של מאגר FACS, צנטריפוגה ולהסיר את הסופרנטאנט.
- השהה מחדש כל טוב עם 50 μL של anti-CD16/CD32 (2.5 μg/mL) במאגר FACS (0.5% BSA, 2.0 mM EDTA ב-PBS) כדי לחסום כריכה לא ספציפית של נוגדנים לזיהוי קולטני Fc.
- דגירה של 15 דקות ב -4 ° c, בחשיכה.
- הוסף ישירות לכל אחד היטב שילוב מאסטר של 2x של fluorochrome מצוCD45 נגד העכבר, CD3, CD4 ו CD8 (מיותר סמנים לחילוץ ניתן להוסיף כרצונך) במאגר FACS.
- דגירה של 30 דקות ב -4 ° c, בחשיכה.
- לשטוף את הצעד: להוסיף 100 μL של מאגר FACS, צנטריפוגה ולהסיר את הסופרנטאנט.
- הוסף 100 μL של מאגר קיבוע של 1x (IC) קיבעון ו מודטה עבור 30 דקות ב RT, בחושך.
- הכינו את הצנטריפוגה.
- הוסף 100 μL של מאגר FACS, צנטריפוגה עבור 5 דקות ב 300 x g ו RT ולהסיר את supernatant. חזור עם מאגר חדירות 1x וצנטריפוגה עבור 5 דקות ב 300 x g; לאחר מכן הסר את הסופרנטאנט.
- הוסף 50 μL של שילוב מאסטר של 1x של fluorochrome מצוIFNγ נגד העכבר, TNFα, ו סמנים תאיים אחרים מוכן במאגר החדירות 1x.
- . בסדר.
- הוסף 100 μL של מאגר חדירות לכביסה. אז צנטריפוגה עבור 5 דקות ב 300 x ו RT ולהסיר את supernatant.
- הוסף 100 μL של מאגר FACS לשטוף, צנטריפוגה עבור 5 דקות ב 300 x g ו RT ולהסיר את supernatant.
- לאחר צנטריפוגה סופית זו, השהה מחדש תאים באמצעי אחסון התואם לcytometer הזורם. זה עשוי להשתנות בהתאם לגודל של הצינורות FACS.
- העבר אמצעי אחסון זה לצינורות ה-FACS המתאימים לרכישה.
- לכסות מהאור ולאחסן במקרר ולרכוש את הדגימות בתוך 24 h.
תוצאות
לאחר הזרקת 1000 תאים TB32048 לתוך הלבלב, הגידולים האורתודפית לקחת כ 30 ימים כדי לפתח (איור 1A, B). במרתף ממברנה דליפה במהלך הניתוח יכול לגרום לגידולים גדולים להיווצר ישירות על הקיר הצפק, אשר בולט לעין דרך העור (איור 1ג). היינו מסירים את העכברים. האלה מהמחקר עם זאת, עם כישורי ניתוח טוב השכיחות של דליפה הוא ממוזער. הגידולים אורתודפית שנקטפו בנקודת הקצה יכול לצמוח בגודל משמעותי C57BL/6 עכברים מסוג פראי (איור 1ד). הגידולים שנקטפו אורתודהנושא דורשים עיכול ב-קולגן/DNase עבור 20 דקות כדי להשיג השעיה תא יחיד (איור 2). בשלב זה, תאים הנגזרים מהגידול יכול להיות מצופה בצלחת U-התחתית ב 2 x 106 תאים/גם. מספר מצופה תאים ניתן לשנות בהתאם לשכיחות של תאי T בתוך המדגם; מספר התא ניתן להוריד אם תאי T נמצאים בצפיפות גבוהה. שליטה הטחול או הלימפה דגימות יכול גם להיות מצופה בנקודה זו עבור גירוי. כל באר הוא מגורה עם PMA ו ionomycin עבור 5 h ואחרי 1 h הדגירה, brefeldin A ו monensin מתווספים כדי לחסום שחרור החילוץ של ציטוקינים (איור 2). לאחר הדגירה, הדגימות מוכתמות לקבלת אפיטסקופים וציטוקינים תאיים לניתוח על ידי הזרמת cy,מאיור 2.
דגימות של טחול וגידולים מעכברים נושאת הגידולים האורתודטופית נותחו על-ידי מיכל הזרימה. האסטרטגיה המסייעת בשימוש בניתוח cytometry לטחול וגידולים משום שאינו מניח פסולת באמצעות FSC-a, אס. אס. או, doublets על ידי FSC-A/FSC-H ו-אס. אס. סי-W, לאחר מכן תאים מתים או אפוטוטיים כחיובי לתיקון הכדאיותלתיקון(איור התאים החיסוניים מגודרת אז עלCD45 +, ו T תאים מגודרת עוד יותרCD3 + ממנו CD4+ ו CD8+ קבוצות מערכות מוגדרות (איור 3א). פלואורסצנטית פחות אחד (FMO) מבוצע כדי לקבוע את הרקע של זריחה עבור בקרת ומונפלדין A/monensin השליטה היחידה מבוצעת כדי לקבוע ייצור בסיס של ציטוקינים (איור 3ב-D).
עבור IFNγ, דגירה עם brefeldin א/monensin הביא לא להגדיל ב IFNγ על שליטה FMO בדגימות הטחול והגידול. עם זאת, התוספת של PMA ו ionomycin גדל את% של IFNɣ תאיים לזיהוי הן הטחול ואת הגידול הנגזר CD4+ ו CD8+ T תאים.
הטחול CD4+ ו CD8+ T תאים, משמש כפקד חיובי, יש ייצור IFNγ גבוה יחסית מאשר החדירה לקבוצות המשנה של תאים T, עם ממוצע של 6.60 ± 1.5% ו 12.97 ± 3.4% לעומת 4.81 ± 1.0% ו 4.13 ± 1.3%, המציינת שדיכוי חיסוני מתרחש בתוך הגידול (איור 3B ו- 4a). באמצעות אותה אסטרטגיה עבור TNFα, אנו מדמיינו כי אחוז גבוה של הטחול CD4+ T תאים חיוביים עבור tnfα (65.93 ± 2.3%), לעומת הגידול החדירה CD4+ T תאים (22.45 ± 5.4%). הטחול ואתהCD8 הגידול תאים T לייצר רמות דומות של tnfα (25.15 ± 3.7% ו 19.91 ± 5.1%, בהתאמה) (איור 3ג, איור 4ב).
לבסוף, CD107a הוא סמן אנדוזומבית כי הוא ביטא באופן מבוקר על פני התא במהלך האקסוציטוזה של גרגירים ציטוטוקסיים ו ציטוקינים, ככזה, הוא משמש סמן פונדקאית עבור רעילות ציטובית. היתרון של כתמים עבור CD107a במהלך הגירוי הוא כי כל משטח התא מבוטא הביע CD107a להילכד על ידי נוגדן פלורסנט. רמות הבסיס של CD107a מוצגות בברפלדין א/מוננסין רק תאים. עבור הטחול CD8+ T תאים, גירוי עם pma/ionomycin מגדיל את הרמה של CD107a זיהה, עם הupregulation החזק ביותר CD8+ תאים שהיו 23.95 ± 3.5% CD107a+, לעומת 5.8 ± 1.9% ב הגידול החדירה CD8+ תאים, המציין הטחול CD8+ היה שיעור גדול יותר של degranulation. מצד שני, הטחול ו-החדירה הגידול CD4+ הביע רמות דומות של CD107a 9.37 ± 1.5% ו 11.50 ± 1.8% (איור 3D ו- 4c).
באופן כללי תוצאות אלה להדגיש כי גידולים אורתוטופית ניתן להפיק מן ההזרקה של מספר נמוך מאוד (1,000) של תאים סרטניים לתוך הלבלב. גידולים אלה יכולים להיות מתעכל במהירות עבור בידוד של תאים T עבור גירוי vivo ex . זיהוי ציטוקינים תאיים אפשרי מדגיש את רמת הבסיס של דיכוי חיסוני החדירה תאים T, לעומת תאי T באיברי הלימפה משני.
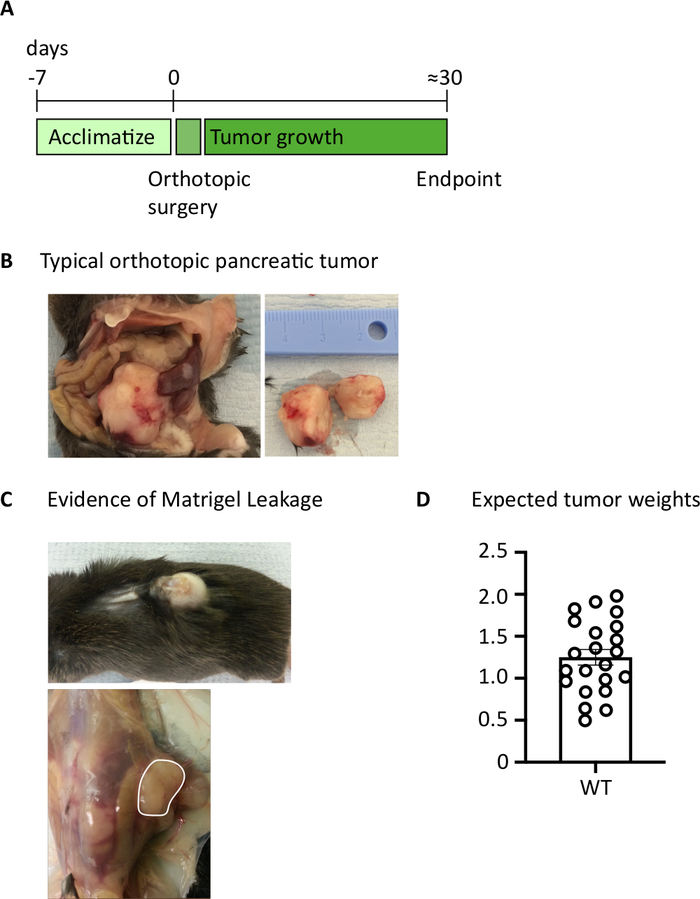
איור 1: הדור של הלבלב אורתודפית גידולים. (א) לוח זמנים בניסויים vivo . (ב) המראה המקסקופי של גידולים אורתוסקופית בתוך חלל הבטן (משמאל) ולאחר כריתה (מימין) שבו הגידול המוצג נחתך לחצי. (ג) הוכחות לדליפת קרום המרתף במהלך הניתוח עלולה לגרום לגידולים להתפתח, הגלויים דרך העור (תצלום עליון) ולטופס על קיר הצפק (צילום תחתון). (ד) אורתוטופית הלבלב משקולות הגידול שנקטפו מעכברים שהגיעו נקודת הקצה (n = 22). כל נקודת נתונים מייצגת עכבר בודד, תרשים עמודות מראה ממוצע ± SEM. הנתונים באיור זה שונו מהעבודה שפורסמה בעבר10. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
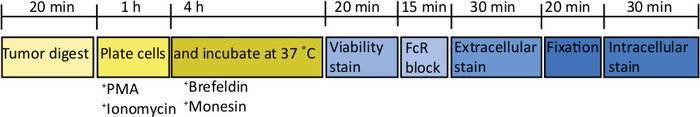
איור 2: סכמטית של עיבוד הגידולים האורתודפית עבור גירוי תא vivo T ex . לאחר הקציר, גידולים בלבלב מתעכל במהירות ב קולגן (2 מ"ג/mL) ו DNase (0.025 mg/mL) עבור 20 דקות ב 37 ° c. לאחר מכן, תאים מושעים מחדש ב-2 x 106/mL במדיה RPMI מלאה ומצופה בלוחית התחתית של U. קוקטייל גירוי של PMA ואיקונמיצין נוסף עבור 5 h, בשלב זה אנטי העכבר CD107a נוגדן ניתן גם להוסיף לתרבות. לאחר 1 h הדגירה חוסמי התחבורה תאיים, brefeldin A ו monensin, מתווספים. לאחר vivo לשעבר גירוי התאים מועברים לתוך צלחת v-התחתית לצביעת עם צבע הכדאיות לתיקון (ב-PBS) עבור 20 דקות 4 ° c. התאים נשטפים במאגר FACS ו-מודבטים ב anti-CD16/32 (בלוק FcR) עבור 15 דקות (ב FACS מאגר) ולאחר מכן מודנות עם פלורסנט מתוך מעלה-מצועם מעלה נוגדנים עבור 30 דקות נוספות (ב-FACS מאגר). תאים נשטפים שוב במאגר FACS ולהשעות מחדש במאגר קיבעון תאיים עבור 20 דקות. לאחר מכן, התאים נשטפים פעם אחת במאגר FACS ופעם אחת במאגר החדירות 1x. תאים מושעים מחדש עבור 1 h ב RT ב-פלורסנט תאיים-מצוח נוגדנים עבור 1 h (במאגר החדירות 1x). התאים נשטפים פעם אחת במאגר החדירות 1x ופעם אחת במאגר FACS לפני השעיית מאגר FACS לרכישה על cytometer הזרימה בתוך 24 h. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
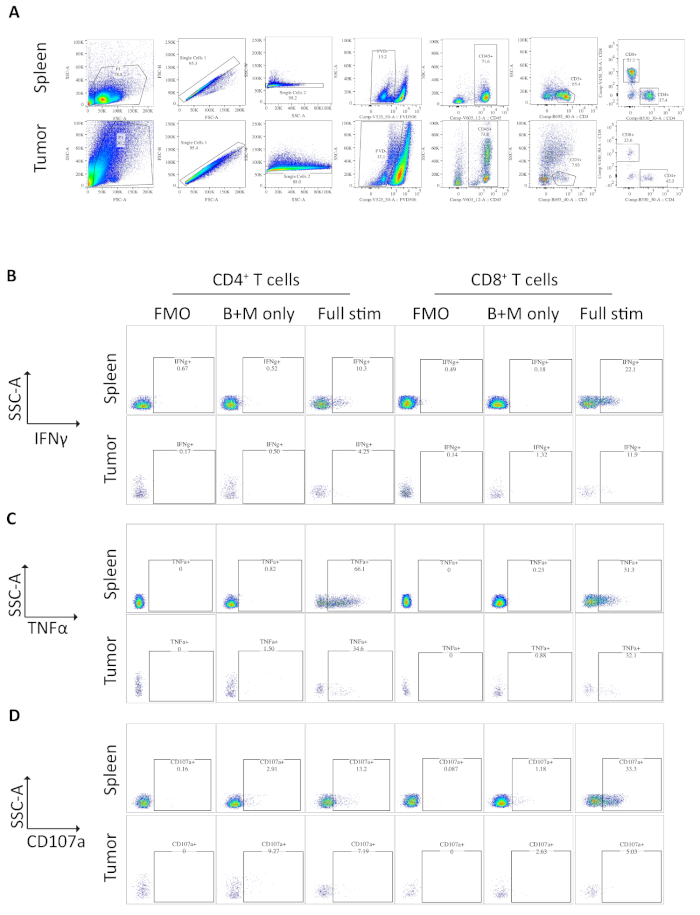
איור 3: הזרימה cyvivo try ניתוח של לשעבר מגורה הטחול-ואת הגידולים הנגזרים תאים T. (א) הזרימהcy, try האסטרטגיה המשמשת הטחול (שליטה חיובית) ו אורתובנושא דגימות גידולים. התאים מפלים מפסולת באמצעות FSC-A/אס-אס-אס ותאים בודדים מבודדים עוד יותר באמצעות FSC-A/FSC-H ו-אס. אס. סי. תאים מתים או אפוטוטיים אינם נכללים באמצעות הכדאיות לתיקון-FVD506 ותאים חיסוניים מגודרת על ידי CD45+. לאחר הגדרת התאיםCD3 + T וערכות המשנה CD4+ ו-CD8+ . . המידע התקבל בשביל BD (ב) אסטרטגיית היציאה המשמשת לכמת IFNγ+ CD4+ ו CD8+ T תאים. פלורסנט פחות אחד (FMO) משמש על דגימות מגורה (PMA/ionomycin/ברפלדין A/monensin) כדי לקבוע את תאורת הרקע. ברפלדין A/monensin שליטה רק (B + M בלבד) משמש כדי לקבוע את הייצור ציטוקין בסיס. לאחר מכן משמש המדגם המלא לחישוב התאים% IFNγ+ T. (ג) האסטרטגיה לעבור המשמש לכמת TNFα+ CD4+ ו CD8+ T תאים. בקרת FMO משמשת על דגימות מוסטימולציה מלאה (PMA/איקונמיצין/ברפלדין A/monensin) כדי לקבוע את הזריחה ברקע. ברפלדין A/monensin שליטה רק (B + M בלבד) משמש כדי לקבוע את הייצור ציטוקין בסיס. לאחר מכן משמש המדגם המלא לחישוב התאים% TNFα+ T. (ד) אסטרטגיית היציאה המשמשת להגדרת תאים CD107a+ CD4+ ו-CD8+ T. בקרת FMO משמשת על דגימות מוסטימולציה מלאה (PMA/איקונמיצין/ברפלדין A/monensin) כדי לקבוע את הזריחה ברקע. ברפלדין A/monensin שליטה רק (B + M בלבד) משמש כדי לקבוע את הדמגרציות בסיס. לאחר מכן משמש המדגם המלא לחישוב התאים% CD107a+ T. כל הנתונים cy, לנסות להיות מנותח על FlowJo גירסה 10.6.1. הנתונים באיור זה שונו מהעבודה שפורסמה בעבר10. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
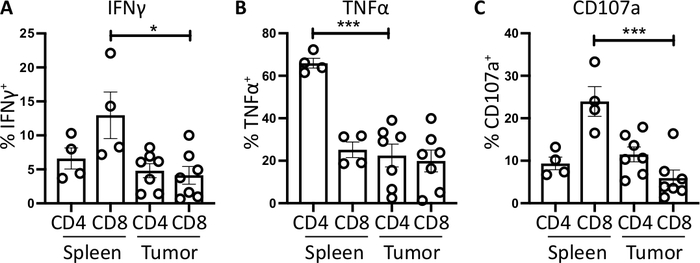
איור 4: קוונפיקציה של vivo ex הטחול-ואת הגידול הנגזר פעילות תא T. החלק של CD4+ ו CD8+ T תאים חיוביים עבור (A) IFNγ+ (ב) tnfα+ ו (ג) CD107a+ היה ככמת בטחול (n = 4) וגידול (n = 7) של עכברים הנושאת הגידול אורתוטופית. כל נקודת נתונים מייצגת עכבר בודד וקווי שגיאה המציגים ממוצע ± SEM. משמעות סטטיסטית נבדקה באמצעות מבחן t שאינו משויך כאשר * = p < 0.05 ו * * * = p < 0.001. כל הנתונים נותחו באמצעות מנסרה 8. הנתונים באיור זה שונו מהעבודה שפורסמה בעבר10. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
במודלים vivo של סרטן הלבלב לספק כלים יסולא בפז כדי להבין התקדמות המחלה להעריך מטרות therapeutics חדש3. המודל האורטו-מודל בפרט הוא מודל חסכוני ומאפשר לשימוש הניתן להחלה בקבוצות גדולות של עכברים בו4,27. המודל האורתוקפית מספק גם את מיקרו הסביבה קנצוני ואת המערכת החיסונית שלם לצמיחת הגידול, מה שהופך אותו מתאים יותר מאשר תת עורית ו pdx-מודלים. עם זאת, מצאנו כי כמה אלמנטים של חדירה חיסונית יכול להיות שונה בין מודל אורתובנושא ועכברים KPC, הדגם murine הזהב בתקן10. אחת הסיבות לכך יכול להיות גידול גידול מואץ לראות במודל הנושא. הבדלים נוספים בצפיפות קבוצות המשנה של התא החיסונית תוארו בין הנושא אורתולבין דגמי תת עורית3,28. לכן, למרות מודל KPC הטרנסגניים יקר יותר משתנה6, ממצאים המפתח צריך להיות מאומת בקבוצה קטנה של עכברים kpc במידת האפשר.
הכנת תאים סרטניים עבור ניתוח אורתוטופית הוא צעד קריטי בפרוטוקול. תאים תמיד צריך להיות בשלב היומן של צמיחה mycoplasma-וללא זיהום. ניתוח אורתוטופית צריך להידחות אם יש חששות לגבי צמיחת תאים סרטניים. השימוש קרום המרתף משפר את שיעור הגידול בשיעור על הזרקת תאים ללא זה29 ומפחית את דליפת התא ובכך התפשטות הצפק27. עם זאת, ברגע השעיה קרום המרתף, תאים סרטניים צריך להיות מוזרק במהירות (בתוך 2 שעות) כדי למנוע אובדן התאים. מספר התאים הסרטניים הדרושים כדי ליצור גידולים הוא עשוי להיות מתאים בתור תא, ומגוון של מספרי תאים יש לבדוק (למשל, מ 100 – 100,000) אשר עשוי גם לקבוע את הזמן כדי להגיע נקודת הקצה. סביר להניח שיהיה שוליים של שגיאה בעת הכנת 1,000 תאים לכל עכבר להזרקה; לכן, אם נדרשים ימים מרובים של ניתוח, הטיפול בקבוצות צריך להתפשט באופן שווה על פני ימים כדי לשלוט באפקטי אצווה. רוב הצעדים הכירורגית ניתן לשנות בהתאם להעדפות; עם זאת, הטיפול חייב להילקח לא להפריע קרום המרתף בעת החלפת הלבלב בחלל הבטן או לסגור את הקיר הצפק. במרתף ממברנה דליפה יכול לגרום לצמיחה תא הגידול על הקיר הצפק, אשר בצורה מהירה והוא יכול לגרום להקריב את החיה מוקדם יותר.
באופן אידיאלי, גידולים בלבלב צריך להיות מתעכל במהירות לאחר הקציר ומוכן vivo לשעבר גירוי מיידי. עם זאת, זה לא יכול להיות אפשרי אם יש אצווה גדולה של גידולים לקצור, במקרה זה גידולים יש לשמור על קרח מתעכל בקבוצות. סוג, ריכוז ואורך של חשיפה לאנזימי העיכול כל הוכחו להשפיע על מספר רב של מולקולות פני השטחעל התאיםהחיסוניים 30,31,32. זמן העיכול הוא גם קצר במכוון כדי להגביל את מוות התאים33. תאים מתעכל ניתן לקפוא למטה בהקפאה בינונית לאחסון לטווח ארוך; עם זאת, אובדן תאים מסוימים יתרחשו בעת הפשרה. תהליך העיכול יכול להיות פחות מיטבי אם חתיכות הגידול אינן מספיק לקוביות לפני הדגירה הקוביואז וזה יהיה ברור כמו חתיכות הגידול קשה יישאר במסנן לאחר העיכול. את הריכוז הקולגן יכול להיות הוריד אם העבודה עם הלבלב בריא או גידולים בשלב מוקדם; דוחות על חילוץ תאים בריאים ductal הלבלב להשתמש ריכוזים נמוכים משמעותית34. מידה גבוהה של מוות של תאים אפיתל היא להיות צפוי במהלך העיכול; עם זאת, תאים חיסוניים צריך לסבול את התהליך היטב. שיטות חלופיות קיימות כדי לבודד תאים אפיתל קיימא עבור צמיחה אורגאיד35 או כדי לשמר את ארכיטקטורת הרקמה36.
שינויים בפרוטוקול גירוי ניתן לעשות בקלות, בהתאם לקריאה הרצויה התא החיסונית ניתח (למשל, מקרופאגים או B תאים). השימוש של הפאן הגירוי ריאגנטים PMA/איקונמיצין לא להפלות TCR-אנטיגן ספציפיות, מה שהופך אותו שימושי כאשר האנטיגן אינו ידוע. עם זאת, הייצור של IFNɣ קשורה היטב עם התחייבות TCR37 , הן IFNɣ ו-TNFα הייצור הם קריטיים בתגובות pdac antitumoral וסרי38. הגירוי PMA/איקונמיצין משקף את הקיבולת המקסימלית של תאי T כדי לייצר ציטוקינים, אשר עשוי או לא יכול להיות מיוצר על ידי תאי T בתוך מיקרוסביבה הגידול. ניתן למדוד ייצור אנדוגני ללא צורך בגירוי; עם זאת, רמות עלולות להיות נמוכות או בלתי מורגשת. ישנן שיטות חלופיות כדי לעורר תאים T: anti-CD3/28-מצופה חרוזים, אשר גם לא דורשים אנטיגן או אכן אוכלוסיות אחרות של תאים חיסוניים. היתרון של שיטה זו הוא לאפשר כימות הייצור cy, על ידי מערכות המשנה של תא T ספציפיים ללא צורך בשיטות הפרדה. סימנים אחרים של רעילות ציטובית (granzyme B ו-ניקובים A), פעילות (IL-2) או דיכוי חיסוני (IL-10) ניתן גם להוסיף21. עם זאת, הזרימה באיכות גבוהה cy, לנסות נוגדנים אינם זמינים כדי לזהות את כל ציטוקינים וגורמי עניין. לכן, אם יש יישומים אחרים כגון אליסה נדרש את הגירוי ניתן לבצע ללא הכללת brefeldin A/monensin, ומאפשר ציטוקינים לשחרר את הסופרנטאנט. עם זאת, של הערה, זה יהיה לאפשר את הגרסה הכוללת ציטוקינים שחרור וזה לא יהיה אפשרי כדי לקבוע אילו אוכלוסיות תאים תרמו.
IFNγ הפקה היא תכונה דומיננטית של תגובת תא T antitumoral, משמש לעתים קרובות כתחליף tcr-אנטיגן זיהוי37,38. אחרים בשיטות vivo כי באופן מדויק יותר להגדיר התשובות ספציפיים אנטיגן לנצל את התאים הסרטניים להביע אנטיגן ידוע, כגון Ovalbumin או SV40. אנטיגן אוניברסלי לאחר מכן ניתן להשתמש לשעבר vivo כדי לבדוק זיהוי תא T או בשילוב עם עכבר מארח tcr-מוגבלת. לחילופין, כאשר האנטיגן אינו ידוע, כימות של הרחבת שבטים של תא T ניתן לבצע על ידי רצף בצובר-tcr, או לאחרונה תא יחיד tcr רצף39,40. כדי להבין באופן מלא את המצב של תגובת תא T intrאטומוראלית, סמנים הרומז על תשישות או קולטנים מעכבות צריך גם להיות נמדד כולל: CTLA-4, PD-1, לג -3, TIM3, 2B4. כמו גם סמנים של התאים של אפקטור T (CD44 hi, CD62lo) ופעילות ההתרבות, Ki67+ או csfe דילול41,42,43,44. באופן כללי, המודל האורתוקפית מספק פלטפורמה שימושית כדי לבדוק במהירות אסטרטגיות טיפוליות, בפרט כי יכול לווסת את תגובת T-cell האנטי מוסרית, כי ניתן לאימות על הקבוצה קטן יותר של transgenic, KPC, עכברים.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
היינו רוצים להודות לשירות טכנאי בעלי חיים וד ר Alzbeta Talarovicova (בארטס מכון לסרטן, המלכה מרי אוניברסיטת לונדון, לונדון, בריטניה) על עזרתם במהלך ניתוח אורתוטופית. אנחנו רוצים גם להודות לד ר ג'ניפר מורטון (מכון ביטלסון לחקר הסרטן, גלאזגו, בריטניה) על הדרכתו בטכניקה כירורגית, ד ר. כריסטינה Ghirelli (בארטס מכון לסרטן, המלכה מרי אוניברסיטת לונדון, לונדון, בריטניה) על העצה שלה על עיכול הגידול וד ר. פביאן מקלאנאהאן (בארטס מכון הסרטן, המלכה מרי אוניברסיטת לונדון, לונדון, בריטניה) לעצתה אנחנו גם רוצים להודות למועצת המחקר הרפואי (MRC), סרטן הלבלב מחקר קרן (PCFR) ו סרטן השחלות פעולה אשר מימנה את המחקר הזה.
Materials
| Name | Company | Catalog Number | Comments |
| 6/0 gauge coated vicryl absorbable sutures | Ethicon | W9500T | |
| 70 μm pore-size cell strainer | Fisher Scientific | 11597522 | |
| 9 mm Clay Adams clips | VetTech Solutions | IN015A | |
| anti-CD107a PE (clone 1D4B) | Biolegend | 121612 | 1:100 to culture media |
| anti-CD16/CD32 | BD Biosciences | 553142 | Use at final dilution 1:200 |
| anti-CD3 PerCP eFluor710 (clone 17A2) | Biolegend | 46-0032 | Use at final dilution 1:50 |
| anti-CD4 FITC (clone GK1.5) | eBioscience | 11-0041 | Use at final dilution 1:100 |
| anti-CD45 Brilliant Violet 605 (clone 30-F11) | Biolegend | 103140 | Use at final dilution 1:200 |
| anti-CD8 Brilliant Violet 421 (clone 53-6.7) | Biolegend | 100738 | Use at final dilution 1:100 |
| anti-IFN-gamma PE/Cy7 (clone XMG1.2) | Biolegend | 505826 | Use at final dilution 1:50 |
| anti-TNF-alpha Alexa Fluor 647 (clone MP6-X) | Biolegend | 506314 | Use at final dilution 1:50 |
| BD Matrigel Basement Membrane Matrix High Concentration | BD Biosciences | 354248 | Aliquot on ice and store in -20 °C |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| Cell Stimulation Cocktail (500x) (phorbol 12-myristate 13-acetate (PMA) and ionomycin) | eBioscience | 00-4970-03 | 1x Final concentration PMA 0.081 μM, ionomycin 1.34 μM |
| Clay Adams Autoclip Applier | VetTech Solutions | IN015B | |
| Clay Adams Autoclip remover | VetTech Solutions | IN015B | |
| Collagenase Type V from Clostridium histolyticum | Sigma-Aldrich | C9263 | 2 mg/mL in media |
| Dimethyl sulphoxide (DMSO) | Sigma-Aldrich | D2650-100mL | |
| DMEM High glucose (4.5 g/L) with L-Glutamine | PAA | E15-810 | |
| DNase (Deoxyribonuclease I from bovine pancreas Type II-S) stock 10 mg/mL in 0.15 M NaCl | Sigma-Aldrich | D4513 | Final concentration in digestion media 0.025 mg/mL |
| Fixable Viability Dye 506 (FVD506) | eBioscience | 65-0866 | Use at 1:200 in PBS |
| Foetal calf-serum (FCS) | GE Healthcare | A15-104 | 10% in RPMI |
| Hamilton syringe 700 series, 25 μL volume, 22s gauge needle bevel tip | Fisher Scientific | 10100332 | |
| Intracellular Fixation buffer and Intracellular Permeabilisation Buffer | eBioscience | 88-8824-00 | Dilute permeabilisation buffer to 1x in H2O |
| Penicillin/streptomycin | PAA | 15140122 | 100 units/mL Penicillin, 100 μg/mL Streptomycin |
| Protein transport inhibitor cocktail (500x) (brefeldin A and monesin) | eBioscience | 00-4980-03 | 1x Final concentration Brefeldin A 10.6 μM, monensin 2 μM |
| RPMI-1640 (containing 0.3 g/L Glutamine) | Sigma-Aldrich | R8758 | |
| Surgical Scalpel Blade No.10 | Swann-Morton | 0501 | |
| Trypsin-EDTA Solution 10x | Sigma-Aldrich | 594-18C | Trypsin (0.1%) EDTA (0.4%) final concentration |
| U-bottomed 96 microwell plate | VWR | 734-2080 | |
| Universal Cotton Tipped Applicators - 6 inch x 100 | Medisave | UN982 | |
| V-bottomed 96 microwell plate | VWR | 735-0184 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Conroy, T., et al. Current standards and new innovative approaches for treatment of pancreatic cancer. European Journal of Cancer. 57, 10-22 (2016).
- Lee, J. W., Komar, C. A., Bengsch, F., Graham, K., Beatty, G. L. Genetically engineered mouse models of pancreatic cancer: The KPC model (LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre), its variants, and their application in immuno-oncology drug discovery. Current Protocols in Pharmacology. 2016, (2016).
- Tseng, W. W., et al. Development of an Orthotopic Model of Invasive Pancreatic Cancer in an Immunocompetent Murine Host. Clinical Cancer Research. 16 (14), 3684-3695 (2010).
- Majumder, K., et al. A Novel Immunocompetent Mouse Model of Pancreatic Cancer with Robust Stroma: a Valuable Tool for Preclinical Evaluation of New Therapies. Journal of Gastrointestinal Surgery. 20 (1), 53-65 (2016).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Herreros-Villanueva, M., Hijona, E., Cosme, A., Bujanda, L. Mouse models of pancreatic cancer. World Journal of Gastroenterology. 18 (12), 1286-1294 (2012).
- Witkiewicz, A. K., et al. Integrated Patient-Derived Models Delineate Individualized Therapeutic Vulnerabilities of Pancreatic Cancer. Cell Reports. , (2016).
- Nicolle, R., et al. Pancreatic Adenocarcinoma Therapeutic Targets Revealed by Tumor-Stroma Cross-Talk Analyses in Patient-Derived Xenografts. Cell Reports. , (2017).
- Spear, S., et al. Discrepancies in the Tumor Microenvironment of Spontaneous and Orthotopic Murine Models of Pancreatic Cancer Uncover a New Immunostimulatory Phenotype for B Cells. Frontiers in Immunology. 10, 542(2019).
- Zhu, Y., et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models. Cancer Research. , (2014).
- Lee, J. J., Huang, J., England, C. G., McNally, L. R., Frieboes, H. B. Predictive Modeling of In vivo Response to Gemcitabine in Pancreatic Cancer. PLoS Computational Biology. , (2013).
- Clark, C. E., et al. Dynamics of the Immune Reaction to Pancreatic Cancer from Inception to Invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Fukunaga, A., et al. CD8+ tumor-infiltrating lymphocytes together with CD4+ tumor-infiltrating lymphocytes and dendritic cells improve the prognosis of patients with pancreatic adenocarcinoma. Pancreas. 28 (1), 26-31 (2004).
- Tewari, N., et al. The presence of tumor-associated lymphocytes confers a good prognosis in pancreatic ductal adenocarcinoma: an immunohistochemical study of tissue microarrays. BMC Cancer. 13 (1), 436(2013).
- Royal, R. E., et al. Phase 2 Trial of Single Agent Ipilimumab (Anti-CTLA-4) for Locally Advanced or Metastatic Pancreatic Adenocarcinoma. Journal of Immunotherapy. 33 (8), 828-833 (2010).
- Brahmer, J. R., et al. Safety and Activity of Anti–PD-L1 Antibody in Patients with Advanced Cancer. New England Journal of Medicine. 366 (26), 2455-2465 (2012).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Beatty, G. L., et al. CD40 Agonists Alter Tumor Stroma and Show Efficacy Against Pancreatic Carcinoma in Mice and Humans. Science. 331 (6024), 1612-1616 (2011).
- Lutz, E. R., et al. Immunotherapy converts nonimmunogenic pancreatic tumors into immunogenic foci of immune regulation. Cancer Immunology Research. 2 (7), 616-631 (2014).
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews. Immunology. 2 (6), 401-409 (2002).
- Mojic, M., Takeda, K., Hayakawa, Y. The dark side of IFN-γ: Its role in promoting cancer immunoevasion. International Journal of Molecular Sciences. , (2018).
- Castro, F., Cardoso, A. P., Gonçalves, R. M., Serre, K., Oliveira, M. J. Interferon-gamma at the crossroads of tumor immune surveillance or evasion. Frontiers in Immunology. , (2018).
- Thiery, J., et al. Perforin pores in the endosomal membrane trigger the release of endocytosed granzyme B into the cytosol of target cells. Nature Immunology. , (2011).
- Betts, M. R., et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. Journal of Immunological Methods. 281 (1-2), 65-78 (2003).
- Schuerwegh, A. J., De Clerck, L. S., Bridts, C. H., Stevens, W. J. Comparison of intracellular cytokine production with extracellular cytokine levels using two flow cytometric techniques. Cytometry. 55 (1), 52-58 (2003).
- Partecke, L. I., et al. A syngeneic orthotopic murine model of pancreatic adenocarcinoma in the C57/BL6 mouse using the panc02 and 6606PDA cell lines. European Surgical Research. , (2011).
- An, X., et al. Immunophenotyping of Orthotopic Homograft (Syngeneic) of Murine Primary KPC Pancreatic Ductal Adenocarcinoma by Flow Cytometry. Journal of Visualized Experiments. (140), (2018).
- Jiang, Y. J., et al. Establishment of an orthotopic pancreatic cancer mouse model: Cells suspended and injected in Matrigel. World Journal of Gastroenterology. , (2014).
- Autengruber, A., Gereke, M., Hansen, G., Hennig, C., Bruder, D. Impact of enzymatic tissue disintegration on the level of surface molecule expression and immune cell function. European Journal of Microbiology & Immunology. 2 (2), 112-120 (2012).
- Trapecar, M., et al. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies. AIDS Research and Human Retroviruses. , (2017).
- Liu, Q., et al. Effects of enzymatic digestion, cell culture and preservation conditions on surface CD62L expression of primary murine CD3+CD4+T cells. Biomedical Research (India). 29 (10), 2153-2159 (2018).
- Seaman, S. A., Tannan, S. C., Cao, Y., Peirce, S. M., Lin, K. Y. Differential effects of processing time and duration of collagenase digestion on human and murine fat grafts. Plastic and Reconstructive Surgery. , (2015).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. EMBO Journal. , (2013).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. , (2015).
- Misra, S., et al. Ex vivo organotypic culture system of precision-cut slices of human pancreatic ductal adenocarcinoma. Scientific Reports. , (2019).
- Moran, A. E., Polesso, F., Weinberg, A. D. Immunotherapy Expands and Maintains the Function of High-Affinity Tumor-Infiltrating CD8 T Cells In Situ. The Journal of Immunology. , (2016).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. , (2015).
- Singh, M., et al. High-throughput targeted long-read single cell sequencing reveals the clonal and transcriptional landscape of lymphocytes. Nature Communications. 10 (1), 3120(2019).
- Jiang, N., Schonnesen, A. A., Ma, K. Y. Opinion Ushering in Integrated T Cell Repertoire Profiling in Cancer. Trends in Cancer. 5, 85-94 (2019).
- Schietinger, A., et al. Tumor-Specific T Cell Dysfunction Is a Dynamic Antigen-Driven Differentiation Program Initiated Early during Tumorigenesis. Immunity. 45 (2), 389-401 (2016).
- Raghav, S. K., et al. Exhaustion of tumor-specific CD8+ T cells in metastases from melanoma patients. Journal of Clinical Investigation. , (2011).
- Gros, A., et al. PD-1 identifies the patient-specific in filtrating human tumors. The Journal of Clinical Investigation. , (2014).
- Miller, B. C., et al. Subsets of exhausted CD8 + T cells differentially mediate tumor control and respond to checkpoint blockade. Nature Immunology. , (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved