Method Article
פרוטוקול אלקטרופורציה אוניברסלי ויעיל להנדסה גנטית של אורגנואידים במערכת העיכול
In This Article
Summary
פרוטוקול זה מתאר שיטת אלקטרופורציה יעילה לסינון של ארבע ישויות שונות של מערכת העיכול באמצעות פלמידים גדולים יותר (בהיקף של 10 kB). זה יכול להתבצע בתוך יום אחד ולא צריך הכנה מקיפה או מיוחד, מאגרי אלקטרופורציה אינטנסיבית בעלות.
Abstract
אלקטרופורציה היא שיטה נפוצה עבור העברה עם סוגים שונים של מולקולות על ידי חדירות החשמל של קרום הפלזמה. עם השימוש הגוברת של אורגנואידים כשיטת culturing עבור חומר החולה העיקרי בשנים האחרונות, שיטות העברה יעילה של רכיבים עבור הנדסה גנטית במערכת התרבות התלת-ממדית הזאת הם זקוקים. במיוחד עבור אורגנואידים, היעילות של המניפולציות הגנטיות תלויה בזיהום מוצלח. לפיכך, פרוטוקול זה פותח כדי להקל על האלקטרופורנואידים של הארגון ולהוכיח את הפונקציונאליות האוניברסלית ביישויות שונות. המעי הגס האנושי, הלבלב, סרטן הכבד והקיבה אורגנואידים היו electroporated בהצלחה עם פלמידים קטנים וגדולים בהשוואה. בהתבסס על וקטורים קידוד GFP, היעילות של הזיהום נקבע על ידי FACS. אין צורך בהכנה מקיפה של תאים או מאגרי אלקטרופורציה מיוחדים בעלות אינטנסיבית, וניתן לבצע את הפרוטוקול תוך יום אחד.
Introduction
בשנים האחרונות, הרומן 3D מערכת תרבות התא, כינה אורגנואידים, פותחה עבור רקמות נורמלי וסרטני שונים. אורגנואידים הם מבחינה פונקציונלית ומורפולוגית קרוב מאוד רקמת המקור שלהם. הם יכולים להיווצר ממינים שונים, ניתן להרחבה בקלות, genomically יציבה מבחינה גנטית, מה שהופך אותם מערכת מודל אידיאלי עבור חקירות גנטיות1,2,3. טכניקות הנדסה גנטית כמו CRISPR (מקובצים באשכולות באופן סדיר בטווח הקצר הרחב החוצה)/Cas9 מערכת לאפשר מניפולציות מגוונות. הבחירה של שיבוטים ניתן להבין על ידי תנאי מדיה מוגדרים, למשל, על ידי wnt ליגנד משיכה עבור APC (אדנומטורומטוזיס polyposis Coli) שיבוטים הנוקאאוט4,5. לחילופין, סמני בחירה צריך להיות מוצג על ידי תיקון הומוולוגי בבימויו של וקטור המיקוד6,7. בשל העובדה שלעתים קרובות צריך להציג יותר מפלסמיד אחד, העברה יעילה הופכת לפרמטר מכריע. בנוסף, כדי להפחית את ההשפעות שאינן ספציפיות ליעד, ביטוי חולף של Cas9 endonuclease הואשמונהרצוי.
אלקטרופורציה היא שיטה פשוטה יחסית לתאי transfect עם דנ א, RNA, חלבונים או קרו אחרים. באמצעות פולסים חשמליים, קרום התא הופך חדיר יותר וגורם ספיגה מוגברת9. בפרוטוקול אלקטרופורציה שפורסם בעבר של המעי הגס ביעילות של 30% עם מחזיר פיגי gfp (חלבון פלורסנט ירוק) הבעת וקטור (7.4 kB) הגיע בהליך ארבעה ימים10. הפרוטוקול הבא פותחה כדי להקל על התפתחות יעילה של סרטן או אורגנואידים בריאים עם קידוד גדול פלמידים עבור מדריך יחיד RNA (sgRNA) ו Cas9 endonuclease רצף (למשל px458 כמו וקטור עם 9.3 kb). תהליך האלקטרופורציה כולו ניתן לבצע בתוך יום אחד, ללא מאגרי אלקטרופורציה מיוחדים, עם יעילות דומה לפחות בין אורגנואידים שונים של מערכת העיכול, כלומר אדנוקרצינומה הלבלב דוטל (PDAC), סרטן המעי הגס (CRC), האקאנגיוקרצינומה (CCC) ו סרטן קיבה (GC) אורגנואידים.
Protocol
אישור האתיקה התקבל מהוועדה האתית של ה-TU Dresden (#EK451122014).
1. תרבות והכנות אורגאידית לפני אלקטרופורציה
- להקים אורגנואידים על ידי עיכול רקמות כפי שמתואר בעבר ולהרחיב אותם עם הישות המקבילה שלהם התרבות הספציפית בינונית בתוך מטריצה מרתף (מבט כולל לראות את לוח 1 ואת לוח החומרים)11,12,13,14,15,16,17.
הערה: עבור דגימות הרקמה האנושית הסכמה ואישור של המחקר על ידי ועדה אתית היא הכרחית. - לחמם 48-מיכשור טוב ב-37 ° c עבור זריעה פוסט-אלקטרופורציה.
- הכינו בסיס אנטיביוטי בינוני w/o כמו גם ישות מסוימת התרבות אורגנואיד בינונית w/o אנטיביוטיקה (לראות את הטבלה 1) כולל 10 Μm Y-27632 ו 3 ΜM CHIR99021.
הערה: הנסיגה של אנטיביוטיקה חשוב כדי להפחית את ההשפעות הרעילות. Y-27632 ו CHIR99021 שפר שחזור התא10. -
הכנת האורגנואידים (ראה איור 1)
- לטפח 5 בארות של אורגנואידים ב 48-באר לדגימת אלקטרופורציה במדיום התרבותי.
הערה: ניתן להשתמש באורגנואידים מתרבים (כ 2-3 ימים לאחר הפיצול האחרון). - הכינו 230 μL של מגיב הדיסוציאציה (ראה טבלת חומרים) כולל 10 Μm Y-27632 לכל טוב.
- הסר את בינונית התרבות מכל טוב ולנתק את האורגנואידים מכנית ב 230 μL של תערובת הדיסוציאציה המוכנה. מאגר 5 בארות לדגם אלקטרופורציה לתוך שפופרת 1 15 mL.
- מערבבים על ידי vortexing ו-דגירה עבור 5-15 דקות ב 37 ° צ' עד אשכולות של 10-15 תאים מתרחשים. לכן, בדוק את מיקרוסקויית הדיסוציאציה. הפסיקו את העיכול על ידי הוספת אנטיביוטיקה בינונית w/o הבסיס עד 10 מ"ל.
הערה: שלב זה הוא קריטי מאוד! יעילות האלקטרופורציה תהיה מצומצמת, כאשר הדגירה קצרה מדי, אך העיכול הארוך יפחית את ההישרדות. - צנטריפוגה ב 450 x g עבור 5 דקות בטמפרטורת החדר, להיפטר supernatant ולשטוף פעמיים עם 4 מ ל של מאגר אלקטרופורציה (ראה טבלת חומרים).
- לטפח 5 בארות של אורגנואידים ב 48-באר לדגימת אלקטרופורציה במדיום התרבותי.
2. אלקטרופורציה
הערה: הפרוטוקול הבא מפותח עבור אלקטרופורטורים המסוגלים לגלי מרובע ומופרדים ברצף הדופק והעברת רצפים (ראה איור 2). באופן אופציונלי, ערכי עכבה, כמו גם את המתח, זרמים ואנרגיות המועברות למדגם ניתן למדוד כשליטה לניסויים הניתנים לאנרגיה.
- השהה מחדש את הגלולה האורגאידית ב-100 μL של מאגר אלקטרופורציה (ראה טבלת חומרים) המכילה 30 μg של דנ א פלמיד.
הערה: הריכוז של ה-DNA המשמש באמצע השימוש צריך לחרוג מ-5 μg/μL לצורך ריכוז המלח האופטימלי במהלך תהליך האלקטרופורציה. לכן, מומלץ ביותר להכין ערכות מקסי-פלמיד (ראה טבלת חומרים) להכנת וקטורים. סכום כולל של עד 45 μg של DNA ניתן להשתמש ללא אפקטים ציטוטוקסיים. - לוותר על התערובת DNA-אורגאיד מלאה לתוך קובט אלקטרופורציה עם רוחב הפער 2 מ"מ מבלי לייצר בועות אוויר.
- הגדר את הפרמטרים של האלקטרופורציה בהתאם ל-Fujii ואח '10 (ראה טבלה 2, איור 2).
- ערבב את התאים מעט ללא קצף על ידי הקשה על קובט עם אצבע. . הניחו את הקובט לחדר הקובט
- לחץ על כפתור Ω של electroporator ולרשום את ערך העכבה.
הערה: עכבה בין 30-40 Ω הראה את התוצאות הטובות ביותר. באופן כללי, זה צריך להיות בטווח בין 30-55 Ω. אם זה לא המקרה, בבקשה לשלוט בהיבטים הבאים: רוחב הפער של הקובט בשימוש, חיבורי כבל של electroporator, בועות אוויר אפשרי, נפח נכון וריכוז מלח של תערובת אלקטרופורציה. - לחץ על לחצן התחל כדי לבצע את תוכנית האלקטרופורציה ולשלוט על ערכי הזרמים, המתח והאנרגיות המוצגות.
הערה: ערכי המתח, הזרמים והאנרגיות הנמדדים אמורים להתאים לפרמטרים של הגדרת האלקטרופורציה. כדי להשוות ניסויים חוזרים, זה יכול להיות מועיל לשים לב לנתונים אלה. - לאחר electroporation, מיד להוסיף 500 μL של תרבות בינונית w/o אנטיביוטיקה (עם CHIR99021 ו-Y-27632; ראה שלב 1.3). מערבבים על ידי ליטוף למעלה ולמטה כדי לנתק את קצף לבן.
הערה: הקצף הלבן מופיע לאחר תהליך האלקטרופורציה ומצורף אליו מספר משמעותי של תאים. אז, הדיסוציאציה של זה חשוב מאוד לא לאבד תאים. - העבירו את המדגם לגמרי מקובט לתוך צינור חדש של 15 מ ל באמצעות הפיפטה השייך לחומר האלקטרו כימיקלים (ראה לוח חומרים). שטיפה קובט שוב עם בינוני בסיס מומלץ לקבל את התאים הנותרים.
- להתחדשות התאים, הדגירה אותם עבור 40 דקות בטמפרטורת החדר.
3. זריעת תאים
- צנטריפוגה את התאים ב 450 x g עבור 5 דקות בטמפרטורת החדר ולהיפטר supernatant.
- השהה מחדש את הגלולה ב-100 μL של מטריצת מרתף וזרעים 20 μL טיפות בצלחת מראש 48-באר (ראה שלב 1.2). דגירה עבור 10 דקות ב 37 ° c עבור פולימור ולהוסיף 250 μL של התרבות הבינונית, אשר יושלם עם Y-27632 ו CHIR99021 עד הפיצול הבא של האורגנואידים הגדולים (סביב 5-7 ימים).
4. קביעת היעילות הטרנספיציה
הערה: באופן כללי, מומלץ להוסיף וקטור הנושא את סמן הקרינה הפלואורסצנטית כבקרת העברה נוספת. תלוי הסמן הנבחר ואת ההבשלה כרומטופור שלה הזריחה יהיה גלוי בתוך סביב 24-48 h הצבה הפוסט18.
- בדוק את המיקרו-פלואורסצנטית לאחר 24-48 h בבקרת ההעברה (ראה איור 4ב).
-
סריקת תא פלורסנט מופעלת (FACS)
- לקצור את התאים בצורה אנלוגית לשלב 1.4.2-1.4.4 ולעכל סביב 10-20 דקות עד שיש תאים בודדים. הוסיפו עד 10 מ ל של תמיסת מלח מוזרמת פוספט (PBS).
- צנטריפוגה ב 450 x g עבור 5 דקות בטמפרטורת החדר ולהיפטר supernatant.
- באופן אופציונלי לאפליה של תאים חיים: השהה מחדש את הגלולה ב-1 מ ל של תמיסת מלח באגירה (PBS) והוסף נוגדן מתאים (ראה טבלת חומרים) או propidium יודיד (PI). מערבבים בזהירות רבה רק על ידי הקשה על מודטה עבור 30 דקות בטמפרטורת החדר בחושך. לשטוף עם 10 מ ל של PBS, צנטריפוגה ולהיפטר supernatant.
- להשעות מחדש את הגלולה התא ב-200 μl של PBS ולסנן באופן אופציונלי את ההשעיה דרך מסננת תא 100 יקרומטר לתוך צינור facs.
- לנתח את התאים על ידי מכונת FACS באמצעות אסטרטגיה מתאימה של הארגון (ראה איור 3; איור 4א) וקבע את היעילות של הזיהום.
תוצאות
אורגנואידים של ארבע ישויות שונות של סרטן (CRC, CCC, PDAC, GC) היו אלקטרופורבטים לפחות 3 פעמים באמצעות 30 μg של פלבאמצע קטן (pCMV-EGFP, 4.2 kb) או פלבאמצע גדול (px458, 9.3 kb). שני וקטורים לשאת קלטת GFP המאפשר את ההגדרה של יעילות ה48 h לאחר אלקטרופורציה על ידי הזרמת cy, לנסות. כדי לנתח רק תאים חיים, כתמים עם נוגדן מוות חיים לפני הסריקה בוצעה. אסטרטגיית הסיכום מוצגת באיור 3.
בכל ארבעת הגופים האורגאידים 4.2 kB בגודל בינוני היה מנוכר עם יעילות גבוהה יותר לעומת אחד גדול יותר (ראה איור 4). הזיהום היעיל ביותר של הפלסטיות הקטן הגיע באורגנואידים PDAC עם 92.1 ± 5.2% GFP התאים החיוביים, בעוד הפלבאמצע הגדול היה מנוכר עם יעילות של 46.7 ± 3.7% (מתכוון ± סטיית התקן, n = 3). לעומת אורגנואידים סרטן הלבלב, הפלביניים גדול יותר היה מנוכר יותר ביעילות ב-CRC אורגנואידים עם יעילות משמעותית של 53.4 ± 11.7%, בעוד הפלביניים הקטן היה מנוכר עם יעילות מרושעת של 84.3 ± 5.8%. הישות הקשה ביותר כדי transfect היו סרטן הקיבה אורגנואידים: עבור הגדול ביותר פלבאמצע, היעילות הקטנה ביותר החצייה הושגה בישות זו (32.3 ± 12.7% ו 74.1 ± 5.5%, בהתאמה). ה-CCC אורגנואידים הראה יעילות מעבר ממוצע של 83.0 ± 13.1% עבור פלבאמצע הקטן ועבור פלבאמצע 39.5 ± 10.4% הושגו.
כהוכחה למושג, הגוף האנושי אורגנואידים הקיבה היו electroporated עם קידוד px458_Conc2 פלמיד עבור Cas9, GFP ושני sgRNAs מיקוד TP53. שבירת הגדיל הכפול הCas9 על אקסון 8 תוקנו על ידי הצטרפות לא-הומוולוגי (nhej), וכתוצאה מכך הframeshifts וכתוצאה מכך נוקאאוט של הגן (ראו איור משלים 1).
טבלה 1: הרכב של מדיה בסיס, תערובות עיכול ומדיה טיפוח. אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).

שולחן 2: הגדרות אלקטרופורציה לפי Fujii ואח '10.
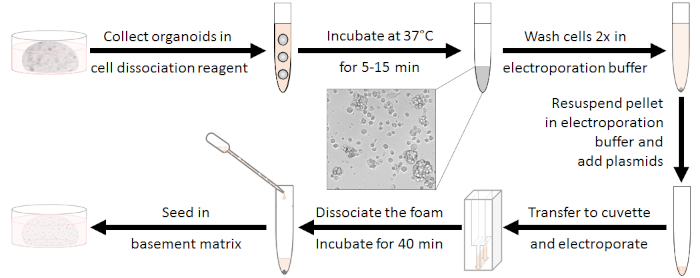
איור 1: תהליך הכנת האלקטרופורציה. ראשון, אורגנואידים צריך להיות מנתק אשכולות של 10-15 תאים ואנטיביוטיקה צריך לקבל שטף החוצה. לאחר האלקטרופורציה צריך לנתק את הקצף הלבן. תאים ניתן לזריעה לאחר התחדשות עבור 40 דקות בטמפרטורת החדר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
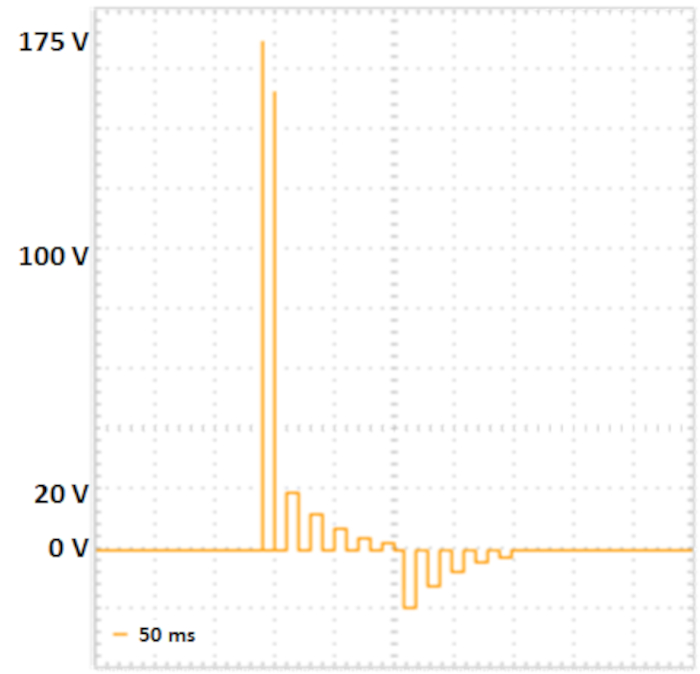
איור 2: אלקטרופורציה של שני צעדים. שני פולסים צפיה עם מתח גבוה יותר וזמן קצר (175 v ו 157.5 v, כל אחד עבור 5 אלפיות השנייה, הפסקה עבור 50 ms, ריקבון מתח 10%) להוביל היווצרות נקבוביות בקרום התא. הפולסים הבאים מספקים את ה-DNA לתוך התאים: חמישה פולסים העברה חיובית (עם 20 V, 12 V, 7.2 V, 4.32 V ו 2,592 V, כל אחד עבור 50 ms, הפסקה עבור 50 ms, ומתח המתח 40%), ואחריו חמש משני קוטביות החלפת פולסים העברה (עם 20 V, 12 V, 7.2 V, 4.32 V ו-2,592 V, כל אחד עבור 50 ms, הפסקה עבור אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
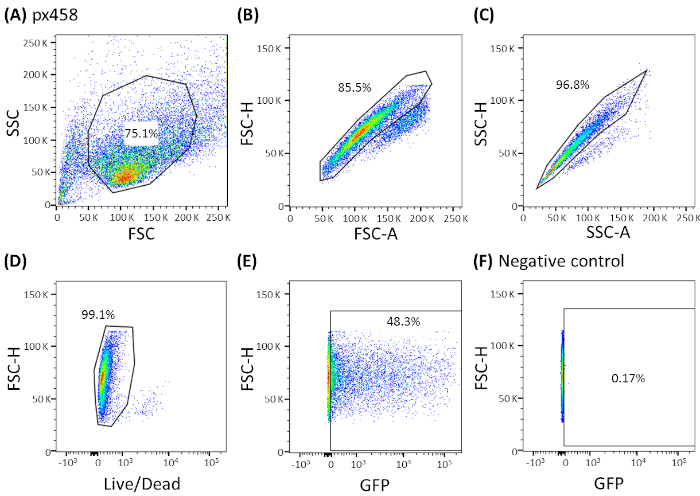
איור 3: הנציגה באסטרטגיה המוצגת על ידי הארגון של CCC. כל מארגני האלקטרופוראידים נותחו על-ידי הזרמת ה48 h לאחר אלקטרופורציה. תאי החשמל מבלי להשתמש ב-DNA כפקדים שליליים. השערים הוגדרו כדלקמן: (א) לעבור לצורת תא,(ב,ג) המשך עבור תאים בודדים (הפליהבלתי מוגדרת), (ד) לעבור תאים חיים (מוכתם בנוגדן לתאים אפוטוטיים) ו (E,F) בסופו של דבר עבור egfp ביטוי תאים (ערוץ fitc). FSC = פיזור העברה; מהאס. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
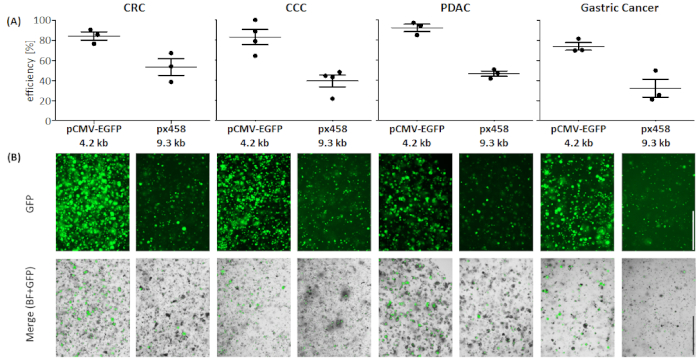
איור 4: יעילות האלקטרופורציה של ארבעה ישויות אורגנואיד. (א) facs ניתוח (n = 34, ממוצע סטיית התקן וכל ערך בודד מוצגים) ו (ב) השוואה חזותית על ידי מיקרוסקופ פלואורסצנטית. סרגל קנה מידה = 1,000 μm. BF = שדה בהיר; CCC = המרה קרצינומה; CRC = סרטן המעי הגס; GC = סרטן קיבה; PDAC = הלבלב אדנוקרצינומה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
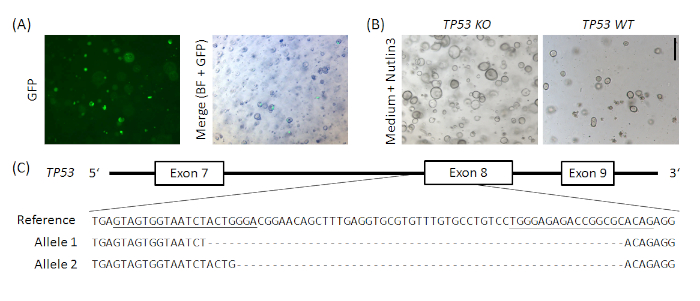
איור משלים 1: למופת CRISPR/Cas9 מבוסס הנוקאאוט של TP53 ב אורגנואידים בבטן האדם הרגיל. וקטור px458_Conc2 (ראה את הטבלה של חומרים) שוכפל על ידי שילוב 2 grna concatemer וקטור, מתנה נדיבה מ Bon-Kyoung קו19, עם px45820, וכתוצאה מכך קידוד פלמיד עבור 2 sgrnas, Cas9 ו-gfp. שני sgRNAs מיקוד TP53 הוצגו בpx458_Conc2 וקטור על ידי שיבוט שער הזהב (באופן מכוון לאנדרסון-רולף ואח '19). 10 μg של דנ א פלמיד היו אלקטרופורבטים בתוך האדם אורגנואידיםהקיבה האנושית (א). שיבוטים נבחרו על ידי Nutlin3 המינהל (ב) ואת הנוקאאוט הTP53 אושרה על ידי שיבוט topo TA ו רצף של האללים, כאן למופת המוצג עבור שיבוט אחד (C). SgRNAs מסומנים בקו תחתון בהפניה. סרגל קנה מידה = 200 μm. BF = שדה בהיר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מעניק הוראות מפורטות לביצוע אלקטרופורציה יעילה, מהירה וקלה של ישויות שונות של אורגנואיד. נוסף לאורגנואידים הגידול המוצגים מ PDAC, CRC, CCC ו-GC, זה עובד בהצלחה עבור אורגנואידים נגזר מרקמות בריאות כמו גם. ניתן לבצע את הפרוטוקול בתוך יום אחד. בפרוטוקולים שפורסמו מחדש הנוהל כולו נמשך ארבעה ימים, כולל יומיים של הכנות עם סוגים שונים של טיפוח-תרגול10,21. בפרוטוקול שלנו אין צורך בטיפול מיוחד. על ידי שטיפת מאגר אלקטרופורציה לפני אלקטרופורציה הרכיבים האנטיביוטיים של המדיה נשטפו החוצה והתאמה של ריכוזי מלוחים עבור ערכי עכבה אופטימלית הושגה. עם זאת, יש לשקול מספר היבטים קריטיים עבור אלקטרופורציה מוצלחת:
תאים
בפרוטוקול אלקטרופורציה על ידי fujii ואח '10 מומלץ לנתק אורגנואידים לתאים בודדים כדי לסנן אותם באמצעות מסננת תא 20 יקרומטר. בידינו העיכול לתאים בודדים מקטין בחוזקה את שרידות התאים. כפי שהוצע ב Merenda et al.21, אנחנו גם הנתק אורגנואידים לאשכולות של 10-15 תאים ולא היתה אפשרות לקבוע יעילות מופחת לעומת דיסוציאציה תא בודד. לאחר electroporation, זה צעד חשוב מאוד כדי לנתק את קצף לבן, כך לא תאים מחוברים מתחילים לאיבוד.
עבור תרבות התא 2D, זה הוכח כי זמן התחדשות לאחר אלקטרופורציה של יותר מ 10 דקות עד 40 דקות מגביר את יעילות ההישרדות והיכולת לשנות במיוחד פלמידים גדולים22. בניסויים בניסוי, אותו יכול להיות מתועד עבור אורגנואידים, המוביל צעד דגירה של 40 דקות לאחר האלקטרופורציה בפרוטוקול זה. כדי להגביר את ההחלמה מהאלקטרופורציה, אנו מתורבתים אותם בעזרת החלבון המקושר Rho (ROCK) מעכב Y-27632 במשך חמישה עד שבעה ימים23. באופן דומה, תוספת נוספת של הגליקוגן סינתז ' ה 3 (GSK3) מעכב CHIR99021 נועד לעזור לתאים בודדים כדי לשחזר10.
גדרות
אחד היתרונות של electroporator משומשים הוא כי העכבה ניתן למדוד לפני אלקטרופורציה לתנאים אופטימליים. על פי היצרן, ערכי העכבה צריך להיות 30-55 Ω. בידינו, ערכי העכבה של 30-40 Ω הראו יעילות אופטימלית. בניסוי מקדמי, מתח שונה וערכי אורך הדופק של הדופק צפיה היו שונים כדי למצוא את החלק האופטימלי של יעילות להישרדות. לסיכום, אנו יכולים לאשר את הערכים המתוארים של Fujii ואח '10 ביישויות שונות המתוארות כאן.
DNA
ההשפעה של כמויות DNA שונות נבדק בניסויים ראשוניים עד 45 μg של DNA לכל מדגם. לא ניתן לזהות אפקטים ציטוטוקסיים. יעילות החצייה הוגדלה בצורה תלוית מינון עם רוויה > 30 μg. אז, השתמשנו 30 μg לכל מדגם בפרוטוקול הסופי, אבל כמובן שזה יכול להיות מוגבר (למשל, עבור האלקטרופורציה של יותר פלמידים במקביל). בנוסף, הטוהר והריכוז של הדנ א נראה מאוד חשוב. ריכוז העולה על 5 μg/μL הראה יעילות מרבית של הזיהום האופטימלי.
כצפוי, הפלמיד 9.3 kB יכול להיות מנוכר עם יעילות נמוכה יותר מאשר הקטן 4.2 kB פלמיד (ראה איור 4). השימוש בפלמידים הגדול אפילו יותר מ-10 kB צפוי להקטין עוד יותר את היעילות. עבור יישומים עתידיים, זה יכול להיות מעניין כדי לבדוק את ה-DNA של מיני מונית כמו וקטור, מאז אלה נושאות גנים חסר עמוד השדרה חיידקי של פלבאמצע שהופך אותם קטנים24. הדבר יגרום ליעילות מוגברת של הזיהום. יתר על כן, עבור CRISPR מבוססי מניפולציות של אורגנואידים אלקטרופורציה ישירה של sgRNAs כרוך Cas9 כמו ribonucleoprotein (RNP) מתחם יכול להיות חלופה או תוספת25.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנחנו מודים לג פוחגרוב, אן-כריסטוף. ומקס היידוק לסיוע טכני מעולה המימון סופק על ידי דויטשה קרבשילוב (No 111350 ו 70112925), סנדר Stiftung (No 2014.104.1), הקטור Stiftung (No M 65.2) והאיחוד האירופי (ERC No 639050).
Materials
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 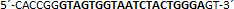 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 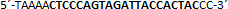 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 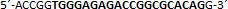 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 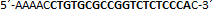 |
References
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved