A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות תפקוד דו-חדרי ומורפולוגיה על ידי הדמיית תהודה מגנטית לבבית בעכברים עם רצועות עורק ריאה
* These authors contributed equally
In This Article
Summary
כדי להבין את הפתופיזיולוגיה של הסתגלות החדר הימני (RV) לעומס חריג, מודלים ניסיוניים הם קריטיים. עם זאת, הערכת ממדי ותפקוד הקרוואנים היא מורכבת ומאתגרת. פרוטוקול זה מספק שיטה לביצוע הדמיית תהודה מגנטית לבבית (CMR) כהליך אמת מידה לא פולשני בעכברים הנתונים לעומס לחץ קרוואנים.
Abstract
תפקוד וכשל של החדר הימני (RV) הם הגורמים העיקריים הקובעים את התוצאה במחלות לב נרכשות ומולדות, כולל יתר לחץ דם ריאתי. הערכת תפקוד ומורפולוגיה של RV היא מורכבת, בין היתר בשל הצורה המורכבת של ה-RV. נכון לעכשיו, הדמיית תהודה מגנטית לבבית (CMR) היא תקן הזהב להערכה לא פולשנית של תפקוד ומורפולוגיה של RV. הפרוטוקול הנוכחי מתאר הדמיית CMR במודל עכבר של עומס לחץ RV המושרה על ידי פס עורק ריאתי (PAB). PAB מבוצע על ידי הנחת תפר 6-0 סביב עורק הריאה מעל מחט 23 גרם. שיפוע ה-PAB נקבע באמצעות אקו לב בשבועיים ו-6 שבועות. לאחר 6 שבועות, המורפולוגיה והתפקוד של החדר הימני והשמאלי מוערכים על ידי מדידת נפחים ומסה של הקצה הסיסטולי והקצה הדיאסטולי על ידי עשר עד אחת עשרה פרוסות סינוס בעובי 1 מ"מ באמצעות סורק הדמיית תהודה מגנטית 9.4 T המצויד בשיפוע של 1,500 mT/m. תוצאות מייצגות מראות כי PAB גורם לעלייה משמעותית בעומס לחץ הקרוואנים, עם השפעות משמעותיות על המורפולוגיה הדו-חדרית ותפקוד הקרוואנים. כמו כן, הוכח כי ב-6 שבועות של עומס לחץ קרוואנים, תפוקת הלב נשמרת. מוצג כאן פרוטוקול הניתן לשחזור לכימות המורפולוגיה והתפקוד הדו-חדרי במודל עכבר של עומס לחץ קרוואנים ועשוי לשמש כשיטה לניסויים החוקרים את הגורמים הקובעים שיפוץ ותפקוד לקוי של קרוואנים.
Introduction
חולים עם מחלות לב וכלי דם נרכשות ומולדות, כולל יתר לחץ דם ריאתי (PH), נמצאים בסיכון לתפקוד לקוי של החדר הימני (RV)ואי ספיקת 1. הסתגלות RV כתוצאה מעומס לחץ מוגבר מאופיינת בהיפרטרופיה קונצנטרית בשלבים מוקדמים והתרחבות מתקדמת במחלה בשלב הסופי. יתר על כן, זה קשור להפרעות בחילוף החומרים ובמטריצה החוץ-תאית, תהליכי דלקת ובסופו של דבר, כשל RV 2,3,4,5,6. מודלים של בעלי חיים פותחו כדי לחקור את התהליכים הבסיסיים של ההתקדמות לקראת כישלון קרוואנים. עם זאת, אופטימיזציה של מודלים והערכה נאותה של תפקוד וממדי RV היו מאתגרים. להערכה לא פולשנית של תפקוד וממדי הקרוואנים, הדמיית תהודה מגנטית לבבית (CMR) היא תקן הזהב. טכניקה זו יוצרת תמונות של הלב הפועם באמצעות שדה מגנטי חזק וגלי תדר רדיו. CMR זמין לבני אדם, ולבעלי חיים כמו מכרסמי מעבדה. מכיוון שהאחרונים דורשים רזולוציה מרחבית גבוהה יותר בשל גודלו הקטן יותר של הלב, השדה המגנטי הנדרש כדי לספק תמונות נאותות חייב להיות גבוה יותר, בהשוואה לבני אדם.
קיימים מספר דגמים המחקים עומס יתר בלחץ קרוואנים, כולל דגמים של PH 7,8,9,10,11,12,13,14,15,16,17 ודגמים של עומס לחץ RV פרוקסימלי 2,3,10,18, 19,20,21,22,23. הבחירה במודל של PH או במודל של עומס לחץ RV פרוקסימלי תלויה בשאלת המחקר: השפעת ההתערבות על כלי הדם הריאתיים ולכן אולי אפנון עומס לאחר RV (כלומר, מודלים של PH), או ההשפעה הישירה על ה-RV (כלומר, מודלים של עומס לחץ RV פרוקסימלי). קיימות מספר שיטות לאינדוקציה ניסיונית של PH, כולל שימוש במונוקרוטלין (MCT)12,13,14,16,22,24,25,26, MCT בשילוב עם שאנט אבי העורקים 9, היפוקסיה כרונית 7,27,28,29והשילוב של אנטגוניסט לקולטן גורם גדילה אנדותל כלי דם, Sugen 5416, עם היפוקסיה כרונית 8,10,30,31., מודלים כאלה מייצגים מודלים ריאתיים מתקדמים של עומס לחץ RV פרוקסימלי ואינם מכוונים לכלי הדם הריאתיים אלא גורמים לעומס לוואי קבוע על ידי התכווצות עורק הריאה, עם עלייה נלווית של עומס לאחר RV 2,3. זה יכול להתבצע על ידי רצועות תפר (רצועת עורק ריאה, PAB) או קליפ כלי דם סביב עורק הריאה. PAB בוצע במספר מינים של בעלי חיים, וממדי הלב ותפקודם נחקרו בדרכים שונות, כגון היסטולוגיה, אקו לב דרך בית החזה (כולל מעקב אחר כתמים), וצנתור לב 2,32,33,34,35,36,37,38,39,40 . PAB במכרסמים קטנים, כמו עכברים, הוא מאתגר. הסיבה לכך היא שהבדלים עדינים בין אטימות התכווצות העורקים סימנו תוצאות על מידת עומס לחץ הקרוואנים והמצב התפקודי וההישרדות שלאחר מכן. כאשר ההיצרות הדוקה מאוד, החיה תמות במהלך הניתוח או זמן קצר אחריו, בעוד שהפנוטיפ הרצוי לא יושג כאשר ההיצרות אינה הדוקה מספיק. עם זאת, לשימוש בעכברים יש יתרונות בהשוואה לבעלי חיים אחרים, בגלל אפשרויות השינוי הגנטי המצוינות (כלומר, מודלים טרנסגניים או נוק-אאוט) והרבייה המהירה. יש לכך ערך מוסף בחקר מחלות ובבחינת תרומתם של גורמים מולקולריים וגנטיים.
עיצובי מחקר בבעלי חיים עוברים לחקר שינויים זמניים במהלך מחלה 2,3,8,13,21. עבור מחקרים כאלה, יש צורך בשיטות לא פולשניות, מכיוון שניתן לבצע הערכות סדרתיות. חלופות ל-CMR בהערכת שיפוץ הלב יכולות להיות (1) אפיון רקמות באמצעות היסטופתולוגיה, כאשר בעלי חיים מרובים מוקרבים בנקודות זמן שונות, (2) הערכה תפקודית פולשנית על ידי ניתוח לחץ-נפח, או (3) אקו לב, המאפשר לחוקר לזהות היפרטרופיה או התרחבות לב באופן לא פולשני בתוך אותה חיה באופן סדרתי. ל-CMR יש שני יתרונות עיקריים בהערכת הקרוואן: (1) CMR היא שיטה לא פולשנית, המאפשרת מדידות סדרתיות בבעל חיים אחד, ובכך תורמת להפחתת מספר בעלי החיים הדרושים למחקרים, ו-(2) CMR אינו מסתמך על צורה גיאומטרית מסוימת ומדמה תלת מימדית. נפחי קרוואנים ומדידות תפקוד שמקורם ב-CMR הוכחו כמדויקים ונחשבים לתקן הזהב הלא פולשני בישויות לב שונות בבני אדם 42,43,44,45, אך עדיין לא תורגמו לפרוטוקול CMR עבור עכברים עם עומס יתר של לחץ קרוואנים.
מודלים רבים של PAB מתוארים בספרות, אך עם הטרוגניות גבוהה בשיטות להערכת השפעות המודינמיות ותפקוד והסתגלות של RV. פרוטוקול זה מתאר את הליך ה-PAB בעכברים עם אימות המודל על ידי מדידת שיפוע PAB על ידי אקו לב והערכת ממדי הלב ותפקודם באמצעות CMR. בעוד שפרוטוקול של CMR בבעלי חיים שנחשפו ל-PAB פורסם עבור חולדות, שילוב זה לא תואר עבור עכברים עד כה. בעוד שחולדות משמשות לרוב עבור דגמי PH 8,12,13,14,15,16,22,24,25,26,27,28,29,30,31,46 עכברים משמשים לרוב למחקרים טרנסגניים או נוק-אאוט ובכך תורמים להבנתנו את המנגנונים בכשל קרוואנים טעוני לחץ., פרוטוקול זה יכול להוות בסיס למחקרים עתידיים לחשיפת מסלולי איתות המעורבים במעבר לקראת כשל קרוואנים.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הניסויים והטיפול בבעלי חיים מבוצעים על פי חוק הניסויים בבעלי חיים ההולנדי ותואמים את המדריך לטיפול ושימוש בחיות מעבדה שפורסם על ידי המכונים הלאומיים לבריאות בארה"ב. ועדת הניסויים בבעלי חיים של אוניברסיטת חרונינגן, הולנד, אישרה את פרוטוקול הניסוי הנוכחי (מספר היתר: 2014-041/3005).
1. דיור והתאקלמות
- השתמש ב-20-30 גרם עכברים פראיים מסוג C57 שחור 6 (C57BL/6) (קו רבייה מוסדי שתואר קודם לכן47), זכר ונקבה, כולם בני יותר מ-8 שבועות. שכן את העכברים בקבוצות עם מקסימום חמישה בכל כלוב. על מנת להתרגל לטיפול אנושי, תנו לעכברים להתאקלם לפחות 7 ימים. אל תבצע הליכים כלשהם במהלך תקופה זו.
2. ניתוח חבישת עורק הריאה
- הכנה
- הנח את העכבר בתא האינדוקציה המלא ב-5% איזופלורן/100% חמצן. בדוק את היעדר הרפלקסים על ידי מתן גירוי כאב (כלומר, צביטה בבוהן).
- לגלח את ההמיטורקס השמאלי של העכבר באמצעות מכונת גילוח חשמלית.
- משוך בעדינות את הלשון והחזק במתח קל.
- האירו את הגרון הפנימי על ידי הנחת מקור אור על הגרון החיצוני בגובה הגלוטיס.
- החדרו את העכבר לאנדוטרכיה עם צינורית גמישה של 20 גרם.
- הניחו את החיה על צדה הימני על מחצלת חום (קבעו טמפרטורה על 37 מעלות צלזיוס).
- חבר את הצינורית למיני-הנשמה והתחל אוורור עם 1.5%-2.5% איזופלורן/חמצן (180 נשימות לדקה, גאות ושפל 250 מיקרוליטר).
- יש להזריק 0.1 מ"ג/ק"ג בופרנורפין תת עורי לשיכוך כאבים לאחר הניתוח.
- יש למנוע התייבשות של העין באמצעות משחת עיניים.
- ניתוח רצועות עורק ריאה על ידי כריתת בית החזה השמאלי
- הנח את העכבר על צדו הימני על ידי הנחת הרגל הקדמית הימנית במצב ניטרלי, הרגל האחורית הימנית מורחבת והרגל הקדמית השמאלית כפופה לאחור.
- לחטא את העור בבית החזה עם כלוריד-הקסידין, ספוגית פי 2.
- השתמש במכשירים סטריליים לניתוח. פתח את העור במספריים קטנים (ידית עגולה, להבים 12 מ"מ) מבית השחי השמאלי במקביל לצלע השנייה והשלישית.
- זהה את m. pectoralis superficialis (שריר אלכסוני, שטחי) ואת m. pectoralis profundus (שריר אלכסוני, בסיסי).
- בעזרת לולאות תפרים, משוך את ה-m. pectoralis superficialis לכיוון הצד הגחוני ואת ה-m. pectoralis profundus לכיוון הצד הגבי של העכבר.
- פתח את החלל הבין-צלעי השני ופזר את הצלעות באמצעות מהדקי נייר מותאמים, מה שמאפשר ללב האוזן השמאלית, לריאה השמאלית ולעורק הריאה להיות גלויים.
- הפרד את העורק הפולמונליס מאבי העורקים. הניחו לולאת תפר סביב עורק הריאה בעזרת מחט קהה של 25 גרם המכילה תפר 6-0 והניחו קשירה אבודה של 2-1-1 סביב העורק הריאתי.
- הנח מחט 23 G במקביל לעורק הריאות בתוך התפר 6-0 ותקן תחילה את קשר התפר הפרוקסימלי ביותר ולאחר מכן את הקשר הדיסטלי של התפר 2-1-1. הסר את מחט 23 גרם. ודא שהקשר מתאים.
- סגור את בית החזה עם שניים או שלושה תפרים נפרדים עם תפר מונופילמנט מפוליפרופילן 5-0. שחרר את m. pectoralis superficalis ו- m. pectoralis profundus.
- לתפור את העור בתפר חומצה פוליגליקולית טהורה 5-0. השתמש בטכניקת תפר רציפה כדי למזער היווצרות צלקת ברקמה; רקמת צלקת תשפיע על איכות התמונה של האקו-לב.
- כבה את האיזופלורן תוך המשך אוורור עם חמצן במהלך ההתאוששות מההרדמה עד שהעכבר יחזור לנשימה ספונטנית משלו כפי שניתן לראות מתנועת הבטן.
- נתק את הצינור האנדוטרכיאלי ממכונת ההנשמה. בדוק אם יש נשימה ספונטנית, הוצא רק כאשר נראית פעולת נשימה ספונטנית. כאשר לא נראית נשימה ספונטנית, חבר שוב את הצינור למכונת ההנשמה וחזור לשלב 2.2.12.
- התבונן בעכבר עד שהוא חוזר להכרה.
- ניתוח דמה
- בצע את ההליך לעיל למעט הרצועה (שלבים 2.2.2–2.2.6).
- תקופה שלאחר הניתוח
- שכן את העכבר בנפרד בחממה (37 מעלות צלזיוס) למשך 24 שעות.
- התבונן בעכבר מדי יום במהלך 3 הימים הראשונים לאחר הניתוח. במקרה של סימני אי נוחות, יש להזריק 0.1 מ"ג/ק"ג בופרנורפין תת עורי פעמיים ביום לשיכוך כאבים לאחר הניתוח.
3. אקו לב
- הכנה
- בצע ניתוח שיפוע PAB באמצעות אקו לב 14 יום לאחר ניתוח PAB.
- הפעל את מכשיר האקו-לב. בחר את חבילת הלב ומתמר 14.0 מגה-הרץ.
- הרדמה
- הניחו את העכבר בתא האינדוקציה המלא בתערובת של 5% איזופלורן ו-100% חמצן.
- לגלח את בית החזה של העכבר.
- הנח את העכבר על גבו על שטיח החום (טמפרטורה 37 מעלות צלזיוס) והנח את החוטם במסכת האוורור.
- אווררו עם תערובת של 1.5%-2.5% איזופלורן ו-100% חמצן (0.15 ליטר לדקה) ואוויר בחדר (0.3 ליטר לדקה).
- בדוק את עומק ההרדמה על ידי ביצוע צביטה בבוהן והתאם את ההרדמה בהתאם.
- יש למנוע התייבשות של העין באמצעות משחת עיניים.
- קביעת שיפוע PAB על ידי אקו לב
- הניחו מדבקות אלקטרוקרדיוגרמה לילדים על כל רגל קדמית ואחת על שתי הרגליים האחוריות. השתמש במדבקות כדי להחזיק את החיה.
- מרחו ג'ל אולטרסאונד על החלק המגולח של בית החזה של העכבר.
- כדי לקבל את התמונות של עורק הריאה, ניתן להשתמש בשתי תצוגות: הציר הארוך הפרסטרנלי (PLAX) או הציר הקצר הפרסטרנלי (PSAX). השג את שניהם והשתמש בתצוגה שנותנת את המדידות האיכותיות ביותר ואת המהירויות הגבוהות ביותר לניתוח.
- השג תצוגות PLAX ו-PSAX.
- לחצו על כפתור דופלר הצבע כדי להמחיש את זרימת הדם.
- מקם את בדיקת האולטרסאונד בזווית של 30 מעלות לקו הפרסטרנלי כדי להשיג PLAX (לתיאור מפורט ראה Cheng, et al.48), תוך הדמיית אבי העורקים העולה.
- טאטא את הגשושית באופן מינימלי לכיוון שמאל כך שאבי העורקים העולה ייעלם מאחורי עורק הריאה. ה-PLAX המתאים מזוהה כאשר מדמיינים את עורק הריאה, כאשר הדם זורם אנכית.
- מקם את הסמן בקו אחד עם עורק הריאה. לחץ על כפתור דופלר הגל הרציף (CW) כדי לגזור מדידות אינטגרליות של זמן מהירות במהלך שלושה מחזורי לב. לחץ על שמור.
- סובב את הגשושית 90° בכיוון השעון מה-PLAX כדי לקבל PSAX, ולאחר מכן הטה את הגשושית מעט לכיוון הגולגולת/הגחון כדי להפיק את ה-PSAX ברמת אבי העורקים. תצוגת ה-PSAX המתאימה מזוהה אם מסלול היציאה של הקרוואנים ממוקם בין אבי העורקים לבדיקה. זה ממשיך בעורק הריאה, כאשר הדם זורם אנכית. לתיאור מפורט ראה Cheng et al.48
- מקם את הסמן בקו אחד עם עורק הריאה. לחץ על כפתור דופלר הגל הרציף (CW) כדי לגזור מדידות אינטגרליות של זמן מהירות במהלך שלושה מחזורי לב. לחץ על שמור.
- מדוד את שלוש המהירויות המקסימליות של התצוגה הטובה ביותר (PSAX או PLAX) וחשב את הממוצע. השתמש בעיקרון הפשוט של ברנולי כדי לגזור את שיפוע ה-PAB במילימטר כספית (mmHg).
4. הדמיית תהודה מגנטית של הלב
- הכנה
- בצע ניתוח CMR 6 שבועות (כלומר, 42 ימים) לאחר ניתוח PAB.
הערה: בנוסף, ניתן לבחור נקודות זמן מוקדמות יותר לאחר ניתוח PAB כאשר יש לכלול מספר נקודות זמן, בהתאם לשאלת המחקר. ניתן לשקול נקודות זמן מאוחרות יותר; עם זאת, כשל בקרוואנים ומוות עלולים להתרחש יותר ויותר. - השתמש במגנט חזק מספיק (בדרך כלל, >7 T משמש לסריקת CMR של מכרסמים). עבור הפרוטוקול הנוכחי, נעשה שימוש במערכת אנכית של 9.4 T, עם סט שיפוע של 1,500 mT/m וגודל קדח של 89 מ"מ.
- התקן תוכנת עיבוד לאחר CMR לניתוח נפחים ומסות בתמונות הנגזרות. התוכנה נחשבת מתאימה אם היא מאפשרת פילוח ידני לקביעת נפחי קצה דיאסטולי (ED) וקצה סיסטולי (ES) (EDV ו-ESV, בהתאמה) ומסת חדרים (נמדדת הן ED והן ES).
- בצע ניתוח CMR 6 שבועות (כלומר, 42 ימים) לאחר ניתוח PAB.
- הרדמה וקיבוע
- הניחו את העכבר בתא האינדוקציה המלא בתערובת של 5% איזופלורן ו-100% חמצן. ודא את השפעת ההרדמה על ידי מתן גירוי כאב על ידי צביטה בבוהן.
- מרחו משחת עיניים על עיני העכבר כדי לשמור על לחות במהלך הסריקה.
- הנח את העכבר במיטת החיות של הסורק עם אספקת אוויר משולבת, תערובת מחוממת (37 מעלות צלזיוס) של 1.5%-2.5% איזופלורן, 100% חמצן (0.15 ליטר לדקה) ואוויר בחדר (0.3 ליטר לדקה), וכרית לחץ המאפשרת התבוננות בקצב הלב (כוון ל-400-500 פעימות לדקה) וקצב הנשימה (כוון ל~35 נשימות לדקה) במהלך הסריקה. לווסת את ההרדמה על סמך שני הפרמטרים הללו. וודאו שהמיטה עשויה מפלסטיק, ללא כל חומר מגנטי.
- הנח את מיטת החיות עם העכבר לתוך הסורק.
- ביצוע הדמיית תהודה מגנטית לבבית
- בצע התאמות טרום רכישה על ידי כוונון סליל כלוב הציפורים בתדר תהודה של 1 מימן (1 H).
- לאחר מכן הגדר את השדה המגנטי הומוגני ככל האפשר באמצעות הליך השימינג האוטומטי.
הערה: השימינג הממוחשב נעשה בשיטת הכוונון כביכול, המשתמשת באזור שמתחת ל-1 H FID כפרמטר איכות. בהליך כוונון זה נבחנת קבוצה מוגדרת על ידי המשתמש של shims (Z, Z2, X, Y, XZ ו-YZ) במחזור איטרטיבי. כל shim ברצף מותאם בנפרד כדי למקסם את השטח תחת ה-FID. זהו בעצם הליך ליניארי שעובד היטב במהירות. - מטב את דופק ה-RF על ידי מקסום פרופיל התמונה החד-ממדי עם התאמת עוצמת דופק ה-RF.
- הקצה את המיקום המדויק של הלב בסורק על ידי ביצוע סריקות צופים באמצעות רצף טריפיילוט. השתמש ברצף הד שיפוע מהיר כדי לרכוש את תמונות הצופים דרך בית החזה: פרוסה רוחבית, עטרתית וסגיטלית. (איור 1A,B,C)
- התאם את הצירים לצירים בפועל של התצוגה הצירית, הדו-תאית וארבעה החדרים (איור 1D,E).
- לאחר מכן, מקם את פרוסות הקולנוע בניצב לציר דמיוני בין צינור היציאה של הקרוואנים לחלק האפיקלי ביותר של הקרוואן.
- גזר עשר עד אחת עשרה פרוסות קולנוע בעובי 1 מ"מ ללא מרווח פרוסה כדי לכסות את כל ההדמיה מלמעלה לבסיס של ה-RV (איור 1F) באמצעות שיטת Flash (FLASH) מהירה עם שער עצמי, המייתרת את הצורך באלקטרוקרדיוגרמה (ECG) ושער נשימה. פרמטרי הרכישה מוצגים בטבלה 1. שמור את התמונות בתבנית DICOM.
- ביצוע אנליזות על תמונות שנרכשו
- לחץ פעמיים על התוכנה כדי לפתוח את התוכנית.
- פתח תמונות בתוכנת העיבוד המאוחר של CMR באמצעות לחצן הייבוא .
- זהה את השלב הסופי הסיסטולי (המוגדר כשלב עם חלל הקרוואנים הקטן ביותר מבחינה ויזואלית) ואת השלב הסופי הדיאסטולי (מוגדר כשלב עם חלל הקרוואנים הגדול ביותר מבחינה ויזואלית).
- על פי הנחיות האגודה לתהודה מגנטית קרדיווסקולרית49, צייר את קווי המתאר של האפיקרדיאל באופן ידני בקצה הדיאסטולה ובקצה הסיסטולה מהקודקוד לבסיס, על ידי סימון מספר נקודות בגבול האפיקרדיאלי של כל תמונה. בנקודה האחרונה, לחץ פעמיים כדי להשלים את קווי המתאר של האפיקרדיאל.
- עשו את אותו הדבר עבור קווי המתאר האנדוקרדיאליים. (איור 2). החדר השמאלי והחדר הימני EDV, ESV, ED מסת ומסת ES מחושבים כעת באופן אוטומטי על ידי התוכנה.
הערה: מסה מוגדרת כנפח שריר הלב כפול צפיפות שריר הלב (כלומר, 1.05). - בהתאם לשאלת המחקר ולאוכלוסייה הנחקרת, אינדקס משתנים אלה לגודל הנבדק באמצעות אורך השוקה או משקל הגוף, על פי נוסחאות שפורסמו בעבר50.
- חשב את מדד האקסצנטריות (EI) הן בקצה הדיאסטולה והן בקצה הסיסטולה, על ידי חלוקת קוטר חלל ה-LV המקביל למחיצה התוך חדרית (IVS) בקוטר חלל ה-LV בניצב ל-IVS, הנגזר מהציר הקצר ברמת האמצע-פפילרי.
- התוכנה מחשבת את נפח השבץ (SV) ב- mL כ-
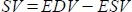 , ואת שבר הפליטה (EF, %) כ-
, ואת שבר הפליטה (EF, %) כ- 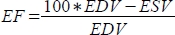 .
. - חשב את תפוקת הלב (CO) במ"ל/דקה כ-
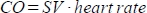 . הדופק נמדד באופן ידני על ידי כרית הלחץ המוטמעת במיטת החי כמתואר לעיל, מכיוון שהסורק אינו מסוגל לרשום את הדופק הגבוה התדיר כראוי.
. הדופק נמדד באופן ידני על ידי כרית הלחץ המוטמעת במיטת החי כמתואר לעיל, מכיוון שהסורק אינו מסוגל לרשום את הדופק הגבוה התדיר כראוי. - בהתאם לשאלת המחקר ולאוכלוסייה הנחקרת, אינדקס את ה-CO וה-SV לגודל הנבדק באמצעות אורך השוקה או משקל הגוף, על פי נוסחאות שפורסמו בעבר50.
5. ניתוחים סטטיסטיים
- פתח את התוכנה המשמשת להדמיית נתונים וניתוחים סטטיסטיים.
- מיין את הנתונים לכל קבוצה (PAB ו- sham) עם כל קבוצה בעמודה נפרדת.
- השתמש במבחן מאן-וויטני כדי להשוות PAB לעומת זיוף עבור כל משתנה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
שיעור התמותה מההליך הכירורגי PAB הוא בסביבות 10%. התוצאות המוצגות מראות מאפיינים של עכברים בקבוצות הדמה (n = 5) ו- PAB (n = 8). כפי שמוצג באיור 3, ערכי שיפוע PAB עלו באופן משמעותי בהשוואה לחיות דמה לאחר 2 ו-6 שבועות לאחר PAB. עלייה זו בעומס גרמה להתרחבות RV המתבטאת בעלייה ב-...
Access restricted. Please log in or start a trial to view this content.
Discussion
פרוטוקול זה מספק שיטה הניתנת לשחזור עבור PAB בעכברים והערכה שלאחר מכן של שיפוץ הלב והסתגלות תפקודית באמצעות CMR.
PAB שונה מדגמים אחרים של עומס לחץ קרוואנים מוגבר מכיוון שהוא כרוך בעלייה מוחלטת וסטטית של עומס לאחר ללא נוכחות של טריגרים אחרים. עומס לחץ קרוואנים ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המרכז הרפואי האוניברסיטאי חרונינגן חתם על חוזה עם אקטליון ולילי לפעילויות ייעוץ של ר.מ.פ. ברגר מחוץ לתוכן כתב היד הזה. המחברים האחרים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
אנו רוצים להודות ל-P. Da Costa-Martins על תמיכתה בניסויים בחיות במחקר הזה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 14.0 MHz i13L-echocardiography transducer | GE Healthcare, Waukesha, WI, USA | ||
| 20G cannula | |||
| 23G needle | |||
| 9.4T magnetic resonance scanner with 1,500 mT/m gradient set | Bruker BioSpin, Ellingen, Germany | ||
| Anesthesia induction chamber | |||
| Blunt 25G needle | |||
| Buprenorphine | |||
| Chloride-hexidine | |||
| CMR post-processing software | Medis Medical Imaging Systems, Leiden, The Netherlands | Qmass version 7.6 | |
| Data visualisation and statistical software | GraphPad Prism Inc, La Jolla, CA, USA | software version 7.02 | |
| Echocardiography machine | GE Healthcare, Waukesha, WI, USA | Vivid Dimension 7 | |
| Eye ointment | |||
| Heat mat | |||
| Incubator (37°C) | |||
| Isoflurane | |||
| Isoflurane evaporator | |||
| Miniventilator for rodents | Hugo Sachs | model 687 | |
| monofilament polypropylene 5-0 sutures | |||
| monofilament polypropylene 6-0 sutures | |||
| Needle and syringe for subcutaneous injections | |||
| Pediatric electrocardiogram-stickers | |||
| pure polyglycolic acid 5-0 sutures | |||
| Sterile surgical instruments | |||
| Ventilation mask |
References
- Norozi, K., et al. Incidence and Risk Distribution of Heart Failure in Adolescents and Adults With Congenital Heart Disease After Cardiac Surgery. The American Journal of Cardiology. 97 (8), 1238-1243 (2006).
- Borgdorff, M. A. J., et al. Clinical symptoms of right ventricular failure in experimental chronic pressure load are associated with progressive diastolic dysfunction. Journal of Molecular and Cellular Cardiology. 79, 244-253 (2015).
- Koop, A. M. C., et al. Right ventricular pressure overload alters cardiac lipid composition. International Journal of Cardiology. , (2019).
- Faber, M. J., et al. Right and left ventricular function after chronic pulmonary artery banding in rats assessed with biventricular pressure-volume loops. American Journal of Physiology and Heart Circirculation Physiology. 291 (4), 1580-1586 (2006).
- Bogaard, H. J., et al. Chronic pulmonary artery pressure elevation is insufficient to explain right heart failure. Circulation. 120 (20), 1951-1960 (2009).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulmonary Circulation. 7 (3), 572-587 (2017).
- Rumsey, W. L., et al. Adaptation to hypoxia alters energy metabolism in rat heart. American Journal of Physiology Heart and Circulatory Physiology. 276 (1), 71-80 (1999).
- Drozd, K., et al. Effects of an endothelin receptor antagonist, Macitentan, on right ventricular substrate utilization and function in a Sugen 5416/hypoxia rat model of severe pulmonary arterial hypertension. Journal of Nuclear Cardiology. 24 (6), 1979-1989 (2017).
- Van Der Feen, D. E., et al. Shunt surgery, right heart catheterization, and vascular morphometry in a rat model for flow-induced pulmonary arterial hypertension. Journal of Visualized Experiments. (120), e55065(2017).
- Gomez-Arroyo, J., et al. Metabolic gene remodeling and mitochondrial dysfunction in failing right ventricular hypertrophy secondary to pulmonary arterial hypertension. Circulation: Heart Failure. 6 (1), 136-144 (2013).
- Bruns, D. R., Dale Brown, R., Stenmark, K. R., Buttrick, P. M., Walker, L. A. Mitochondrial integrity in a neonatal bovine model of right ventricular dysfunction. American Journal of Physiology - Lung Cellular and Molecular Physiology. 308 (2), 158-167 (2015).
- Zhang, W. H., et al. Up-regulation of hexokinase1 in the right ventricle of monocrotaline induced pulmonary hypertension. Respiratory Research. 15 (1), 119(2014).
- Paulin, R., et al. A miR-208-Mef2 axis drives the decompensation of right ventricular function in pulmonary hypertension. Circulation Research. 116 (1), 56-69 (2015).
- Sutendra, G., et al. A metabolic remodeling in right ventricular hypertrophy is associated with decreased angiogenesis and a transition from a compensated to a decompensated state in pulmonary hypertension. Journal of Molecular Medicine. 91 (11), 1315-1327 (2013).
- Balestra, G. M., et al. Increased in vivo mitochondrial oxygenation with right ventricular failure induced by pulmonary arterial hypertension: Mitochondrial inhibition as driver of cardiac failure. Respiratory Research. 16, 6(2015).
- Piao, L., et al. The inhibition of pyruvate dehydrogenase kinase improves impaired cardiac function and electrical remodeling in two models of right ventricular hypertrophy: Resuscitating the hibernating right ventricle. Journal of Molecular Medicine. 88 (1), 47-60 (2010).
- Piao, L., et al. FOXO1-mediated upregulation of pyruvate dehydrogenase kinase-4 (PDK4) decreases glucose oxidation and impairs right ventricular function in pulmonary hypertension: therapeutic benefits of dichloroacetate. Journal of Molecular Medicine. 91, 333-346 (2013).
- Sheikh, A. M., et al. Right ventricular hypertrophy with early dysfunction: A proteomics study in a neonatal model. Journal of Thoracic and Cardiovascular Surgery. 137 (5), 1146-1153 (2009).
- Olivetti, G., et al. Cellular basis of wall remodeling in long-term pressure overload-induced right ventricular hypertrophy in rats. Circulation Research. 63 (3), 648-657 (1988).
- Lauva, I. K., et al. Control of myocardial tissue components and cardiocyte organelles in pressure-overload hypertrophy of the cat right ventricle. The American Journal of Anatomy. 177 (1), 71-80 (1986).
- Fang, Y. H., et al. Therapeutic inhibition of fatty acid oxidation in right ventricular hypertrophy: Exploiting Randle's cycle. Journal of Molecular Medicine. 90 (1), 31-43 (2012).
- Piao, L., et al. Cardiac glutaminolysis: A maladaptive cancer metabolism pathway in the right ventricle in pulmonary hypertension. Journal of Molecular Medicine. 91 (10), 1185-1197 (2013).
- Sack, M. N., Disch, D. L., Rockman, H. A., Kelly, D. P. A role for Sp and nuclear receptor transcription factors in a cardiac hypertrophic growth program. Proceedings of the National Academy of Sciences of the United States of America. 94 (12), 6438-6443 (1997).
- Broderick, T. L., King, T. M. Upregulation of GLUT-4 in right ventricle of rats with monocrotaline- induced pulmonary hypertension. Medical Science Monitor. 14 (12), 261-264 (2008).
- Enache, I., et al. Skeletal muscle mitochondrial dysfunction precedes right ventricular impairment in experimental pulmonary hypertension. Molecular and Cellular Biochemistry. 373 (1-2), 161-170 (2013).
- Sun, X. Q., et al. Reversal of right ventricular remodeling by dichloroacetate is related to inhibition of mitochondria-dependent apoptosis. Hypertension Research. 39 (5), 302-311 (2016).
- Adrogue, J. V., Sharma, S., Ngumbela, K., Essop, M. F., Taegtmeyer, H. Acclimatization to chronic hypobaric hypoxia is associated with a differential transcriptional profile between the right and left ventricle. Molecular and Cellular Biochemistry. 278 (1-2), 71-78 (2005).
- Sharma, S., et al. Dynamic changes of gene expression in hypoxia-induced right ventricular hypertrophy. American Journal of Physiology - Heart and Circulatory Physiology. 286 (3), 1185-1192 (2004).
- Nouette-Gaulain, K., et al. Time course of differential mitochondrial energy metabolism adaptation to chronic hypoxia in right and left ventricles. Cardiovascular Research. 66 (1), 132-140 (2005).
- Graham, B. B., et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake. American Journal of Physiology - Lung Cellular and Molecular Physiology. 309 (5), 435-440 (2015).
- Liu, A., et al. Estrogen maintains mitochondrial content and function in the right ventricle of rats with pulmonary hypertension. Physiological Reports. 5 (6), 1-12 (2017).
- Kobr, J., et al. Right Ventricular Pressure Overload and Pathophysiology of Growing Porcine Biomodel. Pediatric Cardiology. 37 (8), 1498-1506 (2016).
- Yerebakan, C., et al. Acute and chronic response of the right ventricle to surgically induced pressure and volume overload - an analysis of pressure-volume relations. Interactive CardioVascular and Thoracic Surgery. 10 (4), 519-525 (2010).
- Gufler, H., et al. Right Ventricular Function After Pulmonary Artery Banding: Adaptive Processes Assessed by CMR and Conductance Catheter Measurements in Sheep. Journal of Cardiovascular Translational Research. 12 (5), 459-466 (2019).
- Baicu, C. F., et al. Time course of right ventricular pressure-overload induced myocardial fibrosis: relationship to changes in fibroblast postsynthetic procollagen processing. American Journal of Physiology-Heart and Circulatory Physiology. 303 (9), 1128-1134 (2012).
- Manohar, M., et al. Regional myocardial blood flow and coronary vascular reserve in unanesthetized young calves exposed to a simulated altitude of 3500 m for 8-10 weeks. Circulation Research. 50 (5), 714-726 (1982).
- Fávaro, G. A. G., et al. Reversible pulmonary trunk banding: VII. Stress echocardiographic assessment of rapid ventricular hypertrophy in young goats. Journal of Thoracic and Cardiovascular Surgery. 145 (5), 1345-1351 (2013).
- Nielsen, E. A., et al. Regional septal hinge-point injury contributes to adverse biventricular interactions in pulmonary hypertension. Physiological Reports. 5 (14), 1-13 (2017).
- Borgdorff, M. A., et al. Sildenafil enhances systolic adaptation, but does not prevent diastolic dysfunction, in the pressure-loaded right ventricle. European Journal of Heart Failure. 14 (9), 1067-1074 (2012).
- Gold, H., Prindle, K., Levey, G., Epstein, S. Effects of experimental heart failure on the capacity of glucagon to augment myocardial contractility and activate adenyl cyclase. The Journal of Clinical Investigation. 49 (5), 999-1006 (1970).
- Brittain, E. L., et al. Right ventricular plasticity and functional imaging. Pulmonary Circulation. 2 (3), 309-326 (2012).
- Jiang, L., et al. Three-dimensional Echocardiography In Vivo Validation for Right Ventricular Volume and Function. Circulation. 89, 2342-2350 (1994).
- Markiewicz, W., Sechtem, U., Higgins, C. B. Evaluation of the right ventricle by magnetic resonance imaging. American Heart Journal. 113 (1), 8-15 (1987).
- Pattynama, P. M. T., et al. Reproducibility of MRI-derived measurements of right ventricular volumes and myocardial mass. Magnetic Resonance Imaging. 13 (1), 53-63 (1995).
- Wiesmann, F., et al. Comparison of fast spiral, echo planar, and fast low-angle shot MRI for cardiac volumetry at .5T. Journal of Magnetic Resonance Imaging. 8 (5), 1033-1039 (1998).
- Van der Feen, D. E., et al. Multicenter Preclinical Validation of BET Inhibition for the Treatment of Pulmonary Arterial Hypertension. American Journal of Respiratory and Critical Care Medicine. 200 (7), 910-920 (2019).
- da Costa Martins, P. A., et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nature Cell Biology. 12 (12), 1220-1227 (2010).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. Journal of Visualized Experiments. (84), e51041(2014).
- Schulz-Menger, J., et al. Standardized image interpretation and post processing in cardiovascular magnetic resonance: Society for Cardiovascular Magnetic Resonance (SCMR) Board of Trustees Task Force on Standardized Post Processing. Journal of Cardiovascular Magnetic Resonance. 15 (1), 1-19 (2013).
- Hagdorn, Q. A. J., et al. A novel method optimizing the normalization of cardiac parameters in small animal models: The importance of dimensional indexing. American Journal of Physiology - Heart and Circulatory Physiology. 316 (6), 1552-1557 (2019).
- Scherrer-Crosbie, M., et al. Determination of Right Ventricular Structure and Function in Normoxic and Hypoxic Mice. Circulation. 98 (10), 1015-1021 (2012).
- Wiesmann, F., et al. Analysis of right ventricular function in healthy mice and a murine model of heart failure by in vivo MRI. American Journal of Physiology-Heart and Circulatory Physiology. 283 (3), 1065-1071 (2002).
- Lu, X., et al. Accuracy and Reproducibility of Real-Time Three-Dimensional Echocardiography for Assessment of Right Ventricular Volumes and Ejection Fraction in Children. Journal of the American Society of Echocardiography. 21 (1), 84-89 (2008).
- Soriano, B. D., et al. Matrix-array 3-dimensional echocardiographic assessment of volumes, mass, and ejection fraction in young pediatric patients with a functional single ventricle: A comparison study with cardiac magnetic resonance. Circulation. 117 (14), 1842-1848 (2008).
- Damy, T., et al. Prevalence of, associations with, and prognostic value of tricuspid annular plane systolic excursion (TAPSE) among out-patients referred for the evaluation of heart failure. Journal of Cardiac Failure. 18 (3), 216-225 (2012).
- Kowalik, E., Kowalski, M., Rózański, J., Kuśmierczyk, M., Hoffman, P. The impact of pulmonary regurgitation on right ventricular regional myocardial function: An echocardiographic study in adults after total repair of tetralogy of fallot. Journal of the American Society of Echocardiography. 24 (11), 1199-1204 (2011).
- Koestenberger, M., et al. Systolic right ventricular function in pediatric and adolescent patients with tetralogy of Fallot: Echocardiography versus magnetic resonance imaging. Journal of the American Society of Echocardiography. 24 (1), 45-52 (2011).
- Bovens, S. M., et al. Evaluation of infarcted murine heart function: Comparison of prospectively triggered with self-gated MRI. NMR in Biomedicine. 24 (3), 307-315 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved