A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפקת מיקרופלואידים של Lysolipid המכילים טמפרטורה רגישה ליפוזומים
In This Article
Summary
הפרוטוקול מציג את הפרמטרים אופטימיזציה עבור הכנת ליפוזומים תרמיים באמצעות המכשיר מיקרו מיקרופלולה המתלא. זה גם מאפשר משותף של דוקסורוביצין ו indocyanine ירוק ליפוזומים ושחרור פוטותרמי המופעל של דוקסורוביצין עבור שליטה מבוקרת/תרופה שהופעלה.
Abstract
הפרוטוקול המוצג מאפשר הכנה רציפה בתפוקה גבוהה של ליפוזומים בטמפרטורה נמוכה (LTSLs), המסוגלים לטעון תרופות כימותרפיות, כגון דוקסורוביצין (חמצון). כדי להשיג את זה, תערובת השומנים ethanolic ואת הפתרון אמוניום גופרתי מוזרק לתוך המכשיר מיקרופלוהעצם הסטה (SHM) מיקרומטר. הפתרונות מעורבבים במהירות על ידי SHM, מתן סביבת הממס הומוגנית עבור הרכבה עצמית ליפוזומים. ליפוזומים שנאספו מושקעים. לאחר מכן כדי להסיר אתנול שיורית מעבר הדרגתי של אמוניום גופרתי מבוסס באמצעות חילופי מאגרים של הפתרון החיצוני באמצעות כרומטוגרפיה של אי-הכללה בגודל. לאחר מכן, החמצון נטען מרחוק לתוך היפוזומים עם יעילות כימוס גבוהה (> 80%). ליפוזומים שהתקבלו הם הומוגנית בגודל עם קוטר Z ממוצע של 100 ננומטר. הם מסוגלים לשחרר את הטמפרטורה שחרור פרץ של חמצון כושל בנוכחות מכת חום קלה (42 ° c). Indocyanine ירוק (ICG) יכול גם להיות שיתוף טעון ליפוזומים עבור שחרור בלייזר קרוב-אינפרא אדום המופעל. הגישה המיקרופלואידיc מבטיחה תפוקה גבוהה, הכנה מדרגית ומדרגיים של LTSLs.
Introduction
הניסוח ltsl הוא המוצר הרלוונטי קלינית ליפוזומבית שפותחה כדי לספק את התרופה כימותרפיה דוקסורוביצין (חמצון) ומאפשר שחרור התרופה יעיל התפוצצות ב מכת חום מתון השגה (T ≈ 41 ° c)1. הניסוח של LTSL מורכב מ-1, 2-dipalmitoyl-sn-בגליקו-3-פוספולינולינה (dppc), הליסולפיד 1-stearoyl-2-הידרוxy-sn-גליליאו-3-פוספוליטיולין (mspc; M מייצג "מונו") ו PEGylated השומנים 1, 2-distearoyl-sn-גליקו-3-פוספואנתאנאואמין-N-[מתיקסי (פוליאתילן גליקול)-2000] (dspe-יתד2000). עם ההגעה לטמפרטורת המעבר שלב (Tm ≈ 41 ° c), lysolipid ו dspe-יתד2000 יחד להקל על היווצרות של נקבוביות הממברנה, וכתוצאה מכך שחרור פרץ של הסם2. הכנת ה-LTSLs משתמשת בעיקר בגישה מלמעלה-למטה, כלומר לחות ושחול השומנים. זה נשאר מאתגר להיות מוכן להכין אצוות גדולות עם מאפיינים זהים בכמויות מספיקות עבור יישומים קליניים3.
Microfluidics מיקרופלואידיקה היא טכניקה מתפתחים להכנת ליפוזומים, המציעה ננו-חלקיק size, מדרגיות ויכולת הרחבה3. לאחר שפרמטרי הייצור ממוטבים, ניתן לשנות את התפוקה באמצעות מקביליזציה, עם מאפיינים זהים לאלה המוכנים בסולם הספסל3,4,5. היתרון העיקרי של מיקרופלואידיקה מעל טכניקות בצובר קונבנציונאלי היא היכולת להתמודד עם כרכים נוזליים קטנים עם ישור גבוהה בחלל וזמן באמצעות המזעור, המאפשר אופטימיזציה מהירה יותר, תוך הפעלה באופן רציף ואוטומטי6. ייצור ליפוזומים עם התקנים מיקרופלואידים מושגת על ידי גישה nanoprecipitation מלמטה למעלה, שהיא יותר זמן ואנרגיה יעילה בגלל תהליכי המגון כגון שחול וsonication מיותרים7. בדרך כלל, פתרון אורגני (למשל אתנול) של שומנים (ו מטען הידרופובי) מעורבב עם miscible non-ממס (למשל מים ומטען הידרופילי). כמו הממס האורגני תערובות עם non-ממס, מסיסות עבור השומנים מופחת. ריכוז השומנים מגיע בסופו של דבר לריכוז קריטי שבו מופעל תהליך המשקעים7. Nanoprecipitates של שומנים בסופו של דבר לגדול בגודל וקרוב ליפוכמה. הגורמים העיקריים המסדירים את הגודל וההומוגניות של הליזומים הם היחס בין הבלתי ממס לבין הממס (כלומר יחס שיעור הזרימה מימית לאורגני; FRR) ואת ההומוגניות של סביבת הממס במהלך הרכבה עצמית של שומנים ליפוזומים8.
ערבוב של נוזלים יעילים במיקרופלואידיקה, ולכן חיוני להכנת ליפוזומים אחידים, ועיצובים שונים של מיקסרים המועסקים ביישומים שונים9. מיקרומטר האדרה (SHM) מייצג אחד הדורות החדשים של מערבלי פאסיביים, המאפשרים תפוקה גבוהה (בטווח של mL/min) עם גורם דילול נמוך. זה מעולה למיקרו-פלואידיג הידרודינמי ערבוב התקנים8,10. SHM יש בדוגמת חריצים אדרה, אשר מערבבים במהירות נוזלים לפיכאוטי 9,11. ציר הזמן ערבוב קצר של shm (< 5 אלפיות הראשונה, פחות מקנה המידה האופייני התקופה של 10 – 100 ms) מאפשר הרכבה עצמית השומנים להתרחש בסביבה ממיסים הומוגנית, הפקת חלקיקים עם התפלגות גודל אחיד3,12.
הכנת ltsls עם microfluidigis, עם זאת, לא פשוט לעומת ניסוחים ליפוזומליים קונבנציונאלי בשל העדר כולסטרול8, ללא השומנים bilayers רגישים המושרה אתנול הנגרמת13,14,15. עד היום, ההשפעה של שיורית אתנול מציג במהלך ייצור מיקרופלואידים של ליפוזומים לא הבינו היטב. רוב הניסוחים המדווחים הם עמידים בפני מיסודם כדי להבדיל (המכיל כולסטרול או בלתי רווי שומנים)16, אשר בניגוד ltsls הן רווי ונטול כולסטרול.
הפרוטוקול המוצג במסמך זה משתמש ב-SHM כדי להכין את LTSLs עבור מסירת התרופות המופעלת באמצעות טמפרטורה. בשיטה המוצגת, אנו מובטחים את LTSLs המוכן למיקרופלואידים (100 ננומטר) ומדים (דיסטיבסיטה < 0.2) על ידי פיזור אור דינמי (DLS). יתרה מזו, אנו כילנו את החמצון באמצעות שיטת מעבר הצבע אמוניום גופרתי (הידוע גם כטעינה מרחוק)17 כאימות של השלמות של השומנים של ltsl. הטעינה מרחוק של החמצון דורש ליפוכמה כדי לשמור על הדרגתי pH כדי להשיג את היעילות אנקפסולציה גבוהה (EE), אשר סביר לקרות ללא שלמות השומנים שלמים. בשיטה זו הציג, במיוחד מפני ליפופלואידיג טיפוסי מסוימים פרוטוקולי הכנה, צעד ריפוי נדרש לפני האתנול מוסר כדי לאפשר את יכולת הטעינה מרחוק; i.e. כדי לשחזר את היושרה של bilayer השומנים.
כפי שהוזכר קודם לכן, ניתן להציג מטענים הידרופילי והידרופובי גם לפתרונות הראשוניים לעטיפת המים הסימולטני של מטענים במהלך היווצרות LTSLs. כהוכחה-of-קונספט, indocyanine ירוק (ICG), מאושר על ידי ה-FDA צבע פלורסנט באמצעות אינפרא אדום, שהוא גם סוכן פוטותרמי מבטיח, הוא הציג את תערובת השומנים הראשונית בהצלחה משותפת לתוך LTSLs. לייזר 808 ננומטר משמש לשחרור האנטי-והחמצון הטעון/ICG, ולגרום בהצלחה לשחרר את החימום התרמי המופעל בתוך 5 דקות.
כל המכשירים והחומרים זמינים באופן מסחרי, מוכן לשימוש וללא צורך בהתאמה אישית. מאז כל הפרמטרים לניסוח ltsls בעקבות פרוטוקול זה, חוקרים ללא ידע מוקדם של מיקרופלואידיקה יכול גם להכין את ה-ltsls אשר משמש כבסיס למערכת שילוח התרופות התרמורגיש.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. התקנת ציוד
- הכנס את משאבות המזרק ואת SHM כדלקמן.
- לחבר את היציאה "אל המחשב" של משאבת מזרק משני (משאבת 02, עבור פתרון מימית) כדי "אל הרשת" הנמל של המשאבה מזרק מאסטר (משאבה 01, עבור פתרון השומנים אתנול) באמצעות משאבה למשאבת כבל רשת (איור 1, צהוב).
- חבר את היציאה "למחשב" של המשאבה הראשית ליציאת "RS232 Serial" של המחשב באמצעות מחשב כדי לשאוב כבל רשת (איור 1, כחול).
- לחבר אבובים לכל אחד אינלטס ושקעים של shm באמצעות אגוז ו ferrule. להמיר את הטרמינל של אבובים עבור שניהם מאפשרים הנשי Luer באמצעות עוד אגוז ופרשול והרכבה האיחוד. אבובים ארוכים יותר של אינלטס מאפשר מצורף קל יותר מזרקים (איור 2).
- הגדר את תוכנת בקרת המשאבה .
- הקצה את הכתובת של משאבת המזרק הראשי ואת משאבת המזרק המשני ל "Ad: 01" ו-"Ad: 02", בהתאמה, באמצעות כפתור "ההתקנה" של משאבת המזרק. זה צריך להיעשות רק. בפעם הראשונה
- פתח את תוכנת בקרת המשאבה במחשב. שני משאבות מזרק צריך להיות מזוהה באופן אוטומטי, ואחריו צליל צפצוף. אחרת, לחץ על משאבות וחפש משאבות כדי לעדכן את החיבור. (איור 3).
- הקצה קוטר ל 12.45 (מ"מ) על ידי בחירת" Hsw נורמה-פרוייקט 5 Cc (Dia = 12.45) ".
- שיעור הקצאה כדי 0.25 mL/min עבור משאבה 01 (האתנול פתרון השומנים) ו 0.75 mL/min עבור משאבה 02 (פתרון מימית). שיעורי הזרימה מקבילים לקצב הזרימה הכולל (TFR) של 1 mL/min ויחס קצב הזרימה (FRR) מימית לאתנול של 3.
- הקצה את עוצמת הקול לכל ערך מעל 5 מ ל.
הערה: אמצעי העירוי הייעודי מוגדר כגדול יותר מנפח הנוזל שנטען בהתחשב בנפח הריק של האבובים. - בחר מצב INF (אינפוזיה) עבור שני המשאבות.
- לחץ על הגדר כדי לאשר את ההגדרות.
2. הכן את הסגן
- להכין תערובת LTSL10 או LTSL10-ICG השומנים (ראה טבלה 1).
- משיכת 1 מ ל של תערובת ליפיד ולפחות 3 מ ל (NH4)2SO4 פתרון באמצעות שני 5 מזרקים מנעולים לנעול.
- התקן את שני מזרקים על משאבות מזרק בתנוחה זקופה על ידי הזזת מקורבות החבית של המזרק לפלטה מזרק של המשאבה, ואת הבוכנה של המזרק לחסום הדוחס של המשאבה (איור 4).
- עטוף את קצה קלטת החימום למזרק עם התמיסה הימית. לעטוף את הקצה השני של הקלטת החימום ואת הטמפרטורה בדיקה של התרמוסטט סביב המזרק עם פתרון השומנים. מועיל לתרגל שלב זה עם מזרקים ריקים במקום על מנת להקל על תהליך ההרכבה (איור 5א).
- לחבר את שני מזרקים לתוך מתאמי luer נקבה של אינלטס המתאימים של shm. ודא שהזרקים המכילים את תערובת השומנים ו (NH4)2כך4 פתרונות מחוברים כניסת אתנול ו מימית, בהתאמה. כוונן את מיקום הבוכנה כדי להסיר בועות אוויר מן הזרקים (איור 5ב).
הערה: ודא שהזרקים עדיין ממוקמים באופן מאובטח על מחזיק המזרק של המשאבות. - לחמם את הזרקים מעל 51 ° צ' באמצעות קלטת חימום באמצעות חימום 10 s הפעלה. אפשר לתרמוסטט לעדכן את הטמפרטורה של הזרקים. חזור על שלב זה בשלבים הבאים כדי לשמור על הטמפרטורה במהלך העירוי.
התראה: כבה את קלטת החימום לאחר 10 s כדי למנוע הטמפרטורה לירות ולאפשר לתרמוסטט לעדכן את הטמפרטורה בפועל. סרט החימום צריך להיות גם מטופל בזהירות כאשר הטמפרטורה שלה עולה מהר מאוד. חימום ברציפות עלול לגרום נזק הציוד ומזרקים, עקב עיכוב הזמן של התרמוסטט לעדכון הטמפרטורה נמדד. - לאחר הטמפרטורה היא מעל 51 ° c, להפעיל את משאבות המזרק על ידי לחיצה על הפעל הכל בתוכנת בקרת המשאבה (איור 3).
- ודא כי זרימת הנוזלים היא ללא בועות אוויר וכל דליפה. היפטר מן הנפח ההתחלתי (סביב 0.5 mL) של נוזל משקע החשמל כפסולת.
הערה: נפח הפסולת הראשונית אינו מוגדר והוא תלוי בנפח הפנימי של הכיוונון, שהוא אמצעי האחסון של נוזל לנסיעה מהזרקים דרך אבובים ו-SHM לשקע. - לאסוף את שאר הנוזל כמו ליפוכמה דגימות לתוך שפופרת מיקרוצנטריפוגה או בקבוקון יז.
- השהה/הפסק את האינפוזיה כאשר הנוזל בכל אחד מהמזרקים כמעט ריק.
הערה: משאבות צריך להיעצר באופן ידני, מאז המשאבות לא יכול במדויק לזהות את המיקום כאשר מזרקים ריקים. - מניחים את ליפוכי לאסוף כמה פתרונות באמבט מים 60 ° c כדי לספח עבור 1.5 h.
הערה: שלב זה חיוני לאפשר טעינת סמים ליפוזומים. - העבר את הפתרונות לצינורות דיאליזה. Dialyze הפתרונות נגד 1 L של 240 מ"מ (NH4)2כך4 ב 37 ° c עבור לפחות 4 h כדי להשיג ליפוזומים מטוהרים.
הערה: ניתן להשהות את הפרוטוקול כאן. ליפוזומים בשלב זה הם ב 5 מ"מ של פוספוליפיד. ניתן לאחסן ליפוזומים מטוהרים ב -4 ° c. - כדי לנקות את SHM לשימוש חוזר, לשטוף את SHM ברצף עם מים מוכי, אתנול ויבש עם גז חנקן.
3. הטענת מרחוק של החמצון לתוך LTSLs באמצעות הדרגה של pH הטרנסרפידה
- החלפת מאגר חיצוני של LTSLs לתמיסת מלח באגירה (HBS) על ידי שימוש בנפח הדרה כרומטוגרפיה (SEC) כדי ליצור מעבר צבע pH טרנסרפידת.
- הוסף סכום של 25 מ ל של HBS לחלק העליון של עמודת SEC כדי להכין את העמודה. הניחו לכולם לעבור דרך הטור ולהשליך את המלטה.
- הוסף 1 מ ל של ליפוזומים דיאליזה, מוכן משלב 2.12, אל העמודה ולהיפטר האליוט.
- הוסף 1.5 mL של HBS לעמודה ולהיפטר האליוט.
- הוסף 3 מ ל של HBS לעמודה ולאסוף את 3 מ ל של elute.
הערה: ניתן להשהות את הפרוטוקול כאן. ליפוזומים נאספים בשלב זה ונמצאים ב 1.67 מ"מ של פוספוליפיד. ניתן לאחסן ליפוזומים במאגר ב -4 ° c.
- . ולטהר את הדוקסורוביצין
- הוסף פתרון חמצון ב 1:20 חמצון-to-פוספוליפיד טוחנת יחס לתוך 1 מ ל של מאגר החלפת פתרון ליפוזומים (1.67 mmol) הכלול בקבוקון ביג. זה יכול להיות מושגת על ידי הוספת 48.4 μL של 1 מ"ג/mL חמצון פתרון (83.4 μמול).
- מניחים את בקבוקון הביז באמבט מים בגובה 37 ° c בשביל 1.5 h כדי לאפשר לחמצון להיטען ליפוזומים.
- מערבבים 10 μL של ליפוזומים עם 170 μL של HBS ו-20 μL של 1% (v/v) טריטון X-100 פתרון שחור 96-צלחת הבאר. . אני חוזר בשביל שלוש בארות הבארות הללו מתאימות לתוכן החמצון "לפני הטיהור".
- במקרה של הכנת LTSL10-ICG, לערבב 40 μL של ליפוזומים עם 160 μL של DMSO בצלחת 96 ברורה-באר. . אני חוזר בשביל שלוש בארות הבארות הללו מתאימות לתוכן ICG "לפני הטיהור".
- לטהר את הפתרון ליפופי כמתואר בשלב 3.1.
הערה: כדי לעשות שימוש חוזר בטור לטיהור עתידי, נקה את הטור מהחמצון החופשי על-ידי הוספה ראשונה של 1 מ ל של פתרון מדולל 0.5 M NaOH לפני ביצוע שלב 3.1.1. החמצון החופשי באדום יהפוך לסגול-כחול ולאורך הטור במהירות. - מערבבים 30 μL של הפתרון ליפוזומים מטוהרים עם 150 μL של HBS ו 20 μL של 1% (v/v) טריטון X-100 פתרון שחור 96-צלחת הבאר. . אני חוזר בשביל שלוש בארות בארות אלו מתאימות לתוכן החמצון "אחרי הטיהור".
- במקרה של LTSL10-ICG, לערבב 40 μL של הפתרון ליפוזומים מטוהרים עם 160 μL של DMSO ב ברור 96 בצלחת. . אני חוזר בשביל שלוש בארות בארות אלה מתאימות ל "לאחר טיהור" התוכן ICG.
- למדוד את העוצמה הפלואורסצנטית חמצון של הבארות לפני (שלב 3.2.3) ואחרי (שלב 3.2.5) טיהור, באמצעות קורא מיקרופלייט (λex = 485 ננומטר, λem = 590 nm).
- לחשב את יעילות האנקפסולציה של החמצון (חמצון) על ידי נקיטת היחס של עוצמות הקרינה לפני ואחרי הטיהור.
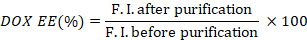
- למדוד את ספיגת ICG של הבארות לפני ואחרי טיהור, באמצעות קורא מיקרופלייט (600 כדי 1000 nm).
- לחשב את היעילות אנקפסולציה של ICG (ICG EE) על ידי נקיטת היחס של ספיגת בשנת 792 ננומטר לפני ואחרי טיהור, לוקח בחשבון את פקטור דילול (3 פעמים) במהלך הטיהור.

4. פיזור אור דינאמי (DLS)
- הוסף 50 μL של פתרון ליפוזומים (שלב 2.12) עד 450 μL של מים מפוהים.
- הניחו את הקובט בתוך כלי DLS ובצעו את המדידה בהתאם להוראות היצרן.
- הקלט את הקוטר ממוצע Z ומפזר שלוש מדידות לכל דוגמה.
5. הקלורימטר סריקה דיפרנציאלית (DSC)
- רכזו 1 מ ל של דגימות ליפוזומים (שלב 2.12) עם יחידת מסנן צנטריפוגלי כדי 0.5 mL (ריכוז השומנים הסופי של 10 מ"מ). באמצעות רוטור קבוע זווית, ספין ב 7500 x g עבור כ 15 דקות.
- העבר 20 μL של (NH4)2SO4 הפתרון ודגימות ליפוזומים לשני מחבתות DSC בהתאמה. לאטום את הסירים עם מכסים DSC ההרמטיות באמצעות ערכת העיתונות לדוגמה DSC.
- מדוד את המדגם מ 30 ° צ' עד 60 ° צ' בקצב חימום של 1 ° צ'/מזערי באמצעות הקלורימטר סריקה דיפרנציאלי.
- נתח את הנתונים באמצעות התוכנה המתאימה. קח את טמפרטורת המעבר שלב (Tm) כמו תחילתה של המעבר שלב (התכה השיא), אשר נמדד על ידי חיתוך x של הטנגנס של נקודת השיפוע המקסימלי.
6. שחרור דוקסורוביצין
- מחממים את HBS בטמפרטורה ייעודית (37 או 42 ° c) באמצעות אמבט מים. להכין אמבט מים קרח עבור הכנת דגימות.
- הוסף 100 μL של ליפוזומים מטוהרים שנטענו על ידי חמצון (שלב 3.2.5) לתוך 1.9 mL של HBS בצינור מיקרוצנטריפוגה. הניחו את הצינור באמבט המים של הטמפרטורה המיועדת.
- לסגת מיד 200 μL של דגימות מהצינור ולמקם אותו במהירות באמבט מים הקרח כדי להרוות כל שחרור התרופה הבאה. דוגמה זו מקבילה לנקודת הזמן הראשונית (t = 0).
- משיכת 200 μL של דגימות בנקודות הזמן העוקבות (t = 5, 10, 15, 30, 60 דקות) ובמהירות למקם אותו באמבט מים הקרח כדי להרוות כל שחרור התרופה.
- מערבבים 50 μL של מדגם של כל נקודת זמן עם 150 μL של HBS בצלחת שחור 96-באר. מדדו את עוצמת הזריחה של החמצון באמצעות קורא לוחית.
- הוסף 20 μL של 1% (v/v) טריטון X-100 לבארות נבחרות אקראיות שהוכנו בשלב 6.5. מדדו את האינטנסיביות הפלואורסצנטית של החמצון של בארות אלה באמצעות קורא לוחית. ערכים אלה מקבילים לנקודת הזמן של שחרור מלא (t = ∞; 100%).
- לחשב ולהתוות את אחוז החמצון שפורסמו על ידי באינטרפולציה האינטנסיביות הפלואורסצנטית של כל נקודות זמן (אני (t), לעומת הראשונית (אני (0)), ושוחרר במלואו (I (∞)), ערך.
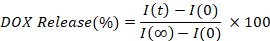
7. חימום לייזר ושחרור מופעל
- הניחו את טמפרטורת אמבט המים ל-37 ° c והניחו לטמפרטורה להתייצב.
- הוסף 200 μL של חמצון טעון LTSL10-ICG ([ICG] = 10 μg/mL) לצלחת 96-באר ברורה, ואז למקם אותו באמבט מים, לשמור על הקרקעית שקוע במים.
- הגדר את הזרם של מערכת הלייזר כדי 2.27 A. מניחים את המאצאו של מערכת הלייזר ב 5 ס מ אנכית מעל פני השטח של הצלחת 96-באר, אשר מתאים שטף האנרגיה של 0.5 W/cm2 [איור 6].
התראה: מערכת הלייזר צריכה להיות מופעלת בהתאם לאמצעים רלוונטיים לצורך בטיחות לייזר. - הפעל את הלייזר ונטר את הטמפרטורה כל דקה באמצעות הבדיקה של טמפרטורת סיבים אופטיים.
- ב 5 ו 10 דקות, משיכת 10 μL של לייזר לקרינה לפני הלייזר מן הצלחת 96-באר ברור ב ו לערבב עם 190 μL של HBS עבור שלוש בארות בלוח שחור 96-באר.
- מערבבים 10 μL של ליפוזומים עם 170 μL של HBS ו 20 μL של 1% (v/v) טריטון X-100 פתרון עבור שלוש בארות בלוח שחור 96-באר. הבארות הללו מתאימות לתוכן החמצון "100% שוחרר". מדדו את עוצמת הפלורסנט של החמצון ומחשבים את שחרור החמצון כמתואר בשלב 6.7.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הכנת LTSLs על ידי microfluiאידיקה דורש הרכב השומנים של DPPC/MSPC/DPPC-יתד2000 (80/10/10, היחס הטוחנת; LTSL10). איור 7A (משמאל ) מראה את המראה של LTSL10 מוכן משלב 2.9, כנוזל ברור ובלתי צמיגי. ניסוח LTSL10 מפותח מן הניסוח קונבנציונאלי, LTSL4 (DPPC/MSPC/DPPC-יתד2000, 86/10/4, יחס טוחנת) מא...
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול המוצג מתאר את הכנת ליפוזומים בטמפרטורה נמוכה (LTSLs) באמצעות מיקרומטר העצם (SHM) הרציף. הניסוח LTSL10 מאפשר שחרור מופעל טמפרטורה פרץ של דוקסורוביצין בתוך 5 דקות בטמפרטורה ימותרפיה קלינית השגה של 42 ° c. Indocyanine ירוק (ICG) יכול גם להיות שותף טעון עבור חימום פוטותרמי עורר את שחרורו של חמצון. השי?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים לסרטן הערמונית בריטניה (CDF-12-002 מלגת), ואת המועצה למחקר פיסי מדעי הנדסה (EPSRC) (EP/M008657/1) עבור מימון.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
References
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved