A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פגיעה מוחית כתוצאה בלייזר בקליפת המוח המוטורית של חולדות
* These authors contributed equally
In This Article
Erratum Notice
Summary
הפרוטוקול המוצג כאן מראה טכניקה ליצירת מודל מכרסם של פגיעה מוחית. השיטה המתוארת כאן משתמשת בהקרן לייזר ותועדת לקליפת המוח המוטורית.
Abstract
טכניקה נפוצה לגרמת שבץ במודלים של מכרסמים ניסיוניים כרוכה ארעי (מסומן לעתים קרובות MCAO-t) או קבוע (מוגדר MCAO-p) חסימה של העורק המוחי האמצעי (MCA) באמצעות צנתר. טכניקה מקובלת זו, עם זאת, יש כמה מגבלות, ובכך להגביל את השימוש הנרחב שלה. אינדוקציה שבץ בשיטה זו מאופיינת לעתים קרובות על ידי שונות גבוהה במיקום ובגודל של האזור האיסכמי, התרחשויות תקופתיות של דימום, שיעורי מוות גבוהים. כמו כן, השלמה מוצלחת של כל אחד מהנהלים ארעיים או קבועים דורשת מומחיות ולעתים קרובות נמשכה כ-30 דקות. בפרוטוקול זה, טכניקה להקרן לייזר מוצגת שיכול לשמש כשיטה חלופית לגירוי וללמוד פגיעה מוחית במודלים מכרסמים.
בהשוואה לחולדות בקבוצות הבקרה ו-MCAO, פגיעה מוחית על ידי אינדוקציה לייזר הראה השתנות מופחתת בטמפרטורת הגוף, נפח אוטם, בצקת במוח, דימום תוך גולגולתי, ותמותה. יתר על כן, השימוש בפציעה המושרה בלייזר גרם נזק לרקמות המוח רק בקליפת המוח המוטורית שלא כמו בניסויי MCAO שבו נצפתה הרס של קליפת המוח המוטורית ורקמות סטריאטל.
ממצאים מחקירה זו מצביעים על כך שהקרן לייזר יכולה לשמש טכניקה חלופית ויעילה לגירוי פגיעה מוחית בקליפת המוח המוטורית. השיטה גם מקצרת את הזמן להשלמת ההליך ואינה דורשת מטפלים מומחים.
Introduction
ברחבי העולם, שבץ מוחי הוא סיבת המוות המובילה השנייה והגורם השלישי המוביל לנכות1. שבץ מוחי מוביל גם לנכות חמורה, הדורשת לעתים קרובות טיפול נוסף מהצוות הרפואי וקרובי משפחה. יש, לכן, צורך להבין את הסיבוכים הקשורים להפרעה ולשפר את הפוטנציאל לתוצאות חיוביות יותר.
השימוש במודלים של בעלי חיים הוא הצעד הראשוני להבנת מחלות. כדי להבטיח את תוצאות המחקר הטובות ביותר, מודל טיפוסי יכלול טכניקה פשוטה, affordability, שכפול גבוה, ושונות מינימלית. הקובעים במודלים שבץ איסכמי כוללים נפח בצקת במוח, גודל אוטם, היקף מחסום הדם - מוח (BBB) התמוטטות, וליקוי תפקודי בדרך כלל מוערך באמצעות ציון חומרתנוירולוגית 2.
טכניקת אינדוקציה שבץ הנפוץ ביותר במודלים מכרסמים חסום את עורק המוח האמצעי (MCA) באופן ארעי אולצמיתות 3. טכניקה זו מייצרת מודל שבץ דומה לאלה בבני אדם: יש לו penumbra המקיפה את האזור ליטף, הוא מאוד לשחזור, ומווסת תדיר איסכמיה משך reperfusion4. אף על פי כן, שיטת MCAO יש כמה סיבוכים. הטכניקה נוטה דימום תוך גולגולתי ופציעה ברשתית ipsilateral עם תפקוד לקוי של קליפת המוח החזותית היפרתרמיה נפוצה כי לעתים קרובות להוביללתוצאות נוספות 5,,6,7. מגבלות אחרות כוללות וריאציות גבוהות בשבץ המושרה (הנובע מההרחבה הסבירה של איסכמיה לאזורים לא מכוונים, כמו אזור העורק הראשי החיצוני), חסימה לא מספקת של MCA, וperperfusion מוקדם. כמו כן, חולדות של זנים וגדלים שונים להפגין כרכים אוטםשונים 8. בנוסף לכל החסרונות שהוזכרו, מודל MCAO לא יכול לגרום לשבץ מבודד קטן באזורים במוח עמוק, כי זה מוגבל מבחינה טכנית מבחינת הדרישה של גודל כלי מינימלי לצנתור. זה הופך את הצורך במודל חלופי ליותר קריטי. שיטה אחרת, photothrombosis, מספק חלופה אפשרית הליכי MCAO אבל לא לשפר את היעילות9. טכניקה זו מתמקדת שבץ עם אור ומציעה כמה שיפורים על הדגמים הקודמים. עם זאת, photothrombosis דורש פתיחת גולגולת פולשנית הקשורה compications משני9.
לאור החסרונות המתוארים, הפרוטוקול המוצג כאן מספק טכניקת לייזר חלופית מסוגלת לגרום פגיעה מוחית מכרסמים. מנגנון הפעולה של טכניקת הלייזר מבוסס על ההשפעות הפוטותרמיות של הלייזר המחקפות ברקמות חיות, מה שמוביל לספיגת קרני אור על ידי רקמות הגוף והמרה שלהן לחום. היתרונות של שימוש טכניקת לייזר הם הבטיחות שלה וקלות מניפולציה. היכולת של לייזר לייצר חום כדי להפסיק את הדימום עושה את זה חשוב מאוד ברפואה, בעוד היכולת שלה להגביר את הקורות השונות בנקודת מפגש נתון מבטיח כי לייזרים להימנע להרוס רקמות בריאות שעומד בדרך של נקודת היעד10. קרן הלייזר המשמשת בפרוטוקול זה יכולה לעבור דרך מדיום נוזלי נמוך, כגון עצם, מבלי לפלוט את האנרגיה שלה ו/או לגרום להרס ים. ברגע שהוא מגיע למדיום נוזלי גבוה, כגון רקמות המוח, הוא משתמש באנרגיה שלו כדי להרוס את רקמות היעד. הטכניקה, לכן, יכולה לגרום פגיעה מוחית רק באזור המתאים של המוח.
הטכניקה שהוצגה כאן הראתה כמות עצומה של יכולת לווסת את רמות ההקרינה שלה, ויצרה את הווריאציות הנבחרות של פגיעה מוחית שנועדה מההתחלה. שלא כמו MCAO המקורי המשפיע הן קליפת המוח סטריאטום, טכניקת הלייזר הצליח לווסת את ההשפעה של פגיעה מוחית, גורם לפציעה רק על קליפת המוח המוטורית המיועדת. בכאן, פרוטוקול פגיעה מוחית המושרה בלייזר וסיכום של תוצאות מייצגות עבור ההליך המבוצע על קליפת המוח של חולדות מסופקים.
Protocol
ההליך הבא נערך על פי הנחיות השימוש בבעלי חיים ניסיוניים של הקהילה האירופית. הניסויים אושרו גם על ידי הוועדה לטיפול בבעלי חיים באוניברסיטת בן-גוריון בנגב.
1. בחירת בעלי חיים והכנה
- בחר 65 חולדות ספראג-דאולי זכר במשקל 300 כדי 350 גרם ללא פתולוגיה פעולה להליך זה. הגודל הקטן יותר מציב קשיים טכניים עבור הליך MCAO.
- להקצות 3 חולדות לכל כלוב ולתת להם להסתגל לפחות 3 ימים.
2. הליך MCAO
- בחר 25 חולדות עבור MCAO המאפשרות תמותה של 10%-20% הקשורות להליך11.
- בצע MCAO באמצעות טכניקה סטנדרטית, כפי שתואר קודם לכן בפירוט12.
3. הליך ניסיוני של פגיעה מוחית בלייזר
- הקצה 20 חולדות לקבוצה המסומנת כקבוצה לייזר ו-20 חולדות לקבוצת בקרה אחרת (המופעלת על-ידי sham).
- לתדרך הבאה לחוות את חולדות קבוצת הלייזר להקרן points לייזר ב-50J X 10 נקודות:
- חולדה מברינה עם תערובת של 2% isoflurane בחמצן המאפשר אוורור ספונטני. בדוק עומק הרדמה מספיק על ידי צביטת הזנב עם מפלצות כדי לראות את היעדר רפלקס הנסיגה.
- לשמור על טמפרטורת הגוף הליבה של העכברוש ב 37 מעלות צלזיוס לאורך כל ההליך הניסיוני באמצעות משטח חימום מוסדר בטמפרטורה פי הטבעת.
- מסירים את השיער המקומי עם גילוח ומחטאים עם 70% אלכוהול ו-0.5% גלוקונאט כלורקסידין. חזור על שלב החיטוי עוד פעמיים.
הערה: גודל החתך הכירורגי צריך להיות כ-3 ס"מ. הסר את השיער לפחות 2 ס"מ סביב אזור החתך. - מניחים את החולדה על מחזיק ראש סטריאוטקסי בתנוחה נוטה ונעשה חתך של 3 ס"מ כדי לשקף את הקרקפת לרוחב ולחשוף את האזור בין ברגמה למבדה.
- שמור על הרדמה דרך קונוס האף.
- השתמש Neodymium-YAG (Nd-YAG) לייזר (אורך גל שיא 1064 nm) כדי לנהל 50J X 10 pointsנקודות , עם משך דופק 1 s, לאזור החשוף של הגולגולת מעל חצי הכדור הימני.
- ודא כי חלק יצירת הלייזר של ההתנעה הוא במרחק של 2 מ"מ מהאזור החשוף כדי לייצר קרן לייזר. 50J X 10 נקודות נבחר לאחר הערכה קפדנית של שילובי אנרגיה / משטח שונים. שילוב זה יעיל ואינו גורם להרס העצם של הגולגולת לאחר ניהול עבור פחות מ10 שני.
הערה: 2 מ"מ הוא המרחק בין המסוף של קרן הלייזר (מהכבלים האופטיים שהוא עובר דרכו) לבין עצם הגולגולת. במקרה של שימוש בעדשת מיקוד, יש לחשב את המרחק תוך מתן בחשבון את זווית הנטייה של העדשה למקד את הקרן באזור הרצוי של נזק. הבטח בטיחות נאותה בעת שימוש בהתקן לייזר הכולל אימון מתאים והגנה על העיניים. - הסר את העכברוש מהמכשיר וסגור את הקרקפת עם תפרים כירורגיים משי 3-0.
- להפסיק את ההרדמה ולהחזיר את העכברוש לכלוב שלה להחלמה. לתת 0.1 מ"ל של 0.25% bupivacaine באופן מקומי כדי להפחית את הכאב לאחר הניתוח מיד לאחר הניתוח.
הערה: ההליך כולו צריך להימשך פחות מ- 5 דקות אם בוצע כראוי.
- שימו לב לעכברוש אחר סימני מצוקה במהלך ההחלמה לאחר ההרדמה. לפני הופעת הרדמה, לתת 0.01 מ ג/ק"ג buprenorphine תוך שרירי עבור משכך כאבים לאחר הניתוח ולהמשיך עם מינונים חוזרים כל 12 שעות לפחות 48 שעות.
- חולדות בקרת נושאים לאותם תנאים מבלי לחשוף אותם ללייזר.
4. ציון חומרת נוירולוגית (NSS)
- להעריך את ציון חומרת נוירולוגית 24 שעות לאחר פגיעה מוחית המושרה בלייזר באמצעות ציון 43 נקודות13. בדוק את בעלי החיים עבור ליקויים נוירולוגיים, הפרעות התנהגות, משימת איזון קרן, רפלקסים, הקצאת ציונים גבוהים יותר עבור מוגבלויות חמורות יותר, כפישפורט בעבר 13.
5. מניפולציות לאחר פציעה
- לאחר הערכת NSS, המתת חסד החולדות על ידי חשיפתם 20% חמצן ו 80% CO2 (באמצעות השראה) ו transcardial להסתנן החולדה עם תמיסת מלח פוספט heparinized (PBS, 0.9% NaCl).
הערה: ודא ש-CO2 מועבר בשיעור קבוע מראש בהתאם להנחיות הוועדה המוסדית לטיפול בבעלי חיים ולשימוש. צעד זה יכול להתבצע גם תחת 5% הרדמה isoflurane. - קציר מוחות ולהתכונן לבדיקה נוספת כמתואר בפרוטוקולמוקדם יותר 11.
- להעריך דימום subarachnoid (SAH) באמצעות בדיקה חזותית של המוח כולו לאחר הבידוד שלו מהגולגולת. במידת הצורך, ניתן להשתמש במיקרוסקופ או במשקפיים מגדילים למטרה זו.
6. הערכת פגיעה מוחית
-
קביעת נפח אוטם המוח ו בצקת במוח על ידי כתם TTC
הערה: 2,3,5-Triphenyltetrazolium כלוריד (TTC) כתמימה הוא הליך נוח לזיהוי אוטם המוח11.- חותכים את המוח שנקטפו ל-6 פרוסות קורונאל, כל אחת בעובי 2 מ"מ.
- דגירה את הסט של פרוסות מכל מוח במשך 30 דקות ב 37 ° C ב 0.05% TTC.
- לאחר הכתמים, סרוק את הפרוסות באמצעות סורק אופטי ברזולוציה של 1600 X 1600 dpi.
- האזורים הלא מוכתמים של פרוסות המוח הקבועות מוגדרים כאוטם12.
- באמצעות תוכנת עיבוד תמונה (למשל, freeware Image J)מודדים את האזור הלא מוכתם, ipsi- וההמיספרות ההמיספרות ההתפלה עבור כל אחת מ-6 פרוסות הקורונה.
- חשב את נפח האחסון האוטם כאחוז מהמוח הכולל:
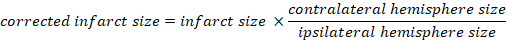
- חשב בצקת מוחית בשיטת קפלן:
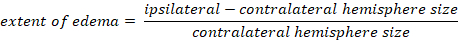
-
קביעת היקף מחסום דם המוח (BBB) שבירה
הערה: להעריך BBB שבירה 24 שעות לאחר פגיעה מוחית המושרה בלייזר כדלקמן:- לנהל 2% אוונס כחול מעורבב עם 4 מ"ל/ ק"ג תמיסת מלח דרך הוורוד לחולדות דרך וירק הזנב הסורר ולאפשר את הפתרון לזרום במשך 1 שעות.
- המתת דם חולדות על ידי חשיפתם 20% חמצן ו 80% CO2 (באמצעות השראה) 24 שעות לאחר NSS האחרון, כפי שתוארקודם לכן 13.
- לקצור את הצבע intravascularularulars מותאם באופן הבא:
- פתח את החזה של החולדות עם סיכות כירורגיות ומספריים כירורגיים.
- להסתנן בעלי החיים עם תמיסת מלח מקורר 0.9% דרך החדר השמאלי באמצעות 110 mmHg עד לקבלת נוזל נוזל נוזל חסר צבע מן האטריום הימני.
- קוצרים את המוח וחותכים אותם בדרך ל-2 מ"מ פרוסות.
- הפרד את פרוסות המוח השמאלי מהחלקים הימניים כדי להעריך חצי כדור הארץ פצוע ולא פצוע בנפרד.
- לשקול, homogenize באמצעות מרגמה ועלי, ולאחר מכן דגירה את רקמות המוח ב 50% חומצה טריכלורואצטית במשך 24 שעות.
- צנטריפוגה המוח הומוגני פרוסות ב 10,000 × g במשך 20 דקות.
- לערבב 1 מ"ל של supernatant מהמוח הצנטריפוג עם 1.5 מ"ל של 96% אתנול ב 1:3 ולהעריך שבירה מחסום דם - מוח באמצעות גלאי פלואורסצנטי ב 620 צפון מערב אורך גל (10 צפון שנייה רוחב פס) ו 680 צפון השנייה פליטת גל (10 רוחב פס 10 צפון).
הערה: שתי קבוצות החולדות עוברות את אותו פרוטוקול לקביעת פירוט BBB.
תוצאות
לא נרשמו מקרי מוות או SAH בקבוצות הבקרה או הניסיוניות(טבלה 1). לקבוצת MCAO היה שיעור של 20% של תמותה וSAH.
השינויים היחסיים בטמפרטורת הגוף בחולדות של שתי הקבוצות היו דומים גם הם, למרות הבדל בשונות של שתי הקבוצות(טבלה 1).
היה NSS גרוע יותר באופן משמעותי ?...
Discussion
זה הוגן להניח כי טכניקת הלייזר היא פולשנית מינימלית, בהתחשב בכך שלא מקרי מוות או SAH התרחשו בקבוצת הלייזר. סיבת המוות העיקרית וSAH הוא הנזק לכלי הדם שמוביל לעלייה של לחץ תוך גולגולתי (ICP), כפי שמצג בטכניקות MCAOהמקוריות 10. היעדר מוות וSAH בקבוצת הלייזר הוא כנראה בשל ההשפעות הספציפיות ?...
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
ברצוננו להודות למחלקה להרדמה של המרכז הרפואי של אוניברסיטת סורוקה וללל צוות המעבדה של אוניברסיטת בן-גוריון בנגב על עזרתם בביצוע ניסוי זה.
Materials
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
References
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved