Method Article
זיהוי אנשי קשר של משפר-יזם ב Embryoid גופים על-ידי לכידת כרומוזום קונפורמציה כמותית (4C)
In This Article
Summary
אנו מדווחים על היישום של לכידת כרומוזום קונפורמציה כמותי ואחריו רצף תפוקה גבוהה בגופים embryoid שנוצרו בתאי גזע עובריים. טכניקה זו מאפשרת לזהות ולכמת את אנשי הקשר בין משפרי ואזורים היזם של גן נתון במהלך הבידול תא גזע עובריים.
Abstract
במהלך התפתחות היונקים, גורלות התאים נקבעים באמצעות הקמת רשתות רגולטוריות המגדירות את הפירוט, התזמון ודפוסי המרחב של הביטוי הגנטי. Embryoid גופים (בס) נגזר בתאי גזע פלאוריטי כבר מודל פופולרי ללמוד את הבידול של שלושת החיידקים העיקריים שלוש להגדיר מעגלים הרגולציה במהלך מפרט הגורל התא. למרות שידוע כי משפרי רקמות ספציפיות לשחק תפקיד חשוב ברשתות אלה על ידי אינטראקציה עם יזמים, הקצאת אותם גנים היעד הרלוונטיים שלהם עדיין נשאר מאתגרת. כדי להפוך את זה לאפשרי, גישות כמותיים נדרשות כדי ללמוד אנשי קשר של משפר-יזם והדינמיקה שלהם במהלך הפיתוח. כאן, הותאמו שיטת 4c כדי להגדיר משפרי ואנשי הקשר שלהם עם היזמים קנצוני במודל בידול EB. השיטה משתמשת בתדירות גבוהה לחיתוך אנזימים הגבלה, sonication, ופרוטוקול בתיווך מקונן-PCR התואם לערכות הכנה לספריות DNA מסחריות. לאחר מכן, ספריות 4C נתונים ברצף תפוקה גבוהה ומנותח ביולוגי, המאפשר זיהוי וכימות של כל הרצפים שיש להם קשרים עם מקדם נבחר. ניתן גם להשתמש בנתוני הרצף המתקבל לקבלת מידע אודות הדינמיקה של אנשי קשר של משפר-יזם במהלך בידול. הטכניקה המתוארת עבור מודל בידול EB קל ליישום.
Introduction
בעכברים, מסת התא הפנימי (ICM) של עוברי 3.5-יום בן מכיל תאי גזע מעובריים מתחלקים. ICM מתפתח עוד לתוך אפיפיצוץ ביום 4.5, הפקת עור, מזועור, ותאי עור אנדובית, שלוש שכבות הנבט הראשי בעובר. למרות התאים החזקים pluripotent ICM קיימים רק בvivo, הם יכולים להיות שנתפסו בתרבות על ידי הקמת תאים גזע עובריים של העכבר (mESCs)1,2,3. MESCs להישאר במצב מובחן מתרבים ללא הגבלת זמן, עדיין על גירויים פנימיים וחיצוניים הם גם מסוגלים לצאת המדינה pluripotency וליצור תאים של שלוש שכבות הנבט ההתפתחותי2,4. מעניין, כאשר תרבותי בהשעיה של טיפות קטנות, mESCs טופס שלוש מימדי (כלומר, בס) כי להבדיל בין שלוש שכבות הנבט5. שיטת היווצרות EB היא כלי חשוב לחקר התהליך המוקדם של מפרט השושלת.
במהלך מפרט השושלת, התאים של כל שכבת נבט לרכוש מסוים ביטוי גנים התוכנית4. הביטוי הזמני המדויק של הגנים מוסדר על ידי רכיבי cis-רגולטוריות שונים, כולל היזמים הליבה, משפרי, משתיקי, ומבודד בידוד6,7,8,9. משפרי, מקטעי ה-DNA רגולציה בדרך כלל פורש כמה מאות זוגות בסיס, קואורדינטות ביטוי גנטי ספציפי לרקמות8. משפרי הפעלה או מושתקים באמצעות קשירה של גורמי שעתוק וקופנים המסדירים את מבנה הכרוטין המקומי8,10. טכניקות בשימוש נפוץ כדי לזהות משפרי באמצעות הגנום כרומטין immunoprecipitation ואחריו ברצף (שבב-seq) ואת הערך עבור כרומטוטין נגיש באמצעות רצף (ATAC-seq) טכניקות. לפיכך, משפרי פעילים מאופיינים בסימני היסטון מסוימים, על ידי הגדלת הנגישות המקומית DNA11,12,13,14. בנוסף לכך, משפרי התפתחותיות מחייבות אינטראקציה פיזית עם היזם קנצוני שלהם8,9. אכן, זה הוכח כי שיפור משתנים ומחיקות אשר משבש את הקשר משפר-יזם יכול להוביל מומים התפתחותיים15. לכן, יש צורך בטכניקות הרומן המספקות מידע נוסף לזיהוי משפרי תפקוד השולטים בביטוי הגן ההתפתחותי.
מאז התפתחות של לכידת כרומוזום היווצרות (3C) שיטה16, מיפוי של אנשי קשר כרומוזומים נעשה שימוש אינטנסיבי כדי להעריך את המרחק הפיזי בין אלמנטים הרגולציה. חשוב מאוד, גרסאות תפוקה גבוהה של טכניקות 3C פותחו לאחרונה, מתן אסטרטגיות שונות לקיבוע, עיכול, התקשרות, והתאוששות של אנשי קשר בין שברי כרומטין17. ביניהם, באתרו ההיי-C הפך טכניקה פופולרית המאפשרת רצף של 3C מוצרים הקשור הגנום-רחב18. עם זאת, עלויות הרצף הגבוה הדרושות כדי להגיע לרזולוציה המתאימה לניתוח של משפר ומקדם הקשר הופך טכניקה זו מעשית לחקר הבית המסוים. לכן פותחו שיטות אלטרנטיביות לניתוח המקום המיועד ברזולוציה גבוהה יותר19,20,21,22. אחת מהשיטות הללו, כלומר 4C, הידועה כאחת לעומת כל האסטרטגיה, מאפשרת זיהוי של כל הרצפים לפנות לאתר שנבחר כנקודת המבט. עם זאת, חיסרון של הטכניקה הסטנדרטית 4C הוא ה-PCR ההופכי הנדרש, אשר מגביר שברים בגודל שונה, העדפה מוצרים קטנים וכימות ממתח לאחר רצף התפוקה הגבוהה. לאחרונה, UMI-4C, גרסה חדשה של הטכניקה 4C באמצעות מזהים מולקולריים ייחודיים (UMI) פותחה עבור כמותית וממוקדת ממוקד הפרופיל קשר שחוסם את הבעיה23. גישה זו משתמשת בחותכי תכופים, sonication, ובפרוטוקול הפצה מקוננת-PCR, ובכך מעורבים הגברה של שברי דנ א עם הפצת אורך אחיד יחסית. הומוגניות מפחיתה את הביסים בתהליך הגברה של העדפות ה-PCR לרצפים קצרים יותר ומאפשרת החלמה יעילה וספירה מדויקת של מולקולות/קטעים המחוברים באופן מדויק.
כאן אנו מתארים פרוטוקול אשר מתאים את טכניקת UMI-4C כדי לזהות ולכמת את הקשר בין היזמים ומשפרי השושלת האלף לימודיים שעתוק גורמים במהלך בידול EB.
Protocol
1. Embryoid דור הגוף מתאי גזע מתחלקים בעכבר
- הכינו מדיום לשנת התרבות ללא סרום: Dמאמ/F12 ו מדיום neurobasal סיס מעורב ביחס של 1:1. בינונית התרבות היא בתוספת הפתרון חומצות אמינו שאינן חיוניות (1x), נתרן פירובט (1 מ"מ), L-גלוטמין (2 מ"מ), פניצילין-סטרפטומיצין (100 U/mL), בטא-mercaptoethanol (50 μM), N2 ו B27 תוספי מזון (1x), PD0325901 (1 μM), CHIR99021 (3 μM), ומקדם לוקמיה מעכבות (ה1,000 U/mL).
- להכין בינוני EB בינונית: DMEM בתוספת עם 10% סרום העוברי (FBS), חומצות אמינו לא חיוניות (1x), נתרן פירובט (1 מ מ"מ), L-גלוטמין (2 מ"מ), פניצילין-סטרפטומיצין (100 U/mL), בטא-mercaptoethanol (50 μM).
- תרבות mESCs על 10 ס מ מנות פלסטיק מצופה מראש עם 0.1% (w/v) ג'לטין ב-mESC התרבות סרום-מדיום חינם.
- כאשר mESCs להגיע 60% השטף, להסיר בינוני התרבות ולשטוף בעדינות 1x עם 2 מ ל של PBS מעוקר.
- הוצא את PBS לחלוטין והוסף 2 מ"ל של מדיום ניתוק תאים. מודחת את קערת התרבות ב 37 ° c עבור 5 דקות.
- הפוך את התגובה על ידי הוספת 8 מ ל של בידול EB בינוני לתוך המנה.
- השעיית מושבות mESC ידי ליטוף למעלה ולמטה 15-20 פעמים כדי לקבל השעיה תא יחיד.
- צנטריפוגה את התאים בשעה 300 x g בטמפרטורת החדר (RT) עבור 5 דקות ובזהירות להסיר את supernatant.
- ספירת תאים (למשל, באמצעות הומוציטוטומטר).
- להשעות מחדש את הגלולה תא עם בידול EB בינוני ולהתאים את הריכוז 2 x 104 תאים/mL.
- היפוך המכסה של הצלחת 15 ס מ התרבות ולהשתמש בצנרת 200 μL רב-ערוצי להפקיד 20 μL טיפות של תאים מושעה (~ 400 תאים/טיפה) על המכסה.
- היפוך המכסה בזהירות על החדר התחתון ומודחת הצלחת עם טיפות תלויות ב 37 ° צ' עם 5% CO2 ו 95% לחות עבור 3 ימים.
- לאסוף את הבס על ידי שטיפת המכסה בעדינות עם 10 מ ל של PBS ולהעביר את ההשעיה המכילה EB לצינור פלסטיק 50 mL.
- מניחים את הצינור ב RT עבור 30 דקות, כך בס יהיה לשקוע לתחתית על ידי כוח הכבידה. הסר בזהירות את הסופרנטאנט.
- השהה את הבס מחדש בעדינות עם 10 מ ל של בינוני חדש EB והעבר לצלחת פטרי בקטיולוגי בגודל 10 ס מ.
- בדוק את היווצרות EB 3-6 ימים מאוחר יותר באמצעות מיקרוסקופ הפוך. שנוצר בס צריך להיות עגול והומוגנית בגודל.
- מודטה את התרבויות ב 37 ° צ' עם 5% CO2 ו 95% לחות. בס תמשיך להבדיל בין שלוש שכבות הנבט ניתן לאסוף בנקודות זמן שונות לניתוח.
2. דיסוציאציה של בס
- לאסוף את הבס מ 2 כדי 3 10 ס"מ מנות לתוך צינור פלסטיק 50 mL. צנטריפוגה את הבס ב 300 x g ב RT עבור 5 דקות, ולאחר מכן הסר בזהירות את הסופרנטאנט.
- השהה את הבס מחדש. עם 10 מ ל של הערוץ צנטריפוגה בס ב 300 x g ב RT עבור 3 דקות ולהסיר את supernatant.
- הוסף 2 מ ל טריפסין-אדטה (0.25%) אל הגלולה ואת הרכבת התחתית ב 37 ° c עבור 15 דקות. פיפטה למעלה ולמטה כל 3 דקות כדי לקבל השעיה תא יחיד.
- הוסף 8 מ ל של בידול EB בינוני כדי לעצור את התגובה טריפסין. בדוק דיסוציאציה של EB מתחת למיקרוסקופ ולספור את התאים.
3. קיבעון
- השהה מחדש את התאים במדיום תרבותי בגודל EB ב-1 x 106 תאים/mL. עבור שפופרת 50 mL, להשתמש במקסימום של 4.5 x 107 תאים ב 45 mL של בינוני.
- הוסף פאראפורמלדהיד ממלאי 37% (לא מעל גיל 6 חודשים) עד 1% ריכוז סופי.
התראה: פעל בהתאם לתקנות הבריאות והבטיחות המתאימות תוך טיפול בפרפורמלדהיד כחומר כימי מסוכן. - דגירה עבור 10 דקות ב RT תחת סיבוב.
- כיבוי פורמלדהיד על ידי הוספת גליצין לריכוז הסופי של 0.125 M.
- דגירה עבור 5 דקות ב RT תחת סיבוב.
- העבירו את התאים הקבועים לקרח ושמרו על קור ב -4 ° c מעתה והלאה.
- גלולה את התאים ב 300 x g עבור 5 דקות בצנטריפוגה בקירור.
- להיפטר supernatant ולהשעות את הגלולה ב-PBS קר (1 mL עבור 5 x 106 תאים), ולאחר מכן להעביר ל 1.5 mL בטוח לנעול צינורות.
- מצנלת את התאים ב-300 x g עבור 5 דקות ב -4 ° c, למחוק את הסופרנטאנט, ולהצמיד להקפיא את כדורי בחנקן נוזלי. חנות at-80 ° צ' או להמשיך עם הפרוטוקול למטה.
4. הליזה תא ותקציר אנזים הגבלה
- בעדינות להשעות מחדש את הגלולה התא ב 0.25 מ ל של מאגר לפירוק טרי קרח קר מוכן (10 מ"מ טריס-HCl pH = 8.0, 10 מ"מ הנאל, 0.2% Igepal CA630, ו-1x מעכבי פרוטאז) לכל 2-5 x 106 תאים. להכנת 5 מ ל של מאגר הליזה, ראו טבלה 1.
- מודקון את התאים במשך 15 דקות על הקרח.
- צנטריפוגה ב 1,000 x g עבור 5 דקות ב 4 ° c. השמט את הסופרנטאנט ושמור את הגלולה, המכילה את הגרעינים.
- רוחצים את גרעיני הפלטד עם 500 μL של מאגר לפירוק קר.
- בעדינות להשעות את הגלולה בצינור 1.5 mL עם 50 μL של 0.5% SDS ב-1x מאגר 2, ולאחר מכן מארג את הצינור בבלוק חימום ב 62 ° c עבור 10 דקות.
- להסיר את הצינורות מבלוק החימום ולהוסיף 170 μL של מאגר העיכול המכיל 25 μL של 10% טריטון X-100 כדי להרוות את ה-SDS. מערבבים היטב על ידי ליטוף, הימנעות קצף מוגזם.
- מודקון ב 37 ° c עבור 15 דקות.
- הוסף 25 μL של מאגר העיכול, לערבב על ידי היפוך, ולקחת 8 μL כפקד בלתי מתעכל. שמור את דגימת הבקרה שאינה מתעכל ב-20 ° c. הוסף 100 U MboI הגבלה אנזים (4 μL של 25 U/μL מלאי) לגרעינים הנותרים ולעכל את כרומטין עבור 2 h ב 37 ° c תחת סיבוב. הוסף עוד סדרת מחלקים של 100 U של mboi ו הדגירה עבור 2 h נוספים.
- הוסף עוד 100 U של MboI ו-מודטה תחת סיבוב לילה ב 37 ° c.
- למחרת, להוסיף עוד 100 U של MboI ו הדגירה עבור 3 h ב 37 ° c תחת סיבוב.
- לקחת 8 μL כמדגם שליטה מתעכל. דה-crosslink דגימות בקרה מתעכל ואת דגימות שליטה בלתי מתעכל משלב 4.8 על ידי הוספת 80 μL של מאגר TE (10 מ"מ Tris pH = 8, 1 מ"מ EDTA) ו 10 μL של הפרוטאינאז K (10 מ"ג/mL). מודטה ב 65 ° c בשביל 1 h.
- הפעל 20 μL ל-0.6% ג'ל כדי לבדוק את יעילות העיכול. מעכל מוצלחת מציגים בעיקר שברים בטווח 3.0-0.5 kb.
5. ביטול קירבה והיפוך הקשר מרובי
- מודלת את הדגימות mboi מתעכל ב 65 ° c בבלוק חימום עבור 20 דקות כדי להפעיל MboI ואז קריר כדי RT.
- צנטריפוגה את הצינורות עבור 5 דקות ב 1,000 x g ב RT, הסר את supernatant, ולפזר את הגלולה ב 200 μl של מאגר ליגאז טרי.
- הוסף 1,000 μL של מיקס תבנית בסיס לשניה לכל דוגמה. להכנת 1,000 μL של המיקס הראשי של ה, ראו טבלה 2.
- מערבבים על ידי היפוך ו-דגירה ב RT לילה עם סיבוב איטי (9 סל ד).
- לחסל RNA ומשקעים חלבון על ידי הוספת 100 μL של פרוטטינואז K (10 מ"ג/mL) ו 10 μL של RNase A (10 מ"ג/mL). מודטה דגימות ב 55 ° c עבור 45-60 דקות.
- המשיכו בדגימות הדגירה ב-65 ° c תמורת 4 מעלות נוספים.
6. הטיית דנ א ובחירת גודל
- צינורות מגניב ל RT.
- צנטריפוגה עבור 5 דקות ב 1,000 x g ב 4 ° c.
- לפצל את המדגם לתוך 3 400 μL ali, 2 מנורות mL ולהוסיף 2 μL של הגליקוגן (20 מ"ג/m), 40 μL של נתרן אצטט (3 M, pH = 5.2), ו 2.5 x אמצעי אחסון (1 mL) של 100% אתנול לכל צינור. מערבבים על ידי היפוך ו-דגירה ב-80 ° c עבור 45-60 דקות.
- צנטריפוגה ב 16,000 x g ב 4 ° c עבור 25 דקות. לשמור על הצינורות על הקרח לאחר ספינינג ובזהירות להסיר את supernatant על ידי ליטוף.
- לשטוף את כדורי DNA ידי השעיית מחדש ב 800 μL של 70% אתנול. צנטריפוגה ב 16,000 x g ב 4 ° צ' עבור 5 דקות.
- הסר את supernatant ולבצע את הכביסה פעם נוספת עם 800 μL של 70% אתנול.
- לפזר את הגלולה ב 130 μL של מאגר 1 x טריס (10 מ"מ טריס-HCl, pH = 8) ו דגירה ב 37 ° צ' עבור 15 דקות כדי לפזר במלואו את ה-DNA. במקרה הצורך, השתמשו באמצעות מלטף כדי להשהות מחדש את כל הזרז.
- למדוד את התשואה DNA; 2.5-5 μg של כרומטין ניתן לצפות עבור 1 x 106 תאים. בדוק את ההארכה על ידי הפעלת ± 200 ng של מוצר 3C על 0.6% agarose ג'ל. הלירות מוצלחות מציגות בעיקר שברי דנ א > 3 kb. יש לאחסן את הדגימות ב-20 ° c.
- לדלל מדגם בצינור 0.65 mL מתאים sonication עד 10 ng/μL ב 100 μL של נפח 1 x טריס מאגר (1 μg לכל שפופרת). הסכום הסטנדרטי המשמש להכנת הספריה הוא 3 μg, כך לבצע את sonication בשלוש צינורות נפרדים במידת הצורך.
- הטיה DNA לגודל של 150-700 bp (ממוצע = 400-500 bp) באמצעות הפרמטרים הבאים על sonicator: מחזורי: 6-8 של 20 s ב-60 s off. זה צריך להפוך את ה-DNA מתאים הכנה התפוקה גבוהה ברצף הכנת באמצעות נצנצים המאיר.
- העבר את הדנ א לצינור. המנעול הרגיל החדש בריכת sonications מרובים מאותה דוגמית.
- חמם בקבוק של חרוזים לטיהור DNA ב RT. מעתה והלאה, השתמש בתיאורי כריכה נמוכים.
- הוסף נפח 1.8 x של חרוזים לצינור ה-DNA והשהה מחדש בעדינות.
- דגירה ב RT עבור 5 דקות.
- לאסוף את החרוזים עם מתלה מגנטי. לשטוף את החרוזים 2x עם 1 מ ל של מוכן טרי 80% אתנול תוך שמירה על צינורות במדף המגנטי.
הערה: להסיר את כל אתנול, כולל טיפות שיורית. - לייבש את החרוזים בקצרה (2-3 דקות) ב RT.
הערה: אין חרוזים יבשים יותר מ 5 דקות. . זה יקטין את התשואה של הדי. אנ. איי - להשעות מחדש את החרוזים עם 90 μL של 1x מאגר טריס (10 מ ל טריס-HCl, pH = 8) כדי elute DNA.
- למדוד את התשואה DNA ולנתח 5 μl הסדרת מחלקים ב 1.5% ג'ל. צריך להיות מעט מאוד אובדן בהשוואה לתשואה הpresonication.
7. הכנת הספרייה לרצף
- הוסף 15 μL של תערובת בסיס מערכת ההכנה של הספריה. כדי לתקן את הקצוות של ה-DNA שלבו, לשלב 10 μL של 10 x קצה התגובה תיקון מאגר ו 5 μL של תיקון סוף האנזים לערבב.
- דגירה ב RT עבור 30 דקות
- הוסף 1.1 x נפח של חרוזים לטיהור DNA ולהשעות מחדש בעדינות.
- דגירה ב RT עבור 5 דקות.
- לאסוף את החרוזים עם מתלה מגנטי. שטוף את החרוזים פעמיים עם 1 מ ל של האתנול הטרי 80%, תוך שמירה על צינורות במדף המגנטי. . הסירי אתנול
- האוויר יבש את החרוזים עבור 2-3 דקות ב RT. מחדש את החרוזים עם 42 μL של 1 x טריס מאגר (10 מ ל טריס-HCl, pH = 8) כדי elute DNA.
- הוסף 8 μL של מיקס תבנית בסיס של dA-למעקב לכל מדגם. כדי להכין את התמהיל הראשי dA-לעקוב, לשלב 5 μl של מאגר תגובה 10x dA-לעקוב ו 3 μl של Klenow הקטע מות מינוס.
- מודקון ב 37 ° c עבור 30 דקות.
- הוסף 2 μL מעיים עגל בסיסי פוספספטאז (CIP) כדי ליטול דנ א מאוחר.
- דגירה של 30 דקות ב 37 ° c, אז 60 דקות ב 50 ° c.
- הוסף 1.1 x כרכים של חרוזים לטיהור DNA ולהשעות מחדש בעדינות.
- דגירה ב RT עבור 5 דקות.
- לאסוף את החרוזים עם מתלה מגנטי. לשטוף את החרוזים 2x עם 1 מ ל של מוכן טרי 80% אתנול תוך שמירה על צינורות במדף המגנטי.
- האוויר יבש את החרוזים בקצרה (2-3 דקות) ב RT. השעיה מחדש עם 35 μL של 1 x תריס מאגר (10 מ"מ טריס-HCl, pH = 8) כדי elute DNA.
- בצע את תגובת המתאם. השתמש בריכוזי מתאם/ligase מופחתים כפי שהוזכר בטבלה 3.
- מודקון ב 20 ° c עבור 15 דקות.
- הוסף 3 μl של התערובת של אורציל dna גליסיקלז ו-dna הגליסיקלז lyase endonחכירה השביעי (למשל, משתמש) אנזים, מערבבים על ידי ליטוף, ו דגירה ב 37 ° c עבור 15 דקות.
- הגדל את עוצמת הקול ל 100 μL עם מים, מרתיחים 5 דקות ב 96 ° c, ולאחר מכן לשים דגימות על קרח.
- הוסף 1.1 x כרכים של חרוזים לטיהור DNA ולהשעות מחדש בעדינות.
- דגירה ב RT עבור 5 דקות.
- לאסוף את החרוזים עם מתלה מגנטי. לשטוף את החרוזים 2x עם 1 מ ל של מוכן טרי 80% אתנול תוך שמירה על צינורות במדף המגנטי.
- האוויר יבש את החרוזים עבור 2-3 דקות ב RT. מחדש את החרוזים עם 50 μL של 1 x טריס מאגר (10 מ ל טריס-HCl, pH = 8) כדי elute DNA.
8. הגברה וטיהור של ספריית כרומטין בספריה
- להגביר את הספרייה 4C באמצעות 10 μL של הספריה כדי לבצע את ה-PCR הראשון. ההתקנה והתוכנית של ה-PCR ניתן למצוא בטבלה 4.
- בצע PCR מקונן. הגדרת ה-PCR המקונן והתוכנית ניתן למצוא בטבלה 5.
- מוצרי ה-PCR של הבריכה עבור כל ספריה וטיהור באמצעות חרוזי ניקוי DNA של 1.1 x.
- למדוד תשואה DNA ולנתח 5 μl סדרת מחלקים ב 1.5% ג'ל.
- כוונן את הריכוז של הספריה וסדר את הספריה. אם באינדקס, ניתן ליצור במאגר הספריות לפני הרצף.
תוצאות
שישה ימים לאחר שקיבל את הבידול בטפטוף בטיפות התלויות, הצלחנו להשיג אוכלוסיה הומוגנית של בס ששימשו לניתוח נוסף (איור 1). התאמתי את UMI-4C שיטה23 לכמת האינטראקציה כרומטין ספציפית על היזמים של גנים ספציפיים היוחסין ב-בס24. סקירה סכמטית של הפרוטוקול עם ג'לים בקרת איכות מייצגים בשלבים שונים מוצגת באיור 2א. בקרת האיכות הראשונה בוצעה כדי לקבוע את היעילות של עיכול ההגבלה של MboI. עיכול יעיל הראה גודל קטע של פחות מ 3 kbp (איור 2ב). מתוך הערה, העיכול של mESC ו-EB היה קשה ולפעמים התעקש שרידי כרומטין לא מתעכלים. בקרת איכות שנייה בוצעה לאחר הארכה כדי לוודא כי רוב השברים היו כעת > 3 kbp (איור 2ב). ואז, שברי כרומטין שהתקבלו לאחר sonication נותחו על ידי ג'ל אלקטרופורזה. בגודלי מקטעים של 400-500 bp צפויים (איור 2ב').
לאחר הדרחון והארכה של מתאם חד-מימדי, שני סיבובים של ה-PCR בוצעו כדי להגביר את יעדי הריבית. גישה מקוננת שימש לעיצוב מערכת של שני צבעי יסוד לכל מקום. זה עזר לשפר את הספציפיות. כל יעד היה מוגבר בנפרד עם שני זוגות פריימר שונים כדי למטב את התנאים PCR (כלומר, למשל זוגות A ו-B עבור Pou5f1 לוקוס ופריימר זוגות C ו-D עבור T לוקוס, בהתאמה) והביא להכפיש DNA סביב 400 bp (איור 2ג). לחילופין, בוצע מולטיפלקס למטרה להגביר את המטרות A ו-C בו (איור 2ד) והביא לגודל קטע דומה לאחר הטיהור (איור 2ד). שימוש בתחל עבור הכנת הספרייה 4C ( הPou5f1 ו- T) ניתן למצוא בטבלה 6.
עבור ניתוח נתונים, קריאות רצף raw היושרים לראשונה נגד הגנום mm10 העכבר החדש, היו כפולים כולם, ואיכות נמוכה (< 20) קריאות הוסרו. עבור כל פיתיון, המידע על כל קטע מגבלה הושג על-ידי חישוב מספר קטעי הקריאה, והתקבל פרופיל איש קשר גולמי. לאחר מכן, אזור העניין הוגדר כמו כל שברי ההגבלה עם 2 kbp ו 250 kbp מרחק פיתיון. הגודל של כל קטע מגבלה הוגדל על-ידי צבירה של שברי ההגבלה הסמוכים ברציפות כדי להחליק את הפרופילים עד לסף של 5% מהמספר הכולל של אנשי הקשר הגולמיים הושגו באזור הריבית. כדי להבטיח שהמשכפל היו משולבים, והתנאים הושוו, כללנו את שני המדרונות וההודעות האקראיות ברמת ההגבלה. הפרופיל הממוצע לכל תנאי ושינוי הקיפול ביניהם הותווה כמוצג באיור 3. במהלך בידול EB, המגעים בין משפרי לבין המקדם של הגן הפלוריטוני Pou5f1 ירד, בעוד משפר-יזם המגעים של השושלת מעניקה שושלת היוחסין מקדם שעתוק לא גדל ( איור 3), מתן תובנות פונקציונליות על אלה משפרי התפתחותיות.
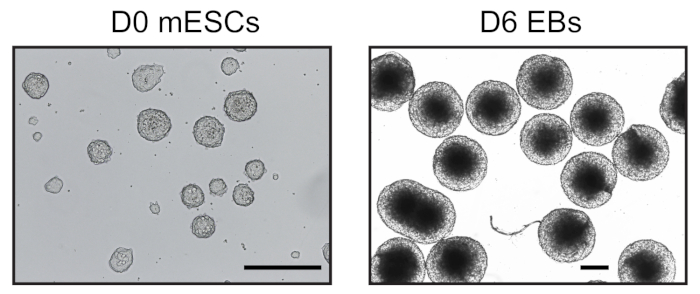
איור 1: דמויות מייצגות של מembryoid וגופים נגזרים. יום 0 mESC תרבותי בתנאים ללא סרום (משמאל) ויום הומוגנית 6 בס (מימין) נצפתה על ידי מיקרוסקופ הפוך. סרגל בקנה מידה = 500 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
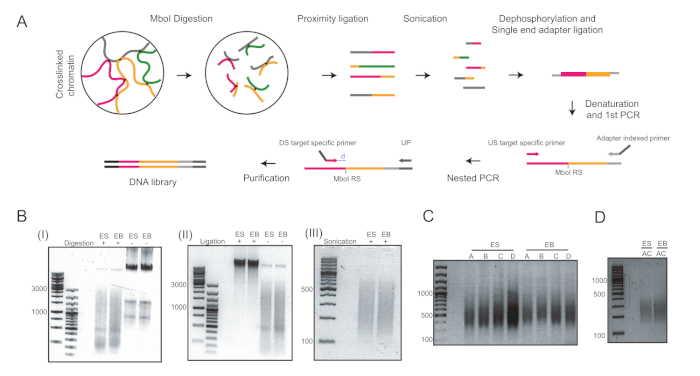
איור 2: זרימת עבודה של 4C ותמונות מייצגות של השלבים העיקריים של הפרוטוקול. (א) תהליך סכמטי של 4c כמותי. RS = אתר הגבלה; ארה ב = במעלה הזרם; ד. ש. במורד הזרם; למעלה = פריימר אוניברסלי; ד = המרחק בין RS ו-DS צריך להיות באופן אידיאלי 5-15 bp. (ב) דוגמאות של כרומטין מעוsonicated (I), ב-גרעינים כרומטין (II), וכרומטין (III). המספרים בצד שמאל מציינים את גדלי ה-DNA שנקבעים על-ידי סולם הדנ א עבור כל דוגמה. (ג) דוגמאות להגברה של ה-PCR בשני הבית: Pou5f1 (התחל A ו-B) ו- T (פריימר C ו-D). (ד) דוגמאות של הגברה של מולטיפלקס ב- Pou5f1 ו- T באמצעות תחל A ו-C. ES = תאי גזע עובריים; EB = גופים embryoid. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
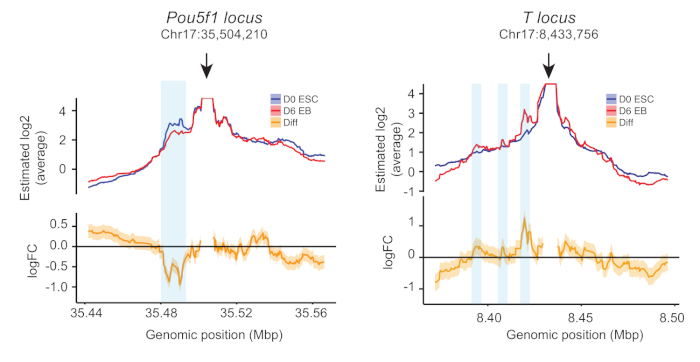
איור 3: דוגמאות לפרופילי 4C. פרופילי 4c כמותיים עבור פיתיונות ממוקם על Pou5f1 ו- T ג'ין היזמים בmESCs וביום 6 בס. הלוח העליון מציג חלקות של אנשי קשר ממוצעים שנוצרו משתי משכפל ביולוגי עצמאי; הפאנל התחתון מראה את השינוי הממוצע קיפול הקשר של יום 6 בס לעומת mESCs (ממוצע של שני משכפל). תיבות כחולות באור מציינות את מיקום התמשפרי עם שינויים דינאמיים במהלך הבידול. הדמות הותאמה מ טיאן ואח '24. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| עבור 5mL | |
| 1M טריס-HCl, pH 8.0 | 50 מיקרומטר |
| 5M הנאל | 10 מיקרומטר |
| 10% igepal CA630 | 100 מיקרומטר |
| 50x רושה להשלים מעכבי פרוטאז | 100 מיקרומטר |
| מים מיליש | 4.74 מ ל |
שולחן 1: מאגר לוליזיס.
| עבור 1000 μL | |
| מים מיליש | 869 מיקרומטר |
| מאגר ה-DNA של NEB ליגאוסה | 120 מיקרומטר |
| החלפת סרום | 6 מיקרומטר |
| 2000 U/μL T4-DNA ליגאוסה | 5 מיקרומטר |
שולחן 2: הכנה לערבב מיקס הורים.
| עבור 15 μL | |
| מאגר תגובות לריסוס מהיר של 5X | 10 מיקרומטר |
| מתאם נברהבא | 3 מיקרומטר |
| מהירות לימוד ה-DNA של T4 | 2 מיקרומטר |
שולחן 3: תגובת מתאם.
| התקנת ה-PCR | |
| מתאם לחיבור הספרייה-על-deads | 10 מיקרומטר |
| המים ברמה PCR | 20.25 מיקרומטר |
| 10 כוון למטרה | 3.75 מיקרומטר |
| המדד האוטומטי 10 מטרים למטה | 3.75 מיקרומטר |
| מאגר 5X הרקלז השני | 10 מיקרומטר |
| 10 ממ מ | 1.25 מיקרומטר |
| הרקלז השני פולימראז | 1 ליטר |
| נפח כולל | 50 מיקרומטר |
| תוכנית PCR | |
| שלב 1:98 ° c-2 דקות | |
| שלב 2:98 ° c-שנות ה -20 | |
| שלב 3:65 ° c-שנות ה -30 | |
| שלב 4:72 ° c-45s | |
| שלב 5: לעבור לשלב 2 כדי לבצע סך של 15-18 מחזורי | |
| שלב 6:72 ° c-3 דקות | |
| שלב 7:4 ° c – החזיקו |
שולחן 4: הגברה של הספרייה הראשונה של כרומטין.
| הגדרת PCR מקוננת | |
| רסיס של דנ א מה | 10 מיקרומטר |
| המים ברמה PCR | 20.25 מיקרומטר |
| 10 μM פריימר ספציפי + P5 הארה פריימר | 3.75 מיקרומטר |
| 10 μM P7 הארה פריימר | 3.75 מיקרומטר |
| מאגר 5X הרקלז השני | 10 מיקרומטר |
| 10 ממ מ | 1.25 מיקרומטר |
| הרקלז השני פולימראז | 1 ליטר |
| נפח כולל | 50 מיקרומטר |
| תוכנית PCR מקוננת | |
| שלב 1:98 ° c-2 דקות | |
| שלב 2:98 ° c-שנות ה -20 | |
| שלב 3:65 ° c-שנות ה -30 | |
| שלב 4:72 ° c-45s | |
| שלב 5: לעבור לשלב 2 כדי לבצע סך של 15-18 מחזורי | |
| שלב 6:72 ° c-3 דקות | |
| שלב 7:4 ° c – החזיקו |
שולחן 5: הגברה של הספרייה, ה-PCR המקונן.
| שם | רצף (5 '-3 ') |
| DS-Oct4-A | AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACG בעלי הגנה מפני הקאג |
| US-Oct4-A | מלון הנגיד הגותי |
| DS-Oct4-B | AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACG מוזיאון האחים לצ (CTCT) |
| US-Oct4-B | מיכל ברקת |
| מדים-T-C | AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACG CTCTTCCGATCTCCTGGGTCCCTGCACATTCGCCAAAGGAGC |
| ארה ב-T-C | GATTACACCTGGGTCCCTGCACATTCGCCAA |
| DS-T-D | AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACG ברוך ש, מיכל בגין |
| US-T-D | מלון ה, מיכל בגין |
| למעלה-4C | CAAGCAGAAGACGGCATACGA |
| Adap-i1 | CAAGCAGAAGACGGCATACGAGATCGTGATGTGACTGGAGTTCAGA מיכל שלמה |
| Adap-i2 | CAAGCAGAAGACGGCATACGAGATACATCGGTGACTGGAGTTCAGA מיכל שלמה |
| Adap-i3 | CAAGCAGAAGACGGCATACGAGATGCCTAAGTGACTGGAGTTCAGA מיכל שלמה |
| Adap-i4 | CAAGCAGAAGACGGCATACGAGATTGGTCAGTGACTGGAGTTCAGA מיכל שלמה |
שולחן 6: שימוש בתחל לקראת הכנת הספרייה 4C.
Discussion
שיטת שחרור תלוי התרבות אינה זקוקה לגורמי גדילה נוספים או ציטוקינים והוא מייצר אוכלוסיות הומוגנית של בס מ מספר קבוע מראש של mESCs5. כאן אנו מתארים פרוטוקול של 4C כמותי המותאם מהגישה UMI-4C כדי לכמת משפר את הקשר של השושלת שעתוק גורמים ספציפיים במודל בידול EB. זיהינו אזורי כרומטין שיצרו קשר עם היזמים של Pou5f1 ו- T גנים בצורה דינמית בזמן בידול EB. Pou5f1 היה מוסדר במהלך בידול EB ואת תדר הקשר בין היזם Pou5f1 ואת העצם המרוחק שלה ירד. לעומת זאת, T היה upregulated במהלך בידול EB וזיהינו שלושה משפרי אשר הקשר תדרים עם היזם שלהם הם ירדו (איור 3). כדי לאשר את הזיהוי, כרומטין immunoprecipitation (שבב) היצע של מארק היסטון פעיל H3K27ac ניתן לבצע24, כמו זה מארק היסטון הוכח להיות קשור עם הפעלת ומשפרי משפר לאבד את הסימון במהלך ההפעלה שלהם11.
טכניקת 4C סטנדרטית היתה בשימוש נרחב כדי לסקור את פרופיל הקשר של כרומטין של אתרים גנומית ספציפיים25. עם זאת, גישה זו קשה לפענוח כמותית גם לאחר נורמליזציה נרחבת26,27, 28 בגלל28 הביסים שהוצגו על ידי טרוגניות הגודל של ה-pcr והבלתי אפשרי להבחין בין PCR כפילויות. שיטת 4C כמותיים שלנו היא זהה במידה רבה לטכניקת UMI-4C המאפשרת כימות של מולקולות יחיד באמצעות sonication ו-מקונן-ליפעה מתווכת-PCR צעד כדי לעקוף את המגבלה של הגישה הקלאסית 4C23. עם זאת, בניגוד ל-UMI-4C המשתמשת במזהים מולקולריים ייחודיים, פרוטוקול 4C כמותי שלנו מאפשר את כימות המולקולות היחידות המבוססות על הפסקת ה-DNA הספציפית שמפיק השלב הsonication. זה הופך את הפרוטוקול שלנו תואם ערכות ה-DNA מסחרי הכנת הספריות, ברור את הצורך של התחל עם מזהים מולקולרית ייחודי.
הפרוטוקול שלנו כולל כמה צעדים מרכזיים שיש לשקול. כמו בשיטה 4C קלאסית28, גורמים קריטיים של הפרוטוקול שלנו הם היעילות של העיכול והארכה במהלך הכנת מולקולות 3c. העיכול הנמוך/יעילות החיבור יכול להקטין באופן דרמטי את המורכבות של האינטראקציה עם קטע של עניין, וכתוצאה מכך רזולוציה מופחתת. כפי שתוארה בעבר23, צעד קריטי נוסף של הפרוטוקול הוא עיצוב התחל של הגברה הספריה. במקום הראשון של תגובת ה-PCR יש למקם 5-15 nt מאתר ההגבלה שנחקר. לקריאה ברצף של 75 nt, הדבר מאפשר לפחות 40 nt שמאל של אורך הלכידה למיפוי. התחל בשימוש התגובה ה-PCR הראשון צריך להיות מעוצב במעלה הזרם של התחל השני עם חפיפה לא ושניהם צריכים להיות ספציפיים מספיק כדי להבטיח הגברה יעילה DNA. עבור ריבוב, התחל צריך להיות מתוכנן באופן עצמאי, מכוון טמפרטורת ההיתוך (Tm) של 60-65 ° c. יתר על כן, כמו עבור טכניקות 3C אחרות, הרזולוציה של שיטת 4C כמותית נקבעת על ידי אנזים ההגבלה המשמש בפרוטוקול25. פרוטוקול זה משתמש באנזים הגבלה עם אתר זיהוי של 4 bp, MboI. הרזולוציה המקסימלית עם אנזים זה הוא סביב 500 bp, אבל זה תלוי מאוד לוקוס ולעתים רחוקות מושגת. מגבלה נוספת היא שאינטראקציות המתרחשות בין רכיבים הממוקמים באותו קטע מגבלה אינן מזהות. בנוסף, אין אפשרות להבדיל בין אינטראקציות המתרחשות במרחק של אתר מגבלה אחד לבין הרקע שאינו מתעכל. השימוש בצעד מילוי לפני הארכה עשוי לאפשר זיהוי של אינטראקציות אלה.
4C כמותי מתאים באופן אידיאלי לחקור מגעים כרומטין של המיקום המיועד. עם זאת, צעד הגברה מסוים של ה-PCR מגביל את מספר המקום שניתן לחקור בו זמנית. דרך להגדיל את מספר המקום המיועד היא להתאים את שלבי ה-PCR כדי להגביר בו מספר מטרות, אבל זה דורש תאימות של התחל בשימוש ובדיקת כל זוג פריימר לפני היישום. אם השינויים הגלובליים של אדריכלות כרומטין על היזמים הם הרצויים, הגנום רחב גישות כגון היי-c, PC Hi-c, או hichip יהיה המתאים יותר29,30,31.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנחנו רוצים להודות ל ' לה דילי, ר. שטהודרס וחברי המעבדה של גראף על העצות והדיונים שלהם. G.S. היה נתמך על ידי מלגת מארי Sklodowska-קירי (H2020-מסקה-IF-2016, miRStem), T. V. T על ידי מלגת חואן דה לה Cierva (MINECO, FJCI-2014-22946). עבודה זו נתמכת על ידי מועצת המחקר האירופי תחת תכניתהמסגרת ה -7 FP7 (Erc סינרגיה הגראנט 4d-הגנום, גרנט הסכם 609989 ל ת גבהים), משרד הכלכלה הספרדי, תעשייה ותחרותיות (meic) לשותפות Embl, סנטרו דה Excel מרכז אוצ'ואה 2013-2017 ו Cerca תוכנית הכלטאת דה קטלוניה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1% EmbryoMax gelatin | EMD Millipore | ES-006-B | Cell culture |
| 0.25% Trypsin-EDTA | 25200072 | ||
| AMPure XP | Beckman Coulter | 10136224 | 4C/DNA purification |
| B27 supplement | Gibco | 17504044 | Cell culture |
| Beta-mercaptoethanol | Gibco | 31350010 | Cell culture |
| Bioruptor Pico | Diagencode | B01060010 | 4C/sonication |
| BSA | NEB | B9000S | 4C |
| CHIR99021 | Selleck Chemicals | S1263 | Cell culture |
| CIP | NEB | M0212 | 4C |
| cOmplete Protease Inhibitor Cocktail | Roche | 4693116001 | 4C |
| DMEM/F12 medium | Gibco | 11320033 | Cell culture |
| dNTP | NEB | N0447S | 4C |
| ESGRO Leukaemia Inhibitory Factor (LIF) | EMD Millipore | ESG1107 | Cell culture |
| Formaldehyde solution (37%) | Sigma | 252549-25ML | 4C |
| Glycin | Sigma | GE17-1323-01 | 4C |
| Glycogen | ThermoFischer | R0551 | 4C |
| Herculase II Fusion DNA polymerase | Agilent | 600675 | 4C |
| IGEPAL CA-630 | Sigma | I3021-50ML | 4C |
| Knockout DMEM | 10829018 | ||
| L-glutamine | Gibco | 25030081 | Cell culture |
| MboI | NEB | R0147M | 4C |
| MEM non-essential amino acids | Gibco | 11140050 | Cell culture |
| N2 supplement | Gibco | A1370701 | Cell culture |
| NEBNext DNA Library prep | NEB | E6040 | 4C |
| NEBuffer 2.1 | NEB | B7202S | 4C/digestion |
| Neurobasal medium | Gibco | 21103049 | Cell culture |
| PD0325901 | Selleck Chemicals | S1036 | Cell culture |
| Penicillin Streptomycin | Gibco | 15140122 | Cell culture |
| Proteinase K | NEB | P8107S | 4C |
| Qubit 4 Fluorometer | ThermoFischer | Q33238 | 4C |
| Qubit dsDNA HS Assay Kit | ThermoFischer | Q32851 | 4C |
| RNase A | ThermoFischer | EN0531 | 4C |
| Sodium pyruvate solution | Gibco | 11360070 | Cell culture |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | Cell culture |
| T4 DNA Ligase Reaction Buffer | NEB | B0202S | 4C |
| T4 DNA Ligase Reaction Buffer | NEB | M0202M | 4C |
References
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292 (5819), 154-156 (1981).
- Martello, G., Smith, A. The nature of embryonic stem cells. Annual Review Cell and Developmental Biology. 30, 647-675 (2014).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proceedings of the National Academy of Science U. S. A. 78 (12), 7634-7638 (1981).
- Loh, K. M., Lim, B., Ang, L. T. Ex uno plures: molecular designs for embryonic pluripotency. Physiological Reviews. 95 (1), 245-295 (2015).
- Sheridan, S. D., Surampudi, V., Rao, R. R. Analysis of embryoid bodies derived from human induced pluripotent stem cells as a means to assess pluripotency. Stem Cells International. 2012, 738910(2012).
- Gaszner, M., Felsenfeld, G. Insulators: exploiting transcriptional and epigenetic mechanisms. Nature Reviews in Genetics. 7 (9), 703-713 (2006).
- Lenhard, B., Sandelin, A., Carninci, P. Metazoan promoters: emerging characteristics and insights into transcriptional regulation. Nature Reviews in Genetics. 13 (4), 233-245 (2012).
- Long, H. K., Prescott, S. L., Wysocka, J. Ever-Changing Landscapes: Transcriptional Enhancers in Development and Evolution. Cell. 167 (5), 1170-1187 (2016).
- Schoenfelder, S., Fraser, P. Long-range enhancer-promoter contacts in gene expression control. Nature Reviews in Genetics. 20 (8), 437-455 (2019).
- Spitz, F., Furlong, E. E. Transcription factors: from enhancer binding to developmental control. Nature Reviews in Genetics. 13 (9), 613-626 (2012).
- Creyghton, M. P., et al. Histone H3K27ac separates active from poised enhancers and predicts developmental state. Proceedings of the National Academy of Sciences U. S. A. 107 (50), 21931-21936 (2010).
- Heintzman, N. D., et al. Histone modifications at human enhancers reflect global cell-type-specific gene expression. Nature. 459 (7243), 108-112 (2009).
- Klemm, S. L., Shipony, Z., Greenleaf, W. J. Chromatin accessibility and the regulatory epigenome. Nature Reviews in Genetics. 20 (4), 207-220 (2019).
- Rada-Iglesias, A., et al. A unique chromatin signature uncovers early developmental enhancers in humans. Nature. 470 (7333), 279-283 (2011).
- Lettice, L. A., et al. Development of five digits is controlled by a bipartite long-range cis-regulator. Development. 141 (8), 1715-1725 (2014).
- Dekker, J., Rippe, K., Dekker, M., Kleckner, N. Capturing chromosome conformation. Science. 295 (5558), 1306-1311 (2002).
- de Wit, E., de Laat, W. A decade of 3C technologies: insights into nuclear organization. Genes and Development. 26 (1), 11-24 (2012).
- Lieberman-Aiden, E., et al. Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science. 326 (5950), 289-293 (2009).
- Simonis, M., et al. Nuclear organization of active and inactive chromatin domains uncovered by chromosome conformation capture-on-chip (4C). Nature Genetics. 38 (11), 1348-1354 (2006).
- Splinter, E., de Wit, E., van de Werken, H. J., Klous, P., de Laat, W. Determining long-range chromatin interactions for selected genomic sites using 4C-seq technology: from fixation to computation. Methods. 58 (3), 221-230 (2012).
- Stadhouders, R., et al. Multiplexed chromosome conformation capture sequencing for rapid genome-scale high-resolution detection of long-range chromatin interactions. Nature Protocols. 8 (3), 509-524 (2013).
- van de Werken, H. J., et al. Robust 4C-seq data analysis to screen for regulatory DNA interactions. Nature Methods. 9 (10), 969-972 (2012).
- Schwartzman, O., et al. UMI-4C for quantitative and targeted chromosomal contact profiling. Nature Methods. 13 (8), 685-691 (2016).
- Tian, T. V., et al. Whsc1 links pluripotency exit with mesendoderm specification. Nature Cell Biology. 21 (7), 824-834 (2019).
- Chen, H., et al. Dynamic interplay between enhancer-promoter topology and gene activity. Nature Genetics. 50 (9), 1296-1303 (2018).
- Apostolou, E., et al. Genome-wide chromatin interactions of the Nanog locus in pluripotency, differentiation, and reprogramming. Cell Stem Cell. 12 (6), 699-712 (2013).
- de Wit, E., et al. The pluripotent genome in three dimensions is shaped around pluripotency factors. Nature. 501 (7466), 227-231 (2013).
- Krijger, P. H. L., Geeven, G., Bianchi, V., Hilvering, C. R. E., de Laat, W. 4C-seq from beginning to end: A detailed protocol for sample preparation and data analysis. Methods. , (2019).
- Mumbach, M. R., et al. HiChIP: efficient and sensitive analysis of protein-directed genome architecture. Nature Methods. 13 (11), 919-922 (2016).
- Rao, S. S., et al. A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell. 159 (7), 1665-1680 (2014).
- Schoenfelder, S., Javierre, B. M., Furlan-Magaril, M., Wingett, S. W., Fraser, P. Promoter Capture Hi-C: High-resolution, Genome-wide Profiling of Promoter Interactions. Journal of Visualized Experiments. (136), e57320(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved