A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תמונה מונחית Transapical צניפי העלון נקב מודל של נפח מבוקרת עומס יתר מ צניפי אי-ספיקת בעכברוש
In This Article
Summary
מודל מכרסם של הלב השמאלי נפח העומס של צניפי אי-ספיקת הוא דיווח. צניפי אי-ספיקת של חומרת מבוקרת נגרמת על ידי קידום מחט של ממדים מוגדרים לתוך העלון הקדמי של שסתום צניפי, בלב פועם, עם הדרכה אולטרסאונד.
Abstract
צניפי אי-ספיקת (MR) הוא נגע נרחב שסתום הלב, אשר גורמת שיפוץ לב ומוביל לאי ספיקת לב מגדשתית. למרות הסיכונים של MR מתוקן הפרוגנוזה המסכנה שלה ידועים, שינויי האורך בתפקוד הלב, מבנה ושיפוץ מובנים לחלוטין. פער ידע זה הגביל את הבנתנו את העיתוי האופטימלי עבור תיקון MR, ואת התועלת כי מוקדם לעומת תיקון מאוחר של MR אולי על החדר השמאלי. כדי לחקור את המנגנונים המולקולריים שנותרו שיפוץ שיפוצים חדרית במסגרת הגדרת MR, מודלים בעלי חיים נחוצים. באופן מסורתי, מודל aorto-caval פיסטולה נעשה שימוש כדי לגרום עומס יתר, אשר שונה מנגעים רלוונטיים קלינית כגון MR. MR מייצג בלחץ נמוך עוצמת הקול עומס הומודינמי, אשר דורש מודלים בעלי חיים לחקות את המצב הזה. להלן, אנו מתארים מודל מכרסם של MR חמור שבו העלון הקדמי של שסתום צניפי חולדה מחורר עם מחט 23G, בלב פועם, עם הדרכה התמונה האקו-קרדיוגרפית. חומרת MR הוא מוערך ואישר עם האקו, ואת השגות התוכמת של המודל הוא דיווח.
Introduction
צניפי אי-ספיקת (MR) הוא הנגע הנפוץ שסתום הלב, אובחן 1.7% האוכלוסייה הכללית בארה ב 9% של אוכלוסיית קשישים גדול מ 65 שנים של גיל1. בנגע זה שסתום הלב, סגירה לא נאותה של כרוזים צניפי שסתום ב systole, גורם אי-ספיקת של דם מחדר השמאלי לתוך האטריום השמאלי. MR יכול להתרחש עקב שונים etiologies; עם זאת, נגעים ראשוניים של שסתום צניפי (הראשי MR) מאובחנים וטופלו לעתים קרובות יותר לעומת MR2. מבודדים MR העיקרי הוא לעתים קרובות תוצאה של ניוון myx, הצניפי שסתום, וכתוצאה מכך התארכות של העלונים או כורסיים tendineae או קרע של כמה כורדיים, כולם תורמים לאובדן של המסתם הסיסטולי של השסתום.
MR הנובע נגעים שסתום כזה מרומם את נפח הדם ממלא את החדר השמאלי בכל פעימת לב, הגדלת את הלחץ בסוף הקיר דיאסטולי לספק גורם מלחיץ שאינו מצטט הסתגלות לב ושיפוץ. שיפוץ לב בנגע זה מאופיין לעתים קרובות על ידי הרחבת קאמרית משמעותית3,4, היפרפרס מתון הקיר, עם פונקציה שמורה שנשמר לפרקי זמן ממושך. מאז שבר הפליטה הוא נשמר לעתים קרובות, תיקון של MR באמצעות כירורגי או משמעו מתעכב לעתים קרובות, עד תחילת הסימפטומים כגון קוצר נשימה, אי ספיקת לב, הפרעות קצב. עם זאת, לא תוקן MR משויך לסיכונים גבוהים של אירועים שליליות לב, למרות הידע הנוכחי לגבי שינויים בעלי מבנה בסיסי האירועים הללו אינם ידועים.
דגמי בעלי חיים של MR לספק מודל רב ערך כדי לחקור שינויים בעלי בדיקת אולטרה מבנית בלב, וללמוד התקדמות האורך של המחלה. בעבר, החוקרים המושרה MR בעלי חיים גדולים כולל חזירים, כלבים, וכבשים, על ידי יצירת המעי החיצוני מהבטן-פרפור, השברהתאיים6, או העלון מחורר7. בעוד שטכניקות כירורגיות קל יותר בבעלי חיים גדולים, מחקרים אלה הוגבלה מעקב תת כרוני בגודל מדגם קטן, בשל העלויות הגבוהות של ביצוע מחקרים כאלה בבעלי חיים גדולים. יתר על כן, ניתוח מולקולרי של רקמות ממודלים אלה הוא לעתים קרובות מאתגרת בשל נוגדנים מוגבלים מינים ספציפיים וספריות הגנום מוערת ליישור.
מודלים בעלי חיים קטנים של MR יכול לספק חלופה מתאימה לחקר נגע שסתום זה ואת השפעתה על שיפוץ לב. היסטורית, מודל חולדה של aorto-caval פיסטולה (ACF) של עומס יתר של נפח הלב כבר שימש. הראשון תיאר בשנת 1973 על ידי Stumpe ואח '8, פיסטולה ורידי עורק נוצר בניתוח כדי לעקוף דם עורקי בלחץ גבוה מעורק העורקים היורד אל הלחץ הנמוך התחתון קאווה. שיעור הזרימה הגבוהה בפיסטולה גורם עומס יתר דרסטי על שני הצדדים של הלב, גורם משמעותי לימין ושמאל המוח החדרית ואת תפקוד לקוי בתוך ימים של יצירת ACF9. למרות הצלחתו, ACF אינו מחקה את המוכדינמיקה של MR, עומס יתר בלחץ נמוך, אשר מרומם את טעינת המטען אך גם מפחית afterload. בשל מגבלות כאלה של מודל ACF, ביקשו לפתח ולאפיין מודל של MR זה מחקה טוב יותר את עומס הלחץ נמוך נפח.
להלן, אנו מתארים את הפרוטוקול עבור מודל של צניפי שסתום עלון ניקוב כדי ליצור MR חמור בחולדות10,11. מחט תת-עורית הוכנס ללב החולדה הפועם, והתקדם לתוך עלון השסתום הצניפי הקדמי תחת הנחיית אקו-בזמן-אמת. הטכניקה היא מאוד מאופיינת ומודל טוב יחסית מחקה MR כפי שנראה בחולים. חומרת MR נשלטת על ידי גודל המחט המשמש כדי לנקב את העלעל צניפי ואת חומרת MR ניתן להעריך באמצעות אקו transesophageal (TEE).
Protocol
הליכים אושרו על-ידי התוכנית לטיפול בבעלי חיים ולהשתמש ב אוניברסיטת אמורי תחת פרוטוקול מספר EM63Rr, תאריך אישור 06/06/2017.
1. הכנה טרום כירורגי
- קיטור מחטא מכשירים כירורגיים לפני ההליך.
- ביום ההליך, להעביר חולדות מדיור לניתוח, ושוקל אותם.
- לצייר לפני הניתוח תרופות שלאחר הניתוח על פי המשקל: שתי מינונים של Carprofen (2.5 מ"ג/ק"ג כל אחד), מנה אחת של גנאמיצין (6 מ"ג/ק"ג), ומנה אחת של בופרינורצין (0.02 מ"ג/ק"ג).
- להבטיח נפח הולם של isofלוריאן במערבל הגז, ואת החמצן במיכלים זמינים לניתוח. מיכל אחד מלא של חמצן (24 ft3) הוא לעתים קרובות מספיק.
2. הכנה לבעלי חיים
הערה: למבוגרים ספראג-דאוליי חולדות זכר במשקל 350-400 g שימשו במחקר זה. טכניקות הניתוח הן קלות למעט בעלי חיים קטנים יותר או גדולים יותר, במידת הצורך.
- הרגעה העכברוש בחדר אינדוקציה עם 5% isofלוריאן מעורב 1 LPM (ליטר לדקה) של 100% חמצן. קביעת רמה נאותה של הרגעה מקצב נשימה איטי יותר תחת התבוננות חזותית, ואובדן עווית על הבוהן של העכברוש.
- . מותאם לשימוש כצינורית אנדוקנה
- המחש את קנה הנשימה ואת מיתרי הקול באמצעות האוטוסקופ, והשתמש במוליך קצה כותנה כדי לנקות הפרשות הלוע.
- הציגו את הצינורית האנדוקנה על חוט הנחיה בגודל 0.034 אינץ ', לתוך מיתרי הקול. לאחר הצינור ממוקם כראוי בקנה הנשימה, לדחוף את הצינור פנימה ולסגת את התיל (Figure1).
- מניחים את העכברוש על משטח כירורגי מחומם מתוחזק ב 37 ° c ולחבר את צינור האנדוקנה אל מאוורר מכני. הקלט את משקל החולדה לתוך תוכנת בקרת ההנשמה, המחשבת את קצב האוורור ונפח הגאות. 66 נשימות לדקה עם נפח הגאות של 1 mL/100 גרם משקל הגוף שימשו במחקר זה (איור 1D).
- השתמש 100% חמצן (1 LPM) מעורבב עם 2-2.5% isof, כמו הרדמה ממסים נדיפים ולאשר את רמת ההרדמה עם אובדן של טון הלסת ואובדן של תגובה צביטה בבוהן.
- שים לב כי אם מותקן כראוי, תנועה בחזה צריך להסתנכרן עם מאוורר.
- אם לא מותקן באופן תקין, התנועה בחזה לא תסנכרן עם מאוורר. כדי לבדוק את הצנרור, לדחוס את הבטן של עכברוש, אשר יוצר לחץ מאחור על מאוורר, יצירת אזעקה מעל לחץ. בתרחיש זה, משוך את האנגיוקט בעדינות, והחזר את העכברוש לחדר האינדוקציה עם 5% isofלינה במשך כמה דקות כדי להבטיח שהעכברוש מורדם מספיק ומחדש את החולדה.
- פעם אחת כראוי מצתיל, לאבטח את צינור האנדוקנה על ידי תפירה הקצה האבובית של הצינור ללחי של חולדה עם תפר משי 4-0 כדי למנוע היווצרות במהלך ההליך.
- הכנס בדיקה בטמפרטורה רקטלית כדי לפקח על טמפרטורת הגוף, ובדיקת אק ג של ארבעה מסופים כדי לפקח על אק ג במהלך ההליך כולו.
- השתמש מנורת חימום תקורה אם החום מפלטפורמה כירורגית אינו מספיק. כבה את המנורה אם טמפרטורת הגוף עולה מעל 37 ° c.
- להעריך באופן חזותי את האלקטרוג עבור כל הפרעות קצב או סימנים של איסכמיה אוטם שריר הלב. , אם אף אחד לא נוכח. הקלט את הג הבסיסי
- ביצוע האקו-החזה (TTE) עבור תפקוד לב בסיסי (איור 2א).
- הפוך את העכברוש לתנוחת מגבון וגלח את הצד השמאלי של בית החזה. כדי לקבל תצוגות הד ברורות, הסר שיער באמצעות קרם להסרת השערות.
- השתמש בכל מערכת אולטרסאונד עם תדר הולם לדימות קצב הלב גבוהה. במחקר זה השתמשנו ויזואלסונים 2100 מערכת עם 21 בדיקה MHz, אשר מתאים לדימות לב בחולדות.
- השג תמונות במצב B במישור הציר הארוך של parasternal, כדי לחשב את הכרכים השמאליים של המוח. באותו מישור, להשיג תמונות במצב M למדוד מידות הקיר.
- להפוך את הגשוש על ידי 90 °, ולקבל במצב B ו-מצב M parasternal הציר הקצר ברמת הלסת האמצעית כדי למדוד את ממדי הקיר החתך.
- בצע transesophageal אקו (טי) עבור דימות בסיסי (איור 2ב).
- מניחים את החולדה בתנוחה הימנית הנכונה ולהכניס 8 Fr בדיקה אולטרסאונד מתוך הזרם (8 MHz) אל הוושט של החולדה עם כמות קטנה של ג'ל להחיל על הקצה. התדר של הקרח (האקו תאיים) בדיקה מספיקה כדי להשיג 4-6 מסגרות לפעימת לב, אשר מספיקים כדי להמחיש את התנועה שסתום.
הערה: ג ' נרל אלקטריק חי I או סימנס SC2000 מערכת הממשלה ניתן להשתמש עבור הדמיה קרח. - השיגו תצפית גבוהה על הוושט כדי לקבל נוף של שני הצדדים של הצד השמאלי של הלב. נוף זה הוא אידיאלי כדי להמחיש את האטריום השמאלי, צניפי שסתום, ואת החדר השמאלי. הצב את המקדח כך העלונים הקדמי והאחורי הם דמיינו החלקה היא מרכזית. זווית זו גם מאפשרת מדידות דופלר על פני שסתום צניפי, ללא תיקון זווית.
- מדידת שמאל האזור פרפור ו צניפי שסתומים הממדים השנתי בתצוגה זו.
- לבצע צבע הדמיה דופלר כדי לאשר יכולת שסתום וחוסר של MR ב בסיסית. לבצע גל פעמו גל רציף הדמיה דופלר לכמת צניפי זרימה ולאשר חוסר regurgitant זרימה.
- לבצע במצב B-wave פעמו הדמיה של אבי העורקים למדוד את קוטר השורש של אבי העורקים ולחשב את זרימת אבי העורקים.
- לבצע גל פעמו הדמיה דופלר של הווריד הריאתי כדי למדוד את זרימת הורידים הריאתי.
- מניחים את החולדה בתנוחה הימנית הנכונה ולהכניס 8 Fr בדיקה אולטרסאונד מתוך הזרם (8 MHz) אל הוושט של החולדה עם כמות קטנה של ג'ל להחיל על הקצה. התדר של הקרח (האקו תאיים) בדיקה מספיקה כדי להשיג 4-6 מסגרות לפעימת לב, אשר מספיקים כדי להמחיש את התנועה שסתום.
- הכנס מנה אחת של Carprofen (2.5 מ"ג/ק"ג, SQ, לא סטרואידיות אנטי דלקתיות), גנאמיצין (6 מ"ג/ק"ג, מ ר, אנטיביוטיקה), ותמיסת מלח סטרילית (1 מ ל, SQ) כדי לפצות מראש על אובדן דם במהלך ההליך.
- לגלח את צד שמאל של החזה כנדרש כדי להסיר את השיער שנותר מהשדה כירורגי. גילוח מאזור הצוואר התחתון כדי xyphoid, ומהיד השמאלית למטה לאמצע החזה צריך להיות מספיק כדי להבטיח שדה נטול שיער ולהפחית את הסיכון של זיהום באתר כירורגי.
- לקרצף את האזור כירורגי עם גזה ספוגה בבטאדין, ואחריו גזה ספוגה ב 70% אתנול. לקרצף את האזור בתנועות מעגליות על העור, כך הגזה לא ליצור קשר עם האזור שהיה מבוטל קודם לכן.
- חזור על שלב זה שלוש פעמים כדי להשיג שדה סטרילי כראוי לניתוח.
- לעטוף את החיה בשמיכה סטרילית, לפתוח חלון כדי לגשת לאזור כירורגי סטרילי.
3. ניקור שמאלי
- בצע את הליך כירורגי כולו באמצעות טכניקות אספטי, עם isofלאנה מתוחזק 2-2.5% 1 LPM של חמצן. מניחים את כל הכלים במגש סטרילי, ומניחים חזרה במגש לאחר כל שימוש.
- לחבוש כפפות סטרילי, מסכה וכובע ניתוחי על ידי המנתח עבור ההליך כולו. שמלת כירורגית סטרילי ניתן לענוד גם, אבל זה אופציונלי אלא אם כן זיהום צפוי.
- השתמש אזמל כירורגי עם להב לא #15 לעשות חתך העור בצד שמאל של בית החזה, כ 1 ס מ הקרוב xyphoid. השתמש במספריים לחיתוך מספריים טיפ כדי להפריד את שכבת העור משכבת השריר ולעשות חתך האורך.
- מנתחים את שכבות השריר באותו אופן, עד לחשיפת הצלעות.
- בזהירות לעשות חיתוך האורך 2-3 ס מ בחלל צלעי החמישית, מספיק כדי להוסיף מחדש ולחשוף את הלב.
- השתמשו בלקחיים משובחים כדי להרים את קרום הלב, ומספריים זעירים לבלו אותו באזור שמסביב לקודקוד הלב. שלב זה מסייע להימנע מהדבקויות לאחר ניתוח של הלב לקירות החזה ולסרעפת.
הערה: הימנע מחתכים כירורגיים קרוב לעצם החזה כדי למזער את הדימום. הסטת עורקי החלב הפנימיים הרצים לאורך עצם החזה, עלולים לגרום לדימום מופרז. אם הוא נתקל עם דימום כזה, לזהות את המדמם ולצרוב אותו.
4. הד מונחה הליך MR (איור 3 & איור 4)
- השתמש 6-0 prolene תפר ומחזיק ה, לשים תפר מחרוזת הארנק על קודקוד החדר השמאלי. אם נדרש, השתמש מלקחיים מיקרו כדי לייצב את הלב.
- בעדינות לקשור את תפר פסגה לייצב את הפיסגה ולהכניס 23 גרם מחט (סמוק עם תמיסת מלח, עם רזלים תרנגול בקצה המרוחק שלו) במרכז הארנק תפר, לתוך חלל המוח השמאלי.
- השתמשו ביד אחת כדי להחזיק ולהנחות את המחט, והיד השנייה במקביל לטפל בtransesophageal הד בדיקה כדי להשיג תצוגה הד אופטימלית כדי להמחיש את המחט, כפי שמתואר לעיל.
- עם הדרכה בזמן אמת אולטרסאונד, לקדם את המחט לעבר הצד החדרית של העלון צניפי הקדמי. לאחר התנוחה המחט מאושר על אולטרסאונד, לקדם את המחט בתנועה אחת בסדר דרך העלון שסתום. אם התנגדות מורגשת, סובב את המחט כפי שהוא מתקדם לתוך העלון כדי לנקב אותו.
הערה: קידום המחט רחוק מדי לתוך האטריום השמאלי עלול לגרום לניקוב שמאלי, גרימת דימום מופרז ומוות בעלי חיים. המחט צריכה להיות מדמיין. באולטרסאונד כל הזמן - למשוך את המחט לתוך החדר השמאלי חדרית, הרחק שסתום צניפי, ולאשר MR ידי הפעלת הדמיה דופלר צבע.
- אם MR לא נראה על צבע הדמיה דופלר, חזור על שלבים 4.4 ו 4.5. התאם את הבדיקה הד אם נדרש כדי לקבל תצוגה טובה יותר. לאחר אימון בכמה חולדות, ניתן לגרום ניקוב העלעל בתנועה אחת של המחט, גרימת חור כי הוא בגודל של הקוטר החיצוני של המחט. זה אושר לאחר נקרוזה. של לבבות העכברושים
- לאחר MR הוא אישר, למשוך את המחט מתוך חלל חדרית שמאל לקשור בעדינות את הארנק תפר מחרוזת.
- השתמש גזה סטרילי להשרות כל דם על הפיסגה בחלל החזה.
הערה: נגיעה במכשיר הד עם כפפות כירורגי עלולה לגרום לזיהום של הסביבה סטרילי. רסס כפפות עם 70% אתנול או להחליף את הכפפות עם חדשים, כראוי.
5. התאוששות בעלי חיים וטיפול שלאחר הניתוח
- לאחר 5-10 דקות של תפקוד לב יציב (אק ג נורמלי וקצב הלב), לסגור את האונה הת'וראקוזה בשכבות עם 4-0 vicryl תוך הפחתת isofלאנה בשלבים.
- השתמש תפר מקוטע לקירוב הצלעות, עם isofלוריאן מתוחזק 2%. הכנס צינורית בחזה לחלל הבין-דתי השישי, ואבטח אותה לוילונות הסטריליים כדי למנוע התקדמות בטעות של הצינורית אל חלל בית החזה.
- השתמש תפר רציף לסגור את שכבת השריר עם isofלאנה הנשמרת ב 1.5%.
- השתמש בתפר רציף כדי לסגור את שכבת העור עם isofלוריאן מתוחזק 1%.
- חבר 10 מ ל Luer-נעילת שסתום מזרק ממזרק לצינור החזה לנקז 10-12 mL של אוויר מחלל החזה ולאחר מכן להסיר את צינור החזה.
- ניהול מנה אחרונה של Carprofen (2.5 מ"ג/ק"ג, SQ) וביטול isofלוריאן.
- המשך אוורור מכני בעוד מואנים עכברים מפני הרדמה, ניטור סימנים חיוניים (SpO2 וקצב הלב). בתחילתה של נשימה ספונטנית, לכבות את האוורור כדי לבדוק את היכולת של החולדה לשמור על הנשימה הזאת טוב SpO2.
- אם הרמות SpO2 מתחילות לרדת מתחת 90%, להדליק את המאוורר. לאחר העכברוש מסוגל לשמור על הרמות של SpO2 ללא אוורור, עיגון תפר אל הצינור האנדוקנה, והחיה מוכנה לצורך היווצרות.
- ברגע שחולדה מראה סימנים של עירנות, כולל תנועות של השקר או העיניים, מתיאת החיה.
- מניחים חרוט אף עם 100% חמצן עד החולדה הוא אמבולטורי.
- העבר עכברוש לכלוב נקי עם מצעים מינימליים ולהמשיך לפקח על סימנים חיוניים באמצעות צג SpO2 כף יד, ממוקם על כף הרגל של החולדה או הזנב, עד עכברוש הוא אמבולטורי.
הערה: אם תופעות לוואי של הניתוח הם נצפו, בעלי חיים עשויים להיות זמן התאוששות ארוך יותר עשוי לקחת עוד יותר להחזיקרמות SpO גבוהה. אם זה קורה, קונוס האף עם 100% חמצן ניתן להחיל עד SpO2 רמות יציבים. - כדי להפחית את הסיכון לפגיעה באתר כירורגי ולמנוע את הסיכון של זיהום, חולדות בית יחיד לאחר הניתוח.
- מנהל בופרינורפין בתוך 3 שעות אחרי החולדה ערה מספיק אמבולטורי. בופראורפין עלולה לגרום למצוקה נשימתית כאשר היא מנוהלת מוקדם בתקופת ההחלמה הפריבית, ובכך מעכבים אותה עד שהעכברוש נושם ללא קושי.
- לאחר הניתוח, כל החיות מקבלים את התרופות הבאות: gentamicin (6 מ"ג/ק"ג, SQ, SID POD 1-3) ו rimadyl (5 מ"ג/ק"ג, SQ, SID POD 1-3). כל החיות נצפו פעם ביום במשך חמישה ימים לאחר הניתוח לבדיקת אתרי החתך, ופעם ביום בשבועיים הראשונים לאחר הניתוח להערכת כאב.
6. ואלידציה של חומרת MR עם האקו (איור 5)
- חזור על ה-TEE בשבועיים שלאחר הניתוח, תוך שימוש באותם שלבים שצוינו בסעיף 2.7. שבועיים לאחר הניתוח זה הזמן המתאים לייצוב הומודינמיקה.
- להשיג הדמיה דופלר צבע על השקפה 2-קאמרית באמצעות דימות אולטרסאונד transesophageal, להמחיש את החדר השמאלי ואת האטריום השמאלי. למדוד את האזור של אטריום שמאל MR מטוס. חשב את השבר באזור הסילון של MR באמצעות
 1
1
חמור MR מוגדר באזור ≥ jet 30%. - משוער את האזור של regurgitant דיזה ידי חישוב השטח של 23 גרם מחט, באמצעות הקוטר החיצוני של המחט. משוואה זו מניחה שהאזור של פתח הregurgitant שווה לאזור של המחט 23G.
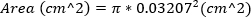 2
2 - השג גל רציף הדמיה דופלר עם השער דופלר בפתח הסילון regurgitant. מעקב אחר צורת הגל כדי לחשב VTI של הסילון regurgitant. ניתן להעריך את אמצעי האחסון של MR באמצעות
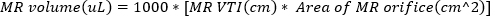 3
3
חמור MR מוגדר כאמצעי אחסון MR ≥ 95 μL. - השג גל הדופק הדמיה דופלר של הווריד הריאתי על ידי מסובב את הבדיקה הד למטה, בכיוון השעון. למדוד את הסיסטולי ואת המהירויות גל הדיאסטולי להשתמש במשוואה הבאה כדי לחשב את היחס.
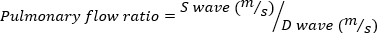 4
4
יחס שלילי לזרימת הריאות מעיד על מר מאוד חמור.
7. ניתוח שאם
- בצע מקטעים 1-3 כמתואר.
- שינוי בסעיף 4 שונה כך את המחט 23 G מוכנס לתוך החדר השמאלי שמאלי, דרך מחרוזת הארנק תפר על הפיסגה השמאלית החדרית, אבל לא מתקדמים לתוך שסתום צניפי כדי ליצור MR. הכנס את המחט לתוך החדר השמאלי חדרית לסגת מיד, בעקבות הידוק וסגירה של איפקס המוח.
- בצע את סעיף 5 כמתואר.
- בצע הערכת שסתום צניפי כמתואר בסעיף 6. עם זאת, אין להיות נוכח בשום בעלי החיים, ולכן אין צורך בקוונפיקציה כמתואר.
תוצאות
היתכנות
מודל MR המוצע הוא מאוד מתוכשל, עם חור מוגדר היטב צניפי העלעל השיגה 100% של חולדות המשמשות במחקר זה. איור 6A מתארת את כיוון המחט כפי שהוא מוכנס לתוך שסתום צניפי. איור 6B מתאר חור בעלון שסתום הצניפי מעכברוש מיי...
Discussion
מודל מכרסם הנוזקות של MR חמור עם הישרדות טובה (93.75% הישרדות לאחר הניתוח) וללא משמעותי לאחר הפעולה סיבוכים מדווחים. הדמיה בזמן אמת עם transesophageal אקו והקדמה של מחט לתוך הלב הפועם לנקב את העלון הצניפי הם ריאלי ניתן ללמד. חמור MR הופק עם המחט בגודל 23 G במחקר זה, אשר יכול להיות מגוונת כרצונך באמצעות מחט...
Disclosures
M. P הוא יועץ לטכנולוגיות תיקון לב (HRT), שעבורו הוא קיבל דמי ייעוץ. HRT לא היה כל תפקיד במחקר זה, וגם לא סיפק מימון כדי לתמוך בעבודה זו.
Acknowledgements
עבודה זו ממומנת על ידי גרנט 19PRE34380625 ו 14SDG20380081 מאיגוד הלב האמריקני D. קוראן ו-M. Padala בהתאמה, מענקים HL135145, HL133667, ו HL140325 מן המוסדות הלאומיים לבריאות ל-M. Padala, ומימון תשתיות מהמרכז לליבו של מרכז הרפואי של אוניברסיטת אמורי במרכז העיר מ. פאדאלה
Materials
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
References
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved