Method Article
הכנת פרוסות היפוקמפוס אנושיות חריפות להקלטות אלקטרופיזיולוגיות
In This Article
Erratum Notice
Summary
הפרוטוקול המוצג מתאר את ההובלה וההכנה של רקמת היפוקמפוס אנושית חתוכה במטרה האולטימטיבית להשתמש פרוסות מוח חיוניות ככלי הערכה פרה-קרטילי עבור חומרים אנטי אפילפטיים פוטנציאליים.
Abstract
אפילפסיה משפיעה על כ-1% מאוכלוסיית העולם ומובילה לירידה חמורה באיכות החיים בשל התקפים מתמשכים, כמו גם סיכון גבוה למוות פתאומי. למרות שפע של אפשרויות טיפול זמינות, כ-30% מהחולים עמידים לתרופות. מספר טיפולים חדשניים פותחו באמצעות מודלים של בעלי חיים, אם כי שיעור החולים עמידים לתרופות נשאר ללא לא מום. אחת הסיבות הסבירות היא היעדר תרגום בין מודלים מכרסמים ובני אדם, כגון ייצוג חלש של סיוע פרמקומרים אנושיים במודלים של בעלי חיים. רקמת מוח אנושית חיתוך ככלי הערכה פרה-לקלינלית יש את היתרון לגשר על פער תרגום זה. מתואר כאן היא שיטה להכנת באיכות גבוהה של פרוסות מוח היפוקמפוס אנושי אינדוקציה יציבה לאחר מכן של פעילות אפילפטיפורם. הפרוטוקול מתאר אינדוקציה של פעילות פרץ במהלך יישום של 8 mM KCl ו 4-aminopyridin. פעילות זו רגישה ל-AED לקוסמיד מבוסס או למועמדים אנטי-אפילפטיים חדשניים, כגון דימתילתנולמין (DMEA). בנוסף, השיטה מתארת אינדוקציה של אירועים דמויי התקף CA1 של פרוסות מוח היפוקמפוס אנושי על ידי הפחתה של Mg חוץ תאי2+ ויישום של bicuculline,חוסם קולטן GABA. ניתן להשתמש בהגדרה ניסיונית כדי לסנן חומרים אנטי אפילפטיים פוטנציאליים להשפעותיהם על פעילות אפילפטיפורמה. יתר על כן, ניתן לאמת מנגנוני פעולה עבור תרכובות ספציפיות באמצעות גישה זו ברקמה אנושית (למשל, באמצעות הקלטות מדבקות). לסיכום, חקירה של רקמת מוח אנושית חיונית ex vivo (כאן, היפוקמפוס נותח מחולים הסובלים מאפילפסיה של האונה הרקתית) ישפר את הידע הנוכחי של מנגנונים פיזיולוגיים ופתולוגיים במוח האנושי.
Introduction
אפילפסיה היא אחת ההפרעות הנוירולוגיות הנפוצות ביותר, המשפיעה על 1% מאוכלוסיית העולם, והיא קשורה לתחלואה מוגברת ותמותה1,2. למרבה הצער, שליש מהחולים הסובלים מאפילפסיה עמידים לתרופות, למרות שפע של אפשרויות טיפול זמינות כולל יותר מ 20 תרופות אנטי אפילפטיות מאושרות (AEDs)3. כישלון לתרגם תוצאות ממחקר פרה-קליני בבעלי חיים לניסויים קליניים היא אחת הסיבות מדוע אסטרטגיות טיפול מבטיח אינן יעילות בחולים רבים4. לאחרונה, neuropeptide Y (NPY) ו galanin הראו יש השפעות אנטי אפילפטיות במודלים של בעלי חיים; למרות, כאשר נבדק רקמת מוח אנושית לקטוע, רק NPY היה יעיל5.
רוב הידע הקיים בנוגע למנגנונים נוירולוגיים בסיסיים וגישות לטיפול במחלות נובע ממודלים של בעלי חיים ומניסויים בתרבות התאים. למרות אינפורמטיבי, מודלים אלה מייצגים רק היבטים בודדים של מחלות אנושיות מורכבות ואת רשת המוח האנושית הבוגרת. לחלופין, רקמת המוח האנושית יש פוטנציאל לגשר על הפער התרגום, אבל הוא זמין לעתים נדירות עבור מחקרים פונקציונליים. לדוגמה, רקמת המוח שלאחר המוות כבר כלי רב ערך בחקירת ביטוי חלבון, מורפולוגיה במוח, או קשרים אנטומיים, למרות פעילות עצבית היא לעתים קרובותבסכנה היא רקמה זו 6,,7,,8,9,,10,,11.
לעומת זאת, רקמת המוח האנושית החיים נותעה נחקרה בנוגע להערכת תרופות פרה-לקלינליות, פונקציות עצביות בסיסיותודפוסי ביטוי גנים 12,,13,,14,,15,,16,,17. יתרון גדול של פרוסות מוח אנושיות בהשוואה פרוסות מכרסמים היא הכדאיות הארוכה של רקמה עצבית לאחר ניתוח והכנה. בהשוואה פרוסות מוח מכרסמים, אשר ניתן להקליט בדרך כלל עד 8 שעות לאחר ההכנה, פרוסות המוח האנושי להראות פעילות עצבית יציבה עד 72 שעות, המאפשר חקירה יסודית של דגימות נדירות ויקרותאלה 12,,18.
מספר מחקרים חקרו תכונות של פעילות אפילפטיפורמה בתחומים שונים של רקמת אדם קליפתית והיפוקמפוס נותח והשתמשו בשיטות שונות עבור אינדוקציה של פעילות אפילפטיפורמה. בפרוסות מכרסמים, פעילות אפילפטיפורם יכולה להיות מושרה על ידי מספר שיטות: גירוי חשמלי של תאי DG hilar, עלייה של K חוץ תאי+ (8-12 mM KCl), חסימה של קולטני GABAA על ידי bicuculline (BIC), חסימת ערוצי אשלגן על ידי 4-aminopyridine (4-AP), והסרה או צמצום מ"ג2+ בתמיסהחוץ תאית 19. עם זאת, אינדוקציה של פעילות אפילפטיפורמה ברקמה האנושית דורשת שילוב של לפחות שתיים מהשיטות הנ"ל20,21,22.
מוצג כאן היא שיטה להכנת פרוסות מוח היפוקמפוס אנושי, אשר קיימא עבור עד 20 שעות ולהראות אינדוקציה של פעילות אפילפטיפורמה על יישום של Kגבוה + (8 mM) ו 4-AP או נמוך Mg2+ ו BIC.
Protocol
על המטופלים לתת הסכמה מושכלת בכתב לפני הניתוח, ועל ההסכמים האתיים הדרושים להיות במקום לפני הניסוי. לגבי התוצאות המייצגות, כל המחקרים המעורבים במשתתפים אנושיים נבדקו ואושרו על ידי Charité-Universitätsmedizin, ברלין (EA2/111/14).
1. הכנת פתרונות פי 10
הערה: בשל קשיים בתכנון גישה לרקמות המוח האנושי, מומלץ להכין פתרונות פי 10 כמתואר כאן. לחלופין, פתרונות 1x סופיים ניתן להכין טרי על ידי הוספת חומרים בודדים בריכוז הסופי למים מזוקקים כפול (ddH2O).
- לפתרונות בודדים של פי 10, הוסיפו חומרים ל-ddH2O לפי טבלה 1 ומערבבים עד להמסה.
- השתמש בפתרונות של 10x עד חודש אחד לאחר ההכנה (עד שנה אחת עבור aCSF כולין קפוא פי 10).
- עבור aCSF כולין 10x, להכין 50 מ"ל aliquots של 10x 1.1 כולין aCSF (טבלה 1) ולהקפיא ב -20 ° C או -80 °C עד לשימוש נוסף.
הערה: אין להוסיף גלוקוז ו CaCl2 כדי 10x 1.1 כולין aCSF כדי למנוע זיהום עם חיידקים ומשקעים של סידן פחמתי. - פתרון 10x 2 יכול לשמש עבור כל הפתרונות הסופיים 1x, בעוד פתרונות 10x 1.1-1.4 מותאמים אישית ונקראיםבהתאם (טבלה 1).
2. הכנת פתרונות סופיים של 1x
הערה: יש להכין פתרונות 1x סופיים טריים או המוקדמים ביותר ביום שלפני השימוש. כל הפתרונות הסופיים צריכים להיות קרבוגניים עם 5% CO2 ו 95% O2 באמצעות פיזור גז זכוכית כדי להעשיר פתרונות עם חמצן, ולהתאים את ה-pH ל- 7.4 (מקסימום = 7.4 ± 0.2).
- כולין aCSF להובלה והכנה
- עבור הפתרון הסופי 500 מ"ל, להפשיר aliquot 50 מ"ל של פתרון 10x 1.1 aliquot עבור כולין aCSF ב 37 מעלות C אמבט מים.
- הוסף את aliquot 50 mL הפשיר של פתרון 10x 1.1 ו 50 מ"ל של פתרון 10x 2 כדי כ 300 מ"ל של ddH2O.
- מוסיפים ריכוזים סופיים של גלוקוז ו-CaCl2, ואז מערבבים עד להמסה(שולחן 1,תמיסה 1.1).
- הוסף ddH2O לנפח סופי של 500 מ"ל ומדד osmolarity (300 mOsm ± 10 mOsm).
- לחלופין, השתמש במסנן כדי לחטא את הפתרון (ראה דיון על יכולת קבילות פרוסה ממושכת בתנאים סטריליים).
- מלא בקבוק נפרד עם כ 100 מ"ל של 1x כולין aCSF להובלה מחדר הניתוח למעבדה.
- אופציונלי: בהתאם לזמן ההובלה מחדר הפעולה למעבדה, שקול להשתמש בפקקי בקבוקים הדוקים לגז כדי להבטיח pH יציב של aCSF בתקופות הובלה ארוכות יותר.
- אחסן את הפתרון הסופי ב- 4-8°C עד לשימוש נוסף.
- ביום הפעולה, צונן 1 כולין aCSF על קרח וקרבוגנאט לפחות 10-15 דקות באמצעות פיזור גז זכוכית מחובר גז קרבוגן (5% CO2,95% O2).
הערה: שקול לשמור על בקבוק גז נגיש לחדר הפעולה במקרה של זמני המתנה ארוכים יותר, אשר ידרוש קרבוגן מחדש של פתרון התחבורה. עם זאת, הובלנו רקמת היפוקמפוס ללא קרבוגן מחדש לפני זמן הובלה ארוך וקצר (15 דקות לעומת 60 דקות) ולא לצפות הבדלים אינדוקציה של פעילות אפילפטיפורמה.
- aCSF לאחסון והקלטה
- עבור פתרון 2 L הסופי, להוסיף 200 מ"ל של 10x פתרון 1.2 (aCSF) ו 200 מ"ל של פתרון 10x 2 וגלוקוז (טבלה 1) כדי ~ 1500 מ"ל של ddH2O.
הערה: כרכים של הפתרונות הסופיים תלויים בניסויים יישומיים ובסוג התא המשמש לאחסון והקלטה. - הוסף ddH2O לנפח הסופי של 2 L ומדד osmolarity (300 mOsm ±10 mOsm).
- לפני חום הפתרון 35 °C ו קרבוגניאט לפחות 10-15 דקות לפני השימוש.
- עבור פתרון 2 L הסופי, להוסיף 200 מ"ל של 10x פתרון 1.2 (aCSF) ו 200 מ"ל של פתרון 10x 2 וגלוקוז (טבלה 1) כדי ~ 1500 מ"ל של ddH2O.
- HighK++4-AP aCSF עבור אינדוקציה של פעילות פרץ
- עבור פתרון 1 L הסופי, להוסיף 100 מ"ל של 10x פתרון 1.3 (highK++4-AP aCSF) ו 100 מ"ל של פתרון 10x 2 כדי ~ 700 מ"ל של ddH2O.
- הוסף גלוקוז ו- 4-AP (ריכוז סופי = 100 μM) על פי טבלה 1.
- הוסף ddH2O לנפח הסופי של 1 L ומדד osmolarity (300 mOsm ±10 mOsm).
- לפני חום הפתרון 35 °C ו קרבוגניאט לפחות 10-15 דקות לפני השימוש.
- LowMg2++BIC aCSF עבור אינדוקציה של אירועים כמו התקף (SLEs)
- עבור פתרון 1 L הסופי, להוסיף 100 מ"ל של 10x פתרון 1.4 (lowMg2++BIC aCSF) ו 100 מ"ל של פתרון 10x 2 כדי ~ 700 מ"ל של ddH2O.
- להוסיף גלוקוז ו BIC (ריכוז סופי = 10 μM) על פי טבלה 1.
- הוסף ddH2O לנפח הסופי של 1 L ומדד osmolarity (300 mOsm ± 10 mOsm).
- לפני חום הפתרון 35 °C ו קרבוגניאט לפחות 10-15 דקות לפני השימוש.
3. הכנת תא ממשק
- בתא ממשק, פרוסות מונחות על שלוש שכבות של נייר סינון כדי להבטיח כמות מספקת של פתרון מתחת לפרוסה. כך, לחתוך שני ~ 4 ס"מ x ~ 2 ס"מ חתיכות נייר מסנן עבור כל תא מחזיק פרוסה (תא ממשק המתואר מורכב משני תאים) ולמקם אותם על גבי זה.
- מניחים מחרוזות כותנה דקות סביב ניירות הסינון של 4 ס"מ על 2 ס"מ בתוך התאים כדי לשבור את המתח של הפתרון. ודא זרימה אחידה (כאן, טייץ ניילון שחור לחתוך מחרוזות בחיתוך דק ~ 10 ס"מ אורך משמשים; למיקום, ראה איור 1).
- מקם חתיכות קטנות של נייר סינון מעל ניירות המסננים הגדולים יותר בתוך התאים האוחזים בפרוסות. חתיכות רקמת מסנן קטנות צריך להיות בערך בגודל של פרוסת מוח אחת (~ 1.5 ס"מ x ~ 1.0 ס"מ) ויאפשר טיפול נוסף של פרוסות בודדות. מניחים 3-4 חתיכות נייר סינון קטנות בכל תא.
- ודא קצב זרימה של ACSF של 1.8 מ"ל/דקה עם משאבה פריסלטית.
- קרבוגן וטרום חחום תא הממשק ~ 35 ° C (הטמפרטורה הסופית של הפרוסה צריך להיות ~ 32 ° C).
4. הגדרת אזור ההכנה
הערה: הכנה יכולה להתבצע בתנאים סטריליים כדי למנוע זיהום ולהאריך את ההישרדות פרוסה. עם זאת, לא כל הרטטים מתאימים מתחת למכסה המנוע סטרילי, ונדרשות אמצעים אחרים כדי להפחית את הזיהום במהלך ההכנה. סעיף זה מתאר חלק מאמצעים אלה.
- נגב את אזור ההכנה עם 70% EtOH והניח נייר אלומיניום או כיסויים סטריליים מעל האזור.
- הכן דבק סופר, שתי פינצטה חדה, מרית, אזמל עם להבים, ולהב לחיתוך גס של רקמת המוח. ניתן לחטא כלים לפני ההליך להפחתת זיהום.
- נגב את מגש החיץ ואת לוח הדגימה של הויברטום עם 70% ETOH. לאחר שמגש החיץ יבש לחלוטין, מכסים אותו בנייר אלומיניום ומנו את המגש באמבט הקרח. ממלאים את אמבט הקרח בקרח כתוש ולשמור על -20 מעלות צלזיוס עד ההכנה.
- נגבו את התנוד וסכין הגילוח עם 70% EtOH וכילו את הרטט כדי למזער את התנודות האנכיות ואת נזקי הרקמות במהלך הליך החיתוך.
5. חיתוך ואחסון של רקמות
- מיד לאחר הניתוב, מניחים את הרקמה מיד בקור, כולין קרבוגני aCSF ולהעביר במהירות למעבדה.
התראה: ללבוש כפפות ומסיכת פנים בכל עת במהלך ההכנה, מאז רקמת המוח האנושי יכול להכיל פתוגנים פוטנציאליים. בנוסף, לבישת מסכת פנים כאשר לא עובד תחת מכסה המנוע סטרילי תפחית מאוד זיהום של פתרונות ורקמות המוח. - להסיר רקמה כולין aCSF ולחתוך את כל החלקים השרופים של רקמות.
- חותכים משטח אחיד כדי להדביק חלק רקמות על צלחת הדגימה, תוך כדי לשקול את זווית החיתוך ושכבות רקמות. באופן אידיאלי, פרוסת היפוקמפוס מכילה DG, CA1-4, ו (אם אפשר) סוביקולום.
- חותכים את רקמת המוח לפרוסות בעובי 400 μm ולהתאים את משרעת ומהירות במהלך חיתוך. בשל אפשרי pia מאטר שנותר, רקמת המוח האנושית מראה התנגדות יותר עשוי לדרוש חיתוך איטי יותר.
הערה: עובי הפרוסה משפיע מאוד על הרשת הזמינה (יותר נוירונים בפרוסות עבות יותר) או על הכדאיות של הפרוסה (חדירה של פתרון לפרוסה). השתמשנו 500 μm פרוסות כדי להגדיל את מיקרו-רשת זמין פוטנציאלי, ולא יכול לצפות הבדלים אינדוקציה של פעילות אפילפילם. 300 פרוסות μm משמשים בדרך כלל עבור ניסויים מדבקה מהדק, אם כי האינדוקציה של פעילות אפילפטיפורמים פרוסות אלה עדיין לא נבדקו כאן. אנו משתמשים 400 μm כעובי פרוסה סטנדרטית, למרות 300-500 μm פרוסות עשוי להיות מספיק. - לפני האיסוף, השתמשו באזמל כדי להקטין את הגדלים של פרוסות המוח כדי להתאים לתא ההקלטה. לשימוש בתא הממברנה (ראה סעיף 6), הפרוסות צריכות להיות 1.5 ס"מ על 1 ס"מ. תוך צמצום, שקול את השכבות והחיבורים הספציפיים הדרושים כדי להיות שלמים להקלטה (לדוגמה, להקלטה ב- CA1 וב-DG, לחתוך את הסוביקולום ואת הרקמה הלבנה שמסביב).
- באמצעות מרית ומפלצות קטנות, בזהירות למקם פרוסות בתא הממשק על ניירות סינון קטנים ולתת להם לנוח ~ 1 שעה ב aCSF עד להקלטה.
- ניתן להקליט פרוסות עד 20 שעות (אפילו יותר בתנאים סטריליים).
6. הקלטה של פעילות אפילפטיפורמה
- בתא הממברנה (תא הקלטה מסוג שקוע), מניחים את פרוסת המוח על קרום שקוף הניתן למחצה, המודבק לטבעת פלסטיק24. כך, השתמש בדבק-על כדי לחבר את טבעת הפלסטיק לממברנה של תרבית תאים.
- השתמשו באזמל כדי להסיר כל קרום בצד החיצוני של טבעת הפלסטיק. ודא כי הממברנה מחוברת באופן שווה ומותק לטבעת לפני הנחת הממברנה בתא.
הערה: ניתן לאחסן את הממברנה ב- ddH2O ב- 4-8 °C ולהשתמש בהן מחדש עד חודש אחד. שמור את הממברנה רטובה כל הזמן. - הן הזרימה והן הזרימה של תא הממברנה מחוברים לצינורות לאספקת פתרון. מניחים את הצינורות במשאבה פריסלטית כך שהזרמה והזרמה נעות לכיוונים מנוגדים.
- מניחים את צינור הזרימה והזרמה ב-aCSF מחמם מראש, עד שכל הצינורות והתא מלאים בתמיסה. כוונן את מהירות המשאבה פריסלטית כדי להשיג קצב זרימה זוגי של 10-13 מ"ל/דקה.
הערה: תא הממברנה המשמש כאן הוא קצב זרימה גבוה, תא הקלטה מסוג שקוע המאפשר זרימת פתרון של עד 14 מ"ל/דקה24. במקרה של שימוש בתא הקלטה מסוג שקוע אחר, יש לכוונן את שיעורי הזרימה. עם זאת, עבור אינדוקציה של פעילות אפילפטיפורמה, מומלץ מאוד להשתמש בתא קרום. - השתמש בגוף חימום המחובר לזרמה בסמיכות לתא הממברנה כדי להבטיח טמפרטורה יציבה של 32°C.
- הכן פיפטות זכוכית MΩ 1-2 באמצעות מושך אנכי. מלאו פיפטות בתמיסת NaCl של 154 מ"מ והנימו אותן במחזיק אלקטרודה.
- בעזרת פינצטה ומרית, מוציאים פרוסת היפוקמפוס מתא הממשק על ידי לקיחת הפרוסה עם נייר המסנן הקטן והצבת שניהם בצלחת פטרי מלאה ב-aCSF מבעבע. הסר את נייר הסינון הקטן מפרוסת ההיפוקמפוס, ו(במידת הצורך) החל כוח באמצעות פיפטה כדי להפריד את הפרוסה מנייר המסנן. תיזהר לא להפוך את הפרוסה.
- מניחים את הפרוסה בתא ההקלטה ומחזיקים אותה במקומה באמצעות רשת פרוסות.
הערה: בשל עקרוןו של ברנולי, בתא קרום סוג שקוע בשימוש, פרוסות הן בדרך כלל יציבות ללא שימוש רשת פרוסה נוספת. - מקם אלקטרודות באזור ובשכבת העניין (כאן, CA1) והתחל להקליט.
- רעד פעילות פוטנציאלית של שדה במצב מהדק נוכחי עם קצב דגימה של 10-20 kHz ולעבור נמוך מסונן ב- 2 kHz.
- שיא פעילות בסיס ב- aCSF עד 5 דקות.
- העבר את צינורות הזרימה מ- aCSF ל- highK++4AP או lowMg2++BIC aCSF ואת צינור הזרימה למכל פסולת כדי למנוע ערבוב של פתרונות. לאחר 2 דקות, מקם את צינור הזרימה באותו פתרון כמו הזרימה כדי לחסוך בפתרון.
- פעילות פרץ המושרה על-ידי highK++4-AP צריכה להיות גלויה 2-5 דקות לאחר השטיפה. עם זאת, אינדוקציה של SLEs על ידי lowMg2++BIC יכול לקחת עד 30 דקות. במידת הצורך, לשנות את העמדות של אלקטרודות בזהירות כדי לקבל תוצאות אופטימליות.
- פעם אחת במיקום הסופי, ריהיה רשומה של פעילות בסיסית למשך 20 דקות לפחות. אם תקליט הסכמי רמת סל, שקול הקלטות בסיסיות ארוכות יותר עקב תדירות נמוכה של הסכמי רמת נתונים.
- במקרה כי פעילות בסיסית היא יציבה (רמה של תדירות אירוע), לשטוף את התרופה הרצויה. שים לב כי בשל שטיפה בקצב הזרימה הגבוה של תרופות לוקח רק 2-5 דקות, המאפשר חילופי פתרון מהיר.
- שיא פעילות במהלך יישום סמים של לפחות 20 דקות, לאחר לשטוף. הפעילות צריכה להיות יציבה למשך 60-90 דקות לפחות, מה שמאפשר הקלטות ארוכות יותר.
7. ניתוח
- ניתוח של תדירות ומשרעת יכול להתבצע עם כל תוכנה זמינה. עד כה, לא הצלחנו ליצור ניתוח אוטומטי אמין של SLEs או פעילות פרץ, ובמקום זאת השתמשנו בניתוח חצי אוטומטי עם אישור חזותי של פעילות מזוהה.
- פעילות ההתפרצות מאופיינת בהטיה דו-פאיסית, חיובית ושלילית ומשך זמן של 100 אלפיות השנייה. כל האירועים המזוהים באופן חזותי כפעילות פרץ (לדוגמה, חצי-אוטומטית לפי ניתוח סף) צריכים להיות מצוינים באופן ידני לניתוח נוסף של תדירות האירועים (מרווח בין אירועים, IEI), משרעת ומספר אירועים כולל במהלך מסגרת הזמן המנותחת.
הערה: בשל התדירות הגבוהה של פעילות פרץ, 5 הדקות האחרונות של כל שלב יישום מנותח בדרך כלל20. - SLEs ניתן לנתח כמתואר Heuzeroth ואח '. SLEs מזוהה ניתן לנתח עוד יותר למשך זמן, משרעת, תדירות ספייק, ומשך של טוניק (תדר גבוה spiking) לעומת משך שלב clonic (תדירות נמוכה spiking). יש להוציא מניתוח <10 s של <10 s.
הערה: להערכה פרה-סרטנית של חומרים אנטי אפילפטיים אפשריים, השפעות על פעילות פרץ (המושרה על ידי highK++4AP) נחקרים, בשל אינדוקציה הוקמה ברקמת היפוקמפוס נותבת. תוצאות ראשוניות על אינדוקציה של SLEs באמצעות lowMg2++BIC דווחו (איור 2), למרות ניתוח של נתונים אלה אינו כלול כאן.
תוצאות
פעילות אפילפטיפורמם נרשמה בהצלחה ברקמת היפוקמפוס אנושית קצטה שמקורה עד 15 חולים. הקמת הליכי הובלה והכנה יציבים היא קריטית לאינדוקציה מוצלחת של פעילות אפילפטיפורמה ברקמת המוח האנושית. תוצאות שפורסמו לאחרונה הראו 1) אינדוקציה יציבה של פעילות אפילפטיפורמה ברקמה קצונה של חולים שונים, כמו גם 2) השימוש ברקמת מוח אנושית קצונה ככלי פרה-לקלינלי להערכה של מנגנונים אנטי אפילפטייםחדשניים 14,20.
יישום של highK++4-AP המושרה פעילות אפילפטיפורמה בצורה של פעילות פרץ בתוך כמה דקות (איור 2A, B, C,D). בשל התפלגות עצבית נמוכה ברקמת היפוקמפוס האנושית או אובדן תאי עצביים גבוהים עקב אפילפסיה של האונה הרקתית (TLE), מיקום של אלקטרודות ניתן להתאים בתחילת ההקלטה. במקרים שבהם פעילות פרץ של פרוסות אינה גלויה באזור CA1 לאחר 10 דקות (ללא תלות במיקום אלקטרודה), ניתן לסכן את יכולת הפרוסה, ויהיה צורך להחליף את הפרוסה.
SLEs, עם משך של >10 s, ניתן להשרות עם יישום של lowMg2++BIC (איור 2E,F). איור 2E מציג אינדוקציה יציבה של הסכמי רמת סל לאחר מספר דקות ותדירות יציבה לאורך כל ההקלטה. כאן, פעילות SLE הושרה בהצלחה בשתיים מתוך ארבע פרוסות מהמטופל נחקר. פרוסה אחת הראתה פעילות פרץ רק לאחר 15 דקות של פעילות SLE, בעוד הפרוסה השנייה לא הציגה SLEs גם לאחר 40 דקות.
להערכה פרה-סרטית של השפעות החומר, נחקרה השפעה אנטי-אפילפטית אפשרית על פעילות פרץ שנגרמה על-ידי highK++4-AP. חומרים אנטי אפילפטיים ידועים ופוטנציאליים (לקוסמיד, DMEA, dynorphine14) נבדקו, ודוגמאותמוצגות כאן עבור lacosamide AED קונבנציונלי (חוסם ערוץ נתרן) כמו גם DMEA (חומר אנטי אפילפטי פוטנציאלי רומן)20. מספר האירועים ומרווח האירועים הבין-אירועים (IEI) של אירועי פרץ ירד הן במהלך יישום של לקוזמיד והן ב- DMEA (איור 3C), אם כי משרעת לא הושפעה ברובה(איור 3D). בתת-קבוצה של פרוסות, למרות שהשראה של אירועי פרץ הושגה בדקות הראשונות, תדירות הפעילות לא התאוששה במהלך השטיפה של AEDs יישומיים (נתונים לא מוצגים כאן, ראה קראוס ואח '20). כאן, התרופות המיושמות נחשבו לגרום להשפעות; עם זאת, ייתכן שירידה בפעילות ההתפרצות הושפעה מהריקבון ההדרגתי בפעילות במהלך הקלטות ארוכות. לפיכך, יש לפרש בזהירות את התוצאות.
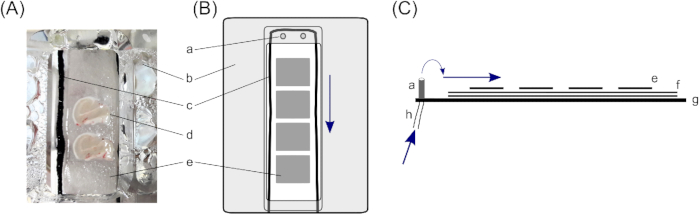
איור 1: תא ממשק. לאחסון פרוסות מוח היפוקמפוס אנושי, נעשה שימוש בתא ממשק עם שני תאי החזקה של פרוסת מוח (A); באופן ספציפי, תא ממשק מסוג האס23. כאן, פרוסות מוח היפוקמפוס נשענות על(ד)שלוש שכבות של נייר סינון,(ה)חתיכות קטנות יותר כדי לאפשר טיפול של פרוסות מוח בודדות, ו - (ו) חתיכות נייר מסנן גדולות יותר כדי להבטיח שכבה מספקת של פתרון מתחת לפרוסה. (ג)חוט כותנה המקיף את פרוסות המוח, מעל ניירות המסנן, מבטיח זרימת פתרון אחידה מהמפתרים ב (a) החלק העליון של התא. (ב)מכסה מכסה מכוון חמצן מתחת לתא אל הפרוסה. (ב) תצוגה למעלה של תא אחד שמחזיק פרוסה. (ג) תצוגה צדדית להמחשת שכבות ניירות הסינון. (ז)תחתית התא. (h)צינור להזרמת פתרון, המחובר למשאבה פריסלטית (חצים כחולים מסמנים את כיוון זרימת הפתרון). לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
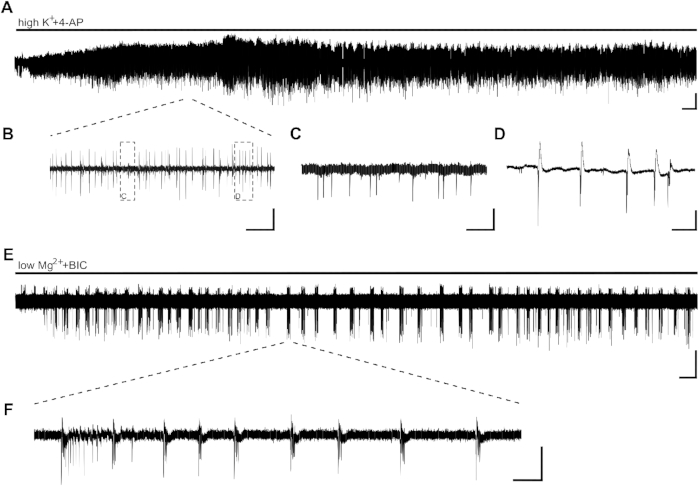
איור 2: פעילות אפילפטיפורמה בפרוסות היפוקמפוס אנושיות המושרה על-ידי highK++4-AP ונמוךMg2++BIC. CA1 הקלטות ו קטעים של יישום של highK+ (8 mM)+4-AP (100 μM) (A, B, C, D) ו נמוךMg2++BIC (10 μM) (E, F). (א) יישום אמבטיה של highK++4-AP גורם פעילות אפילפטיפורמה בתוך כמה דקות, והפעילות יציבה לפחות 60 דקות. פרטים של (א) ניתן לראות ב (ב). שני סוגים שונים של פעילות מושרה באזור CA1 של פרוסות היפוקמפוס אנושיות: קוצים דמויי ביניקטאל (C, פרטים של [B]ופעילות פרץ (D, פרטים של [B]). פעילות פרץ הוצגה להיות רגיש לתרופות אנטי אפילפטיות ולכן נותח להשפעה של חומרים אנטי אפילפטיים פוטנציאליים (איור 3). (E, F) אני לא יודע. יישום של LowMg2++BIC גורם SLEs משך של >10 s (F) ב CA1 בתוך דקות ספורות. עם זאת, אינדוקציה של SLEs יכול לקחת עד 30 דקות בפרוסות אחרות. ברים בקנה מידה = 0.2 mV, 2 דקות (A,E), 5 שניות (B), 500 ms (C, D), 5 דקות (E) ו- 2 שניות (F). נתון זה הותאם מ-Kraus et al.20. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
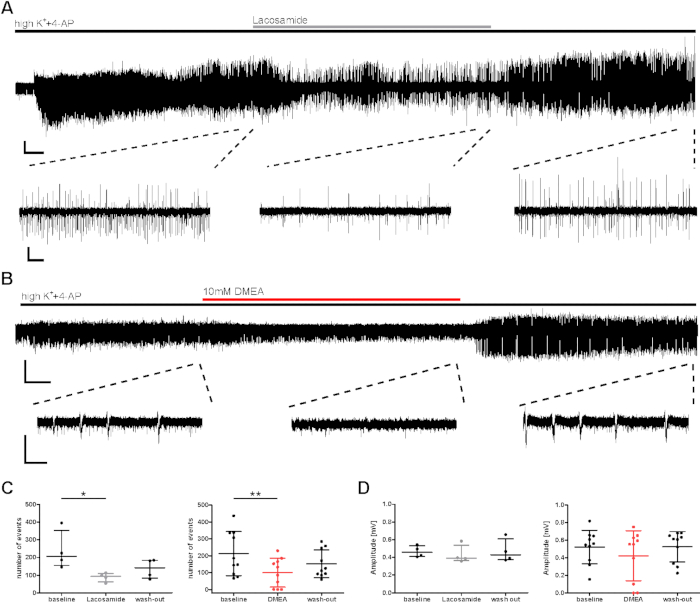
איור 3: ירידה בפעילות פרץ אפילפטי של פרוסות אנושיות במהלך יישום של לקוסמיד או DMEA. פעילות פרץ ירדה במהלך יישום של (A) lacosamide ו - (B) DMEA, מולקולה אנטי אפילפטית חדשה פוטנציאלית. (א) ו- (ב) מציגים הקלטות למופת של אזור CA1 עם קטעים של אזורים המשמשים לניתוח ב- (C) ו- (D). פעילות פרץ ירד במהלך לקוסמיד (100 μM) ויישום DMEA (10 mM), כפי שניתן לראות על ידי קטעים אמצעיים ומגביר שוב במהלך לשטוף החוצה. (C, D) אני לא יודע. מספר ומשרעת של פעילות פרץ נותחו עבור 5 הדקות האחרונות של כל שלב יישום (בסיסי, lacosamide / DMEA, לשטוף) ומוצגים כתוצאות מסוכמות עבור כל החולים (מספר אירועים, C; משרעת, D) כ מתכוון ± SD. כל נקודה מצביעה על מטופל אחד. כוכביות מסמנים הבדלים משמעותיים כפי שהוערך על ידי בדיקת פרידמן ופוסט הוק עם השוואה מרובה של דנקט של קבוצות לניתוח של יישום lacosamide (*p < 0.05, n = 4) או על ידי מדידה חוזרת ANOVA ופוסט הוק עם ההשוואה של Tukey לניתוח של יישום DMEA (**p < 0.01, n = 10). סולם ברים = 0.2 mV, 2 דקות (הקלטה מלאה, A), 5 s (קטעים, A), 3 דקות (הקלטה מלאה, B) ו 1 s (קטעים, B). נתון זה הותאם מ-Kraus et al.20. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
| פתרון 1.1 כולין aCSF | |||
| חומר (חומר) | ריכוז פי 10 (mM) | ריכוז 1 (mM) | הערה (10 |
| כולין Cl | 1100 | 110 | |
| (+)-נה L-ascorbate | 116 | 11.6 | |
| ג'י.סי.2x6H2O | 70 | 7 | |
| נה פירוונט | 31 | 3.1 | |
| קיי.סי.איי. | 25 | 2.5 | |
| 32PO4 (1111) | 12.5 | 1.25 | |
| 3 אנשים | 260 | 26 | |
| ק.א.ל.ב. | - | 0.5 | הוסף לפתרון הסופי |
| גלוקוז (גלוקוז) | - | 10 | הוסף לפתרון הסופי |
| פתרון 1.2 aCSF | |||
| חומר (חומר) | ריכוז פי 10 (mM) | ריכוז 1 (mM) | הערה (10 |
| נ.א.ק. | 1290 | 129 | |
| 32PO4 (1111) | 12.5 | 1.25 | |
| ק.א.ל.ב. | 16 | 1.6 | |
| קיי.סי.איי. | 30 | 3 | |
| MGSO4 (MGSO4) | 18 | 1.8 | |
| גלוקוז (גלוקוז) | - | 10 | הוסף לפתרון הסופי |
| פתרון 1.3 highK++4-AP aCSF | |||
| חומר (חומר) | ריכוז פי 10 (mM) | ריכוז 1 (mM) | הערה (10 |
| נ.א.ק. | 1240 | 124 | |
| 32PO4 (1111) | 12.5 | 1.25 | |
| ק.א.ל.ב. | 16 | 1.6 | |
| קיי.סי.איי. | 80 | 8 | |
| MGSO4 (MGSO4) | 18 | 1.8 | |
| גלוקוז (גלוקוז) | - | 10 | הוסף לפתרון הסופי |
| 4-AP | - | 0.1 | הוסף לפתרון הסופי |
| פתרון 1.4 נמוךMg2++BIC aCSF | |||
| חומר (חומר) | ריכוז פי 10 (mM) | ריכוז 1 (mM) | הערה (10 |
| נ.א.ק. | 1300 | 130 | |
| 32PO4 (1111) | 12.5 | 1.25 | |
| ק.א.ל.ב. | 16 | 1.6 | |
| קיי.סי.איי. | 30 | 3 | |
| גלוקוז (גלוקוז) | - | 10 | הוסף לפתרון הסופי |
| BIC (BIC) | - | 0.01 | הוסף לפתרון הסופי |
| פתרון 2 | |||
| חומר (חומר) | ריכוז פי 10 (mM) | ריכוז 1 (mM) | הערה (10 |
| 3 אנשים | 210 | 21 | |
טבלה 1: הכנת פתרונות 1x ואחרון 1 עבור הובלה, הכנה, והקלטה.
Discussion
רקמת מוח אנושית ונקטויה חיה היא כלי בעל ערך רב בהערכה פרה-קולינית של AEDs, כפי שהוא מייצג כראוי מיקרו-רשת של המוח האנושי שלם. הפרוטוקול המוצג מתאר שיטה להובלת רקמות והכנה, אשר מבטיחה פרוסות היפוקמפוס באיכות גבוהה, כמו גם שיטת אינדוקציה יציבה עבור פעילות אפילפטיפורמה קריטית להערכת AED.
חקירה של פעילות אפילפטיפורמים, כמו גם שיטות אינדוקציה כימית או חשמלית בפרוסות מוח אנושי הוצגו בעבר על ידי קבוצותאחרות 17,20,21,22. פרוטוקול זה מתאר אינדוקציה של פעילות פרץ יציבה בפרוסות מחולים שונים באמצעות יישום של Kגבוה ++4-AP, כמו גם אינדוקציה של SLEs באזור CA1 באמצעות יישום של Mgנמוך 2++BIC. נמצא כי האינדוקציה של פעילות פרץ היא עקבית יותר (80% של פרוסות שנבדקו ב 15 חולים) מאשר אינדוקציה של SLEs (50% של פרוסות שנבדקו בחולה אחד). עם זאת, עד כה, האינדוקציה של SLEs כבר רק נבחן בחולה אחד. אף על פי כן, אינדוקציה של SLEs על ידי נמוךMg 2++BIC מומלץ, כמו SLEs עדיין לא הצליח להיות מושרה באמצעות Kגבוה ++4-AP.
מספר מחקרים הציגו שיטות להובלה והכנה של רקמת המוח האנושית ולעתים קרובות מדגישים שלושה גורמים קריטיים להישרדות עצבית: זמן הובלה, פתרונות תחבורה משומשים, ותנאי אחסון.
עבור הכדאיות פרוסה אופטימלית, כמה קבוצות מציעות כי ההובלה של רקמת מוח חתוכה להיות קצר ככל האפשר. עם זאת, חדרי ניתוח ומעבדות נמצאים לעתים נדירות בסמיכות, כלומר איכות הפרוסה עלולה להיות בסכנה עקב תחבורה ארוכה. קבוצות מסוימות התגברו על מכשול זה על ידי החלת O2 קבוע לפתרון במהלךתחבורה 12. הובלנו רקמת מוח בקיצור (מקסימום = 15 דקות) ותקופות ארוכות (עד 1 שעות) של זמן ללא אספקה קבועה נוספת O2 במהלך ההובלה, בדומה לקבוצותאחרות 18,25. במקרים אלה, הבדלים באיכות הרקמה לא נצפו במהלך הקלטות אפילפטיפורמה. בתקשורת עם קבוצות אחרות במכון שלנו, איכות הפרוסה לא משתנה גם לניסויים במלחציים. לעומת זאת, שונות באיכות הרקמה נובעת אולי מנזק במהלך פעולות, ניתוח ממושך והליך חיתוך.
לגבי פתרון תחבורה וחיתוך, כל השיטות שפורסמו להשמיט NaCl מפתרונות כדי להפחית את נפיחות התא בשל לחץ אוסמוטי, בדומה להליך הסטנדרטי לניסויים תיקון-מהדק מכרסמים. עם זאת, מספר תחליפים הוצגו עד כה (כלומר, aCSF13מבוסססוכרוז ,22, ACSF12מבוסס NMDG,26, ו aCSF מבוסס כולין27). דינג ועמיתיו הציגו את aCSF מבוסס NMDG להכנת פרוסה ב 201426 ומאוחר יותר הוסיף פרוטוקול שחזור, אשר לאט לאט מציג מחדש NaCl לפרוסות28. עם זאת, כפי שתואר על ידי Ting et al., נוירונים של רקמת המוח שהוכנו aCSF מבוסס NMDG להראות עמידות קרום גבוה יותר, ובכך להשפיע על אטם תאים שלמיםבמהלך ניסויים תיקון-מהדק 26. לכן, עברנו מ- aCSF מבוסס NMDG לשימוש aCSF20מבוסס כולין , אשר מניב פרוסות באיכות גבוהה עבור פוטנציאל השדה והקלטות תיקון-clamp.
לגבי אחסון של פרוסות, מקובל כי תנאי ממשק לספק חמצון אופטימלי קריטי להישרדות פרוסה ארוכה18. עם זאת, קבוצות אחרות להראות הישרדות פרוסה עד 72 שעות בתנאיםשקועים 12. בניגוד להשערה קודמת, פרוסות מוח אנושי נראה עמיד יותר חמצון נמוך או סטרס חמצוני בהשוואה פרוסות מכרסמים. בעיקר, תאי ממשק שימשו בעבר לאחסון של פרוסות היפוקמפוס אנושי, למרות תנאים שקועים מומלצים לתחזוקה של פרוסות מוח אנושיות בניסויים מדבקה מהדק.
כפי שנדונו על ידי קבוצות אחרות, צעד קריטי נוסף להישרדות פרוסה ארוכה (ממשק עבור <48 שעות18, שקוע עבור <72 h12)הוא מניעת זיהום חיידקי. פרוסות מוח מכרסמים משמשים בדרך כלל הקלטות אלקטרופיזיולוגיות עד 8 שעות, זיהום חיידקי אינו נחשב להשפיע על הכדאיות פרוסה בתקופה זו. מספר גבוה של פרוסות שהוכנו מחתך אחד והזמינות הנדירה של רקמת המוח האנושית מדגיש את הצורך להאריך את הכדאיות של פרוסות מוח אנושיות. שיטה זו מתארת בהצלחה את הכנת פרוסות מוח היפוקמפוס אנושיות חיים, אשר ניתן להתאים בקלות לתנאים סטריליים. עם זאת, עבור ההקלטות שבוצעו כאן, הישרדות פרוסה המשתרעת על פני 20 שעות לא הייתה בראש סדר העדיפויות.
הקלטה בחדרי ממשק גם הוכח כחיוני עבור אינדוקציה של פעילות אפילפטיפורמה כגון SLEs22. תנאים שקועים, בשל חמצון נמוך, משמשים לעתים נדירות להקלטה של SLEs; עם זאת, הם נחוצים עבור רזולוציה גבוהה אופטית הדרושה לניסויים תיקון-מהדק. השימוש בתא הקלטה מסוג שקוע ממוטב מאפשר הקלטה של פעילות אפילפטיפורמה (שדה חוץ תאי או נוירון יחיד) בפרוסות מוח אנושיות, בשל חמצון גבוה ויישום תרופהמהירה 29. כאן מתוארות שיטות ותוצאות עבור הקלטות פוטנציאליות בשטח, אך יש להדגיש כי הקלטות של תיקון-מהדק בוצעו בהצלחה בפרוסות עכבר ומוח אנושי באמצעות תא הקלטה זה ששונה (הנתונים אינם מוצגים).
רקמת מוח אנושית לקטוע יש ערך תרגום גבוה יותר בהשוואה למודלים מכרסמים. הוא מייצג רשת עצבית בוגרת וחלויה שלא ניתן לשכפל על ידי iPSCs. עם זאת, כמו בכל מערכת במבחנה, פרוסות מוח אנושי אינן מייצגות מוח אנושי שלם. בנוסף, הרשתות העצביות המוקלטות של רקמת המוח הקטע יכול לעבור שינויים מולקולריים ופונקציונליים משמעותיים עקב נזק במהלך פעולה או הכנה. הליכי חיתוך הראו להשפיע על תפקוד GABAergic עשוי להשפיע על האינדוקציה של פעילות אפילפטיפורמה30. יש לשקול מגבלות אלה בעת גיבוש השערה. בעת בדיקת תרופות אנטי אפילפטיות פוטנציאליות, יש לקחת בחשבון את השימוש באזורים שונים במוח, כמו מטרות סמים לא יכול לבוא לידי ביטוי בכל אזורי המוח האנושי או כל החולים. בפרט, ההיפוקמפוס של חולי TLE לעתים קרובות להראות סימנים של טרשת היפוקמפוס מלווה באובדן תאים עצביים חמורים. מומלץ לקבל מידע על המטופל על שינויים פתולוגיים והיסטוריה של מחלות, כגון אפשרות בעיה כלפי תרופות, ולשקול זאת במהלך פרשנות נתונים.
לסיכום, שיטה זו מתארת בהצלחה את הכנת פרוסות מוח היפוקמפוס אנושיות חיים וטכניקות אינדוקציה להקלטת שני סוגים שונים של פעילות אפילפטיפורם. מאז הזמינות של רקמת מוח אנושית חיה היא נדירה, תנאי תחבורה והקלטה אופטימיזציה יש להשתמש כדי להבטיח פלט מרבי מניסויים באמצעות פרוסות מוח אנושיות. הוא הציע כי רקמת המוח האנושי ים ניתן להשתמש ככלי אימות פרה-לקלינלי בנוסף מודלים מכרסמים וניסויים תרבות התא.
Disclosures
המחברים לא מצהירים על ניגוד עניינים.
Acknowledgements
אנו מודים למנדי Marbler-Pötter (Charite-Unversitätsmedizin, ברלין) על סיוע טכני מעולה. P.F. מומן על ידי קרן המחקר הגרמנית (DFG, דויטשה Forschungsgemeinschaft) תחת אסטרטגיית מצוינות של גרמניה-EXC-2049-390688087. עבודה זו נתמכה על ידי מרכז QUEST לשינוי מחקר ביו רפואי במכון הבריאות של ברלין.
Materials
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
References
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved