A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכה של חמצון הסלולר באמצעות מערכת משנית ספציפי לחמצון-רגיש ירוק פלורסנט ירוקה
In This Article
Summary
פרוטוקול זה מתאר את ההערכה של מצב החמצון הייחודי של תא משנה בתוך התא. בדיקה פלואורסצנטית תלויית-חמצון רגישה מאפשרת ניתוח טימטרי נוח בתאים שלמים.
Abstract
מדידת חמצון תאיים/הפחתת המאזן מספק סקירה של המצב הפיסיולוגי ו/או פתופסולוגית הסטטוס של אורגניזם. תיוולים חשובים במיוחד להארת המצב החדש של התאים באמצעות dithiol מופחת וביחס דיגומי. מהונדסים cysteine-המכיל חלבונים פלורסנט לפתוח עידן חדש לחמצון רגישות biosensors. אחד מהם, חלבון הניאון רגישות ירוק רגיש (רוfp), יכול בקלות להיות הציג לתאים עם התמרה ויראלי, המאפשר את מצב החמצון של תאי subcellular להיות מוערך מבלי לשבש את התהליכים הסלולריים. Cysteines מופחת ו cysteines תחמוצת של רוfp יש עירור מקסימה ב 488 ננומטר ו 405 nm, בהתאמה, עם פליטה ב 525 nm. הערכת היחס בין צורות מופחתות ומחמצנים מאפשרת חישוב נוח של איזון מחדש בתוך התא. במאמר שיטה זה, מונצח האדם האנושי משולשת שליליים סרטן השד תאים (מד א-MB-231) שימשו כדי להעריך את הסטטוס של חמצון בתוך התא החי. שלבי הפרוטוקול כוללים התמרה מד-התאים מספר 6-1-MB-231, הטיפול ב-H2O2, והערכה של היחס ציסטאין וציסטינה עם שתי הזרימה הציטונסות והמיקרוסקופיה הפלואורסצנטית.
Introduction
לחץ חמצוני הוגדר ב 1985 על ידי הלמוט שעירים כמו "הפרעה ב-prooxidant-מאזן נוגד חמצון לטובת לשעבר"1, ושפע של מחקר נערך כדי להשיג מחלות-, תזונה-, ו-הזדקנות-מעמד החיים ספציפי חמצון של אורגניזמים1,2,3. מאז, ההבנה של לחץ חמצוני הפך להיות רחב יותר. בדיקת השערות של שימוש נוגדי חמצון נגד מחלות ו/או הזדקנות הראו כי לחץ חמצוני לא רק גורם נזק אלא גם יש תפקידים אחרים בתאים. יתר על כן, מדענים הראו כי רדיקלים חופשיים לשחק תפקיד חשוב עבור התמרה אות2. כל מחקרים אלה מחזקים את החשיבות של קביעת השינויים הפחתת חמצון היחס של קרו. פעילות אנזימים, נוגדי חמצון ו/או חמצון, ומוצרי חמצון ניתן להעריך עם שיטות שונות. בין אלה, שיטות הקובעות חמצון תיול הם ללא ספק המשמשים ביותר משום שהם מדווחים על האיזון בין נוגדי חמצון ו prooxidants בתאים, כמו גם אורגניזמים4. במיוחד, היחס בין הגלוטתיון (gsh)/גלוטתיון קשר דיסולפידי (gssg) ו/או ציסטאין (cys)/cyסטינה (cyss) משמשים כסמנים לניטור מעמד החמצון של אורגניזמים2.
שיטות המשמשות לאמירת האיזון בין prooxidants ונוגדי חמצון להסתמך בעיקר על רמות של חלבונים מופחת/תחמוצת או מולקולות קטנות בתוך תאים. הכלים המערבי וספקטרומטר המסה משמשים כדי להעריך באופן כללי את היחס של מופחת/תחמוצת קרו (חלבון, שומנים וכו '), ו gsh/gssg יחס יכול להיות מוערך עם ספקטרופוטומטר5. תכונה נפוצה של שיטות אלה היא הנטייה הפיזית של המערכת על ידי הליזה תא ו/או רקמת המגון העור. מנתח אלה גם להיות מאתגרת כאשר יש צורך למדוד את מצב החמצון של תאים סלולריים שונים. כל אלה מרטבאליות לגרום לחפצים בסביבת העבודה.
החלבונים הניאון הרגישים מחדש פתחו עידן היתרון להערכת איזון החמצון מבלי לגרום להפרעה בתאים6. הם יכולים למקד תאים תאיים שונים, המאפשר כימות של פעילויות ספציפיות לחלקה (g., לומר את המצב החדש של המיטו, ואת הציטוסול) כדי לחקור את הקשר בין אורגלים סלולריים. חלבון פלורסנט צהוב (YFP), חלבון פלורסנט ירוק (GFP), וחלבונים HyPeR נבדקים על ידי מאייר ועמיתיו6. בין החלבונים האלה, החמצון הרגיש (gfp) הוא ייחודי עקב קריאות פלורסנט שונות של cys (ex. 488 ננומטר/em. 525 nm) ו-cyss (ex. 405 nm/525 nm) שאריות, אשר מאפשרת ניתוח של טימטרי, בניגוד לחלבונים אחרים הרגישים מפני חמצון כגון yfp7,8. פלט טימטרי הוא בעל ערך מכיוון שהוא מאזן את ההבדלים בין רמות הביטוי, הרגישויות לזיהוי והלבנתשמונה. תאי משנה של תאים (ציטוזול, המיטומטר, גרעין) או אורגניזמים שונים (חיידקים, כמו גם תאים ממיונקים) ניתן לפלח על ידי שינוי רוfp7,9,10.
הספר מבוצע באמצעות טכניקות הדמיה פלואורסצנטית, במיוחד עבור ניסויים חזותיים בזמן אמת. ניתוח ציטומטלי זרימה של "רומינטריק" ניתן גם לניסויים בנקודות זמן שנקבעו מראש. המאמר הנוכחי מתאר הן את השימוש של מיקרוסקופ פלורסנט ואת הזרימה cy, מנסה לבצע הערכה מחודשת של מעמד החמצון בתאי היונקים overexpressing (ממוקד ציטוסול) באמצעות התמרה ויראלית.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: פרוטוקול זה הותאם במיוחד ל-70%-80% בתאים מד א-231-MB. עבור קווי תאים אחרים, יש למטב מחדש את מספר התאים וריבוי הזיהומים (מוי).
1. הכנת תאים (יום 1)
- שמור מד א-MB-231 קו תא ב 75 ס"מ2 מבחנות עם 10 מ ל של מדיום שונה של הנשר של Dulbecco (dmem) שיושלם עם 10% סרום העובר העוברי (fbs) ב 37 ° c ב 5% CO2 מחולל אווירה.
הערה: DMEM בתוספת של 10% FBS, 37 ° c, ו-5% CO2 מחולל אווירה משמשים עבור כל הקבצים המצורפים והטיפול incubations במהלך כל הפרוטוקול. - הכן את תאים מד-ה231. לניסוי
- מוחלק את המדיום בתוך הבקבוקון, לנתק את התאים עם 2 מ ל של 0.25% טריפסין-EDTA פתרון עבור 2 דקות, ו להשבית את הפעילות טריפסין עם 6 מ ל של בינונית מלאה (DMEM זיכרון עם 10% FBS). צנטריפוגה את התאים ב 150 x g עבור 5 דקות. ומכה את הסופרנטאנט ומשהה את התאים ב -5 מ ל של מדיום שלם.
- מערבבים מתלה שווה של תאי נפח ו-0.4% טרי, כחול. קח 10 μL של תערובת זו ולספור את התאים עם מונה התא האוטומטי.
הערה: ניתן להשתמש בדלפק של קולטר או בהאנטי-הומוציטוטר לספירת תאים. - הזרע את התאים לתוך 6 צלחת הבאר לצורך זרימה cy, ניתוח הזרע 150,000 תאים בגודל 1 מ ל בינוני לכל טוב. המתן 16 שעות לקובץ מצורף לתא.
- זרע את התאים לתוך 4 שקופית קאמרית היטב עבור דימות פלורסנט ו-seed 25,000 תאים 0.5 mL של בינוני לכל טוב. המתן 16 שעות לקובץ מצורף לתא.
הערה: בארות בקרת זרעים בנוסף לבארות טיפול. השתמש באחת מבארות הבקרה כדי לקבוע את מספר התאים (אופציונלי: אם תקופת הקובץ המצורף עבור התאים קצרה מזמן ההכפלה, ניתן להניח שמספר התאים זהה לצפיפות הזריעה) והשני עבור פקד שאינו נגוע (0 מע).
2. אדנגיזציה של התמרה (יום 2 ו -3)
התראה: אדנווירוסים יכולים לגרום למחלות. בעת העברת התאים, השתמש בטיפים מסוננים ובטיפים טהרים, בפיפטות פסטר ובצינורות מיקרוצנטריפוגה עם מלבין 10%.
הערה: פרוטוקול זה הוכח עם כמות מסוימת של התאים הסלולאריים ציטוסול, אך בתאי הסלולר האחרים (למשל, מרחב מיטוכונדריאני או מנשא) יכול להיות ממוקד עם אותו פרוטוקול.
- צור עקומת מינון-תגובה עבור משרד המידע כדי להשיג את יעילות התמרה הגבוהה ביותר על-ידי חישוב הנפח של אדנווירוס (mL) הנדרש עבור כל ערך משרד ה-i-MB-231 קו תא (טבלה 1):
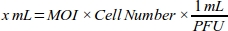
הערה: סיכוייו פונקציונלי של כל אצווה של מלאי אדנונגיפי, אשר מבוטא כיחידת היווצרות פלאק (pfu) לכל mL, מסופק על ידי החברה. משרד המידע האופטימלי לצורך התמרה שונה בין סוגי תאים. עבור מרבית תאי היונקים, טווח משרד המידע האופטימלי הוא בין 10 ל-300. על פי התגובה התאית, ערכי משרד התקשורת צריכים להיות מחושבים מחדש (למשל, טווח מוי צריך להיות מופחת אם התאים יש תגובה ציטוטוקסיים, או טווח צריך להיות מוגבר אם לתאים יש התמרה נמוכה יעילות). - הפוך 1:100 דילול של 6 x 1010 pfu/mL אדנוויראלי הפתרון עם התרבות התאית בינונית (dmem עם 10% fbs) עבור מלטף אמין.
- פיפטה ולהוסיף 0.0125 mL (12.5 μL), 0.025 mL (25 μL), 0.05 mL (50 μL) של אדנוויראלי של הדילול לתוך כל באר של 6 צלחת הבאר על מנת לשנות את התאים ה150,000 עם 50, 100, ו-200 מע בהתאמה עבור הניתוח cy, לעבורבטבלה 1.
- הפיפטה והוספת 0.0042 mL (4.2 μL) של הדילול האנטי-ויראלי בבארות בארבע שקופיות הקאמרית כדי לשנות את 25,000 תאים עם 100 מע להדמיה (שולחן 1).
הערה: כמות מינימלית של בינונית יש להשתמש בבארות כדי להבטיח את האינטראקציה הגבוהה ביותר בין המבנה והתאים של ה-הנגיף. את התוכן סרום של מדיום התרבות ייתכן שיהיה צורך להקטין עבור קווי תאים שונים, כי רמות גבוהות של סרום יכול להשפיע לרעה על יעילות התמרה בסוגי תאים מסוימים. - התאים הדגירה עבור 16 – 24 שעות תחת תנאי תחזוקה תא. למחרת (יום 3), לשנות את המדיום לתרבות התאים בינונית (DMEM עם 10% FBS) כדי לאפשר שחזור התא 24 שעות נוספות. לדמיין את התאים תחת מיקרוסקופ כדי להעריך את המבנה שלהם; תאים יכולים לבטא את רוfp גם אם יש להם שינויים מורפולוגיים.
הערה: ביום 3, התאים אמורים להתחיל לבטא את רוfp; לכן, יעילות התמרה ניתן לפקח באמצעות מיקרוסקופ קרינה (מסננים עם ex. 488/em. 525). כדי להשיג תוצאות עקביות עקבית, להיות מודעים ולתעד את השינויים מורפולוגיים תחת מיקרוסקופ הניגודיות פאזה ולבחון מורפולוגיה תוך הערכת יעילות התמרה. - לבנות עקומת התגובה מינון באמצעות 50, 100 ו 200 ממוי דגימות מוכן בשלב 2.3 התוצאות יעילות התמרה שלהם שהתקבלו מהניתוח זרימה cy, שלבים 3.1 ו-4.1. הערכת יעילות התמרה אופטימלית עם תיעוד של שינויים מורפולוגיים (שלב 2.5) ואת עקומת המינון-תגובה של משרד הבין.
הערה: למרות שיותר מ-98% מאוכלוסיית התאים ב-100 מארה ב ו200 מארה ב מבטאים את זה (ראו תוצאות מייצגות), 200 החברה מארה ב הראתה שינויים ניכרים במבנה התאים של תאי מד א-MB-231. כתוצאה מכך, משרד המידע היעיל ביותר עבור תאים מד א-MB-231 היה נחוש להיות 100. - לאחר משרד הפנים האופטימלי (כאן, 100 מע) נבחר עבור קו התאים מד א-MB-231, התנהלות ניסוי עם חומרי בדיקה (10 μM H2O 2 והרכב שלה 0.1% המים).
- הכן והזרע את התאים לפי סעיף 1. שימוש בנפח התמרה ויראלי עבור 100 מע מחושב בשלב 2.1, חזור על שלבים 2.2-2.4 עבור 100 מארה ב. התמרה ויראלית של תאים. לאחר מכן מודקת את הצלחת ואת שקופיות קאמרית לפי שלב 2.5.
3. רכישת מאזן כלוניים
- הציטוצינסי זרימה (יום 4)
- ביום 4, בתאי הדגירה משלב 2.7.1 עם 10 μM H2O2 עבור 1 H.
הערה: 10 μM H2או2 שימש כחומר המבחן ו 0.1% המים האלה שימשו כטיפול ברכב בפרוטוקול זה. סוכני חמצן אחרים יכולים לשמש כפקדים חיוביים כאן. - מספר מדיה מ 6 צלחת הבאר, להחליף עם 750 μL של 0.25% טריפסין-EDTA פתרון ולחכות 2 דקות לתאים להתנתק. הפעל טריפסין עם 2 מ ל של בינוני מלא (DMEM עם 10% FBS) ולאסוף את אמצעי האחסון לתוך 15 מ"ל שפופרות חרוט.
- צנטריפוגה את הצינורות ב 150 x g עבור 5 דקות ב 4 º c. להיפטר supernatant ולהשעות את התאים ב 500 μL של מלוחים מאגור פוספט (PBS).
- חזור על שלב 3.1.3
- לסנן את השעיות התא לתוך הזרימה cy, התואם צינורות באמצעות 40 יקרומטר רשת שינוי. לשמור על הצינורות על הקרח והרחק מן האור ובצע צעד 4.1 עבור ניתוח נתונים.
- ביום 4, בתאי הדגירה משלב 2.7.1 עם 10 μM H2O2 עבור 1 H.
- הדמיה מיקרוסקופית (יום 4)
- ביום 4, לטפל בתאים עם 10 μM H2O2, לרכוש תמונות מיד (נקודת זמן 0) ו 1 H לאחר הטיפול ובצע צעד 4.2 עבור ניתוח נתונים.
4. ניתוח נתונים
- מכמת
- הגדרת שיטת הזרימה cy, עבור 3 ניתוחים שונים באמצעות תוכנה לרכישתמדגם (ראה טבלת חומרים): פיזור הקדמי (fcs) על ציר x ופיזור בצד (הסוכנות למען המוות) על ציר y כדי להעריך את גודל התא ואת המורכבות של תאים (הסוכנות למען האו לזיהוי מחוספס של תאים לחיות); לשעבר. 488 ננומטר 525 ננומטר (פלואורואסעין איזוטיאוקלאט [FITC]) מסנן על ציר ה-x ו-אס. סי. על ציר y כדי להעריך את CyS-רוfp; לשעבר. 405 ננומטר 525 nm (סגול מבריק 510 [BV510]) מסנן בנדנה על ציר ה-x ו-ss על ציר y כדי להעריך CySS-רוfp.
- רוכשים בקרת משרד הפיקוח 0 ומדמיינים תאים עם תוכנת רכישה לדוגמה. חזור על שלב זה עבור הדגימות הנותרות (50, 100, 200 ממוי קבוצות ומאוחר יותר על 10 μMH 2O2 תאים מטופלים ותאים טיפול בכלי רכב). שמור את הקבצים לניתוח נתונים.
- פתח את תוכנת ניתוח הנתונים (ראה טבלת חומרים) ופתח קובץ לדוגמה 0 ממוי. הערכת האוכלוסיה של התאים המעניינים (שער 1). הגדר את הגגים הבאים כדי למזער את הזריחה של הרקע עבור ex. 488 ננומטר/em. 525 nm (שער 2) ו-ex. 405 ננומטר/em. 525 nm (שער 3) מסנני בנדנה עם תאי בקרה שאינם נגועים (0 מע).
- פתח את הקבצים 50, 100 ו-200 מארה ב בתוכנת ניתוח נתונים כדי להעריך את עקומת תגובת המינון. לנתח את עוצמות הזריחה עם גייטס 2 ו 3 עבור כל מדגם. חזור על שלב זה עבור דגימות בדיקה (10 μM H2O2 תאים מטופלים ותאים הטיפול ברכב).
- לחשב את היחס עוצמת פלורסנט ממוצע בין תחמוצת לעומת צורות מופחתת של רוfp עם המשוואה הבאה.

- הערכת תמונות
- השתמש במיקרוסקופ המכיל מסנני קרינה עבור CyS-רוfp ו-CySS-רוfp (ex. 488 ננומטר/em. 525 nm ו ex. 405 ננומטר/em. 525 מסננים ננומטר, בהתאמה).
- בכל באר של שקופית קאמרית, לבחור 4 אזורים אקראיים להשיג תמונות, באמצעות מטרת 4x כדי להמחיש אזורים גדולים יותר.
הערה: ניתן להשתמש במטרה 20x גם עבור תצוגות תמונה. - פתח את התמונה באמצעות תוכנת ImageJ11. החל את הניתוח | למדוד פקודות עבור כל תמונה ולהשתמש במשוואה בשלב 4.1.5 כדי לכמת את הנתונים.
הערה: קוונפיקציה של התמונות הוא מטימטרי; לפיכך, הפרוטוקול אינו כולל חיסור של רקע. עם זאת, כדי שתוכל להשוות בין תמונות, בהירות, ניגודיות ורוויה, עליך להיות זהה עבור כל תמונה. מובהקות סטטיסטית הוערך בניתוח חד כיוון של שונות (ANOVA) ו-Tukey הבדיקה הפוסט הוק.
Access restricted. Please log in or start a trial to view this content.
תוצאות
המצב החדש של ה-CyS/CySS הוא בקלות עם התמרה באמצעות מדידה של רוfps. בדיקת פלורסנט מכמת את היחס בין צורות מופחתת ו תחמוצת (העירור אורכי גל 488 nm ו 405 nm, בהתאמה). נתונים בעלי קרינה פלואורסצנטית ניתן להשיג על ידי שניהם cy, הזרמת לנסות מיקרוסקופ.
מספר גדול של תאים יכול בעקביות ובנוחות להיות ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
האיזון הטימלי/דיגופרתי באורגניזם משקף את מעמדם החדש של תאים. אורגניזמים חיים יש גלוטתיון, cysteine, החלבון thiols, ו נמוך מולקולרי משקל thiols, כולם מושפעים על ידי רמת החמצון ואת הד מעמד החמצון של תאים4. הנדסה מהונדסים לאפשר את הכמת הבלתי מפריעה של האיזון thiol/disulfide באמצעות שאריות CyS שלהם
Access restricted. Please log in or start a trial to view this content.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המבנה ו רקומביננטי אדנווירוס להבעת ציטוסול ספציפי מסוים בתאים נוצרו במעבדה של פול ט. שואקר, PhD, פרייברג בית הספר לרפואה, אוניברסיטת נורת'ווסטרן, ו ViraQuest Inc., בהתאמה. מחקר זה היה נתמך על ידי המרכז ללימודי תגובה מארחת לטיפול בסרטן המענק P20GM109005 דרך המכון הלאומי NIH של מרכזים למדעי הרפואה הכללית של מצוינות מחקר ביו-רפואי (COBRE כולשי), המכון הלאומי של מערכות מדעי הרפואה הכללית פרמקולוגיה וטוקסיקולוגיה תוכנית ההכשרה מענק T32 GM106999, קרן UAMS/ הזרם cy, ליבת מתקן הליבה היה נתמך בחלקו על ידי המרכז לפתוגנזה ומארח תגובות דלקתיות להעניק P20GM103625 באמצעות הקצעם COBRE. התוכן הוא רק באחריות המחברים ואינו מייצג בהכרח את ההשקפות הרשמיות של ה-NIH. ATA נתמכת על ידי מועצת המחקר המדעית והטכנולוגית של טורקיה (TUBITAK) 2214-מלגה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
References
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved