Method Article
מודל Drosophila לחקר פוליפלואידים הנגרמים על ידי פצע
In This Article
Summary
פוליפואידציה הנגרמת על-ידי פצע היא אסטרטגיה של תיקון רקמות שוחמרות שבה תאים גדלים בגודל במקום לחלק כדי לפצות על אובדן תאים. הנה פרוטוקול מפורט על איך להשתמש בזבוב הפירות כמודל למדוד תכסיסה ויסות גנטי שלה בתיקון פצעים אפיתל.
Abstract
Polyploidy היא תופעה תכופה שהשפעתה על בריאות אורגניזמית ומחלות עדיין לא מובנת היטב. תא מוגדר פוליפלואיד אם הוא מכיל יותר מעותק diploid של הכרומוזומים שלה, שהוא תוצאה של אנדורפול או היתוך תא. בתיקון רקמות, פוליפלואידים הנגרמים על ידי פצע (WIP) נמצאה כאסטרטגיית ריפוי שנסמרה מזבובי פירות ועד בעלי חוליות. WIP יש מספר יתרונות על התפשטות תאים, כולל התנגדות לצמיחה oncogenic ומתח genotoxic. האתגר היה לזהות מדוע תאים פוליפלואידים מתעוררים וכיצד תאים ייחודיים אלה מתפקדים. מסופק הוא פרוטוקול מפורט ללמוד WIP באפיתל זבוב פירות למבוגרים שבו תאים פוליפלואידים נוצרים בתוך 2 ימים לאחר פצע דקירה. ניצול של ערכת הכלים הגנטיים הנרחבת של D. melanogaster, הגנים הנדרשים ליזום ולווסת WIP, כולל Myc, החלו להיות מזוהים. מחקרים מתמשכים בשיטה זו יכולים לחשוף כיצד משתנים גנטיים ופיזיולוגיים אחרים כולל מין, דיאטה, וגיל לווסת ולהשפיע על תפקוד WIP.
Introduction
מנוגסטר Drosophila היא מערכת מודל אטרקטיבית ללמוד את המנגנונים הסלולריים והמולקולריים של תיקון פצע אפיתל. כמו ביונקים, מנגנוני תיקון הרקמות המשמשים תלויים הן ברקמה והן בשלב ההתפתחותי שלה. ריפוי פצע ללא צלקות מתרחש בעובר זבוב הפירות שבו אקטומיויסין "מחרוזת הארנק" צורות בקצה המוביל אפיתל המאפשר את הפצע לסגורבצורה חלקה 1,,2. ריפוי פצע לאחר העובר בזחלים, גלימות, וזבובי פירות למבוגרים תוצאות שיפוץ מטריצה extracellular, היווצרות צלקת מלנין, וצמיחת תאים אפיתל3,,4,,5,6. תאי האפיתל להגדיל את גודל על ידי היתוך התא ואת endocycle, מחזור תא לא שלם העוקףמיטוזה 3,,4,,7,8. כתוצאה מכך, אובדן תאים מפוצה על ידי צמיחת תאים polyploid במקום חלוקת תאים. המבוגר לטוס hindgut, midgut, ו אפיתל זקיקים גם להסתמך על צמיחת תאים פוליפלואידים כדי לפצות על אובדן תאים לאחר נזקלרקמות 9,10,11.
Polyploidy הוא היבט ידוע של התפתחות אורגנית בצמחים וחרקים, אבל בשנים האחרונות זה הפך להיות יותר ברור כי polyploidy היא אסטרטגיה תיקון רקמות שוחמר בעלי חוליות12. דג הזברה, אשר יש את היכולת לחדש את לבו, מסתמך על צמיחת תאים polyploid לרפא epicardium פגום13. Polyploidy גם תורם התחדשות הכבד יונקים תיקון אפיתל צינור כליה לאחר פציעהחריפה 14,15. בדוגמאות אלה, תאים polyploid נוצרים על ידי אנדורפולציה באמצעות אנדוציקל או אנדומיטוזיס, וכתוצאה מכך תא binucleated עקב בלוק ציטוקינזיס12. האניגמה היא הסיבה לכך שתאי פוליפזואיד מתעוררים במהלך תיקון הפצע וכיצד polyploidy משפיע על תפקוד הרקמה. מחקרים אחרונים סיפקו תובנה חדשה לשאלה אם polyploidy מציע יתרון ריפוי או חיסרון. באפיקארדיום דגי זברה, polyploidy שיפר את המהירות של ריפוי הפצע13. ב D. מלנוגסטר hindgut וכבד יונקים, polyploidy נמצא המגן מפני צמיחה oncogenic11,14. באפיתל זבוב למבוגרים, לאחרונה נמצא כי polyploidy מאפשר תיקון הפצע בנוכחות מתח גנוטוקסי16. אנדורפולציה עמידה בפני נזק DNA, המאפשר ריפוי הפצע כאשר התפשטות תאים אחרת היה בסכנה17. עבור cardiomyocytes בלבבות עכבר וזברה, עם זאת, polyploidy מאט ריפוי, וכתוצאה מכךהיווצרות צלקת משופרת 18,19. לכן, בהתאם לאיבר ו/או סוג התא, polyploidy יכול להיות אסטרטגיה מועילה או מזיקה לתיקון רקמות. הנגישות של גנטיקה מלנוגסטר D. יחד עם ניתוח של תגובת פוליפלואידציה (WIP) הנגרמת על ידי פצע להפוך אותו למערכת מודל אידיאלית להדרת מנגנונים מולקולריים ותאיים המנחים אסטרטגיה זו ריפוי הפצע.
כאן, אנו מציגים פרוטוקול לניתוח WIP באפיתל D. מלנוגסטר למבוגרים. כלולים הוראות לפציעה זבוב פירות, ניתוח, חיסון, הרכבה, הדמיה, וניתוח של אפיתל מחדש, היתוך תאים, אנדורפול (ploidy). ניתן להתאים את ניתוח ההדמיה והתכסיס גם למודלים אחרים כדי לבדוק אם WIP מתרחש. יש ל ציין כי עם עלייה בתכני ה-DNA הגרעיני יש לעתים קרובות עלייה מקבילה בגודל גרעיני. עם זאת, ישנן דוגמאות רבות בביולוגיה שבהן גודל גרעיני אינו משקף שינוי מקביל בתכסיס20. עוד יותר זהירות יש לנקוט בעת פרשנות גודל גרעיני בהקשר של סביבת הפצע שבו תאים לעתים קרובות להתפשט או למתוח כדי לכסות את אתר הפצע. לכן, ההוכחה המוחלטת היחידה לשינוי בתחבולה היא למדוד תוכן DNA בשיטה זו (או אחרים, כגון רצף גנום שלם)21. שיטה זו מגבירה את התאמתו של אפיתל הבטן D. מלנוגסטר למבוגרים כמודל ללמוד את התפקיד ואת הרגולציה של polyploidy בתיקון הפצע.
Protocol
1. היערכות ופצע של זבובי פירות בוגרים
- בחר D. מלנוגסטר זן של בחירה (כלומר, epi-Gal4 / כב"מים זן, ראה טבלת חומרים).
הערה: כאן, מערכת Gal4/UAS משמשת כדי לאפשר ביטוי גנים ספציפי אפיתל (epi-Gal4) של גן או RNAi מקודד במורד הזרם של כ"כים. מחקר זה משתמש בחלבון קרום פלורסנט (כ"כים-CD8.mRFP), גורם מיטוטי(כ"א-fzr RNAi, כעבותית-stg) ומעכב WIP (UAS-E2F1RNAi; UAS-RacDN). - אספו שני בקבוקונים של 10-15 זבובי פירות נשיים חדשים כל וגיל על בקבוקונים של מזון טרי ב-25°C עד גיל 3-5 ימים. בקבוקון אחד ישמש כשליטה ללא פגע והמבען השני ייפצע כמתואר להלן. יש לשמור על הזבובים הנקבה עם זכרים (כ-5/בקבוקון).
- כדי לפצוע את הזבובים, להרכיב כמה מחזיקי סיכה כל אחד עם סיכה אחת 0.10 מ"מ נירוסטה. ודא שהסוף החד של הסיכה פונה כלפי החוצה. סיכות יכול בקלות לכופף או שבב לאחר ניקוק הזבוב סיכות מכור או פגום צריך להיזרק.
- להנהים פירות נשיים מבוגרים זבובים על CO2 -לטוסכרית תחת stereomicroscope וליישר אותם לשורה באמצעות מברשת צבע. מרכיב משקפי בטיחות, מחזיק את מחזיק הסיכה ביד אחת ומכריח ביד השנייה, להשתמש מפסים כדי למקם זבוב עם הבטן הפתחית שלה פונה כלפי פנים.
- לנקב את הנקבה הבוגרת זבובים בתוך אזור pleurite אפיתל של tergite A4 משני צידי החזה האמצעי הגחוני(איור 1א'). ניקוב אזור גחני זה מספק מרחב אופטימלי הרחק מאתרי הקרע שבהם קצוות הרקמה יהיו קרועים על ידי עיבוד מכני.
- להחזיר זבובים פצועים למבען המזון וגיל לפציעה הרצויה ביום שלאחר (dpi). ריפוי פצע אפיתל מתחיל ב 1 dpi ומסתיים על ידי 3 dpi. אנדורפול מגיע לשיא של 2 dpi, שהוא אידיאלי עבור edU אסא (סעיף 4, איור 2).
2. טוס בטן
הערה: בשלב זה, חשוב להימנע מלגעת ברקמת הבטן הפתחית עם כלי הניתור, כי זה יפגע בשלמות האפיתל.
- להשיג את כל החומרים הדרושים עבור ניתוח: הפתרון של גרייס, מקציפים, מספריים האביב של ואנה, 0.10 מ"מ סיכות, לחתוח צלחות, 9 צלחת כרית זכוכית גם, תמיסה קיבעון (4% paraformaldehyde ב 1x PBS), 1x PBS, מגבונים, pipettes וטיפים עבור 30 μm, וכפפות (ראה שולחן של חומרים).
- ודא כי זבובים נפגעו בהצלחה על ידי זבובים פצועים מברמה על CO2-לטוס כרית תחת stereomicroscope ולבדוק את הנוכחות של צלקת הפצע (כלומר, נקודה מלנין עלהבטן, ראה איור 1B ). השליכו זבובים מהקבוצה הניסיונית שלא נפצעו בהצלחה.
- כדי להתחיל לנתח, למלא באר אחת של צלחת 9 באר זכוכית עם הפתרון של גרייס. השתמש בזוג מרטנים כדי לתפוס זבוב נקבה פצועה על ידי הצד הגב של בית החזה ולהחדר את הזבוב בבאר המכילה את הפתרון של גרייס.
- באמצעות מקציות ביד הנגדית מבלי לשחרר את בית החזה, לנקב את עור הגב מתחת tergite A6 ולמשוך את העורן מהקצה האחורי של זבוב הפרי. האיברים הפנימיים (השחלה והמעי) בדרך כלל לצאת בשלב זה. אם לא, בעדינות לדחוף על הצד הגב של הבטן עם המלחציים לסחוט את האיברים הנותרים ולזרוק לתוך באר ריקה.
- הצמד את הבטן המלאה בצומת בית החזה מעל tergite A2 באמצעות המגרסה ולהעביר את הבטן לבאר ריקה המכילה ~ 100 μL של הפתרון של גרייס.
- חזור על שלבים 2.3-2.5 עד שכל הבטן המעופף יחתכו.
- להפחית את נפח הפתרון של גרייס ל 30 μL בבאר המכילה מאגר, בטן נותח.
- פילה הבטן נפתחת על ידי מיקום הבטן בצד הגב עם הממחצותים ביד אחת ולאחר מכן החדרת הלהב התחתון של מספריים האביב של ואנה לחלל הבטן ביד השנייה. חותכים לאורך קו האמצע הגב עד הבטן נפתחת באופן מלא, אשר יכול לדרוש עדשלושה חתכים (איור 1C, 1D).
- הגדר צלחת ניתוח יבש עם ארבעה סיכות 0.10 מ"מ לכל אזור הרכבה בבטן. כל לוח לנתח 35 מ"מ יכול להתאים עד שבעה אזורי הרכבה. פיפטה 30 μL של הפתרון של גרייס על כל אזור הרכבה ולהעביר בטן פילה אחת לכל טיפה.
- מצמידים את הבטן פילה לצלחת על ארבע פינות הגב(איור 1E). ודא כי הרקמה שוכב שטוח מבלי לקרוע או מתוח יתר על המידה את רקמת הבטן.
- כדי לתקן את הרקמה, פיפטה את הפתרון של גרייס ולהוסיף 30 μL של פתרון לתקן לבטן מוצמדת.
התראה: ללבוש כפפות תוך כדי טיפול בתמיסת התיקון, כמו paraformaldehyde הוא רעיל. - חזור על שלבים 2.10-2.11 עד שכל הבטן פילה מוצמדת על לוח החתור.
- מקם תווית קלטת בתחתית כל מנה כדי לסמן כל פקד וקבוצה ניסיונית. תקן דגימות במשך 30-60 דקות בטמפרטורת החדר (RT).
- לשטוף את פתרון לתקן על ידי pipetting על 1.5 מ"ל של 1x PBS לכל צלחת. להיפטר פתרון תיקון ופלסטיק במכולות פסולת כימית נוזלית או יבשה המתאימים על פי הנחיות מוסדיות.
- צלחות רחצה 2x עם 1.5 מ"ל של 1x PBS ולאחסן רקמה קבועה מכוסה 1.5 מ"ל של 1x PBS במיכל פלסטיק עם מכסה. מוסיפים שכבה של מגבת נייר לחה לתחתית המכולה ומאחסנים דגימות ב-4°C עד שהם מוכנים לחיסונים בתוך שבוע אחד של ניתוח.
3. אימונולוסיות
- הכנת מחדש של רייגנטים (ראה טבלת חומרים):פתרון מאגר כביסה (0.3% Triton X 100, 0.3% BSA ב- PBS אחד). ניתן לשמור את מאגר השטיפה שנותר ב- 4°C ולהשתמש בו למשך פרוטוקול ההכתמה של יומיים. הכן מספיק פתרון נוגדנים ראשי לכל תסה(איור 2)באמצעות אנטי-FasIII (1:50 העכבר נגד Fasciclin-III) במאגר כביסה עם אנטי-Grh (1:300 זיקה ארנב מטוהר נגד Grainyhead8)או נגד RFP (1:1,000 ארנב נגד RFP). ניתן לשמור את פתרונות הנוגדנים העיקריים ב-4°C ולהשתמש בהם מחדש מספר פעמים עד שהאות יופחת באופן משמעותי.
- לחלחל רקמה על ידי pipetting את 1x PBS, הוספת 1.5 מ"ל של מאגר כביסה, ותורגור לפחות 30 דקות על שייקר מסלולי (80 סל"ד) ב RT.
- הסר מאגר כביסה ורקמות כתם בן לילה עם 1.5 מ"ל של פתרון נוגדן ראשי, דגירה על שייקר מסלולי (80 סל"ד) ב 4 ° C. לאסוף את פתרון הנוגדנים הראשי ולשמור בצינור ב 4 ° C לניסויים עתידיים.
- תחילה לשטוף את הדגימה במהירות עם PBS 1x ולאחר מכן לשטוף 3x עם 1.5 מ"ל של מאגר כביסה. עבור כל שטיפה, דגירה דגימות ב RT על שייקר מסלולית במשך 30 דקות לפחות.
- במהלך השטיפה הסופית, הכינו את פתרון הנוגדנים המשני: 1:1,000 חמור נגד ארנב אלקסה 488 או 568 ו-1:1,000 עז נגד העכבר אלקסה 488 או 568 (או פלואורופורים של בחירה) במאגר כביסה.
- הסר מאגר כביסה ורקמות כתם עם 1.5 מ"ל של פתרון נוגדן משני. לכסות דגימות עם רדיד אלומיניום ודגירה על שייקר מסלולית ב RT במשך 3 שעות. לחלופין, ניתן לדגום דגימות למשך הלילה ב-4°C על שייקר מסלולי.
- לשטוף דגימות על ידי השלכה ראשונה של פתרון נוגדנים משני ולאחר מכן לשטוף דגימה במהירות עם PBS 1x ואחריו שלוש שטיפה עם 1.5 מ"ל של מאגר כביסה. עבור כל שטיפה, דגירה דגימות ב RT על שייקר מסלולית במשך 30 דקות לפחות.
- הכן פתרון DAPI על-ידי דילול DAPI ל- 10 μg/mL במאגר כביסה. לאחר השטיפה הסופית, דגימות כתם עם פתרון DAPI 1.5 מ"ל דגירה ב RT במשך 30 דקות.
- בטל פתרון DAPI ושטיפה של דגימות פי 2 ב- 1.5 מ"ל של PBS אחד. לאחסן רקמה מוכתמת ב 1.5 מ"ל של 1x PBS בחושך, מכוסה רדיד אלומיניום, ב 4 ° C עד מוכן לעלות על מגלשת זכוכית עם כיסוי. שלב ההרכבה אמור להתבצע בתוך שבוע אחד.
4. פעילות מחזור תא (EdU Assay)
- המציא פתרון מניות 10 mM EdU מתוך ערכת Click-iT (ראה טבלת חומרים)על ידי המסת אבקת EdU ב dH20 ומערבוב במשך ~ 15 דקות עד מומס לחלוטין. פתרון המניות ניתן לצטט (250 μL לכל שפופרת) ומאוחסן ב -80 °C.
- ההזנה מטיסה EdU על ידי דילול הראשון של מלאי EdU ל-5 מ"מ ב-dH2O. הוסף שמרים יבשים עד שהפתרון מעונן ולזמן קצר לערבב. חותכים מכסה צינור 0.5 מ"ל ולמקם אותו בתחתית בקבוקון מזון לטוס. תדחפי את הכובע לתוך האוכל, כך שהיא תייצב.
- להנרים את הזבובים ולהעביר זבובים בני 3-5 ימים לתוך הבקבוקון. הקש על הזבובים לקצה אחד כדי שאף אחד לא יהיה תקוע בכובע.
- פיפט 75 μL של תמיסת שמרים-EdU לתוך הכובע. יש להאכיל זבובים פתרון שמרים-EdU טרי מדי יום ולעבור למבכסן מזון טרי עם כובע כל יומיים כדי להבטיח שהזבובים לא ייתקעו בתחתית הבקבוקון.
- כדי להעביר זבובים, הפוך למבען חדש עם כובע, הרדים זבובים, הקש על זבובים לצד אחד והוסף פתרון שמרים-EdU טרי.
- ביום השלישי, לפצוע את הזבובים ולהמשיך להאכיל שמרים-EdU עד לפירוק ב 2 dpi(איור 4א'). עיין בפרוטוקול סעיף 2 עבור שיטות ניתוח וקבעון.
- הכנת ריוגנטים מכתימים EDU: מאגר כביסה (0.3% Triton X 100, 0.3% BSA ב- PBS אחד), מאגר חדירות (0.5% Triton X 100 ב- PBS 1x), חוסם מאגר (3% BSA ב- PBS 1x), ולהכין ריאגנטים ערכת EdU אסאי (ראהטבלת חומרים), כולל מאגר תגובה 1x ותוסף מאגר 1x כפי שהתכוון על ידי היצרן.
- לשטוף דגימות לשעה אחת, ערבוב ב RT ב 1.5 מ"ל של מאגר כביסה.
- הוסף 1.5 מ"ל של מאגר חדירות ודגירה דגימות במשך 20 דקות.
הערה: להפשיר ולהכין פתרון קוקטייל תגובה באמצעות נפח של 500 μL / צלחת. - לשטוף דגימות 1x במהירות עם PBS 1x ולאחר מכן 3x במהירות עם 1 מ"ל של מאגר חסימה.
- פיפטה את כל מאגר החסימה הנותר ולהוסיף 500 μL של פתרון קוקטייל תגובה לכל צלחת. צלחות מערבול כדי להבטיח רקמות מכוסות לחלוטין. דגירה במגירה בחושך במשך שעה אחת בRT.
- לשטוף דגימות 1x במהירות עם 1.5 מ"ל של מאגר חסימה.
- כתם עם 1.5 מ"ל של פתרון DAPI ב 1:5,000 מאגר כביסה במשך 30 דקות.
- יש לשטוף 2x עם PBS אחד במהירות, לעטוף בנייר כסף, ולאחסן בחושך ב 4 ° C עד מוכן להרכיב דגימות בתוך 3 ימים.
5. הר רקמה מוכתמת
- השג את כל החומרים הדרושים להרכבה: שקופיות זכוכית, כיסויי זכוכית, לק צלול, מדיה הרכבה, זוג מלקות ומגבונים.
- כדי להרכיב רקמת זבוב מוכתמת, לבטל את הבטן מצלחת החתיכה באמצעות ממחטות מתחת stereomicroscope. להעביר רקמה ~ 30 μL של הרכבה מדיה על כיסוי זכוכית על ידי בעדינות תופס את הרקמה עם מלקחיים על ידי אגפי הגב שלה, טיפול כדי למנוע נגיעה באזור גחוני עם מלקחיים.
- מתחת סטריאומיקרוסקופ לכוון את רקמת הבטן כך בפנים פונה כלפי מטה לכיוון כיסוי (כלומר, העורון החיצוני / זיפים פונים כלפי מטה). משוך את הבטן הכיוון לקצה של droplet התקשורת באמצעות המקצות. מתח פני השטח יעזור לשמור על הרקמה שטוחה(איור 1F).
הערה: שימושי להדמיה לארגן את הבטן בעמודה או בשורה בשלב זה. - תייג מגלשת זכוכית (כלומר, בקרה או ניסיונית) ואסוף את כיסוי הכיסוי על-ידי הבאת השקופית באיטיות קרוב יותר לסיכות. הפוך את השקופית ותכתם בעדינות עם מחיקה כדי להסיר מדיית הרכבה עודפת.
- אטמו את קצוות הכיסוי עם לק ברור וחזרו על הפעולה עבור כל הקבוצות הניסיוניות הנותרות. אחסן שקופיות בתיבת שקופיות ב- 4°C עד שתהיה מוכנה לתמונה.
6. הדמיה ועיבוד
- תדמיינו את אזור פצע הבטן המעופף על ידי איתור צלקת המלנין עם מיקרוסקופ קונפוקלי(איור 1ב'),סורק נקודות או תאורה מובנית (ApoTome) עם שמן פי 40 או מטרה יבשה.
- בדוק את החשיפה בכל ערוץ, כדי לוודא שהאות נמצא מתחת לרוויה. הגדרות ההדמיה צריכות להתבסס על קבוצת המדגם הבהירה ביותר. זה חשוב במיוחד עבור ניתוח תכסיס כמו ערוץ DAPI צריך להישאר בטווח ליניארי כדי למדוד במדויק את תוכן ה-DNA.
- לצלם תמונה מלאה z-stack בכל שלושת הערוצים עם מרחק אופטימלי של לפחות 0.50 μm בין פרוסות. שמור תמונות שנתפסו ופתח את הקובץ בתוכנית ניתוח התמונה פיג'י (המכונה גם ImageJ).
- עבור כל תמונה, צור הקרנת z-stack באמצעות האפשרות סכום פרוסות עבור כל הערוצים.
- סובב את התמונות כנדרש כדי להבטיח שהגרעין יעמדו בשורה אופקית על-פני תמונות(איור 3 א'A ואיור 4E).
- חתוך את כל התמונות לבחירה מלבנית של 300 μm x 300 μm מרוכז סביב אתר הפצע או מרכז של שליטה ללא פגע. זהה את האזור על-ידי ציור מלבן ובחירה באפשרות ערוך | בחירה | ציין. ודא שיחידות עם קנה מידה נמצאות במיקרונים כדי להבטיח שאותה תיבה בגודל משמשת לניתוח כל התמונות.
7. ניתוח אנדורפול (תכסיס)
- באמצעות Fiji, בחר בחלון ערוץ Grh ושכפול את התמונה. לאחר מכן השתמש בכלי הסף ליצירת מסיכה. כוונן ידנית את הסף על-ידי החלקת הסר העליון כדי למזער את הרקע מבלי לגרום לגרעין להתכווץ באופן דרסטי(איור 4D).
- אם גרעין ים נוגע בתמונת הסף, השתמש בכלי מברשת הצבע (רוחב 2 פיקסלים) באותו צבע כמו הרקע, כדי לצייר קו בין הגרעין. לחץ כדי להחיל 1x כאשר סיים כדי ליצור את המסיכה הסופית.
- צור מפה של אזור עניין (ROI) באמצעות הפונקציה נתח חלקיקים: להגדיר גודל 5 μm-60 μm כדי ללכוד את רוב הגרעין מבלי לכלול את הרקע.
- התאם באופן ידני את מפת ההחזר על ההשקעה בהתאם לצורך מנהל ההחזר על ההשקעה. מחק את כל הבחירות אינן גרעינים ולהוסיף גרעין ים לרשימה שלא זוהו על-ידי חלוקה לרמות של הגרעין באמצעות כלי הבחירה החופשי והוספתו למנהל ההחזר על ההשקעה (איור 4ד).).
- בחר את ערוץ DAPI ולאחר מכן לחץ על הצג הכל מנהל ההחזר על ההשקעה כדי להחיל את מפת ההחזר על ההשקעה ב- Roi שנוצר בערוץ Grh על ערוץ DAPI.
- מחק את כל הבחירות שבהן קו המתאר של גרעין האפיתל חופף לגרעין לא פיתל (לדוגמה, גרעין משריר או שומן) ממפת ROI. מגורען רק מכתים גרעינים אפיתל, בעוד DAPI מכתים את כל הגרעינים. ודא שכל בחירה עם חלוקה לרמות מכילה גרעין אחד בלבד ומחק או ערוך בחירות עם יותר מגרעין אחד. שמור רשימת החזרים על ההשקעה.
- למדוד את האזור ואת הצפיפות המשולבת של כל גרעין אפיתל במפת ROI באמצעות כלי הניתוח בפיג'י. יצא את הערכים לתוכנית גיליון אלקטרוני.
- מדוד את רקע התמונה הממוצע באמצעות כלי הבחירה המעגלי. צייר שלושה עיגולים אינם חופפים לגרעין אף גרעין באזורים שונים של תמונת DAPI. הוסף את האזור ואת הצפיפות המשולבת של כל אחד מהעיגולים לתוכנית גיליון אלקטרוני כדי ליצור את בהירות תמונת הרקע.
- התחל על-ידי חישוב אזור הרקע הממוצע ליחידה עבור כל תמונה על-ידי חלוקת כל ערך צפיפות משולב ברקע לפי האזור המתאים לה. לאחר מכן, ממוצע שלוש מדידות הצפיפות המשולבת באזור עבור התמונה כדי להשיג את הרקע הממוצע לכל אזור יחידה.
- לאחר מכן, חשב את הרקע הכולל של כל גרעין DAPI על-ידי הכפלת אזור הגרעין לפי הרקע הממוצע לכל אזור יחידה. ניתן לחשב את עוצמת DAPI מנורמלת עבור כל גרעין שנמדד לאחר מכן על ידי חיסור הרקע הכולל של כל גרעין מהצפיפות המשולבת הנמדדת שלו.
- ממוצע כל ערכי עוצמת DAPI מנורמל מהפקד האפיתל הלא פצוע. גרעין האפיתל הלא פצוע חושב בעבר בעל ערך תכסיס של 2C והוא יכול לשמש התייחסות לחישוב תחבולה בגרעין האפיתל מהתנאיםהניסיוניים 8.
- חשב את התחבולה של כל גרעין על-ידי חלוקת עוצמת DAPI מנורמלת של כל גרעין על-ידי הערך המנורמל מתוך הפניה לא נפגע בקרת אפיתל (2C), ולאחר מכן להכפיל את הערך ב- 2 כדי להשוות את תכסיסה מנורמלת (C-ערך):
(צפיפות משולבת גרעינית - רקע צפיפות גרעינית משולבת)/צפיפות משולבת גרעינית ממוצעת (גרעינים אפיתל לא פצועים = 2C) x 2 = תכסיס גרעיני אפיתל (C) - גרעין גרף עם ערכים פלואידיים כעלילת נקודה, היסטוגרמה, או מקבוצה לגרף עמודות בהתאם (כלומר, 2C [0.6-2.9C], 4C [3.0-5.9C], 8C [6.0-12.9C], 16C [13.0-24.9C], ו->32C [>25.0C](איור 3F).
תוצאות
פרוטוקול מפורט מסופק להשתמש D. מלנוגסטר כמודל ללמוד פוליפלואידים הנגרמת על ידי פצע (WIP). מודל זה ריפוי הפצע מספק יתרונות רבים על יונקים ומודלים אחרים לטוס של WIP. Polyploidy היה מושרה בקלות על ידי נקב מכני עם סיכת חרק ותאים polyploid נוצרו בתוך פרק זמן קצר (2-3 dpi) (איור 1A, 1B)4. האתגר העיקרי הוא ניתוח של רקמת בטן שלמה ללא כל פרורים לאפיתל. האפיתל D. מלנוגסטר הוא בקלות בטעות נתקל או שרוט עם כלי הניתוב החדים. לכן, יש לתרגל את השלבים של פרוטוקול זה לפני השימוש והניתוח.
ראשית, הפציעה הוגבלה לבטן הנשית הפתחית, המספקת אזור רקמה אטום גדול ושטוח האידיאלי להדמיה. פצעי הדקירה נגרמו באפיתל פלוריט, שנמצא משני צדי החזה האמצעי הגחוני וממוהר בין קטעי טרגט (T) T4-T5(איור 1A-C). מיקום הפצע הזה מספק אזור גלוי גדול שלא משובש על ידי הפירוק. שלבים מאתגרים כוללים את החיתוך והצמדת מספריים בבטן (איור 1D, 1E). צעד חיתוך האביב עבד בצורה הטובה ביותר כאשר הבטן נחתכו בנפח מופחת של הפתרון של גרייס (~ 30 μL) כדי להקטין את תנועת הרקמות. חתך מרוכז היטב לאורך קו האמצע הגב היה הכרחי כדי לספק שטח מספיק על מגני הגב בבטן כדי להצמיד לפתוח על לוח החיתוך(איור 1ג). הבטן חייבת להיות מוצמדת בעדינות בארבע הפינות ללא כוח מוגזם(איור 1E). דחיפת סיכה קשה מדי תעוות את רקמת הבטן ואפילו יכולה לדחוף את הרקמה לתוך צלחת הניתור. אם זה קורה, יש להשליך את הרקמה. לאחר שרקמות הבטן תוקנו, היא נשארה על לוחית הניתוח עד להשלמת כתמי חיסון והבטן הורכבה על כיסוי זכוכית להדמיה(איור 1F).
ריפוי הפצע דורש גיליון אפיתל רציף כדי ליצור, אשר תלוי אנדורפול והיתוך תא4,16. חלבון צומת הספט FasIII, המתייג צמתים של תאים, סיפק אינדיקציה לשאלה אם התרחשו במהלך ההכנה(איור 1גרם, 1H). יש להשליך בטן עם שריטות גדולות (שטח לא מוכתם) המחיטות את אזור הפצע ולא שימשו לניתוח נוסף(איור 1ח').
השלב הבא היה לנתח דגימות שלמות לכל פגמים ב-WIP. פרוטוקול זה כולל תבחינות ברורות לזיהוי היבטים שונים של תגובת WIP (איור 2). תיקון הפצע הושלם כאשר תא מרכזי, גדול ורב-שלושה כיסה את גלד הפצע(איור 3א'). כאן זוהה היתוך התא על ידי כתם עבור FasIII / Grh וכמת את מספר Grh+ גרעין אפיתל הקיף באזור FasIII המתואר4. ליקויים בסגירת פצע או אפיתל מחדש זוהו כאשר נצפו פערים של >10 μm בגיליון האפיתל(איור 3ב',חץ אדום). זה היה המקרה, למשל, כאשר WIP היה מעוכב על ידי ההפעלה של מחזור מיטוטי באמצעות ביטוי של stg, fzrRNAi, כפי שדווח לאחרונה16. במצב גנטי זה, 52% מהפצעים לא הצליחו ליצור גיליון אפיתל רציף מעל גלד הפצע(איור 3B, 3C).
שיטה נוספת למדוד תיקון הפצע במודל זה הייתה על ידי הדמיית קרום האפיתל עם ביטוי epi-Gal4 של UAS-mCD8-ChRFP4 (איור 2, איור 3D). בפקד, 91% מפצעי האפיתל נסגרו לחלוטין על ידי 3 dpi, אבל עיכוב WIP על ידי חסימת אנדורפול (E2f1RNAi) והיתוך תאים(RacDN)בו זמנית, כפי שדווח בעבר, גרם 92% של פצעי אפיתל להישאר פתוח לחלוטין (איור 3D, 3E)8,,16. ההפעלה של מחזור תא מיטוטי על ידי ביטוי של STG, fzrRNAi גם הביא פגם סגירת פצע אפיתל. עם זאת, על ידי הדמיה קרום תא האפיתל, ניתן לקבוע את היקף פגם האפיתל מחדש. מוטנט WIP (E2f1RNAi, RacDN ) פצעי זבובהיו פתוחים יותר stg, fzrRNAi פצעים (איור 3D, מקווה מקווקו אדום)16. זה פצע ממברנה ריפוי איסוף סיפק מידע נוסף על היקף הפגם תיקון הפצע. כתוצאה מכך, ניתן לקבץ פגמים באפיתל מחדש כפתוחים לחלוטין, סגורים חלקית (כלומר, >פערים של 10 μm), או לסגורלחלוטין (איור 3ד', 3E).
בנוסף היתוך תאים, תאים אפיתל לגדול בגודל על ידי אנדורפול, מחזור תא לא שלם המכפיל את תוכן ה-DNA הגרעיני. אנדורפול היה assayed הן על ידי פעילות מחזור התא ומדידות תחבולה DNA גרעיני ישיר(איור 2 ואיור 4). כאן, פעילות מחזור התא זוהתה על ידי התאגדות של אנלוגי thymidine, EdU (איור 4A, 4B). D. תאים אפיתל מלנוגסטר נמצאו להיכנס אנדוציק, מחזור תא לא שלם כי תנודות בין שלבי S ו- G ללא שלב Mמתערב 4,12. הדיאטה D. מלנוגסטר למבוגרים בתוספת EdU+ מזון לפני פציעה ואת הזבובים נשמרו על EdU+ דיאטה עד הניתור ב 2 dpi(איור 4א'). לאחר מכן זוהה ה- EdU באמצעות פרוטוקול Click-iT של היצרן. EdU זה סיסאי שימש כדי לקבוע איפה, מתי, וכמה גרעין הופעלו כדי להיכנס שלב S בתגובה לפצע. באמצעות מערכת Gal4 / כב"מים, לאחרונה נמצא כי ביטוי ספציפי אפיתל של myc יכול לחסום (mycRNAi) או להחמיר (Myc ביטוי יתר) את היכולת של תאי אפיתל להיכנס שלב S. כתוצאה מכך, זה כבר הראה כי Myc מספיק כדי לגרום אנדוריבטור בתאים postmitotic, גם ללאפציעה 16,22.
לאחר מכן, תכסיס אפיתל נקבע על ידי מדידה ישירה של תכולת דנ"א גרעינית. גרעין אפיתל זוהו על ידי כתמי חיסון עבור סמן ספציפי אפיתל, Grh(איור 4D). בתוכנה להדמיה פיג'י, גרעין אפיתל זוהה באופן שיטתי ולאחר מכן סף באמצעות כתם גרעיני Grh. לאחר מכן הופרדו הגרעינים וה-ROIs הושתה על תמונת ה- DAPI של ערימות(איור 4D, חץ ירוק). כל גרעין חופף נמחק באופן ידני לפני שהצפיפות המשולבת של הגרעין הנבחר נמדדה(איור 4D,חצים אדומים). שיטה זו, המאומת למחצה, מאפשרת לכמת את ההפצה והתחבולה של רוב הגרעין לאורך אפיתל הבטן הזבוביםהלא פצועים והתוקנו 8. כפי שדווח לאחרונה, גרעין האפיתל המקיף את הפצע היו מורכבים 44% גרעין פוליפלואיד עם תוכן DNA יותר מ 3C ב 3 dpi (איור 4E, 4F)16. כצפוי מתוצאות EdU, נוק-דאון של myc הוביל לבלוק משמעותי באנדורב, כמו רק 9% של גרעין האפיתל היו polyploid, בעוד דיכוי יתר של Myc הביא 100% גרעין אפיתל פוליפלואיד סביב אתר הפצע(איור 4F)16. גודל גרעיני אפיתל הושפע גם באופן ניכר על ידי ביטוי myc עם גרעין מופחת או מוגדל הנוכחי. עם זאת, אזור גרעיני אינו מדד מדויק של השפעות תכסיס ופיזיולוגיות, כי גורמים כגון מתיחת תאים יכולים גם להשפיע על גודל גרעיני מבלי להשפיע על תוכן DNAגרעיני 20.
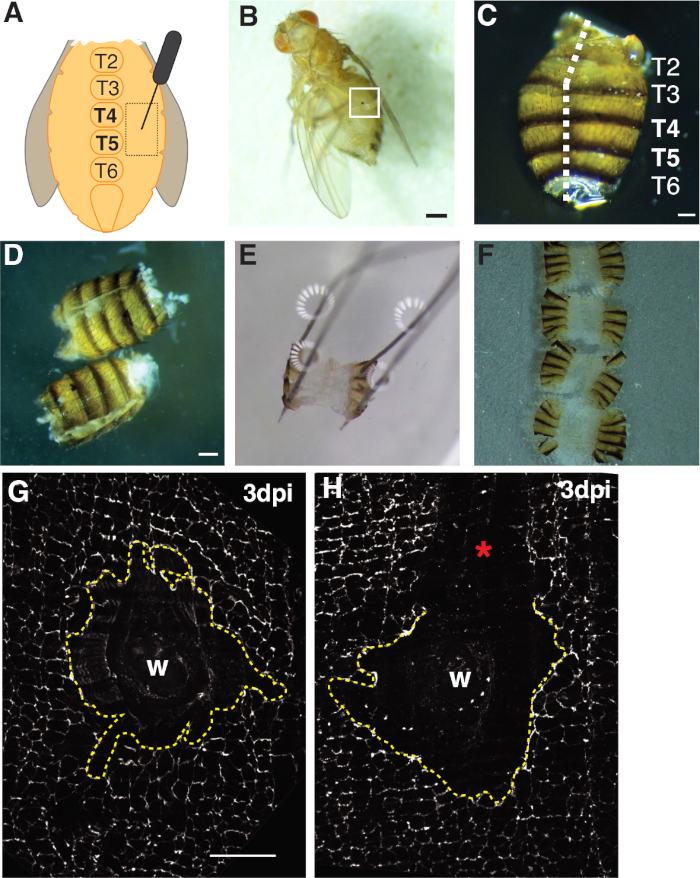
איור 1: פרי בוגר זבובי בטן פציעה, ניתוח, והרכבת רקמות. (א)תרשים של ההתפתלות של פציעת הבטן הבוגרת. זבובים צריכים להיפגע משני צידי הבטן בtergite 4 (T4). (ב)זבוב פירות נקבה בוגרת 3 dpi עם גלד מלנין שנוצר מריפוי פצעים (קופסה לבנה). סרגל קנה מידה = 50 μm.(ג)בטן בוגרת נותח, נוף גב, עם tergites מסומן. הבטן היו פילה דרך קו האמצע של הצד הגב (קו מקווקו לבן). סרגל קנה מידה = 50 μm. (D)ניתח פילה בטן למבוגרים לפני הצמדה. סרגל קנה מידה = 50 μm.(ה)בטן בוגרת מוצמדת על צלחת לנתח. סיכה הונחה בכל אחת מארבע פינות הבטן בצד הגב. הרקמה נפתחה בעדינות אך לא מתוחה, כדי להימנע מקרע. (ו)בטן בוגרת הורכבה והונחה על כיסוי זכוכית כשחלק הפנימי של הבטן פונה כלפי מטה לכיוון כיסוי הכיסוי והציפורן הכוונים לכיוון מגלשת הזכוכית. (ז)כתם FasIII של אזור הפצע שלם ללא סטייה עיבוד וסנכרון מרכזי (קו צהוב מקווקו). סרגל קנה מידה = 50 μm. (H)תמונה של אזור פצע שרוט (*) עם אזור FasIII לא מוכתם שמשבש את הסינכרון. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
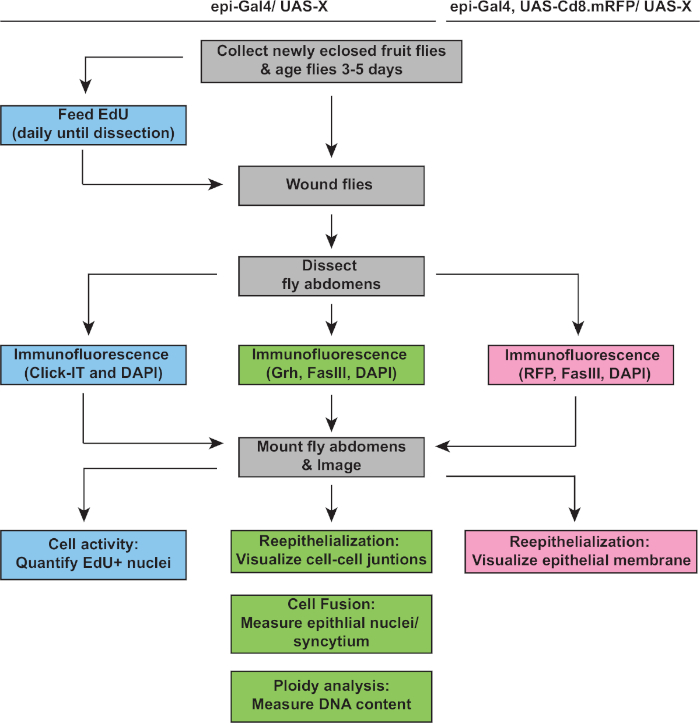
איור 2: זרימת עבודה של ניתוח WIP. תרשים הזרימה מתאר את שלושת ההתארים המתוארים במחקר זה וצעדים חופפים ונפרדים כדי לזהות מודד את תגובת WIP. EdU assay מודד פעילות מחזור התא (תיבות כחולות), תכסיס ואפיתל מחדש מזוהים על ידי חיסון Grh /FasIII (תיבות ירוקות), וביטוי של RFP ממברנה מאפשר מדידה של היקף סגירת פצע אפיתל (קופסאות ורודות). השלבים הנפוצים הם בקופסאות אפורות וגנוטיפים של זן מלנוגסטר D מפורטים לעיל. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
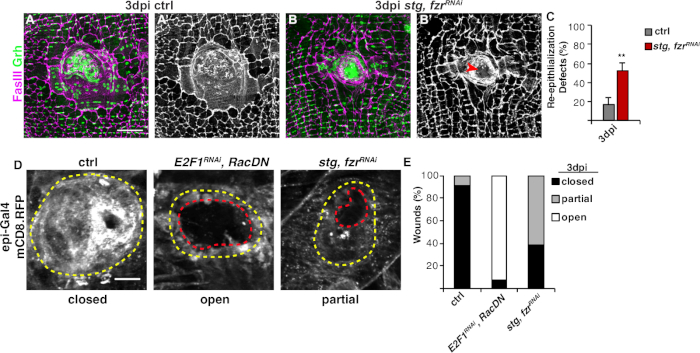
איור 3: שיטות לזיהוי אפיתל מחדש במהלך WIP. האפיתל מחדש היה מוטרד כאשר WIP היה מעוכב גנטית. תמונות אימונופלורסנט של שליטה ( A )ו stg, fzrRNAi (B) ב 3 dpi. גרעיני האפיתל וצמתים ספט היו מוכתמים ב-Grh (ירוק) וב-FasIII (מג'אנטה), בהתאמה. (א' וב') כתמי FasIII לבד הראו כי אפיתל מחדש היה לקוי (חץ אדום) ב STG, fzrRNAi אפיתל. סרגל קנה מידה = 50 μm. (ג)כימות של פגמים אפיתלציה מחדש (%) ב- 3 dpi (אפור): פקד (n = 8), stg, fzrRNAi (n = 6). קווי שגיאה מציינים שגיאה רגילה; משמעות סטטיסטית נמדדה באמצעות מבחן T של סטודנט, **P < 0.01. אפיתל מחדש במהלך תיקון הפצע יכול להיות מזוהה גם על ידי ביטוי של RFP מקושר ממברנה באמצעות epi-Gal4, UAS-mCD8-RFP. (ד)תמונות אימונופלורסנט של שליטה, E2F1RNAi, RacDN, ו stg, fzrRNAi ב 3 dpi. סרגל קנה מידה = 20 μm. גלד פצע (קו מתאר צהוב) ופתוח אזור פצע אפיתל (קווי מתאר אדומים). (ה)כימות סגירת הפצע ב- ctrl (n = 11), E2F1RNAi, RacDN (n = 13) ו- stg, fzrRNAi (n = 13). עיבוד מגרנדלר ואח '16. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
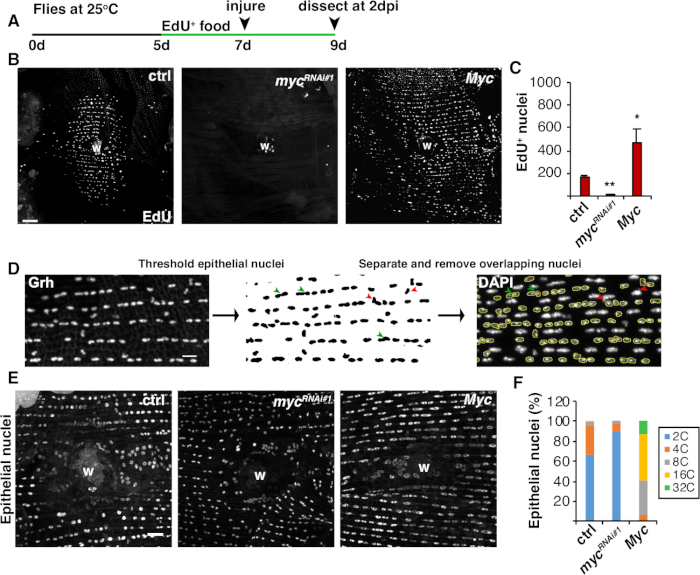
איור 4: שיטות לזיהוי אנדורפול במהלך WIP. (A)ציר הזמן של EdU הודעה: דרוסופילה למבוגרים האכילו 75 μL של 5 mm שמרים-EdU כל יום 2 ימים לפני הפציעה והמשיך עד 2 dpi. (ב)תמונות אימונופלורסנט של תווית EdU בזני זבובים המבוטאים עם מערכת epi-Gal4 / כ"כים ב 2 dpi. גלד פצע (W). סרגל קנה מידה = 50 μm. (C) מספר ממוצע של גרעין אפיתל EdU + לזבוב ב 2 dpi: ctrl (n = 37), mycRNAi #1 (n = 10), ו Myc (n = 8). קווי שגיאה מציינים שגיאה רגילה; משמעות סטטיסטית נמדדה באמצעות מבחן T של סטודנט, *P < 0.05, **P < 0.01. (ד)סכמטי של איתור ומדידה של תכסיס גרעיני אפיתל. גרעיני אפיתל זוהו וסף על ידי הכתם נגד Grh בפיג'י. גרעיני אפיתל חופפים הופרדו (ראשי חץ ירוקים) או הוסרו (ראשי חץ אדומים) אם הם מכוסים על ידי גרעין לא פיתל. הצפיפות המשולבת והתור הגרעיני של תמונת הגרעין המוכתמת של DAPI נמדדו. (ה)גודל גרעיני אפיתל (Grh) שונה על ידי ביטוי myc ב 3 dpi. (ז)תחבולה גרעינית אפיתל (%) ב- 3 dpi: ctrl (n = 4), mycRNAi#1 (n = 6) ו- Myc (n = 3). עיבוד מגרנדלר ואח '16. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
Discussion
מוצג פרוטוקול מפורט על איך לנתח ולהשתמש באפיתל הבטן D. מלנוגסטר למבוגרים כדי ללמוד כיצד גנים לווסת WIP על ידי שינוי אפיתל מחדש אנדורליזציהבמהלך תיקון הפצע 16. באמצעות שיטה זו, Myc proto-oncogene זוהה לאחרונה כרגולטור מפתח של WIP. Myc נדרש עבור תאי אפיתל אנדורפליפט לאחר פציעה והוא מספיק עבור תאי אפיתל שלווה כדי endocycle הן אפיתל לטוס למבוגרים ובלוטותאביזר 16,,22. נמצא גם כי החלפת תאי אפיתל למחזור תא מיטוטי על ידי ביטוי של stg, fzrRNAi מזיק לתיקון הפצע. מחקרים מתמשכים באמצעות שיטה זו יזהו גנים אחרים הנדרשים לווסת אפיתל מחדש אנדורכיכה במהלך WIP, חושף גם קווי דמיון והבדלים כיצד polyploidy מוסדר ופונקציות במגוון רחב של רקמות.
מודל ושיטה אלה מציעים יתרונות ייחודיים, כולל אינדוקציה קלה של polyploidy עם נקב מכני והעובדה כי תאים polyploid נוצרים בתוך ימים4. פרוטוקולי ניתוח הרקמות וההכנה מבוססים על טכניקות ניתוח זחל23, אך הבטן של הזבוב הבוגר נוקשה יותר ולכן קל לפגוע בה. כתוצאה מכך, פרוטוקול זה דורש תרגול ודיוק כדי לבודד רקמה שלמה כדי ללמוד WIP. עם זאת, לאחר הניתוח, האפיתל נראה בבירור ותמונה בקלות, ומניב תמונה של תהליך ריפוי הפצע. שיטה זו מספקת שפע של מידע על הארגון האפיתל של הזבוב הבוגר, גודל התא והסינכרון, ועל התחבולה של תאים וגרעין בודד. בעוד הדמיה חיה עדיין לא אפשרי בתוך זבוב פירות שלם בשל התוצר האטום שלה, פרוטוקול זה יכול להיות מותאם לכלול כיום תנאי תרבות vivo לשעבר זמין בשימוש D. מלנוגסטר לבצע מחקרי הדמיה חיים לטווח קצר24.
בעתיד, מודל זה יהיה אידיאלי ללמוד crosstalk מתא לתא ואת התרומה של סוגי תאים אחרים כדי WIP על ידי ויסות ביטוי גנים עם מערכת Gal4/UAS בסוגים אחרים של עניין. שאלות דומות ניתן לענות גם באמצעות מגוון רחב של רקעים גנטיים ומוטנטים. הבטן לטוס למבוגרים לנתח מכיל מגוון רחב של סוגי תאים שניתן לדמיין בקלות באמצעות שיטה זו, כולל גוף שומן oenocytes, סיבי שריר לחוץ, נוירונים חושיים, קנה נשימה, ו המוציטים כמו מקרופאג.. בנוסף, מודל זה יאפשר לחוקרים לחקור כיצד משתנים פיזיולוגיים משפיעים על WIP, כולל מין, דיאטה, זיהום, גיל, ולחצים סביבתיים. בעוד הפרוטוקול משתמש בזבוב הנקבה הבוגרת בשל גודלו הגדול יותר, WIP מתרחש גם בזבוב הפירות הגברי (Gjelsvik ו Losick, שלא פורסם). תאים Polyploid נמצאו להתעורר במהלך הזדקנות ומחלות הקשורות לגיל בכבד היונקים, המוח, העין, ולב12. מודל זבוב הפירות יאפשר לחוקרים לחקור פוליפלואידציה בהקשרים פיזיולוגיים ומחלות, משום שגנים הקשורים למחלות אנושיות הם מאוד שמורים.
Disclosures
ללא.
Acknowledgements
במכללת בוסטון, ברצוננו להודות לד"ר אריק פולקר על השימוש במצלמת המעבדה שלו ובמיקרוסקופ הסטריאוסקופ להדמיה וברטון ג'דסון במכללת בוסטון Core להדמיה עבור תשתית ותמיכה. ברצוננו גם להודות למשאבי הקהילה לטוס: בלומינגטון Drosophila Stock Center (NIH P40OD018537), וינה Drosophila מרכז משאבים, ו TRiP מרכז בבית הספר לרפואה של הרווארד (NIH / NIGMS R01-GM084947) למתן מניות טרנסגנית בשימוש במחקר זה. נוגדן FasIII העכבר הושגו מבנק Hybridoma מחקרים התפתחותיים נתמך על ידי NICHD של NIH והתוחזק באוניברסיטת איווה, המחלקה לביולוגיה, איווה סיטי, IA. מחקר שדווח בפרסום זה נתמך על ידי המכון הלאומי למדעי הרפואה הכלליים של המכונים הלאומיים לבריאות תחת מספר פרס R35GM124691. התוכן הוא אך ורק באחריות המחברים ואינו מייצג בהכרח את השקפותיהם הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
References
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239(2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251(2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125(2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327(2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344(2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005(2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013(2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111(2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved