Method Article
מדידת קשירת נוקלאוטידים לחלבוני ממברנה שלמים ומתפקדים בזמן אמת
In This Article
Summary
פרוטוקול זה מציג שיטה למדידת קשירת אדנין נוקלאוטיד לקולטנים בזמן אמת בסביבה תאית. הקישור נמדד כהעברת אנרגיית תהודה של פורסטר (FRET) בין נגזרות נוקלאוטידים של טריניטרופניל לבין חלבון המסומן בחומצת אמינו פלואורסצנטית לא קנוני.
Abstract
פיתחנו שיטה למדידת קשירה של נוקלאוטידים אדנין לקולטנים טרנסממברנליים שלמים ופונקציונליים בסביבה תאית או ממברנה. שיטה זו משלבת ביטוי של חלבונים המתויגים עם חומצת האמינו הפלואורסצנטית הלא קנונית ANAP, ו- FRET בין ANAP ונגזרות נוקלאוטיד פלואורסצנטיות (trinitrophenyl). אנו מציגים דוגמאות של קשירת נוקלאוטידים לתעלות יון KATP המתויגות על ידי ANAP שנמדדו בקרומי פלזמה לא מקורים ובכתמי קרום שנכרתו מבפנים החוצה תחת מהדק מתח. האחרון מאפשר מדידות בו זמנית של קשירת ליגנד וזרם ערוץ, קריאה ישירה של תפקוד החלבון. טיפול וניתוח נתונים נדונים בהרחבה, יחד עם מלכודות וחפצים. שיטה זו מספקת תובנות מכניסטיות עשירות לגבי ה-gating תלוי הליגנד של תעלותK ATP וניתן להתאים אותה בקלות לחקר חלבונים אחרים המווסתים נוקלאוטידים או כל קולטן שעבורו ניתן לזהות ליגנד פלואורסצנטי מתאים.
Introduction
מספר סוגים חשובים של חלבון מווסתים ישירות על ידי קשירת ליגנד. אלה נעים בין אנזימים מסיסים לחלבונים משובצים בקרום, כולל קולטן טירוזין קינאזות, קולטנים מצומדים לחלבון G (GPCRs) ותעלות יונים. GPCRs וערוצים מהווים ~34% ו~15% מכלל יעדי התרופות הנוכחיים, בהתאמה 1,2. לכן, קיים עניין ביוכימי ורפואי רב בפיתוח שיטות המספקות תובנות מכניסטיות לגבי אינטראקציות ליגנד-קולטן. שיטות מסורתיות למדידת קשירת ליגנדים, כולל תיוג זיקת אור ומחקרי קשירת רדיוליגנד, דורשות כמויות גדולות של חלבון מטוהר חלקית ומבוצעות בדרך כלל בתנאים לא פיזיולוגיים ובסקאלות זמן. שיטה אידיאלית תדרוש כמויות קטנות בלבד של חלבון, תוכל להתבצע על חלבונים שלמים המבוטאים בסביבה תאית או ממברנה, תוכל להיות מנוטרת בזמן אמת, ותהיה תואמת לקריאות ישירות של תפקוד החלבון.
Förster resonance energy transfer (FRET) היא שיטה המזהה את הקרבה בין שתי מולקולות המתויגות באופן פלואורסצנטי3. FRET מתרחש כאשר פלואורופור תורם נרגש מעביר אנרגיה באופן לא קרינתי למולקולת קבלה (בדרך כלל פלואורופור אחר). העברת אנרגיה גורמת למרווה של פליטת הפלואורסצנטיות של התורם ולרגישות של הפליטה המקבלת (אם המקבל הוא פלואורופור). יעילות ההעברה תלויהבחזקת 6 של המרחק בין התורם למקבל. יתר על כן, התורם והמקבל חייבים להיות בקרבת מקום (בדרך כלל פחות מ -10 ננומטר) כדי ש- FRET יתרחש. ככזה, ניתן לנצל את FRET כדי למדוד את הקישור הישיר בין קולטן חלבון המסומן באופן פלואורסצנטי לבין ליגנד פלואורסצנטי.
מספר חלבונים שונים מווסתים או מופעלים על ידי קשירת נוקלאוטידים אדנין תוך-תאיים או חוץ-תאיים (ATP, ADP, AMP, cAMP). חלבוני טרנספורטר רבים זקוקים להידרוליזה של ATP עבור מחזור התגובה שלהם, כולל מובילי קלטות קושרי ATP ו-ATPases מסוג P כמו משאבת Na+/K+ 4,5. תעלות K+ (K ATP) רגישותל-ATP, וסת ההולכה הטרנסממברנה של סיסטיק פיברוזיס (CFTR) ותעלות מווסתות נוקלאוטידים מחזוריות הן כולן תעלות יונים המגודרות על ידי קשירה של נוקלאוטידים אדנין תוך-תאיים, מה שהופך אותם לרגישים להפליא לשינויים בחילוף החומרים התאי ובהעברת אותות 6,7,8. קולטני P2X ו-P2Y פורינרגיים מגיבים לשינויים ב-ATP חוץ-תאי, שיכול להשתחרר כמוליך עצבי או כתוצאה מנזק לרקמות9. פיתחנו בדיקה מבוססת FRET למדידת קשירת נוקלאוטידים אדנין לחלבוני ממברנה בזמן אמת. בעבר יישמנו שיטה זו כדי לחקור קשירת נוקלאוטידים לתעלות KATP 10,11.
כדי למדוד קשירת נוקלאוטידים באמצעות FRET, חלבון מעניין חייב להיות מתויג תחילה עם פלואורופור. התג הפלואורסצנטי חייב להיות מוכנס לחלבון המעניין אותו כך שיהיה קרוב מספיק לאתר קשירת הליגנד כדי ש-FRET יתרחש, תוך הקפדה מיוחדת על כך שהתג לא ישפיע על המבנה הכללי של החלבון ותפקודו. כדי להשיג זאת, אנו משתמשים בטכניקה שפותחה על ידי Chatterjee et al., באמצעות דיכוי סטופ-קודון ענבר כדי להחדיר חומצת אמינו לא קנונית פלואורסצנטית (l-3-(6-acetylnaphthalen-2-ylamino)-2-aminopropionic; ANAP) באתר הרצוי12. אנו מודדים קשירת נוקלאוטידים כ-FRET בין חלבון המסומן בתווית ANAP לבין נגזרות נוקלאוטידים פלואורסצנטיים של טריניטרופניל (TNP) (איור 1A). ספקטרום הפליטה של ANAP חופף לספקטרום הספיגה של TNP-נוקלאוטידים, תנאי הכרחי להתרחשות FRET (איור 1B). כאן אנו מתארים שני סוגים שונים של ניסוי מחייב. בראשון, קשירת נוקלאוטידים לצד התוך-תאי של תעלות KATP המסומנות על ידי ANAP נמדדת בתאים שלא כוסו על ידי סוניקציה והותירו שברים דבקים של קרום פלזמה על מכסה זכוכית10,11,13,14.
בשיטה השנייה, קשירת נוקלאוטידים לתעלות KATP המסומנות על ידי ANAP נמדדת בטלאי קרום תחת מהדק מתח, מה שמאפשר מדידה בו זמנית של זרמים יוניים ופלואורסצנטיים. על ידי שילוב שתי גישות ניסיוניות אלה, שינויים בקשירה יכולים להיות בקורלציה ישירה עם שינויים בפונקציית ערוץ11. תוצאות אופייניות, מלכודות פוטנציאליות וניתוח נתונים נדונים.
Protocol
1. הכנת תלושי כיסוי
הערה: צעדים אלה חייבים להתבצע בתרבית רקמות סטרילית. כמויות ניתנות להכנת 10 מנות.
- הניחו עשר כוסות כיסוי בורוסיליקט בקוטר 30 מ"מ שהחליקו בנפרד לתוך עשרה כלים סטריליים בקוטר 35 מ"מ ללא טיפול ושטפו פעם אחת ב-2 מ"ל מים סטריליים ומזוקקים.
- לדלל 1 מ"ל של 0.1% w/v תמיסת פולי-L-ליזין למים סטריליים מזוקקים לנפח כולל של 10 מ"ל (ריכוז סופי של 0.01% w/v). מערבבים היטב, ואז פיפטה 1 מ"ל על כל כיסוי מחליקים ודגרים בטמפרטורת החדר במשך 20 דקות.
- יש לשאוף את הפולי-L-ליזין ולשטוף כל כיסוי פעמיים עם לפחות 2 מ"ל מים מזוקקים סטריליים. להשאיר עד יבש לחלוטין, כלומר, לפחות 3 שעות.
2. זריעת תאי HEK-293T
הערה: שלבים אלה חייבים להתבצע בתרבית רקמות. תאי HEK-293T נבחרו בשל הרקע הנוכחי הנמוך שלהם וקלות הגידול שלהם בתרבית. פרוטוקול זה עשוי להיות מותאם לסוגי תאים אחרים.
- יש לשטוף בקבוק T75 80-90% של תאי HEK-293T פעם אחת עם 12 מ"ל פוספט חוצץ מלוחים (PBS) לפני הדגירה עם 2 מ"ל טריפסין למשך 2-5 דקות, או עד שהתאים מנותקים לחלוטין ומנותקים כמעט לחלוטין.
- השהה מחדש את התאים על ידי הוספת 10 מ"ל מדיום הנשר המעובד של דולבקו (DMEM) בתוספת 10% נסיוב בקר עוברי, 100 U/mL פניצילין ו 100 מיקרוגרם / מ"ל סטרפטומיצין. פיפטה בעדינות על תחתית הבקבוק כדי לפרק את גושי התאים שנותרו.
- הוסף 2 מ"ל של DMEM בתוספת למספר הרצוי של צלחות 35 מ"מ המכילות פתקי כיסוי מצופים. הוסף 100 μL של תאים מרחפים לכל מנה. לדגור לילה ב 37 °C (77 °F).
3. טרנספקציה
הערה: שלבים אלה חייבים להתבצע בתרבית רקמות. כמויות ניתנות עבור transfection של 10 מנות. עבור שילוב ANAP ספציפי לאתר, קודון ה- DNA במיקום המיועד לתיוג חייב להיות מוחלף בקודון עצירת ענבר (TAG). מבנה זה הוא transfected עם שני פלסמידים: pANAP ו peRF1-E55D12,15. pANAP מקודד מספר עותקים של זוג סינטטאז tRNA/tRNA ספציפי ל-ANAP. בנוכחות ANAP, טרנספקציה של פלסמיד זה מייצרת tRNA טעון ANAP המזהה את קודון עצירת הענבר. peRF1-E55D מקודד גורם שחרור ריבוזומלי שלילי דומיננטי המגדיל את התפוקה של חלבון באורך מלא, עם תווית ANAP.
- הכינו צינור של 1.5 מ"ל עם 10 מיקרוגרם pANAP, 10 מיקרוגרם peRF1-E55D ו-DNA למבנה המיועד לתיוג עם ANAP. יש להגיע לנפח סופי של 500 μL עם DMEM ללא תוספת.
- בצינור נפרד, הכינו 3 מיקרוליטר של מגיב טרנספקציה מבוסס שומנים (ראו טבלת חומרים) עבור כל 1 מיקרוגרם של DNA והביאו לנפח סופי של 500 μL עם DMEM ללא תוספת.
- ערבבו את תערובות הדנ"א ומגיב הטרנספקציה בצינור יחיד ודגרו במשך 20 דקות בטמפרטורת החדר.
- הוסף 400 μL של 1 mM ANAP ציר (מלח trifluoroacetate ב 30 mM NaOH) ל 20 מ"ל DMEM בתוספת עבור ריכוז סופי של 20 μM ANAP. החלף את המדיה הישנה מהתאים המצופים ב- 2 מ"ל של המדיה המכילה ANAP לכל מנה.
- פיפטה 10% מטרנספקציית הדנ"א מתערבבת על כל מנה. יש לדגור בטמפרטורה של 33°C במשך 2-4 ימים לפני הניסויים. דגירה ב-33°C מאטה את חלוקת התא ומגדילה את תפוקת החלבון לתא16.
4. ניסויים בממברנות ללא גג
- השתמש בזוג מלקחיים כדי לשבור את חלקת הכיסוי עם תאים נגועים למקטעים קטנים יותר.
- בצע אחד מההליכים הבאים כדי לפתוח תאים.
- אם אתם משתמשים בפתקי כיסוי מצופים מראש, שטפו קטע עם PBS, ולאחר מכן הניחו אותו על תחתית צלחת 35 מ"מ המכילה 2 מ"ל PBS. בצע סוניקטור קצר באמצעות סוניק בדיקה (50 W, 20%-40% משרעת, 3 מ"מ בדיקה) הממוקם 3-5 מ"מ מעל הדגימה כדי לפתוח תאים ולהשאיר מאחור שברי קרום פלזמה דבקים (איור 2A,C).
הערה: ניתן לשנות את עוצמת הסוניקטור, משך הזמן וגובה הבדיקה מעל הדגימה כדי לקבל תפוקה גבוהה של קרומים לא מקורים מבלי לשלול לחלוטין את הכיסוי. - אם אינכם משתמשים בהחלקות כיסוי מצופות מראש, שטפו שבר כיסוי עם PBS, ולאחר מכן טבלו לתוך צינור המכיל 0.1% w/v פולי-L-ליזין במשך ~30 שניות לפני ביצוע קצר (כמו בשלב 4.2.1) כדי לפתוח תאים על הגג ולהשאיר מאחור שברי קרום פלזמה לא מקורים/לא מקורים חלקית (איור 2A,C,D). חשיפות קצרות לפולי-ל-ליזין הוכחו כמשפרות את ההיצמדות ל-coverslip13.
- אם אתם משתמשים בפתקי כיסוי מצופים מראש, שטפו קטע עם PBS, ולאחר מכן הניחו אותו על תחתית צלחת 35 מ"מ המכילה 2 מ"ל PBS. בצע סוניקטור קצר באמצעות סוניק בדיקה (50 W, 20%-40% משרעת, 3 מ"מ בדיקה) הממוקם 3-5 מ"מ מעל הדגימה כדי לפתוח תאים ולהשאיר מאחור שברי קרום פלזמה דבקים (איור 2A,C).
- הניחו את השבר הסוני בכלי כיסוי בתחתית זכוכית בקוטר 35 מ"מ המכיל תמיסת אמבט בנפח 2 מ"ל והרכיבו אותו על מיקרוסקופ הפוך המצויד במטרה גבוהה של טבילה במים פי 60. יציאת המצלמה של המיקרוסקופ מחוברת לספקטרוגרף בסדרות עם מצלמת CCD בעלת רגישות גבוהה. יש לנקב את תא האמבטיה (0.5 – 1 מ"ל/דקה) באמצעות חיץ באמצעות משאבה פריסטלטית. הרכב החיץ ישתנה בהתאם לחלבון הנחקר.
הערה: אם למשתמש אין גישה למטרה עם מרחק עבודה ארוך, ייתכן שלא ניתן יהיה להתמקד בשברי הממברנה הלא מקורים בגלל הגובה הנוסף של תלוש הכיסוי. חלופה אחרת היא לזרוע תאים ישירות על כלים עם תחתיות זכוכית פולי-L-ליזין (ראו טבלה של חומרים לדוגמה). זה גם יפחית סטיות פוטנציאליות בתמונה הקשורות למיקוד דרך שתי חתיכות זכוכית. סטיות אלה אינן משפיעות על צורת הספקטרום שנרכש. - זהו שברי קרום לא מקורים המבטאים את התעלה המסומנת על-ידי ANAP על-ידי חיפוש פלואורסצנטיות של תעלה (איור 2C,D).
הערה: מומלץ להשתמש בתווית פלואורסצנטית נוספת (כאשר ספקטרום הפליטה נבדל מספקטרום הפליטה ANAP) כדי לסייע בזיהוי ממברנות לא מקורות, המכילות את החלבון המעניין. הניסויים באיור 2C,D בוצעו בתעלות המסומנות ב-ANAP עם תגי חלבון פלואורסצנטי C-terminal. - הפעילו חלקית את מסיכת הספקטרומטר (הרם ~ 10%) בין יציאת המצלמה במיקרוסקופ לבין הספקטרוגרף. צל המסכה יופיע על תמונת המצלמה. יישרו את הממברנה הלא מקורה עם מסיכת הספקטרומטר, על ידי התאמת שלב המיקרוסקופ. רכוש שדה בהיר ותמונה פלואורסצנטית של הממברנה הלא מקורה. אלה ישמשו לבחירת אזור עניין לניתוח.
- קרבו את קצה מערכת הזילוח למיקרו-נפח לקרום הלא מקורה.
הערה: כדי להפחית את פלואורסצנטיות הרקע, זרימת הזרימה של מערכת הזילוח הוחלפה בקצה מותאם אישית עשוי זכוכית בורוסיליקט. - כדי לצלם ספקטרום פלואורסצנטי, עורר את הממברנה עם LED של 385 ננומטר דרך מסנן עירור פסים של 390/18 ננומטר ודיכרואית קצה של 416 ננומטר. אספו אור שנפלט דרך מסנן פליטה באורך 400 ננומטר (איור 2B).
- הפעילו את מסיכת הספקטרומטר וודאו שהאור הנפלט עובר דרכה. הפעילו את גרגרי הספקטרומטר (300 חריצים למ"מ). עם הגרגרים במקומם, האור המפוזר על-ידי הספקטרומטר יוקרן על השבב של מצלמת CCD כדי להפיק תמונות ספקטרליות (איור 3A). תמונות אלה שומרות על מידע מרחבי בממד y . ממד x מוחלף באורך גל.
- לחלופין, אם החלבון המעניין מתויג בחלבון פלואורסצנטי, קבל תמונה ספקטרלית של החלבון הפלואורסצנטי באמצעות ערכת המסננים המתאימה.
- קח חשיפה אחת או יותר של 0.1-10 שניות בתחילת הניסוי תוך כדי ניקוב תמיסת חיץ נטולת נוקלאוטידים. אלה ישמשו לתיקון ולנרמול נתונים לאורך שאר הניסוי (ראה סעיף 5 להלן).
הערה: בחירת זמן החשיפה תלויה ברמת הביטוי שהושגה, בהירות הפלואורופור והאופטיקה. יש לבחור זמן חשיפה כדי למקסם את האות ולמזער את קצב ההלבנה הנצפה. טווח זמן החשיפה הנתון ב- 4.10 מתאים למדידות קשירת שיווי משקל אך עשוי להיות שימושי למדידת שינויים קינטיים איטיים יותר10. היכולת להשתמש בזמני חשיפה קצרים כדי לעקוב אחר קינטיקה מהירה יותר תוגבל על ידי רמות ביטוי חלבונים והלבנה, ולא על ידי חומרה. - החל טווח של ריכוזים של TNP-ATP (בדרך כלל מוכן בתמיסת אמבטיה) כדי לקבוע עקומת ריכוז-תגובה. יש לערבב כל תמיסה למשך דקה אחת לפחות כדי להבטיח הגעה למצב יציב ולשטוף כל ריכוז בתמיסת אמבטיה למשך דקה אחת לפחות.
הערה: חשוב לוודא שמערכת הזילוח יכולה להגיע במהירות לשיווי משקל (איור 2E) ולהשיג את הריכוז המקומי הנכון של TNP-ATP (איור 2F). - יש להיחשף (באותו משך זמן שבו נעשה שימוש בשלב 4.10) בכל ריכוז ובסוף כל שטיפה.
5. ניתוח ספקטרלי
הערה: הוראות אלה נכתבות לשימוש עם קוד הניתוח "pcf.m", שניתן למצוא ב- GitHub. https://github.com/mpuljung/spectra-analysis10. קוד נוסף וחלופי ניתן למצוא https://github.com/smusher/KATP_paper_201911. תיארנו כאן את הפעולות המבוצעות על ידי התוכנה כך שהמשתמש יכול ליצור קוד משלו או לבחור לנתח את הנתונים באופן ידני.
- הפעל את תוכנית הניתוח על-ידי הקלדת שם התוכנית ("pcf") בשורת הפקודה.
- כאשר תיבת דו-שיח של קובץ/תיקייה פתוחה נפתחת עם הפקודה: "בחר קבצים עבור החזר השקעה", בחר את שמות הקבצים המשויכים לתמונות שדה בהיר ופלואורסצנטיות של הממברנה ללא קירוי. בשורת הפקודה תופיע בקשה להקליד את שם קובץ הפלט.
- הקלד את שם הקובץ ולחץ על Enter.
- כאשר התוכנה מציגה את תמונות שדה הבהירות והפלואורסצנטיות, בחר אזור עניין (ROI) בתמונה הספקטרלית המתאים למיקום של מקטע הממברנה הלא מקורה או התיקון שנכרת (ראה סעיף 6) בהתאם להנחיות התוכנה. בחרו אזור רקע באותה תמונה ספקטרלית (המייצג את אותו טווח אורכי גל כמו בהחזר ההשקעה) המתאים למקטע של חלקת כיסוי או צלחת ללא ממברנה מחוברת (איור 3A). התוכנה תבקש ללחוץ על החלק העליון של החזר ההשקעה והקש Enter, לחץ על החלק התחתון של החזר ההשקעה ולחץ על Enter ולאחר מכן חזור על תהליך זה עבור אזור הרקע.
- כאשר תיבת דו-שיח של קובץ/תיקייה פתוחה נפתחת עם ההנחיה: "בחר קובץ עבור ספקטרום FP", בחר בשם הקובץ המשויך לספקטרום החלבון הפלואורסצנטי (FP) (שלב אופציונלי 4.9). אם לא נרכש ספקטרום FP, בחר קובץ ספקטרום אחר. ספקטרום FP משמש כבקרת איכות להבחנה בין חלבון מתויג לבין פלואורסצנטיות רקע.
- כאשר נפתחת תיבת דו-שיח של קובץ/תיקייה פתוחה עם ההנחיה: "Select Files for Analyisis", בחר בכל הקבצים המתאימים לספקטרום ANAP (משלבים 4.10 עד 4.12), כולל הקבצים הדרושים לתיקון אקונומיקה.
- כאשר תיבת דו-שיח פתוחה/תיקייה נפתחת עם ההנחיה: "Select Files for Bleaching Collection", בחר בתת-קבוצת הקבצים משלב 5.6 המתאימה לספקטרום הראשוני שנרכש בתמיסה נטולת נוקלאוטידים בתחילת הניסוי או בספקטרום שנרכש במהלך שטיפות בתמיסה נטולת נוקלאוטידים לשימוש לתיקון (משלבים 4.10 עד 4.12).
- ממוצע קו לכל תמונה כדי להפיק ספקטרה, כלומר, ממוצע העוצמה של כל הפיקסלים בממד y של החזר השקעה או אזור רקע בכל אורך גל. (איור 3B). החסרו את ספקטרום הרקע הממוצע המתקבל מהספקטרום הממוצע המתקבל מהחזר ההשקעה כדי להסיר פלואורסצנטיות רקע ופלואורסצנטיות מ-TNP-ATP לא מאוגד (איור 3C). שלבים אלה מבוצעים באופן אוטומטי על-ידי התוכנה.
- קבע את עוצמת ANAP עבור כל חשיפה על-ידי ממוצע העוצמה של חלון 5 ננומטר שמרכזו סביב שיא ANAP של הספקטרום שהוחסר (בדרך כלל ~ 470 ננומטר, אך עשוי להשתנות בהתאם למיקרו-סביבה המקומית של שאריות ANAP).
הערה: איור 3D מראה 6 ספקטרום שהתקבל מחשיפות רצופות של 10 שניות של מקטע קרום לא מקורה המבטא ערוצים מתויגים ANAP. הכניסה מראה את העוצמה הממוצעת של שיא כל ספקטרום. התוכנה תמצא באופן אוטומטי את שיא אורך הגל בספקטרום הראשון שנרכש ותשתמש בערך זה לאורך כל הדרך. העוצמה תחושב באופן אוטומטי על ידי התוכנה. - נרמול עוצמות ANAP עבור כל ניסוי על ידי חלוקת עוצמת ANAP של חשיפה נתונה (F) בעוצמת ANAP של החשיפה הראשונה בסדרת הזמן, אשר נלקחה בשלב 4.10 (Fmax). שוב, התוכנה מבצעת חישובים אלה באופן אוטומטי.
- בצע את השלבים הבאים כדי להשיג נתונים.
- כדי לתקן עבור הלבנה מעריכית ANAP, יש להתאים תחילה דעיכה מעריכית יחידה, (F/Fmax) = A*exp(-t/τ)+(1-A), כאשר t הוא זמן החשיפה המצטבר, τ הוא קבוע הזמן ו-A הוא המשרעת) לשלבי השטיפה המתווכים בין יישומי TNP-ATP או לחשיפות ראשוניות מרובות שנלקחו לפני השטיפה ב-TNP-ATP (איור 3D, כניסה).
הערה: התוכנה תציג התאמה זו ותבקש לקבל או לדחות אותה. אם ההתאמה תידחה, תינתן הזדמנות נוספת לבחירת קבצים לתיקון הלבנה. - חלק את ספקטרום ANAP המנורמל (בשלב 5.10) בערך החזוי של ההתאמה המעריכית משלב 5.11.1 בכל נקודת זמן (איור 3E).
הערה: בדוגמה המוצגת, שיא הפלואורסצנטיות המנורמל שנצפה ב- 50 שניות הוא 0.65 והפלואורסצנטיות החזויה מההתאמה המעריכית היא 0.64. כדי לתקן הלבנה, חלק את הערך הנצפה (0.65, כניסה באיור 3E, עיגול ריק) בערך החזוי (0.64, כניסה באיור 3E, קו מקווקו) כדי להפיק את הערך המתוקן (~1, כניסה באיור 3E, עיגול צבעוני). אם תיקון ההלבנה מספיק, עוצמת ANAP מכל החשיפות שנרכשו בהיעדר נוקלאוטידים צריכה להיות שווה בקירוב (איור 3E). חישובים אלה מבוצעים באופן אוטומטי על ידי התוכנה. - השג את הפלט כתמונה המתווה את הנתונים וגיליון אלקטרוני עם כרטיסיות המכיל את ספקטרום הגולם, ספקטרום מופחת, ספקטרום מתוקן להלבנה ואת נתוני השיא עבור כל קובץ כדי שניתן יהיה לבצע ניתוח נוסף.
- כדי לתקן עבור הלבנה מעריכית ANAP, יש להתאים תחילה דעיכה מעריכית יחידה, (F/Fmax) = A*exp(-t/τ)+(1-A), כאשר t הוא זמן החשיפה המצטבר, τ הוא קבוע הזמן ו-A הוא המשרעת) לשלבי השטיפה המתווכים בין יישומי TNP-ATP או לחשיפות ראשוניות מרובות שנלקחו לפני השטיפה ב-TNP-ATP (איור 3D, כניסה).
6. ניסויי פלואורומטריה מהדק טלאי
- משוך פיפטות טלאי מנימי זכוכית בורוסיליקט עבים להתנגדות של 1.5 MΩ עד 2.5 MΩ כאשר הם מלאים בתמיסת פיפטה. הרכב תמיסת פיפטה ישתנה בהתאם לחלבון הנחקר.
- העבירו את החלקת הכיסוי עם התאים הנגועים על צלחת כיסוי בעלת תחתית זכוכית בקוטר 35 מ"מ המכילה תמיסת אמבטיה בנפח 2 מ"ל והרכיבו על גבי מיקרוסקופ הפוך המצויד ביעד טבילה במים גבוה פי 60. יש לנקב את תא האמבטיה (0.5 – 1 מ"ל/דקה) בתמיסת אמבטיה באמצעות משאבה פריסטלטית. באשר לפתרון פיפטה, פתרון האמבטיה ישתנה בהתאם לחלבון הנחקר.
- זהה תא המבטא תעלות המסומנות בתווית ANAP על-ידי חיפוש פלואורסצנטיות בקרום התא.
- ממלאים פיפטה טלאי בתמיסת פיפטה. הפעילו לחץ חיובי עדין על פיפטה והניחו בחדר האמבטיה. לחצו על פיפטה כנגד קרום התא והפעילו יניקה עדינה כדי להשיג אטם GΩ (איור 4A).
- הבלו את המדבקה על-ידי הרחקה מהירה של מחזיק הפיפטה מהתא (איור 4A).
הערה: כריתת המדבקה באופן זה צריכה ליצור טלאי מבפנים החוצה, כאשר התחומים הציטוסוליים של החלבון חשופים למערכת הזילוח. אם מיקומו של אתר קשירת הנוקלאוטידים הנחקר אינו ציטוסולי, יהיה צורך להשתמש בטלאים חיצוניים או בהקלטות של תאים שלמים כדי לבצע ניסויים ב-PCF. - קרבו את קצה פיפטת המדבקה לקצה מערכת הזילוח, ובדקו שהמדבקה נמצאת בתוך החריץ של מסיכת הספקטרומטר (איור 4A).
- החל TNP-ATP וספקטרום תמונה כמו בשלבים 4.10-4.12, תוך הקלטה בו-זמנית של תגובת הזרם היוני ליישום נוקלאוטידים.
הערה: זכוכית פיפטה עשויה להציג סטיות מרחביות והשתקפויות בתמונות שנרכשו. עם זאת, סטיות אלה לא ישפיעו על צורת הספקטרום הנרכש ואור העירור המוחזר מופרד בקלות מפלואורסצנטיות באמצעות ספקטרוגרף או מסנן פליטה בעל מעבר ארוך. - נתח את הספקטרה. ספקטרום שצולם ממדבקות שנכרתו יכול להציג חיסור יתר של פלואורסצנטיות TNP-ATP לא קשורה עקב אי הכללת TNP-ATP מהזכוכית של פיפטת המדבקה (איור 4C-E). חיסור יתר זה אינו משפיע על ספקטרום הפליטה של ANAP ולכן ניתן להתעלם ממנו.
הערה: מכיוון שהאות הפלואורסצנטי בכתמים שנכרתו יהיה נמוך יותר מאשר בממברנות לא מקורות, חשוב להשתמש בזמן חשיפה שנותן אות לרעש גבוה מספיק מבלי להלבין ANAP מהר מדי.
תוצאות
איור 2 מתאר את מערך הניסוי הבסיסי למדידת קשירת נוקלאוטידים לחלבונים פלואורסצנטיים במקטעי קרום לא מקורים המתקבלים על-ידי סוניקציה (איור 2A,B). שתי גישות שונות שימשו להשגת קרומים לא מקורים, תרבית ישירה של תאים על פתקי כיסוי מצופים פולי-L-ליזין או תאי תרבית על זכוכית לא מטופלת וחשיפתם לזמן קצר לפולי-ל-ליזין (0.1% במים) לפני הסרת הגגות. איור 2C מתאר שבר קרום טיפוסי ללא גג מתא HEK-293T המבטא תעלותK ATP המתויגות בחלבון פלואורסצנטי כתום (OFP). קרומים לא מקורים היו כמעט בלתי נראים בתמונות של שדה בהיר וזוהו על ידי פלואורסצנטיות של חלבוני ממברנה מתויגים או על ידי צביעה נגדית עם צבע קרום כמו אוקטדציל רודמין B13. בנוסף לממברנות לא מקורות, סוניקציה של תאי HEK-293T יצרה גם שברי תאים לא מקורים חלקית (איור 2D)10,17. שברים אלה נראו בשדה בהיר. זו עשויה להיות תוצאה של קרומי פלזמה פרועים שנצמדים רק בצורה גרועה לזכוכית הכיסוי. לחלופין, שברים אלה עשויים להכיל שלפוחיות וקרומים מאברונים תוך-תאיים. ככזה, עדיף לקבל תמונות רק מממברנות "אמיתיות" לא מקורות, שכן חלבון מטרה מסומן הקשור לממברנות תוך תאיות עשוי לשקף שלבי ביניים של עיבוד והרכבה לאחר תרגום. מומלץ לטפח תאים על זכוכית מצופה פולי-L-ליזין מכיוון שהדבר הביא לתפוקה גבוהה יותר של קרומים "אמיתיים" ללא גג עם סוניקציה.
מערכת זילוח מיקרו-נפחי הופעלה על נוקלאוטידים פלואורסצנטיים כדי למזער את הכמויות הדרושות בניסוי טיפוסי (איור 2B). קצה הזכוכית המצופה פולימיד הוחלף בקצה זכוכית בורוסיליקט שנמשכה ביד במערך הזילוח שלנו, שהפחית את הרקע הפלואורסצנטי. כדי למזער הצטברות נוקלאוטידים סביב הקרומים הלא מקורים המצולמים, חדר האמבטיה כולו נוקב לאט בחיץ. לפיכך, ביקשנו למדוד את קצב שינוי התמיסה ממערכת הזלוף המיקרו-נפחי שלנו ולוודא שהצלחנו להשיג את ריכוז הליגנד המיועד באזור העניין שלנו, כלומר, שהליגנד ממערכת הזילוח שלנו לא נמהל ישירות במצע הרחצה לפני שהגיע לקרום הלא מקורה. כדי לשלוט באפשרויות האלה, נמדדו שטיפה ושטיפה של תמיסת 50 מיקרומטר של טטרמתילרודאמין-5-מלימיד (TMRM) ממערכת הזילוח המיקרו-נפחי שלנו המכוונת לפני השטח של צלחת מכוסה תחתית זכוכית מחוררת במים (איור 2E). קינטיקה של החלפת פתרונות הייתה ניתנת לשחזור ותוארה היטב על ידי דעיכה מעריכית אחת עם קבועי זמן של פחות מ -1 שניות הן לשטיפה והן לשטיפה. זמני החלפת פתרונות כאלה מגבילים את יכולתנו למדוד קינטיקה של קשירת ליגנדים ובלתי מחייבים במערך הנוכחי שלנו. כדי לוודא שהצלחנו להשיג את ריכוז הליגנד הרצוי על פני השטח של החלקת הכיסוי, השווינו את עוצמת הפלואורסצנטיות של 50 μM TMRM המועברת להחלקת הכיסוי על-ידי מערכת זילוח המיקרו-נפח שלנו ל-50 מיקרומטר TMRM באמבט דומם (איור 2F). לא נצפה הבדל בעוצמה, מה שווידא כי ניתן להשיג ריכוזי ליגנד מתאימים על פני השטח של החלקת הכיסוי עם מערכת זילוח המיקרו-נפח שלנו, גם כאשר האמבטיה מחוררת.
איור 3A מראה תמונה ספקטרלית שהתקבלה מתעלות K ATP עם תיוג ANAP בקרום לא מקורה מתא HEK-239T שנחשף ל-5 מיקרומטר TNP-ATP. כדי לקבל תמונות כאלה, האור הנפלט מהקרום הלא מקורה הופנה דרך ספקטרומטר בסדרות עם מצלמת CCD. הפלואורסצנטיות שנפלטה התפזרה מגרגרים והוקרן על שבב המצלמה, וכך נוצר ספקטרה. התמונות המתקבלות שומרות על מידע מרחבי בממד y, אך ממד x הוחלף באורך גל. אזור העניין (ROI), המתאים לקרום הלא מקורה מסומן בכתום. שני אזורים בעוצמה גבוהה ניכרים בתמונה, המתאימים לשיא הפליטה של ANAP ו- TNP-ATP. זה הוערך בצורה הטובה ביותר באורך גל אחר אורך גל ממוצע (על פני כל ספקטרום החזר ההשקעה) שמוצג באיור 3B. השיא ~ 470 ננומטר מתאים ל- ANAP המשולב ב- KATP; השיא ~ 535 ננומטר מתאים TNP-ATP. כדי לתקן פלואורסצנטיות רקע ועירור ישיר של TNP-ATP בתמיסה, נבחר אזור רקע (איור 3A, אפור) מכל תמונה. ספקטרום הרקע הממוצע מוצג באיור 3B. הספקטרום הסופי התקבל על-ידי הפחתת ספקטרום הרקע הממוצע מספקטרום החזר ההשקעה הממוצע (איור 3C).
ANAP נוטה לפוטו-אקונומיקה. איור 3D מראה את הירידה בפלואורסצנטיות שיא ANAP לאחר חשיפות מרובות. שיא הפלואורסצנטיות מכמה חשיפות בהיעדר TNP-ATP (או משטיפות בין ריכוזי TNP-ATP) הותאם לדעיכה מעריכית אחת, וזה שימש לתיקון חפצי פוטו-הלבנה (איור 3E). מומלץ לבצע ניסויי תגובת ריכוז הן מריכוזי נוקלאוטידים נמוכים לגבוהים והן מריכוזים גבוהים עד נמוכים. אם תיקון הלבנה אינו מציג חפצים נוספים, התוצאות צריכות להיות דומות11.
איור 5A מראה תמונות ספקטרליות מייצגות מממברנה לא מקורה המתקבלת מתא המבטא תעלות K ATP המתויגות ב-ANAP בהיעדר TNP-ATP ובנוכחותו. הספקטרום המתוקן מוצג באיור 5B. בהתבוננות בספקטרום הפליטה הייתה הפרדה ברורה בין הפליטה הפלואורסצנטית של התורם למקבל. מכיוון שנצפתה קשירה לא ספציפית של TNP-ATP לקרומי פלזמה נאיביים מתאי HEK-293T לא נגועים, מומלץ לכמת FRET כהפחתה בפלואורסצנטיות10,11 של התורם (ANAP). שיא זה היה ספציפי לקולטן המסומן.
עבור ליגנדות הגורמות לשינוי קונפורמטיבי בקולטן שלהן, מחקרי קשירה בבידוד אינם מספקים מידע ישיר ובעל משמעות מכניסטית על תהליך קשירת הליגנד18. יחסי ריכוז-תגובה עבור קשירת ליגנד תלויים לא רק בזיקה הקשירה הפנימית, אלא גם בשינוי הקונפורמטיבי המושרה על ידי קשירת ליגנד, ובנטייה הטבועה של הקולטן לשנות קונפורמציה בהיעדר ליגנד. כדי להבין טוב יותר את התהליכים המדגישים אינטראקציות ליגנד-קולטן, ניתן לשלב מדידות קשירה עם ניסויים המספקים קריאה של תפקוד החלבון. לשם כך, תעלות יונים הן מערכת מודל אידיאלית, שכן ניתן למדוד את הזרמים שלהן ברזולוציית זמן של תת-אלפיות השנייה עד לרמת המולקולה הבודדת באמצעות מהדק מתח. מבחינה היסטורית, מדידות זרם זוגי ופלואורסצנטיות סיפקו תובנות משמעותיות לגבי פתיחה וסגירה (גטינג) של תעלות יונים מגודרות מתח וליגנד 19,20,21. ניסויים נערכו כדי למדוד בו זמנית זרמים יוניים ונוקלאוטיד מחזורי פלואורסצנטי נקשר לתעלות מווסתות נוקלאוטידים מחזוריות שונות22,23,24. מחקרים אלה השתמשו בליגנד שהגדיל את התפוקה הקוונטית שלו בעת הקשירה. פלואורסצנטיות מליגנד לא קשור בנפח התמיסה ליד המדבקה ניתנת לחיסור על ידי הדמיה של המדבקות באמצעות מיקרוסקופ קונפוקלי22,23. במחקרים שלנו, הקשירה נמדדה באמצעות הפחתה בפלואורסצנטיות ANAP. מכיוון שאות זה הוא ספציפי לערוץ ו- FRET בין ANAP ו- TNP-ATP תלוי מרחק חזק (חצי מקסימלי ב~ 43 Å), נמנע זיהום של האות שלנו על ידי נוקלאוטידים שאינם קשורים באופן ספציפי ולא קשורים.
איור 4A מראה ניסוי פלואורומטריה טיפוסי של מהדק טלאי (PCF). אטם בעל התנגדות גבוהה (GΩ) נוצר בין פיפטה מזכוכית בורוסיליקט מלאה במי מלח (המחוברת למגבר מהדק מתח) לבין תא המבטא KATP המתויג ANAP. לאחר היווצרות האטם, הפיפט נמשכה מהתא, ואפשרה גישה לאתרי הקישור של הנוקלאוטידים התוך-תאיים. לאחר מכן הפיפטה הוצבה מעל מטרת המיקרוסקופ, במרכזו החריץ של מסיכת הספקטרומטר, והזרימה החוצה של מערכת הזלוף של מיקרו-נפח (ששונתה עם קצה זכוכית בורוסיליקט) התקרבה לפיפטה (איור 4D). המתח נשלט ונמדדו זרמים מהערוצים בטלאי. זרמים מייצגים וספקטרום מערוצי KATP המתויגים ב-ANAP מוצגים באיור 4B, כשהם מקודדים בצבע כדי להתאים את הספקטרום לזרמים. ספקטרום הפליטה תוקן עבור רקע והלבנה כמו עבור ממברנות לא מקורות.
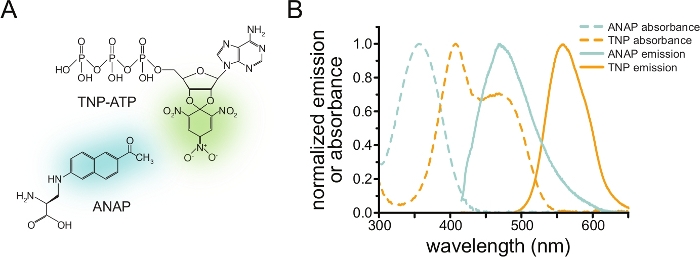
איור 1: ANAP ו-TNP-ATP יוצרים זוג FRET מתאים. (A) מבנים של ANAP ו-TNP-ATP. המויאטים הפלואורסצנטיים מודגשים. (B) ספקטרום ספיגה ופליטת פלואורסצנטיות של ANAP ו-TNP-ATP. חפיפה בין פליטת ANAP לספיגת TNP-ATP נדרשת עבור FRET. עובד מתוך Puljung et al. (פורסם תחת רישיון ייחוס Creative Commons, https://creativecommons.org/licenses/by/4.0/)10. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
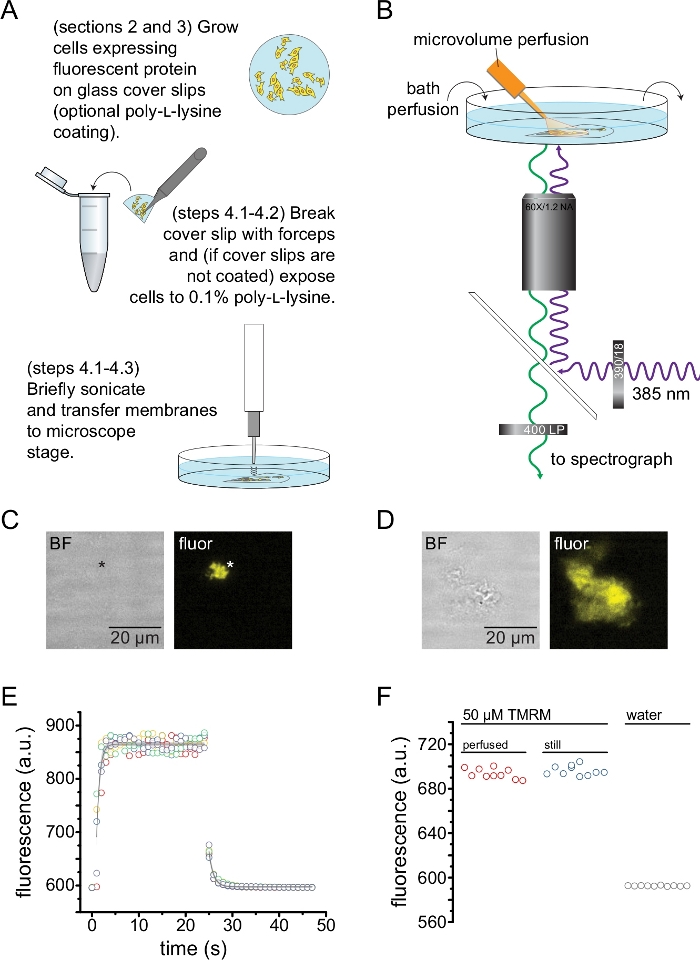
איור 2: מדידת קשירת נוקלאוטידים בקרומי פלזמה לא מקורים. (A) סכמטי להכנת קרומי פלזמה לא מקורים מתאים דבקים המבטאים חלבון קרום פלואורסצנטי. ההוראות ניתנות לתאים הגדלים על פתקי כיסוי מצופים פולי-L-ליזין או לא מטופלים. (B) מערך ניסיוני למדידת קשירת נוקלאוטידים בממברנות לא מקורות. (C) שדה בהיר ותמונות פלואורסצנטיות של קרום פלזמה בלתי מקורה לחלוטין שמקורו בתא המבטא חלבון פלואורסצנטי כתום (OFP) המתויג כתעלותK ATP. הכוכבית מסמנת את מיקום הממברנה, שהיא כמעט בלתי נראית בתמונת השדה הבהיר. OFP התלהבה עם LED רחב של 565 ננומטר דרך מסנן פסים של 531/40 ננומטר ואור דיכרואי ונפלט של 562 ננומטר נאסף דרך מסנן פסים של 593/40 ננומטר. (D) שדה בהיר ותמונות פלואורסצנטיות של מקטע קרום לא מקורה חלקית שמקורו בתא המבטא חלבון פלואורסצנטי כתום (OFP) המתויג כתעלותK ATP. (E) מסלול זמן החלפת פתרונות שנרכש באמצעות ההתקנה המתוארת ב-B. מוצגים חמישה עותקים משוכפלים טכניים. מערכת הזילוח microvolume היה טעון עם 50 μM tetramethylrhodamine-5-maleimide (TMRM). האמבטיה הייתה מחוררת במים בקצב של ~ 0.5 מ"ל / דקה. נתונים ממסלולי הזמן של שטיפה (הגדלת פלואורסצנציה) ושטיפה (ירידה פלואורסצנטית) התאימו לדעיכה מעריכית אחת של הצורה F = A*exp(-x/τ) + y0. קבוע הזמן (τ) לשטיפה היה ~ 0.6 שניות. קבוע הזמן לשטיפה היה ~ 1.0 שניות. TMRM התלהב עם LED רחב של 565 ננומטר דרך מסנן פסים של 540/25 ננומטר ואור דיכרואי ונפלט של 565 ננומטר נאסף דרך מסנן פס של 605/55 ננומטר. (F) השוואה של עוצמת הפלואורסצנטיות של תמיסה של 50 מיקרומטר של TMRM המיושמת באמצעות מערכת זילוח מיקרו-נפח כמו ב-B ואמבט דומם המכיל 50 מיקרומטר TMRM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
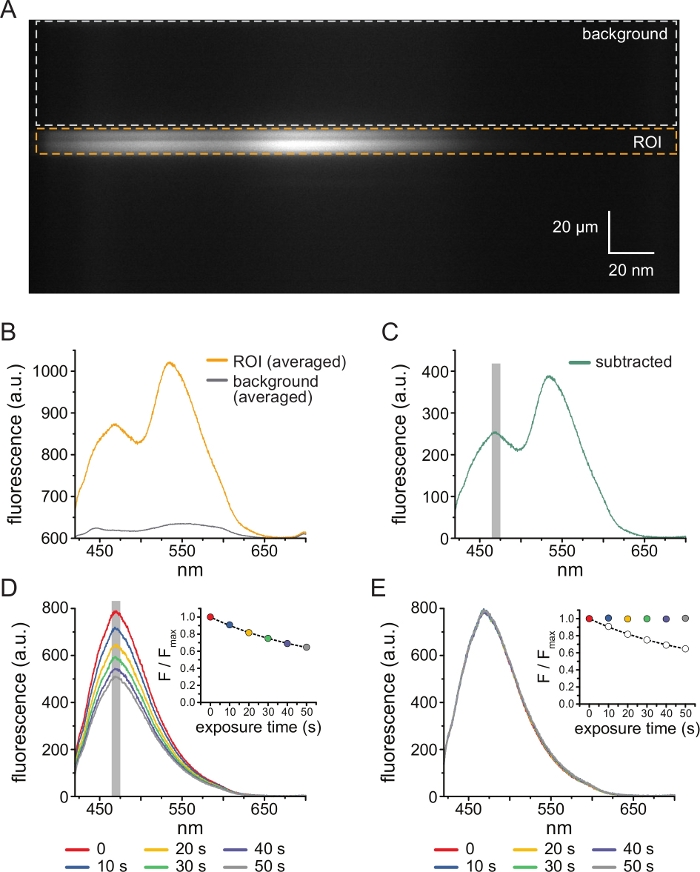
איור 3: חיסור רקע ותיקון הלבנה. (A) תמונה ספקטרלית (מידע מרחבי בממד y, אורך גל בממד x) של קרום פלזמה לא מקורה מתא המבטא תעלות KATP המסומנות בתווית ANAP. 5 מיקרומטר TNP-ATP יושם באמצעות ההתקנה המתוארת באיור 2B. הקופסה הכתומה מציינת את אזור העניין (ROI), המתאים לקרום הלא מקורה. התיבה האפורה מציינת את אזור הרקע המשמש לתיקון הספקטרום. (B) ספקטרום פליטה הנגזר מממוצעים של אורך גל אחר אורך גל של החזר ההשקעה ואזורי רקע בספקטרום A. (C) הנגזר על ידי הפחתת ספקטרום הרקע הממוצע מספקטרום החזר ההשקעה הממוצע ב-B. חלון 5 ננומטר סביב פסגת ANAP המשמש לקביעת העוצמה הממוצעת מוצג כאזור אפור מוצלל. (D) ספקטרום נרכש משש חשיפות רצופות של 10 שניות של קרום פלזמה לא מקורה מתא המבטא תעלות KATP המסומנות כ-ANAP. שימו לב לירידה בפלואורסצנטיות הנובעת מהלבנה. הכניסה מראה את התאמת שיא הפלואורסצנטיות המנורמלת עם דעיכה מעריכית יחידה מהצורה F/Fmax = A*exp(-t/τ) + (1-A). הסמלים בכניסה מקודדים בצבע כדי להתאים לספקטרה. (E) אותו ספקטרום כמו ב-D מתוקן עבור פוטו-הלבנה. הכניסה מציגה את פלואורסצנטיות השיא המנורמלת מ-D כעיגולים פתוחים, כאשר פלואורסצנטיות השיא המתוקנת מוצגת באמצעות עיגולים מלאים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: מדידות סימולטניות של קשירת נוקלאוטידים וזרמי תעלה באמצעות פלואורומטריית מהדק טלאי (PCF). (A) סכמטי המראה את מערך הניסוי למדידת קשירת נוקלאוטידים וזרמים יוניים. (B) זרמים לדוגמה (משמאל) וספקטרום (מימין) המתקבלים ממדבקה של ממברנה שנכרתה מתא המבטא תעלות KATP המסומנות בתווית ANAP. הזרמים תועדו בפוטנציאל החזקה של -60 mV, עברו דיגיטציה ב-20 קילוהרץ וסוננו ב-5 קילוהרץ. האזור המוצלל האפור מתאים לטווח אורכי הגל שממנו כומתה עוצמת ANAP. מעובד על ידי אשר ואחרים (פורסם תחת רישיון ייחוס Creative Commons, https://creativecommons.org/licenses/by/4.0/)11. (C) ספקטרום המתקבל ממדבקה של קרום שהוצא מתא המבטא תעלות K ATP המסומנות בתווית ANAP ונחשפו ל-1 mM TNP-ATP. שימו לב לשיא השלילי המתאים לתחום אורכי הגל שבו נצפית פלואורסצנטיות TNP-ATP. האזור המוצלל האפור מציין את טווח אורכי הגל המשמש לכימות פלואורסצנטיות ANAP כמו ב-B. Adapted from Usher et al. (פורסם תחת רישיון Creative Commons Attribution, https://creativecommons.org/licenses/by/4.0/)11. (D) שדה בהיר ותמונות פלורסנט של פיפטת טלאי שנחשפה ל-1 mM TNP-ATP. הכוכבית מסמנת את קצה הפיפטה. (E) תמונה ספקטרלית של אותה פיפטת טלאי ב-1 mM TNP-ATP. הכוכבית מסמנת את מיקום הפיפטה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
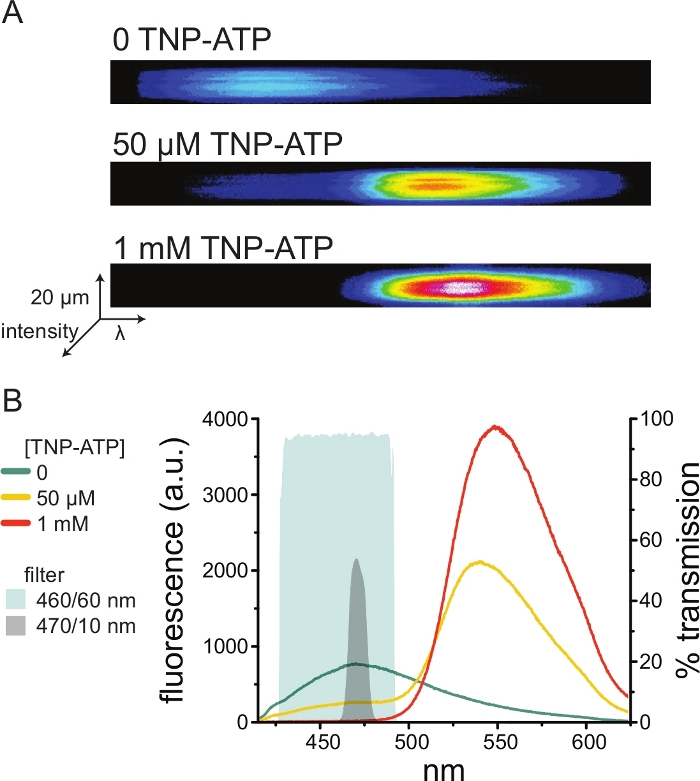
איור 5: קישור TNP-ATP לערוצי KATP המסומנים בתווית ANAP. (A) תמונות ספקטרליות של קרום פלזמה לא מקורה מתא המבטא תעלות K ATP המסומנות בתווית ANAP בהיעדר TNP-ATP או בנוכחות 50 מיקרומטר או 1 מילימטר TNP-ATP. העוצמות מוצגות כמפת חום. (B) ספקטרום ממוצע של אורך גל אחר אורך גל מהתמונות ב-A המראות מרווה של פלואורסצנטיות ANAP על ידי TNP-ATP. האזורים המוצללים מייצגים שני מסנני פסים שונים שניתן להשתמש בהם למדידת מרווה של ANAP אם ספקטרומטר אינו זמין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
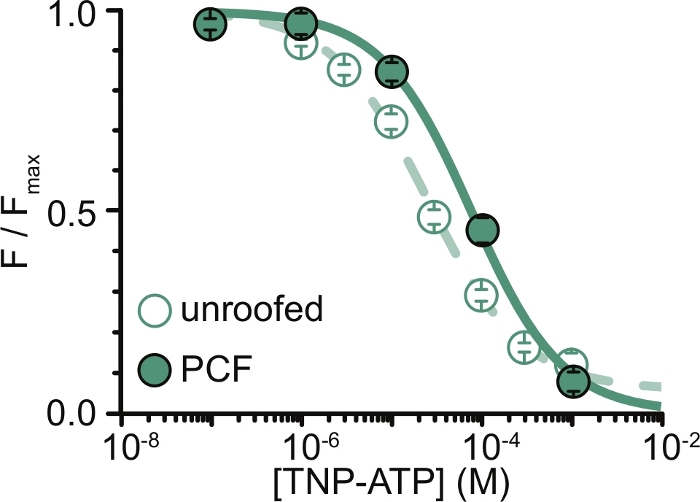
איור 6: מרווה של תעלות K ATP המסומנות ב-ANAP על-ידיTNP-ATP בממברנות לא מקורות, וב-PCF. שכבת-על של נתונים מאת אשר ואחרים (פורסם תחת רישיון ייחוס Creative Commons, https://creativecommons.org/licenses/by/4.0/)11. הנתונים התאימו למשוואת היל: F / F max = E max + (1 – E max) / (1+10(EC50 –[TNP-ATP])*h). F הוא הפלואורסצנטיות הנמדדת, F max הוא הפלואורסצנטיות המקסימלית בהיעדר נוקלאוטידים, Emax הוא המרווה המקסימלית בריכוזי נוקלאוטידים רוויים, ו-h הוא שיפוע הגבעה. EC50, (ריכוז הנוקלאוטידים שבו המרווה היא חצי מקסימלית) ו- [TNP-ATP] הם ערכי יומן. ממברנות ללא קירוי: EC50 = -4.59 (25.7 מיקרומטר), h = 0.82, Emax = 0.93. PCF: EC50 = -4.11 (77.6 מיקרומטר), h = 0.87, Emax = 1.00. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
פיתחנו שיטה למדידת קשירת אדנין נוקלאוטיד בזמן אמת לחלבוני ממברנה שלמים. השיטה שלנו מתבססת על מספר טכניקות מבוססות אחרות, כולל תיוג חלבונים עם ANAP באמצעות דיכוי קודון עצירה ענבר 12, הסרת קירוי תאים 14, ופלואורומטריית מהדק מתח/PCF19,20,21,22,23,24,25. הסינתזה של גישות אלה מאפשרת מדידה של קשירת נוקלאוטידים ברזולוציה מרחבית וטמפורלית גבוהה. ואכן, בעבודתנו הקודמת הצלחנו להבחין בין אתרי קישור שונים על אותו קומפלקס חלבונים באמצעות גישה זו10,11. חשוב לציין כי ניתן ליישם טכניקה זו ישירות על כמויות קטנות של חלבון בסביבה תאית בתנאים המשמרים את תפקוד החלבון. השימוש בשיטת הקשירה שלנו בשילוב עם קריאה ישירה ואלקטרופיזיולוגית של זרמי תעלות יונים מאפשר לנו לקבל תובנות עשירות על היסודות המולקולריים של ערוץגאטינג 11.
מכיוון שספקטרומטרים הם ציוד מעבדה לא סטנדרטי, ניתן לנטר את עוצמת ANAP גם בבידוד יחסי באמצעות מסנני פסים. איור 5B מתאר את התכונות הספקטרליות של שני מסננים כאלה. מסנן הפס 470/10 ננומטר מסנן ביעילות את אות הפלואורסצנטיות מ-TNP-ATP וחופף היטב לשיא הפלואורסצנטיות של ANAP. עם זאת, שיא ההעברה של מסנן זה הוא רק סביב 50%, מה שעלול להקשות על קבלת אותות טובים מממברנות עמומות (או בכתמי קרום נכרתו תחת מהדק מתח). אפשרות נוספת היא מסנן פסים של 460/60 ננומטר. יש מעט יותר חפיפה בין מסנן 460/60 ננומטר לבין כף הרגל של שיא הפליטה TNP-ATP בהשוואה למסנן 470/10 ננומטר. עם זאת, לפס 460/60 ננומטר יש העברה של 90-95% על פני טווח רחב של שיא ANAP, אשר צפוי להגביר את אות הפלואורסצנטיות.
ANAP הוא פלואורופוררגיש לסביבה 12,26,27. שיא הפליטה ותפוקת הקוונטים משתנים בהתאם לאתר ההתאגדות של החלבון המעניין ועשויים להשתנות כאשר החלבון משנה קונפורמציה. שינויים כאלה יהיו ברורים באופן מיידי מספקטרום הפליטה, אך לא יהיו ברורים כל כך כאשר עוצמת ANAP נמדדת באמצעות מסננים. בכל מקרה, נדרשות בקרות מתאימות כדי להוכיח שהאות הפלואורסצנטי אינו משתנה בגלל שינויים בסביבה המקומית סביב ANAP בעקבות קשירת הנוקלאוטידים. ניסויי בקרה עם נוקלאוטידים לא מסומנים יכולים לעזור לוודא שכל שינוי בעוצמת ANAP הוא תוצאה של FRET בין ANAP לנוקלאוטידים TNP. TNP-נוקלאוטידים יכולים להיקשר באופן לא ספציפי לממברנות שמקורן בתאים לא נגועים (לקרום הפלזמה או לחלבוני הממברנה המקומיים)10. אנו מכמתים את הכריכה כגזירה בפלואורסצנטיות של התורם, מכיוון שאות זה הוא ספציפי לערוץ המסומן. עם זאת, אנו ממליצים לבצע ניסויי בקרה נוספים עבור כל זוג אגוניסטים/קולטנים, למשל מוטציה באתר קשירת הנוקלאוטידים אם ידוע, כדי לוודא שהשינוי בפלואורסצנטיות של התורם הוא אכן תוצאה של קשירה ישירה לקולטןהמסומן 11. לבסוף, מומלץ לעבוד עם מבנים המכילים תג חלבון פלואורסצנטי בנוסף לתווית ANAP. זה עוזר להבדיל בין פלואורסצנטיות קולטן מסומן לבין רקע / אוטופלואורסצנטיות. ניתן להבדיל בין פלואורסצנטיות רקע לבין ANAP על ידי שיא וצורה של ספקטרום פליטה10, אך קביעות כאלה יכולות להיות קשות מאוד כאשר משתמשים רק בערכות סינון. בנוסף, ניתן לזהות תאים וקרומים לא מקורים המבטאים קולטנים פלואורסצנטיים באמצעות תג החלבון הפלואורסצנטי מבלי לעורר ANAP ולהסתכן בהלבנה מוגזמת.
ברבות מרישומי ה-PCF שלנו ראינו שיא שלילי חזק בספקטרום שלנו בריכוזי TNP-ATP גבוהים (איור 4C). שיא שלילי זה הוא תוצר של פרוטוקול חיסור הרקע שלנו. איור 4D מראה תמונות שדה בהיר ופלואורסצנטי של פיפטת טלאי שנחשפה ל-1 mM TNP-ATP. ניתן להבחין בצל בקצה הפיפטה, הנובע מהרחקת TNP-ATP מנפח דפנות הפיפטה, הניכרת ביותר במישור המיקוד. התמונה הספקטרלית באיור 4E מראה פס כהה, המתאים לצל הזה. כאשר אזור מעל או מתחת לפס כהה זה משמש לחיסור רקע, הוא מפיק שיא שלילי. חשוב לציין כי שיא זה התרחש בטווח אורכי גל המתאים לפליטת TNP-ATP ולא השפיע על המדידות שלנו של מרוות ANAP.
המגבלה העיקרית של הניסויים שלנו הייתה בהשגת ביטוי הולם של קרום פלזמה של מבנים המתויגים על ידי ANAP כדי למדוד פלואורסצנטיות. בדרך כלל היה קל יותר לרכוש ספקטרום איכותי מממברנות לא מקורות, מאשר ב-PCF, בשל גודלן הגדול יותר ויכולתנו לסרוק במהירות צלחת שלמה של ממברנות לא מקורות, בניגוד ל-PCF שם ניתן לקבל טלאים רק אחד בכל פעם. בניסויים שלנו, הנתונים מממברנות לא מקורות, ומניסויי PCF היו דומים אך לא שווי ערך (איור 6)11. עם זאת, אין סיבה אפריורית מדוע זו צריכה להיות תצפית אוניברסלית מכיוון שחלבונים בפיפטת טלאי עשויים להיות במצב תפקודי שונה מאלה שבממברנות לא מקורות.
כאן, נעשו ניסיונות למקסם את הביטוי של המבנים המתויגים ANAP שלנו, במיוחד הורדת טמפרטורת תרבית התא ל 33 ° C10,11,16. מניסיוננו, הניסיון לזהות אתרים בחלבון שבהם ANAP יהיה תחליף שמרני לא הניב באופן עקבי מבנים שהתבטאו היטב. הייתה לנו הצלחה רבה יותר בסריקה שיטתית של אזורי חלבון שלמים עבור אתרי שילוב ANAP וסינון מועמדים לביטוי פני שטח10. מערכת התיוג ANAP פועלת גם בביציות Xenopus laevis, המאפשרת כריתה של מדבקות קרום גדולות בהרבה, ובכך מגבירה את האות לרעש26,27,28.
בעוד שרמות ביטוי גדולות יותר צפויות לגרום לאותות בהירים יותר, מספר הערוצים המינימלי הדרוש למדידת פלואורסצנטיות תלוי במספר גורמים, כולל בהירות הפלואורופור, מידת ההלבנה, עוצמת אור העירור ומישור המיקוד. בתיאוריה, ניתן לבצע הערכות על ידי מתאם בין עוצמת הפלואורסצנטיות לבין זרם הערוץ כפי שהוכח בעבר28,29. עם זאת, מהימנותם של אומדנים כאלה דורשת ידע מסוים על המוליכות החד-ערוצית ועל ההסתברות הגלויה של הערוץ. בנוסף לגורמים המפורטים לעיל, האות הפלואורסצנטי יושפע גם מתעלות הקשורות לשלפוחיות או חלקים של קרום הפלזמה הדבוקים לזכוכית פיפטה שאינם תחת מהדק מתח.
שיטה זו מותאמת בקלות לחקר תעלות יונים אחרות הרגישות לנוקלאוטידים. CFTR דומה מבחינה מבנית לתת-היחידה של קולטן סולפונילאוריאה של KATP30,31. כמו KATP CFTR GATING נשלט על ידי קשירת נוקלאוטידים, מה שהופך אותו למטרה עתידית ברורה של שיטה7 שלנו. קולטני P2X פורינרגיים הם תעלות יונים המגודרות על ידי ATP9 חוץ-תאי. TNP-ATP פועל כאנטגוניסט לקולטני P2X32,33. לכן, זה לא יהיה שימושי לחקר הפעלת P2X, אם כי ניתן להשתמש בו במבחני תחרות עם אגוניסטים P2X. לחלופין, נגזרות ATP פלואורסצנטיות אחרות עם חפיפה ספקטרלית מספקת עם פליטת ANAP עשויות לשמש לחקר ההפעלה. Alexa-647-ATP הוא אגוניסט P2X פלואורסצנטי34. R0 המחושב בין Alexa-647 ו- ANAP הוא ~ 85 Å, מה שאומר שקשירה ישירה ל- P2X אמורה לגרום לרוויה משמעותית של ANAP המשולב בתעלה. עם זאת, R0 ארוך כזה יגרום גם למרווה מ-Alexa-647-ATP הקשור לתת-יחידות שכנות ויגדיל את הסבירות שקשירת נוקלאוטידים לא ספציפיים תגרום ל-FRET. מכיוון שאתר קשירת הליגנד בקולטני P2X הוא חוץ-תאי, מדידות הקשירה יבוצעו על תאים שלמים, במהדק מתח של כל התא, או בכתמי קרום חיצוניים. ניתן להרחיב את השיטה שלנו גם לחקר קשירה והפעלה של טרנספורטרים ומשאבות אלקטרוגניים ולא אלקטרוגניים התלויים ב-ATP עבור מחזור התגובה שלהם, כמו גם קולטני P2Y מצומדים לחלבון G. לבסוף, למרות שפיתחנו שיטה זו למדידת קשירת אדנין נוקלאוטיד (TNP-ATP, TNP-ADP, TNP-AMP), ניתן להשתמש באותה גישה כדי לחקור קשירה כמעט לכל קולטן שעבורו זוהה ליגנד פלואורסצנטי מתאים.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
ברצוננו להודות לראול טרון אקספוזיטו על סיוע טכני מעולה. עבודה זו מומנה על ידי מועצת המחקר לביוטכנולוגיה ומדעי הביולוגיה (BB/R002517/1; MCP ו-FMA) וקרן Wellcome (203731/Z/16/A; SGU)
Materials
| Name | Company | Catalog Number | Comments |
| T75 tissue-culture treated flask | StarLab | CC7682-4875 | |
| 0.1% w/v poly-L-lysine | Sigma-Aldrich | P8920 | |
| 30 mm borosilicate cover glass slips | VWR | 631-0174 | |
| 35 mm non-treated sterile dishes | CytoOne | CC7672-3340 | |
| 35 mm cover glass bottom dish | WPI | FD35-PDL-100 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 31966021 | |
| Foetal bovine serum (FBS) | Gibco | 10500-064 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| TrypLE select (tryosin) | Gibco | 12563-011 | Trypsin/EDTA reagent |
| Phosphate buffered saline (PBS) | Gibco | 14040-091 | |
| UltraPure distilled water | Invitrogen | 10977-035 | |
| HEK293T cells | ATTC | CRL-3216 | Used between passages 5-30 |
| ANAP-TFA | AsisChem | ASIS-0014 | Reconstituted in 30 mM NaOH to a final concentration of 1 mM |
| pANAP expression plasmid | Addgene | Plasmid #48696 | Encodes tRNA/tRNA synthetase pair for expression of ANAP-tagged protein |
| peRF1-E55D | Chin Lab (MRC Laboratory of Molecular Biology, Cambridge, UK) | Jason Chin: DOI: 10.1021/ja5069728 | Encodes dominant-negative eukaryotic ribosomal release factor |
| TransIT-LT1 | Mirus Bio | MIR 2300 | Lipopolyplex transfection reagent |
| Thick-walled borosilicate glass capillaries | Harvard Apparatus | GC150F-15 | |
| Tetramethylrhodamine-5-maleimide | Sigma-Aldrich | 94506 | |
| TNP-ATP | Jena Bioscience | NU-221L | Delivered at 10 mM in water |
| Nikon Eclipse TE2000-U inverted microscope microscope | Nikon | ||
| 60x water immersion objective (1.4 NA) | Nikon | MRD07602 | |
| 4-Wavelength High-Power LED Head | ThorLabs | LED4D245 | 385/490/565/625 nm LEDs |
| Four-Channel LED Driver | ThorLabs | DC4100 | |
| 390/18 nm band-pass excitation filter | ThorLabs | MF390-18 | For ANAP excitation |
| 400 nm long-pass emission filter | ThorLabs | FEL0400 | For imaging ANAP spectra |
| 416 nm edge dichroic | ThorLabs | MD416 | For imaging ANAP spectra |
| 460/60 nm band-pass emission filter | ThorLabs | MF460-60 | Suggested wide band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 470/10 nm band-pass emission filter | ThorLabs | FB470-10 | Suggested narrow band-pass filter for imaging ANAP fluorescence (Figure 4B) |
| 531/40 band-pass excitation filter | Brightline | FF01-531/40-25 | For orange fluorescent protein (OFP) excitation |
| 540/25 nm band-pass excitation filter | Chroma | D540/25X | For tetramethylrhodamine-5-maleimide (TMRM) excitation |
| 562 nm edge dichroic | Semrock | FF562-Di03 | For imaging OFP fluorescence |
| 565 nm edge dichroic | Chroma | 565DC | For imaging TMRM fluorescence |
| 593/40 nm band-pass excitation filter | Brightline | FF01-387/11-25 | For imaging OFP fluorescence |
| 605/55 nm band-pass emission filter | Chroma | D605/55M | For imaging TMRM fluorescence |
| IsoPlane-160 Imaging Spectrometer | Princeton Instruments | IsoPlane-160 | |
| PIXIS 400BR_eXcelon Camera | Princeton Instruments | PIXIS: 400BR_eXcelon | |
| Axopatch 200B amplifier | Molecular Devices | Axopatch 200B-2 | |
| Digidata 1440A digitizer | Molecular Devices | Digidata 1440A | |
| Probe sonicator | Sonics & Materials | VC-50 | For unroofing |
| REGLO digital peristaltic pump | Ismatec | ISM 832 | For bath perfusion |
| Microvolume perfusion system | ALA Scientific Instruments | ALA μFlow-8 | For TNP-ATP perfusion |
| pClamp 10.6.2 | Molecular Devices | Recording and analysing currents | |
| Lightfield 5.20.1507 | Princeton Instruments | Acquisition software for images and spectra | |
| Matlab | Mathworks | For data analysis | |
| Python 3.8.1 | Python Software Foundation | For data analysis |
References
- Garcia, M. L., Kaczorowski, G. J. Ion channels find a pathway for therapeutic success. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5472-5474 (2016).
- Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schioth, H. B., Gloriam, D. E. Trends in GPCR drug discovery: new agents, targets and indications. Nature Reviews Drug Discovery. 16 (12), 829-842 (2017).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. 3rd edn. , Springer. (2006).
- Higgins, C. F., Linton, K. J. The ATP switch model for ABC transporters. Nature Structural & Molecular Biology. 11 (10), 918-926 (2004).
- Toyoshima, C., Cornelius, F. New crystal structures of PII-type ATPases: excitement continues. Current Opinion in Structural Biology. 23 (4), 507-514 (2013).
- Craven, K. B., Zagotta, W. N. CNG and HCN channels: two peas, one pod. Annual Review of Physiology. 68, 375-401 (2006).
- Csanady, L., Vergani, P., Gadsby, D. C. Strict coupling between CFTR's catalytic cycle and gating of its Cl- ion pore revealed by distributions of open channel burst durations. Proceedings of the National Academy of Sciences of the United States of America. 107 (3), 1241-1246 (2010).
- Vedovato, N., Ashcroft, F. M., Puljung, M. C. The Nucleotide-Binding Sites of SUR1: A Mechanistic Model. Biophysical Journal. 109 (12), 2452-2460 (2015).
- Burnstock, G. Introduction to the Special Issue on Purinergic Receptors. Advances in Experimental Medicine and Biology. 1051, 1-6 (2017).
- Puljung, M., Vedovato, N., Usher, S., Ashcroft, F. Activation mechanism of ATP-sensitive K(+) channels explored with real-time nucleotide binding. Elife. 8, 41103(2019).
- Usher, S. G., Ashcroft, F. M., Puljung, M. C. Nucleotide inhibition of the pancreatic ATP-sensitive K+ channel explored with patch-clamp fluorometry. Elife. 9, 52775(2020).
- Chatterjee, A., Guo, J., Lee, H. S., Schultz, P. G. A genetically encoded fluorescent probe in mammalian cells. Journal of the American Chemical Society. 135 (34), 12540-12543 (2013).
- Gordon, S. E., Senning, E. N., Aman, T. K., Zagotta, W. N. Transition metal ion FRET to measure short-range distances at the intracellular surface of the plasma membrane. Journal of General Physiology. 147 (2), 189-200 (2016).
- Heuser, J. The production of 'cell cortices' for light and electron microscopy. Traffic. 1 (7), 545-552 (2000).
- Schmied, W. H., Elsasser, S. J., Uttamapinant, C., Chin, J. W. Efficient multisite unnatural amino acid incorporation in mammalian cells via optimized pyrrolysyl tRNA synthetase/tRNA expression and engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Lin, C. Y., et al. Enhancing Protein Expression in HEK-293 Cells by Lowering Culture Temperature. PloS One. 10 (4), 0123562(2015).
- Usukura, J., et al. Use of the unroofing technique for atomic force microscopic imaging of the intra-cellular cytoskeleton under aqueous conditions. Journal of Electron Microscopy. 61 (5), 321-326 (2012).
- Colquhoun, D. Binding, gating, affinity and efficacy: the interpretation of structure-activity relationships for agonists and of the effects of mutating receptors. British Journal of Pharmacology. 125 (5), 924-947 (1998).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Science's STKE. 2003 (176), 7(2003).
- Biskup, C., et al. Relating ligand binding to activation gating in CNGA2 channels. Nature. 446 (7134), 440-443 (2007).
- Kusch, J., et al. Interdependence of receptor activation and ligand binding in HCN2 pacemaker channels. Neuron. 67 (1), 75-85 (2010).
- Wu, S., et al. State-dependent cAMP binding to functioning HCN channels studied by patch-clamp fluorometry. Biophysical Journal. 100 (5), 1226-1232 (2011).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in K(V) channels probed by a fluorescent unnatural amino acid. Proceedings of the National Academy of Sciences of the United States of America. 110 (20), 8272-8277 (2013).
- Kalstrup, T., Blunck, R. S4-S5 linker movement during activation and inactivation in voltage-gated K(+) channels. Proceedings of the National Academy of Sciences of the United States of America. 115 (29), 6751-6759 (2018).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nature Structural & Molecular Biology. 26 (8), 686-694 (2019).
- Liu, C., et al. Patch-clamp fluorometry-based channel counting to determine HCN channel conductance. Journal of General Physiology. 148 (1), 65-76 (2016).
- Hwang, T. C., et al. Structural mechanisms of CFTR function and dysfunction. Journal of General Physiology. 150 (4), 539-570 (2018).
- Puljung, M. C. Cryo-electron microscopy structures and progress toward a dynamic understanding of KATP channels. Journal of General Physiology. 150 (5), 653-669 (2018).
- Kasuya, G., et al. Structural insights into the competitive inhibition of the ATP-gated P2X receptor channel. Nature Communications. 8 (1), 876(2017).
- Virginio, C., Robertson, G., Surprenant, A., North, R. A. Trinitrophenyl-substituted nucleotides are potent antagonists selective for P2X1, P2X3, and heteromeric P2X2/3 receptors. Molecular Pharmacology. 53 (6), 969-973 (1998).
- Bhargava, Y., Nicke, A., Rettinger, J. Validation of Alexa-647-ATP as a powerful tool to study P2X receptor ligand binding and desensitization. Biochemical and Biophysical Research Communications. 438 (2), 295-300 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved