Method Article
הזמנת הקרנה ודוזימטריה להערכת LQ α ופרמטרים β, סכימת מינון קרינה ותצהיר מינון vivo
* These authors contributed equally
In This Article
Summary
דוזימטריית קרינה מספקת טכניקה לשיפור הדיוק של ניסויים פרה-קליניים ולהבטחת כי מינוני הקרינה המועברים קשורים קשר הדוק לפרמטרים קליניים. פרוטוקול זה מתאר צעדים שיש לנקוט בכל שלב במהלך ניסויי קרינה פרה-קולינית כדי להבטיח תכנון ניסיוני תקין.
Abstract
דוזימטריית קרינה היא קריטית באספקה מדויקת ושחזור של תוכניות קרינה במודלים פרה-קוליניים לרלוונטיות תרגום גבוהה. לפני ביצוע כל ניסויים במבחנה או in vivo, יש להעריך את תפוקת המינון הספציפית עבור הקרינה ועיצובים ניסיוניים בודדים. באמצעות תא יינון, אלקטרומטר, והתקנת מים מוצקים, ניתן לקבוע את תפוקת המינון של שדות רחבים ב- isocenter. באמצעות התקנה דומה עם סרטים רדיוכרומיים במקום תא היוניזציה, ניתן לקבוע גם את שיעורי המינון של שדות קטנים יותר בעומקים שונים. במבחנה clonogenic הישרדות מבחנים של תאים סרטניים בתגובה לטיפול בקרינה הם ניסויים זולים המספקים מידה של רגישות רדיו אינהרנטית של קווי תאים על ידי התאמת נתונים אלה עם המודל ליניארי-ריבועי המסורתי. פרמטרי מודל המוערכים ממסיעים אלה, בשילוב עם עקרונות המינונים היעילים הביולוגיים, מאפשרים לפתח לוחות זמנים משתנים של שברים לטיפול בקרינה המספקים מינונים יעילים מקבילים בניסויים בבעלי חיים נושאי גידולים. זהו גורם חשוב שיש לקחת בחשבון ולתקן בהשוואה בלוחות הזמנים של הקרנות vivo כדי למנוע בלבל פוטנציאלי של תוצאות עקב שונות במינונים יעילים נמסר. יחד, מאמר זה מספק שיטה כללית לאימות מינון של בעלי חיים פרה-קוליניים וקרני ארונות, הערכה במבחנה של רגישות לרדיו ואימות אספקת קרינה באורגניזמים חיים קטנים.
Introduction
סרטן מייצגים באופן קולקטיבי את סיבת המוות השנייה המובילה בארה"ב ובמדינות רבות ברחבי העולם1. הקרנות הן אבן יסוד בטיפול בתת-סוגים רבים של גידולים ומנוהלות לכמחצית מכלל חולי הסרטן2,3. תוצאות המטופל עבור כמעט כל סוגי הסרטן השתפרו עם הזמן כמו ציוד המשמש להעברת מינוני קרינה התקדם בהתמדה וכמה גישות טיפול multimodal יעיל פותחו4,5,6, אבל שיעורי הישנות ותמותה עבור חולים עם סוגים מסוימים של גידולים להישאר גבוה7,8,9. לכן, הקרנות לסרטן ממשיך להיות תחום פעיל של מחקר בסיסי וקליני. מחקרי הקרנות פרה-קליניים רבים משתמשים בקרינה בקנה מידה קטן כדי לספק מנות קרינה למודלים במבחנה או בבעלי חיים של סרטן. עם שפע של ניסויים פוטנציאליים לערוך לחקור פרטי רדיוביולוגיה מכנית או טיפולים חדשניים, ניתן להיתקל במלכודות נפוצות שמובילות למסקנות שגויות, רבייה לקויה ומשאבים מבוזבזים. מלכודות אלה נופלות בתוך שלושה תחומים חשובים: דוזימטריה של הקרנה, אפיון במבחנה של קווי תאים מודל, ו בלוח הזמנים מנוון הקרנה vivo והגדרה. תוצאות מדויקות וניתן לשחזור מניסויים מתקדמים יותר קשה להשיג ללא תשומת לב מוקדמת להיבטים בסיסיים אלה של מחקר הקרנות.
הפרוטוקול המפורט בזאת מתאר אסטרטגיה כללית למניעת בעיות אלה או להפחתתן, והוא נשען על מספר מתודולוגיות שפותחו בעבר ומיועדות לשימוש עצמאי. שיטות נפרדות אלה מוזגו כך שחוקר המעוניין להתחיל או לשפר ניסויי הקרנות פרה-קוליניים יכול להשתמש בכך כמערך ניסיוני חזק. המסגרת המוצעת כוללת מתודולוגיה להזמנת מקריני בעלי חיים בקנה מידה קטן, לקביעת תכונות רדיוביולוגיות בסיסיות של קווי תאים סרטניים לדוגמה, ולעיצוב וניהול נאותים של לוח זמנים למינון ושברים למודלים של גידולים ב- vivo.
Protocol
כל השלבים בפרוטוקול זה הכרוכים בשימוש בחיות מעבדה, כולל טיפול ונהלים, אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת מערב וירג'יניה במורגנטאון, מערב וירג'יניה (מספר פרוטוקול: 1604001894).
1. קביעת תפוקת המינון
- השתמש בפרוטוקול זה, המבוסס על פרוטוקול "שיטת פנטום" של האגודה האמריקאית של פיזיקאים בקבוצת המשימות לרפואה (AAPM TG)61 10 ודומה לפרוטוקול ההזמנה שנקבע על ידי Xstrahl, כדי לקבוע את תפוקת הקרן של הקרנת בעלי החיים הקטנים ביחס לגיאומטריה מסוימת בתנאי ההתקנה הבאים.
- הגדר את הקרינה כדי לספק קרינה ב 220 kVp ו 13 mA, עם שדה פתוח (17 ס"מ על ידי 17 ס"מ) ממוקם isocenter, או 35 ס"מ מהמקור. בנוסף, לסנן את הקרן עם מסנן Cu 0.15 מ"מ עם מוקד רחב. הקרנה סלולרית מסוימת מכילה רק מקור רדיואקטיבי, פרוטוקול זה יכול לשמש רק עבורקרי רנטגן.
- ליישר את רוחות מים מוצקים בסדר הבא: לוח 1 ס"מ, לוח 2 ס"מ עם חריץ תא יינון, לוח 2 ס"מ, לוח 1 ס"מ. ערימת פנטומי המים המוצקים בסדר זה ממקמת את תא היוניזציה בעומק של 2 ס"מ, ומאפשרת 4 ס"מ גם עבור backscatter. ראו איור 1 לתיאור גרפי של הגדרת הדוזימטריה.
הערה: כדי להכיל את הערימה הגדולה והכבדה למדי של מים מוצקים, המחברים ממליצים על רכישת ספה מודפסת בתלת-ממד מותאמת אישית עם תמיכה משתנה כדי להבטיח שערימת הפנטום היא ברמה ובמרחק הנכון מהמקור על פני השטח של החומר, לא רק במרכז.
- השתמש בציוד המדידה (כלומר, תא יינון מכויל של ADCL, electrometer) והסבר על גורמי התיקון בהם נעשה שימוש ניתן למצוא בטבלת החומרים ובטבלה 1 בהתאמה.
הערה: כי ADCL מספק ערכים של Nk בכמה נקודות עבור שכבות ערך למחצה שונים (HVL, מידה של איכות הקרן). הערך של Nk שישמש בפרוטוקול צריך להתבסס על אינטרפולציה של ערכי ה- ADCL עבור HVL הנמדד של היחידה. היצרן מדד את HVL של היחידה שלנו והשתמשנו בזה בקביעת תפוקת קצב המינון שלנו. - הגדר את מחסנית הפנטום והכנס את תא היוניזציה לפנטום כפי שצוין בשלב 1.1.2.
- התאם את ערימת הפנטום כך שהמקור למרחק פני השטח (SSD), או המרחק ממקור הקרינה לפני השטח הראשונים, הוא 33 ס"מ כאשר מפולס כראוי.
הערה: המחברים מציעים ליצור ספה מודפסת בהתאמה אישית בתלת-ממד, גדולה מספיק כדי לתמוך בממדי לוחות המים המוצקים. בנוסף אחד, מנוצל בפרוטוקול זה יש מרכיב מתכוונן עבור פילוס מחסנית פנטום.
- התאם את ערימת הפנטום כך שהמקור למרחק פני השטח (SSD), או המרחק ממקור הקרינה לפני השטח הראשונים, הוא 33 ס"מ כאשר מפולס כראוי.
- קח את הממוצע של שלוש חשיפות רנטגן נפרדות, קריאה של דקה אחת עם מתח הטיה אלקטרומטר מוגדר ב 300 V. התוצאה תיקרא M+.
הערה: הקרנות מבוצעות עם המכשיר מוגדר לספק קרינה ב 220 kVp ו 13 mA. פעולה זו זהה עבור שני השלבים הבאים (שלבים 1.5-1.6). לבטיחות המשתמש, ודאו שהדלתות נשארות סגורות במהלך הטיפולים. - בצע קבוצה נוספת של שלוש חשיפות רנטגן נפרדות, קריאה של דקה אחת עם מתח הטיה אלקטרומטר מוגדר -150 V. התוצאה תיקרא ML.
- בצע קבוצה נוספת של שלוש חשיפות רנטגן נפרדות, 1 דקות קריאות עם מתח הטיית אלקטרומטר מוגדר -300 V. התוצאה תיקרא MH, או גם M-.
- חשב Ppol ו- Pיון באמצעות משוואה 1 ומשוואה 2 בהתאמה כמתואר להלן:
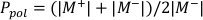 (משוואה 1)
(משוואה 1)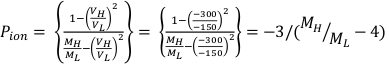 (משוואה 2)
(משוואה 2) - למדוד את הטמפרטורה, בצלזיוס, ואת הלחץ, ב kPa, בתוך הקרינה באמצעות מדחום דיגיטלי מכויל ברומטר. לאחר מכן, חשב PTP כמצוין להלן במשוואה 3.
הערה: חישוב זה מניח כי ה- ADCL השתמש בערכי טמפרטורה ולחץ סטנדרטיים של 22 °C (70 °F) ו- 101.33 kPa בעת ציון ערכם עבור גורם הכיול של כיבה אווירית.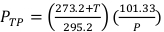 (משוואה 3)
(משוואה 3) - חשב את קריאת התא המתוקנת, M, על-ידי הכפלת קריאת התא הגולמי, MH, על-ידי Pelec, Ppol, Pionו- PTP. משוואה זו ניתן למצוא להלן במשוואה 4.
הערה: חישוב זה מניח כי ה- ADCL ביצע את הכיול שלהם עם מתח ההטיה מוגדר ל- -300V, שהוא נוהג נפוץ למדי.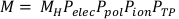 (משוואה 4).
(משוואה 4). - הכפל עוד יותר את קריאת התאים המתוקנתב-N k , [(μen/p)wאוויר]מים,PQ, צ'אםו- Pנדן. Pנדן נדרש רק עבור מדידות המתקבלות במים. לכן, עבור פרוטוקול זה Pנדן הוא רק 1.
הערה: באמצעות התנאים בפרוטוקול זה, שלושת הפריטים האחרונים נותנים ערך של 1.0731. ערך זה תלוי באיכות הקרן, ולכן HVL חייב להיות ידוע כדי לקבוע את זה. הערך של 1.0731 הוא ספציפי ליחידה שלנו והוא ניתן כדוגמה. כדי לקבוע את הערכים של PQ, cham ו- [(μen/p)wair]מים ספציפיים ליחידה שלך, השתמש ב- HVL הנמדד ובאינטרפולציה מטבלה VII וטבלה VIII, ונכון עבור גודל שדה הייחוס לפי איור 3 ואיור 4 מפרוטוקול AAPM TG6110. במקרה שלנו, הכפלת Nk על ידי 1.0731 מספק את המינון למים, Dw, ב Gy לזמן נומינלי של 1 דקות, בהנחה ערך ADCL Nk ניתנת Gy / Coulumbs. - קבע את אפקט הסיום של הקרינה הנמצאת בשימוש. כאשר צילומי הרנטגן נוצרים לראשונה, הפלט עולה לערך המלא שלו על פני זמן מוגבל. באופן דומה, כאשר מקור הרנטגן כבוי, הפלט פוחת לאפס על פני זמן מוגבל.
- תסביר את השעה עבור מעבר זה, או את אפקט הסיום. זה יכול להיעשות על ידי לקיחת הממוצע של שלוש קריאות עם מתח הטיה אלקטרומטר מוגדר ב-300 V, עבור מגוון רחב של הגדרות זמן. תעשה את זה במשך 6, 12, 18, 24, 30 ו-60 שניות.
- התווה את קריאות האלקטרומטר כנגד הזמן ומצא את הקו הישר הטוב ביותר. הזמן הכולל, t, לטיפול של דקה אחת ניתן לחשב לפי משוואה 5:
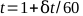 (משוואה 5).
(משוואה 5).
- לחשב את שיעור המינון עבור הקרנה נתון על ידי משוואה 6:
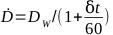 (משוואה 6)
(משוואה 6)
2. יצירת עקומת כיול סרט רדיוכרומי
- לרשימת החומרים הדרושים ראו טבלת חומרים.
- באמצעות הגדרה כמעט זהה כמו הפרוטוקול הקודם, למקם את הסרט בעומק 2 ס"מ בערימת פנטום מים מוצקים. הסדר של רוחות מים מוצקים הוא חסר משמעות כל עוד יש 2 ס"מ של מים מוצקים מעל 4 ס"מ של מים מוצקים מתחת עבור הצטברות אפקטים backscatter.
- באמצעות המינון שנקבע שהוזמן בפרוטוקול 1, קבע את זמני הטיפול במינונים המפורטים בטבלה 2 באמצעות משוואה 7:
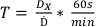 (משוואה 7)
(משוואה 7) - הכינו כמה קטעי סרט כדי להבטיח שכל סרט יהיה באותו גודל ונשאר באותו אוריינטציה מהטיפול ועד רכישת הסריקה. זה יכול להיעשות על ידי הצבת חתך אלכסוני קטן בפינה השמאלית התחתונה. כל סרט מנקודה זו ואילך חייב להיות מאותה קבוצה של סרט.
הערה: הכן 3 משכפלים נפרדים עבור כל נקודת מנה שיש להעריך. - סרוק את החלקים החתוכים באמצעות סורק תמונות צבעוני של 48 סיביות כאשר כל התיקונים כבויים. ודא שכל סרט ממוקם במרכז המדויק של מיטת הסריקה. הערכים המתקבלים הם סריקות טרום חשיפה המשמשות לקביעת הצפיפות האופטית שלא נחשפה11,12. שמור את כל התמונות ב . תבנית קובץ Tiff כדי למנוע דחיסה של נתוני מפתח.
הערה: המחברים ממליצים לסרוק את הסרטים שלוש פעמים ולהשתמש בממוצע המתקבל כערך יחיד לסרט נתון. - התחל את ההקרנה של הסרטים על ידי הצבת פיסת סרט על גבי 4 ס"מ של מים מוצקים והציב את 2 ס"מ הנותרים של מים מוצקים מעל, כמתואר קודם לכן בסעיף זה.
- התאם את ערכת הפנטום כך שהסרט יהיה באותו מרחק מהמקור כמו תא היוניזציה בעת קביעת תפוקת המינון. זוהי הנקודה האיסוצנטרית של ההקרנה.
- תוכנית זמן הטיפול מחושב בשלב 2.3 לעיל עבור מנה אחת שנקבעו.
- טיפול חוזר עבור כל אחד מהמינונים המפורטים בטבלה 2.
- אפשר לסרטים לנוח במשך 24 שעות מוגנים מפני אור.
- לרכוש את סריקות הסרט שלאחר החשיפה באותו אופן כמו לעיל.
- יבא תמונות לתוכנת ניתוח ImageJ ובצע את כל המדידות בערוץ האדום.
- גרור את התמונה ב- . תבנית קובץ Tiff לתוך ImageJ.
- לחץ על התפריט הנפתח תמונה. בחרו 'צבע' מהתפריט הנפתח 'תמונה'. בחרו באפשרות 'פצל ערוצים מהצבע'.
- בעזרת ערוץ התמונה האדום בלבד, ציירו אזור מעניין בעזרת הכלי מלבן. הקש Ctrl+M. תעתיק ערך ממוצע מחלון התוצאות.
- חזור על שלבים 2.12.1-2.12.4 עבור כל הסרטים הסרוקים.
- השג את ערך הפיקסל במיקום מרכזי של 1 ס"מ על 1 ס"מ מרובע הן לסרטים שלא נחשפו והן לסרטים החשופים. ערכים אלה יסומלו כ- PVU(D) ו- PV(D) בהתאמה, וניתן להשתמש בהם כדי לחשב את הצפיפות האופטית נטו כמתואר במשוואה 8.
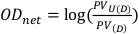 (משוואה 8) 13 ,13
(משוואה 8) 13 ,13
- חזור על שלב 2.13 עבור כל זוג תמונות סרט, הן לפני החשיפה והן לאחר החשיפה.
- התווה גרף של המינון לעומת הצפיפות האופטית נטו והתאים את העקומה לפולינום מעוקב בתבנית של y = גרזן3 + bx2 + cx + d. דוגמה לכך ניתן למצוא באיור 2B.
3. קביעת ערך α/β עבור קווי תאים סרטניים ספציפיים באמצעות מבחנים קלונוגניים
הערה: הפרוטוקול הבא הוא גרסה שונה של השיטות המתוארות על ידי Franken et al14 וניתן לראותו באיור 3.
- לגדל תאים ~ 80% מפגש. הימנע משימוש במקורות תאים מבלבלים מדי לניסוי זה, שכן יש צורך שהתאים נמצאים בשלב היומן של צמיחת התאים. לתוצאות הבדיקה הקלונוגנית הייצוגית המוצגת באיור 3C, תאי סרטן השד MDA-MB-231 של המוח-טרופיים היו מתורבתים במדיום הנשר המותאם של דולבקו (DMEM) בתוספת 10% סרום שור עוברי ופניצילין/סטרפטומיצין והודגרו ב-37 מעלות צלזיוס ו-5% פחמן דו-חמצני באינקובטור לח.
- זרעו את התאים בצפיפות הרצויה לבדיקת המושבה. דילול מדויק במהלך הזריעה חיוני לקביעת יעילות הציפוי של ההסתעפות. הקפד ללוחות עותקים משוכפלים מרובים.
- המשך בשלב זה אם הטיפול בקרינה יקדים את ציפוי התאים (איור 3A). לחלופין, המשך לשלב 3.4 אם ציפוי התא יקדים את הטיפול בקרינה.
- בצעו את הטיפול הרצוי בקרינה על צלושי תרבות. כל טיפול נוסף (כלומר טיפולים תרופתיים) יכול להתבצע בכל נקודה לפני או אחרי זה. לתוצאות הייצוגיות באיור 3C, הטיפול בקרינה התרחש לאחר ציפוי תאים, המפורט בשלב 3.4.
- חלץ את התאים באמצעות שיטת trypsinization מועדפת וצור השעיית תא בודד. הסר מדיית תרבות והוסף אנזים רקומביננטי (למשל, טריפל אקספרס) כדי לנתק תאים מהבקבוקון. דגירה תאים עם האנזים במשך כ 3 דקות עד התאים היו מנותקים כפי שזוהה באמצעות מיקרוסקופ אור. לנטרל את האנזים באמצעות נפח שווה של מדיה תרבות התא. תאי צנטריפוגה ב 300 x g במשך 10 דקות ו resuspend לריכוז הרצוי במדיום התרבות.
- לוח התאים בצפיפויות הרצויות בשכפולים מרובים.
- החלף במדיה טרייה לאחר 24 שעות הראשונות.
- המשך להחליף מדיה כל 2-3 ימים.
- המשך culturing תאים עד מושבות שליטה יעלה על 50 תאים למושבה, ~ 9-14 ימים. מושבות בקרה הן אותן קבוצות טיפול שאינן מקבלות מנות קרינה. לניסויים גם באמצעות טיפולים תרופתיים, קבוצת ביקורת נוספת עם מנון תרופות אך לא יהיה צורך גם בטיפול בהקרנות.
- המשך בשלב זה בעת זריעת תאים לפני טיפול בקרינה (איור 3B).
- חלץ תאים באמצעות שיטת טריפסיניזציה מועדפת וצור השעיית תא בודד.
- מקם תאים בצפיפויות הרצויות בשכפולים מרובים.
- אפשר לתאים לדבוק בצלחת בן לילה.
- בצע את מינון הקרינה הרצוי. טיפולים נוספים, כגון מינון תרופות, עשויים להתבצע בכל נקודה לפני או אחרי שלב זה, כל עוד התאים מחוברים ללוחות הטיפול שלהם. לתוצאות הייצוגיות באיור 3C, 1250 תאי מד"א-MB-231 טרופיים היו מצופים לפני הטיפול (שלב 3.4). לאחר מכן, תאים טופלו עם 15 nM וקסורוביצ'ין 3 שעות לפני הקרנה עם 3 Gy של צילומי רנטגן.
- החלף את המדיה לאחר 24 שעות הראשונות.
- החלף מדיה כל 2-3 ימים.
- תרבות התאים שטופלו עד מושבות קבוצת הביקורת יעלה על 50 תאים, ~ 9-14 ימים. מושבות בקרה הן אותן קבוצות טיפול שאינן מקבלות מנות קרינה. לניסויים גם באמצעות טיפולים תרופתיים, קבוצת ביקורת נוספת עם מנון תרופות אך לא יהיה צורך גם בטיפול בהקרנות.
- הסר את מדיית התרבות מבארות או מכלים, ושטף עם PBS.
- לתקן תאים במשך 15 דקות בתמיסה 1:7 (v:v) של חומצה אצטית קרחונית ומתנול.
- הסר את פתרון הקיבעון.
- לאחר קיבוע, תאי כתם במשך 30 דקות, או 2 שעות אם הזמן זמין, בטמפרטורת החדר עם פתרון 2.5-5.0 מ"ג / מ"ל של סגול גביש בתמיסת 4:1 (v:v) של מים מזוקקים ומתנול.
- הסר את תמיסת הכתמים ושטוף תאים באמבט מים גדול בטמפרטורת החדר.
הערה: אין לשטוף תחת מים זורמים. - לספור את מספר המושבות וכתוצאה מכך בכל קבוצת טיפול ולחשב את שבר ההישרדות של כל צלחת.
- התווה את שבר ההישרדות כנגד המינון המתאים שנמסר, והתאים את העקומה להתאמה אקספוננציאלית.
- כדי להעריך את ערך α/β, השתמש בהתאמה מעריכית של ההתוויה לעיל כדי להעריך את הערכים עבור כל אחד מהפרמטרים הניתנים להתאמה במשוואה הליניארית-ריבועית הנמצאת להלן:
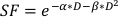 (משוואה 9)
(משוואה 9)
הערה: הקרנה של תאים יכולה להיעשות בדרך כלל ב isocenter ללא כל collimation בתנאי גודל השדה הוא גדול מספיק כדי להכיל צלחות היטב או צלחות פטרי. מלכודות פוטנציאליות בפרוטוקול זה עשויות לכלול תשואות כגון ללא היווצרות מושבה, נדידת תאים משמעותית עם צמיחת תאים ברורה אך ללא מושבות אמיתיות, או זיהום עקב טיפול בתא הקרנה לא סטרילי.
4. קביעת תפוקת המינון הספציפית עבור עיצובים ניסיוניים משתנים
- החלט על גודל השדה הרצוי והמרחק מהמקור.
הערה: Collimation ישנה את שיעור המינון לא משנה את הגודל או המרחק של קולימטור ממקור הרנטגן. - באמצעות רוחות מים מוצקים כדי לספק הצטברות ו backscatter, למקם חתיכת סרט בכיוון הנכון המתאר בצורה הטובה ביותר את העיצוב הניסיוני.
הערה: עבור כל התקנה ניסיונית מים מוצקים לא יכול לספק את הייצוג המדויק ביותר של עיצוב נתון. במקום זאת אנו ממליצים להשתמש בכלי הניסוי בפועל (כלומר, צלחת פטרי, צלחות היטב, רוחות חיות קטנות וכו '). - סרטי הקרנה במשך 1 (N = 3) ו 2 (N = 3) דקות.
- אפשר לסרטים לנוח במשך 24 שעות מוגנים מפני אור.
- קבע את הצפיפות האופטית נטו של כל סרט לאחר ההליכים מסעיף 2. השתמש בעקומת הכיול של הסרט כדי לקבוע את המינון מהצפיפות האופטית נטו.
- לקבוע את המינון ב 1 דקה, D1, כקצב מינון הפלט, Ḋ, עבור התקנה ניסיונית זו מוגדרת על ידי משוואה 10 כדלקמן:
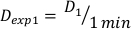 (משוואה 10)
(משוואה 10) - באופן דומה, caluclate את המינון ב 2 דקות על ידי משוואה 11 כדלקמן:
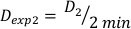 (משוואה 11)
(משוואה 11) - בשל ההשפעה הסופית, שיעור המינון עבור החישובים לעיל עשוי להיות שונה במקצת. מסיבה זו כדי לחשב Dexp עבור העיצוב הניסיוני הרצוי, להשתמש בממוצע שלexp D בודדים כפי שצוין במשוואה 12:
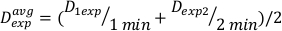 (משוואה 12)
(משוואה 12) - באמצעות ממוצע זה, הגדר את הזמן לטיפול במינון הרצוי עבור התקנה מסוימת זו במשוואה 13:
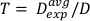 (משוואה 13)
(משוואה 13)
5. טיפול בעכברים הנושאים גידולים במיקום אנטומי של עניין
- הרדמה עכבר עם טכניקות הרדמה בטוחות ואנושיות שאושרו על ידי IACUC של המוסד.
- מניחים את החיה מורדמת באיפוק כפי שצוין בתכנון הניסיוני הרצוי.
- שלב זה הוא אופציונלי, אם לא זמין להמשיך לשלב 5.6. השג רדיוגרמה, באמצעות מצלמת פורטל מובנית, של העכבר ללא איסוף באמצעות מסנן אלומיניום.
- השג רדיוגרמה שנייה עם איסוף במקום.
- שכבת-על של יחידות רדיו ב-ImageJ כדי להדגים מיקום קרן.
- באמצעות הערך שנקבע מראש α/β, לקבוע את ערכת המינון המספקת את הגישה הסבירה ביותר כדי לענות על שאלת מחקר (כלומר, אם רוצים מודל ההשפעות של מנה של 30Gy נמסר 10 שברים של 3 Gy, אבל רק רוצה לתת ארבעה שברים). באמצעות משוואה 14, עם ערך α/β המשוער של 10 (ערך זה ניתן לקבוע עבור שורות תאים סרטניים בודדים בפרוטוקול 3) ומיטה דומה לזו של 30 Gy/10 F, לטפל עם 24 Gy ב 4 שברים של 6 Gy.
- לטפל בבעלי חיים לזמן שנקבע ניתנה עבור המינון הרצוי.
6. אישור היסטולוגי של תצהיר מינון ב vivo
- בעקבות פרוטוקול 5, לאסוף רקמה של עניין בתוך שעה אחת של טיפול15,16. לאחר קצירת רקמות, המשך עם פרוטוקול אימונוהיסטוכימיה מועדף. דוגמה לכך ניתנת להלן.
- לחלחל בעל חיים עם קר כקרח 4% paraformaldehyde (PFA).
- לאחר תיקון ב PFA ב 4 °C (69 °F).
- לאחר הקיבעון, לתקן רקמה ברצף ב 10%, 20%, ו 30% סוכרוז במשך 24 שעות כל אחד בטמפרטורת החדר.
- להטביע רקמה בג'לטין ולתקן ברצף 4% PFA ושוב ב 10-30% סוכרוז במשך 24 שעות כל אחד בטמפרטורת החדר.
- חתוך בלוק ומניחים ב -80 מעלות צלזיוס במשך 30 דקות.
- פורסים רקמה לקטעים של 20-30 מיקרומטר.
- Immunostain שקופיות כמו קטעים צפים חינם בשש צלחת היטב17,18.
- לשטוף שלוש פעמים ולחלחל במשך 30 דקות על שייקר עם 1.83% ליסטין ב 1% טריטון, ו 4% חום מומת סרום עזים.
- דגירה קטעים עם נוגדן anti-γH2AX במשך 24 שעות, ואחריו דגירה 2 שעות עם הנוגדן המשני הרצוי.
- כיסוי שקופיות עם כיסויי זכוכית באמצעות מדיית הרכבה מועדפת.
- תמונה על מיקרוסקופ פלואורסצנטי.
תוצאות
בעקבות פרוטוקול 1 יספק שיעור מינון ב Gy /min, אשר ספציפי הקרנה בשימוש. עם זאת, ללא קשר לסוג ההקרנה, עם קצב מינון ידוע ניתן ליצור עקומת כיול באמצעות פרוטוקול 2 המניבה סרטים דומים ועקומת כיול דומה לזו באיור 2A-B. מבחנים מוצלחים מפרוטוקול 3 יניבו מושבות שונות ומטומאות היטב של תאים שמכתימים סגול הומוגני. ניתן להשוות את הערכת α/β לערכי ספרות או לקבוצות טיפול אחרות כדי לפרש את רגישות הרדיו של קו התאים הנתון. שימוש בעקומת הכיול שפותחה בעקבות פרוטוקול 2 ומוצג באיור 2B, פרוטוקול 4 יניב שתי דגימות פילם הדומות לאיור 2A שניתן להשתמש בהן להערכת זמני ההקרנה הניסיוניים הנדרשים. אם מצלמת הדמיית פורטל מובנית זמינה עבור ההקרנה הנמצאת בשימוש, ניתן להשיג רדיוגרמות של בעלי חיים קטנים עם וללא איסוף. כיסוי תמונות אלה ידגים את המיקום המדויק של קרן הקרינה המקולפת ביחס לחיה הקטנה המטופלת כמתואר באיור 4A. מינון מוצלח תצהיר בפרוטוקול 5 ניתן לאשר בעקבות פרוטוקול 6. אינדיקציה אחת לכך שקרינה מופקדת במערכות in vivo או in vitro היא באמצעות זיהוי של שברי דנ"א כפולים. איור 4B, אותו עכבר המטופל אך ורק בחצי הכדור הימני באיור 4A, מדגים כתמי γH2AX חיוביים רק בחצי הכדור המטופל. באיור זה, הגרעינים מוכתמים ב- DAPI כדי להראות שני דברים; 1) כל המוח שעליו הוחל הנוגדן נגד γH2AX במהלך הניתוח ההיסטולוגי, ו -2) האונה הלא מטופלת של המוח נותרה ללא מוכתם.
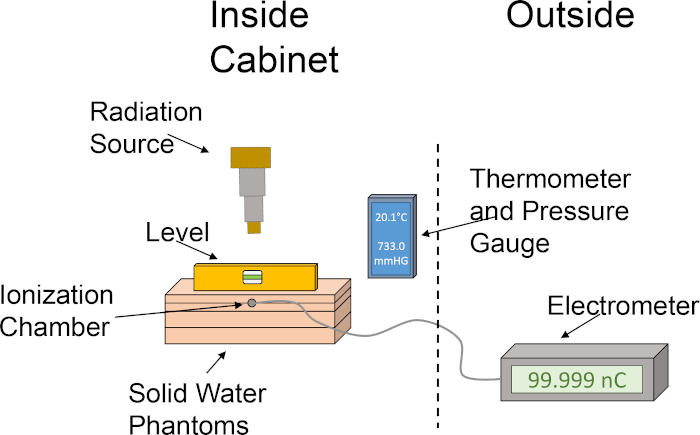
איור 1: הגדרה גסה של תא יינון ופנטום מים שהוקמו לקביעת תפוקת המינון. הפיקטוגרמה ממחישה התקנה בסיסית תוך שימוש ברכיבים השונים הנדרשים לדוסימטריה באמצעות תא יינון ופאנטומים של מים מוצקים בתוך ארון ההקרנה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: יצירת עקומת כיול באמצעות סרט רדיוכרומי. (א)שינוי צבע מייצג של סרט רדיוכרומי עם מינון הולך וגדל. למעלה משמאל (0 cGy); בפינה הימנית התחתונה (2000 cGy). (B) עקומת כיול סרט רדיוכרומי פוטנציאלית המשווה צפיפות אופטית נטו ומינון. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
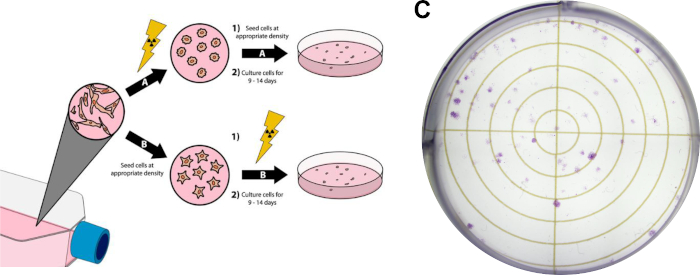
איור 3: מבחנים קלונוגניים של תאים סרטניים. טיפול בקרינה בתאים יכול להיעשות לפני הציפוי בשש צלחות באר / צלחות פטרי (A), או אחרי (B). בפאנל(C),מוצגת תמונה מייצגת של מבחני קלונוגניים מוצלחים עם תאי סרטן השד MDA-MB-231 לאחר ביצוע פרוטוקול סעיף 3. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
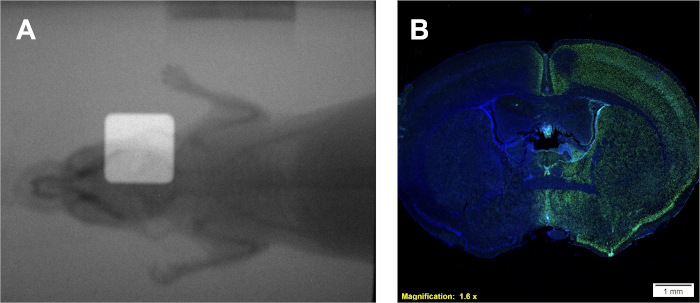
איור 4: שימוש ברדיוגרמים כפולי שכבת-על למיקום (אם זמין) וכתם אימונוהיסטוכימי חיובי של γH2AX לאישור תצהיר מינון. (A)נציג שכבות רדיוגרמות המתארות מיקום של קרן קרינה. (B) תוצאות מייצגות המציינות תצהיר מינון לחצי הכדור הימני כפי שהוכח על ידי γH2AX אינטנסיביות מוגברת. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| פקטור תיקון | הסבר | |
| Nκ (100 ק | גורם כיול קרמה אווירית | |
| [(μen/ρ)Wאוויר] מים ומים | הקצבה של מקדמי ספיגת אנרגיה המונית של מים לאוויר; כ- 1.05 | |
| Pq, צ'אם | תיקון חשבונאות עבור גזע קאמרי המשפיעים על תנודות פוטון perterbation לפי תא; כ- 1.022 | |
| Pנדן | תיקון חשבונאות עבור נדן הגנה על תא יינון; ערך של 1, כמו תא הוא עמיד למים | |
| פפול | פקטור תיקון חשבונאות עבור קוטביות; נקבע בפרוטוקול 1 | |
| Pיון | פקטור תיקון חשבונאות עבור רקומבינציה יון; נקבע בפרוטוקול 1 | |
| PTp | תיקון גורם acocunting עבור temerpature ולחץ ביום הניסוי; נקבע בפרוטוקול 1 | |
טבלה 1: גורמי תיקון הדרושים לקביעת שיעור המינון בפרוטוקול 1.
| מנה | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * הכרחי רק עבור מינונים העולים על 10 עבור ניסויים בודדים. | |
טבלה 2: מינונים לשימוש בדור של עקומת כיול סרט רדיוכרומי.
Discussion
הפרוטוקול לעיל מתאר גישה ידידותית למשתמש עבור דוזימטריה קרינה, קביעת ערכי α /β בקווי תאים סרטניים, ודוגמה קצרה של גישה להקרין במודל פרה-קוליני של גרורות במוח סרטן השד. שיטות אלה ניתן להשתמש כדי ללמוד כל מודל של סרטן והם לא רק מוגבל גרורות במוח של סרטן השד. בחלק זה נדון במורכבות הרלוונטית שבבסיס ניסויי הקרנות פרה-קליניים.
Dosimetry כרוך בשני חלקים: 1) לכייל את הפלט עם תא חקלאי, כך קצב המינון של יחידת הרנטגן הוקמה, ו 2) להכין מערכת מדידה דוזימטריה מעשית באמצעות סרט רדיוכרומי. לגבי כיול תפוקה, TG-61 מספק שיטה לשחזור במים. הפרוטוקול כאן משתמש Gammex RMI 457 מים מוצקים, כפי שהומלץ על ידי XStrahl, היצרן של הקרינה. למרות דוזימטריה יחסית (פרופילים או עקומות מינון עומק מנורמל למינון מרבי) ניתוח עם מים מוצקים, מסכים טוב יותר מאשר 1% עם זה של מים, יש הבדל של כ 3 עד 4% במינון מוחלט בשל מקדם ספיגת אנרגיה המונית גבוהה יותר עבור מים מוצקים לעומת מים. עם זאת, מכיוון שכל ההתקנות של מערכת XStrahl משתמשות בפרוטוקול המים המוצקים לכיול פלט, לא תיקנו עבור הבדלים אלה. ידיעת הפלט מאפשרת חישוב זמן החשיפה הנדרש כדי לספק מנה רצויה. הצבת סרט באותה התקנה כמו תא האיכרים מאפשרת לנו לספק מנות ידועות לסרט. סריקת הסרט מספקת צפיפויות אופטיות. לאחר מכן ניתן לגרף את המינון לסרט כנגד הצפיפות האופטית נטו המתאימה (הבדל בצפיפות האופטית לאחר ולפני החשיפה). פעולה זו מפיקה עקומת כיול סרט צילום. כאשר אנו משנים הגדרות ניסיוניות, שיעור המינון במצב זה יכול להשתנות, שכן שיעור המינון תלוי בגודל השדה, בעומק והחומר מוקרן. חשיפת הסרט עם ההתקנה הניסיונית מספקת לנו צפיפות אופטית נטו, ובאמצעות עקומת כיול הסרט, אנו יכולים לקבוע את המינון המתאים. חלוקת מינון זה על ידי הזמן הסרט היה מוקרן, אנחנו מקבלים את שיעור המינון. לאחר מכן ניתן להשתמש בקצב מינון זה כדי לחשב את זמן החשיפה כדי לספק מנה רצויה עבור ההתקנה הניסיונית הנתונה. הפרוטוקול המתואר לעיל מטפל במספר ניואנסים הקשורים לדוסימטריית סרטים. לדוגמה, לאחר החשיפה, הסרט דורש כ 24 שעות עבור התגובות הכימיות בשכבה הפעילה של הסרט להיות כמעט שלם. אי-המתנה לפרק זמן זה תוביל לצפיפות אופטית נמוכה יותר.
עבור כל מחקר יש דוזימטריה לשחזור חשוב לדעת ולהבין כמה מן המרכיבים העיקריים של הקרנה נתון. בפרט, חיוני לדעת ולפרט לחוקרים אחרים את התואם והמודל של הקרינה המשמשת, סוג המקור (רנטגן, רדיואקטיבי, וכו '), אנרגיה, שכבה חצי ערך, גודל השדה, מקור לפני השטח ומקור למרחקים isocenter, גודל החומר מוקרן, הנחתה לפני backscatter לאחר החומר המוקרן, שיעור מינון ספציפי לניסוי, סכימת שבר, ציוד דוזימטריה מדויק מנוצל, ואת פרוטוקול dosimetry בשימוש. כל נקודות המידע הללו הן מה שמתארים בצורה מלוכדת את איכות הקרן של הקרנה נתונה לפני מתן מנה לכל בעל חיים או תא19. נקודה רלוונטית נוספת של מידע מפרוטוקול זה ואחרים היא כי שיעור המינון שהושג בפרוטוקול 1 הוא פשוט הפלט של הקרינה בשימוש. עבור כל ניסוי נתון חשוב להגדיר את קצב המינון עבור התקנה מסוימת זו (פרוטוקול 4) בהשוואה לעקומת כיול סרט רדיוכרומי שנוצר (פרוטוקול 2).
ניסויים במבחנה מספק פרטים חשובים על ההתנהגות הרדיוביולוגית של קווי תאים סרטנים. במבחנה clonogenic תא הישרדות מבחנים במדויק להעריך ולכמת את הרגישות הרדיו הטבועה של קו התא20, סיוע בתכנון לוחות זמנים שבר בניסויים הבאים הסלולר או בעלי חיים קטנים21. באופן ספציפי, אלה מבחנים ערכים משוערים עבור הפרמטרים α β המשמשים במודל ליניארי-ריבועי לחזות מוות של תאים בתגובה הקרנות על פי המשוואה:
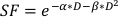 (משוואה 9)
(משוואה 9)
כאשר SF הוא החלק ששרד של תאים קיימא קלונוגנית, D הוא מינון קרינה ב Gy, α β הם פרמטרים מצוידים22. היחס α/β מספק מידה אינהרנטית של רגישות לרדיו הסלולר, עם ערכים גבוהים יותר בקורלציה עם רגישות מוגברת של קו תא22. כי מערכת יחסים תפקודית זו אינה ליניארית ביחס למינון, ההשפעות הביולוגיות של ערכת שבר הקרנות אינן קשורות רק למינון הכולל שנמסר, אלא גם למספר וגודל השברים23. המינון היעיל הביולוגי (BED) הוא מדד של המינון הביולוגי האמיתי המועבר לרקמה ומאפשר השוואה ישירה של תוכניות שברים שונים24,25. משוואת BED דורשת הערכה של α/β בלבד ומוצגת להלן:
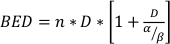 (משוואה 14)
(משוואה 14)
כאשר n הוא מספר שברים של מינון D. מבחני הישרדות תא קלונוגני להעריך α/β להקל על השוואה ישירה של תוכניות שבר הקרנות באמצעות משוואת BED. ניתן להסיק מסקנות שגויות לגבי תגובת רקמה או איבר להקרנות (או שילובים של הקרנות עם אופנים אחרים) אם המיטה בקבוצות הטיפול אינה שוויונית בתוך או בין ניסויים. לדוגמה, 2 שברים של 10 Gy לעומת 4 שברים של 5 Gy אינם מניבים את אותה BED, ולכן תוכניות מנון אלה לא ניתן להשוות ישירות במונחים של תגובה ביולוגית. משוואת BED, אמנם לא מושלמת בשל מגבלות מובנות במודל הליניארי-ריבועי, אך מעריכה באופן אמין השפעות הוגנות עבור מגוון רחב של תנאי טיפול ניסיוניים24,25.
מבחני הישרדות תאים קלונוגניים בבירור לשחק תפקיד חשוב בחקר השפעות הקרנות במודלים סרטניים, אבל ניסויים במבחנה מציע מספר אפשרויות נוספות כדי להמשיך לחקור פרטים מכניים של רדיוביולוגיה של תאים סרטניים. שינויים פשוטים של מבחני ההישרדות של התא הקלונוגני שימשו כדי לקבוע את דרכי הפעולה עבור כמה כימותרפיה רגישה לרדיו, כגון paclitaxel או etoposide26,27. אפשרויות ניסיוניות נוספות במבחנה כוללות מחקרים אימונוציטוכימיים לבחינת מסלולי תיקון תאיים ספציפיים, כגון מוקדי γ-H2AX ו/או 53BP1 לתיקון שבירת דנ"א דו-גדילי28. ניסויים אלה עשויים להיות מעניינים במיוחד בעת השוואת הקרנות כאמצעי יחיד עם טיפולים משולבים, במיוחד כאשר בודקים פרטים מכניים עבור קו תא נתון. אפשרויות ניסיוניות אחרות כוללות מדידות ציטוקינים כדי לבחון את התפקיד המולד של התגובה הדלקתית של התא להקרנה או ניתוחים של אופן המוות התאי (כלומר, אפופטוזיס, נמק, קטסטרופה מיטוטית וכו ') בתנאים טיפוליים שונים29,30,31. סוג זה של ניסויים יכול להשלים או להחליף ניסויים בבעלי חיים ולספק הבנה מלאה יותר של רדיוביולוגיה של קו תאים סרטני. ללא קשר לבחירה של ניסויים נוספים לבצע, בדיקת הישרדות תא קלונוגני סטנדרטי כמתואר בפרוטוקול 3 היא הערכה רדיוביולוגית ראשונית חשובה של קו תאים.
מבחנים קלונוגניים ודוזימטריית קרינה מספקים לחוקר אמצעים לתכנן במדויק ניסויים הדומים יותר ישירות לתרחישים קליניים. עם תוספת של מודלים מכרסמים קטנים סרטן פרה-קוליני, ניתן ללמוד את התגובה לקרינה לבד או בהקשר של תוכנית טיפול vivo. לפני השימוש בבעלי חיים, חשוב לקבוע את תפוקת המינון היחסית של ההתקנה הספציפית אם היא שונה מהמערך המשמש לקביעת תפוקת המינון32,33. כשמדובר בקביעת שיעור המינון עבור גדלי שדה של <10 מ"מ, השימוש בתא יינון הופך פחות מדויק בשל יישור בתוך שדה קטן ונפח חלקי ממוצע אפקטים33. השימוש בסרט רדיוכרומי כדי לקבוע פלט בשילוב עם ניסויים אימונוהיסטוכימיים in vivo שימש לקביעת תצהיר פלט ומינון בעבר16,34,35,36,37,38.
Disclosures
המחברים אין גילויים לעשות.
Acknowledgements
המחברים רוצים להודות מיקרוסקופ מודלים בעלי חיים הדמיה Facilites ב WVU על השימוש בציוד שלהם נתמך על ידי מספר מענק P20GM103434. בנוסף, עבודה זו נתמכה על ידי מספר מענק P20GM121322 מן Institue הלאומי של מדעי הרפואה הכללית, על ידי מספר מענק המכון הלאומי לסרטן F99CA25376801, ואת קרן הקדש יו"ר מיילן.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5 (2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001 (2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104 (2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. . Radiobiology for the radiologist. Eighth edition. , (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96 (2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251 (2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204 (2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134 (2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved