A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימור בהקפאה של ביציות שנלקחו מרקמת השחלה כדי לייעל את שימור הפוריות אצל נערות ונשים לפני גיל ההתבגרות
In This Article
Summary
אנו מציעים פרוטוקול לשימור פוריות אצל נערות לפני גיל ההתבגרות ונשים בסיכון לאי ספיקת שחלות מוקדמת. הוא משלב הקפאת רקמת שחלה ושימור בהקפאה של ביציות שנלקחו מרקמת השחלה. אסטרטגיה זו משפרת את הבטיחות ומייעלת את פוטנציאל הרבייה של שימור הפוריות, וממקסמת את הסיכוי ללידה.
Abstract
שימור בהקפאה של רקמת שחלה אנושית (OTC) נמצא בשימוש הולך וגובר ברחבי העולם לשימור פוריות האישה אצל נערות לפני גיל ההתבגרות ונשים בסיכון לאי ספיקת שחלות מוקדמת (POI) בהקשר של טיפולים גונדוטוקסיים דחופים או ניתוחי שחלות. שימור פוריות הוא מאתגר מכיוון שאין קונצנזוס לגבי ניהול מטופלים, אסטרטגיות פוריות לשימור, או אפילו פרוטוקולי מעבדה טכניים, מה שמרמז על כך שכל הליך חייב להיות מותאם למאפייני פרופיל המטופל וליחס הסיכון-תועלת שלו. במהלך OTC, ניתן לשאוב ביציות בוגרות/לא בשלות ישירות מזקיקים אנטרליים גדולים/קטנים בתוך דגימות רקמת שחלה ו/או להשתחרר למצע תרבית מזקיקי גידול במהלך דיסקציה של רקמת השחלה בנערות ונשים לפני גיל ההתבגרות. בכתב יד זה, אנו מציגים פרוטוקול המשלב הקפאת רקמת שחלה עם שימור בהקפאה של ביציות בוגרות/לא בשלות שנלקחו מדגימות רקמת שחלה, ומשפר את פוטנציאל הרבייה של שימור פוריות. יתוארו איסוף, טיפול ואחסון מתאימים של רקמת שחלה וביציות לפני, במהלך ואחרי השימור בהקפאה. כמו כן, יידונו השימוש והבטיחות הבאים של דגימות רקמת שחלה וביציות שמורות/מופשרות, כמו גם התזמון האופטימלי להבשלה במבחנה של ביציות לא בשלות. אנו ממליצים על שימוש שיטתי בפרוטוקול זה בשימור פוריות של נערות ונשים לפני גיל ההתבגרות מכיוון שהוא מגדיל את כל פוטנציאל הרבייה של שימור פוריות (כלומר, ויטריפיקציה של ביציות בנוסף ל-OTC) וגם משפר את הבטיחות והשימוש בשימור פוריות (כלומר, הפשרת ביציות לעומת שתל שחלות), וממקסם את הסיכוי ללידה מוצלחת עבור המטופלות בסיכון ל-POI.
Introduction
תחום שימור הפוריות גדל בשני העשורים האחרונים עקב המספר ההולך וגדל של מטופלות בסיכון לאי ספיקת שחלות מוקדמת (POI)1,2,3. האפשרויות הרפואיות הזמינות כיום לשימור פוריות הן הקפאת רקמת שחלה (OTC)4, הקפאת ביציות/עוברים לאחר גירוי שחלתי5, מתן אנלוגים של GnRH6 או טרנספוזיציה שחלתית7. OTC הוא התקדמות משמעותית לשימור פוריות, במיוחד אצל נערות לפני גיל ההתבגרות, שם זו האפשרות היחידה הזמינה כיום לשימור פוריות וגם אצל נשים שאינן יכולות לעכב את תחילת הטיפול הגונדוטוקסי שלהן 2,4.
OTC מאפשר שימור של מספר גבוה של זקיקים קדמוניים, הנמצאים ב -1 מ"מ החיצוני של קליפת השחלה2. רקמת שחלה קפואה/מופשרת יכולה לשמש לאחר מכן על ידי השתלה (אורתוטופית או הטרוטופית, אוטולוגית או תורמת) או תרבית במבחנה להשגת ביציות בוגרות2. השתלת דגימות רקמת שחלה לפני גיל ההתבגרות שהוקפאו והופשרו הוכחה כגורמת להתבגרות מינית 8,9. אצל נשים, תוצאות הרבייה לאחר השתלה עצמית אורתוטופית של קליפת השחלה הקפואה ומופשרת מרגיעות, כאשר שיעורי לידת חי מגיעים ל-57.5% לאחר התעברות טבעית10 ובין 30% ל-70% לאחר התעברות בטכניקות רבייה מסייעות (ART)11. מאז לידת החי הראשונה מהשתלה אורתוטופית של רקמת שחלה אנושית קפואה/מופשרת בשנת 200412, טכניקה זו אפשרה ללדת לפחות 130 ילדים ברחבי העולם2. התפקודים ההורמונליים והרבייה של רקמת השתל נמשכים בדרך כלל מספר שנים 11,13,14, מה שמאשר את הפונקציונליות ארוכת הטווח שלה.
עם זאת, השתלה אוטומטית של דגימות רקמת שחלה טומנת בחובה סיכון תיאורטי להחדרה מחדש של תאים ממאירים ברי קיימא בחלק מהחולות 15,16,17,18, במיוחד במחלימות לוקמיה 19. עד כה, לא דווח על מקרה של העברת סרטן באמצעות השתלה של קליפת שחלה קפואה/מופשרת בקרב מחלימות סרטן בריאות11, מה שמצביע על כך שהאופי האווסקולרי הסיבי של קליפת השחלה יכול לייצג מיקרו-סביבה לא מסבירת פנים להפצת תאים ממאירים. עם זאת, השתלת רקמת שחלה עדיין מייצגת טכניקה ניסיונית ומאתגרת, מה שמצביע על כך שיש לשקול כיום את השימוש בביציות כגישה קלה ובטוחה יותר מאשר השתלת רקמת שחלה להחזרת הפוריות. מעניין לציין כי ניתן היה להוציא בקלות ביציות לא בשלות מרקמת השחלה במהלך OTC הן בנערות לפני גיל ההתבגרות והן בנשיםבגיל 16, מה שמצביע על כך שהוא יכול להוות מקור אמין למקסום פוטנציאל שיקום הפוריות בנוסף להקפאת רקמת קליפת השחלה. ניתן לשאוב ביציות אלה באופן ידני ex vivo במעבדת ART מזקיקים אנטרליים גלויים או להיות מבודדים ממדיה משומשת לאחר דיסקציה של רקמת השחלה. לאחר מכן ניתן היה לזגג ביציות שאוחזרו ישירות בשלב לא בוגר או להבשיל לפני שלב הזיגוג באמצעות התבגרות חוץ גופית (IVM)20,21.
בכתב יד זה, אנו מציעים פרוטוקול המשלב שימור בהקפאה של רקמת השחלה עם בידוד ושימור בהקפאה של ביציות בוגרות (בשלב MII) ו/או לא בשלות (כלומר, ביציות בשלב שלפוחית נבט (GV) וביציות בשלב Metaphase I (MI)) שנלקחו מרקמת השחלה. פרוטוקול זה מתאר את כל הצעדים הספציפיים הנדרשים כדי למקסם את פוטנציאל שימור הפוריות הן אצל נערות לפני גיל ההתבגרות והן אצל נשים.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הנשים (מעל גיל 18) כמו גם כל הנערות הקטינות והוריהן חתמו על טופס הסכמה מדעת לשמירה על פוריות המטופלת בסיכון ל-POI. פרוטוקול זה נחשב להליך ART שגרתי במרכז שלנו לשימור פוריות. זה עוקב אחר ההנחיות של ועדת האתיקה של המחקר האנושי של המוסדות שלנו.
1. בקרת איכות
- כלול גיל נקבה ≤ 38 שנים, המכיל ריכוז הורמון אנטי-מולרי במחזור הדם >1 ננוגרם/מ"ל ומראה נוכחות של סיכון מוגבר ל-POI עקב טיפול גונדוטוקסי. אל תכלול נשים הזכאיות לזיגוג ביציות להליך שימור פוריות, נשים עם מצב המונע מתן הסכמה מדעת מלאה או נשים עם סיכון גבוה לסיבוכים מהרדמה או ניתוח.
- אשר את קיומה של הסכמת מטופל חתומה לפני התחלת הליך זה.
- זהה שני מיקומים פנויים בתוך שני מיכלי אחסון נפרדים לשימור בהקפאה. מחצית מהקריוטיוב/קשיות יישמרו במיכל האחסון הראשון ואילו המחצית השנייה של הקריוטוב/קשיות יישמרו במיכל השני כדי למזער את הסיכון לאובדן מוחלט של הדגימות במקרה של כשל במיכל.
- בדוק את הזמינות והפונקציונליות של כל המכשירים הרפואיים הנדרשים בפרוטוקול זה. מספריים כירורגיים סטריליים עם להבים ישרים חדים ונקודות מושחזות דק וכן מלקחיים סטריליים של רקמות אטראומטיות מומלצים לשלב הדיסקציה.
- בדוק שכל שלבי בקרת האיכות כובדו עבור כל המכשירים הרפואיים (בפרט, אימות ובקרה שגרתית של תהליכי סטריליזציה, אימות תפוגה/מספר אצווה ומעקב).
- שמרו על סביבה אספטית/סטרילית לאורך כל ההליך והקפידו בזהירות על כל אמצעי הבטיחות.
- השתמש בכלים, פיפטות ומכשירים כירורגיים שונים עבור כל מטופל.
2. היום שלפני השימור
- הכינו צלחת פטרי IVF סטרילית אחת בגודל 60 מ"מ המכילה מדיום IVF מכוסה בשמן מינרלי ודגרו את המנה למשך הלילה בטמפרטורה של 37 מעלות צלזיוס באווירה של 5% O2 ו-5% CO2. השתמש בצלחת זו כדי לאסוף את קומפלקסי הקומולוס-ביצית (COCs) שעשויים להישלף מהרקמה (ראה סעיף 7.2).
- מכינים צלחת פטרי IVF סטרילית אחת 35 מ"מ המכילה מדיום IVF ודוגרים את המנה למשך הלילה בטמפרטורה של 37 מעלות צלזיוס באווירה של 5% O2 ו-5% CO2. השתמש במנה זו לשלב הסרת הביציות (ראה סעיף 9.1).
- מכינים צלחת פטרי IVF סטרילית אחת בגודל 35 מ"מ המכילה מדיום IVF מכוסה בשמן מינרלי ודוגרים את המנה למשך הלילה בטמפרטורה של 37 מעלות צלזיוס באווירה של 5% O2 ו-5% CO2. השתמש בכלי זה כדי לאסוף את הביציות לאחר שלב הניתוק (ראה סעיף 9.4).
3. איסוף והובלה של רקמות שחלות
- יש לבצע את הניתוח הלפרוסקופי בהרדמה כללית באמצעות פתח אחד של 10 מ"מ הממוקם בטבור ושתי יציאות של 5 מ"מ, האחת ממוקמת ברביע השמאלי-תחתון והשנייה ממוקמת בימין.
- לבצע כריתת שחלות חד צדדית חלקית או מלאה על פי החלטת הקונצנזוס של האונקולוג, המנתח והצוות הרפואי של יחידת ART בהתבסס על הרזרבה השחלתית, הגודל וההיבט המקרוסקופי של שתי השחלות (איור 1, A1-B1) והפרוטוקול הגונדוטוקסי המתוכנן. בצע כריתת שחלות עם מספריים חדים או סיכות כירורגיות. אל תשתמש במכשיר דיסקציה כלשהו שעלול לגרום לפגיעה אגבית, חשמלית או תרמית ברקמת השחלה שיש לשמר.
הערה: כריתת שחלות חד צדדית מלאה מבוצעת בדרך כלל בנערות לפני גיל ההתבגרות16,22, בעוד שכריתת שחלות חד צדדית חלקית יכולה להתבצע בדרך כלל במטופלות בוגרות עם שחלות גדולות ו/או רזרבה שחלתית גבוהה.
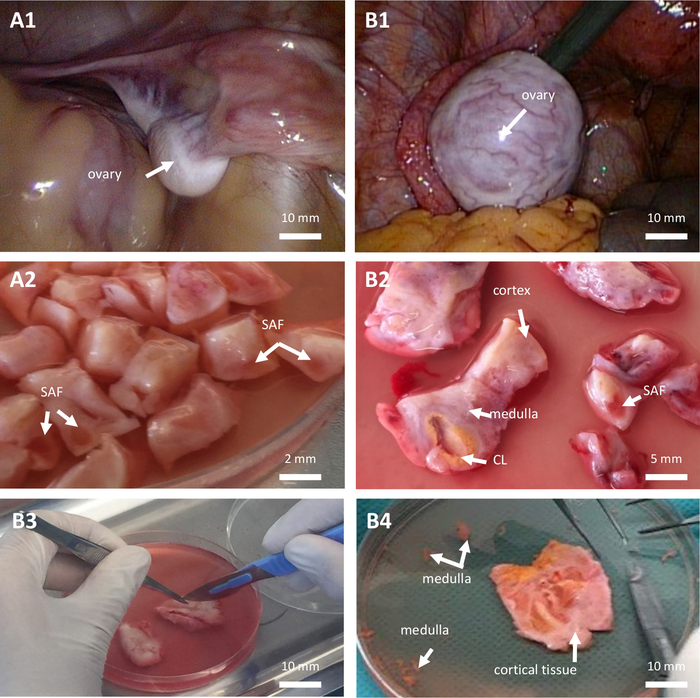
איור 1: שימור הקפאה של רקמות שחלות. שימור בהקפאה של רקמת השחלה בילדה לפני גיל ההתבגרות (א', מטופלת בת 7) ובאישה (ב', מטופלת בת 28) שניהם סובלים מלוקמיה מיאלואידית חריפה. (A1–B1) מבט לפרוסקופי על השחלה. (A2–B2–B3) דיסקציה של רקמת שחלה. (ב4) רקמת שחלה קליפת המוח. CL: קורפוס לוטום. SAF: זקיק אנטרלי קטן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- בצע את פינוי רקמת השחלה באמצעות שקית אחזור דגימה לפרוסקופית בעבודת יד או מסחרית.
- הכניסו את רקמת השחלה לצינור סטרילי המכיל מדיום תרבית בטמפרטורה של 4 מעלות צלזיוס. הרקמה חייבת להיות שקועה לחלוטין במדיום התרבית.
- יש להעביר מיד את רקמת השחלה בכיס מבודד בטמפרטורה של 4 מעלות צלזיוס למעבדת ART לקבלת תוצאות מיטביות.
הערה: במידת הצורך, ניתן להעביר את רקמת השחלה בטמפרטורות קרות (בסביבות 4 מעלות צלזיוס) למעבדה עד 26 שעות לאחר האיסוף מבלי לאיים על איכות הרקמה23.
4. הכנת רקמת שחלה
- העבירו את רקמת השחלה לצלחת פטרי IVF סטרילית בגודל 90 מ"מ המכילה 20 מ"ל של מדיום תרבית מקורר מראש בטמפרטורה של 4 מעלות צלזיוס.
- הניחו את צלחת הפטרי המכילה את רקמת השחלה על צלחת קרה (בטמפרטורה של 4 מעלות צלזיוס) המונחת על ספסל נקי בזרימה למינרית אנכית כדי למזער את הסיכון לזיהום מיקרואורגניזמים.
5. שאיבת זקיקים ידנית מדגימות רקמת שחלה
- שאפו זקיקים אנטרליים גלויים (אם קיימים על פני רקמת השחלה) עם מחט מזרק 21 גרם המחוברת למזרק חד פעמי של 1 מ"ל.
הערה: שלב זה עשוי להיות מסובך. חלופה עשויה להיות לפתוח בעדינות כל זקיק אנטרלי גלוי עם אזמל ולשטוף את החלק הפנימי של כל זקיק עם מדיית IVF על מנת לשחרר ברכות COCs בתוך אמצעי הדיסקציה. - שטפו את הנוזלים הזקיקים שנאספו לצלחת פטרי IVF סטרילית בגודל 60 מ"מ המכילה 5 מ"ל של מדיום תרבית IVF בטמפרטורת החדר.
- שטפו את המזרק עם 1 מ"ל של מדיום תרבית IVF בטמפרטורת החדר ושטפו את הנוזל לאותה צלחת פטרי IVF. חזור על שלב זה פעמיים.
- זהה ובודד את ה-COCs במיקרוסקופ הפוך (הגדלה של פי 50-200).
- העבירו את ה-COCs הבריאים עם פיפטה לצלחת פטרי IVF סטרילית חדשה בגודל 60 מ"מ המכילה מדיום IVF מאוזן מראש מכוסה בשמן ב-37 מעלות צלזיוס באווירה של 5% O2 ו-5% CO2.
הערה: COCs בריאים מכילים ביצית שקופה. השליכו את ה-COCs האטרטיים המציגים ביצית בצבע חום. - אחסן את צלחת פטרי ההפריה החוץ גופית בחממה בטמפרטורה של 37 מעלות צלזיוס באווירה של 5% O2 ו-5% CO2 עד לשלב הדנודיציה (ראה שלב 9).
6. דיסקציה של רקמת השחלות
- הכינו את תמיסת ההקפאה הטרייה בצינור סטרילי של 50 מ"ל. תמיסת ההקפאה מכילה 1.5M דימתילסולפוקסיד (DMSO) ו-10% אלבומין בסרום אנושי במדיום תרבית IVF. מערבולת עדינה.
הערה: יש להכין אותו ממש לפני השימוש. - חותכים את רקמת השחלה ומסירים את המדולה ככל האפשר (איור 1, B4).
- חותכים את קליפת השחלה לפרוסות בגודל 10 מ"מ x 10 מ"מ x 1 מ"מ או 0.5 מ"מ x 0.5 מ"מ x 1 מ"מ במקרה של כריתת שחלות חד צדדית מלאה או חלקית, בהתאמה (איור 1, A2-B2-B3). החיתוך מתבצע במספריים חדים כירורגיים סטריליים ומלקחיים א-טראומטיים.
הערה: פרוסה אחת של רקמת השחלה נשמרת שלמה עם קליפת השחלה והמדולה לניתוח היסטולוגי נוסף (ראה שלב 8). - לאחר הדיסקציה, בצע שני שלבי שטיפה (או יותר, במידת הצורך) עבור כל דגימת קליפת השחלה ב-1 מ"ל של מדיום תרבית IVF כדי להסיר דם. לאחר הכביסה, העבירו את כל דגימות הרקמה לצלחת פטרי חדשה בגודל 60 מ"מ עם מדיום תרבית IVF טרי.
- יש להניח כל דגימת קליפת המוח של השחלות בצינור קריוטיקלי המכיל 1 מ"ל של תמיסת הקפאה.
הערה: ערבוב מיותר. פרוסת רקמת השחלה שנשמרה לניתוח היסטולוגי נוסף אינה שמורה בהקפאה (ראה שלב 8). - שמור את הדגימות למשך 30 דקות ב-4 מעלות צלזיוס לאיזון עם תמיסת ההקפאה.
- שימור הקפאה של כל הדגימות בטכניקת הקפאה איטית. קצב הקירור הוא -2 מעלות צלזיוס לדקה מ-+4 מעלות צלזיוס עד -9 מעלות צלזיוס, -50 מעלות צלזיוס לדקה עד -30 מעלות צלזיוס; החזק במשך דקה אחת, +4 מעלות צלזיוס/דקה עד -15 מעלות צלזיוס, -2 מעלות צלזיוס/דקה עד -40 מעלות צלזיוס; ולבסוף -25 מעלות צלזיוס לדקה עד -150 מעלות צלזיוס באמצעות מקפיא הניתן לתכנות.
- הסר מיד את צינורות הקירור וצלל אותם לחנקן נוזלי בטמפרטורה של -196 מעלות צלזיוס.
- הנח מחצית מצינורות הקירור במיכל אחסון חנקן נוזלי ראשון ואת החצי השני של צינורות הקירור במיכל חנקן נוזלי שני.
7. בידוד COC ידני ממדיית החיתוך המושקעת
- זהה COCs ממדיית החיתוך המושקעת תחת מיקרוסקופ (הגדלה של פי 50-200) (איור 2).
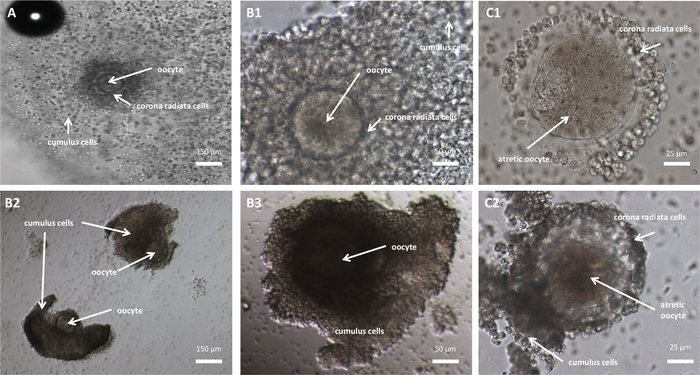
איור 2: COCs בוגרים ולא בשלים שנשלפו מרקמת השחלה. COCs בוגרים (A) ולא בשלים (B1-B3,C1-C2) שנשלפו מרקמת השחלה. (A) COC בוגר שמכיל ביצית בוגרת (נוכחות של הגוף הקוטבי הראשון, ביצית בשלב Metaphase II). (ב1) COC בריא ולא בוגר המכיל ביצית לא בשלה (ללא גוף קוטבי, ביצית בשלב I). (B2–B3) COCs בריאים ולא בשלים המכילים ביציות לא בשלות בשלב שלפוחית הנבט (ללא גוף קוטבי, ביציות בשלב Prophase I). (ג1–ג2) COCs לא בריאים המכילים ביצית בצבע חום אטרטי אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- העבירו את ה-COCs הבריאים עם פיפטה לצלחת פטרי IVF סטרילית חדשה בגודל 60 מ"מ המכילה מדיום IVF מאוזן מראש מכוסה בשמן ב-37 מעלות צלזיוס באווירה של 5% O2 ו-5% CO2 (ראה שלב 2.1).
הערה: השלך את ה-COCs האטרטיים. - אחסן את צלחת פטרי ההפריה החוץ גופית בחממה בטמפרטורה של 37 מעלות צלזיוס באווירה של 5% O2 ו-5% CO2 עד לשלב הדנודיציה (ראה שלב 9).
8. ניתוח היסטולוגי של רקמת שחלות
- יש לתקן את הפרוסה הנותרת של רקמת השחלה (המכילה גם את קליפת השחלה וגם את המדולה) בתמיסת פורמלין 3% בספסל נקי כימי לבדיקה היסטולוגית.
הערה: יש לבצע זאת רק לאחר שהדגימות בקליפת המוח מוקפאות ומאוחסנות בהצלחה.
זהירות: תמיסת הפורמלין מגרה, קורוזיבית ורעילה. שלב זה צריך להתבצע בזהירות ומחוץ למעבדת ההפריה החוץ גופית. - קבעו ניתוח היסטולוגי מלא של דגימת רקמת שחלה זו עם הערכה של הנוכחות הפוטנציאלית של תאים ממאירים וכן תיאור של מספר וסוג זקיקי השחלות (כלומר, זקיקים ראשוניים, ראשוניים, משניים ואנטרליים, בהתאמה).
9. כריתת ביציות וברירה
- בצע כריתת ביציות. חשוף לזמן קצר COCs לתמיסת היאלורונידאז (80 IU/mL או ריכוז סופי 0.1 מ"ג/מ"ל) עם פיפטינג עדין (שאיבה חוזרת והוצאה של ה-COCs לתמיסת הדנודיציה) באמצעות קצה פיפטה בקוטר גדול (נפח 0.1-20 מיקרוליטר, אורך: 40.5 מ"מ, קוטר חרוט עבודה: 6 מ"מ, קוטר פתיחה: 0.36 מ"מ) למשך 30 שניות, מיד לאחר מכן שני שלבי כביסה במדיום מאוזן מראש מכוסה בשמן מינרלי כדי להסיר את עודפי האנזים (ראה שלב 2.1).
- מטב את ההסרה של תאי קומולוס ועטרה רדיאטה על ידי פיפטינג עדין באמצעות קצה פיפטה של 150 מיקרומטר במדיום IVF מאוזן מראש (ראה שלב 2.1).
- בצע שלב בחירה של ביציות בריאות באמצעות מיקרוסקופ הפוך (הגדלה של פי 200–400). שלב ההתבגרות של ביציות בריאות יכול להיות ביציות בשלב GV, MI או MII (איור 3). לביציות בריאות יש את המאפיינים המורפולוגיים הבאים: ציטופלזמה שלמה ועגולה, בגודל שבין 100-150 מיקרומטר וצבע חיוור.
הערה: השליכו ביציות אטרטיות ולא בריאות (איור 3, D1-D3).
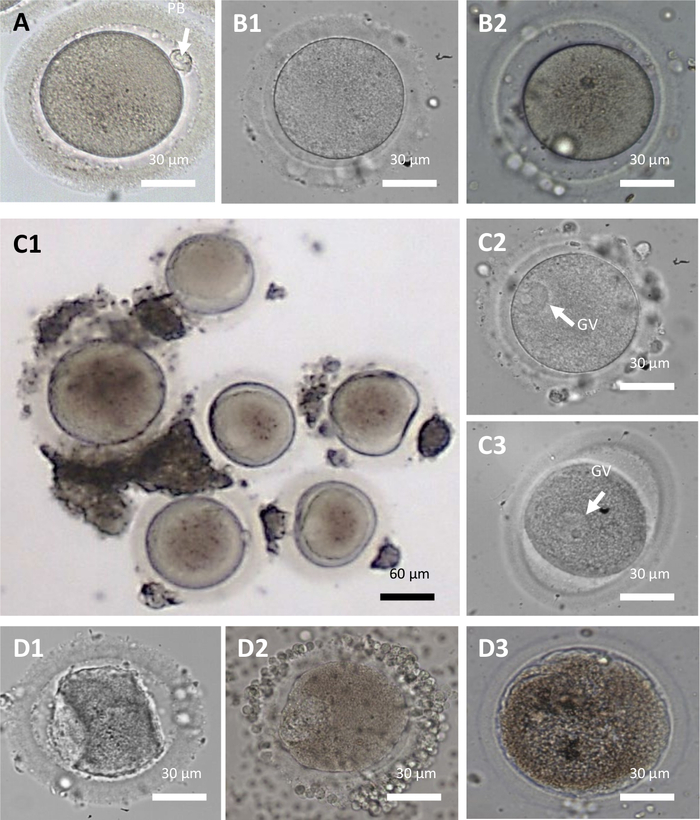
איור 3: ביציות בוגרות ולא בשלות שנשלפו מרקמת השחלה. (A) ביצית בוגרת (ביצית שלב מטפאזה II: נוכחות של הגוף הקוטבי הראשון (PB, חץ), (B1-B2) ביציות לא בשלות (ביצית שלב I: ללא גוף קוטבי, ללא גרעין גלוי), (C1-C3) ביציות לא בשלות (ביציות שלב שלפוחית נבט (VG): ללא גוף קוטבי, נוכחות של הילה גדולה עם גרעינים בתוך הציטופלזמה (חץ)). ב-C1, ביציות בשלב שלפוחית הנבט מציגות גודל הטרוגני. (D1–D3) ביציות אטרטיות. פ.ב.: גוף קוטבי. GV: שלפוחית נבטה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- דגרו ביציות בריאות בתוך החממה בטמפרטורה של 37 מעלות צלזיוס, 5% O2 ו-5% CO2 עד לשלב הזיגוג (ראה שלב 2.1).
10. ויטריפיקציה של ביציות
- אשר את זיהוי המטופל/הדגימה.
- בצע שלב בחירה חדש של ביציות בריאות באמצעות מיקרוסקופ הפוך (הגדלה של פי 200-400).
הערה: יש להשליך ביציות אטרטיות ולא בריאות. - צלמו תמונה של כל ביצית בריאה באמצעות מיקרוסקופ הפוך ממש לפני שלב הזיגוג. שימו לב לשלב ההתבגרות של כל ביצית.
הערה: צרף את כל הנתונים הללו (תמונה, גודל, שלב התבגרות) בקובץ המטופל. - השתמש במספרי זיהוי שונים לכל קשית כדי להבדיל ביניהם אם שימור בהקפאה של יותר מקשית אחת לכל מטופל.
- שמור בהקפאה ביצית אחת או שתיים לכל קשית.
הערה: יש לשמר ביציות בוגרות ולא בשלות בהקפאה בנפרד. בעת שימור בהקפאה של שתי ביציות יחד באותה קשית, מומלץ לבחור ביציות בעלות מאפיינים מורפולוגיים דומים. - שימור ביציות בריאות בהקפאה באמצעות ערכת ויטריפיקציה בהתאם להוראות היצרן (ראה טבלת חומרים).
- טען את ביציות ההקפאה על מכשיר מתאים לאחסון בהקפאה בחנקן נוזלי בהתאם להוראות היצרן (ראה טבלת חומרים).
- מניחים מחצית מהקשיות במיכל אחסון חנקן נוזלי ראשון ואת החצי השני של הקשיות במיכל חנקן נוזלי שני.
Access restricted. Please log in or start a trial to view this content.
תוצאות
בסך הכל בוצעו 81 OTC מ-81 מטופלות בין 2007 ל-2020, כולל 43 נערות לפני גיל ההתבגרות ו-38 נשים. הגיל הממוצע של מטופלות (נערות ונשים לפני גיל ההתבגרות) היה 14.21 ± 9.61 שנים (ממוצע ± טעות תקן). המטופל הצעיר ביותר היה בן 5 חודשים והמבוגר ביותר היה בן 33.6 (טבלה 1). הגיל הממוצע של נערות ונשים...
Access restricted. Please log in or start a trial to view this content.
Discussion
כתב היד הנוכחי מספק פרוטוקול המשלב הקפאת רקמת שחלה ושימור בהקפאה של ביציות שנשלפו מרקמת השחלה, מה שמגדיל את פוטנציאל הפוריות אצל נערות לפני גיל ההתבגרות ונשים בסיכון ל-POI. אנו ממליצים בחום לבצע פרוטוקול זה לפני תחילת כל טיפול גונדוטוקסי על מנת לייעל את הכמות (כלומר, מספר ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
לאף אחד מהכותבים אין אינטרסים מתחרים.
Acknowledgements
אנו מודים לכל חברי המרכזים שלנו העוסקים בפעילות שימור הפוריות (גינקולוגים, ביולוגים, אונקולוגים ואנטומופתולוגים). המחקר נערך כחלק מההליכים השגרתיים לשימור פוריות. לא התקבל מימון.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml disposable syringe | CDD | 1323101/7002655 | Other material and sizes may also be suitable |
| 21-gauge syringe needle | Merck | Z192481 | Other material and sizes may also be suitable |
| 35 mm IVF Petri Dish | Nunc | 150255 | Other material and sizes may also be suitable |
| 60 mm IVF Petri Dish | Nunc | 150270 | Other material and sizes may also be suitable |
| 90 mm IVF Petri Dish | Nunc | 150360 | Other material and sizes may also be suitable |
| Atraumatic forceps | Medlane | PI 299 04 | Other material and sizes may also be suitable |
| Continuous Single Culture Complete with HSA | Irvine Scientific | 90165 | IVF culture medium for follicular fluid collection, COCs incubation, oocyte denudation and oocyte incubation until the vitrification step. |
| Cryotube | Thermo Scientific | 368632 | Other products may also be suitable |
| Dimethylsulfoxide (DMSO) | MILTENYI BIOTEC SAS | 170-076-303 | CryoMACS DMSO 10 (EP) |
| GT40 | Air Liquide | 1,13,517 | Storage tank |
| HSV High Security Vitrification Straw | Irvine Scientific | 25251 | Vitrification straws |
| Human serum albumin | Vitrolife | 10064 | Other products may also be suitable |
| Leibovitz L15 medium | Eurobio | CM1L15000U | Culture medium for ovarian tissue collection, transport and tissue dissection |
| Leibovitz L15 medium | Eurobio | CM1L15000U | Culture medium for freezing solution |
| Mars-IVF Class II Workstation/L126 IVF Dual | CooperSurgical | WM1500/6-133-911-121 | Workstation |
| Programmable freezer | Planner KRYO 500 | Kryo 560-16 | Other equipements may also be suitable |
| Scissors with sharp straight blades and finely sharpened points | Medlane | CI 034 03 | Other material and sizes may also be suitable |
| Stripper | CooperSurgical | MXL3-STR-CGR | Other products may also be suitable |
| Tips (150µm) for Stripper | CooperSurgical | MXL3-150 | Other products may also be suitable |
| Vitrification Kit | Irvine Scientific | 90133 | Protocols are available at http://www.irvinesci.com/products/90133-so-vitrification-freeze-solutions. Other products may also be suitable |
References
- Ataman, L. M., et al. Creating a global community of practice for oncofertility. Journal of Global Oncology. 2 (2), 83-96 (2016).
- Rivas Leonel, E. C., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Chae-Kim, J. J., Gavrilova-Jordan, L. Premature ovarian insufficiency: procreative management and preventive strategies. Biomedicines. 7 (1), (2018).
- Anderson, R. A., Wallace, W. H. B., Telfer, E. E. Ovarian tissue cryopreservation for fertility preservation: clinical and research perspectives. Human Reproduction Open. 2017 (1), (2017).
- Donnez, J., Dolmans, M. M. Fertility preservation in women. The New England Journal of Medicine. 377 (17), 1657-1665 (2017).
- Lambertini, M., et al. Ovarian suppression using luteinizing hormone-releasing hormone agonists during chemotherapy to preserve ovarian function and fertility of breast cancer patients: a meta-analysis of randomized studies. Annals of Oncology. 26 (12), 2408-2419 (2015).
- Gubbala, K., et al. Outcomes of ovarian transposition in gynaecological cancers; a systematic review and meta-analysis. Journal of Ovarian Research. 7, 69(2014).
- Poirot, C., et al. Induction of puberty by autograft of cryopreserved ovarian tissue. Lancet. 379 (9815), 588(2012).
- Ernst, E., Kjaersgaard, M., Birkebaek, N. H., Clausen, N., Andersen, C. Y. Case report: stimulation of puberty in a girl with chemo- and radiation therapy induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. European Journal of Cancer. 49 (4), 911-914 (2013).
- Pacheco, F., Oktay, K. Current success and efficiency of autologous ovarian transplantation: a meta-analysis. Reproductive Sciences. 24 (8), 1111-1120 (2017).
- Silber, S., Kagawa, N., Kuwayama, M., Gosden, R. Duration of fertility after fresh and frozen ovary transplantation. Fertility and Sterility. 94 (6), 2191-2196 (2010).
- Donnez, J., et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet. 364 (9443), 1405-1410 (2004).
- Donnez, J., et al. Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue: a review of 60 cases of reimplantation. Fertility and Sterility. 99 (6), 1503-1513 (2013).
- Jensen, A. K., et al. Outcomes of transplantations of cryopreserved ovarian tissue to 41 women in Denmark. Human Reproduction. 30 (12), 2838-2845 (2015).
- Abir, R., et al. Occasional involvement of the ovary in Ewing sarcoma. Human Reproduction. 25 (7), 1708-1712 (2010).
- Abir, R., et al. Cryopreservation of in vitro matured oocytes in addition to ovarian tissue freezing for fertility preservation in paediatric female cancer patients before and after cancer therapy. Human Reproduction. 31 (4), 750-762 (2016).
- Abir, R., et al. Ovarian minimal residual disease in chronic myeloid leukaemia. Reproductive BioMedicine Online. 28 (2), 255-260 (2014).
- Dolmans, M. M., Luyckx, V., Donnez, J., Andersen, C. Y., Greve, T. Risk of transferring malignant cells with transplanted frozen-thawed ovarian tissue. Fertility and Sterility. 99 (6), 1514-1522 (2013).
- Soares, M., et al. Eliminating malignant cells from cryopreserved ovarian tissue is possible in leukaemia patients. The British Journal of Haematology. 178 (2), 231-239 (2017).
- Son, W. Y., Henderson, S., Cohen, Y., Dahan, M., Buckett, W. Immature oocyte for fertility preservation. Frontiers in Endocrinology. 10, 464(2019).
- Yang, Z. Y., Chian, R. C. Development of in vitro maturation techniques for clinical applications. Fertility and Sterility. 108 (4), 577-584 (2017).
- Imbert, R., et al. Safety and usefulness of cryopreservation of ovarian tissue to preserve fertility: a 12-year retrospective analysis. Human Reproduction. 29 (9), 1931-1940 (2014).
- Duncan, F. E., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction. 152 (6), 201-210 (2016).
- Abir, R., et al. Selection of patients before and after anticancer treatment for ovarian cryopreservation. Human Reproduction. 23 (4), 869-877 (2008).
- Yasui, T., et al. Factors associated with premature ovarian failure, early menopause and earlier onset of menopause in Japanese women. Maturitas. 72 (3), 249-255 (2012).
- Cobo, A., Diaz, C. Clinical application of oocyte vitrification: a systematic review and meta-analysis of randomized controlled trials. Fertility and Sterility. 96 (2), 277-285 (2011).
- Mohsenzadeh, M., Salehi-Abargouei, A., Tabibnejad, N., Karimi-Zarchi, M., Khalili, M. A. Effect of vitrification on human oocyte maturation rate during in vitro maturation procedure: A systematic review and meta-analysis. Cryobiology. 83, 84-89 (2018).
- Anderson, R. A., McLaughlin, M., Wallace, W. H., Albertini, D. F., Telfer, E. E. The immature human ovary shows loss of abnormal follicles and increasing follicle developmental competence through childhood and adolescence. Human Reproduction. 29 (1), 97-106 (2014).
- Revel, A., et al. At what age can human oocytes be obtained. Fertility and Sterility. 92 (2), 458-463 (2009).
- Margulis, S., et al. morphogenetic protein 15 expression in human ovaries from fetuses, girls, and women. Fertility and Sterility. 92 (5), 1666-1673 (2009).
- Kedem, A., et al. Alginate scaffold for organ culture of cryopreserved-thawed human ovarian cortical follicles. Journal of Assisted Reproduction and Genetics. 28 (9), 761-769 (2011).
- Lerer-Serfaty, G., et al. Attempted application of bioengineered/biosynthetic supporting matrices with phosphatidylinositol-trisphosphate-enhancing substances to organ culture of human primordial follicles. Journal of Assisted Reproduction and Genetics. 30 (10), 1279-1288 (2013).
- Ben-Haroush, A., Sapir, O., Fisch, B. Aspiration of immature oocytes during cesarean section for fertility preservation and future surrogacy. American Journal of Obstetrics and Gynecology. 203 (1), 12-14 (2010).
- Farhi, J., Sapir, O., Maman, M., Fisch, B., Ben-Haroush, A. Novel protocol for scheduling oocyte retrieval in IVM cycles in PCOS patients: a case series. Reproductive BioMedicine Online. 23 (6), 765-768 (2011).
- Segers, I., et al. In vitro maturation (IVM) of oocytes recovered from ovariectomy specimens in the laboratory: a promising "ex vivo" method of oocyte cryopreservation resulting in the first report of an ongoing pregnancy in Europe. Journal of Assisted Reproduction and Genetics. 32 (8), 1221-1231 (2015).
- Ellenbogen, A., Shavit, T., Shalom-Paz, E. IVM results are comparable and may have advantages over standard IVF. Facts, Views & Vision in ObGyn. 6 (2), 77-80 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved