Method Article
בדיקת ציטומטריית זרימה מבוססת DNA/Ki67 לניתוח מחזור תאים של תאי CD8 T ספציפיים לאנטיגן בעכברים מחוסנים
* These authors contributed equally
In This Article
Erratum Notice
Summary
הרחבת ציפורן היא תכונה מרכזית של תגובת תאי T ספציפיים אנטיגן. עם זאת, מחזור התא של תאי T מגיב אנטיגן נחקר בצורה גרועה, בין היתר בגלל מגבלות טכניות. אנו מתארים שיטה ציטומטרית זרימה לנתח באופן קלוני הרחבה תאי CD8 T ספציפיים אנטיגן בטחול ובלוטות הלימפה של עכברים מחוסנים.
Abstract
מחזור התא של תאי T ספציפיים אנטיגן ב vivo נבדק באמצעות כמה שיטות, שלכולן יש כמה מגבלות. ברומודיאוקסיורידין (BrdU) מסמן תאים הנמצאים בשלב S או שהושלמו לאחרונה, ו- carboxyfluorescein succinimidyl ester (CFSE) מזהה תאי בת לאחר החלוקה. עם זאת, צבעים אלה אינם מאפשרים זיהוי של שלב מחזור התא בזמן הניתוח. גישה חלופית היא לנצל Ki67, סמן המתבטא מאוד על ידי תאים בכל שלבי מחזור התא למעט שלב ה- Quiescent G0. למרבה הצער, Ki67 אינו מאפשר הבחנה נוספת כפי שהוא אינו מפריד תאים ב S-פאזה המחויבים מיטוזה מאלה ב G1 שיכולים להישאר בשלב זה, להמשיך לתוך רכיבה על אופניים, או לעבור לתוך G0.
כאן, אנו מתארים שיטה ציטומטרית זרימה ללכידת "תמונת מצב" של תאי T בשלבי מחזור תאים שונים באיברי לימפה משניים של העכבר. השיטה משלבת Ki67 והכתמת DNA עם קומפלקס היסטו-תאימות מרכזי (MHC)-פפטיד-רב-משתתפים ואסטרטגיית גיטינג חדשנית, המאפשרת לנו להבדיל בהצלחה בין תאי CD8 T ספציפיים לאנטיגן ב- G0, ב- G1 ושלבי S-G2/ M של מחזור התאים בטחול וניקוז בלוטות הלימפה של עכברים לאחר חיסון עם וקטורים ויראליים הנושאים את מחסום האנטיגן של נגיף הכשל החיסוני האנושי (HIV)-1.
צעדים קריטיים של השיטה היו הבחירה של צבע ה- DNA ואסטרטגיית הגינג כדי להגביר את רגישות הבדיקה ולכלול תאי T פעילים / מתרבים מאוד ספציפיים לאנטיגן שהיו חסרים על ידי הקריטריונים הנוכחיים של ניתוח. צבע הדנ"א, Hoechst 33342, איפשר לנו להשיג אפליה באיכות גבוהה של פסגות ה- DNA G0/ G1 ו- G2/ M, תוך שמירה על ממברנה וכתמים תאיים. לשיטה פוטנציאל גדול להגדיל את הידע על תגובת תאי T ב- vivo ולשפר את ניתוח ניטור האימונו.
Introduction
תאי T נאיביים עוברים התרחבות כלנית ובידול על אנטיגן-priming. תאי T מובחנים מציגים פונקציות אפקט החיוניות לסילוק אנטיגן ולשימור זיכרון ספציפי לאנטיגן, שהוא המפתח להגנה לאורך זמן. במהלך השלבים הראשונים של התגובה הראשונית, אינטראקציה תאי T נאיבית עם תאים אנטיגן מציג (APCs) בתוך נישות מיוחדות באיברי הלימפה הוא קריטי כדי לגרום להתפשטות תאי T ענק המאפיין את שלב הרחבת הציפורן1,2,3. אינטראקציה תא-APC T מוסדר דק על ידי ריכוז והתמדה של אנטיגן, אותות מגרה משותף, וגורמים מסיסים (ציטוקינים וכימותרפיה) המשפיעים על הכמות והאיכות של צאצאי ציפורן תא T4,5,6,7.
למרות מחקרים אינטנסיביים של התפשטות כלנית תאי T, עדיין לא ידוע אם תאי T אנטיגן-ראש להשלים את כל מחזור התא שלהם באתר של זיהוי אנטיגן, או אם הם נודדים לאיברים אחרים במהלך התקדמות מחזור התא. חוסר ידע זה נובע המאפיינים של כלים זמינים לניתוח מחזור התא. אלה כוללים נוגדנים חד שבטיים (mAbs) הספציפיים לסמן הגרעיני, Ki67, וצבעי תאים המזהים תאים שעברו את שלב ה- S של מחזור התא (למשל, ברומודוקסיורידין (BrdU)) או מפלים בין תאי הבת ואבותיהם (למשל, קרוקסיפלואורסצ'ין סוצ'ינימידיל אסתר (CFSE)).
עם זאת, צבעים של תיוג תאים, כגון CFSE ו- BrdU, אינם מאפשרים לקבוע אם תאים שנמצאו באיבר מסוים התרבו באופן מקומי או ליתר דיוק הועברו לאתר זה לאחר חלוקה8,9. יתר על כן, החלבון התוך-גרעיני, Ki67, מסוגל להבחין רק בתאים ב- G0 (תאים שליליים Ki67) מאלה בכל שלב מחזור תאים אחר (תאים חיוביים Ki67). לכן, ניתוח Ki67 אינו מבחין בין תאים בשגשוג פעיל (כלומר, ב- S, G2, או M) מאלה שב- G1, אשר עשויים להתקדם במהירות לחלוקה או להישאר לתקופות ארוכות ב- G1 או לחזור ל- quiescence10,11.
כאן, אנו מתארים שיטה ציטומטרית זרימה חדשה לניתוח מחזור התאים של תאי CD8 T ספציפיים אנטיגן12 מן הטחול ובלוטות הלימפה (LNs) של עכברים מחוסנים(איור 1). השיטה מנצלת שילוב של Ki67 וכתמי DNA ששימשו בעבר לניתוח מחזור התא של תאי המטופויאטיים של מח העצם של העכבר (BM)13,14. כאן, יישמת בהצלחה Ki67 בתוספת כתמי DNA, יחד עם אסטרטגיית הגינג החדשנית שפורסמה לאחרונה12, לניתוח הרחבת כלת תא CD8 T. הצלחנו להפלות בבירור בין תאי CD8 T ספציפיים לאנטיגן ב- G0,ב- G1,ובפעמי S-G2/ M בטחול ו- LNs ניקוז של עכברים מחוסנים.
Protocol
עכברים שוכנו במתקן החיות Plaisant, והעבודה בוצעה תחת אישור משרד הבריאות האיטלקי מספר 1065/2015-PR. הפרוטוקול פעל על פי הנחיות הטיפול בבעלי חיים על פי חוקים ומדיניות לאומיים ובינלאומיים (הוראת UE 2010/63/UE; צו חקיקה איטלקי 26/2014).
1. הכנת פתרון בינוני וכתים
- הכן בינוני מלא: מכון הזיכרון רוזוול פארק (RPMI) בינוני עם 2 mM גלוטמין, 100 U / mL פניצילין / סטרפטומיצין, 50 μM בטא-mercaptoethanol, ו 10% נפח / נפח (v / v) של סרום בקר עוברי (FBS)
- הכן חיץ כתמים: תמיסת מלח חוצצת פוספט ללא Ca2 +/ Mg2 + (PBS) עם 1% משקל / נפח (w / v) אלבומין סרום בקר (BSA) ו 2 mM מלח דיסודיום חומצה אתילנדימינטראצטית (EDTA)
2. טיפול בעכבר
- ראש 7-8 שבועות, עכברי Balb/c נקבה על ידי הזרקה תוך שרירית (i.m.) בשריר הארבע ראשי של וירוס חיסוני אנושי (HIV)-1-איסור-איסור-שימפנזה אדנו-ויראלי (ChAd3-gag) עם מנה של 107 חלקיקים ויראליים.
- ב 1-4 חודשים לאחר priming, להגביר פעם אחת את העכברים על ידי i.m. הזרקה של HIV-1-איסור פרסום-ביטוי וירוס vaccinia אנקרה שונה (MVA-gag) עם מנה של 106 יחידות יוצרות פלאק.
- ביום 3 לאחר דחיפה, להקריב את העכברים מוגברת על ידי נקע צוואר הרחם, ולנתח אותם במקביל עם עכברים מטופלים.
- קוצרים את ה-LNs המנקזים את שריר הארבע ראשי (כסל, פופליטאלי ומשתנה) ואת הטחול מעכברים מוגברים ולא מטופלים. יתר על כן, לאסוף את BM משתי הרגליים האחוריות מעכברים מטופלים, ולהשתמש BM זה עבור הגדרות cytometer זרימה כמו שליטה חיובית עבור ניתוח מחזור התא (איור 2).
הערה: צור ChAd3-gag ו- MVA-gag וקטורים כפי שתואר בעבר12,15,16,17.
3. בידוד של תאי LN, טחול ו- BM מתנקזים
- בידוד של תאי טחול ו- LN
- מניחים 5 מ"ל של מדיום מלא בכל אחד משני צינורות 15 מ"ל, ולשמור אותם על קרח, מוכן לאיברים לאיסוף.
- להקריב עכבר בוגר על ידי פריקת צוואר הרחם.
- מניחים את העכבר על גבו, ומעקרים את פני העור עם 70% v/ v אתנול.
- כדי לאסוף LNs מפשעתי, לעשות ~ 1 ס"מ אורך חתך על הבטן עם מספריים, ולמתוח את החתירה עם המלקחיים.
- דמיינו LNs מפשעתי על פני השטח הפנימיים של העור, וקצור אותם עם המלקחיים. מניחים את LNs מפשעתי באחד משני צינורות 15 מ"ל מוכן בשלב 3.1.1.
- כדי לאסוף את הטחול, לעשות קיסך צפק עם מספריים ולהסיר את הטחול. לאחר חיתוך רקמת החיבור שמסביב, מניחים את הטחול לתוך צינור 15 מ"ל השני שהוכן בשלב 3.1.1.
- כדי לאסוף LNs כסל, להזיז את המעיים הצידה לדמיין LNs iliac קרוב vena קאווה נחות, ולאחר מכן לאסוף אותם באמצעות מלקחיים. מקם את ה- LNs הכסל באותה שפופרת המכילה את ה- LNs המגיתיים.
הערה: כדי להשיג מספיק תאי LN להכתמה (ראה סעיף 4), לעתים קרובות יש צורך לאגר חלונות קופצים, מפשעתיים, ו- iliac LNs מעכבר אחד. כל ה-LNs האלה מרוקנים את שריר הארבע ראשי (האתר של i.m. חיסון). פרוטוקול זה משתמש רק בצינור אחד של 15 מ"ל של LNs מקבצים מאותבים. - כדי לאסוף LNs popliteal, לתפוס את העור של הרגליים האחוריות בעדינות למשוך אותו כלפי מטה כדי לחשוף את השרירים. לאחר מכן, הכנס את המלקחיים בין השרירים מתחת למפרק הברך, ולאסוף את LNs popliteal. למקם את LNs popliteal באותו צינור המכיל LNs מפשעתי וכסל.
הערה: ראה הערה לאחר 3.1.7. - מניחים את הטחול לתוך מסננת תא 70 מיקרומטר בתוך צלחת תרבות 60 מ"מ מלא 5 מ"ל של מדיום מלא. בעזרת בוכנה מזרק 5 מ"ל, בעדינות לרסק את האיבר עד פירוק מלא שלה.
- הסר מסננת, ולהעביר את השעיית התא צינור נקי 15 מ"ל.
- מוסיפים 5 מ"ל של מדיום מלא לצלחת התרבות, ושטפים בזהירות את המנה ואת המסננת כדי להבטיח שכל התאים נמצאו. בריכה עם שאר התלוי של תא הטחול לתוך צינור 15 מ"ל.
- עבור LNs מפשעתי, iliac ו- popliteal מרופדים, הכינו השעיית תא בודד בעקבות הליך דומה לזה המשמש בשלבים 3.1.9 עד 3.1.11 עבור הטחול.
- תאי צנטריפוגות ב 400 × גרם במשך 10 דקות ב 4 °C (70 °F). השלך את supernatant, ו resuspend כדורי התא PBS.
- לספור את התאים עם תא Neubauer באמצעות מאגר תמה תא דם אדום 0.04% v / v טריפן כחול PBS.
- בידוד של תאי BM
- מניחים 5 מ"ל בינוני מלא בצינור 15 מ"ל, ולשמור אותו על קרח, מוכן לאוסף של רגליים אחוריות.
- להקריב עכבר בוגר על ידי פריקת צוואר הרחם.
- לחטא את פני העור עם 70% v / v אתנול.
- בצע חתך רוחבי ~ 1 ס"מ על העור הגחון עם מספריים, לתפוס בחוזקה את העור משני צידי החתך, ולמשוך בעדינות כלפי מטה כדי לחשוף את השרירים של הרגליים האחוריות.
- כדי לחסל את העור מהחלק האחורי של הרגליים האחוריות, שמירה על העכבר בתנוחה supine, למקם את המהדק מתחת לברך, ולמשוך כלפי מעלה כדי לחשוף את השרירים.
- חותכים את העצמות בשתי הגפיים של רגל אחורית אחת: מפרק האגן / הירך והקרסול.
- העבר את שתי הרגליים האחוריות לצינור 15 מ"ל מוכן בשלב 3.2.1. שמור את הצינור על קרח.
- קח את הרגליים האחוריות מהצינור 15 מ"ל ולהעביר אותם לנייר טישו. חותכים את הרגליים האחוריות ממש מתחת למפרק הברך כדי להסיר את השוקה. לנתח את עצם הירך ואת השוקה מן השרירים שמסביב, להסיר רקמות עודפות באמצעות מספריים, ולהרטיב את נייר הרקמה.
- חותכים את העצם מסתיים עם מספריים כדי לחשוף את פיר מח העצם הפנימי. הכנס את השוקה ואת עצם הירך לתוך צינור החילוץ BM (ראה הכנה 3.2.9.1-3.2.9.218), עם הקצה הרחב ביותר בתחתית.
- חותכים טיפ פיפטה 200 μL בקו ממש מעל סוף הקצה בקו 100 μL.
- מניחים את החלק האמצעי בחלק העליון והגדול יותר של הקצה, ומניחים אותו בצינור מיקרופוגה 1.5 מ"ל.
- לסובב את צינור החילוץ BM ב 800 × גרם במשך 1 דקות.
- להשליך את העצם, ובמרץ resuspend הכדור ב 1 מ"ל של מדיום מלא כדי להסיר את כל האשכולות. סנן את ההשעיה של התא באמצעות מסנן 70 מיקרומטר שהונח על גבי צינור 15 מ"ל.
- לשטוף את צינור החילוץ BM פעמיים עם 1 מ"ל של מדיום מלא בכל פעם. סנן דרך מסנן 70 מיקרומטר וקשף את עוצמת הקול עם שאר ההשעיה של התא שהתקבל בשלב 3.2.11.
הערה: צינור יחיד של 15 מ"ל יכיל תאים משתי הרגליים האחוריות של עכבר. - תאי צנטריפוגות ב 400 × גרם במשך 10 דקות ב 4 °C (70 °F). השלך את supernatant, ו resuspend גלולה התא PBS.
- לספור את התאים עם תא Neubauer באמצעות מאגר תמה תא דם אדום 0.04% v / v טריפן כחול PBS.
4. כתמים של תאי טחול, LN ו- BM
- חלק דגימות תאים להיות מוכתם ל 3 תת קבוצות: דגימות תאים לפיצוי, כולל תאי BM מעכברים מטופלים להיות מוכתם רק עם Hoechst 33342 (מעתה ואילך המכונה Hoechst) ותאי טחול מעכברים מטופלים לשמש להכנת תערובת תאים מתים / חיים לפיצוי צבע תא מת; שליטה חיובית עבור ניתוח מחזור התא, המורכב מדגם BM מעכברים לא מטופלים; ודגימות ניסיוניות המכילות דגימות טחול ו- LN מעכברים לא מטופלים ומחסן.
הערה: ודא שיש מספיק תאי טחול ו- LN לניתוח של מספרים מספיקים של תאי CD8 T ספציפיים למחסום. לעתים קרובות יש צורך להשתמש בתאי טחול מקבצים ותאי LN מ-3 עכברים מחוסנים ולהכתים שתי דגימות זהות או יותר של תאים מאוגדים, שכל אחת מהן מכילה 3 × 106 תאים. מזג דוגמאות זהות בשלב של הכתמת היצ'סט. באופן דומה, תאי טחול מלוגדים כתמים ותאי LN מ-3 עכברים לא מטופלים, וממזגים דגימות זהות בסוף. הקצה דגימה לא נגועה של תאי טחול מעכבר לא מטופל שישמש להגדרת מכשירים ופיצויים. - הכן תערובת תאים מתים / חיים לפיצוי צבע תא מת (תערובת זו של תאים תהיה מוכתמת רק עם צבע התא המת).
- לחמם אמבט מים ב 65 °C (5 °F).
- קח aliquot של תאי טחול (~ 3 × 106).
- להעביר את ההשעיה התא לצינור microfuge, למקם אותו באמבט המים ב 65 °C (5 דקות), ולאחר מכן מיד למקם אותו על קרח במשך 10 דקות.
- מערבבים את התאים מוכי החום עם תאי טחול חיים (~3 × 106) ביחס של 1:1, ומעבירים מחצית מהתערובת לצלחת תחתונה עגולה של 96 (כ-3 × 106 תאים/גם לבקרת הכתמת התא המת).
- כתמי תאים מתים של דגימות ניסיוניות, שליטה חיובית לניתוח מחזור התאים ותערובת תאים מתים/חיים
- העבר טחול, LN, תאי BM (3 × 106 תאים / טוב), ואת תערובת התא המת / חי (סעיף 4.2) לתוך צלחת עגולה 96 היטב, על פי ערכת הכתמים (שלב 4.1), וצנטריפוגה ב 400 × גרם במשך 3 דקות ב 4 °C (50 °F).
- resuspend כל גלולה תא ב 50 μL של צבע תא מת מדולל PBS, ו resuspened על ידי צינור למעלה ולמטה 3 פעמים מיד.
- דגירה במשך 30 דקות ב 4 °C (6 °F), מוגן מפני אור.
- לשטוף תאים 2 פעמים עם חוצץ כתמים; בפעם הראשונה עם 200 μL והפעם השנייה עם 250 μL. עבור כל צנטריפוגה לשטוף את הצלחת ב 400 × גרם במשך 3 דקות ב 4 °C (70 °F).
- להשליך את supernatant, ו resuspend גלולה התא ב 20 μL של PBS.
- מכתים תאי ממברנה עם קומפלקס היסטו-תאימות מרכזי (MHC) -מולטימרים ו- mAbs.
- אם ניקח בחשבון את הכרכים הדרושים על פי ערכת הכתמים (הגדרות Cytometer זרימה, טבלה 1), להכין את ריאגנטים הבאים:
- לדלל mAb 2.4G2 במאגר הכתמים על פי הדילול המתאים (ראה טבלת חומרים); עבור כל דגימה להיות מוכתם, להשתמש 10 μL של דילול זה.
הערה: 2.4G2 mAb חוסם כריכה לא ספציפית אנטיגן של אימונוגלובולינים לקולטנים FcγII ו- FcγII. - לדלל את H-2k(d) AMQMLKETI allophycocyanin (APC)-תווית טטרמר (Tetr-gag) במאגר הכתמים כדי לקבל את הדילול המתאים (ראה טבלת חומרים); כדי שכל דגימה תהיה מוכתמת, השתמש ב- 20 μL של דילול זה.
- הכן את תערובת הנוגדנים על ידי דילול mAbs במאגר הכתמים על פי הדילול המתאים (ראה טבלת חומרים) שנקבעה בעבר בניסויי טיטריון; כדי שכל דגימה תהיה מוכתמת, השתמש ב-20 מיקרו-אל של תערובת נוגדנים זו.
הערה: כאן, חלבון כלורופיל peridin אנטי CD3e (PerCP-Cy5.5) (שיבוט 145-2C11), אנטי CD8a מבריק אולטרה סגול (BUV805) (שיבוט 53-6.7), ו נגד CD62L phycoerythrin ציאנין7 (PECy7) (שיבוט MEL-14) שימשו.
- לדלל mAb 2.4G2 במאגר הכתמים על פי הדילול המתאים (ראה טבלת חומרים); עבור כל דגימה להיות מוכתם, להשתמש 10 μL של דילול זה.
- הוסף 10 μL של 2.4G2 mAb מדולל בעבר (שלב 4.4.1.1), ודגרה במשך 10 דקות ב 4 °C (4 °F), מוגן מפני אור.
- הוסף 20 μL של נגמ"ש Tetr-gag מדולל בעבר (שלב 4.4.1.2) ו 10 μL של H-2k(ד) AMQMLKETI phycoerythrin (PE) מחומש (pent-gag). דגירה במשך 15 דקות ב 4 °C (5 °F), מוגן מפני אור.
- הוסף 20 μL של תערובת נוגדנים שהוכן בעבר (שלב 4.4.1.3), ודגור 15 דקות ב 4 °C (70 °F), מוגן מפני אור.
הערה: לפיכך, נפח סופי הוא 80 μL לבאר (שלב 4.3.5, שלבים 4.4.2 עד 4.4.4). - לשטוף תאים עם 200 μL של חוצץ כתמים. צנטריפוגה ב 400 × גרם במשך 5 דקות ב 4 °C (70 °F).
- resuspend גלולה התא ב 250 μL של חוצץ כתמים, ולהעביר את ההשעיה התא 5 mL צינורות. הוסף 1 מ"ל של חוצץ כתמים לצינור, וצנטריפוגה ב 400 × גרם במשך 5 דקות ב 4 °C (70 °F).
- קח את aliquot של תאי BM (3 × 106 תאים) (ראה רשימה של דגימות תאים, סעיף 4.1) לשמש כדי לפצות את ערוץ Hoechst (Hoechst 33342 מתרגש על ידי לייזר אולטרה סגול (הגדרות cytometerזרימה (טבלה 2)), ולהעביר את ההשעיה התא לתוך צינור 5 מ"ל. הוסף 1 מ"ל של חוצץ כתמים לצינור, וצנטריפוגה 400 × גרם במשך 5 דקות ב 4 °C (70 °F).
- אם ניקח בחשבון את הכרכים הדרושים על פי ערכת הכתמים (הגדרות Cytometer זרימה, טבלה 1), להכין את ריאגנטים הבאים:
5. קיבעון/פרמיביליזציה
- הכן חיץ קיבעון/פרמזיביליזציה טרי על ידי דילול חלק אחד של תרכיז קיבעון/פרמזיביליזציה עם 3 חלקים של דילול קיבעון/פרמזיביליזציה, בהתאם להוראות היצרן.
- להשליך את מערבולת supernatant ודופק הדגימות כדי לנטרל לחלוטין את הכדור.
- הוסף 1 מ"ל של חיץ קיבעון / permeabilization מוכן טרי לכל צינור, כולל צינור עם תאי טחול לא מזוהמים (3 x 106, ראה רשימה של דגימות תאים, סעיף 4.1) ומערבולת.
- דגירה במשך 16 שעות ב 4 °C (5 °F).
הערה: ניתן להשהות את הפרוטוקול כאן.
6. כתמים תאיים
- כתמי Ki67
- הכן חיץ permeabilization טרי 1x על ידי דילול חיץ permeabilization 10x עם מים מזוקקים, על פי הוראות היצרן. לפני השימוש, מאגר permeabilization 1x חייב להיות מסונן באמצעות מסנן 0.45 מיקרומטר כדי לחסל אגרגטים.
- לדלל mAb Ki67 פלואורסצין איזוטיויאנאט (FITC) (שיבוט SolA15) במאגר permeabilization 1x (ראה טבלת חומרים),כפי שנקבע בעבר בניסויי טיטרציה (נפח סופי של 100 μL לדגימה).
- הוסף 3 מ"ל של חיץ פרמזביליזציה 1x לכל צינור, וצנטריפוגה ב 400 × גרם במשך 5 דקות בטמפרטורת החדר (RT).
- השלך את שלב העל וחזר על שלב 6.1.3.
- השלך את supernatant, ו resuspend גלולה התא ב 100 μL של mAb Ki67 FITC מדולל בעבר (שלב 6.1.2).
- דגירה במשך 30 דקות ב RT, מוגן מפני אור.
- לשטוף תאים 2 פעמים עם 4 מ"ל של חיץ permeabilization 1x. עבור כל צנטריפוגה לשטוף ב 400 × גרם במשך 5 דקות ב RT.
- Resuspend גלולה התא PBS בהתחשב בנפחים הבאים: 350 μL של PBS עבור הדגימות שנרכשו ישירות ב cytometer הזרימה; 250 μL של PBS עבור הדגימות להיות דגירה עם Hoechst זמן קצר לפני ציטומטריה זרימה (סעיף 6.2).
- כתמי דנ"א
- הוסף 250 μL של 4 מיקרוגרם / מ"ל Hoechst ב PBS לכל מדגם (הריכוז הסופי של Hoechst הוא 2 מיקרוגרם / מ"ל).
הערה: במקרה שתי דגימות זהות או יותר של 250 μL ב- PBS הוכנו, למזג אותם בשלב זה, ולהוסיף נפח שווה של 4 מיקרוגרם / mL פתרון Hoechst ב PBS (הריכוז הסופי של Hoechst הוא 2 מיקרוגרם / מ"ל). מספר התאים משפיע מאוד על שלב הכתמת הדנ"א. השתמש באותו מספר תא בכל דגימה. שים לב כי אפילו מספר תא מופחת מעט (למשל, עקב אובדן תאים בשלבי כביסה קודמים) גורם כריכה Hoechst גבוה יותר ל- DNA ועוצמת Hoechst גבוהה יותר. - דגירה במשך 15 דקות ב RT, מוגן מפני אור.
- צנטריפוגות הדגימות ב 400 × גרם במשך 5 דקות ב RT.
- resuspend גלולה התא ב 350 μL של PBS.
- הוסף 250 μL של 4 מיקרוגרם / מ"ל Hoechst ב PBS לכל מדגם (הריכוז הסופי של Hoechst הוא 2 מיקרוגרם / מ"ל).
7. הכנת דגימות חרוזים לפיצוי
- הכן 5 μL של הנוגדן על ידי דילול mAb במאגר הכתמים כראוי.
הערה: עבור כל mAb מצומד פלואורוכרום המשמש בניסוי, להכין את מדגם חרוז הפיצוי המתאים שלה. - מערבולת שליטה שלילית ונגד חולדה / אוגר Ig, κ Comp חרוזים לפני השימוש.
- עבור כל מדגם, להציג טיפה אחת (~ 20 μL) של CompBeads של שליטה שלילית טיפה אחת של אנטי חולדה / אוגר Ig, k CompBeads.
- הוסף 5 μL של הנוגדן prediluted (שלב 7.1) לצינור, וצינור למעלה ולמטה.
- דגירה במשך 15 דקות ב 4 °C (5 °F), מוגן מפני אור.
- לשטוף דגימות עם 2 מ"ל של חוצץ כתמים. צנטריפוגה ב 400 × גרם במשך 5 דקות ב 4 °C (70 °F).
- להשליך את supernatant, ו resuspend הכדור על ידי הוספת 500 μL של PBS לכל צינור מערבולת.
8. מערך מכשירים ופיצויים ורכישת מדגם ניסיוני בציטומטר הזרימה
הערה: עיין בהגדרות ציטומטר הזרימה (טבלה 2) עבור תצורת cytometer.
- מכשיר כללי וכיוונון פיצוי
- פתח את התוכנה לרכישה לדוגמה (ראה טבלת חומרים ) וצור ניסוי חדש על-ידי לחיצה על ניסוי חדש במקטע רצועת הכלים שלסביבת העבודה ובחירה בניסוי ריק חדש.
- לחץ פעמיים על הניסוי שנוצר כדי לפתוח אותו.
- בחלון הגדרות Cytometer, לחץ על פרמטרים ובחר את כל הערוצים (למשל, PE, APC וכו ') המשמשים בלוח הכתמים כולל פיזור קדימה (FSC) ופרמטרים של פיזור צד (SSC).
- בחר קנה מידה ליניארי כפרמטר Hoechst על-ידי ביטול הסימון של סולם יומן הרישום ובדוק את הרוחב (W) של פעימת המתח עבור FCS, SSC ו- Hoechst.
הערה: כל הפרמטרים מוצגים כברירת מחדל בקנה מידה לוגריתמי (יומן רישום), למעט FSC ו- SSC הנמצאים בקנה מידה ליניארי. כל הפרמטרים מנותחים על ידי האזור (A) והגובה (H) של פעימת המתח. - בגליון העבודה הכללי, צור התוויית נקודות עם FSC-A בציר ה- x ו- SSC-A בציר ה- y.
- הפעל את דגימת הטחול הלא נגועה על-ידי לחיצה על השג נתונים בלוח המחוונים של הרכישה.
- הגדר את הגדרות ה- FSC וה- SSC המתאימות כדי להציג באופן חזותי את התאים על-ידי שינוי ערכי המתח במקטע פרמטרים וצור שער לבחירת כל התאים המוצגים בהתוויה של הנקודות FSC-A/A/SSC-A על-ידי לחיצה על שער מצולע בסרגל הכלים של סביבת העבודה של גליון העבודההכללי .
- הצג את התאים המגודרים בהיסטוגרמה עם כל פרמטר פלואורסצנטיות בציר ה- x.
- הפעל דגימות טחול לא מוכתמות ומוכתמות לחלוטין כדי להתאים את גלאי הפלואורסצנטיות (PMT) להפרדה ברורה בין אותות שליליים וחיוביים של התאים המוכתמים עבור כל פרמטר פלואורסצנטי.
- כדי לבצע הגדרת פיצוי, לחץ על התנסות ברצועת הכלים של סביבת העבודה ותחת המקטע הגדרת פיצוי, בחר צור פקדי פיצוי. בטל את הסימון כלול צינור בקרה/באר לא נגוע ולחץ על אישור.
הערה: פעולה זו תגרום ליצירת דגימה בשם בקרת פיצוי וגליון עבודה רגיל המכיל מספר גליונות המתאימים לכל פרמטר שנבחר. - הפעלת מדגם של חרוזי פיצוי (ראה סעיף 7); הגדר את הגדרות ה- FSC וה- SSC המתאימות כדי לדמיין את החרוזים על-ידי שינוי ערכי המתח וסף הרכישה של 5,000 בפרמטרים של FSC בחלון Cytometer.
- התאם את שער P1 באוכלוסיית החרוזים, ובדוק שהפסגות החיוביות והשליליות נראות שתיהן על ציר ה- x. חזור על פעולה זו עבור כל דגימת חרוז פיצוי, ולבסוף הקלט כל קובץ לדוגמה על-ידי לחיצה על נתוני רשומה בלוח המחוונים של הרכישה (רשמה לפחות 5,000 אירועים עבור כל מדגם).
- עבור כל מדגם חרוזים מוקלט, קבעו את שערי P2 ו- P3 על הפסגות החיוביות והשליליות, בהתאמה.
- הפעל את דגימות התא לפיצוי (ראה שלבים 4.2 ו- 4.4.7, וסעיפים 5 ו- 6). שנה את המתחים FSC ו- SSC ואת ערך הסף כדי לדמיין את התאים, להתאים שער P1 ולבסוף להקליט כל קובץ לדוגמה (להקליט לפחות 10,000 אירועים). הגדר את שערי P2 ו- P3 על הפסגות החיוביות והשליליות, בהתאמה.
הערה: עבור הפיצוי של ערוץ Hoechst, להשתמש G0/ G1 כמו השיא השלילי (P3) ואת G2/ M כחיובי (P2). - לחץ על התנסות במקטע רצועת הכלים של סביבת העבודה ובסעיף הגדרת פיצוי, בחר חשב פיצוי.
- תן שם להגדרת הפיצוי שנוצרה, קשר ושמור אותה בניסוי הנוכחי.
- רכישת מדגם ניסיוני
- פתח דגימה על-ידי לחיצה על דגימה חדשה בסרגל הכלים של הדפדפן וצור את אסטרטגיית הגינג בגליון העבודה הכללי.
הערה: אסטרטגיית הגטינג של רכישת מדגם דומה לזו של ניתוח מדגם, המתואר באיור 3 ובסעיף 9. - הצג את כל אוכלוסיית האירועים בהיסטוגרמה עם CD3-A בציר ה- x. צור שער מרווח כדי לבחור רק את התאים CD3+ .
- בלוח המחוונים של הרכישה, בחר שער אחסון כ'כל האירועים' עבור דוגמאות LN, ואת כל האירועים או CD3+ תאים עבור דוגמאות טחול.
- הפעל את הדגימות הניסיוניות במהירות נמוכה, ולבסוף להקליט את כל הקבצים הקפד לאסוף לפחות 100-200 תאי CD8 T ספציפיים אנטיגן עבור כל מדגם מן העכברים מחוסנים.
הערה: גודל הקובץ של דגימות ניסיוניות הוא בדרך כלל גדול (30-120 MB), במיוחד כאשר התדירות של תאי CD8 T ספציפיים אנטיגן הוא נמוך. לפיכך, יש לאסוף מספר גבוה של אירועים (> 1 ×10 6) כדי להקליט לפחות 100-200 תאי CD8 T ספציפיים לאנטיגן. קבצים גדולים עשויים להאט את תהליך ניתוח הנתונים הבא. רכישת CD3+ תאים בלבד בדגימות טחול (ראה שלב 8.2.2 לעיל) שימושית לשמירה על גודל הקובץ קטן יותר. - הפעל ורשום את הפקד החיובי עבור ניתוח מחזור התא, כלומר, דגימת BM מעכברים שלא טופלו.
- פתח דגימה על-ידי לחיצה על דגימה חדשה בסרגל הכלים של הדפדפן וצור את אסטרטגיית הגינג בגליון העבודה הכללי.
9. ניתוח נתונים
- פתח את התוכנה (ראה טבלת חומרים ) וצור קבוצות שונות המתאימות לאיברים השונים שיש לנתח על-ידי לחיצה על צור קבוצה במקטע רצועת הכלים שלסביבת העבודה (כלומר, צור קבוצה "a-LNs"; "טחול ב"; "C-BM").
הערה: קבוצות חדשות שנוצרו יופיעו ברשימת הקבוצות, בעוד שהקבוצה "פיצוי" נוצרת באופן אוטומטי על-ידי התוכנה. - פתח את החלון שנה קבוצה על-ידי לחיצה כפולה על שם הקבוצה ובדוק שהקבוצות החדשות שנוצרו מסונכרנות. אם לא, הוסף סימן ביקורת על הפונקציה מסונכרנת.
- גרור כל קובץ .fcs בקבוצה המתאימה לו.
- צור את אסטרטגיית הגטינג החל מקבוצת "a-LNs".
- לחץ פעמיים על המדגם המוכתם לחלוטין בקבוצה כדי לפתוח את חלון הגרף; ציר x ו- y מסומנים כמו בקבצי fcs (ראה הגדרות ציטומטר זרימה, טבלה 2).
- הצג את סך האירועים שנרכשו עבור מדגם זה בחלקת נקודות עם DNA-A על ציר x ו- DNA-W בציר ה- y.
- בחר רק את אוכלוסיית התא הבודד על-ידי לחיצה על מלבן במקטע הכלי gating של חלון התרשים.
הערה: לתאים בודדים יש ערכי DNA-A כדלקמן: 2N (נמוך): בין 2N ל- 4N (ביניים), או שווה ל- 4N (גבוה), בעוד שערכי DNA-W זהים לכולם (שלב 1 באיור 3). - לחץ פעמיים במרכז השער המלבני כדי להציג תאים בודדים בפתק נקודה עם פרמטר FSC-A בציר x וצבע תא מת בציר ה- y.
- בחר רק את אוכלוסיית התאים החיים על-ידי לחיצה על מצולע במקטע כלי הגינג של חלון התרשים. תאים חיים הם שליליים לצבע התא המת (שלב 2 באיור 3).
- לחץ פעמיים במרכז השער המצולעת כדי להציג את התאים בתיוו נקודה עם פרמטר FSC-A בציר x ו- SSC-A על ציר ה- y.
- לחץ על מלבן, וצור שער "רגוע" שיכלול את כל התאים החיים הבודדים בגרף12 (שלב 3 באיור 3).
- לחץ פעמיים במרכז השער "הרגוע" כדי להציג את התאים בחלקת נקודות עם CD3 בציר x ו- CD8 בציר ה- y.
- בחר את התקליטור+CD8+ תאים על ידי לחיצה על מצולע (שלב 4 באיור 3).
- לחץ פעמיים במרכז ה- CD3+CD8+ השער כדי להציג את התאים בחלקת נקודות עם Tetr-gag על ציר ה- x ו- Pent-gag על ציר ה- y.
- בחרו את תאי ה-CD8 T הספציפיים לאנטיגן (חיוביים הן עבור Tetr-gag והן עבור Pent-gag) על ידי לחיצה על מצולע (שלב 5 באיור 3).
- לחץ פעמיים במרכז השער הספציפי למחסום כדי להציג את התאים בחלקת נקודות עם DNA-A על ציר ה- x ו- Ki67 בציר ה- y (איור 4).
- בחר את התאים בשלבי מחזור התא השונים על-ידי לחיצה על Quad במקטע הכלי gating של חלון התרשים.
הערה: תא בשלב G0 הם תאים נמוכים Ki67neg-DNA (רבע שמאלי תחתון); תאים ב- G1 הם Ki67pos-DNA נמוך (רבע שמאלי עליון); תאים ב-S-G2/M הם Ki67pos-DNA ביניים/גבוה (רבע ימני עליון)(איור 4). - העתק את אסטרטגיית הגטינג שנוצרה במדגם אחד לקבוצה המתאימה כדי להחיל את השערים על כל הדגימות של הקבוצה.
- חזור על שלבים 9.5 עד 9.18 עבור "קבוצת a-LN".
- בדוק שכל השערים מתאימים לכל דגימה של קבוצת "b-spleen". כדי לנתח את מחזור התא בין תאי ה- BM (שליטה חיובית), לחץ במרכז השער "הרגוע" כדי להציג את התאים בחלקת נקודה עם DNA-A בציר x ו- Ki67 בציר ה- y.
- בדוק שכל השערים מתאימים לכל דגימה של 3 הקבוצות (כלומר, לתאים מטחול, LN ו- BM).
הערה: שער אוכלוסיית תאים בודדים (שלב 9.7) ושער מרובע למחזור התא (שלב 9.17) עשויים להיות קואורדינטות שער שונות בדגימות שונות, בעיקר בשל ההבדלים הקלים האפשריים של עוצמת הצבע Hoechst בין דגימות (סעיף 6.2). מסיבה זו, ייתכן שיהיה צורך לשנות את שער אוכלוסיית התא הבודד ואת שערי Quad עבור מחזור התא בכל מדגם. פעולה זו תיעשה באופן הבא: לחץ פעמיים על שם הקבוצה, והסר את הסינכרון ממאפייני הקבוצה. פעולה זו מאפשרת את שינוי השערים במדגם אחד מבלי לשנות את אותם שערים בכל הדגימות האחרות של הקבוצה. לאחר הסרת הסינכרון, שנה את השערים במידת הצורך. - כדי להציג באופן חזותי את התוצאות שהושגו על-ידי ניתוח זה, לחץ על עורך הפריסה במקטע רצועת הכלים של סביבת העבודה כדי לפתוח אותו. גרור כל שער של אסטרטגיית הג'יטינג בחלונית לדוגמה לעורך הפריסה, והצב את התוויות בהתאם לרצף אסטרטגיית הג'יטינג. במידת הצורך, שנה את סוג התרשים על-ידי לחיצה כפולה על התוויית התוויה המתאימה בפריסה ובחירת הסוג המתאים בחלון הגדרת גרף.
- לחץ על הקבוצה וחזר לפי פונקציות ברצועת הכלים לפריסה כדי לדמיין את התוצאות המתקבלות בכל איבר, ולהשוות דוגמאות שונות.
תוצאות
שלבי מחזור התאים של תאים מטחול, LNs ו- BM של עכברי Balb/c נותחו באמצעות צבע ה- DNA הפלואורסצנטי, Hoechst, ו- Anti-Ki67 mAb, על פי הפרוטוקול המסוכם באיור 1. כתמים אלה אפשרו את הבידול של תאים בשלבים הבאים של מחזור התא: G0 (Ki67neg, עם 2N של DNA המוגדרים כ- DNAlow), G1 (Ki67pos, DNAlow) ו- S-G2/M (Ki67pos, עם תוכן DNA המורכב בין 2N ל- 4N, או שווה ל- 4N של DNA המוגדר כ- DNAintermediate / גבוה).
ביצענו תחילה ניתוח מחזור תאים של תאי BM כדי לשחזר תוצאות שפורסמו בעבר13,14 ולאחר מכן ניתחנו את התאים מעניינים, כלומר, תאי CD8 T. איור 2 מציג דוגמה טיפוסית לניתוח מחזור תאים של תאי BM(איור 2A). הפרוטוקול הניב מקדם נמוך של וריאציה (CV) של פסגות DNA G0/ G1 ו- G2/ M, המציין את האיכות המצוינת של כתמי ה- DNA (איור 2B, המציג דוגמה עם קורות < 2.5; קורות העיר תמיד היו < 5 בכל הניסויים).
לאחר מכן יישמנו את אותו פרוטוקול על תאי CD8 T ספציפיים לאנטיגן מעכברים מחוסנים. עכברי BALB/c חוסנו נגד איסור הפרסום האנטיגן של HIV-1 באמצעות Chad3-gag עבור priming ו- MVA-gag לחיזוק, שניהם מהונדסים לשאת HIV-1 איסור פרסום. ביום (ד) 3 לאחר דחיפה, ניתחנו את התדירות של תאי CD8 T ספציפיים למחסום מהטחול ו- LNs מתנקז. ניצלנו את אסטרטגיית הגטינג החדשה שהוגדרה עבור תאי T בשלב המוקדם של התגובה החיסונית, אשר בניגוד לאסטרטגיה הקונבנציונלית, מתאימה לאיתור תאי CD8 T מגיבים אנטיגן מופעלים מאוד12. ביצענו את האסטרטגיה החדשה בחמישה שלבים הבאים. בשלב 1, לא כללנו מכפילים או אגרגטים על ידי שער DNA-A / -W, ובצעד 2, זיהינו תאים חיים על ידי אי הכללת סמן תא מת. בשלב 3, זיהינו את אוכלוסיית העניין באמצעות שער FSC-A / SSC-A לא קונבנציונאלי(איור 3A)במקום שער הלימפוציטים הצר הקנוני12. לאחר ההסתמכות על CD3+CD8+ תאים (שלב 4 באיור 3A), זיהינו תאי CD8 T ספציפיים למחסום באמצעות שני מולטימרים שונים של MHC, כלומר, Pent-gag ו- Tetr-gag (שלב 5 באיור 3A). השתמשנו בשני ריבוי מולטימרים במקום באחד כדי לשפר את הרגישות של זיהוי תאי CD8 T ספציפיים למחסום בעכברים מחוסנים, מבלי להגדיל את הרקע הכתים בעכברים לא מטופלים(איור 3B ו- C,שלב 5). לכן, הבחנו בהצלחה בעכברים לא מטופלים (0.00% ו-0.00% תאי CD8 T ספציפיים לאנטיגן ב- LNs וטחול, בהתאמה) מעכברים מחוסנים (0.46% ו-0.29% תאי CD8 T ספציפיים לאנטיגן ב- LNs וטחול, בהתאמה, איור 3B ו- C).
ראוי לציין, הפרוטוקול אפשר לנו רקע נמוך מאוד בשער תא CD8 T ספציפי אנטיגן של LNs וטחול של עכברים לא מטופלים (בדרך כלל 0.00% ובמקסימום 0.02%). ההשוואה של עלילות FSC-A / SSC-A ספציפיות למחסום הראתה כי לתאים הספציפיים למחסום היו SSC-A ו- FSC-A גבוהים (איור 3D),המאשרים את הצורך להשתמש בשער FSC-A / SSC-A "רגוע" כדי ללכוד תאים אלה. לאחר מכן הערכנו את האחוזים של תאי CD8 T ספציפיים למחסום בשלבי מחזור תאים שונים (איור 4A). מצאנו כי תאי CD8 T ספציפיים לטחול ואפילו יותר ב- LNs הניקוז הכילו שיעור גבוה של תאים בשלבי S-G2/ M ביום 3 לאחר דחיפה (18.60% ו 33.52%, בהתאמה).
יתר על כן, מצאנו כי תאי CD8 T ספציפיים למחסום בשלבי S-G2/ M היו FSC-A ו- SSC-A גבוהים, כאשר הם מכוסים על סך תאי CD8 T מאותו איבר (איור 4B). ביטוי CD62L על-ידי תאי CD8 T ספציפיים למחסום היה נמוך, כצפוי עבור תאי T מופעלים, למעט כמה תאים ב- G0 ב- LNs (איור 4C). בסך הכל, תוצאות אלה אישרו כי השער "הרגוע" (שלב 3 של איור 3A, B ו- C) נדרש לכלול את כל תאי ה- CD8 T הספציפיים לאנטיגן12. הפרוטוקול היה בעל ערך רב להערכת "תמונת מצב" של שלבי מחזור התא של תאי CD8 T ספציפיים לאנטיגן בזמן הניתוח ושל ביטוי CD62L לפי תאים בשלבי מחזור תאים שונים.

איור 1: ערכת הפרוטוקול לניתוח מחזור תאים של תאי CD8 T ספציפיים לאנטיגן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
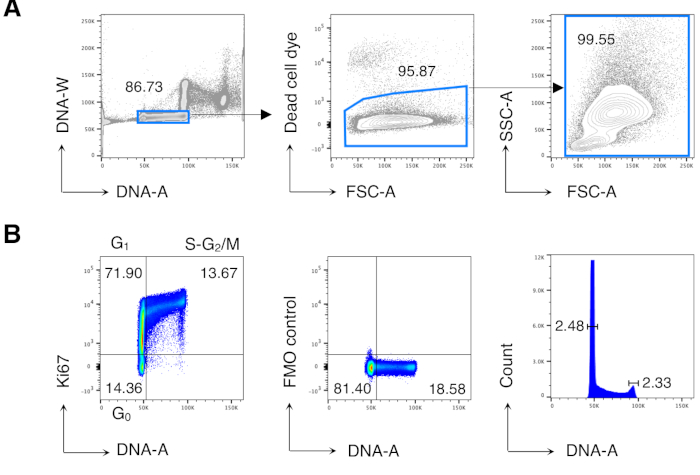
איור 2: ניתוח מחזור תאים של תאי BM. תאי BM מעכברי Balb/c לא מטופלים הוכתמו ונותחו על ידי ציטומטריית זרימה. (א) דוגמה לאסטרטגיית גטינג. גודרנו על תאים בודדים בחלקת ה- DNA-A / W (משמאל) ולאחר מכן על תאים חיים על ידי אי הכללת צבע תא מת (באמצע). לאחר מכן, שער FSC-A/SSC-A "רגוע" שימש עבור כל תאי ה- BM (מימין). (ב) דוגמה לניתוח מחזור תאים של תאי BM (משמאל). השתמשנו בשילוב של Ki67 וכתמי DNA כדי לזהות תאים בשלבים הבאים של מחזור התא: G0 (רבע שמאלי תחתון, תאי Ki67neg-DNAlow), G1 (רבע שמאלי עליון, Ki67pos-DNAlow), S-G2/M (רבע ימני עליון, Ki67pos-DNAintermediate/high). פלואורסצנטיות מינוס אחד (FMO) של Ki67 mAb (אמצע) והיסטוגרמה DNA (מימין) מוצגים. בעלילת היסטוגרמה של ה- DNA, השערים השמאליים והימנים תואמים ל- G0/ G1 ולשיא ה- DNA G2/ M, בהתאמה, והמספרים מייצגים את מקדמי השונות (קורות העיר) של כל פסגה. בכל התוויות האחרות, המספרים מייצגים אחוזי תאים בשערים שצוינו. האיור מראה 1 ניסוי מייצג מתוך 5. בכל ניסוי, ניתחנו תאי BM מ-3 עכברים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
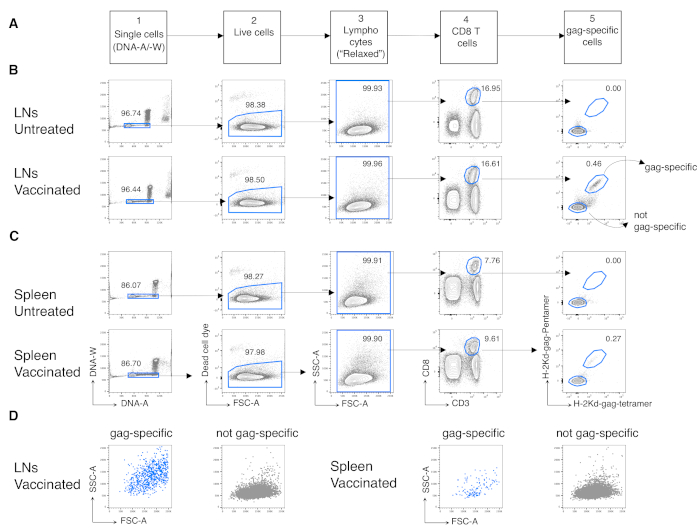
איור 3: ניתוח תאי CD8 T ספציפיים לאנטיגן מ-LNs וטחול. עכברי Balb/c היו מוכנים תוך שרירית (i.m.) עם צ'אד3-gag ועודד i.m. עם MVA-gag. ביום 3 לאחר דחיפה, ניקוז LN ותאי טחול מעכברי בקרה מחוסנים ולא מטופלים הוכתמו ונותחו על ידי ציטומטריית זרימה. (א) ערכה של אסטרטגיית הג'יטינג בחמישה שלבים לזיהוי תאים בודדים (שלב 1); תאים חיים (שלב 2); לימפוציטים (שלב 3); תאי CD8 T (שלב 4); ותאים ספציפיים למחסום (שלב 5). (B-C) דוגמה לחלקות: ניתוח תאים מ- (B) LNs ו- (C) טחול של עכברים לא מטופלים (עליונים) ומבוגרים (למטה). זיהינו תאים בודדים על עלילת DNA-A / -W בשלב 1. ואז, בשלב 2, בחרנו תאים חיים על ידי אי-הכללה של תאים מתים. בשלב 3, השתמשנו בשער "רגוע" לא קנוני ללימפוציטים. בשלב 4, זיהינו תאי CD8 T לפי הביטוי הכפול שלהם של CD3 ו- CD8. לאחר מכן זיהינו תאים ספציפיים למחסום ולא ספציפיים למחסום בשלב 5, בהתבסס על יכולתם לקשור את H-2kd-gag-Pentamer (Pent-gag) ו- H-2kd-gag-Tetramer (Tetr-gag), או לא, בהתאמה. (D) פרופילי FSC-A/SSC-A של תאים ספציפיים לבדיחה (כחול) ולא ספציפיים לחסימה (אפורה) לאחר ההסתה כמתואר לעיל. מספרים מייצגים אחוזי תאים בשערים שצוינו. האיור מראה 1 ניסוי מייצג מתוך 5. בכל ניסוי, ניתחנו טחול משותף ואיחדנו תאי LN מ-3 עכברים מחוסנים ו-3 עכברים לא מטופלים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
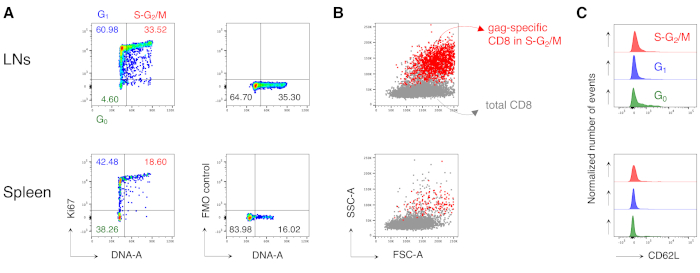
איור 4: ניתוח מחזור תאים של תאי CD8 T ספציפיים לאנטיגן. עכברים חוסנו כמו באיור 3 וניתוח מחזור התאים של תאים ספציפיים למחסום ערך ביום השלישי לאחר הדחיפה, לאחר שצעדו ב-5 שלבים כמו באיור 3. (A)דוגמה לניתוח מחזור תאים של תאי CD8 T ספציפיים ל- LNs (למעלה) וטחול (למטה) של עכברים מחוסנים. שלבי מחזור התא זוהו באיור 2B. הלוחות מייצגים תאים ב- G0, ב- G1, וב- S-G2/M (משמאל) ובפלואורסצנטיות מינוס אחד (FMO) של Ki67 mAb (מימין). מספרים מייצגים אחוזי תאים בשערים שצוינו. (B) התוויות נקודות FSC-A/SSC-A המציגות תאי CD8 T ספציפיים למחסום בשלבי S-G2/M (באדום) עם כיפה על סך כל תאי CD3+CD8+ T (באפור) מ- LNs (למעלה) וטחול (למטה) של עכברים מחוסנים. (ג) היסט היסטוגרמה המציגה ביטוי CD62L על-ידי תאי CD8 T ספציפיים למחסום ב- G0 (ירוק), ב- G1 (כחול) וב- S-G2/M (אדום) מ- LNs (למעלה) וטחול (למטה) של עכברים מחוסנים. צירי ה- y מציינים מספר אירועים מנורמל. האיור מציג דוגמה מייצגת אחד מתוך 5 ניסויים עצמאיים עם סך של 15 עכברים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
חומר משלים: הגדרות ציטומטר זרימה. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
למרות התרחבות ציפורן תא T נחקרה באופן אינטנסיבי, היבטים מסוימים עדיין לא ידוע, בעיקר משום שהכלים הזמינים לחקור אותו הם מעטים ויש להם חסרונות משלהם. מנקודת מבט זו, הקמנו שיטה ציטומטרית זרימה רגישה מאוד כדי לנתח מחזור תאים של תאי CD8 T ספציפיים אנטיגן בזמנים מוקדמים לאחר החיסון במודל עכבר. הפרוטוקול מבוסס על שילוב של Ki67 וכתמי DNA, אשר שימש בעבר כדי לנתח את מחזור התא של תאים hematopoietic BM בעכברים13,14. כדי להתאים את הפרוטוקול לתאי CD8 T ספציפיים לאנטיגן, היינו צריכים לשקול כמה בעיות קריטיות, כולל בחירת צבע ה- DNA, התנאים המתאימים להשגת כתמי DNA דומים על פני דגימות שונות, ואסטרטגיית הגינג לניתוח נתונים.
צבעים רבים זמינים עבור כתמי DNA, כולל פרופידיום יודיד ו 7-אמינוקטינומיצין D; בחרנו בהוכסט מכיוון שהוא התאים להכתמת הממברנה ולפרוטוקול הקיבעון / permeabilization המתון הנדרש להכתמת Ki 67. יחד עם זאת, הכתמה עם Hoechst אפשר לנו להשיג היסטוגרמה DNA באיכות מעולה, כלומר, G0/ G1 ו- G2/ M DNA פסגות היה מקדם נמוך בהרבה של וריאציה (קורות רה"ב) מאשר פסגות DNA בדרך כלל מתקבל עם צבעי DNA אחרים, למשל, DRAQ519. ואכן, Hoechst יכול להכתים DNA אפילו בתאים חיים20.
כמה אסטרטגיות שימשו כדי למנוע את התנודתיות בעוצמת Hoechst בדגימות שונות של אותו ניסוי. כתמי הוצ'סט בוצעו ממש לפני רכישת מדגם בציטומטר הזרימה כדי למזער את הירידה בעוצמת הצבע בזמן. למעוניינים לשחזר את הפרוטוקול בניסויים גדולים עם דגימות רבות, אנו ממליצים לבצע הכתמת Hoechst על כמה דגימות בכל פעם. חיסרון נוסף הוא כי עוצמת Hoechst יכול להיות מושפע בכבדות על ידי מספר התא במהלך דגירה עם הצבע. מסיבה זו, אנו ממליצים בחום להשתמש תמיד באותו מספר תאים ובאותו נפח לכל דגימה להכתמת DNA. אם נדרש מספר גבוה של תאים לרכישה בציטומטר הזרימה, אנו ממליצים להכין שתי דגימות זהות או יותר ולאחר מכן למזג אותן ממש לפני שלב הכתמת הוכשט.
נקודת מפתח בפרוטוקול היא אסטרטגיית הג'יטינג לניתוח נתונים. לאחרונה פרסמנו אסטרטגיה חדשנית לניתוח תאי T בזמנים מוקדמים של התגובה החיסונית, אשר אפשרה לנו להגביר את הרגישות של זיהוי של תאי T ספציפיים אנטיגן12. יישמנו אסטרטגיה זו על הנתונים המוצגים כאן כדלקמן. ראשית, שללנו אגרגטים של תאים במזימת ה-DNA-A/W. שנית, לאחר שקבענו תאים מתים, השתמשנו בשער לימפוציטים גדול למדי בחלקת FSC / SSC ("שער רגוע"). על ידי אסטרטגיה זו, הצלחנו לכלול תאי CD8 T ספציפיים אנטיגן מופעלים מאוד ב- S-G2/ M כי הם בדרך כלל החמיצו על ידי אסטרטגיות gating הנוכחי, כמו תאים אלה יש FSC-A גבוה SSC-A ו- SSC-A. לסיכום, ניתוח הנתונים מייצג חלק קריטי של השיטה, אשר חיוני כדי לקבל זיהוי רגיש של תאי T מופעלים / מתרבים.
השיטה מונעת את האפשרות של חסר נתוני תאי T קריטיים בשלבים מוקדמים של התגובה החיסונית ופותחת פרספקטיבות חדשות לניטור חיסוני של תאי T. שיפור עתידי עשוי להיות לכלול כתמים עבור phospho-histone 3 שיאפשר הבחנה בין G2 ו- M21. המגבלה הנוכחית היא כי תאים צריכים להיות קבועים permeabilized כדי להכתים עבור הסמן הגרעיני, Ki67. לפיכך, תאים לא יכולים לשמש עבור סוגים אחרים של ניתוח כגון מיון וניתוח פונקציונלי עוקב. יתר על כן, צבעי DNA, כולל Hoechst, בדרך כלל להפריע ניתוח DNA גנומי ואינם מתאימים לסוג זה של הערכה. זיהוי של סמני ממברנה התואמים עם שלבי מחזור תאים שונים וזה יכול להיות מוכתם על תאים חיים יכול להתגבר על מגבלה זו. לסיכום, לשיטה פוטנציאל רב להערכת תאי T פעילים/מתרבים במספר הקשרים כגון חיסון, זיהום, מחלות בתיווך אימונו וטיפול אימונו.
Disclosures
א. Folgori ו S. Capone הם עובדים של ריית'רה סרל. א ניקוסיה נקרא ממציא על בקשת פטנט WO 2005071093 (A3) "שימפנזה אדנווירוס חיסון נשאים." למחברים האחרים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי ריית'רה, על ידי פרויקט MIUR 2017K55HLC_006, ועל ידי 5 × 1000 מענק מ Associazione איטלקית רייסרקה סול Cancro (AIRC). הטטרמר הבא הושג באמצעות מתקן NIH Tetramer: H-2K מצומד APC (ד) בדיחת HIV 197-205 AMQMLKETI.
Materials
| Name | Company | Catalog Number | Comments |
| 1-200 μL universal fit bulk packed pipet tips | Corning | CLS4866-1000EA | |
| 2.4G2 anti-FcγR mAb | BD | 553141 | 10 μg/ml final concentration |
| 5 ml syringe plunger | BD Emerald | 307733 | |
| 15 ml conical tubes | MercK Millipore | SBHA025SB | |
| 60 mm TC-treated Cell Culture Dish | Falcon | 353002 | |
| 70 μm cell strainer | Falcon | 352097 | |
| 96-well Clear Round Bottom TC-treated Culture Microplate | Falcon | 353077 | |
| Anti-Rat/Hamster Ig,k/Negative Control Compensation Particles | BD- Bioscience | 552845 | |
| Beta-mercaptoethanol | Sigma | M3148 | |
| Bovine Serum Albumin | Sigma | A07030 | |
| BUV805 Rat Anti-Mouse CD8a | BD- Bioscience | 564920 | 4 μg/ml final concentration |
| Dulbecco's Phosphate Buffer Saline w/o Calcium w/o Magnesium | Euroclone | ECB4004L | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120159 | |
| Ethanol | Sigma | 34852-1L-M | |
| Ethylenediaminetetraacetic Acid Disodium Salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum | Corning | 35-079-CV | |
| Filcon, Sterile, Syringe-Type 70 μm | Falcon | 352350 | |
| Fixable Viability Dye eFluor 780 | eBioscience | 65-0865-14 | 1:1000 final concentration |
| Foxp3 / Transcription Factor Staining Buffer Set | eBioscience | 00-5523-00 | This Set contains fixation/permeabilization concentrate and diluent, and permeabilization buffer 10x |
| H-2k(d) AMQMLKETI allophycocyanin (APC)-labelled tetramer | provided by NIH Tetramer Core Facility | 6 μg/ml final concentration | |
| H-2k(d) AMQMLKETI phycoerythrine (PE) labelled pentamer | Proimmune | F176-2A-E - 176 | 10 μL / sample |
| Hoechst 33342, Trihydrochloride, Trihydrate - 10 mg/mL Solution in Water | ThermoFisher | H3570 | |
| Ki-67 Monoclonal Antibody (SolA15), FITC | eBioscience | 11-5698-82 | 5 μg/ml final concentration |
| L-Glutamine 100X (200 mM) | Euroclone | ECB3000D | |
| Millex-HA Filters 0,45 µm | BD | 340606 | |
| Penicillin/Streptomycin 100X | Euroclone | ECB3001D | |
| PE/Cyanine7 anti-mouse CD62L Antibody | Biolegend | 104418 | 0.2 μg/ml final concentration |
| PerCP-Cy™5.5 Hamster Anti-Mouse CD3e | BD- Bioscience | 551163 | 4.4 μg/ml final concentration |
| Red Blood Cell Lysis Buffer | Sigma | R7757 | |
| Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352058 | |
| RPMI 1640 Medium without L-Glutamine with Phenol Red | Euroclone | ECB9006L | |
| Software package for analyzing flow cytometry data | FlowJo | v.10 | |
| Software for acquisition of samples at flowcytometer | BD FACSDiva | v 6.2 | |
| Trypan Blue Solution | Euroclone | ECM0990D |
References
- Castellino, F., et al. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440 (7086), 890-895 (2006).
- Zhang, N., Bevan, M. J. CD8(+) T cells: foot soldiers of the immune system. Immunity. 35 (2), 161-168 (2011).
- Bajénoff, M., et al. Highways, byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunology. 28 (8), 346-352 (2007).
- Bevan, M. J., Fink, P. J. The CD8 response on autopilot. Nature Immunology. 2 (5), 381-382 (2001).
- Van Stipdonk, M. J., Lemmens, E. E., Schoenberger, S. P. Naïve CTLs require a single brief period of antigenic stimulation for clonal expansion and differentiation. Nature Immunology. 2 (5), 423-429 (2001).
- Kaech, S. M., Wherry, E. J., Ahmed, R. Effector and memory T-cell differentiation: implications for vaccine development. Nature Review Immunology. 2 (4), 251-262 (2002).
- Beverley, P. C. Primer: making sense of T-cell memory. Nature Clinical Practice Rheumatology. 4 (1), 43-49 (2008).
- Parretta, E., et al. CD8 cell division maintaining cytotoxic memory occurs predominantly in the bone marrow. Journal of Immunology. 174 (12), 7654-7664 (2005).
- Di Rosa, F. Maintenance of memory T cells in the bone marrow: survival or homeostatic proliferation. Nature Review Immunology. 16 (4), 271 (2016).
- Di Rosa, F. Two niches in the bone marrow: a hypothesis on life-long T cell memory. Trends in Immunology. 37 (8), 503-512 (2016).
- Di Rosa, F. Commentary: Memory CD8(+) T cells colocalize with IL-7(+) stromal cells in bone marrow and rest in terms of proliferation and transcription. Frontiers in Immunology. 7, 102 (2016).
- Simonetti, S., et al. Antigen-specific CD8 T cells in cell cycle circulate in the blood after vaccination. Scandinavian Journal of Immunology. 89 (2), 12735 (2019).
- Wilson, A., et al. c-Myc controls the balance between hematopoietic stem cell self-renewal and differentiation. Genes & Development. 18 (22), 2747-2763 (2004).
- Hirche, C., et al. Systemic virus infections differentially modulate cell cycle state and functionality of long-term hematopoietic stem cells in vivo. Cell Report. 19 (11), 2345-2356 (2017).
- Colloca, S., et al. Vaccine vectors derived from a large collection of simian adenoviruses induce potent cellular immunity across multiple species. Science Translational Medicine. 4 (115), (2012).
- Di Lullo, G., et al. Marker gene swapping facilitates recombinant Modified Vaccinia Virus Ankara production by host-range selection. Journal of Virological Methods. 156 (1-2), 37-43 (2009).
- Di Lullo, G., et al. The combination of marker gene swapping and fluorescence-activated cell sorting improves the efficiency of recombinant modified vaccinia virus Ankara vaccine production for human use. Journal of Virological Methods. 163 (2), 195-204 (2010).
- . Mouse phenotype Available from: https://www.mousephenotype.org/data/secondaryproject/3i (2020)
- Yoon, H., Kim, T. S., Braciale, T. J. The cell cycle time of CD8+ T cells responding in vivo is controlled by the type of antigenic stimulus. PLoS One. 5 (11), 15423 (2010).
- Pauklin, S., Vallier, L. The cell-cycle state of stem cells determines cell fate propensity. Cell. 155 (1), 135-147 (2013).
- Vignon, C., et al. Flow cytometric quantification of all phases of the cell cycle and apoptosis in a two-color fluorescence plot. PLoS One. 8 (7), 68425 (2013).
Erratum
Formal Correction: Erratum: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice
Posted by JoVE Editors on 11/03/2021. Citeable Link.
An erratum was issued for: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice. The Authors section and a figure were updated.
The authors section was updated from:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
* These authors contributed equally
To:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2,6, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
6IRCCS, Neuromed
* These authors contributed equally
Figure 1 was updated from:
Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.
To:

Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved