A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
3D תא מודפס סרטן היפוקסי על שבב עבור recapitulating התקדמות פתולוגית של סרטן מוצק
* These authors contributed equally
In This Article
Summary
היפוקסיה היא סימן ההיכר של microenvironment הגידול ממלא תפקיד מכריע בהתקדמות הסרטן. מאמר זה מתאר את תהליך הייצור של סרטן היפוקסי על שבב המבוסס על טכנולוגיית הדפסת תאים 3D כדי לשחזר פתולוגיה הקשורות היפוקסיה של סרטן.
Abstract
מיקרו-וירוס סרטן יש השפעה משמעותית על התקדמות המחלה. בפרט, היפוקסיה היא המניע העיקרי של הישרדות סרטן, פלישה, ו chemoresistance. למרות מספר מודלים במבחנה פותחו כדי ללמוד פתולוגיה סרטן הקשורות היפוקסיה, יחסי הגומלין המורכבים של microenvironment סרטן שנצפו vivo לא שוחזר עדיין בשל חוסר שליטה מרחבית מדויקת. במקום זאת, גישות biofabrication 3D הוצעו כדי ליצור מערכות מיקרופיזיולוגיות עבור חיקוי טוב יותר של אקולוגיה סרטן והערכה מדויקת טיפול נגד סרטן. בזאת, אנו מציעים גישה של הדפסת תאים בתלת-ממד כדי ליצור סרטן היפוקסי על שבב. הרכיבים מעוררי היפוקסיה בשבב נקבעו על סמך הדמיית מחשב של התפלגות החמצן. טבעות קונצנטריות סרטן סטרומה הודפסו באמצעות bioinks המכילים תאים גליובלסטומה ותאי אנדותל כדי לסכם סוג של סרטן מוצק. השבב וכתוצאה מכך הבין היפוקסיה מרכזית ממאירות בנסיבות מחמירות בסרטן עם היווצרות של סמנים פתופיזיולוגיים מייצגים. בסך הכל, הגישה המוצעת ליצירת מערכת מיקרופיזיולוגית מוצקה-סרטן-מימטית צפויה לגשר על הפער בין מודלים in vivo ו in vitro לחקר הסרטן.
Introduction
microenvironment סרטן הוא גורם קריטי המניע את התקדמות הסרטן. רכיבים מרובים, כולל רמזים ביוכימיים, ביופיזיים ותאית, קובעים את התכונות הפתולוגיות של סרטן. בין אלה, היפוקסיה קשורה קשר הדוק עם הישרדות סרטן, התפשטות, פלישה1. בשל הצמיחה הבלתי מוגבלת וחלוקה של תאים סרטניים, חומרים מזינים וחמצן מתרוקנים ברציפות, שיפוע היפוקסי נוצר. בתנאים של חמצן נמוך, תאים מפעילים גורם שעתוק היפוקסיה-בלתי ניתן להקרבה (HIF) הקשורים מפל מולקולרי. תהליך זה גורם לליבה נמקית, מפעיל שינויים מטבוליים, ויוזם היפרפלזיה של כלי דם וגרורות2,3. לאחר מכן, היפוקסיה בתאים סרטניים גורמת להרס של רקמות נורמליות שכנות. יתר על כן, היפוקסיה קשורה קשר הדוק עם ההתנגדות הטיפולית של גידולים מוצקים בנימוסים רב-גורמיים. היפוקסיה עלולה לעכב קשות הקרנות, כמו רגישות רדיו מוגבלת בשל מינים חמצן תגובתי1,4. בנוסף, זה מקטין את רמות ה- pH של microenvironments סרטן, אשר מקטין הצטברות תרופות1. לכן, שחזור תכונות פתולוגיות הקשורות היפוקסיה במבחנה היא אסטרטגיה מבטיחה עבור ממצאים מדעיים פרה קליניים.
מידול microenvironment מסוים של סרטן חיוני להבנת התפתחות סרטן וחקר טיפולים מתאימים. למרות מודלים בעלי חיים כבר בשימוש נרחב בגלל הרלוונטיות הפיזיולוגית החזקה שלהם, נושאים הקשורים הבדלים מינים ובעיות אתיות קיימים5. יתר על כן, למרות מודלים קונבנציונליים 2D ו 3D לאפשר מניפולציה והדמיה בזמן אמת של תאים סרטניים לניתוח מעמיק, המורכבות האדריכלית והתאית שלהם לא ניתן לשחזר באופן מלא. לדוגמה, מודלים ספירואיד סרטן כבר בשימוש נרחב, כמו צבירת תאים סרטני בספרואיד יכול באופן טבעי ליצור היפוקסיה בליבה. יתר על כן, מספר גדול של ספרואידים סלולריים בגודל אחיד יוצרו באמצעות מערכות מולטי-באר מבוססות פלסטיק או סיליקון6,7. עם זאת, הגמישות הנמוכה יותר לגבי לכידת המבנה ההטרוגני המדויק של רקמות סרטניות עם פלטפורמות קונבנציונליות דרשה הקמת טכנולוגיית biofabrication מתקדמת כדי לבנות פלטפורמה ביומימטית מאוד כדי לשפר את חקר הסרטן8.
מערכות מיקרופיזיולוגיות תלת מימדיות (MPSs) הן כלים שימושיים לסיכום הגיאומטריה המורכבת וההתקדמות הפתולוגית של תאים סרטניים9. כמו תאים סרטניים לחוש את השיפוע הביוכימי של גורמי גדילה וכימוקינים ואת ההטרוגניות המכנית לשכפל על המערכת, תכונות חשובות של התפתחות סרטן ניתן לחקור במבחנה. לדוגמה, כדאיות סרטן, ממאירות גרורתית, עמידות לתרופות בהתאם ריכוזי חמצן משתנים נחקרה באמצעות MPSS10,11. למרות ההתקדמות האחרונה, יצירת תנאים היפוקסיים של מודלים במבחנה מסתמכת על הליכי ייצור מורכבים, כולל חיבור עם משאבות גז פיזיות. לכן, יש צורך בשיטות פשוטות וגמישות לבניית מיקרו-וירוסים ספציפיים לסרטן.
טכנולוגיית הדפסת תאים תלת מימדית זכתה לתשומת לב רבה בגלל השליטה המדויקת שלה בסידור המרחבי של ביו-חומרים לסיכום ארכיטקטורות ביולוגיות מקומיות12. בפרט, טכנולוגיה זו מתגברת על המגבלות הקיימות של מודלים היפוקסיה 3D בשל השליטה הגבוהה שלה ואת ההיתכנות לבניית התכונות המרחביות של microenvironment סרטן. הדפסה תלת-ממדית גם מאפשרת ייצור בעזרת מחשב באמצעות תהליך שכבה אחר שכבה, ובכך מספקת בנייה מהירה, מדויקת וניתן לשחזור של גיאומטריות מורכבות כדי לחקות ארכיטקטורות רקמות בפועל. בנוסף ליתרונות של אסטרטגיות ייצור קיימות עבור MPSs 3D, התכונות הפתופיזיולוגיות של התקדמות סרטן ניתן לשחזר על ידי דפוס הרכיבים הביוכימיים, הסלולר, וביופיזי13,14.
בזאת, אנו מציגים אסטרטגיית הדפסת תאים תלת-ממדית עבור סרטן היפוקסי על שבב לסיכום ההטרוגניות של סרטן מוצק (איור 1)15. פרמטרי הייצור נקבעו באמצעות סימולציה חישובית של היווצרות היפוקסיה מרכזית במערכת. טבעות קונצנטריות סרטן סטרומה הודפסו באמצעות bioinks קולגן המכילים תאים גליובלסטומה ותאי אנדותל לחקות את הפתופיזיולוגיה של גליובלסטומה, סוג של סרטן מוצק. היווצרות של שיפוע חמצן רדיאלי מחמירות ממאירות סרטן, המציין תוקפנות מחוזקת. יתר על כן, אנו מציינים פרספקטיבות עתידיות עבור היישומים של השבב למודלים פרה-קוליניים ספציפיים למטופל. הגישה המוצעת ליצירת מערכת מיקרופיזיולוגית מוצקה-סרטן-מימטית צפויה לגשר על הפער בין מודלים in vivo ו במבחנה של סרטן.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הדמיית מחשב של היווצרות שיפוע חמצן
-
יצירת מודל גיאומטריה תלת-ממדית להדפסת סרטן על שבב היפוקסי
- הפעל תוכנת CAD תלת-ממדית.
- שרטט את המודל הגיאומטרי של סרטן היפוקסי על שבב. לחץ על סקיצה ובחר את המישור הרצוי כדי לצייר את הגיאומטריה. עיין בציור (איור 2A) לקבלת קנה המידה של הפרטים של כל חלק.
- הגדר את עובי הגיאומטריה על ידי לחיצה על בוס/בסיס בולט תכונה. הזינו את העובי הרצוי (עיין באיור 2A)בתיבה הריקה ובחרו בסמל הסימון הירוק ליצירת הגיאומטריה בתלת-ממד.
הערה: הממד של הסרטן על שבב מוגדר בהתבסס על הנפחים הרצויים של מדיה הידרוג'ל. בניסוי הנוכחי, הכרכים הרצויים של מדיה הידרוג'ל היו כ 1,500 μL ו 500 μL, בהתאמה, בהתבסס על החוויות המעשיות הקודמות לפתרון של ביופרינט מבוסס שחול. - שמור את קובץ הגיאומטריה כתבנית קובץ CAD תלת-ממדית ( .prt או .stl).
-
קביעת צפיפות הסלולר לגיוס ליבה היפוקסית
- הפעל תוכנית הדמיית דיפוזיה פיזית.
- לחץ על LiveLink ובחר את תוכנית CAD בשימוש. לחץ על סנכרן כדי לייבא את הגיאומטריה של סרטן היפוקסי על שבב על תוכנית הסימולציה. מכיוון שהמרחב הפנימי של התא יתמלא במדיום תרבותי בסביבה ניסיונית ממשית, החמצן יתפזר בחלל הפנימי של התא ובמבנה התאי, שיורכב מהידרוגלים עמוסי תאים.
הערה: עיין במחקר הקודם לקבלת פרטים על הפרמטרים הפיזיים15. - הגדירו את הגיאומטריה בתלת-ממד המיובאת כנפח בקרה של החלל שבו מפזר החמצן, והתאים צורכים חמצן (איור 2B).
- הפעל ניתוח מחשב לניתוח פיזור גז בעקבות מדריך למשתמש ושיטות שנקבעו בעבר16,17.
- מתוצאות ניתוח המחשב, יש לייצא את נתוני ריכוז החמצן המשוערים על פני A-A' חתך רוחב בכל נקודת זמן בעקבות המדריך למשתמש. המשוואה השלטת מבוססת על החוק הראשון של פיק, כפי שבא לידי ביטוי ב-Eq. (1) (איור 2C).
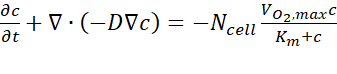
כאשר c הוא הריכוז, D הוא מקדם פיזור החמצן, תא N הוא הצפיפות של התאים, הוא קצב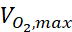 החמצן המרבי, וק"מ הוא קבוע מיכאליס-מאנטן. הקבועים הוחלו כמתואר בפרסום הקודם15.
החמצן המרבי, וק"מ הוא קבוע מיכאליס-מאנטן. הקבועים הוחלו כמתואר בפרסום הקודם15.
הערה: כל נקודת זמן פירושה נקודת צעד כדי לבחון שינוי דיפוזיה חמצן לאורך זמן. - להעריך אם רמת החמצן המינימלית מגיעה לסף של היפוקסיה ולחזור על תהליך ניתוח המחשב עם תוספת או צמצום של צפיפות הסלולר.
הערה: הגדר כי שיפוע היפוקסיה נוצר במבנה אם רמת החמצן של 80% באזור הידרוג'ל הוא פחות מ 0.02 מ"מ לאחר 24 שעות. - אשר את מספר התאים הדרושים כדי ליצור את היפוקסיה גרימת חמצן באזור המרכז מהחוק הראשון של פיק בשלב 1.2.5 ואת תוצאות הסימולציה משלב 1.2.6.
הערה: בפרוטוקול זה, מספר התא היה 2 × 106 תאים / כל מבנה.
2. תרבות התאים של תאים סרטניים ותאי סטרומה
-
הכנת מדיה של תרבות התא כדי למנוע מתח פיזיולוגי
- עבור תאי U-87 MG (קו תא גליובלסטומה אנושי מונצח), מקום 12 מ"ל של מדיום הנשר שונה של גלוקוז גבוה Dulbecco המכיל 10% סרום שור עוברי, 100 U/mL פניצילין, ו 100 מיקרוגרם / מ"ל סטרפטומיצין בבקבוקון תרבות התא T-75 ב 37 °C (77 °F), 5% CO2 חממה לחה במשך 30 דקות כדי למזער את ההשפעות התרמיות ואלקליין של המדיום על התאים.
הערה: גליובלסטומה נבחרה כסוג של סרטן מוצק כי יש לה מאפיינים אגרסיביים בסביבה היפוקסית. סוגים שונים אחרים של סרטן ניתן להחיל על מודל זה. - לתאי אנדותל ורידים טבוריים אנושיים (HUVECs), יש למקם 12 מ"ל של מדיום צמיחת תאי אנדותל בבקבוקון תרבית תאים T-75 באינקובטור לח CO2 ב-37 °C (70°C) למשך 30 דקות.
הערה: HUVECs נבחרו מכיוון שזהו אחד מקווי התאים האנדותל המייצגים ביותר. סוגים שונים של תאים סטרומה ניתן להחיל גם על מודל זה.
- עבור תאי U-87 MG (קו תא גליובלסטומה אנושי מונצח), מקום 12 מ"ל של מדיום הנשר שונה של גלוקוז גבוה Dulbecco המכיל 10% סרום שור עוברי, 100 U/mL פניצילין, ו 100 מיקרוגרם / מ"ל סטרפטומיצין בבקבוקון תרבות התא T-75 ב 37 °C (77 °F), 5% CO2 חממה לחה במשך 30 דקות כדי למזער את ההשפעות התרמיות ואלקליין של המדיום על התאים.
-
הפשרה מהירה של תאים סרטניים cryopreserved ותאים סטרומה ותחזוקתם
- להעביר cryovials המכיל 5 x 105 U-87 תאי MG ו HUVECs ממיכל חנקן נוזלי לארון זרימה למינארי. מיד לשחרר מחדש את הכובע כדי לשחרר את הלחץ הפנימי.
- מניחים בעדינות את התאים cryopreserved באמבט מים ב 37 מעלות צלזיוס במשך 2 דקות, שמירה על הכובע מחוץ למים. לשטוף את הבקבוקונים עם 70% אתנול תחת זרימת למינאר כדי למנוע זיהום.
- מעבירים את התאים המופשרים לבקבוקים המכילים את מדיית תרבות התאים המוכנה המתוארת בשלב 2.1 ומניחים את הבקבוקים המכילים תאים באינקובטור לח 5% CO2 ב 37 מעלות צלזיוס להתאוששות התא.
- רענן את מדיית תרבות התאים כל יומיים ושמור על צמיחת התאים.
- לאחר 24 שעות של הפשרה, להחליף את התקשורת תרבות התא כדי למנוע ציטוקסיות של דימתיל סולפוקסיד (DMSO), אשר שימש להקפאת תאים. השתמש ב- HUVECs, שעברו פחות מ- 6 קטעים.
3. הכנת תמיסת קולגן טרום ג'ל
-
סולוביליזציה של ספוג קולגן עם 0.1 N חומצה הידרוכלורית (HCl)
- הכן פתרון של 0.1 N HCl וסנן אותו עם מסנן מזרק 0.2 מיקרומטר.
- עבור 3 מ"ל של 1% (w / v) פתרון פרגן טרום ג'ל מנוטרל, להכין ספוגים קולגן לחתוך 5 x 5 מ"מ2 חתיכות ומשקלו 30 מ"ג.
- מעבירים את חתיכות הקולגן החתוכות לבקבוקון זכוכית סטרילי של 10 מ"ל.
הערה: הכן נפח פי 1.5 של הידרוג'ל הקולגן הנדרש, בהתחשב באובדן ההידרוגל בשל המאפיין הדביק של פתרון הקולגן. - הוסף 2.4 מ"ל של 0.1 N HCl לתוך בקבוקון זכוכית המכיל קולגן ולהדגיר אותו על הנדנדה ב 15 סל"ד ו 4 מעלות צלזיוס במשך 3 ימים.
הערה: הנפח של פתרון 0.1 N HCl היה ארבע חמישיות מהנפח הסופי של הידרוג'ל קולגן נדרש. במקרה זה, 3 מ"ל של קולגן הוכן. - לאחר העיכול, מסננים את חלקיקי הקולגן הלא מעוכלים באמצעות מסננת תאים של 40 מיקרומטר. יש לאחסן את תמיסת הקולגן החומצי ב-4 מעלות צלזיוס ולהשתמש בה תוך 7 ימים.
-
התאמת pH לתמיסת קולגן טרום ג'ל מנוטרלת של 1%
- צנטריפוגה פתרון קולגן חומצי ב 1224 x g במשך 5 דקות ב 4 מעלות צלזיוס.
- הוסף 30 μL של פתרון אדום פנול כמחוון pH לריכוז הסופי של 1% (v / v) ו 300 μL של 10x פוספט אגירה מלוחים (PBS) מאגר לריכוז הסופי של 10% (v / v) בתמיסת קולגן מראש ג'ל.
- לנטרל את ה- pH ל 7 עם 1 N נתרן הידרוקסידי (NaOH), אימות שינוי הצבע.
הערה: בהתבסס על הנוסחה, שומות H+ = טוחנות H+ x נפח H+ = שומות OH-= טוחנות OH- x נפח OH-, להוסיף 240 μL של NaOH. - הוסף מים מזוקקים כדי לקבל נפח כולל של 3 מ"ל.
- לאחר התאמת pH, לאחסן את 1% (w / v) פתרון פרגן טרום ג'ל מנוטרל ב 4 מעלות צלזיוס ולהשתמש בתוך 3 ימים.
הערה: כדי לבדוק מראש את הג'לציה של תמיסת קולגן טרום ג'ל מנוטרל, לעשות 50 טיפות קולגן μL על צלחת קטנה באמצעות פיפטה תזוזה חיובית דגירה אותם באינקובטור 37 מעלות צלזיוס במשך 1 שעות. עיין בשלוש השיטות הבאות כדי לאמת את ההצלבה של טיפות קולגן. - בדקו אם צבע הקולגן השתנה ללבן אטום מצבע שקוף.
- הטה את המיכל ובדוק אם הקולגן דבק בתחתית המיכל.
- יוצקים 1x PBS על הטיפות ולבדוק אם מבנה הקולגן אינו שבור בתמיסה.
4.3D הדפסת מחסום חדיר לגז
-
הדפסה תלת-ממדית של תבנית פולי הקרבה (אתילן-ויניל אצטט) (PEVA)
- צור את הגיאומטריה תלת-ממדית של תבנית PEVA המוקרבת המוגדרת בשלב 1 באמצעות תוכנת CAD תלת-ממדית (איור 3A).
הערה: הגיאומטריה בתלת-ממד וקנה המידה המפורט של הדגם, כולל ממדים, יחידות וסוגי קווים, הוצגו באיור 2A. - המר את קובץ ה- CAD תלת-ממדי לתבנית קובץ STL על-ידי לחיצה על קובץ | סוג קובץ שמירה כ- STL. כמו כן, לחץ על אפשרות | טופס פלט כ- ASCII ליצירת קוד G.
- לחץ על קובץ | פתח את קובץ STL ובחר את קובץ ה- STL שנשמר כדי לייבא את קובץ ה- STL שנוצר. לחצו על דגם פרוסה של מחליף STL-CAD כדי ליצור אוטומטית את קוד ה-G של תבנית PEVA(איור 3B, C).
הערה: נתיב ההדפסה נוצר עם חיבור של נקודות מצטלבות בין האיור הבסיסי של קובץ STL לבין מישור ההחלקה (כלומר, שכבה). בעיקרון, הדמות הבסיסית של קטע בקובץ STL היא משולש המכיל את הקואורדינטות תלת-ממדיות. לאחר קבלת הנקודות המצטלבות בין המשולש לשכבה, נוצר קוד G להדפסה על-ידי חיבור כל נקודה ללא נתיב חופף בשכבה18. כל אלגוריתם יצירת קוד G בתוכנה הלוח יכול לשמש כדי ליצור נתיבי הדפסה עבור ייצור השבב. - הכינו שקופית היסטולוגיה סטרילית והידרופילית.
הערה: זכוכית שקופית הידרופילית היא קריטית עבור מליטה קבועה של polydimethylsiloxane (PDMS) על הזכוכית ואת הדבקות של קולגן בונה אנקפסולציה תאים סרטניים ותאים סטרומה. - הדפס את תבנית PEVA ההקרבה על השקופית עם זרבובית דיוק 50 G בלחץ פנאומטי של 500 kPa ב 110 °C (60 °F).
הערה: רוחב הקו מושפע מקצב ההזנה, מד הזרבובית והטמפרטורה של החומר. נעשה שימוש זרבובית 50 G וקצב הזנה של 400 הוחל כדי ליצור רוחב קו 500 מיקרומטר עבור קיר ההקרבה. מד הזרבובית, הלחץ הפנאומטי וקצב ההזנה מוגדרים עם תוצאות מעשיות19. קיר ההקרבה צריך להיות עבה מספיק כדי להחזיק את פתרון PDMS, שהוא שלב הייצור הבא.
- צור את הגיאומטריה תלת-ממדית של תבנית PEVA המוקרבת המוגדרת בשלב 1 באמצעות תוכנת CAD תלת-ממדית (איור 3A).
-
יציקת מחסום פולידימיאתילסילוקסן (PDMS)
- מערבבים 6 מ"ל בסיס PDMS אלסטומר ו 0.6 מ"ל ריפוי סוכן הומוגנית מעל 5 דקות במאגר פלסטיק. זה יכול לפברק 6 סרטן היפוקסי על שבבים, בהתחשב בהפסד בשל המאפיין הדביק של PDMS.
- טען את פתרון ה-PDMS הממוזג למזרק חד פעמי של 10 מ"ל והתאים לראש המזרק עם קצה מחלק מחודד מפלסטיק 20 גרם.
- מלאו את תבנית PEVA המקריבה בתמיסת PDMS הממוזגת במזרק. PDMS הממוזג ימלא את תבנית PEVA ההקרבה במשטח קמור. גובה מחסום PDMS יהיה גבוה יותר מזה של תבנית PEVA.
- לרפא את מחסום PDMS בתנור ב 40 מעלות צלזיוס במשך 36 שעות, כדי למנוע את המסת PEVA. אין להעלות את הטמפרטורה תעלה ל-88 מעלות צלזיוס, שהיא טמפרטורת ההיתוך של PEVA.
- נתק את תבנית PEVA ההקרבה עם זוג פינצטה מדויקת ועקר את המחסום חדיר הגז ב 120 °C (60 °F) במובלעת אוטומטית.
5. הכנת ביו-דיו קולגן עטוף תאים
-
ניתוק התאים הסרטניים המוכנים והתאים הסטרומה
הערה: בהתחשב בכדאיות התאים, יש להשלים את תהליך ההדפסה כולו בהקדם האפשרי לאחר ניתוק התאים.- לשטוף סרטן ותאי סטרומה עם 10 מ"ל של 1x PBS באמצעות פיפטה סרולוגית; לטפל עם 2 מ"ל של 0.25% טריפסין-ethylenediaminetetraacetic חומצה (EDTA) באמצעות פיפטה לדגר אותם במשך 3 דקות ב 37 °C (69 °F).
- לנטרל את התאים טריפסיניזציה עם 3 מ"ל של מדיה תרבות התא; לאסוף את המתלים של תאים לתוך 15 מ"ל צינורות חרוט צנטריפוגה ב 516 x g במשך 5 דקות ב 20 מעלות צלזיוס.
- לשאוף את העל-טבעי באיטיות; resuspend כדורי התא במדיה תרבות התא 5 מ"ל ולספור את מספר התאים באמצעות hemocytometer.
- העבר 5 x 106 תאים מכל סוג תא לתוך צינורות חרוטים חדשים של 15 מ"ל וצנטריפוגה אותם ב 516 x g במשך 5 דקות ב 20 °C (69 °F).
- לשאוף את supernatant את ומניחים אותו על קרח רטוב.
-
ערבוב של כל סוג תא עם 1% מנוטרל קולגן טרום ג'ל פתרון
הערה: כדי למנוע התמצקות תרמית של 1% מנוטרל פתרון קולגן טרום ג'ל, תהליך זה צריך להתבצע על קרח רטוב.- Resuspend כל סוג של גלולה התא שנאסף בשלב 5.1.4 עם 20 μL של מדיה תרבות התא כל אחד.
- הוסף 1 מ"ל של 1% מנוטרל תמיסת קולגן מראש ג'ל לתוך כל השעיות התא לשימוש חוזר ומערבבים אותם הומוגנית באמצעות פיפטה תזוזה חיובית. הריכוז הסופי של כל סוג תא יהיה 5 x 106 תאים / מ"ל.
- מעבירים את הביו-לינקים של הקולגן ל-3 מ"ל באמצעות פיפטה חד פעמית חיובית ומאחסנים את המזרקים ב-4°C עד להדפסת תאים בתלת-ממד.
6.3D הדפסת תאים של טבעות קונצנטריות סרטן סטרומה
-
הדפסת תאים תלת-ממדית של ביו-לינקים של קולגן הכומסים תאים סרטניים ותאי סטרומה
- צור את הגיאומטריה 3D של טבעות קונצנטריות סרטן סטרומה מוגדר בשלב 1.2 באמצעות תוכנת CAD 3D.
הערה: הממדים של טבעות סטרומה סרטן קונצנטריים מוגדרים באמצעות פרמטרים מדומים. ממדי הפרמטרים של המימד הסופי מוצגים באיור 3A. - להמיר את קובץ CAD 3D לתבנית קובץ STL וליצור G-קוד של טבעות קונצנטריות סרטן סטרומה באמצעות מחליף STL-CAD.
הערה: עיין בהערה בשלב 4.1.2 עבור אלגוריתם יצירת קוד G. - לטעון את bioinks קולגן עטוף התא הכלול מזרקים חד פעמיים 3 מ"ל לראש המדפסת 3D ולהגדיר את הטמפרטורה של הראש ואת הצלחת ל 15 °C (69 °F).
הערה: אם הטמפרטורה של הראש והצלחת של המדפסת מגיעה ויותר מ-37°C, ה-bioink מקבל מקושר ולא מודפס עוד. - טען את נתיב ההדפסה שנוצר בתוכנת הבקרה של מדפסת תלת-ממד.
- על ידי לחיצה על כפתור התחל, להדפיס את bioinks קולגן אנקפסולציה תאים סרטניים ותאים סטרומה על מחסום גז חדיר בעקבות G-code טעון עם מחט פלסטיק 18 G בלחץ פנאומטי של כ 20 kPa ב 15 °C (69 °F).
- בסוף כל פעולת הדפסה, למקם באופן ידני כיסוי זכוכית מעוקר 22 מ"מ x 50 מ"מ על גבי מחסום חדיר גז כדי ליצור את השיפוע היפוקסי.
הערה: השווה שתי קבוצות בהתאם לנוכחות כיסוי זכוכית (GR+) והיעדרות (GR-) של זה כדי לאמת את הדור של השיפוע היפוקסי. - לאחר יצירת שלושה סרטן היפוקסי על שבבים, להעביר את השבבים לאינקובטור ב 37 °C (69 °F) עבור 1 h כדי להצליב את bioinks קולגן.
- צור את הגיאומטריה 3D של טבעות קונצנטריות סרטן סטרומה מוגדר בשלב 1.2 באמצעות תוכנת CAD 3D.
-
השלמת תהליך הייצור והתחזוקה של הסרטן ההיפוקסי על שבב
- לאחר השלמת כל תהליכי הדפסת התאים בתלת-ממד של הסרטן-על-שבב ההיפוקסי, משפשפים בעדינות את משקפי הכיסוי על גבי המחסומים החודרים לגז עם מגרד התאים לחיבור הדוק(איור 4A, B).
הערה: זכוכית הכיסוי והמחסום החודר לגז מורכבים באמצעות מליטה הידרופובית ללא דבקים כימיים, פשוט מגרדים את החלק המקשר בין זכוכית הכיסוי למחסום ה- PDMS. - הצג 1.5 מ"ל של מדיום צמיחת תאי אנדותל לכל שבב. כדי למנוע ניתוק של מבנה הסרטן, להציג מדיום תרבות התא מצד אחד של השבב. הטה את השבב כדי לאפשר למדיית תרבות התאים לזרום באמצעות פיפטה.
- רענן את מדיית תרבות התאים מדי יום במשך שבוע. השתמש פיפטה לשאוף את המדיום תרבות התא; אין להשתמש במשאבת לחץ.
- לאחר השלמת כל תהליכי הדפסת התאים בתלת-ממד של הסרטן-על-שבב ההיפוקסי, משפשפים בעדינות את משקפי הכיסוי על גבי המחסומים החודרים לגז עם מגרד התאים לחיבור הדוק(איור 4A, B).
7. הערכת הכדאיות של התאים לאחר ההדפסה
-
הכנת דגימות וטיפול בתמיסת קלצ'ין AM ו-EthD-1
- חם 1x PBS באמבט מים ב 37 מעלות צלזיוס.
- הכן את הפתרון מבחני על ידי הוספת 0.75 μL של calcein acetoxymethyl (calcein AM) ו 3 μL של הומודימר אתידיום (EthD-1) כדי 1.5 מ"ל מראש מחומם PBS.
- שאף בזהירות את כל המדיה מהשבב באמצעות פיפטה.
- לשטוף את מבנה הסרטן עם PBS מראש. מלא 1.5 מ"ל PBS לתוך השבב באמצעות פיפטה ולתת לו לעמוד במשך 10 דקות בטמפרטורת החדר. כדי למנוע עיוות של מבנה הסרטן, להציג 1x PBS מצד אחד של השבבים להטות את השבבים כדי לאפשר 1x PBS לזרום.
- לשאוף את PBS מהשבב; לטפל בתמיסת 1.5 מ"ל מבחני דגירה את השבב ב 37 °C (77 °F) במשך 20 דקות באמצעות רדיד אלומיניום כדי להגן מפני אור. השתמש פיפטה לשאוף 1x PBS; אין להשתמש במשאבת יניקה.
-
הדמיה של כדאיות התא באמצעות מיקרוסקופ פלואורסצנטי
- הצג ולכוד את התאים המסומנים בתווית באמצעות מיקרוסקופ פלואורסצנטי (איור 4C).
הערה: Calcein AM מסמן תאים חיים עם פלואורסצנטיות ירוקה (אורך גל ~ 488 ננומטר). EthD-1 מייצג את האות של תאים מתים עם פלואורסצנטיות אדומה (אורך גל ~ 594 ננומטר). - ספור את מספר התאים החיים והמתים באמצעות תוכנת דימות, תוכנית לעיבוד תמונה בקוד פתוח וחשב את הכדאיות עם המספרים .
- הצג ולכוד את התאים המסומנים בתווית באמצעות מיקרוסקופ פלואורסצנטי (איור 4C).
8. אימונופלואורסצנטיות כדי לאמת את היווצרות היפוקסיה מרכזית והשפעתה על ממאירות סרטן
-
קיבוע, חדירה וחסימת מבנה הסרטן
- הכן 1x PBS, 4% paraformaldehyde (PFA), 0.1% (v /v) טריטון X-100, ו 2% (w / v) אלבומין סרום שור (BSA) בטמפרטורת החדר.
- בזהירות לשאוף את כל המדיה מהשבב באמצעות פיפטה ולשטוף את השבב שלוש פעמים עם 1x PBS. כדי למנוע עיוות של מבנה הסרטן, להציג 1x PBS מצד אחד של השבבים להטות את השבבים כדי לאפשר 1x PBS לזרום. בין כל שלב כביסה, תן לשבב לעמוד עם PBS 1x למשך 5 דקות כדי להסיר פתרונות שיורית.
הערה: 1x PBS היה שאפתן באמצעות פיפטה, לא משאבת לחץ. - הוסף 500 μL של 4% PFA למבנה הסרטן על השבב באמצעות פיפטה; להשאיר אותו במשך 15 דקות ולשטוף שלוש פעמים עם 1x PBS כדי לתקן את התאים במבנה הסרטן.
- לטפל במבנה סרטן עם 500 μL של 0.1% טריטון X-100 באמצעות פיפטה בטמפרטורת החדר במשך 5 דקות ולשטוף שלוש פעמים עם 1x PBS כדי solubilize ולחלחל קרום התא.
- לטפל בבניית סרטן עם 500 μL של 2% BSA באמצעות פיפטה בטמפרטורת החדר במשך 1 שעות כדי לחסום אפיטופים תגובתי.
הערה: לכסות את השבב עם סרט פרפין כדי למנוע אידוי. - לאחר שעה, לשטוף את השבב שלוש פעמים עם 1x PBS.
-
טיפול בנוגדנים ראשוניים, נוגדנים משניים, DAPI והדמיה של המבנה באמצעות מיקרוסקופ קונפוקלי.
- הכן נוגדני בקרת isotype ואת הקוקטייל של נוגדנים ראשוניים על ידי דילול הנוגדנים ב 1x PBS לכל ריכוז העבודה הרצוי.
הערה: הפרטים הספציפיים של הנוגדנים מפורטים בטבלת החומרים. אותם ריכוזי עבודה של נוגדני בקרת isotype כמו הנוגדנים העיקריים יש להשתמש. - בזהירות לשאוף את כל 1x PBS מהשבב באמצעות פיפטה ולטפל בשבב עם 200 μL פתרון נוגדן ראשוני ב 4 מעלות צלזיוס לילה. מכסים את השבבים בסרט פרפין למניעת אידוי.
- לשאוף את פתרון הנוגדנים העיקרי ולשטוף את השבב שלוש פעמים עם 1x PBS.
- לדלל נוגדנים משניים DAPI ב 1x PBS לריכוז העבודה הרצוי.
הערה: נוגדן משני מצומד פלואורסצנטי ירוק משמש במקרה זה ביחס של 1:200. נעשה שימוש ב- DAPI ביחס של 1:1000. - בזהירות לשאוף את כל 1x PBS מהשבב באמצעות פיפטה ולטפל בשבב עם 200 μL פתרון נוגדן משני-DAPI ב 4 °C (70 °F) עבור 3 שעות. מכסים את השבב עם סרט פרפין כדי למנוע אידוי ולאחר מכן לעטוף אותו עם רדיד אלומיניום כדי למנוע photobleaching.
- לשאוף את פתרון הנוגדן-DAPI המשני ולשטוף את השבב שלוש פעמים עם 1x PBS.
- לאחר סיום שלב הכתם, להעביר את מבנה הסרטן לצלחת confocal על ידי אחיזה בעדינות עם מלקחיים.
- דמיינו ותפסו את התאים המסומנים בתווית באמצעות מיקרוסקופ קונפוקלי (איור 5).
הערה: אורך הגל של המיקרוסקופ הקונפוקלי הותאם, בהתאם לסוג הסמנים הפלואורסצנטיים. הפרטים הספציפיים של הנוגדנים מפורטים בטבלת החומרים. כדי לזהות ביעילות את מיקום התא, עדיף להתבונן בגרעיני ה- DAPI המוכתמים של המבנה בהתחלה. אורכו של אותות הפלואורסצנטיים היה 358/461 ננומטר (DAPI, כחול), 494/517 ננומטר (ירוק) ו-590/617 ננומטר (אדום). ההגדלות היו 4x, 10x ו- 20x, הותאמו מהנמוך ביותר לגבוה ביותר.
- הכן נוגדני בקרת isotype ואת הקוקטייל של נוגדנים ראשוניים על ידי דילול הנוגדנים ב 1x PBS לכל ריכוז העבודה הרצוי.
9. ניתוח סטטיסטי
-
ספירת תאים באמצעות תוכנית עיבוד תמונה
- הפעל תוכנית לעיבוד תמונה כדי לספור את מספר התאים החיים והמתים.
- פתח את קבצי התמונה הפלואורסצנטיים. לחץ על קובץ | פתח וייבא את תמונות TIFF.
- המר את התמונות לתמונות בגווני אפור של 16 סיביות. לחץ על תמונה | הקלד | גווני אפור של 16 סיביות.
- התאם את הסף על ידי לחיצה על תמונה | כוונון | סף ולאחר מכן בחר את צבע התאים לשחור.
- גזור תאים ממוזגים זה מזה על-ידי לחיצה על תהליך | | בינארי קו פרשת מים לספירת תאים מדויקת.
- לספור את מספר התאים על ידי לחיצה על לנתח ולאחר מכן על לנתח חלקיקים שלוש פעמים; לחשב את הממוצע ולהציג את הנתונים כשגיאת תקן ± הממוצעת.
הערה: סמני כשל חיסוני נותחו על ידי השוואת עוצמת הפלואורסצנטיות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הסרטן ההיפוקסי על שבב פותח באמצעות טכנולוגיית הדפסת תאים תלת-ממדית בסיוע מחשב כדי לשחזר היפוקסיה ופתולוגיה הקשורה לסרטן (איור 1). הובלת חמצן וצריכתו היו מדומים באמצעות מודל הגיאומטריה 3D. השבב תוכנן בצורת טבעות קונצנטריות כדי לחקות את דיפוזיה ודלדול חמצן ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
במחקר זה, אנו מתארים את תהליך הייצור של סרטן היפוקסי על שבב המבוסס על טכנולוגיית הדפסת תאים 3D. היווצרות השיפוע ההיפוקסי בשבב המתוכנן נצפתה באמצעות הדמיות מחשב. הסביבה שיכולה לגרום לשיפוע היפוקסי הטרוגני שוחזרה באמצעות אסטרטגיה פשוטה המשלבת את מחסום חדיר הגז המודפס בתלת-ממד ואת כיסוי הזכו...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין גילויים.
Acknowledgements
מחקר זה נתמך על ידי קרן המחקר הלאומית של קוריאה (NRF) במימון משרד החינוך (מס ' 2020R1A6A1A03047902 ו- NRF-2018H1A2A1062091) וממשלת קוריאה (MSIT) (לא. NRF-2019R1C1C1009606 ו- NRF-2019R1A3A3005437).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Cells | |||
| Human umbilical vein endothelial cells | Promocell | C-12200 | |
| U-87 MG cells | ATCC | ATCC HTB-14 | |
| Disposable | |||
| 0.2 μm syringe filter | Sartorius | 16534-K | |
| 10 mL disposable syringe | Jung Rim | 10ml 21G32 | |
| 10 mL glass vial | Hubena | A0039 | |
| 10 mL Serological pipette tip | SPL lifescience | 91010 | |
| 15 mL conical tube | SPL lifescience | 50015 | |
| 18G plastic needle | Musashi engineering | PN-18G-B | |
| 20G plastic tapered dispense tip | Musashi engineering | TPND-20G-U | |
| 22x50 glass cover | MARIENFIELD | 0101142 | |
| 25 mL Serological pipette tip | SPL lifescience | 90125 | |
| 3 mL disposable syringes | HENKE-JET | 4020-X00V0 | |
| 40 µm cell strainer | Falcon | 352360 | |
| 5 mL Serological pipette tip | SPL lifescience | 91005 | |
| 50 mL conical tube | SPL lifescience | 50050 | |
| 50 mL Serological pipette tip | SPL lifescience | 90150 | |
| 50N precision nozzle | Musashi engineering | HN-0.5ND | |
| Aluminum foil | SINKWANG | ||
| Capillary tips | Gilson | CP1000 | |
| Cell-scrapper | SPL lifescience | 90030 | |
| Confocal dish | SPL lifescience | 200350 | |
| Parafilm | Bemis | PM996 | |
| Pre-coated histology slide | MATSUNAMI | MAS-11 | |
| Reservoir | SPL lifescience | 23050 | |
| T-75 cell culture flask | SPL lifescience | 70075 | |
| Equipment | |||
| 3DX printer | T&R Biofab | ||
| Autoclave | JEIOTECH | AC-12 | |
| Centrifuger | Cyrozen | 1580MGR | |
| Confocal laser microscopy | Olympus Life Science | FV 1000 | |
| Fluorescence microscope | FISHER SCEINTIFIC | O221S366 | |
| Forcep | Korea Ace Scientific | HC.203-30 | |
| Hand tally counter | KTRIO | ||
| Hemocytometer | MARIENFIELD | 0650030 | |
| Incubator | Panasonic | MCO-170AIC | |
| Laminar flow cabinet | DAECHUNG SCIENCE | CB-BMMS C-001 | |
| Metal syringe | IWASHITA engineering | SUS BARREL 10CC | |
| Operating Scissors | Hirose | HC.13-122 | |
| Oven | JEIOTECH | OF-12, H070023 | |
| Positive displacement pipette | GILSON | NJ05652 | |
| Refrigerator | SAMSUNG | CRFD-1141 | |
| Voltex Mixer | DAIHAN scientific | VM-10 | |
| Water bath | DAIHAN SCIENTIFIC | WB-11 | |
| Water purifier | WASSER LAB | DI-GR | |
| Materials | |||
| 0.25 % Trypsin-EDTA | Gibco | 25200-072 | |
| 10x PBS | Intron | IBS-BP007a | |
| 4% Paraformaldehyde | Biosesang | ||
| 70% Ethanol | Daejung | 4018-4410 | |
| Anti-CD31 antibody | Abcam | ab28364 | |
| Anti-HIF-1 alpha antibody | Abcam | ab16066 | |
| Anti-SHMT2/SHMT antibody | Abcam | ab88664 | |
| Anti-SOX2 antibody | Abcam | ab75485 | |
| Bovine Serum Albumin | Thermo scientific | J10857-22 | |
| Collagen from porcine skin | Dalim tissen | PC-001-1g | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermofisher | D1306 | |
| Endothelial Cell Growth Medium-2 | Promocell | C22011 | |
| Fetal bovine serum | Gibco | 12483-020 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Theromofisher | A-11001 | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | Theromofisher | A-11012 | |
| High-glucose Dulbecco’s Modified Eagle Medium(DMEM) | Hyclone | SH30243-0 | |
| Hydrochloric acid | Sigma-Aldrich | 311413-100ML | |
| Live/dead assay kit | Invitrogen | L3224 | |
| Mouse IgG1, kappa monoclonal [15-6E10A7] - Isotype Control | Abcam | ab170190 | |
| Penicillin/streptomycin | Gibco | 15140-122 | |
| Phenol red solution | Sigma-Aldrich | P0290-100ML | |
| Poly(ethylene-vinyl acetate) | Poly science | 06108-500 | |
| Polydimethylsiloxane | Dowhitech | sylgard 184 | |
| Rabbit IgG, polyclonal - Isotype Control | Abcam | ab37415 | |
| Sodium hydroxide solution | Samchun | S0610 | |
| Triton X-100 | Biosesang | TRI020-500-50 | |
| Trypan Blue | Sigma-Aldrich | T8154 | |
| Software | |||
| COMSOL Multiphysics 3.5a | COMSOL AB | ||
| IMS beamer | in-house software | ||
| SolidWorks Package | Dassault Systems SolidWorks Corporation |
References
- Jing, X., et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment. Molecular Cancer. 18 (1), 157(2019).
- Al Tameemi, W., Dale, T. P., Al-Jumaily, R. M. K., Forsyth, N. R. Hypoxia-modified cancer cell metabolism. Frontiers in Cell and Developmental Biology. 7, 4(2019).
- Petrova, V., Annicchiarico-Petruzzelli, M., Melino, G., Amelio, I. The hypoxic tumour microenvironment. Oncogenesis. 7 (1), 1-13 (2018).
- Hockel, M., Vaupel, P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. Journal of the National Cancer Institute. 93 (4), 266-276 (2001).
- Kim, H., Lin, Q., Glazer, P. M., Yun, Z. The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells. Breast Cancer Research. 20 (1), 16(2018).
- Jeong, G. S., Lee, J., Yoon, J., Chung, S., Lee, S. -H. Viscoelastic lithography for fabricating self-organizing soft micro-honeycomb structures with ultra-high aspect ratios. Nature Communications. 7 (1), 1-9 (2016).
- Razian, G., Yu, Y., Ungrin, M. Production of large numbers of size-controlled tumor spheroids using microwell plates. Journal of Visualized Experiments:JoVE. (81), e50665(2013).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Wan, L., Neumann, C., LeDuc, P. Tumor-on-a-chip for integrating a 3D tumor microenvironment: chemical and mechanical factors. Lab on a Chip. 20 (5), 873-888 (2020).
- Nam, H., Funamoto, K., Jeon, J. S. Cancer cell migration and cancer drug screening in oxygen tension gradient chip. Biomicrofluidics. 14 (4), 044107(2020).
- Palacio-Castañeda, V., Kooijman, L., Venzac, B., Verdurmen, W. P., Le Gac, S. Metabolic switching of tumor cells under hypoxic conditions in a tumor-on-a-chip model. Micromachines. 11 (4), 382(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: a fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Mi, S., Du, Z., Xu, Y., Sun, W. The crossing and integration between microfluidic technology and 3D printing for organ-on-chips. Journal of Materials Chemistry B. 6 (39), 6191-6206 (2018).
- Yi, H. -G., Lee, H., Cho, D. -W. 3D printing of organs-on-chips. Bioengineering. 4 (1), 10(2017).
- Yi, H. -G., et al. A bioprinted human-glioblastoma-on-a-chip for the identification of patient-specific responses to chemoradiotherapy. Nature Biomedical Engineering. 3 (7), 509-519 (2019).
- Kang, T. -Y., Hong, J. M., Jung, J. W., Yoo, J. J., Cho, D. -W. Design and assessment of a microfluidic network system for oxygen transport in engineered tissue. Langmuir. 29 (2), 701-709 (2013).
- Woo Jung, J., et al. Evaluation of the effective diffusivity of a freeform fabricated scaffold using computational simulation. Journal of Biomechanical Engineering. 135 (8), (2013).
- Brown, A. C., De Beer, D. Development of a stereolithography (STL) slicing and G-code generation algorithm for an entry level 3-D printer. 2013 Africon (IEEE). , 1-5 (2013).
- Shim, J. -H., Lee, J. -S., Kim, J. Y., Cho, D. -W. Bioprinting of a mechanically enhanced three-dimensional dual cell-laden construct for osteochondral tissue engineering using a multi-head tissue/organ building system. Journal of Micromechanics and Microengineering. 22 (8), 085014(2012).
- Gillispie, G., et al. Assessment methodologies for extrusion-based bioink printability. Biofabrication. 12 (2), 022003(2020).
- Kim, B. S., Das, S., Jang, J., Cho, D. -W. Decellularized extracellular matrix-based bioinks for engineering tissue-and organ-specific microenvironments. Chemical Reviews. 120 (19), 10608-10661 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved